La diabetes mellitus posterior a trasplante (DMPT) es una complicación grave de largo plazo que tiene un impacto negativo sobre el injerto y la sobrevida del paciente. El objetivo del presente estudio fue describir la incidencia de la DMPT en una cohorte mexicana y evaluar su asociación con el antecedente familiar de diabetes (AFD).
MétodosSe realizó un estudio de cohorte retrospectivo unicéntrico de pacientes sometidos a trasplante hepático. El desenlace primario fue el tiempo entre el trasplante hepático y el desarrollo de DMPT. El diagnóstico de DMPT fue establecido utilizando los criterios de la ADA. Se realizó un análisis de mediación que utilizó modelos de regresión de Cox ajustados y se manejó la prediabetes pretrasplante como mediador, para determinar el efecto total y el efecto directo del AFD sobre la DMPT.
ResultadosSe incluyó a un total de 152 pacientes, con una mediana de seguimiento de 41 meses; 19.2% (n=29) presentaron diabetes pretrasplante. Durante el tiempo de seguimiento, 15% de los pacientes desarrollaron DMPT (n=23), con una tasa de incidencia de 4.71 casos/100 personas-año. La DMPT fue significativamente más elevada en pacientes con AFD en comparación con aquellos sin AFD (8.72 casos/100 personas-año vs. 2.04 casos/100 personas-año, respectivamente; p=0.001). El cociente de riesgo ajustado para el desarrollo de DMPT en los pacientes con AFD fue 4.14 (IC 95% 1.60-10.7; p=0.005) y 3.49 (IC 95% 1.35-9.01; p=0.010), cuando se controló por prediabetes pretrasplante.
ConclusiónLa incidencia de DMPT fue similar a la reportada en la mayoría de los estudios internacionales. Al igual que con la diabetes tipo 2, el AFD desempeña un papel importante en el desarrollo de la DMPT, incluso después de considerar la prediabetes pretrasplante. Los pacientes con AFD deben someterse a un programa metabólico más estricto.
Posttransplantation diabetes mellitus (PTDM) is a serious long-term complication that has a negative impact on graft and patient survival. The purpose of the present study was to describe the incidence of PTDM in a Mexican cohort and evaluate its association with a previous family history of diabetes (FHD).
MethodsA retrospective single-center cohort study was conducted on patients undergoing liver transplantation. The primary outcome was time from liver transplantation to PTDM. The diagnosis of PTDM was established using the ADA criteria. A mediation analysis that used adjusted Cox regression models and considered pretransplant prediabetes a mediator was performed, to determine the total effect and direct effect of FHD on PTDM.
ResultsA total of 152 patients were included, with a median follow-up time of 41 months; 19.2% (n=29) had pretransplant diabetes. During the follow-up time, 15% of patients developed PTDM (n=23), with an incidence rate of 4.71 cases/100 person-years. PTDM was significantly higher in patients with FHD, compared with those with no FHD (8.72 cases/100 person-years vs 2.04 cases/100 person-years, respectively; P=.001). The adjusted hazard ratio of PTDM for FHD was 4.14 (95% CI 1.60-10.7), P=.005) and 3.48 (95% CI 1.35-9.01, P=.010), when further controlled for pretransplant prediabetes.
ConclusionThe occurrence of PTDM was similar to that reported in most international studies. As with type 2 diabetes, family history plays an important role in the development of PTDM, even after accounting for pretransplant prediabetes. Patients with FHD should undergo a stricter metabolic program.
El trasplante hepático (TH) se ha convertido en el tratamiento principal para un amplio rango de enfermedades hepáticas crónicas y agudas. Durante los últimos 30 años, los avances en la medicina perioperatoria, las técnicas quirúrgicas y la inmunosupresión han mejorado de manera substancial la supervivencia1,2. Debido a esta mejoría, recientemente se ha puesto mayor atención en las complicaciones de largo plazo del TH. La diabetes mellitus posterior a trasplante (DMPT) es una complicación metabólica grave que está asociada con disfunción del injerto, infecciones, rechazo del injerto y peor sobrevida de paciente. Durante el seguimiento de largo plazo posterior a TH, hasta un 30% de las muertes son atribuibles a causas cardiovasculares, como el síndrome metabólico o diabetes3,4. En diferentes centros se ha reportado una amplia variación en la prevalencia de la DMPT, debido a la falta de consenso sobre su definición y el tiempo de diagnóstico, yendo desde un 9% hasta un 63.3%5–7.
La DMPT se define como el desarrollo de diabetes posterior a trasplante en un paciente previamente no diabético y el diagnóstico se establece según los criterios de la American Diabetes Association y la Organización Mundial de la Salud (ADA/OMS)8. Son varios los factores asociados a su desarrollo y existen tanto modificables como no modificables. Los factores no modificables incluyen la edad, la etnicidad (poblaciones negras e hispanas), antecedente familiar de diabetes, etiología de cirrosis (esteatohepatitis no alcohólica) y la prediabetes. Por otro lado, los factores modificables incluyen obesidad, inmunosupresión postrasplante, hipomagnesemia e infecciones virales como el virus de hepatitis C y el citomegalovirus (CMV)7,9–11. La prevalencia de diabetes mellitus en la población mexicana es alta, hasta de 13.7%, según la Encuesta Nacional de Salud y Nutrición (ENSANUT) de 201612. Se piensa que la etnicidad desempeña un papel en el desarrollo de la diabetes y la DMPT13. Por ejemplo, tener ascendencia nativa americana ha sido asociado con un riesgo más elevado de diabetes tipo 2. Además del estilo de vida, la dieta y el acceso a servicios de salud, dicha asociación podría estar relacionada con factores genéticos14. Sin embargo, aún no es claro si la patogénesis de la DMPT y la diabetes tipo 2 comparten la misma fisiopatología. A pesar de que la presencia de la DMPT también ha sido asociada con disfunción de célula B secundaria a inmunosupresión, se ha observado en estudios que comparte factores genéticos con la diabetes tipo 215–17. Actualmente no existen reportes de DMPT en la población mexicana, por lo tanto, el propósito de este estudio fue determinar la incidencia de la DMPT en una cohorte mexicana y evaluar su asociación con el antecedente familiar de diabetes mellitus tipo 2 (AFD).
Materiales y métodosRealizamos un estudio de cohorte retrospectivo, incluyendo a pacientes sometidos a TH ortotópico, entre el 2015 y el 2019, en el Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán, un hospital de tercer nivel en la Ciudad de México. Excluimos a los pacientes con antecedente de diabetes mellitus y aquellos que fallecieron o se perdieron en el seguimiento postrasplante dentro de los primeros 6 meses del mismo. Con base en el AFD, clasificamos a los pacientes en 2 grupos: con AFD y sin AFD. Consideramos AFD cuando alguno de los padres o hermanos del paciente presentaron diabetes tipo 2. El objetivo principal fue determinar si los pacientes con AFD presentaban una mayor incidencia de DMPT y el desenlace principal fue el tiempo para diagnóstico de DMPT. Los desenlaces secundarios fueron el tiempo de rechazo del injerto, el tiempo de infección por CMV y la necesidad de retrasplante. Los datos fueron obtenidos de registros electrónicos de los expedientes médicos pretrasplante y de las visitas de seguimiento. La DMPT fue definida según los criterios de la ADA e incluyó lo siguiente: un nivel de glucosa en plasma en ayuno de 126mg/dl (7.0mmol/l) o mayor, un nivel de glucosa en plasma de 2h de 200mg/dl (11.1mmol/l) o mayor durante una prueba de tolerancia a 75g de glucosa oral, glucosa en plasma aleatoria de 200mg/dl (11.1mmol/l) o mayor en pacientes con síntomas clásicos de hiperglucemia o crisis de hiperglucemia, o nivel de hemoglobina A1c de 6.5% (48mmol/mol) o mayor. Los pacientes que presentaron hiperglucemia transitoria y no cumplieron con los criterios de la ADA 6 meses después del TH no fueron registrados como casos DMPT.
Los siguientes datos fueron obtenidos de los expedientes médicos pretrasplante: edad, sexo, índice de masa corporal (IMC), AFD (pariente de primer grado), antecedente de prediabetes, antecedente de hipertensión, puntaje de la escala de Child-Pugh, puntaje de la escala MELD, puntaje de la escala MELD-Na, antecedente de carcinoma hepatocelular, etiología de enfermedad hepática y grupo sanguíneo. La presencia de DMPT según los criterios de diabetes de la ADA e información sobre inmunosupresión (uso de basiliximab, inhibidores de calcineurina, sirolimus y esteroides, al igual que el tiempo con esteroides y dosis de prednisona para pacientes con esteroides durante más de un año) fueron obtenidos de visitas ambulatorias de los pacientes y/o expedientes de hospitalizaciones recurrentes. Para pacientes que recibieron tacrolimus, también se obtuvieron el promedio y la mediana de los niveles de tacrolimus dentro de los primeros 6 meses postrasplante. Los datos obtenidos de los donantes de órganos fueron edad, sexo, IMC, presencia de esteatosis hepática determinada por biopsia y grupo sanguíneo. El estudio fue realizado de acuerdo con la Declaración de Helsinki y cumplió con las normas vigentes de investigación bioética; también fue autorizado por el comité de ética del Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán (CAI-3743-21-21-1).
Análisis estadísticoLas variables categóricas se presentan como frecuencias y porcentajes, mientras que las variables numéricas se resumen en media y desviación estándar o mediana o rango intercuartílico, según fuera apropiado. Las características de línea de base fueron comparadas entre los pacientes con y sin AFD utilizando una prueba de chi cuadrada en las variables categóricas, y en las numéricas una prueba t, permitiendo heterocedasticidad.
Se calculó la incidencia acumulativa general de DMPT a los años 1, 2, 3 y 4 postrasplante y la incidencia de DMPT relacionada con AFD, utilizando el método de Kaplan-Meier y las incidencias fueron comparadas utilizando una prueba de log-rank. El efecto total condicional y no condicional del AFD sobre el desarrollo de DMPT fue estimado utilizando un modelo de regresión de Cox sin ajustar y ajustado, respectivamente. El modelo ajustado fue controlado por edad, IMC y etiología de enfermedad hepática, los cuales fueron considerados confusores a priori. Además, debido a que la prediabetes es una condición que antecede a la diabetes, la prediabetes pretrasplante fue considerada como un mediador, aunque un mediador parcial, ya que los pacientes pueden desarrollar prediabetes postrasplante y DMPT, posteriormente (ver diagrama abajo). Se realizó un análisis de mediación utilizando el método de Baron y Kenny para verificar que la prediabetes pretrasplante era un mediador parcial y para estimar el efecto directo no condicional y condicional del AFD sobre el desarrollo de DMPT18. El efecto total de AFD sobre el desarrollo de DMPT incluye la vía causal a lo largo de la prediabetes antes del TH (efecto indirecto) y el que no incluye la prediabetes antes del TH (efecto directo).
Finalmente, como análisis exploratorio, las características basales y de inmunosupresión fueron evaluadas como predictores de DMPT, utilizando modelos de regresión de riesgo proporcional univariado de Cox. Las variables que fueron estadísticamente significativas al nivel de 0.10 en el análisis univariado fueron incluidas en un modelo de regresión de riesgo proporcional multivariado.
Para todos los modelos de regresión de Cox, se evaluaron los supuestos de riesgo proporcional, utilizando residuos de Schoenfeld. El análisis estadístico fue realizado con R versión 4.0.3. El nivel de confianza fue establecido como 0.05 de 2 colas.
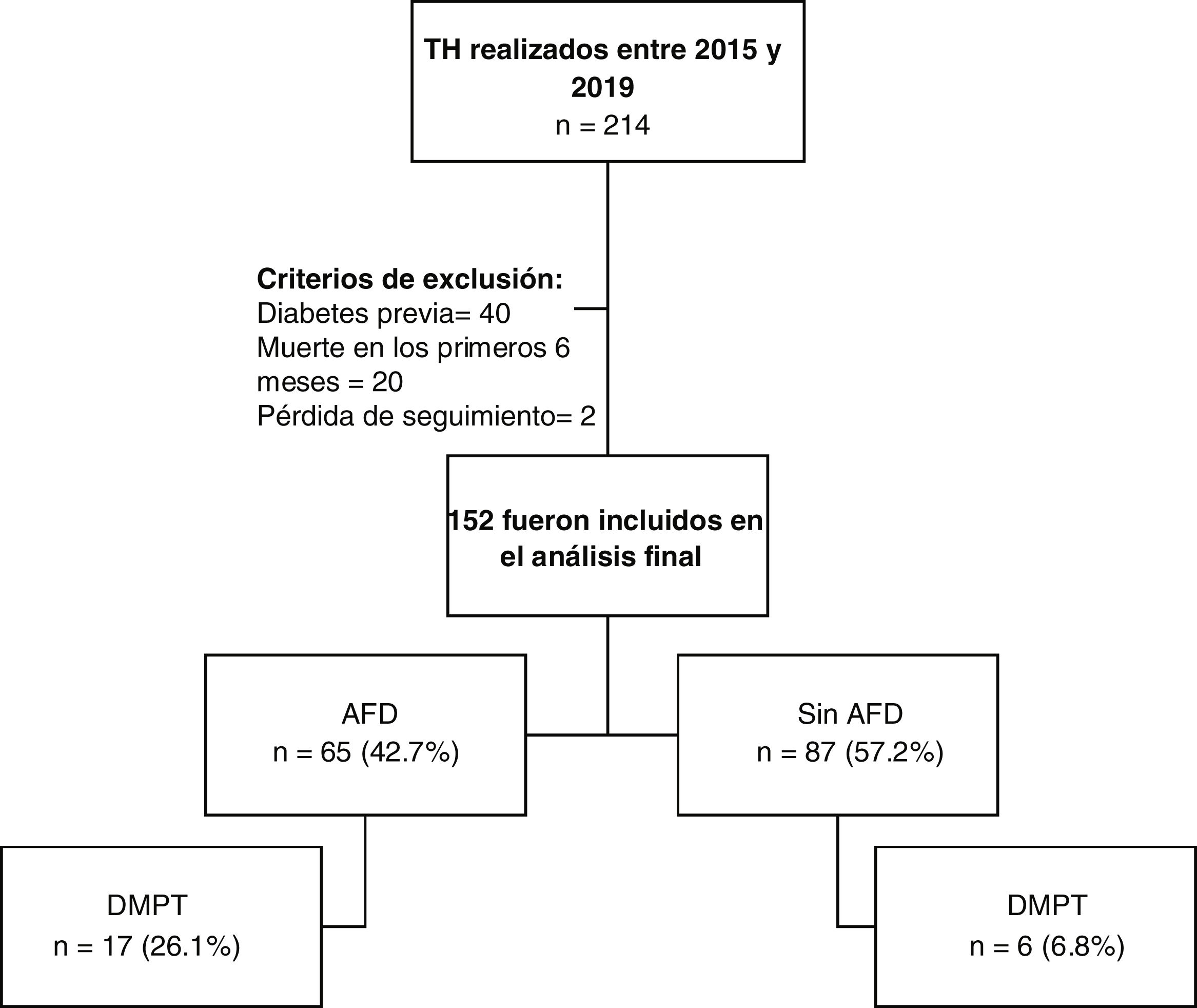
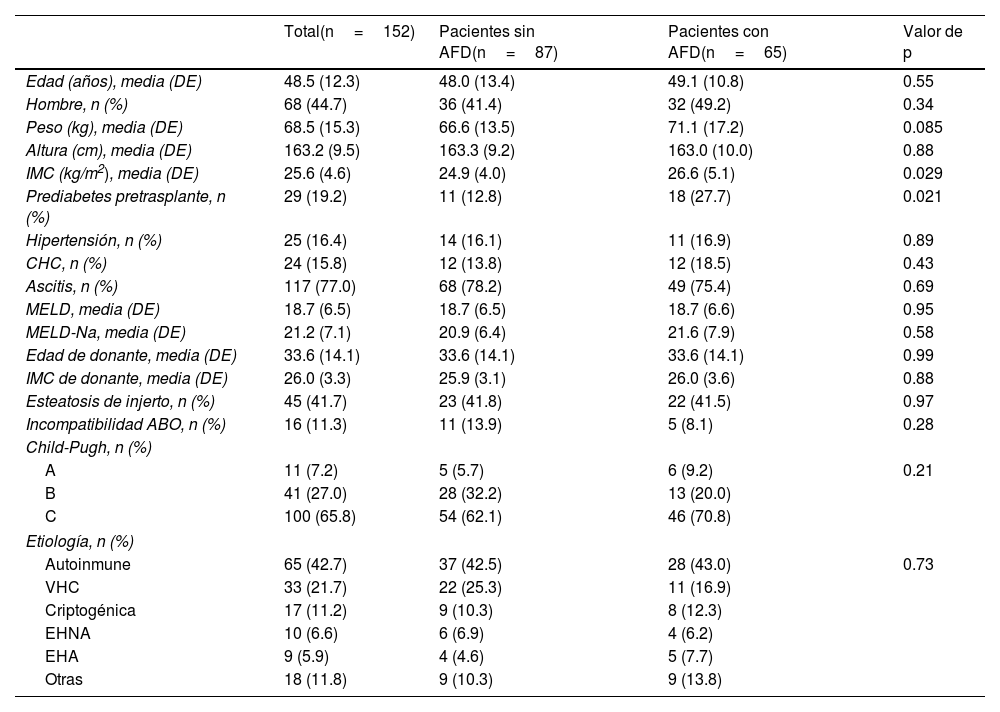
ResultadosSe realizaron un total de 214 TH ortotópicos durante el periodo establecido, de los cuales 152 cumplieron con los criterios de selección (fig. 1) Las características basales se muestran en la tabla 1. Los pacientes con AFD presentaron un IMC mayor (media de 26.6±5.1kg/m2 en pacientes con AFD vs. 24.9±4kg/m2 en pacientes sin AFD, p=0.029) y una mayor prevalencia de prediabetes pretrasplante (27.7% de los pacientes con AFD vs. 12.8% de los pacientes sin AFD, p=0.021), pero el resto de las características fueron similares entre los grupos. No existieron diferencias estadísticamente significativas respecto al IMC del donante, la edad del donante, la presencia de esteatosis en injerto o incompatibilidad ABO.
Características clínicas basales
| Total(n=152) | Pacientes sin AFD(n=87) | Pacientes con AFD(n=65) | Valor de p | |
|---|---|---|---|---|
| Edad (años), media (DE) | 48.5 (12.3) | 48.0 (13.4) | 49.1 (10.8) | 0.55 |
| Hombre, n (%) | 68 (44.7) | 36 (41.4) | 32 (49.2) | 0.34 |
| Peso (kg), media (DE) | 68.5 (15.3) | 66.6 (13.5) | 71.1 (17.2) | 0.085 |
| Altura (cm), media (DE) | 163.2 (9.5) | 163.3 (9.2) | 163.0 (10.0) | 0.88 |
| IMC (kg/m2), media (DE) | 25.6 (4.6) | 24.9 (4.0) | 26.6 (5.1) | 0.029 |
| Prediabetes pretrasplante, n (%) | 29 (19.2) | 11 (12.8) | 18 (27.7) | 0.021 |
| Hipertensión, n (%) | 25 (16.4) | 14 (16.1) | 11 (16.9) | 0.89 |
| CHC, n (%) | 24 (15.8) | 12 (13.8) | 12 (18.5) | 0.43 |
| Ascitis, n (%) | 117 (77.0) | 68 (78.2) | 49 (75.4) | 0.69 |
| MELD, media (DE) | 18.7 (6.5) | 18.7 (6.5) | 18.7 (6.6) | 0.95 |
| MELD-Na, media (DE) | 21.2 (7.1) | 20.9 (6.4) | 21.6 (7.9) | 0.58 |
| Edad de donante, media (DE) | 33.6 (14.1) | 33.6 (14.1) | 33.6 (14.1) | 0.99 |
| IMC de donante, media (DE) | 26.0 (3.3) | 25.9 (3.1) | 26.0 (3.6) | 0.88 |
| Esteatosis de injerto, n (%) | 45 (41.7) | 23 (41.8) | 22 (41.5) | 0.97 |
| Incompatibilidad ABO, n (%) | 16 (11.3) | 11 (13.9) | 5 (8.1) | 0.28 |
| Child-Pugh, n (%) | ||||
| A | 11 (7.2) | 5 (5.7) | 6 (9.2) | 0.21 |
| B | 41 (27.0) | 28 (32.2) | 13 (20.0) | |
| C | 100 (65.8) | 54 (62.1) | 46 (70.8) | |
| Etiología, n (%) | ||||
| Autoinmune | 65 (42.7) | 37 (42.5) | 28 (43.0) | 0.73 |
| VHC | 33 (21.7) | 22 (25.3) | 11 (16.9) | |
| Criptogénica | 17 (11.2) | 9 (10.3) | 8 (12.3) | |
| EHNA | 10 (6.6) | 6 (6.9) | 4 (6.2) | |
| EHA | 9 (5.9) | 4 (4.6) | 5 (7.7) | |
| Otras | 18 (11.8) | 9 (10.3) | 9 (13.8) | |
AFD: antecedente familiar de diabetes; CHC: carcinoma hepatocelular; DE: desviación estándar; EHA: enfermedad hepática por alcohol; EHNA: esteatohepatitis no alcohólica; IMC: índice de masa corporal; MELD: modelo para enfermedad hepática en etapa terminal; MELD-Na: modelo para enfermedad hepática en etapa terminal-sodio; VHC: virus de hepatitis C.
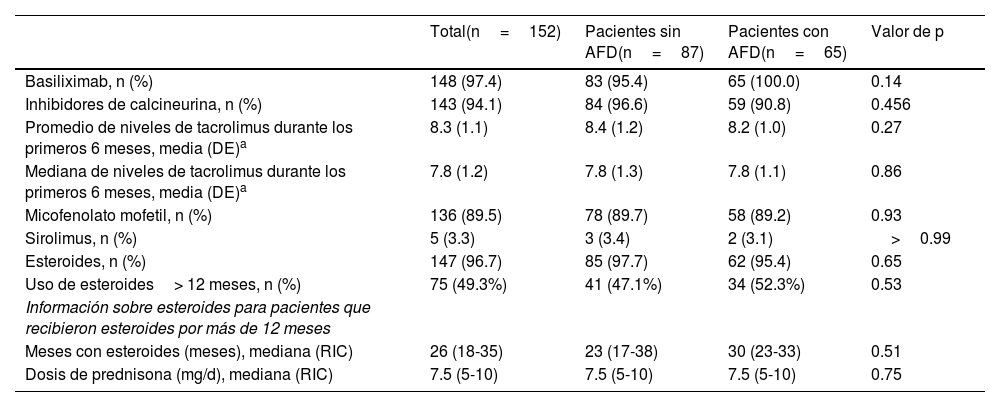
Respecto a la inmunosupresión, el esquema más común fue inducción de basiliximab, en conjunto con inhibidores de calcineurina, micofenolato mofetil y esteroides. No existieron diferencias entre los 2 grupos en los esquemas de inmunosupresión, niveles medios de tacrolimus, tiempo con esteroides o dosis de prednisona (tabla 2).
Esquemas inmunosupresores
| Total(n=152) | Pacientes sin AFD(n=87) | Pacientes con AFD(n=65) | Valor de p | |
|---|---|---|---|---|
| Basiliximab, n (%) | 148 (97.4) | 83 (95.4) | 65 (100.0) | 0.14 |
| Inhibidores de calcineurina, n (%) | 143 (94.1) | 84 (96.6) | 59 (90.8) | 0.456 |
| Promedio de niveles de tacrolimus durante los primeros 6 meses, media (DE)a | 8.3 (1.1) | 8.4 (1.2) | 8.2 (1.0) | 0.27 |
| Mediana de niveles de tacrolimus durante los primeros 6 meses, media (DE)a | 7.8 (1.2) | 7.8 (1.3) | 7.8 (1.1) | 0.86 |
| Micofenolato mofetil, n (%) | 136 (89.5) | 78 (89.7) | 58 (89.2) | 0.93 |
| Sirolimus, n (%) | 5 (3.3) | 3 (3.4) | 2 (3.1) | >0.99 |
| Esteroides, n (%) | 147 (96.7) | 85 (97.7) | 62 (95.4) | 0.65 |
| Uso de esteroides> 12 meses, n (%) | 75 (49.3%) | 41 (47.1%) | 34 (52.3%) | 0.53 |
| Información sobre esteroides para pacientes que recibieron esteroides por más de 12 meses | ||||
| Meses con esteroides (meses), mediana (RIC) | 26 (18-35) | 23 (17-38) | 30 (23-33) | 0.51 |
| Dosis de prednisona (mg/d), mediana (RIC) | 7.5 (5-10) | 7.5 (5-10) | 7.5 (5-10) | 0.75 |
AFD: antecedente familiar de diabetes; DE: desviación estándar; RIC: rango intercuartílico.
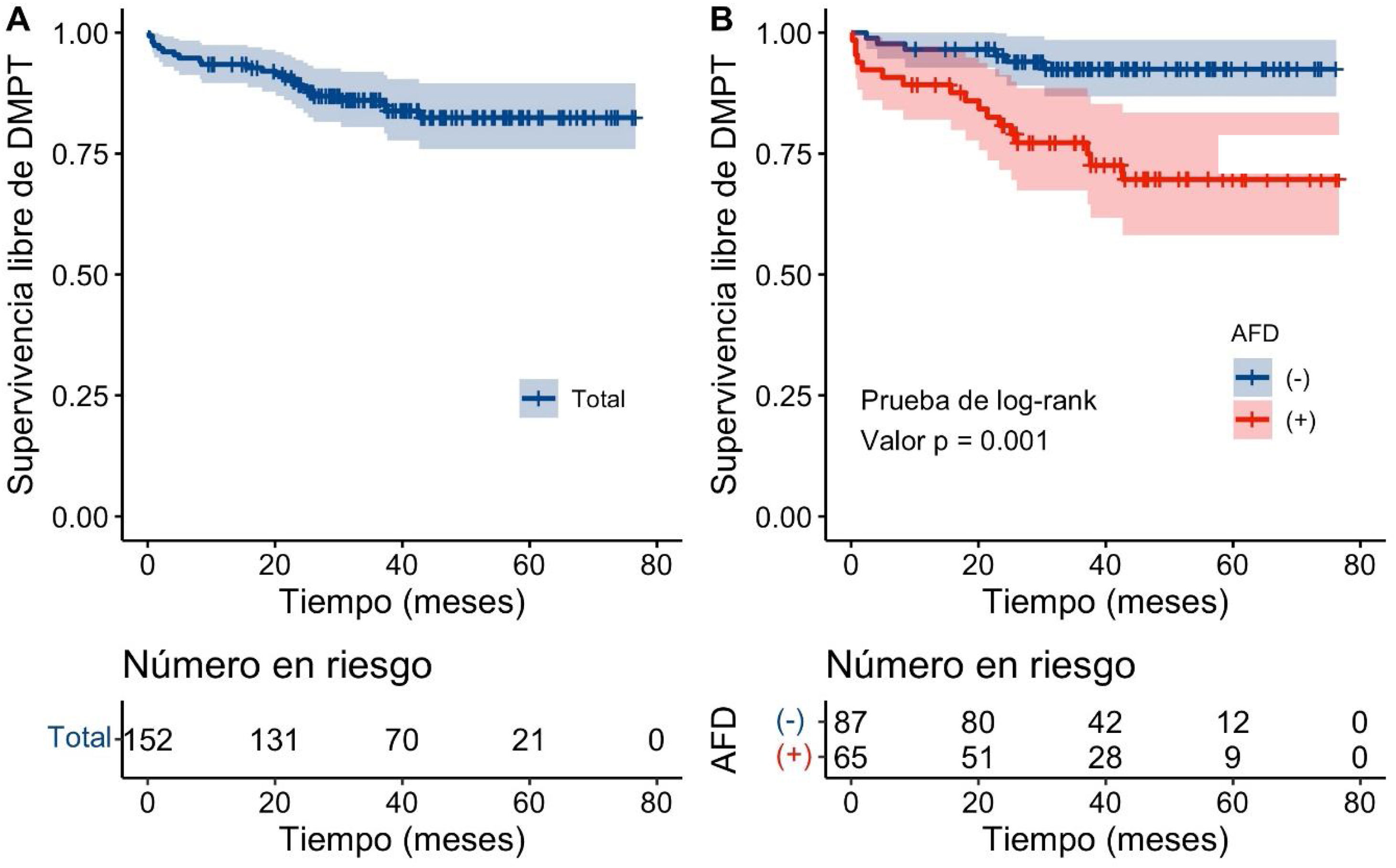
La mediana de seguimiento fue de 41 meses (rango intercuartílico 31-55) y no existió diferencia entre pacientes con y sin AFD (42 meses vs. 40 meses, p=0.6). Durante dicho tiempo, 15% de los pacientes desarrollaron DMPT (n=23); 26.1% de estos pacientes tenían AFD y 6.8% no. En la figura 2 se muestra la supervivencia general libre de DMPT posterior a TH y estratificado por estatus de AFD. La incidencia acumulada general de DMPT a los años 1, 2, 3 y 4 postrasplante fue de 6.6, 10.8, 14.0 y 17.6%. La tasa promedio de incidencia fue de 4.71 casos/100 personas-año. Las tasas de incidencia fueron significativamente más altas en pacientes con AFD, en comparación con los pacientes sin AFD (10.8 vs. 3.4% a 1 año, p=0.086; 19.2 vs. 4.7% a 2 años, p=0.008; 22.8 vs. 7.5% a 3 años, p=0.013; 30.3 vs. 7.4% a 4 años, p=0.001; y 8.72 casos/100 personas-año vs. 2.04 casos/100 personas-año, p=0.001, respectivamente). Respecto a los otros desenlaces postrasplante, el rechazo de injerto ocurrió en 29 (19%) pacientes, con una tasa de incidencia de 5.58 personas-año y la infección por CMV en 28 (18%) pacientes, con una tasa de incidencia de 6.09 personas-año.
Efecto directo y total del antecedente familiar de diabetes sobre la diabetes mellitus postrasplanteEl cociente de riesgo sin ajustar de DMPT para AFD (expuesto vs. no expuesto) fue de 4.19 (IC 95% 1.65-10.6, p=0.003) y 4.14 (IC 95% 1.60-10.7, p=0.005), cuando se controló por edad, IMC y etiología de enfermedad hepática. En el análisis de mediación, el cociente de riesgo ajustado de prediabetes pretrasplante de DMPT para AFD (expuesto vs. sin exposición) fue 3.54 (IC 95% 1.38-9.08, p=0.009) y 3.48 (IC 95% 1.35-9.01, p=0.010) cuando se controló por edad, IMC y etiología de enfermedad hepática. El cociente de riesgo ajustado por AFD de DMPT para prediabetes pretrasplante vs. sin prediabetes pretrasplante fue 3.19 (IC 95% 1.38-7.35, p=0.007) y 2.57 (IC 95% 1.05-6.27, p=0.038), cuando se controló por edad, IMC y etiología de enfermedad hepática. Las estimaciones ajustadas y no ajustadas de cociente de riesgo para la exposición a AFD se muestran en la tabla 3. Tanto en el modelo ajustado como en el no ajustado, el efecto directo del AFD sobre el desarrollo de DMPT fue del 84% del efecto total, lo cual apoya la hipótesis de que la prediabetes pretrasplante es solo un mediador parcial entre el AFD y la DMPT.
Efecto total y directo del antecedente familiar de diabetes sobre la diabetes mellitus posterior a trasplante
| Modelo | CR | IC 95% | Valor de p |
|---|---|---|---|
| Efecto total | |||
| Modelo 1: Sin ajuste | 4.19 | 1.65-10.6 | 0.003 |
| Modelo 2: Ajustado por IMC, edad y etiología EHNA/criptogénica | 3.91 | 1.51-10.1 | 0.005 |
| Efecto directo | |||
| Modelo 3: Ajustado por prediabetes pretrasplantea | 3.54 | 1.38-9.08 | 0.009 |
| Modelo 4: Ajustado por prediabetesa pretrasplante, IMC, edad y etiología EHNA/criptogénica | 3.48 | 1.35-9.01 | 0.010 |
CR: cociente de riesgo; EHNA: esteatohepatitis no alcohólica; IC: intervalo de confianza; IMC: índice de masa corporal.
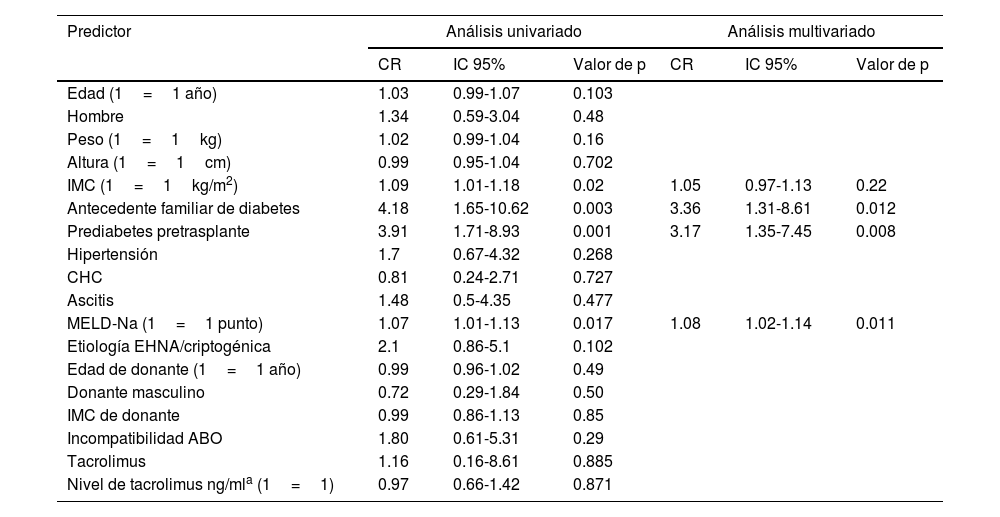
En la tabla 4 se resume el análisis exploratorio de los predictores para desarrollar DMPT. En los análisis univariados, los valores más elevados de IMC, AFD, la prediabetes pretrasplante, puntuaciones MELD mayores y puntuaciones MELD-Na mayores estuvieron asociados con un mayor riesgo de DMPT. El puntaje MELD no se incluyó en el análisis multivariado porque está altamente correlacionado con el puntaje MELD-Na. En el análisis multivariado, el AFD, la prediabetes pretrasplante y el puntaje MELD-Na permanecieron asociados con la DMPT. El predictor con el cociente de riesgo más elevado para DMPT fue AFD. Cuando se controló por otras covariables en el modelo multivariado, el riesgo de desarrollar DMPT en sujetos que tenían AFD fue 3.36 veces más elevado (IC 95% 1.31-8.61, p<0.012) que el riesgo correspondiente a los sujetos sin AFD.
Potenciales predictores de diabetes mellitus postrasplante
| Predictor | Análisis univariado | Análisis multivariado | ||||
|---|---|---|---|---|---|---|
| CR | IC 95% | Valor de p | CR | IC 95% | Valor de p | |
| Edad (1=1 año) | 1.03 | 0.99-1.07 | 0.103 | |||
| Hombre | 1.34 | 0.59-3.04 | 0.48 | |||
| Peso (1=1kg) | 1.02 | 0.99-1.04 | 0.16 | |||
| Altura (1=1cm) | 0.99 | 0.95-1.04 | 0.702 | |||
| IMC (1=1kg/m2) | 1.09 | 1.01-1.18 | 0.02 | 1.05 | 0.97-1.13 | 0.22 |
| Antecedente familiar de diabetes | 4.18 | 1.65-10.62 | 0.003 | 3.36 | 1.31-8.61 | 0.012 |
| Prediabetes pretrasplante | 3.91 | 1.71-8.93 | 0.001 | 3.17 | 1.35-7.45 | 0.008 |
| Hipertensión | 1.7 | 0.67-4.32 | 0.268 | |||
| CHC | 0.81 | 0.24-2.71 | 0.727 | |||
| Ascitis | 1.48 | 0.5-4.35 | 0.477 | |||
| MELD-Na (1=1 punto) | 1.07 | 1.01-1.13 | 0.017 | 1.08 | 1.02-1.14 | 0.011 |
| Etiología EHNA/criptogénica | 2.1 | 0.86-5.1 | 0.102 | |||
| Edad de donante (1=1 año) | 0.99 | 0.96-1.02 | 0.49 | |||
| Donante masculino | 0.72 | 0.29-1.84 | 0.50 | |||
| IMC de donante | 0.99 | 0.86-1.13 | 0.85 | |||
| Incompatibilidad ABO | 1.80 | 0.61-5.31 | 0.29 | |||
| Tacrolimus | 1.16 | 0.16-8.61 | 0.885 | |||
| Nivel de tacrolimus ng/mla (1=1) | 0.97 | 0.66-1.42 | 0.871 | |||
CHC: cáncer hepatocelular; CR: cociente de riesgo; EHNA: esteatohepatitis no alcohólica; IC: intervalo de confianza; IMC: índice de masa corporal; MELD-Na: modelo para enfermedad hepática en etapa terminal-sodio.
Hasta donde sabemos, este es el primer estudio sobre DMPT en población mexicana. Durante una mediana de 41 meses de seguimiento, encontramos que el 15% de nuestros pacientes desarrollaron DMPT, con una tasa de incidencia de 7.71 casos/100 personas-año y una incidencia acumulativa a los años 1, 2, 3 y 4 postrasplante de 6.6, 10.8, 14.0 y 17.6%, respectivamente. Utilizando el mismo criterio de diagnóstico, otros estudios han reportado porcentajes más elevados de DMPT (18%-31%)7,19. Desafortunadamente, dichos análisis no reportaron la tasa de incidencia o la incidencia acumulativa en un tiempo fijo posterior a trasplante. La tasa de incidencia o la incidencia acumulativa a tiempo fijo son mejores medidas para comparar el desarrollo de la DMPT entre estudios ya que los tiempos de seguimiento usualmente son diferentes.
En nuestro estudio, teníamos la expectativa de una mayor incidencia de diabetes debido a la alta carga de diabetes en pacientes mexicanos-mestizos. Reportes previos indican que la población hispánica tiene un mayor riesgo de DMPT13,20, pero en nuestra cohorte no encontramos una mayor incidencia. Una explicación para nuestros resultados podría ser el intervalo de 6 meses durante el cual no registramos casos de hiperglucemia transitoria como DMPT. Un periodo de 6 meses de hiperglucemia prolongada posterior a TH parece ser adecuado para hacer el diagnóstico21. Estudios con tiempo de seguimiento más corto reportan una proporción más elevada de DMPT porque incluyen casos de hiperglucemia transitoria, mientras que los periodos de seguimiento más largos dan como resultado estimaciones menores3. También elegimos dicho abordaje porque la DMPT prolongada está asociada con disfunción del injerto y menor supervivencia del paciente. También es importante resaltar que hasta el 57% de los pacientes no diabéticos presentan hiperglucemia transitoria en los primeros meses posteriores a TH22. En un estudio retrospectivo de la base de datos de TH de la OPTN/UNOS que incluyó a 20,172 pacientes, la DMPT ocurrió en un 26.4% de los receptores, con una mediana de tiempo de seguimiento de 22.8 meses. Sin embargo, no se utilizó la definición de la ADA, la cohorte estuvo conformada por pacientes de mayor edad y la mayoría de los casos (82.1%) fue diagnosticada en el curso de un año, posiblemente incluyendo hiperglucemia transitoria23.
Respecto al esquema de inmunosupresión utilizado, se ha reportado un menor riesgo de DMPT en pacientes tratados con inducción de basiliximab, terapia de antimetabolitos y suspensión temprana de esteroides19. Este abordaje se utiliza en nuestro centro, pero debido a la alta prevalencia de enfermedad hepática autoinmune (42%) en nuestra cohorte, la suspensión temprana de esteroides no fue posible en un número considerable de pacientes. Esta situación podría ser explicada por el hecho de que nuestra institución es un centro de referencia para enfermedades autoinmunes.
Nuestro estudio ofrece evidencia de que el AFD es un factor de riesgo para DMPT. Al controlar por confusores potenciales, encontramos que el riesgo de desarrollar DMPT era 4.14 veces más alto en pacientes con AFD (pariente de primer grado), en comparación con los pacientes sin AFD, lo cual sugiere una predisposición genética. Además, un 84% de dicha asociación se conservó después de ajustar adicionalmente para prediabetes pretrasplante. Como se mencionó antes, nuestro análisis de mediación confirmó que la prediabetes pretrasplante es un mediador parcial para la relación entre AFD y DMPT. En teoría, la prediabetes debería ser un mediator completo, pero debido a que la prediabetes fue evaluada en el periodo de pretrasplante, la variable de prediabetes pretrasplante no fue un mediador completo; por lo tanto, algunos pacientes podrían hacer la transición a la prediabetes después del trasplante y eventualmente a diabetes.
En nuestro análisis exploratorio de otros factores asociados con DMPT, el IMC fue estadísticamente significativo en el análisis univariado, pero no en el análisis multivariado. La evidencia sobre el IMC no es concluyente; algunos estudios han encontrado una asociación positiva entre el IMC y la DMPT11,24, mientras que otros no han hallado esta asociación21,25. La asociación encontrada en algunos estudios puede haber sido confundida por covariables que no fueron consideradas en el análisis (confusores). Además del AFD, en nuestro estudio exploratorio también estuvieron asociados con el desarrollo de DMPT la prediabetes y los puntajes MELD-Na más elevados. Aunque la prediabetes pretrasplante estuvo asociada con DMPT, no eliminó el efecto del AFD sobre el desarrollo de DMPT y un enfoque exclusivo en la prediabetes pretrasplante podría ser insuficiente26. Finalmente, aunque los donantes mayores, la incompatibilidad ABO y la esteatosis de injerto han sido previamente asociados con un mayor riesgo de DMPT9,27, no encontramos diferencias en las características del donante entre los 2 grupos, ni estuvieron asociados con el desarrollo de DMPT.
Con relación a los desenlaces postrasplante, el rechazo del injerto y la infección por CMV pueden haber estado asociados con un riesgo elevado de DMPT28,29. En un análisis post-hoc de nuestros datos, utilizando un modelo de regresión ajustado de Cox con infección por CMV como predictor variante en el tiempo y controlando por edad, IMC, prediabetes pretrasplante, MELD-Na y etiología de cirrosis, encontramos que la infección por CMV estaba asociada con un mayor riesgo de desarrollar DMPT (un cociente de riesgo de 6.40, IC 95% 2.07-19.8, p=0.001). En cuanto a los factores genéticos, algunos estudios han reportado un aumento de 2 a 6 veces en el riesgo de diabetes tipo 2 en pacientes con AFD30,31. La asociación entre polimorfismos de un solo nucleótido y el riesgo de DMPT ha sido documentado en múltiples estudios32. Sin embargo, no se realizó un perfil genético de los pacientes con DMPT y AFD positivo de nuestra cohorte.
Las fortalezas del presente estudio incluyen un tiempo de seguimiento largo, un tamaño de muestra considerable, una cohorte de receptores de TH reciente, el uso de los criterios de la ADA para definir la DMPT y un protocolo estandarizado de inmunosupresión actualizado con los lineamientos vigentes. Otra fortaleza es nuestro enfoque en la evaluación del AFD como factor de riesgo para DMPT. A pesar de que estudios previos declaran que el antecedente familiar es un riesgo de DMPT7,33, son exploratorios y examinan diversos factores de riesgo. Al elegir el antecedente familiar a priori como nuestra exposición de interés y ajustar para confusores potenciales, realizamos un análisis confirmatorio, más que uno solamente exploratorio (sujeto a sesgo aleatorio alto). Nuestro análisis también incluyó un análisis de mediación para cuantificar el efecto directo del AFD sobre la DMPT, al eliminar el efecto por medio de prediabetes. Las principales limitaciones de nuestro estudio incluyen el diseño retrospectivo y unicéntrico, la falta de niveles de hemoglobina A1c cercanos al trasplante (para cuantificar de mejor manera la prediabetes) y la falta de perfil genético de nuestros pacientes.
ConclusiónEn la población mexicana, un AFD positivo podría incrementar el riesgo de desarrollar DMPT. Aunque existe una alta prevalencia nacional de diabetes, la incidencia de DMPT fue similar a la de otros reportes internacionales. Los pacientes con antecedente familiar de diabetes sometidos a TH deben someterse a un programa metabólico más estricto, incluidas modificaciones de estilo de vida y suspensión temprana de esteroides, para prevenir DMPT.
FinanciaciónNo se recibió ningún apoyo específico de cualquier tipo de agencia de los sectores público, comercial, o sin fines de lucro, con relación a la presente investigación.
AgradecimientosDeseamos agradecer y reconocer a todos los miembros del equipo de la Unidad de Hepatología y Trasplante Hepático por el cuidado y monitoreo de los pacientes durante estos años.