La falla hepática aguda es un síndrome poco común pero grave, con una incidencia de aproximadamente 2,000 a 3,000 casos por año en América del Norte. Su fisiopatología y curso clínico varían según la causa del daño hepático primario, y puede llevar a una alta morbimortalidad o necesidad de trasplante hepático, a pesar de las terapias disponibles. Este síndrome involucra una activación excesiva del sistema inmunológico con daño en otros órganos, lo que contribuye a su alta tasa de mortalidad. La definición más aceptada incluye daño hepático con encefalopatía hepática y coagulopatía en las últimas 26 semanas en un paciente sin enfermedad hepática previa. Las principales causas son intoxicación por paracetamol, hepatitis viral, lesión hepática inducida por drogas, entre otras. Es crucial identificar la causa, ya que influye en el pronóstico y tratamiento. La supervivencia ha mejorado con medidas de soporte, terapia intensiva, prevención de complicaciones y el uso de medicamentos como la N-acetilcisteína. El trasplante hepático es una opción curativa para casos no respondedores al tratamiento médico, pero la evaluación adecuada del momento para el trasplante es crucial para mejorar los resultados. Factores como la edad del paciente, la causa subyacente y la gravedad de las fallas orgánicas influyen en los resultados y la supervivencia postrasplante.
Acute liver failure is a rare but serious syndrome, with an incidence of approximately 2,000 to 3,000 cases per year in North America. Its pathophysiology and clinical course vary, depending on the cause of the primary liver injury, and can lead to high morbidity and mortality or the need for liver transplantation, despite available therapies. This syndrome involves excessive activation of the immune system, with damage in other organs, contributing to its high mortality rate. The most accepted definition includes liver injury with hepatic encephalopathy and coagulopathy within the past 26 weeks in a patient with no previous liver disease. The main causes are paracetamol poisoning, viral hepatitis, and drug-induced liver injury, among others. Identifying the cause is crucial, given that it influences prognosis and treatment. Survival has improved with supportive measures, intensive therapy, complication prevention, and the use of medications, such as N-acetylcysteine. Liver transplantation is a curative option for nonresponders to medical treatment, but adequate evaluation of transplantation timing is vital for improving results. Factors such as patient age, underlying cause, and severity of organ failure influence the post-transplant outcomes and survival.
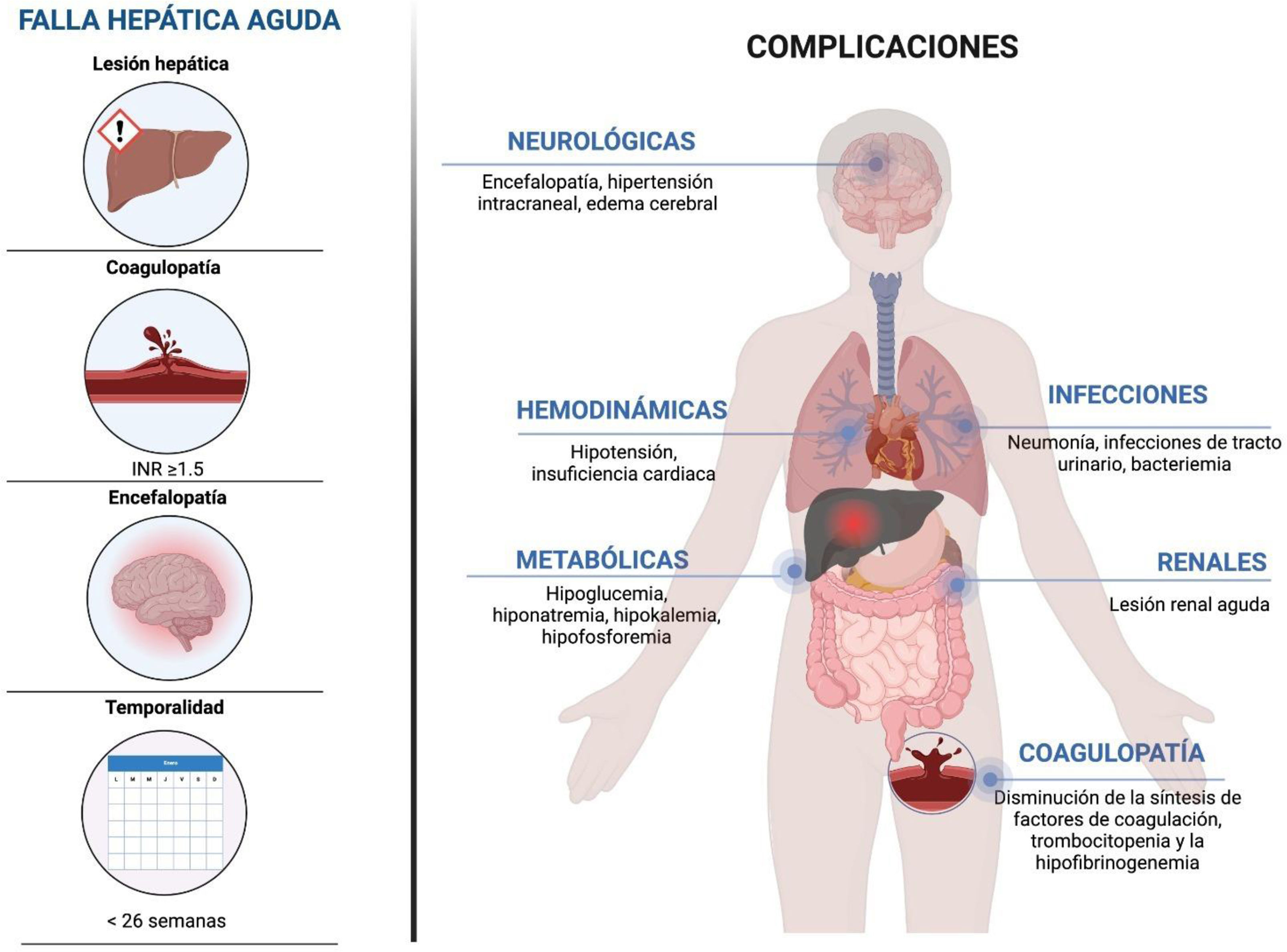
La falla hepática aguda (FHA) es un síndrome multisistémico, complejo, de desarrollo rápido progresivo e impredecible causado por múltiples etiologías (infecciones virales, herbolaria y fármacos, enfermedades autoinmunes, genéticas y/o factores ambientales), y aunque poco frecuente, posee una alta tasa de mortalidad. Esta entidad es considerada potencialmente reversible y se caracteriza por un daño hepático rápido (<26 semanas) con desarrollo de encefalopatía hepática (EH) y coagulopatía (INR>1.5) en un individuo sin enfermedad hepática preexistente1. La incidencia anual reportada es de 2,000 a 3,000 casos en Estados Unidos2.
La probabilidad de recuperación espontánea o supervivencia libre de trasplante (SLT) está relacionada con la etiología y el grado de la EH. Actualmente, se ha incrementado la cifra de pacientes con SLT gracias a las opciones de manejo de soporte médico como el uso de N-acetilcisteína (NAC), terapia continua de reemplazo renal (TCRR) y un menor requerimiento de ventilación mecánica invasiva3–5. Sin embargo, la mortalidad reportada va desde el 25 hasta el 30% de los pacientes que llegan a una lista de espera de trasplante hepático. El trasplante es considerado como una urgencia nacional en aquellos que cumplen con los criterios, y actualmente la supervivencia a uno y 5 años postrasplante es de 90 y 80%, respectivamente, y los resultados llegan a ser equiparables a los de la población trasplantada por una enfermedad hepática crónica6,7.
A menudo, se malinterpreta en pacientes con enfermedad hepática crónica que experimentan un repentino deterioro en la función hepática, lo cual se denomina falla hepática aguda sobre crónica. Además, es crucial diferenciar otras condiciones que no forman parte del espectro de FHA, como la hepatitis alcohólica, la sepsis, la resección hepática extensa y el trauma hepático, para garantizar un manejo óptimo y oportuno8.
Diferencias entre falla hepática aguda y falla hepática aguda sobre crónicaEn ocasiones, es difícil la distinción entre una FHA y una descompensación aguda de cirrosis o una falla hepática aguda sobre crónica. La cirrosis hepática es altamente prevalente a nivel mundial y el desarrollo de descompensaciones (EH, hemorragia variceal, y ascitis) suele estar presente en algún punto en el transcurso de la enfermedad, sin embargo, en la mayoría de las ocasiones es fácil determinar el antecedente de la hepatopatía crónica. Por otro lado, la falla hepática aguda sobre crónica se caracteriza por una inflamación sistémica intensa, una relación temporal estrecha a un evento precipitante, y la presencia de una o múltiples fallas orgánicas. La falla hepática aguda sobre crónica se presenta de manera repentina en un paciente con cirrosis hepática descompensada y conlleva una mortalidad alta a corto plazo (>20% a 28 días). Usualmente, se desarrolla en el contexto de un daño sobre agregado que provoca una reacción inflamatoria sistémica; las causas pueden ser intrahepáticas (por ejemplo, virales, inducida por drogas, alcohol, etc.) o extrahepáticas (por ejemplo, hipoperfusión por disfunción cardiaca, sepsis, Budd-Chiari, etc.)9. Es de vital importancia identificar las diferencias entre estas entidades, ya que el manejo cambia radicalmente, siendo que la FHA recibe un estatus 1A en la lista de trasplante, mientras que al momento la falla hepática aguda sobre crónica no recibe ninguna prioridad y se enlista de acuerdo con el puntaje de MELD10.
EpidemiologíaLa FHA es considerada una enfermedad relativamente rara, con una incidencia anual de 2,000 a 3,000 casos por año1; representa hasta el 4 a 5% de todos los trasplantes de hígado. Las causas son diversas y varían según la región y el nivel socioeconómico. En países desarrollados predomina la toxicidad por paracetamol hasta en el 45 al 55%, con una incidencia de 5.5 a 6.2 casos por millón-año11 (tabla 1), sin embargo, en países en vías de desarrollo la sobredosis por paracetamol es menos frecuente y las hepatitis virales (hepatitis A y E), herbolaria y otras drogas tienen un papel fundamental en el desarrollo de FHA3,12,13. Se sabe que hasta en el 11 al 15% de los adultos y en el 50% de los pacientes pediátricos no es posible identificar la etiología, y esta cifra puede incrementarse hasta en un 34% en países en vías de desarrollo14, muchas veces por la falta de acceso a estudios de laboratorio adecuados4,15,16. Existe una escasa descripción en cuanto a la epidemiología de la FHA en México. Se ha observado un incremento en la incidencia y mortalidad atribuibles a las causas virales de la FHA en el país. Sin embargo, estas observaciones se fundamentan en estudios retrospectivos basados en registros nacionales, lo que los hace susceptibles a sesgos de información y a variaciones en la detección dependiendo del acceso a los servicios de salud17.
Incidencia de falla hepática y causas
| País | Incidencia | Causa |
|---|---|---|
| Global18 | Epidemiología FHA viral | VHA: 2-20%VHB: 20-22%VHC: 9%VHE: 32% |
| Países de altos ingresosa,3 | 5.5-6.2 casos por millón de habitantes-año | Principal causa: IPC |
| Países de ingresos medios-bajosa,3 | Poca información por falta de referencia a centros de tercer nivel | Principales causas: indeterminada, hepatitis virales (VHE), herbolaria, DHIF |
| Estados Unidos1 | Un caso por millón de habitantes-año | IPC: 45.7%, DHIF: 10%, VHB: 8%Otras causas: asociada al embarazo, síndrome Budd-Chiari, infecciones virales no hepatotrópicas, malignidad (15%) |
| Alemania19 | 11.3 casos por millón de habitantes-año | DHIF: 32%, IPC: 32%, indeterminada: 24%, viral: 21% |
| Kenia3 | 15.7 casos por millón de habitantes-año | No especificada |
| Tailandia3 | 62.9 casos por millón de habitantes-año | Indeterminada: 69.4%DHIF no paracetamol: 26.2% |
DHIF: daño hepático inducido por fármacos; FHA: falla hepática aguda; IPC: intoxicación por paracetamol; VHA: virus de la hepatitis A; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VHE: virus de la hepatitis E.
El curso de la enfermedad es variable e impredecible; se sabe que la tasa de mortalidad es del 25 al 30%, siendo las principales causas la sepsis y el edema cerebral20. A pesar de no tener estadísticas claras, en países en vías de desarrollo la mortalidad puede variar del 26.7 hasta el 84% de los casos15. Por otro lado, la recuperación espontánea puede presentarse en el 45% de los pacientes, dependiendo de su etiología21.
Definición y características clínicas de la falla hepática agudaEn el espectro del comportamiento clínico de la FHA, se distinguen diversas etapas. La primera comprende el daño hepático agudo o lesión hepática aguda (LHA), término que describe la afectación de las pruebas de función hepática10, sin llegar a evolucionar hacia la EH. Esta condición puede evolucionar hacia la FHA o resolverse sin secuelas.
La etiología desempeña un papel determinante en el pronóstico; por ejemplo, la recuperación espontánea y la SLT en casos de toxicidad por paracetamol alcanza aproximadamente el 70%, mientras que en la infección por el virus de la hepatitis A es solo del 56%, y las complicaciones relacionadas con el embarazo registran un 83%. En contraste, entidades como la hepatitis autoinmune, el daño hepático inducido por fármacos, la hepatitis aguda por el virus de la hepatitis B y las causas indeterminadas exhiben un pronóstico desfavorable, con tasas de recuperación espontánea reportadas inferiores o iguales al 35%21,22.
La definición de LHA no está uniformemente establecida. En un estudio prospectivo que incluyó a 386 pacientes con esta enfermedad, definidos según su etiología (paracetamol: INR≥2 y ALT≥10 veces el límite superior normal; no paracetamol: INR≥2, ALT≥10 veces el límite superior normal y bilirrubina≥3.0mg/dL), Koch et al. identificaron que la progresión a un desenlace adverso (FHA, muerte o trasplante hepático) estaba asociada con la etiología de la LHA (no paracetamol), los niveles de bilirrubina (>3mg/dL), el INR (>1.7), los niveles séricos de paracetamol (>60mg/dL) y la duración de la ictericia (>3 días)23.
La transición a la etapa de FHA se caracteriza por el desarrollo de EH, caracterizada por déficits cognitivos (deficiencias en la atención, el tiempo de reacción, desorientación, comportamiento inadecuado, somnolencia, confusión e inconsciencia) y deterioro de la función neuromuscular (bradicinesia, asterixis, disartria, ataxia, reflejos tendinosos profundos hiperactivos, nistagmo, etc.). Es crucial considerar 3 causas con manifestaciones fulminantes que podrían estar asociadas a una enfermedad hepática preexistente, como la enfermedad de Wilson, la reactivación de la infección crónica por el virus de la hepatitis B y la hepatitis autoinmune16,23.
La definición de FHA varía de manera global, sin embargo, en Estados Unidos y Europa la definición más aceptada es la de una enfermedad de una duración<26 semanas en un paciente sin enfermedad hepática preexistente o cirrosis asociada con cualquier grado de EH y coagulopatía (INR≥1.5)10.
El tiempo de evolución de la enfermedad provee información para asociar la etiología, las complicaciones, el pronóstico y el tratamiento médico de soporte. En 1993, O’Grady et al.6 propusieron uno de los sistemas más aceptados para describir la evolución y estimar un pronóstico de la enfermedad. Esta clasificación se basa en el tiempo entre la aparición de la ictericia y el desarrollo de EH, subdividiéndose en 3 grupos: hiperagudo<7 días, agudo 7-28 días y subaguda 4-12 semanas (tabla 2)24. Aunque esta clasificación es la más difundida, parece más lógico agrupar la aguda y la subaguda en un solo síndrome, porque su velocidad de evolución comúnmente se sobrepone, mientras que los pacientes con insuficiencia hepática hiperaguda tienen una evolución y patrón de enfermedad distinto1.
Clasificación y sistema de O’Grady, manifestaciones clínicas y pronóstico de los subtipos de falla hepática aguda
| Manifestaciones | Hiperaguda | Aguda | Subaguda |
|---|---|---|---|
| Tiempo de ictericia a encefalopatía, semanas | 0-1 | 1-4 | 4-12 |
| Severidad de la coagulopatía | Severa | Moderada | Leve |
| Grado de HIC | Moderada | Moderada | Leve |
| Supervivencia libre de TH | Buena | Moderada | Pobre |
| Etiología indicativa | Paracetamol, VHA, VHE | VHB | DHIF |
DHIF: daño hepático inducido por fármacos; FHA: falla hepática aguda; HIC: hipertensión intracraneal; TH: trasplante hepático; VHA: virus de la hepatitis A; VHB: virus de la hepatitis B; VHE: virus de la hepatitis E.
Además de la clasificación previamente descrita, existen otras adoptadas a nivel mundial para clasificar la FHA. Un ejemplo es la propuesta por Bernuau et al.25 en Francia en 1986, que distingue entre falla hepática fulminante (<2 semanas) y subfulminante (de 2 a 12 semanas). Otra clasificación, presentada por Tandon et al.26 en 1999 bajo el auspicio de la International Association for the Study of the Liver, define la FHA como aguda si se desarrolla en menos de 4 semanas, subdividiéndola en hiperaguda (menos de 10 días) y fulminante (de 10 a 30 días), mientras que la subaguda abarca un periodo de 5 a 24 semanas. Por otra parte, Mochida et al.27 en Japón, en 2011, propusieron una clasificación que distingue entre FHA aguda (menos de 10 días) y subaguda (de 11 a 56 días).
A pesar de las variaciones en los intervalos temporales y las definiciones, existe un consenso general de que los pacientes que experimentan un rápido desarrollo de la EH a partir del inicio de los síntomas también muestran una mayor probabilidad de responder favorablemente al tratamiento médico.
Etiologías de falla hepática agudaEl daño hepático de forma súbita y grave en la FHA puede tener diversas causas, como toxicidad por drogas, infecciones virales, trastornos autoinmunes o genéticos, problemas vasculares, malignidades y alteraciones metabólicas (tabla 3). Para comprender mejor las causas de la FHA las podemos clasificar en 2 categorías principalmente: aquellas desencadenadas por paracetamol y las no relacionadas con paracetamol.
Causas generales de falla hepática aguda
| Virales | Hepatitis A, B (±D), C y ECMV, VEB, herpes virus, HHV-6, parvovirus B19, parainfluenza y VVZ |
| Daño hepático inducido por drogas (dependiente de drogas) | ParacetamolAntibióticos/antivirales: amoxicilina-clavulanato, ciprofloxacino, minociclina, dapsona, doxiciclina, TMP/SMX, didanosina, ketoconazol, efavirenz, abacavirAntiepilépticos: ácido valproico, fenitoína, CBZAntituberculosos: isoniazida, rifampicina, pirazinamidaAntihipertensivos: metildopa, hidralazina, labetalolAINE: diclofenaco, ibuprofeno, indometacina, naproxenoAnestésicos: halotanoHerbolaria y suplementosOtros: amitriptilina, estatinas, amiodarona, metotrexato |
| Daño hepático inducido por drogas (sinergia) | Etanol+paracetamolBarbitúricos+paracetamolIsoniacida+rifampicina |
| Genéticas/metabólicas | Enfermedad de WilsonGalactosemiaHemocromatosisDeficiencia de α1-antitripsinaTirosinemia |
| Enfermedades relacionadas con el embarazo | Hígado graso del embarazoSíndrome HELLPPreeclampsia/eclampsia |
| Vasculares | Síndrome de Budd-ChiariTrombosis de la arteria hepáticaEnfermedad venooclusiva |
| Otras | MalignidadSíndrome de ReyeHepatitis autoinmuneLeptospirosis, malaria |
AINE: antiinflamatorios no esteroideos; CBZ: carbamazepina; CMV: citomegalovirus; HHV-6: virus herpes humano 6; TMP/SMX: trimetoprima sulfametoxazol; VEB: virus de Epstein-Barr; VVZ: virus varicela-zóster.
La intoxicación por paracetamol (IPC) representa un problema a nivel mundial, en especial por el incremento del consumo de narcóticos y paracetamol. Esta entidad se considera, de manera frecuente, asociada a un consumo intencional relacionado con intento de suicidio28. La dosis terapéutica segura del paracetamol es de hasta 4,000mg cada 24h. Sin embargo, una dosis mayor de 10-15g en un periodo de 24h, generalmente asociada con intentos autolíticos, o el uso prolongado de altas dosis (>10g) pueden inducir LHA. Situaciones como el ayuno, la desnutrición, el consumo concomitante de alcohol y la edad avanzada pueden ser factores predisponentes para la hepatotoxicidad10,29.
La IPC es la principal causa de FHA en el mundo, sin embargo, la tasa de mortalidad es baja en comparación con otras causas. Algunos factores asociados a la gravedad de la hepatotoxicidad por paracetamol es el incremento del metabolismo oxidativo por el consumo concomitante y crónico de alcohol, el ayuno, la edad y el estado nutricional, que son factores reductores de las reservas intrahepáticas de glutatión24. Ante la sospecha de IPC, la medición sérica de los niveles del fármaco puede ser de utilidad para la estratificación del riesgo. Su determinación y correlación con el nomograma de Rumack-Matthew es útil para guiar la terapia y evaluar los desenlaces. Es relevante mencionar que una detección negativa o baja de paracetamol debe interpretarse con cautela, dado que los niveles pueden subestimarse aun cuando ya exista daño hepático establecido28,30.
La IPC se caracteriza por una elevación significativa de aminotransferasas, INR variable y niveles moderados a normales de bilirrubinas. De manera concomitante puede presentar acidosis láctica, lesión renal aguda, hipoglucemia y rápido deterioro neurológico dentro de las primeras 72h, con un marcado edema cerebral. En esta etiología en particular, la SLT es cercana al 70% aun en pacientes con desarrollo de EH grado 3-428,30–32. El tratamiento de elección en FHA por paracetamol es el antídoto con NAC vía oral o parenteral (tabla 4)10,16. En México, la presentación más común de NAC es en tabletas efervescentes para administración oral. Sin embargo, tanto la vía oral como la intravenosa son igualmente efectivas, siendo la segunda la preferida en otros lugares debido a su mejor tolerabilidad y facilidad de administración. Es crucial disolver las tabletas en agua y administrar la solución dentro de una hora después de su preparación. En caso de que el paciente vomite dentro de esta ventana de tiempo, se recomienda volver a administrar la dosis33,34.
Esquema de administración de N-acetilcisteína
| Vía oral | Dosis de carga: 140mg/kgDosis subsecuentes: 70mg/kg cada 4h durante 72h |
| Vía parenterala | Dosis de carga: 150mg/kg en 500cc de solución glucosada al 5% en infusión para 4hSegunda dosis: 50mg/kg en 1,000cc de solución glucosada al 5% en infusión para 19hTercera dosis: 125mg/kg en 1,000cc de solución glucosada al 5% en infusión para 24hCuarta dosis: 150mg/kg en 1,000cc de solución glucosada al 5% en infusión para 24hQuinta dosis: 150mg/kg en 1,000cc de solución glucosada al 5% en infusión para 24h |
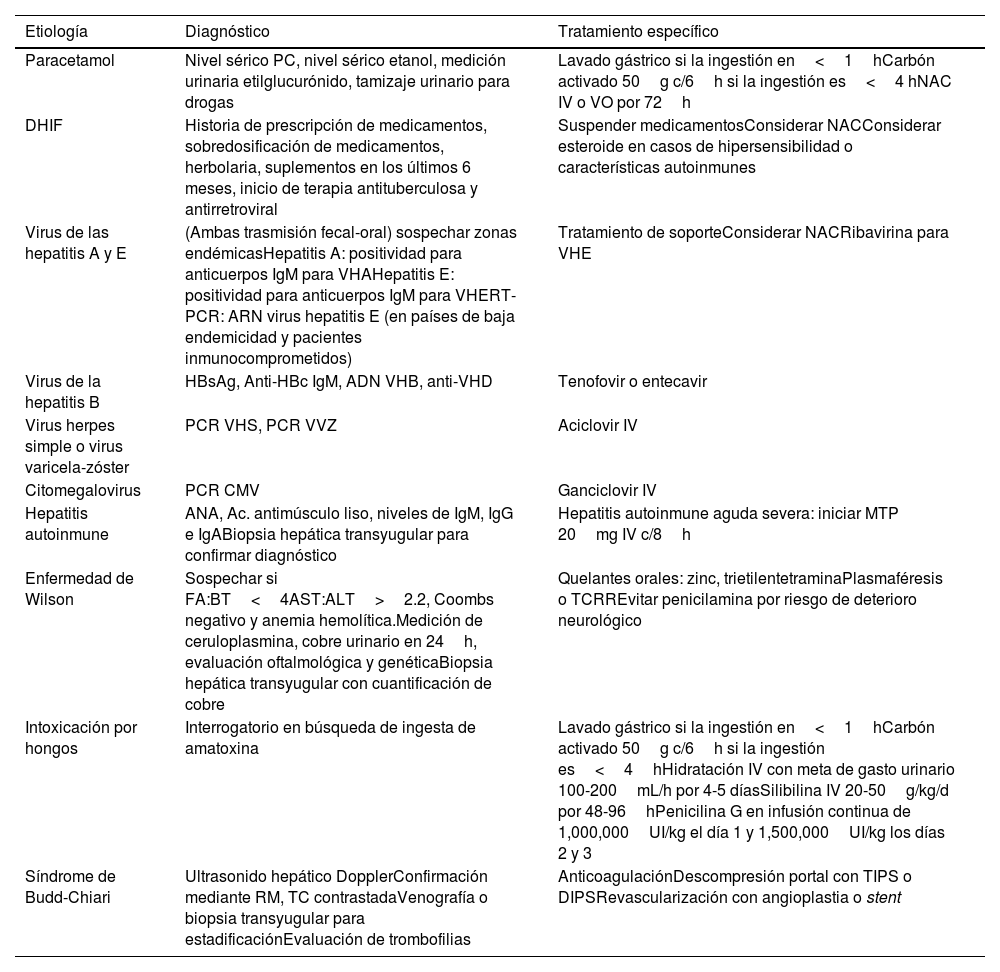
Las causas de FHA no paracetamol pueden ser idiosincráticas, relacionadas con fármacos, hepatitis virales, autoinmunes, dengue, entre otras. Identificar la causa, iniciar rápidamente el tratamiento específico de acuerdo con la etiología y proporcionar manejo de soporte es crucial para mejorar el pronóstico (tabla 5). En el estudio llevado a cabo por Lee et al. se incluyeron 1,147 pacientes con FHA con el propósito de evaluar factores relacionados con la mortalidad y la resolución espontánea, discriminando por etiología. Se identificaron grupos con pronósticos diversos, donde el buen pronóstico, con una probabilidad significativa de resolución espontánea, se observó en casos de IPC (60-70%), hepatitis A (50-70%) y embarazo (75%). Por otro lado, los casos de mal pronóstico, aunque con cierta posibilidad de resolución espontánea, se observaron en hepatitis autoinmune (15%), hepatitis B (20%), intoxicación por fármacos (20%) y casos de etiología indeterminada (20-30%)35.
Recomendaciones de evaluación y tratamiento en adultos con falla hepática aguda (causas más frecuentes)
| Etiología | Diagnóstico | Tratamiento específico |
|---|---|---|
| Paracetamol | Nivel sérico PC, nivel sérico etanol, medición urinaria etilglucurónido, tamizaje urinario para drogas | Lavado gástrico si la ingestión en<1hCarbón activado 50g c/6h si la ingestión es<4 hNAC IV o VO por 72h |
| DHIF | Historia de prescripción de medicamentos, sobredosificación de medicamentos, herbolaria, suplementos en los últimos 6 meses, inicio de terapia antituberculosa y antirretroviral | Suspender medicamentosConsiderar NACConsiderar esteroide en casos de hipersensibilidad o características autoinmunes |
| Virus de las hepatitis A y E | (Ambas trasmisión fecal-oral) sospechar zonas endémicasHepatitis A: positividad para anticuerpos IgM para VHAHepatitis E: positividad para anticuerpos IgM para VHERT-PCR: ARN virus hepatitis E (en países de baja endemicidad y pacientes inmunocomprometidos) | Tratamiento de soporteConsiderar NACRibavirina para VHE |
| Virus de la hepatitis B | HBsAg, Anti-HBc IgM, ADN VHB, anti-VHD | Tenofovir o entecavir |
| Virus herpes simple o virus varicela-zóster | PCR VHS, PCR VVZ | Aciclovir IV |
| Citomegalovirus | PCR CMV | Ganciclovir IV |
| Hepatitis autoinmune | ANA, Ac. antimúsculo liso, niveles de IgM, IgG e IgABiopsia hepática transyugular para confirmar diagnóstico | Hepatitis autoinmune aguda severa: iniciar MTP 20mg IV c/8h |
| Enfermedad de Wilson | Sospechar si FA:BT<4AST:ALT>2.2, Coombs negativo y anemia hemolítica.Medición de ceruloplasmina, cobre urinario en 24h, evaluación oftalmológica y genéticaBiopsia hepática transyugular con cuantificación de cobre | Quelantes orales: zinc, trietilentetraminaPlasmaféresis o TCRREvitar penicilamina por riesgo de deterioro neurológico |
| Intoxicación por hongos | Interrogatorio en búsqueda de ingesta de amatoxina | Lavado gástrico si la ingestión en<1hCarbón activado 50g c/6h si la ingestión es<4hHidratación IV con meta de gasto urinario 100-200mL/h por 4-5 díasSilibilina IV 20-50g/kg/d por 48-96hPenicilina G en infusión continua de 1,000,000UI/kg el día 1 y 1,500,000UI/kg los días 2 y 3 |
| Síndrome de Budd-Chiari | Ultrasonido hepático DopplerConfirmación mediante RM, TC contrastadaVenografía o biopsia transyugular para estadificaciónEvaluación de trombofilias | AnticoagulaciónDescompresión portal con TIPS o DIPSRevascularización con angioplastia o stent |
Ac.: anticuerpos; ALT: alanina aminotransferasa; ANA: anticuerpos antinucleares; AST: aspartato aminotransferasa; BT: bilirrubina total; DHIF: daño hepático inducido por fármacos; DIPS: direct intrahepatic portocaval shunt; FA: fosfatasa alcalina; FHA: falla hepática aguda; IV: intravenoso; MTP: metilprednisolona; NAC: N-acetilcisteína; PC: paracetamol; RT-PCR: reacción en cadena de la polimerasa en tiempo real; RM: resonancia magnética; TC: tomografía computarizada; TCRR: terapia continua de reemplazo renal; TIPS: transjugular intrahepatic portosystemic shunt; VHA: virus de la hepatitis A; VHB: virus de la hepatitis B; VHD: virus de la hepatitis D; VHE: virus de la hepatitis E; VHS: virus del herpes simple; VO: vía oral; VVZ: virus de la varicela-zóster.
Fuente: Shingina et al.10.
El tratamiento con NAC fuera del grupo no paracetamol se ha considerado como opción en ciertas causas (daño hepático inducido por fármacos, virus de la hepatitis A y hepatitis autoinmune). La utilización de la NAC se ha incrementado en los últimos 10 años y se ha relacionado con un incremento de la SLT, particularmente cuando se utiliza de forma temprana, especialmente en EH grado<2, ya que a mayores grados de EH no se ha observado un efecto significativo36.
Dentro del abordaje inicial, la biopsia hepática juega un papel poco definido, y con un riesgo alto de complicaciones. Su realización se justifica en situaciones específicas, como la sospecha de hepatitis autoinmune, infecciones virales como el herpes simple y cuando se sospecha malignidad. En estos casos, se prefiere la vía transyugular en lugar de la percutánea, con el objetivo de minimizar el riesgo de sangrado36.
Falla hepática aguda en mujeres embarazadasLa FHA durante el embarazo puede originarse por causas específicas asociadas al estado gestacional durante el tercer trimestre o en el posparto inmediato, como el síndrome de hemólisis, elevación de enzimas hepáticas y trombocitopenia (HELLP), así como el hígado graso agudo del embarazo (HGAE), además de las causas observadas en personas no embarazadas.
La incidencia de FHA durante el embarazo se ha reportado en aproximadamente el 3% de los embarazos. Existen diferencias significativas entre el HGAE y el síndrome HELLP. El síndrome HELLP se asocia con antecedentes de embarazos complicados por HELLP, multigestación y extremos de edad materna, usualmente manifestándose después de las 20 semanas de gestación. Sus características laboratoriales principales incluyen hemólisis, trombocitopenia, hipertensión y proteinuria, rara vez progresando a FHA. A nivel ecográfico, puede presentar una imagen normal, así como infartos, hematomas o rotura capsular, y conlleva una mortalidad materna y fetal del 1 y 11%, respectivamente. Por otro lado, el HGAE se presenta con mayor frecuencia en primigestas, embarazos múltiples y fetos masculinos, típicamente después de las 24 semanas de gestación. Sus manifestaciones laboratoriales incluyen coagulopatía, encefalopatía, hipoglucemia e ictericia. En la exploración ecográfica, se evidencia infiltración grasa. Este trastorno conlleva una mortalidad materna y fetal del 7-18 y 9-23%, respectivamente. Al igual que ocurre con otras enfermedades relacionadas con el embarazo, la resolución de este puede contribuir a mejorar la condición hepática37.
El síndrome HELLP y el HGAE representan cada uno aproximadamente el 25% de las causas de FHA durante el embarazo. El restante 50% está compuesto por etiologías que se presentan en personas no embarazadas, donde predominan las causas por paracetamol, virales y autoinmunes. La presencia de FHA asociada al síndrome HELLP y al HGAE constituye una urgencia obstétrica que requiere un manejo multidisciplinario. Esto incluye una pronta resolución del parto, manejo de soporte como se menciona más adelante y la evaluación para trasplante hepático en aquellas pacientes que no muestren mejoría tras el parto10.
Complicaciones y manejo de falla hepática agudaEl manejo integral de los pacientes con falla hepática es complejo. Deben tener una monitorización estrecha en una unidad de cuidados intensivos, y un abordaje multidisciplinario entre médicos intensivistas, hepatólogos, nefrólogos e infectólogos. El tratamiento inicial se considera de soporte médico, centrándose en garantizar la estabilidad hemodinámica, evaluar la gravedad de la enfermedad y, al mismo tiempo, llevar a cabo un análisis detallado de la etiología. Las complicaciones más frecuentes y graves en el FHA están relacionadas con alteraciones neurológicas, infecciosas, hemodinámicas y el desarrollo de falla orgánica múltiple en los casos de mayor severidad (fig. 1).
Edema cerebral e hipertensión intracranealLa hipertensión intracraneal se caracteriza por un aumento de la presión intracraneal superior a 20-25mmHg. Es una complicación de la FHA que está vinculada a un pronóstico desfavorable, con una tasa de mortalidad del 35 al 40%. Por tanto, es crucial identificar y tratar esta complicación de manera oportuna38.
La presencia de edema cerebral es poco frecuente en grados 1-2 de EH, sin embargo, está presente en el 25-35% de los enfermos con EH grado 3, y el 75% en EH grado 439. En el contexto de FHA, la hipertensión intracraneal parece estar relacionada con la hiperamonemia y el edema astrocitario temprano que provoca una pérdida de la autorregulación del flujo sanguíneo intracraneal. Los niveles de amonio arterial>150μmol/L guardan una proporción directa con el aumento de la presión intracraneana (PIC), pudiendo progresar a herniación encefálica, inestabilidad hemodinámica y muerte40.
Entre las estrategias para detectar hipertensión intracraneal se encuentra la monitorización ultrasonográfica: la medición del diámetro de la vaina del nervio óptico mediante ultrasonido, siendo significativo si supera los 0.48cm. Esta medida se relaciona con una PIC>20mmHg y puede utilizarse para monitorizar y evaluar la respuesta al tratamiento41. El ultrasonido Doppler transcraneal puede evaluar el flujo sanguíneo e identificar a los pacientes con hipoperfusión cerebral, así como la medición del índice de pulsatilidad que correlaciona con la PIC y predice el pronóstico42–44.
La monitorización invasiva de la PIC es una opción en pacientes con EH grado 3-4, sin embargo, su uso generalizado no está recomendado ya que no se ha podido demostrar una disminución en la mortalidad con su uso, por lo cual, su utilización se restringe a pacientes seleccionados en centros con experiencia en su colocación y uso10. La monitorización intraparenquimatosa logra mediciones exactas y en tiempo real, mientras que la aplicación de catéteres intraventriculares, subdurales o epidurales proveen mediciones indirectas, siendo el último el menos invasivo y con menor tasa de complicaciones (infección y sangrado)45. El uso profiláctico de factor viia recombinante, plasmas frescos congelados y desmopresina previo a la colocación de la monitorización intraparenquimatosa son opciones para reducir el riesgo de hemorragia a<5%22,46,47. En la tabla 6 se describen las medidas generales del edema cerebral en el paciente con FHA.
Manejo en terapia intensiva del edema cerebral en el paciente con falla hepática aguda
| Generales | Laboratorios: BH, electrólitos séricos, tiempos de coagulación, fibrinógeno, factor v, lactato y amonio cada 8-12hGlucometría capilar cada 1-2hProfilaxis de úlceras por estrés con IBPCultivos (hemocultivo, urocultivo, cultivo de expectoración) y radiografía de tórax al ingreso y evaluación cada 48-72h |
| Neuroprotección | Evaluación neurológica (Escala de Coma de Glasgow, West Haven) cada 1-2hCabecera>30-35%Evitar depresores y sedantes (benzodiazepinas, opioides, antihistamínicos)Uso de medicamentos de acción corta (midazolam, propofol) en caso de agitación o para VMA en caso de EH grado 3-4Minimizar manipulación y estimulación (aspiración endotraqueal, maniobras de Valsalva) |
| Manejo de hipertensión intracraneana | TC cráneo en EH grado 3 o 4 (excluir hemorragia intracraneal)No se recomienda la monitorización invasiva de PIC de manera general, solo en pacientes altamente seleccionadosUso de agentes osmóticos:- Solución salina hipertónica: meta Na sérico 145-150mmol/L, evitar incrementos>8mmol de Na en 24h- Manitol 0.5-1g/kg IV bolo para 5min. Monitorizar osmolaridad sérica cada 4h (detener si>320mOsm/L)Valorar hiperventilación permisiva PaCO2 28-30mmHg durante periodos cortos en caso de no tener respuesta con terapia previa |
BH: biometría hemática; EH: encefalopatía hepática; IBP: inhibidor de la bomba de protones; IV: intravenoso; PaCO2: presión parcial de dióxido de carbono; PIC: presión intracraneal; TC: tomografía computarizada; VMA: ventilación mecánica asistida.
Otras de las opciones para disminuir las complicaciones neurológicas en FHA es reducir la producción y aumentar la depuración de amonio arterial. Una opción es el uso de TCRR, la cual es efectiva para disminuir la concentración de amonio circulante, manteniendo una estabilidad metabólica y térmica, principalmente en aquellos pacientes que desarrollan lesión renal aguda y oliguria con sobrecarga hídrica. La TCRR se ha asociado con una mejor supervivencia en FHA, sobre todo en grado de EH>348–50.
CoagulopatíaLa prolongación del INR es una característica que se presenta en todos los casos de FHA según su definición, aunque es importante señalar que la probabilidad de sangrado asociado es baja (5-10%). En este escenario, el hígado disminuye la síntesis de factores de coagulación (ii, v, vii, ix, x) y factores anticoagulantes (proteínas C y S), y el sistema fibrinolítico se ve alterado. A pesar de que un INR incrementado es un factor pronóstico, el valor del INR no se vincula directamente con el riesgo de sangrado. En un estudio llevado a cabo por Agarwal et al.22, se observó una falta de correlación entre el INR y las pruebas viscoelásticas en los pacientes con FHA. El uso de la tromboelastografía rotacional se ha propuesto para una mejor correlación de los estados de coagulabilidad en esta población y su asociación con complicaciones e incidencias de sangrado51.
Otras alteraciones hemostáticas frecuentes son la trombocitopenia y la hipofibrinogenemia. La administración de rutina de hemoderivados como plasmas frescos congelados no se recomienda para la corrección de alteraciones en el panel de coagulación en ausencia de sangrado, y, por el contrario, puede impactar negativamente en el pronóstico, exacerbando el edema pulmonar y/o cerebral, y enmascarar los valores reales de INR y factor v. La indicación de transfusión de hemoderivados profiláctica es recomendada sólo previa a la realización de procedimientos invasivos y de acuerdo con los protocolos de cada centro. En general, se considera la administración de plaquetas para mantener niveles>50mil/mm3 o corrección de fibrinógeno a niveles mayores de 100mg/dL52.
InfeccionesLas infecciones en pacientes con FHA ocurren hasta en el 80% de los casos y son una causa significativa de mortalidad, por lo que se deben desarrollar estrategias para la prevención y el tratamiento oportuno. Se considera que hasta el 20% pueden cursar de manera concomitante con infecciones fúngicas, incrementando la morbimortalidad53. Las infecciones más frecuentes incluyen neumonía, infecciones del tracto urinario, asociadas a dispositivos intravenosos y bacteriemia. La sintomatología puede estar ausente y el deterioro de la función hepática y/o neurológica puede ser la única pista diagnóstica de infección. La búsqueda intencionada con cultivos e imágenes seriadas con un umbral bajo para el inicio de terapia empírica con antibióticos está recomendada54.
Nutrición y soporte metabólicoLas alteraciones metabólicas en la FHA son frecuentes, y el gasto energético está aumentado en un 18 a un 30% en comparación con individuos sanos. Es imperativo iniciar el soporte nutricional según el estado del paciente, prefiriendo la vía enteral como primera opción. Esto puede ser a través de la vía oral en pacientes con EH de bajo grado y que son cooperadores, o mediante sonda enteral en casos de EH de alto grado y ventilación mecánica invasiva. El aporte proteico aumentado no impacta la progresión de la EH, por lo que se recomienda una dosis de 1.0-1.5g/kg por día. La hipoglucemia, causada por la disminución de las reservas de glucógeno hepático, debe vigilarse activamente con glucometrías cada una a 2h. En caso de presentarse, se debe iniciar un aporte con infusión continua de dextrosa al 10% para mantener cifras de glucemia entre 150-180mg/dL. Por último, las deficiencias hidroelectrolíticas (fósforo, magnesio) deben monitorizarse y reponerse en caso de presentarse10.
Otras terapiasA pesar de los avances de soporte y manejo médico en los pacientes con falla hepática, persiste una alta morbimortalidad. Por lo anterior, se requiere de opciones de tratamiento que puedan ser una terapia puente para estos pacientes y preserven la función hepática mientras se encuentran en lista de espera para trasplante o cuando la opción del trasplante no es viable.
Ante estos escenarios se ha propuesto una nueva modalidad de tratamiento de soporte que es la terapia de intercambio plasmático (PLEX) de alto volumen. El primer estudio aleatorizado controlado describiendo la utilidad de esta terapia fue reportado en 2016 por Larsen et al.55. Los resultados mostraron que el tratamiento con PLEX de alto volumen mejora la supervivencia hospitalaria sin trasplante hepático en comparación con la terapia médica estándar (59 vs. 48%, respectivamente; p=0.0083), sin embargo, no se observó diferencia en la supervivencia sin trasplante de hígado durante la hospitalización (26 y 36%, respectivamente; p=0.17). Los autores reportaron una disminución significativa en los marcadores de respuesta inflamatoria sistémica y disfunción orgánica en el grupo tratado con PLEX. Estudios subsecuentes han respaldado la idea de que el PLEX puede tener efectos positivos en la modulación de la respuesta inflamatoria, la función orgánica, el flujo sanguíneo cerebral y la tasa metabólica cerebral de oxígeno en pacientes con FHA, lo que podría conducir a una mejoría en los resultados clínicos y una reducción de la morbimortalidad asociada con esta condición56,57. En general, existe información sobre el potencial beneficio del PLEX de alto volumen, no obstante, se necesitan más estudios para definir mejor su papel en el manejo de la FHA y en este momento no se puede recomendar de manera generalizada.
Determinación de gravedad y pronóstico en falla hepática agudaLa FHA es la más grave dentro de las enfermedades hepáticas. La tasa de mortalidad con tratamiento médico de soporte oscila alrededor del 60%, y su curso clínico suele ser insidioso, súbito e incierto. Desde la introducción del trasplante hepático ortotópico (THO) en el algoritmo de tratamiento, los resultados en la supervivencia global han mejorado. Sin embargo, los principales beneficios del THO en este grupo de pacientes están limitados por varios factores, como la gravedad de la enfermedad en el momento de la evaluación (daño cerebral irreversible o falla multiorgánica), así como la falta de disponibilidad de órganos en el momento oportuno58.
Los marcadores pronósticos tienen como objetivo permitir diferenciar a los pacientes con probabilidad de sobrevivir solo con terapia médica (sin la necesidad de THO) de aquellos con mal pronóstico en los que el THO no debería retrasarse. Las principales escalas para determinar la gravedad de la enfermedad son los criterios del King's College Hospital (KCC)59 y los criterios de Clichy-Villejuif60, entre otros61.
En la actualidad, la mayoría de los centros de trasplante usan los KCC (tabla 7), los cuales poseen una sensibilidad del 68-70%, una especificidad del 82-92% y un valor predictivo positivo del 80% en FHA por paracetamol y 70-90% para otras etiologías62.
Criterios actualizados del King's College Hospital
| Falla hepática aguda por paracetamol1. pH<7.3 por más de 24h posterior a la ingesta y a reanimación hídrica2. Todas las siguientes: INR>6.5 (TP>100s), Cr>3.4mg/dL (300μmol/L), EH grado 3/43. Daño hepático, coagulopatía y EH con:Lactato arterial>5mmol/L al ingresoLactato arterial>3.5mmol/L>24h posterior a reanimación hídricaExclusión de otras causas de hiperlactatemia4. Dos de los 3 criterios de la categoría 2, en ausencia de sepsis con evidencia de FMO |
| Falla hepática aguda no inducida por paracetamol1. Causas favorables (virales) con grado de EHINR>6.5 (TP>100s)Tres de los siguientes: INR> 3.5 (TP>50s), edad<10 o>40, bilirrubinas>300μmol/L (18mg/dL), tiempo de inicio de ictericia al inicio de encefalopatía>7 días2. Causas no favorables (indeterminadas, DHIF)INR>6.5 (TP>100s)Ausencia de EH: INR>3.5 y edad<10 o>40 añosPresencia de EH: bilirrubina>300μmol/L (18mg/dL), tiempo de inicio de ictericia al inicio de encefalopatía>7 días3. Presentación aguda de enfermedad de Wilson o síndrome de Budd-ChiariCombinación de cualquier grado de EH y coagulopatía |
Cr: creatinina; DHIF: daño hepático inducido por fármacos; EH: encefalopatía hepática; FMO: falla multiorgánica; INR: índice internacional normalizado; TP: tiempo de protrombina.
El puntaje pronóstico propuesto por el Grupo de Estudio de Falla Hepática Aguda –ALFSG index, por sus siglas en inglés– incluye el grado de EH, la etiología de la FHA, el uso de vasopresor, los niveles de bilirrubina total y el INR, siendo mejor predictor de SLT que el score de MELD y KCC63. Sin embargo, es importante señalar que la validación prospectiva de este modelo aún está pendiente.
Evaluación del trasplante hepático en falla hepática agudaLa FHA sin respuesta al tratamiento de soporte es una indicación clara para trasplante hepático. Actualmente es una entidad que representa entre el 4 y el 8% aproximadamente de todos los trasplantes de acuerdo con lo reportado por el Scientific Registry of Transplant Recipients y el European Liver Transplant Registry32,64.
La decisión de trasplante se debe realizar en un lapso no mayor a 3 días mediante la valoración de un equipo multidisciplinario, con la intención de evitar un deterioro clínico que contraindique realizarlo65. Como parte integral de la evaluación se debe llevar a cabo una imagen dinámica del hígado y las vías biliares, un ecocardiograma en las primeras 12 a 24h para confirmar la idoneidad del paciente para el trasplante y evaluar su estado cardiopulmonar. Los candidatos que cumplan con los criterios para el trasplante serán incluidos en la lista de prioridad, y en caso de un deterioro clínico significativo o mejoría notable, se considerará su retirada de la lista de trasplante66.
En el 2020 la United Network for Organ Sharing adoptó un nuevo sistema de priorización de pacientes con FHA para catalogar a aquellos con alta mortalidad a corto plazo, situándolos en prioridad 1A (tabla 8)67.
Criterios para prioridad 1A en lista de trasplante (UNOS)
| Pacientes con falla hepática agudaPresencia de EH dentro de los 56 primeros días desde el inicio de síntomasAdmisión a unidad de cuidados intensivosNo enfermedad hepática crónica preexistentePresencia de cualquiera de los siguientes:Ventilación mecánicaTerapia continua de reemplazo renalINR≥2 |
| Pacientes con trasplante hepático recienteDisfunción primaria del injerto o trombosis de la arteria hepática dentro de los primeros 7 días postrasplante con AST>3,000U/L y algún parámetro de los siguientes:pH arterial≤7.3pH venoso≤7.5INR≥2.5Lactato≥4mmol/L |
AST: aspartato aminotransferasa; EH: encefalopatía hepática; INR: índice internacional normalizado; UNOS: United Network for Organ Sharing.
En México, los criterios propuestos por el Centro Nacional de Trasplantes son la base para ingresar a un paciente con FHA. Estos consideran: a) no evidencia de enfermedad hepática previa; b) pacientes en unidad de cuidados intensivos con las siguientes condiciones: deterioro neurológico con cualquier grado de EH<8 semanas de evolución, INR≥2 y requerimiento de terapia de reemplazo renal, y c) se puede apoyar en los criterios del King's College Hospital o Clichy-Villejuif.
Los pacientes que son registrados en lista de espera de trasplante hepático pueden ser retirados a causa de mejoría clínica con resolución espontánea, o por deterioro y presencia de contraindicación para el trasplante. Las contraindicaciones relevantes a tener en cuenta se pueden clasificar en 3 categorías principales. Primero, las contraindicaciones médicas y los factores de mal pronóstico, que incluyen la presencia de malignidad activa, infección por VIH/sida, insuficiencia cardiaca con fracción de eyección del ventrículo izquierdo reducida, dependencia de soporte ventilatorio con una fracción inspirada de oxígeno mayor del 90%, presión positiva al final de la espiración elevada, síndrome de insuficiencia respiratoria aguda y acidosis concomitante, inestabilidad hemodinámica que requiera el uso de más de 2 vasopresores, sepsis no controlada y confirmación de infección fúngica invasiva. Segundo, la presencia de daño neurológico irreversible, como herniación encefálica y hemorragia intracraneal severa. Finalmente, la existencia de barreras psicosociales, como la falta de red de apoyo y soporte social, trastorno de abuso de sustancias no controlado y una baja probabilidad de adherencia al seguimiento médico y al tratamiento farmacológico67. Todas ellas se clasifican mayoritariamente como contraindicaciones relativas, con excepción del daño neurológico irreversible, que constituye una contraindicación absoluta.
Factores éticos y psicosocialesLa valoración psicológica y del entorno social puede resultar un reto por el deterioro neurológico que desarrollan los pacientes, principalmente ante la presencia de EH avanzada. Es importante indagar la aceptación del trasplante, la red de apoyo familiar, la evaluación de recursos y el posible apego al tratamiento inmunosupresor. La etiología de la FHA puede conllevar estigmas sociales tales como el intento suicida o el consumo de drogas intravenosas, que requieren de evaluaciones precisas en términos de justicia y equidad.
Supervivencia de falla hepática aguda posterior a trasplanteLa supervivencia reportada en Europa y Estados Unidos va del 79 al 84% en el primer año postrasplante, es del 75% a los 5 años y del 72% a 10 años. Los factores que se han identificado como predictores de mortalidad posterior a trasplante por FHA son el sexo masculino, donador mayor de 60 años, receptor mayor de 50 años, incompatibilidad de ABO y tamaño reducido del injerto32,61. Las causas más frecuentes de mortalidad en este periodo son infecciones (fúngicas principalmente), complicaciones neurológicas y falla orgánica múltiple68. Además, aquellos pacientes que durante el tiempo en lista de espera requirieron mayores medidas de soporte (ventilación mecánica, uso de vasopresores, trasfusión de hemoderivados, y mayor número de intervenciones médicas y farmacológicas por complicaciones neurológicas) presentan una peor sobrevida11,19.
ConclusionesEs esencial detectar de manera oportuna a los pacientes con FHA, ya que el inicio temprano del tratamiento y la referencia apropiada a un centro de trasplantes pueden mejorar significativamente la supervivencia. La FHA se presenta como una entidad poco común, siendo la IPC la causa principal en países desarrollados, mientras que en países de ingresos medios-bajos las principales causas son las hepatitis virales agudas, sobre todo por virus de la hepatitis A y E, y la indeterminada. Se ha observado un aumento en la supervivencia sin necesidad de trasplante, independientemente de su presentación con o sin lesión renal aguda, mediante el empleo de TCRR. Es crucial optimizar el manejo médico de soporte en áreas de terapia intensiva, llevar a cabo una monitorización continua e identificar rápidamente las complicaciones de la FHA, en especial el edema cerebral, las infecciones y la coagulopatía. En la evaluación inicial, se deben considerar las escalas pronósticas de supervivencia sin necesidad de trasplante para identificar a los pacientes que deben iniciar valoración para un trasplante hepático. En general, la supervivencia a largo plazo de los receptores de trasplante por FHA muestra resultados favorables.
Consideraciones éticasEste artículo se basa en una revisión bibliográfica exhaustiva y, por lo tanto, no involucra la participación directa de pacientes ni la necesidad de la aprobación de un comité de ética institucional. Es importante destacar que no se han utilizado datos personales identificables en este trabajo, y hemos tomado medidas para proteger la privacidad de cualquier información que pudiera haber sido utilizada en la revisión bibliográfica.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.