Bacterias enteropatógenas aisladas en la Ciudad de México han mostrado una alta tasa de resistencia a diversos antibióticos, con excepción de la rifaximina (RIF). La RIF es un antibiótico no absorbible que alcanza altas concentraciones fecales (≈ 8,000μg/g). La susceptibilidad a los antimicrobianos puede variar en distintas regiones geográficas.
ObjetivoInvestigar la susceptibilidad a rifaximina y otros antimicrobianos de bacterias enteropatógenas aisladas de pacientes con diarrea aguda en el sureste de México.
Material y métodosSe analizaron 614 cepas de bacterias aisladas de pacientes con diarrea aguda de 4 ciudades del sureste del México. Se realizó antibiograma con: ampicilina (AMP), trimetoprim/sulfametoxazol (T-S), neomicina (NEO), furazolidona (FUR), ciprofloxacino (CIP), cloranfenicol (CLO) y fosfomicina (FOS) por difusión en agar a las concentraciones estándar recomendadas por CLSI y ASM y RIF en 4 concentraciones por microdilución.
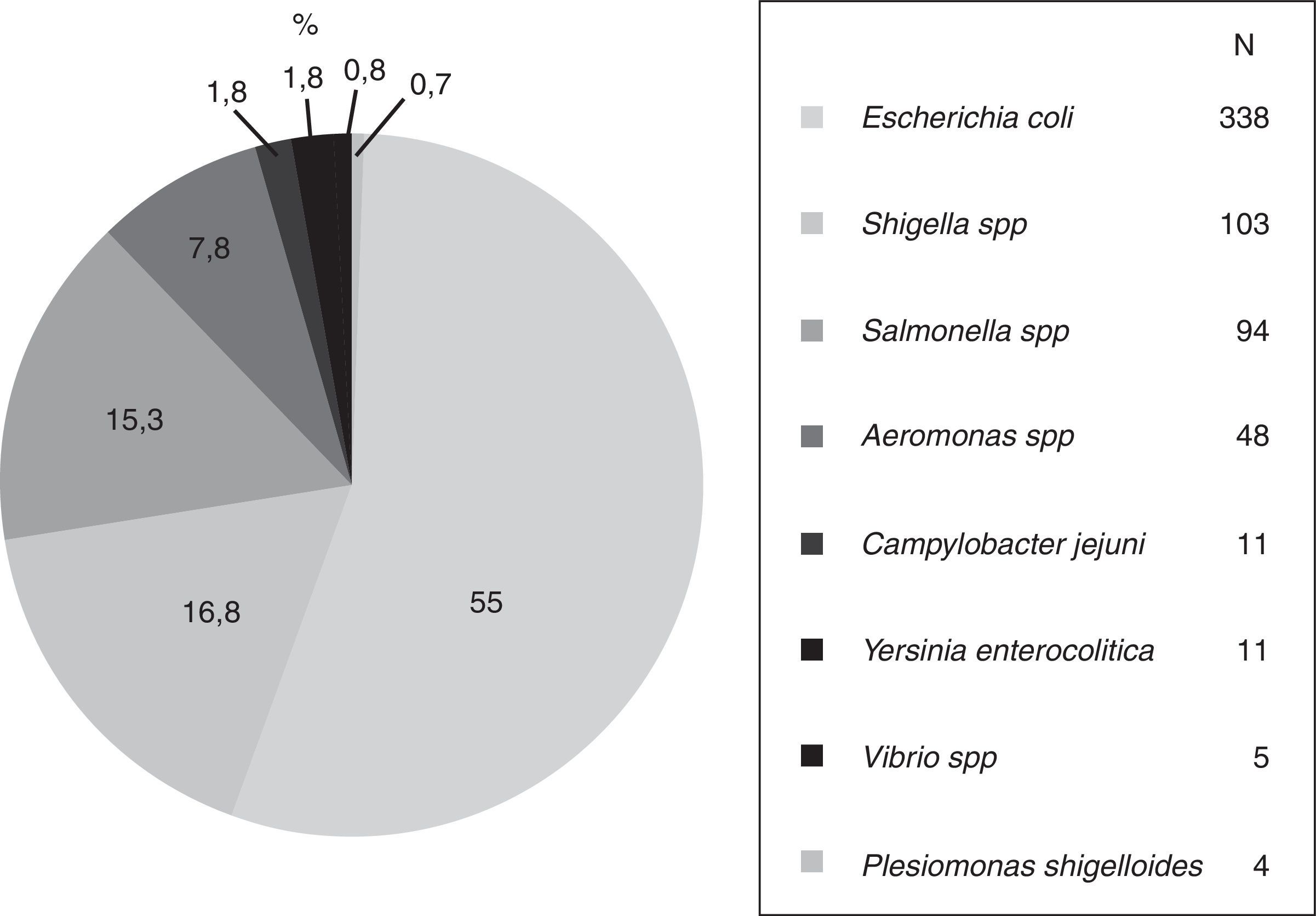
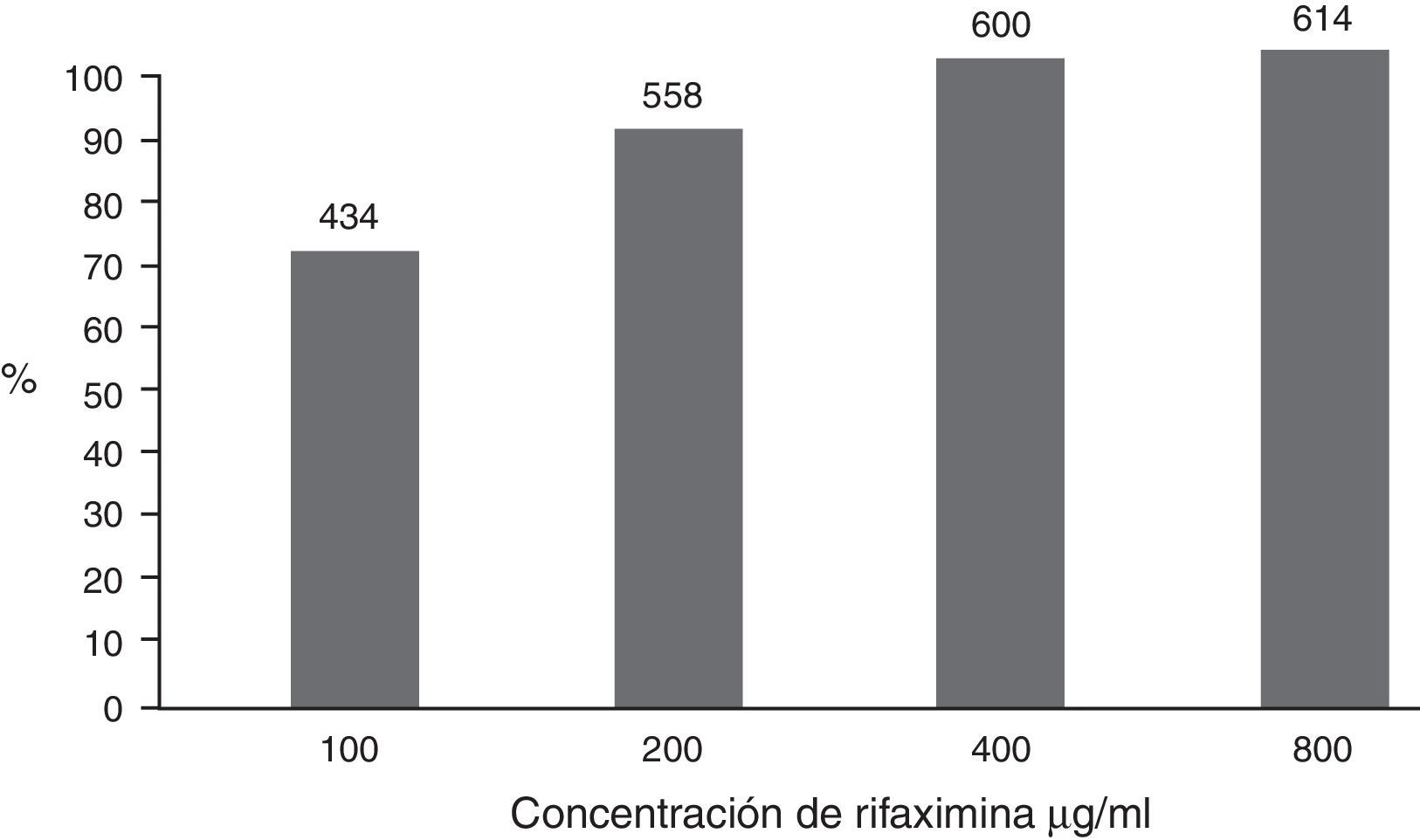
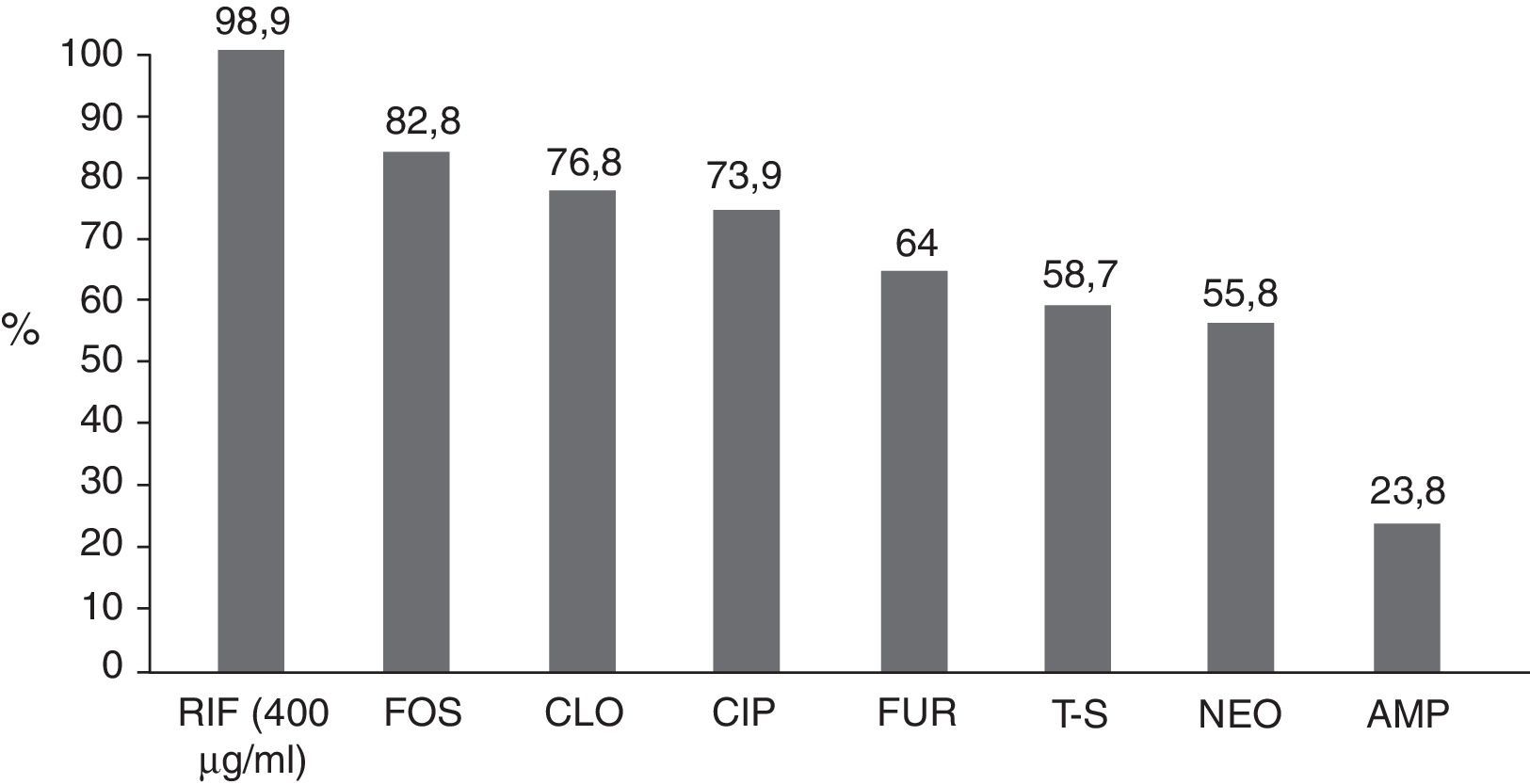
ResultadosLa mayoría de las bacterias fueron Escherichia coli (55%) en todas sus variantes patógenas, Shigella (16.8%), Salmonella (15.3%), Aeromonas (7.8%) y menos de 5% Campylobacter, Yersinia, Vibrio y Plesiomonas. La susceptibilidad global acumulada a RIF fue del 69.1, el 90.8, el 98.9 y el 100% a las concentraciones de 100, 200, 400 y 800μg/ml, respectivamente. La susceptibilidad global a los otros antibióticos fue: FOS 82.8%, CLO 76.8%, CIP 73.9%, FUR 64%, T-S 58.7%, NEO 55.8% y AMP 23.8%. La susceptibilidad a RIF 400 y 800μg fue significativamente mayor que con los otros antimicrobianos (p<0.001).
ConclusionesSe encontraron datos similares a los de un estudio previo realizado en la Ciudad de México: susceptibilidad a RIF en>98% de las cepas bacterianas y alta frecuencia de resistencia a varios antimicrobianos comunes.
Enteropathogenic bacteria isolated in Mexico City have shown a high rate of resistance to different antibiotics, with the exception of rifaximin (RIF). RIF is a nonabsorbable antibiotic that reaches high fecal concentrations (≈ 8,000μg/g). Susceptibility to antimicrobials can vary in different geographic regions.
AimTo study the susceptibility to rifaximin and other antimicrobials of enteropathogenic bacteria isolated in patients with acute diarrhea in the southeastern region of Mexico.
Material and methodsA total of 614 strains of bacteria isolated from patients with acute diarrhea from 4 cities in Southeast Mexico were analyzed. An antibiogram with the following antibiotics was created: ampicillin (AMP), trimethoprim/sulfamethoxazole (T-S), neomycin (NEO), furazolidone (FUR), ciprofloxacin (CIP), chloramphenicol (CHL), and fosfomycin (FOS), assessed through the agar diffusion method at the standard concentrations recommended by the Clinical and Laboratory Standards Institute (CLSI) and the American Society for Microbiology (ASM), and RIF, assessed through microdilution at 4 concentrations.
ResultsThe bacteria were Escherichia coli (55%), as the majority, in all its pathogenic variants, Shigella (16.8%), Salmonella (15.3%), Aeromonas (7.8%), and less than 5% Campylobacter, Yersinia, Vibrio, and Plesiomonas. The accumulated overall susceptibility to RIF was 69.1, 90.8, 98.9, and 100% at concentrations of 100, 200, 400, and 800μg/ml, respectively. Overall susceptibility to other antibiotics was FOS 82.8%, CHL 76.8%, CIP 73.9%, FUR 64%, T-S 58.7%, NEO 55.8%, and AMP 23.8%. Susceptibility to RIF at 400 and 800μg was significantly greater than with the other antimicrobials (P<.001).
ConclusionsThe data of the present study were similar to those of a previous study carried out in Mexico City: susceptibility to RIF in > 98% of the bacterial strains and a high frequency of resistance to several common antimicrobials.
En el mundo se calcula que cada año hay 2 billones de casos de enfermedad diarreica aguda. Esta es la segunda causa de mortalidad infantil, solo precedida por la neumonía. En las últimas décadas la utilización extendida de las soluciones de rehidratación oral, así como la mejoría de las condiciones sanitarias, han derivado en un notable descenso en la mortalidad por esta causa. Sin embargo, en los niños sigue siendo una de las principales causas de enfermedad y de mortalidad en los países en desarrollo. En estos, los niños menores de 5 años presentan en promedio 3 episodios diarreicos anuales1. Las infecciones contribuyen a la malnutrición infantil, ya que cada episodio reduce los nutrientes necesarios para el crecimiento y desarrollo; en nuestro país, existen evidencias de que hasta el 17.8% de los niños con cuadros diarreicos frecuentes muestran datos clínicos de malnutrición2.
La etiología de la enfermedad diarreica es múltiple, en los países en desarrollo es fundamentalmente de origen infeccioso por bacterias y parásitos, como consecuencia de la exposición a alimentos y agua contaminados. En México, la enfermedad diarreica aguda ocupa el quinto lugar como causa de muerte en niños de 1 a 4 años y en algunas zonas geográficas del país, principalmente del sureste (Chiapas, Tabasco y Yucatán), la frecuencia es hasta del 16% mayor que la de los estados del norte del país3,4.
Determinar la etiología basándose exclusivamente en datos clínicos es difícil, pero en los menores de 5 años de edad frecuentemente se debe a una infección viral, mientras que en los niños mayores y en los adultos la infección bacteriana es frecuente5. Establecer el diagnóstico etiológico permite proporcionar un tratamiento que ayude a disminuir la sintomatología, acorte la enfermedad, evite complicaciones y reduzca la diseminación de agentes patógenos en la población. Sin embargo, en la inmensa mayoría de los casos la terapia antimicrobiana es empírica, por lo que es necesario realizar estudios de vigilancia epidemiológica de los organismos causales y de susceptibilidad antimicrobiana que tomen en cuenta los patrones locales o regionales. En un estudio previo6 reportamos los patrones de susceptibilidad antimicrobiana de los microorganismos causantes de diarrea aguda en 1,000 pacientes, niños y adultos, de la Ciudad de México. En esa investigación se demostró una alta frecuencia de resistencia bacteriana a los antimicrobianos comunes, mientras que se observó una excelente actividad antibacteriana de la rifaximina (RIF). Este es un antibiótico no absorbible, bactericida de amplio espectro, que alcanza elevadas concentraciones en la luz intestinal7. Una de las limitaciones de ese estudio fue que solamente abarcó la Ciudad de México. Dada la elevada prevalencia de síndromes diarreicos reportada en otras zonas del país, como el sureste, se decidió realizar un estudio similar al anterior en las bacterias aisladas de pacientes con síndrome diarreico agudo en 4 ciudades del sureste de México.
Material y métodosAislamientos bacterianosSe analizaron 614 cepas bacterianas aisladas en la materia fecal del mismo número de pacientes de ambos sexos y todas las edades con diagnóstico clínico de síndrome diarreico agudo, de muestras provenientes de 4 laboratorios privados de las ciudades de Veracruz, Veracruz (153 casos), Villahermosa, Tabasco (160 casos), Mérida, Yucatán (151 casos) y Tuxtla Gutiérrez, Chiapas (150 casos). Las cepas fueron conservadas en caldo leche y caldo soya glicerol, congeladas a –70°C antes de la identificación bioquímica, serológica y de susceptibilidad antimicrobiana. En los aislamientos iniciales de las muestras que se realizaron en cada laboratorio particular se utilizaron los medios de cultivo: agar MacConkey, agar MacConkey-sorbitol, agar Shigella-Salmonella, agar XLD, agar Campylobacter, agar Yersinia, agar TCBS, agar verde brillante y caldo tetrationato.
Los aislamientos fueron identificados bioquímicamente en cada laboratorio utilizando procesos y sistemas manuales y automatizados; Autoscan 4, Walkaway/ (Micros Scan) o VITEK 2, con una probabilidad de aceptación mayor al 95% en su identificación. La tipificación y la identificación serológica en los casos en que procedió en determinadas especies bacterianas, como Escherichia coli (E. coli), Salmonella y Shigella, esta se llevó a cabo utilizando antisueros y reactivos de aglutinación o conglutinación específicos de diferentes marcas comerciales.
Pruebas de susceptibilidad a antimicrobianosPara las pruebas de susceptibilidad antimicrobiana se utilizaron difusión en agar y dilución en placa siguiendo los procedimientos establecidos por la Sociedad Americana de Microbiología y el Instituto de Estándares para Laboratorios Clínicos de los Estados Unidos de América (CLSI)8,9, con las siguientes concentraciones de antibióticos: ampicilina (AMP) 10μg/ml, cloranfenicol (CLO) 30μg/ml, ciprofloxacino (CIP) 50μg/ml, fosfomicina (FOS) 50μg/ml, furazolidona (FUR) 100μg/ml, trimetoprim/sulfametoxazol (T-S) 1.25/23.75μg/ml y neomicina (NEO) 30μg/ml. La RIF se probó con 4 diferentes concentraciones: 100, 200, 400 y 800μg/ml. Las cepas que no fueron susceptibles con una concentración menor fueron probadas sucesivamente con las concentraciones mayores. La concentración inhibitoria mínima a la cual se inhibe el 90% de las cepas (MIC90) se consideró con respecto a todos los antibióticos, pero se consideró la MIC100 en relación a RIF.
Análisis estadísticoLa susceptibilidad de las bacterias a RIF se comparó con la de los otros antimicrobianos con la prueba Z, se consideró significativa p<0.05. La misma prueba se utilizó para comparar estos resultados con los de la Ciudad de México previamente publicados. El software estadístico empleado fue Estadística 8.0 y Stata 11.
ResultadosSe analizaron 614 aislamientos bacterianos provenientes de coprocultivos de 308 individuos del sexo masculino (50.1%) y 306 del femenino (49.9%), la mayoría fueron adolescentes y adultos jóvenes (65.9%), el 0.9% fueron menores de 10 años y el 3.7% mayores de 70 años, el 91% eran muestras de pacientes ambulatorios y el 9% de sujetos hospitalizados.
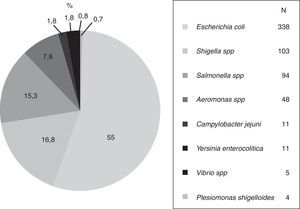
Bacterias. Más de la mitad de los aislamientos se identificó como algún serotipo de E. coli «diarreagénica», un tercio fueron especies de los géneros Shigella y Salmonella, seguidas por Aeromonas, Campylobacter, Yersinia, Vibrio y Plesiomonas, en ese orden (fig. 1).
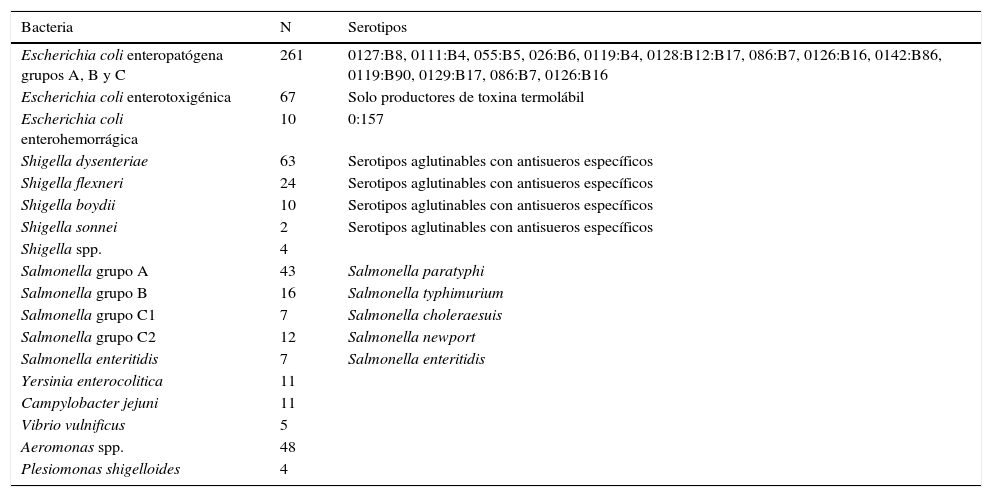
Tres cuartas partes de las E. coli (77%) correspondieron a serotipos de E. coli enteropatógena (EPEC), muy pocas fueron E. coli enterohemorrágica O:157. La mayoría de Shigella fueron dysenteriae y flexneri, mientras que Salmonella paratyphi fue la especie más frecuente de ese género. El número y proporción de otros géneros, especies y serotipos se anotan en la tabla 1.
Bacterias aisladas en 614 pacientes con gastroenteritis aguda y sus serotipos
| Bacteria | N | Serotipos |
|---|---|---|
| Escherichia coli enteropatógena grupos A, B y C | 261 | 0127:B8, 0111:B4, 055:B5, 026:B6, 0119:B4, 0128:B12:B17, 086:B7, 0126:B16, 0142:B86, 0119:B90, 0129:B17, 086:B7, 0126:B16 |
| Escherichia coli enterotoxigénica | 67 | Solo productores de toxina termolábil |
| Escherichia coli enterohemorrágica | 10 | 0:157 |
| Shigella dysenteriae | 63 | Serotipos aglutinables con antisueros específicos |
| Shigella flexneri | 24 | Serotipos aglutinables con antisueros específicos |
| Shigella boydii | 10 | Serotipos aglutinables con antisueros específicos |
| Shigella sonnei | 2 | Serotipos aglutinables con antisueros específicos |
| Shigella spp. | 4 | |
| Salmonella grupo A | 43 | Salmonella paratyphi |
| Salmonella grupo B | 16 | Salmonella typhimurium |
| Salmonella grupo C1 | 7 | Salmonella choleraesuis |
| Salmonella grupo C2 | 12 | Salmonella newport |
| Salmonella enteritidis | 7 | Salmonella enteritidis |
| Yersinia enterocolitica | 11 | |
| Campylobacter jejuni | 11 | |
| Vibrio vulnificus | 5 | |
| Aeromonas spp. | 48 | |
| Plesiomonas shigelloides | 4 |
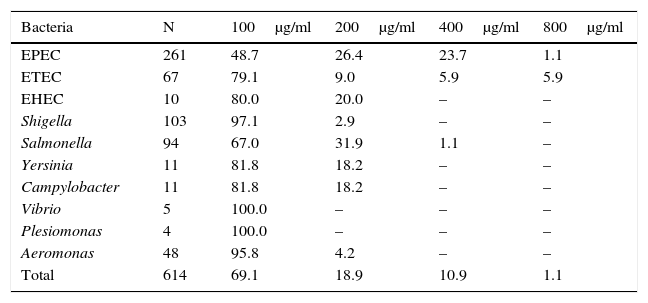
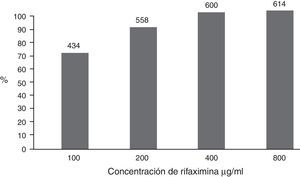
Susceptibilidad a los antimicrobianos. En forma global, el 69.1% de las bacterias fueron susceptibles a RIF a concentración de 100μg/ml; el 90.8% fueron susceptibles a 200μg/ml y casi todas a concentraciones mayores (fig. 2). Las especies bacterianas que requirieron más frecuentemente mayores concentraciones de RIF fueron E. coli y Salmonella (tabla 2).
La susceptibilidad global de las 614 bacterias a las concentraciones de rifaximina de 100, 200, 400 y 800μg/ml fue, en forma acumulada, del 69.1, el 90.8, el 98.9 y el 100%, respectivamente. Las bacterias que no fueron susceptibles a 100μg/ml se probaron sucesivamente a las concentraciones mayores; el número de bacterias se anota encima de las columnas.
Susceptibilidad bacteriana a diferentes concentraciones de rifaximina
| Bacteria | N | 100μg/ml | 200μg/ml | 400μg/ml | 800μg/ml |
|---|---|---|---|---|---|
| EPEC | 261 | 48.7 | 26.4 | 23.7 | 1.1 |
| ETEC | 67 | 79.1 | 9.0 | 5.9 | 5.9 |
| EHEC | 10 | 80.0 | 20.0 | – | – |
| Shigella | 103 | 97.1 | 2.9 | – | – |
| Salmonella | 94 | 67.0 | 31.9 | 1.1 | – |
| Yersinia | 11 | 81.8 | 18.2 | – | – |
| Campylobacter | 11 | 81.8 | 18.2 | – | – |
| Vibrio | 5 | 100.0 | – | – | – |
| Plesiomonas | 4 | 100.0 | – | – | – |
| Aeromonas | 48 | 95.8 | 4.2 | – | – |
| Total | 614 | 69.1 | 18.9 | 10.9 | 1.1 |
Resultados expresados en porcentaje de las bacterias susceptibles.
EPEC: Escherichia coli enteropatógena; EHEC: Escherichia coli enterohemorrágica; ETEC: Escherichia coli enterotoxigénica.
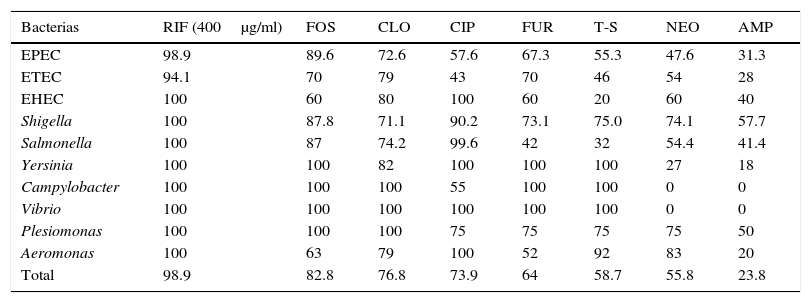
La susceptibilidad de las distintas bacterias a los antibióticos probados se anota en la tabla 3. Las bacterias que fueron susceptibles en ≥ 75% de las veces fueron: EPEC solo a RIF y FOS, E. coli enterotoxigénica a RIF y CLO, E. coli enterohemorrágica a RIF, CIP y CLO, Shigella a RIF, CIP y FOS, Salmonella a RIF, CIP, FOS y muy cerca CLO, Aeromonas a la mayoría, excepto AMP, FUR y FOS. Las siguientes fueron susceptibles a casi todos los antimicrobianos: Yersinia excepto NEO y AMP, Campylobacter excepto CIP y T-S, Vibrio excepto NEO y AMP, Plesiomonas excepto AMP. AMP solo mostró buena actividad contra Campylobacter.
Susceptibilidad de las bacterias aisladas a los antimicrobianos probados
| Bacterias | RIF (400μg/ml) | FOS | CLO | CIP | FUR | T-S | NEO | AMP |
|---|---|---|---|---|---|---|---|---|
| EPEC | 98.9 | 89.6 | 72.6 | 57.6 | 67.3 | 55.3 | 47.6 | 31.3 |
| ETEC | 94.1 | 70 | 79 | 43 | 70 | 46 | 54 | 28 |
| EHEC | 100 | 60 | 80 | 100 | 60 | 20 | 60 | 40 |
| Shigella | 100 | 87.8 | 71.1 | 90.2 | 73.1 | 75.0 | 74.1 | 57.7 |
| Salmonella | 100 | 87 | 74.2 | 99.6 | 42 | 32 | 54.4 | 41.4 |
| Yersinia | 100 | 100 | 82 | 100 | 100 | 100 | 27 | 18 |
| Campylobacter | 100 | 100 | 100 | 55 | 100 | 100 | 0 | 0 |
| Vibrio | 100 | 100 | 100 | 100 | 100 | 100 | 0 | 0 |
| Plesiomonas | 100 | 100 | 100 | 75 | 75 | 75 | 75 | 50 |
| Aeromonas | 100 | 63 | 79 | 100 | 52 | 92 | 83 | 20 |
| Total | 98.9 | 82.8 | 76.8 | 73.9 | 64 | 58.7 | 55.8 | 23.8 |
Resultados expresados como porcentaje de bacterias susceptibles.
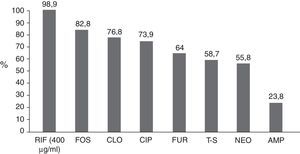
En forma global, la susceptibilidad de las 614 cepas bacterianas a los antibióticos probados (fig. 3) muestra que más de 3 cuartas partes de los casos fueron resistentes a AMP y casi la mitad a T-S y NEO. La resistencia a FUR ocurrió en el 36% y a CIP en el 26%, mientras que la mayoría de las bacterias fueron susceptibles a CLO (77%), FOS (83%) y RIF a 400μg/ml (98.9%). La proporción acumulada de cepas susceptibles a RIF<400 y<800 fue significativamente mayor que a los otros antimicrobianos (p<0.001).
Susceptibilidad global de las bacterias a los antibióticos probados. Sobre las columnas se anota el porcentaje de cada antimicrobiano.AMP: ampicilina; CIP: ciprofloxacino; CLO; cloranfenicol; FOS: fosfomicina; FUR: furazolidona; NEO: neomicina; RIF: rifaximina (concentración 400μg/ml); T-S: trimetoprim/sulfametoxazol.
La susceptibilidad significa que el crecimiento de una determinada bacteria es inhibido a la concentración del antibiótico que se alcanza en el sitio de la infección con la dosis recomendada; frecuentemente son las concentraciones séricas. Las concentraciones para decidir si una bacteria es susceptible o resistente se han definido y publicado9; estas son las que se emplearon en este estudio, con excepción de la RIF. No se ha establecido la concentración de RIF para definir la susceptibilidad, sin embargo, en otras investigaciones se han utilizado como puntos de corte 32, 128 y 256μg/ml10-12. La RIF es un antibiótico que por ser no absorbible alcanza muy altas concentraciones en la luz intestinal. Con la dosis de RIF recomendada para el tratamiento de infecciones gastrointestinales agudas (800mg diarios durante 3 días) se han informado concentraciones fecales del antibiótico de hasta 8,000μg/g en promedio13. Por tal motivo, en este estudio utilizamos concentraciones mayores a las informadas por otros autores, hasta de 400 y 800μg/ml, que tienen más significado clínico, aun siendo 10 a 20 veces menores que las concentraciones medias encontradas en las heces.
Los hallazgos de este estudio realizado en cultivos de heces de pacientes con cuadros de diarrea aguda en 4 ciudades del sureste de la República Mexicana confirman los datos del estudio previo llevado a cabo con la misma metodología en coprocultivos de 1,000 pacientes con gastroenteritis aguda de la Ciudad de México6. Los géneros y las especies de las bacterias aisladas fueron similares en los 2 estudios, solo con mayor proporción de Shigella en la muestra actual (16.1 vs. 12.0% del estudio previo), diferencia que fue estadísticamente significativa (Z=2.27, p<0.05). En ambas investigaciones se observó una baja frecuencia de bacterias patógenas gastrointestinales susceptibles a AMP, NEO, T-S y FUR, susceptibilidad más frecuente a CIP y CLO, y elevados porcentajes de susceptibilidad a FOS y RIF.
El tratamiento con antimicrobianos de las infecciones bacterianas es útil para reducir los síntomas, acortar la enfermedad y disminuir la transmisión de la bacteria patógena, pero el uso diseminado de los antimicrobianos favorece la aparición de cepas resistentes y la transmisión de la resistencia a otras bacterias14. La aparición de cepas de E. coli y otras enterobacterias productoras de betalactamasa de espectro extendido se ha convertido en un problema terapéutico que puede transmitirse de un país a otro15. Es más, en muchos casos los antimicrobianos no están indicados, como en las infecciones virales respiratorias o gastrointestinales, o se utilizan en dosis o duración insuficientes, como en la automedicación. La creciente resistencia bacteriana es un problema de salud, especialmente en los casos severos. En otras regiones del mundo también se ha demostrado un aumento en la resistencia bacteriana en muchas infecciones, incluyendo las gastrointestinales16.
Este estudio y el de la Ciudad de México coinciden en señalar una alta frecuencia de resistencia bacteriana a los antimicrobianos que en nuestro país se han utilizado frecuentemente para diversas infecciones, como AMP y T-S, y también las que se han utilizado libremente en los casos de diarrea aguda, como NEO y FUR. La resistencia a CIP, un antibiótico que «solo» tiene poco más de 30 años de uso es creciente. El CLO es un viejo antibiótico que se utilizó ampliamente durante años; sin embargo, debido a la toxicidad sobre la médula ósea, desde hace algunas décadas se prescribe casi exclusivamente en algunos casos de fiebre tifoidea; la frecuencia de bacterias susceptibles a CLO rebasó un 75% en este estudio. FOS es un antibiótico de amplio espectro que se indica principalmente para infecciones urinarias17. En cambio, casi todas las cepas bacterianas fueron susceptibles a la RIF. La poca frecuencia de resistencia bacteriana a la RIF también se ha documentado en las bacterias asociadas con diarrea del viajero provenientes de Latinoamérica y de Asia10-12,18.
Hay varias razones que apoyan o explican la baja resistencia de las bacterias enteropatógenas a la RIF: a) las bacterias que desarrollan resistencia a RIF desaparecen espontáneamente de las heces en pocas semanas19; b) en una investigación los niveles de MIC90 para RIF para bacterias patógenas intestinales no variaron en respecto a las bacterias aisladas 10 años antes11; c) experimentos muestran que la resistencia a RIF no se induce fácilmente20; d) cuando aparece resistencia, es por cambios cromosómicos más que mediada por plásmidos, por lo que no se transmite fácilmente a otras bacterias7; e) cuando se inducen plásmidos resistentes por concentraciones subinhibitorias, la RIF «cura» los plásmidos e inhibe la transmisión de plásmidos resistentes, disminuye la viabilidad de las bacterias y su virulencia aun cuando hayan desarrollado resistencia21, y f) en México se encuentra disponible hace menos de 20 años, aunque en países europeos se usa hace aproximadamente 40 años, sin informes de resistencia importante.
La RIF se ha utilizado exitosamente en la gastroenteritis aguda en niños y adultos, incluyendo ancianos22,23, en la diarrea del viajero24,25 y asociada a otros antimicrobianos en la diarrea recurrente asociada a Clostridium difficile26. Es interesante que en un estudio en niños con diarrea aguda en los que la RIF acortó significativamente la duración de la diarrea, en la mitad de los casos no se demostrara la etiología en los exámenes de las heces22. En forma similar, en 2 investigaciones de pacientes con diarrea del viajero, tampoco se demostró la etiología en aproximadamente la tercera parte de los casos. Estos pacientes con diarrea «patógeno-negativa» fueron analizados en forma separada y se demostró que la RIF acortó a la mitad la duración de la diarrea también en ellos27. Aunque podría invocarse la imperfección de los métodos diagnósticos, también pueden estar involucradas otras acciones de RIF que se enlistan en la tabla 428-32.
Acciones de rifaximina, adicionales al efecto bactericida
| ↑ Población de Lactobacilli ↓ Adherencia bacteriana a células epiteliales, ↓ internalización ↓ Translocación bacteriana Activación de receptor pregnano X (↓ de NF-kB) ↓ Expresión intestinal de citocinas proinflamatorias ↓ Endotoxemia en pacientes cirróticos ↓ Producción de ureasa por enterobacterias y ↓ exotoxinas y factores de virulencia en concentraciones subinhibitorias |
Cuando el tratamiento es empírico, la resistencia bacteriana a los antibióticos dificulta escoger el antibiótico útil y obtener la adecuada respuesta terapéutica. Según los datos de este estudio, si el médico considera indicar un tratamiento empírico con un antibiótico no absorbible, RIF estaría mejor indicada que NEO. En caso de sospechar una infección gastrointestinal con una bacteria invasora (con fiebre elevada o diarrea con sangre), CIP estaría mejor indicada que FUR. AMP y T-S no serían una buena elección en ningún caso. Además, T-S es el antimicrobiano con mayor frecuencia de efectos adversos33.
En esta investigación no se separaron los datos de la frecuencia de bacterias según los grupos de edad, ni la resistencia bacteriana en muestras de adultos y niños, ya que solo una pequeña proporción de las muestras provenían de menores de 10 años de edad. Sin embargo, en forma conjunta con el estudio previo, este aspecto será sujeto de un subanálisis en la población pediátrica.
Las guías mexicanas de práctica clínica de diagnóstico y tratamiento de la diarrea aguda en pediatría, con un espíritu eminentemente epidemiológico para prevenir resistencias bacterianas, sugieren no utilizar inicialmente antimicrobianos, a menos que existan datos clínicos que indiquen sepsis, que se demuestre una bacteria patógena en coprocultivo o con objeto de evitar la diseminación si la diarrea ocurre en una guardería. Esta guía toma en cuenta la alta frecuencia de diarrea de origen viral en los lactantes y preescolares y que, en caso de etiología bacteriana, la diarrea cura en 7 o 14 días aún sin antimicrobianos34. En los adultos, se recomienda el uso de antimicrobianos si la diarrea persiste después de 24 a 48 h, si es grave o si el agente patógeno se ha identificado35. Otras medidas pueden contribuir a prevenir resistencias bacterianas a los antibióticos, como reforzar la educación médica en terapia antimicrobiana, evitar la libre venta de antibióticos, suprimir la utilización indiscriminada de antibióticos en el ganado y determinar periódicamente estudios de susceptibilidad a los antimicrobianos, la vigilancia epidemiológica es clave36,37.
El tratamiento con antimicrobianos puede ser una valiosa herramienta en el control de las infecciones gastrointestinales, reduce la duración e intensidad de la enfermedad, previene complicaciones que pueden ser graves y puede disminuir su transmisión. La determinación periódica de los patrones locales, nacionales y mundiales de susceptibilidad antimicrobiana puede contribuir a un uso más racional de la terapia antimicrobiana. La situación epidemiológica puede diferir de una región a otra, sobre todo en un país de grandes dimensiones, como es México. Por ejemplo, la frecuencia de Shigella fue mayor en el sureste que en la ciudad de México. Por lo tanto, puede ser interesante evaluar otras regiones, distantes del centro del país.
En conclusión, en este estudio se encontraron datos similares a los del estudio previo realizado en pacientes con gastroenteritis aguda de la Ciudad de México: susceptibilidad a RIF en más del 98% de las cepas de bacterias enteropatógenas y una alta frecuencia de resistencia en los antimicrobianos más comúnmente utilizados, como AMP, T-S, NEO y FUR.
Limitaciones del estudio. Este no es un estudio epidemiológico de las causas de gastroenteritis aguda, de modo que no puede determinarse con estos datos la frecuencia de diarrea bacteriana en el total de causas de diarrea aguda. Aunque no está diseñado para investigar la prevalencia de las distintas bacterias causantes de gastroenteritis aguda, las bacterias incluidas en este estudio dependen de la frecuencia con la que los laboratorios de estas ciudades las detectan y, en cierta forma, reflejan la prevalencia local.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLa investigación fue financiada por Alfa Wassermann S.A. de C.V.
Conflicto de interesesAlberto C. Frati es actualmente director médico de Alfa Wassermann S.A. de C.V., distribuidor de rifaximina en México; participó en la planeación del proyecto y en la revisión del manuscrito, pero no intervino en ninguna fase de la realización del estudio, de la enumeración de resultados ni en el análisis estadístico. Los demás autores declaran no tener conflictos de interés.