La primera guía clínica sobre la encefalopatía hepática se publicó en el año 2009, a casi 14 años de esta primera publicación, numerosos avances en el campo del diagnóstico, tratamiento y cuidados en condiciones especiales, han ocurrido; por ello, a iniciativa de la Asociación Mexicana de Gastroenterología AC presentamos este manuscrito elaborado por 24 expertos que han trabajado en 6 mesas de trabajo analizando, discutiendo y resumiendo los siguientes tópicos: Definición de encefalopatía hepática, clasificaciones que se recomiendan utilizar, panorama epidemiológico mundial y en México, herramientas para el diagnóstico, condiciones que ameritan hacer un diagnóstico diferencial, tratamiento y profilaxis primaria y secundaria. Así mismo, esta guía hace énfasis en el manejo de ciertas condiciones especiales como encefalopatía hepática en insuficiencia hepática aguda y en falla hepática aguda sobre crónica y cuidados específicos en pacientes con encefalopatía hepática como medicamentos que se deben evitar, por ejemplo, uso de analgésicos permitidos y no permitidos, y en caso de sedación para procedimientos cuales se permiten o sugieren y cuáles no.
The first clinical guidelines on hepatic encephalopathy were published in 2009. Almost 14 years since that first publication, numerous advances in the field of diagnosis, treatment, and special condition care have been made. Therefore, as an initiative of the Asociación Mexicana de Gastroenterología A.C., we present a current view of those aspects. The manuscript described herein was formulated by 24 experts that participated in six working groups, analyzing, discussing, and summarizing the following topics: Definition of hepatic encephalopathy; recommended classifications; epidemiologic panorama, worldwide and in Mexico; diagnostic tools; conditions that merit a differential diagnosis; treatment; and primary and secondary prophylaxis. Likewise, these guidelines emphasize the management of certain special conditions, such as hepatic encephalopathy in acute liver failure and acute-on-chronic liver failure, as well as specific care in patients with hepatic encephalopathy, such as the use of medications and types of sedation, describing those that are permitted or recommended, and those that are not.
La encefalopatía hepática (EH) es una afección compleja con diversos grados de gravedad, que tiene un impacto negativo en la calidad de vida de los pacientes, y además se asocia con carga significativa en materia de salud y asistencia no solo para los pacientes, sino también para sus cuidadores primarios. Además, la prevalencia de la cirrosis, el factor de riesgo más común para la ocurrencia de la EH, ha aumentado constante y gradualmente durante los últimos años; por tanto, se espera un repunte de las cargas clínica y asistencial relacionadas con esta complicación en los próximos años que impactará en los sistemas de atención a la salud1.
En México, como antecedente, se publicaron las «Guías clínicas de diagnóstico y tratamiento de la EH» en el año 2009 en 3 fascículos divididos en 1) generalidades2, 2) fisiopatología y diagnóstico3 y 3) tratamiento y perspectivas a futuro4. Desde entonces no ha habido una actualización de las mismas, lo cual a cerca de 14 años de distancia resulta imprescindible, ya que en este periodo se ha acrecentado el acervo científico resultando en múltiples novedades en cuanto a herramientas diagnósticas y terapéuticas que son actualmente fundamentales para la práctica clínica diaria. Por este motivo la Asociación Mexicana de Gastroenterología AC (AMG) ha tomado la iniciativa de elaborar una guía clínica actualizada sobre la EH, que permita integrar los nuevos conceptos sobre epidemiología, diagnóstico, tratamiento y seguimiento de los pacientes que padecen esta enfermedad. En la tabla 1 se resumen las recomendaciones emitidas en esta guía clínica.
| Recomendación | Nivel de evidencia | Grado de recomendación |
|---|---|---|
| Definiciones y clasificación | ||
| 1. La EH se define como la disfunción cerebral causada por insuficiencia hepática y/o derivación portosistémica; manifestada por un amplio espectro de anormalidades neurológicas o psiquiátricas, que van de las alteraciones subclínicas, al coma. | NA | NA |
| 2. La EHM es una disfunción neurocognitiva y motora imposible de diagnosticar en un examen físico estándar, y que únicamente puede detectarse mediante pruebas psicométricas y/o neurofisiológicas. | NA | NA |
| 3. La EH puede clasificarse con base a diversos criterios: 1) etiología, 2) gravedad de las manifestaciones, 3) presentación a través del tiempo y 4) factores precipitantes. | NA | NA |
| 4. Sugerimos clasificar a la EH de acuerdo con su gravedad en encubierta (EHM o grado I de WH) y manifiesta (a partir del grado II de WH). | NA | NA |
| Mecanismos fisiopatológicos, manifestaciones clínicas y factores precipitantes | ||
| 5. La fisiopatología de la EH es multifactorial. La hiperamonemia (un factor determinante en su patogénesis) conduce a una disfunción cerebral asociada con complicaciones neuropsiquiátricas y neurológicas. | NA | NA |
| 6. La inflamación sistémica, estrés oxidativo, alteraciones en la permeabilidad intestinal y en la composición de la microbiota intestinal, sarcopenia, deficiencia de zinc y disfunción de la unidad neurogliovascular son otros factores que contribuyen a la presencia y gravedad de la EH. | NA | NA |
| 7. La EH se caracteriza por alteraciones neurológicas, neuropsiquiátricas y musculoesqueléticas con presentación clínica en grado variable y heterogéneo. | NA | NA |
| Herramientas para el diagnóstico de la EH, y diagnóstico diferencial | ||
| 8. La clasificación de West Haven, se utiliza para graduar la gravedad de la EH clínicamente manifiesta y guía la decisión terapéutica. | II-B | 1 |
| 9. La determinación rutinaria de amonio en el diagnóstico y en el seguimiento de la EH no está indicada. | II-C | 2 |
| 10. El PHES se considera accesible, sensible y costo-efectiva para el diagnóstico de la EHM, además está estandarizado. | II-B | 1 |
| 11. La FCP y la prueba de interferencia semántica (Stroop test) son pruebas objetivas que pueden ser útiles para el diagnóstico de la EHM. | II-B | 1 |
| 12. En el diagnóstico diferencial del paciente con cirrosis y EH se recomiendan estudios de laboratorio (electrolitos séricos, marcadores de infección, función renal, función hepática, equilibrio acido-base, análisis de líquido peritoneal y cefalorraquídeo), de imagen (TC, RMN de cráneo) y microbiológicos (cultivos). | II-B | 1 |
| Tratamiento y profilaxis | ||
| 13. En pacientes con EH debe asegurarse un aporte calórico y proteico suficiente para evitar la malnutrición y la sarcopenia. | II-B | 1 |
| 14. La lactulosa es la estrategia terapéutica de primera elección para la EH manifiesta. | I-A | 1 |
| 15. Lactulosa es útil como estrategia en profilaxis secundaria después de un primer episodio de EH manifiesta. | I-A | 1 |
| 16. La lactulosa puede recomendarse como profilaxis primaria en pacientes con cirrosis que presentan factores de alto riesgo para desarrollar la EH manifiesta episódica. | I-A | 1 |
| 17. La lactulosa puede recomendarse como tratamiento en pacientes con EHM. | I-A | 1 |
| 18. Rifaximina es útil como adyuvante a la lactulosa en pacientes con EH manifiesta y respuesta clínica subóptima; y administrada de esta misma forma, también en el contexto de profilaxis secundaria, particularmente tras un segundo episodio de EH manifiesta. | I-A | 1 |
| 19. L-ornitina L-aspartato es una estrategia terapéutica efectiva en pacientes con EH manifiesta, tanto en monoterapia como en forma coadyuvante a lactulosa y rifaximina. | I-A | 1 |
| 20. L-ornitina L-aspartato puede utilizarse como profilaxis primaria y secundaria para evitar el desarrollo de EH manifiesta en condiciones de alto riesgo. | I-A | 1 |
| 21. L-ornitina L-aspartato es una estrategia superior al placebo para tratar la EHM y podría prescribirse como alternativa a la lactulosa o a la rifaximina. | I-A | 1 |
| 22. La suplementación con aminoácidos de cadena ramificada puede mejorar las manifestaciones clínicas de la EH. | II-A | 2 |
| 23. No hay evidencia suficiente actualmente para recomendar el uso de zinc, L-carnitina, probióticos o trasplante de microbiota fecal. | II-A | 2 |
| 24. El polietilenglicol ha demostrado eficacia en el tratamiento para la EH, pero se requiere mayor evidencia para poder recomendarlo. | I-A | 2 |
| Condiciones especiales: la EH en insuficiencia hepática aguda y en ACLF | ||
| 25. La aparición clínica de la EH es criterio para el diagnóstico de la IHA. | II-B | 1 |
| 26. En el contexto de la IHA, se recomienda un abordaje diagnóstico de exclusión de otras causas de alteración neurológica. | II-B | 1 |
| 27. Los pacientes con IHA que presentan niveles de amonio sérico >200μM/l presentan mayor riesgo para desarrollar edema cerebral e hipertensión intracraneal. | II-B | 1 |
| 28. El manejo de la EH en pacientes con IHA grave debe contemplar el uso de medidas anti-edema cerebral. | II-B | 1 |
| 29. La presencia de la EH en un paciente con ACLF confiere un pronóstico adverso, aumentando el riesgo de mortalidad a corto y largo plazo. | II-B | 1 |
| Cuidados específicos adicionales en pacientes con cirrosis y encefalopatía hepática | ||
| 30. En pacientes con cirrosis el uso de algunos fármacos puede precipitar la EH. | II-B | 1 |
ACLF: falla hepática aguda sobre crónica; EH; encefalopatía hepática; EHM: encefalopatía hepática mínima; FCP: frecuencia crítica de parpadeo; IHA: insuficiencia hepática aguda; NA: no aplica; PHES: puntaje psicométrico de encefalopatía hepática; RMN: resonancia magnética nuclear; TC: tomografía computada; WH: West Haven.
En marzo de 2022, la mesa directiva de la AMG en coordinación con el comité científico de la misma, presentaron la iniciativa de actualizar la Guía Clínica sobre EH, la cual fue aprobada. Se designó a 2 profesionales expertos para fungir como coordinadores de esta guía, cuyas funciones fueron:
- 1.
Realizar una búsqueda exhaustiva de la literatura en las siguientes bases de datos: Pubmed, Embase, Medline, Trip Database, Clinical Evidence y Cochrane Library con el fin de recopilar toda la información actualizada y relevante. Los criterios de búsqueda incluyeron los términos: EH, EH mínima (EHM), definición, clasificaciones, panorama epidemiológico mundial y en México, fisiopatología, factores de riesgo, manifestaciones clínicas, diagnóstico, diagnóstico diferencial, tratamiento, profilaxis primaria y secundaria. Condiciones especiales: EH en insuficiencia hepática aguda (IHA) y en falla hepática aguda sobre crónica (del inglés: acute-on-chronic liver failure [ACLF]). Cuidados específicos en pacientes con EH: medicamentos que se deben evitar, uso de analgésicos permitidos y no permitidos, en caso de sedación para procedimientos cuales se permiten o sugieren y cuáles no.
- 2.
Dividir el panel de 24 expertos según su área de mayor experiencia en una de 6 diferentes mesas de trabajo, que se encargaron de elaborar los diferentes enunciados y recomendaciones; así como de calificar la evidencia existente mediante el sistema Grading of Recommendations Assessment, Development, and Evaluation (GRADE) (tabla 2)5.
Tabla 2.Grado de recomendación y grado de evidencia (GRADE modificado)
Grado de recomendaciónFuerte a favor de la intervención: influyen en la fuerza de recomendación y la calidad de la evidencia, de la cual derivan resultados importantes positivos para el paciente o para costos.Débil a favor de la intervención: variabilidad en preferencias y valores, o incertidumbre. Poca evidencia o de baja calidad que demuestre beneficio al paciente, o requiere altos costos o consumo de recursos. Grado de evidenciaI-A. Ensayos clínicos controlados, aleatorizadosII-A. Ensayos clínicos sin aleatorizaciónII-B. Estudios observacionales: cohortes o casos y controlesII-C. Estudios observacionales: series de casos. Experimentos no controladosIII. Opinión de expertos Fuente: Manterola et al.5.
A nivel mundial, la incidencia acumulada de EH en pacientes cirróticos, a 1, 5 y 10 años varía entre el 0 y 21%, el 5 y 25% y el 7 y 42%, respectivamente. Dentro de los 2 años posteriores a la derivación portosistémica intrahepática transyugular (TIPS), la incidencia de EH va del 20 al 55%. Hablando de la EHM la prevalencia oscila entre el 20 al 80% en función del grado de descompensación de la cirrosis. En pacientes con cirrosis, los principales factores de riesgo para desarrollar EH manifiesta incluyen: EHM, sarcopenia, hiponatremia, epilepsia, diabetes tipo 2, creatinina elevada, bilirrubina elevada e hipoalbuminemia1.
Como la EH manifiesta es una manifestación de insuficiencia hepática descompensada, tiene un impacto negativo en la supervivencia. Estudios de cohortes demuestran que los pacientes con cirrosis que presentan EH manifiesta tienen una mediana de supervivencia de solo unos pocos meses y un riesgo de mortalidad 2 veces mayor a un año de seguimiento en comparación con los pacientes cirróticos sin EH6,7.
En pacientes mexicanos con cirrosis, la prevalencia de EHM se ha reportado en 11.5%8. De acuerdo con un comunicado de prensa de octubre de 2018, la EH representa el 10% del total de ingresos hospitalarios en un centro de referencia de tercer nivel en la Ciudad de México9.
Definiciones y clasificación- 1.
La EH se define como la disfunción cerebral causada por insuficiencia hepática y/o derivación portosistémica; manifestada por un amplio espectro de anormalidades neurológicas o psiquiátricas, que van de las alteraciones subclínicas, al coma.
Nivel de acuerdo del panel: Totalmente de acuerdo 100%
La disfunción cerebral puede ocurrir bajo múltiples condiciones con o sin enfermedad hepática. Por lo tanto, la EH no debe definirse por síntomas específicos, sino más bien, por la presencia de cirrosis o IHA y la presencia de hiperamonemia, el agente causal. Muchos otros cofactores pueden actuar sinérgicamente con la hiperamonemia para producir o agravar la EH, pero por sí mismos o en forma aislada los expertos no los consideran causantes exclusivos de la EH; es decir, en ausencia de hiperamonemia10. Los pacientes con cortocircuitos porto-sistémicos (CPS) sin enfermedad hepática pueden también cursar con disfunción cerebral asociada a hiperamonemia a pesar de contar con un hígado funcional o normal11; estos pacientes también pueden beneficiarse de terapias específicas que detoxifiquen amoníaco/amonio.
- 2.
La EHM es una disfunción neurocognitiva y motora imposible de diagnosticar en un examen físico estándar y únicamente puede detectarse mediante pruebas psicométricas y/o neurofisiológicas.
Nivel de acuerdo del panel: Totalmente de acuerdo 100%
La forma más leve de EH es la EHM, esta es relevante ya que influye negativa y significativamente en la calidad de vida, el pronóstico y la incidencia de complicaciones. En el diagnóstico se utiliza una amplia gama de pruebas psicométricas y neurofisiológicas que se abordarán en esta guía en detalle más adelante. El tratamiento se basa en los mismos principios que en la EH manifiesta o clínica12.
- 3.
La EH puede clasificarse con base a diversos criterios: 1) etiología, 2) gravedad de las manifestaciones, 3) presentación a través del tiempo y 4) factores precipitantes.
Nivel de acuerdo del panel: Totalmente de acuerdo 100%
De acuerdo con la enfermedad hepática subyacente, la EH se puede clasificar como11:
- •
Tipo A, que es aquella que resulta de una IHA.
- •
Tipo B, que resulta de CPS.
- •
Tipo C, que es originada por la presencia de cirrosis.
Por su presentación en el tiempo, la EH puede ser11:
- •
Episódica, que es aquella que se presenta en eventos de corta duración generalmente desencadenados por infección, deshidratación o transgresión dietética, y que se distancian entre sí por más de 6 meses.
- •
Recurrente, en la cual los episodios se presentan de manera más frecuente, a intervalos menores de 6 meses.
- •
Persistente, con presencia de alteraciones del patrón de conducta durante todo el tiempo, que se intercalan con recaídas de EH manifiesta que suceden en días o semanas.
Por su factor precipitante, se clasifica como11:
- •
No precipitada, en la que no es posible identificar el factor desencadenante tras un interrogatorio adecuado y estudios de laboratorio pertinentes.
- •
Precipitada, en la que la etiología logra identificarse, misma que debe tratarse adecuadamente con el fin de mejorar el episodio de EH. Los principales factores precipitantes son infecciones, sangrado de tubo digestivo, sobredosis de diuréticos, ingesta insuficiente de líquidos, alteraciones electrolíticas, estreñimiento y transgresión dietética.
- 4.
Sugerimos clasificar a la EH de acuerdo con su gravedad en encubierta (EHM y grado I de West Haven [WH]) y manifiesta (a partir del grado II de WH).
Nivel de acuerdo del panel: Totalmente de acuerdo 91%, parcialmente de acuerdo 9%
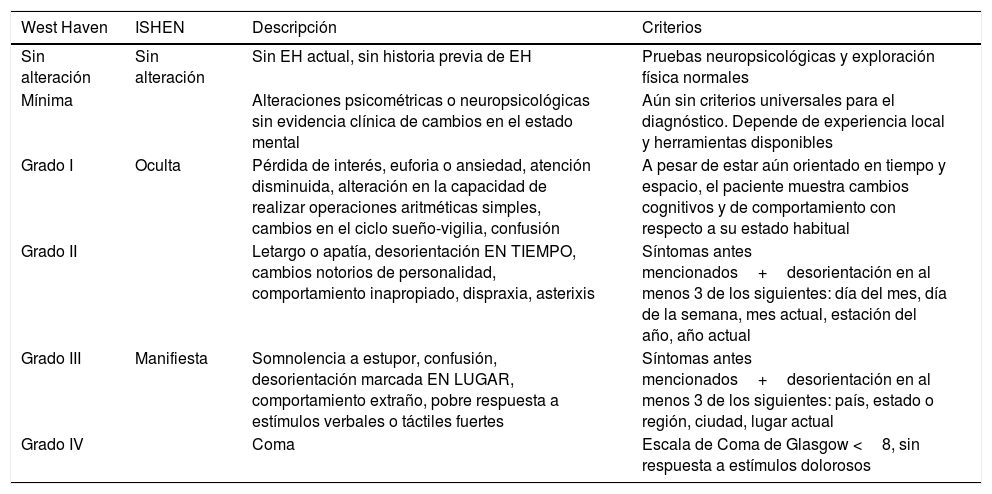
En general, la clasificación inicial que sugerimos aplicar consiste en distinguir entre los pacientes con EHM y aquellos con signos o síntomas francos, llamada EH «manifiesta»; esta última debe además graduarse de acuerdo con los criterios de WH en etapas de la II a la IV13 (tabla 3).
La EH oculta y manifiesta, y su integración con la escala de West Haven
| West Haven | ISHEN | Descripción | Criterios |
|---|---|---|---|
| Sin alteración | Sin alteración | Sin EH actual, sin historia previa de EH | Pruebas neuropsicológicas y exploración física normales |
| Mínima | Alteraciones psicométricas o neuropsicológicas sin evidencia clínica de cambios en el estado mental | Aún sin criterios universales para el diagnóstico. Depende de experiencia local y herramientas disponibles | |
| Grado I | Oculta | Pérdida de interés, euforia o ansiedad, atención disminuida, alteración en la capacidad de realizar operaciones aritméticas simples, cambios en el ciclo sueño-vigilia, confusión | A pesar de estar aún orientado en tiempo y espacio, el paciente muestra cambios cognitivos y de comportamiento con respecto a su estado habitual |
| Grado II | Letargo o apatía, desorientación EN TIEMPO, cambios notorios de personalidad, comportamiento inapropiado, dispraxia, asterixis | Síntomas antes mencionados+desorientación en al menos 3 de los siguientes: día del mes, día de la semana, mes actual, estación del año, año actual | |
| Grado III | Manifiesta | Somnolencia a estupor, confusión, desorientación marcada EN LUGAR, comportamiento extraño, pobre respuesta a estímulos verbales o táctiles fuertes | Síntomas antes mencionados+desorientación en al menos 3 de los siguientes: país, estado o región, ciudad, lugar actual |
| Grado IV | Coma | Escala de Coma de Glasgow <8, sin respuesta a estímulos dolorosos |
EH: encefalopatía hepática.
Fuente: modificada de Weissenborn13.
- 5.
La fisiopatología de la EH es multifactorial. La hiperamonemia (un factor determinante en su patogénesis) conduce a una disfunción cerebral asociada con complicaciones neuropsiquiátricas y neurológicas.
Nivel de acuerdo del panel: Totalmente de acuerdo 91%, parcialmente de acuerdo 9%
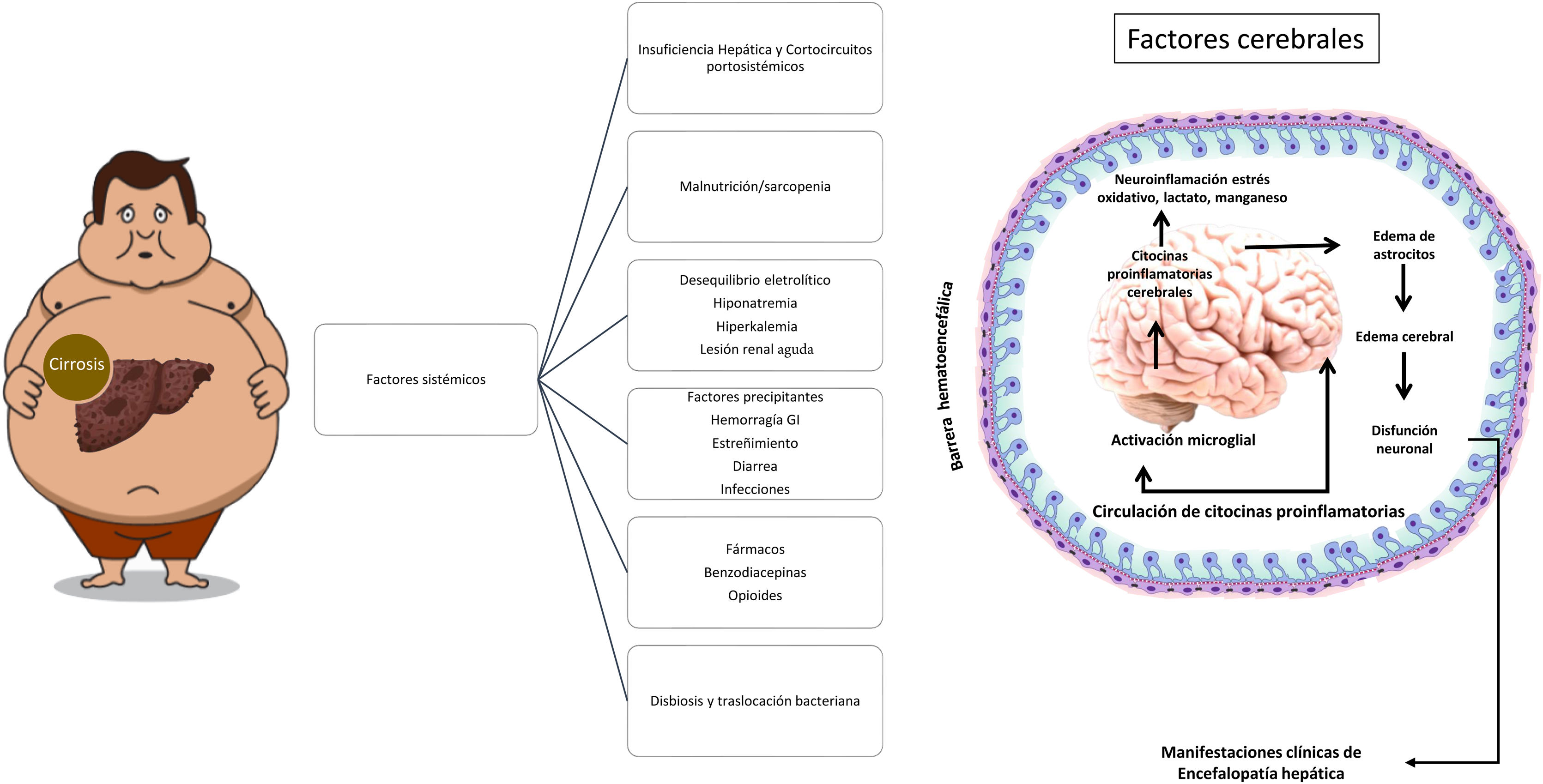
Los principales factores precipitantes que en pacientes con cirrosis suelen contribuir al desarrollo de la EH se muestran en la figura 1.
Los niveles elevados de amonio, citocinas proinflamatorias y la acumulación de falsos neurotransmisores, entre otros, son factores involucrados en el desarrollo de la EH. La hiperamonemia se considera como el principal factor etiológico. El amonio es producto del metabolismo de sustancias nitrogenadas, derivadas principalmente de proteínas, y su principal vía de eliminación es por medio del ciclo de la urea en los hepatocitos. Existen otras vías metabólicas, la enzima glutamina sintetasa presente en varios tejidos realiza la conversión de amonio con glutamato a glutamina, logrando su excreción renal por medio de la síntesis de urea a partir de la glutamina. Por otro lado, a nivel cerebral las neuronas metabolizan la glutamina proveniente de los astrocitos a glutamato (neurotransmisor) y posteriormente este es convertido nuevamente a glutamina por los astrocitos para ser reutilizado14.
En la enfermedad hepática crónica se observan alteraciones del metabolismo de la urea y la glutamina. En los hepatocitos hay disminución de la capacidad de eliminación de amonio a través del ciclo de la urea, lo cual conduce a hiperamonemia que estimula la síntesis de glutamina en tejidos extrahepáticos (músculo, cerebro, corazón y pulmones). La glutamina es degradada a amonio a nivel intestinal y renal logrando su excreción parcial15. A nivel cerebral, la hiperamonemia condiciona aumento de la actividad de la glutamina sintetasa y al exceder la capacidad metabólica del astrocito condiciona alteraciones de la osmolaridad intracelular con posterior edema, citolisis y liberación de citocinas proinflamatorias. Estos cambios celulares inhiben la síntesis de glutamina y la expresión de los receptores de glutamato disminuyendo su captación neuronal desencadenando desequilibrio del ciclo glutamato-glutamina con consecuente aumento del flujo sanguíneo cerebral, edema e incremento de la presión intracraneal, lo cual conlleva a las manifestaciones clínicas neuropsiquiátricas y neurológicas observadas en la EH16.
- 6.
La inflamación sistémica, estrés oxidativo, alteraciones en la permeabilidad intestinal y en la composición de la microbiota intestinal, sarcopenia, deficiencia de zinc y disfunción de la unidad neurogliovascular son otros factores que contribuyen a la presencia y gravedad de la EH.
Nivel de acuerdo del panel: Totalmente de acuerdo 91%, parcialmente de acuerdo 9%
La fisiopatología de la EH es compleja. La hiperamonemia es el detonante cardinal de una serie adicional de alteraciones que perpetúan y agravan la EH; por ejemplo, el estrés oxidativo, la inflamación sistémica, la disfunción de la unidad neurogliovascular y la microglia, el aumento en la permeabilidad de la barrera hematoencefálica, el edema astrocitario y también la hiponatremia17,18.
La disbiosis juega también un rol en la EH. Comparado con sujetos sanos, se han observado cambios en la microbiota intestinal de pacientes con cirrosis y presencia de EH; por ejemplo, la traslocación de Stenotrophomonas pavanii y Methylobacterium extorquens hacia sangre periférica aumenta el riesgo de la EH17.
La sarcopenia es una complicación importante en la cirrosis, y casi entre el 50 y el 70% de ellos desarrollan sarcopenia19. La sarcopenia en pacientes con cirrosis también incrementa el riesgo de EH20. Dasarathy et al. han demostrado además, que los niveles elevados de amonio sérico y miostatina contribuyen a la sarcopenia en la cirrosis21. Se desarrolla entonces un círculo vicioso cuando un paciente cirrótico desarrolla sarcopenia ya que la eliminación de amonio disminuye en pacientes sarcopénicos, lo que a su vez conduce a un mayor riesgo de desarrollar hiperamonemia y EH22. La detoxificación de amonio mediante la administración de L-ornitina L-aspartato (LOLA) en un modelo murino de sarcopenia y esteatohepatitis, mejoró significativamente la masa corporal magra, la fuerza prensión manual y el diámetro promedio de la fibra muscular del grupo suplementado con LOLA vs. el grupo placebo. Estos hallazgos sugieren que LOLA puede ser eficaz para mejorar la sarcopenia23.
El zinc, un centro activo de coenzimas para más de 300 tipos de enzimas que median las funciones celulares, es un oligoelemento esencial. La prevalencia de deficiencia de zinc en pacientes con enfermedad hepática avanzada por aumento de la excreción urinaria y disminución de la absorción es de hasta el 80%. El zinc juega un papel importante en el metabolismo del amonio y su detoxificación hepática24,25. Otros factores que contribuyen al desarrollo de EH son el lactato y el exceso de manganeso26.
- 7.
La EH se caracteriza por alteraciones neurológicas, neuropsiquiátricas y musculoesqueléticas con presentación clínica en grado variable y heterogéneo.
Nivel de acuerdo del panel: Totalmente de acuerdo 83%, parcialmente de acuerdo 5%, parcialmente desacuerdo 12%
El diagnóstico de EH primordialmente es clínico, y para su estadificación se agrupan las características clínicas en base a los criterios de WH25 (tabla 3).
La EH encubierta, que engloba a la EHM (detectable solo mediante la alteración de pruebas neuropsicométricas que se detallarán más adelante en esta guía) y a la EH grado I de WH, se asocia con caídas frecuentes, alteración en habilidades motrices por ejemplo en conducción, presencia de fatiga, desinterés, distracción con atención fluctuante y respuestas lentas a las solicitudes son típicas. Los pacientes se ven afectados en capacidades cognitivas como la memoria, motricidad fina, atención y cálculo25,27.
Dentro de las manifestaciones neuromusculares de la EH, el signo más característico, de patogenia desconocida, es la asterixis o flapping tremor. Existe progresión al estupor, que requiere de un gran estímulo nocivo a menudo para obtener una respuesta sostenida. En esta etapa, los pacientes tienen taquipnea, con pérdida del control habitual de la respiración, que a menudo conduce a problemas respiratorios de alcalosis. En pacientes no comatosos con EH, se pueden observar anomalías del sistema motor, como hipertonía, hiperreflexia, y signo de Babinski positivo. Por el contrario, en el coma pueden disminuir, e incluso desaparecer, los reflejos profundos del tendón28.
En pacientes con IHA el desarrollo de EH es un proceso de deterioro cognitivo y confusión abrupto, y rápidamente progresivo, con extremidades rígidas y resistencia a los movimientos pasivos. Una postura extensora, sugiere daño estructural cerebral, ocurre característicamente en la EH grado IV de WH y puede ser completamente reversible después de corrección de la hiperamonemia. Las pupilas de los pacientes con EH temprana son normales y las respuestas pupilares están conservadas; pero en EH grados III o IV, la reacción pupilar se vuelve lenta y se acompaña de mirada periódica lateral, desconjugada o mirada fija. Pueden además ocurrir movimientos musculares involuntarios o espasmos en las extremidades y puede fusionarse con mioclonos11.
Herramientas para el diagnóstico de encefalopatía hepática y diagnóstico diferencial- 8.
La clasificación de WH, se utiliza para graduar la gravedad de la EH clínicamente manifiesta y guía la decisión terapéutica.
Nivel de evidencia: II-B, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 96%, parcialmente de acuerdo 4%
La clasificación o criterios de WH, tradicionalmente se han utilizado para diagnosticar y graduar la gravedad de la EH clínicamente manifiesta, sin embargo, es una herramienta subjetiva, con limitada fiabilidad inter-observador, sobre todo para el grado I, su mayor utilidad es a partir del grado II de la EH y para grados mayores. Se tiene que complementar con la escala de coma de Glasgow; pero a pesar de ello sigue siendo de utilidad y tiene valor en la práctica clínica por su simplicidad y utilidad para guiar la decisión terapéutica. Idealmente los grados III y IV de WH deberían ser atendidos en la unidad de cuidados intensivos; particularmente por la potencial necesidad de intubación orotraqueal para proteger la vía aérea mientras el estado neurocognitivo se encuentre deteriorado29,30.
- 9.
La determinación rutinaria de amonio en el diagnóstico y en el seguimiento de la EH no está indicada.
Nivel de evidencia: II-C, Grado de recomendación: 2
Nivel de acuerdo del panel: Totalmente de acuerdo 96%, totalmente en desacuerdo 4%
El amonio juega un papel central en la fisiopatología de la EH, pero su papel en el diagnóstico y en el seguimiento de estos pacientes en la práctica clínica, es relativamente incierto. Clásicamente se considera que no se debe usar como método de escrutinio para diagnóstico en pacientes asintomáticos, y en pacientes con signos o síntomas de EH es controversial, ya que no es específico para diagnosticar EH; por tanto, la evaluación clínica es lo más importante. Sus valores no se correlacionan con la gravedad y se ven fácilmente influenciados por el método utilizado para medirlo. Por lo tanto, los niveles altos de amonio en sangre no añaden ningún diagnóstico, estadificación, o valor pronóstico en pacientes con EH y un valor normal requiere reevaluación diagnóstica. Niveles de amonio elevados sin síntomas o signos de EH no deben ser por si solos indicativos de tratamiento para la EH30,31.
A pesar de lo anterior, evidencia mucho más reciente revela que, además de ayudar en el diagnóstico diferencial de la EH, los valores normales de amonio, aunque posibles en la EH, pueden justificar la reconsideración del diagnóstico32,33. La prueba de amonio sérico brinda poco beneficio adicional en escenarios clínicos con una probabilidad previa a la prueba alta o baja para la EH. Sin embargo, si la probabilidad previa a la prueba de EH es incierta, un nivel bajo de amoníaco puede reducir la probabilidad posterior a la prueba de EH. En este escenario, se deben explorar otras etiologías de alteración del estado mental33.
La amonemia también podría ser un marcador pronóstico no solo en pacientes con EH, sino también en pacientes sin síntomas neurológicos, lo que sugiere un posible papel tóxico del amoníaco más allá del cerebro32. Tranah et al. realizaron un estudio de cohorte prospectivo que evaluó la asociación de los niveles de amonio en sangre en 754 pacientes con cirrosis compensada en 3 unidades hepáticas independientes, encontrando que la hiperamonemia fue un predictor independiente, incluso superior al puntaje de Child-Pugh y al puntaje del Model for End-stage Liver Disease (MELD), del desarrollo de diversas complicaciones relacionadas a la enfermedad hepática y mayor mortalidad; esto se confirmó en una cohorte independiente de pacientes34.
Finalmente, enfocarse en la amonemia mientras se monitorea la respuesta terapéutica podría ser una forma de mejorar los resultados en pacientes con HE32. Así que si bien, por el momento la determinación rutinaria de amonio no puede recomendarse, concordamos con otros grupos expertos en que la investigación futura debe centrarse en desarrollar un enfoque estandarizado para la recolección, el procesamiento y la interpretación del amoníaco sérico33.
- 10.
El puntaje psicométrico de encefalopatía hepática (PHES) se considera accesible, sensible y costo-efectivo para el diagnóstico de la EHM, además está estandarizado.
Nivel de evidencia: II-B, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 96%, parcialmente de acuerdo 4%
PHES tiene valores estandarizados y ajustados por edad y nivel de instrucción, requiere que el paciente sepa leer y escribir, y explora la atención y habilidad motora fina y se utiliza para el cribado de la EHM. PHES ha sido validado en controles sanos vs. cirróticos con y sin EH. Cada paciente puede obtener una calificación entre −15 y +3. El límite que define la existencia de EHM es −4 puntos. En el resultado debe considerarse la edad del paciente y los años de escolaridad. El puntaje se obtiene tras realizar 5 pruebas, de lápiz y papel, por lo tanto, es accesible y costo-efectivo35.
- 11.
La frecuencia crítica de parpadeo (FCP) y la prueba de interferencia semántica (Stroop test) son pruebas objetivas que pueden ser útiles para el diagnóstico de EHM.
Nivel de evidencia: II-B, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 87%, parcialmente de acuerdo 13%
La medición de la FCP ha mostrado útil en el diagnóstico de la EHM. El paciente debe presionar un botón cuando nota el parpadeo de un punto luminoso en el interior de un visor. Si la frecuencia detectada es superior a 39 Hz (en el promedio de 10 mediciones) la prueba se considera normal, en cambio, los cirróticos con EHM registran un promedio menor a 3936. La sensibilidad de la FCP es del 83.3% comparado con otras pruebas psicométricas como criterio diagnóstico. Cabe señalar que la concordancia entre la FCP y PHES no es absoluta y un tercio de los pacientes presentan alteradas sólo una de las pruebas. El resultado de la FCP tiene la ventaja de no ser influido por la edad o el nivel de instrucción y no presenta fenómeno de aprendizaje, la desventaja es que existen muy pocos equipos en el país37.
Otra prueba cognitiva recientemente validada para la EHM es la prueba de interferencia semántica (en inglés: Stroop test), se realiza en algún dispositivo inteligente como smartphone o tableta electrónica en donde se descarga la aplicación (EnchephalApp_strooptest); consta de diferentes etapas que incluyen tiempos de practica «on» y tiempos de realización «off», combina signos, palabras y colores que van cambiando y el paciente debe apretar el botón correspondiente, al final se obtiene una puntuación que se carga en la página https://www.encephalapp.com/test1.html, en donde se ingresa la edad del paciente, años de escolaridad y sexo, para obtener una calificación final y el diagnóstico o no de EHM, su sensibilidad es del 85%, es una prueba disponible y objetiva38.
El electroencefalograma y los potenciales evocados auditivos y visuales no se utilizan de forma rutinaria en el diagnóstico de la EHM, la mayor utilidad de ambas pruebas es en protocolos de investigación39.
- 12.
En el diagnóstico diferencial del paciente con cirrosis y EH se recomiendan estudios de laboratorio (electrolitos séricos, marcadores de infección, función renal, función hepática, equilibrio ácido-base, análisis de líquido peritoneal y cefalorraquídeo), de imagen (tomografía o resonancia magnética de cráneo) y microbiológicos (cultivos).
Nivel de evidencia: II-B, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 100%
Deben identificarse factores precipitantes de EH y corregirlos siempre que sea posible (fig. 1). Las infecciones se han identificado como el factor precipitante más común para desarrollar la EH, donde la peritonitis bacteriana espontánea, las infecciones del tracto respiratorio y urinario son las más relevantes. Para identificar de forma oportuna procesos infecciosos, se recomienda realizar examen general de orina, análisis citológico y citoquímico de ascitis, radiografía de tórax y cultivos. Adicionalmente puede ser útiles marcadores indirectos, como leucocitos séricos, procalcitonina, proteína C reactiva, velocidad de sedimentación globular, etc. No olvidar que la hiponatremia e hipokalemia son los desequilibrios hidroelectrolíticos más comúnmente asociados al desarrollo de la EH episódica; por tanto, contar con determinación de electrolíticos séricos es de utilidad40.
Dentro del diagnóstico diferencial cobran relevancia otros estudios como gasometría arterial (equilibrio ácido-base, oxemia y carboxemia), determinación de glucemia, azoados40,41.
El diagnóstico diferencial debe de hacerse en pacientes con datos clínicos atípicos que sugieran focalización (hemiparesia facial o afectación de algún par craneal, hemiparesia o hemiplejia, falta de respuesta a estímulos súbita, crisis convulsivas, afasia, postura de decorticación, signo de Babinski), antecedente de traumatismo, o en aquellos en quienes a priori existen en la exploración neurológica datos sugestivos de otras alteraciones estructurales del sistema nervioso central; así como, en aquellos que no muestran mejoría tras terapia con medidas antiamonio. Dentro de los hallazgos imagenológicos más frecuentes que hacen parte del diagnóstico diferencial se encuentran: Evento vascular cerebral, hemorragia intraparenquimatosa y tumoraciones40,41.
Marcadores de encefalopatía infecciosa: Considerar análisis de líquido cefalorraquídeo para determinación de leucocitos, proteínas, glucosa y microbiología40,41.
Un pequeño porcentaje de las alteraciones neurológicas pueden ser explicados por ingesta de tóxicos. De acuerdo a la accesibilidad y, en conjunto con el interrogatorio, se recomienda realizarlo de forma dirigida. Finalmente, trastornos psiquiátricos como el delirio hipo e hiperactivo, particularmente en adultos mayores debe ser parte a considerar en el diagnóstico diferencial40.
Tratamiento y profilaxis- 13.
En pacientes con EH debe asegurarse un aporte calórico y proteico suficiente para evitar la malnutrición y la sarcopenia.
Nivel de evidencia: II-B, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 100%
La sarcopenia se presenta con frecuencia en los pacientes con cirrosis, con una prevalencia alta entre el 65 y el 90%42. Los factores que han sido identificados en la génesis de la sarcopenia se encuentran: ingesta inadecuada de nutrientes, absorción de nutrientes comprometida y pobre metabolismo y utilidad de los nutrientes secundario a la insuficiencia hepática43. Aunado a esto, la necrosis hepática con liberación de citocinas, biomoléculas del hospedero que incluyen patrones moleculares asociados al daño y asociados a patógenos (DAMP y PAMP) y los CPS; todos ellos contribuyen a la hiperamonemia y endotoxemia, a los cuales se suma la causa de la hepatopatía propiamente dicha, contribuyendo a la resistencia anabólica, en la cual los nutrientes y la actividad física son incapaces de incrementar la síntesis proteica y disminuir la proteólisis44. Una vez que el hígado es incapaz de metabolizar el amonio, solo los astrocitos y las células musculares son capaces de metabolizarlo y transformarlo en glutamina a través de la enzima sintetasa de la glutamina; sin embargo, con la sarcopenia el mecanismo compensador del metabolismo muscular del amonio está disminuido teniendo un papel relevante en favor de la EH. En el estudio de Nardelli et al.45, la sarcopenia se encontró en hasta el 58% de los pacientes; y la historia de EH estuvo presente con más frecuencia en los pacientes con sarcopenia, comparado con los que no tenían sarcopenia (43 vs. 15%, respectivamente; p=0.02), al igual que los niveles de amonio en sangre (62.6±17.7 vs. 41.4±16.1μg/dl; p<0.001), así como EHM (73 vs. 18.5%; p<0.001). En cuanto al tratamiento, este debe ser guiado y monitorizado de preferencia por un servicio especializado en nutriología. La ingesta calórica debe ser por lo menos 35kcal/kg para el paciente no obeso y de 500 a 800kcal/día en el paciente obeso (también se puede estratificar la ingesta de acuerdo con el índice de masa corporal [IMC]: 30-40kg/m2, 25-35kcal/kg; con IMC>40kg/m2, 20-25kcal/kg. En cuanto a la ingesta de proteínas en el paciente con cirrosis, la cantidad necesaria para evitar la pérdida de masa muscular o revertir la ya existente es de 1.2-1.5g/kg, siempre que sea posible debe preferirse la vía oral o enteral por sobre la vía parenteral46.
- 14.
La lactulosa es la estrategia terapéutica de primera elección para la EH manifiesta.
Nivel de evidencia: I-A, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 96%, parcialmente de acuerdo 4%
La lactulosa es el disacárido no absorbible más utilizado para el tratamiento de la EH. El mecanismo de acción de la lactulosa se ha atribuido a la supresión de las bacterias proteolíticas al favorecer un aumento de las bacterias acidófilas (p. ej., Lactobacillus), la captación del ión amonio gracias a la acidificación del contenido colónico (aumento del ritmo deposicional y efecto osmótico por la disminución del pH) y a la alteración del metabolismo del nitrógeno de las bacterias, estimulando que estas utilicen el amonio para la síntesis proteica47. Todos ellos mecanismos que explican su eficacia48,49.
Una serie de ensayos clínicos aleatorizados (ECA)50–53, así como estudios observacionales, han demostrado el beneficio de la lactulosa frente a la ausencia de terapia, aunque no existen verdaderos estudios doble ciego, ya que es extremadamente difícil cegar el efecto laxante y el típico sabor dulce de la lactulosa. Dentro de estos estudios, un ECA abierto mostró que los pacientes que se habían recuperado de un episodio de EH manifiesta y estaban recibiendo lactulosa tenían un riesgo de recurrencia a los 14 meses del 20 vs. 47% entre los que no recibieron lactulosa50.
Por lo general, la lactulosa se administra como jarabe por vía oral (15-30ml) con dosis tituladas para un objetivo de 2 a 4 deposiciones blandas por día. La lactulosa también se puede administrar por vía rectal (300 en 700ml de solución salina), lo que se prefiere en aquellos en quienes la administración oral se ve dificultada (EH grados III o IV)54. Los efectos secundarios comunes de la lactulosa incluyen flatulencia, malestar abdominal y diarrea, lo que puede determinar falta de adherencia en algunos pacientes.
- 15.
La lactulosa es útil como estrategia en profilaxis secundaria después de un primer episodio de EH manifiesta.
Nivel de evidencia: I-A, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 96%, parcialmente de acuerdo 4%
La EH recurrente se observa entre el 47 y el 57% al año y se relaciona con un mal pronóstico en los pacientes con cirrosis, por lo que es un objetivo controlarla. Una revisión sistemática y un metaanálisis en red, que incluyeron un total de 1,828 participantes, demostraron que la lactulosa fue eficaz para prevenir episodios de EH manifiesta, con efectos adversos gastrointestinales leves55.
Una revisión sistemática y metaanálisis52 que consideró ocho ECA (705 participantes) con bajo riesgo de sesgo, mostró un efecto benéfico de los disacáridos no absorbibles vs. placebo/ninguna intervención sobre la mortalidad (razón de riesgos [RR]: 0.63; intervalo de confianza [IC] al 95%: 0.41-0.97). En comparación con placebo/ninguna intervención, los disacáridos no absorbibles se asociaron con efectos benéficos sobre la EH (RR: 0.58; IC al 95%: 0.50-0.69; 1,415 participantes; 22 ECA; I2=32%). Los análisis adicionales mostraron que los disacáridos no absorbibles pueden ayudar a reducir los eventos adversos graves asociados con la enfermedad hepática subyacente, incluida la insuficiencia hepática, el síndrome hepatorrenal y la hemorragia por várices (RR: 0.47; IC al 95%: 0.36-0.60; 1,487 participantes; 24 ECA; I2=0%). Los disacáridos no absorbibles se asociaron con eventos adversos no graves, principalmente gastrointestinales. En cuanto a los ingresos recurrentes por EH, se destaca la importancia de titular la dosis de la lactulosa en cada paciente, dado que hasta en un 22% de los reingresos a 30 días pueden evitarse50.
- 16.
La lactulosa puede recomendarse como profilaxis primaria en pacientes con cirrosis que presentan factores de alto riesgo para desarrollar EH manifiesta episódica.
Nivel de evidencia: I-A, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 87%, parcialmente de acuerdo 13%
Se ha demostrado que la lactulosa es eficaz en la prevención de la EH en pacientes con cirrosis y hemorragia variceal (HV). La relación entre la hemorragia gastrointestinal y el aumento de amonio sérico está bien establecida y es considerada multifactorial. Un estudio aleatorizado abierto de un solo centro mostró que el tratamiento con lactulosa redujo significativamente la incidencia de EH en pacientes con hemorragia digestiva (14 vs. 40%; p<0.03), sin ningún efecto sobre la supervivencia (8.5 vs. 14%; p=NS)56. Otro estudio aleatorizado abierto también demostró que la lactulosa disminuyó de forma significativa la incidencia de EH (3.2 vs. 16.9%; p<0.02); dentro de los factores que se asociaron de forma independiente con la aparición de EH, el puntaje de Child-Pugh fue de los más relevantes57. En un ensayo clínico mexicano, aleatorizado, doble ciego, controlado con placebo que incluyó a pacientes cirróticos con HV, sin EH manifiesta ni EHM al ingreso, se comparó el uso de lactulosa y otros tratamientos antiamonio (rifaximina, LOLA) contra placebo, la frecuencia con respecto al desarrollo de EH fue menor en el grupo con lactulosa vs. placebo (27.3 vs. 54.5%, respectivamente); la diferencia tuvo tendencia a la significación clínica (razón de momios [RM]: 0.3; IC al 95%: 0.09-1.0; p=0.06) y además, no hubo diferencia significativa entre los tres grupos que recibieron cualquier terapia antiamonio; pero sí se presentaron mayores efectos adversos gastrointestinales en el grupo tratado con lactulosa58. Falta evidencia de calidad suficiente para poder emitir una recomendación respecto a la profilaxis con lactulosa en el contexto de procesos infecciosos activos, así como en el escenario post-TIPS; por lo tanto, los autores de esta guía consideran oportuno evaluar el caso en forma individualizada valorando riesgo-beneficio de la administración de lactulosa en estos contextos clínicos.
- 17.
La lactulosa puede recomendarse como tratamiento en pacientes con EHM.
Nivel de evidencia: I-A, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 91%, parcialmente de acuerdo 9%
Se ha encontrado que los pacientes con cirrosis que desarrollan EHM mejoran la calidad de vida relacionada con la salud, las variables neurofisiológicas y el rendimiento psicométrico después de la terapia con lactulosa, de acuerdo a diversos ensayos clínicos; sin embargo, no mostraron disminución en la mortalidad59–61. Tanto la lactulosa como el lactitol tienen efectos sobre la microbiota intestinal y se consideran prebióticos intestinales. La lactulosa puede producir un efecto bifidogénico relacionado con un efecto favorable sobre el metabolismo del amonio en el colon62.
En un análisis en red de 25 ensayos y 1,563 participantes, la lactulosa fue un tratamiento efectivo para revertir la EHM, reducir niveles de amonio y mejorar la calidad de vida con efectos adversos tolerables55.
- 18.
Rifaximina es útil como adyuvante a la lactulosa en pacientes con EH manifiesta y respuesta clínica subóptima; y administrada de esta misma forma, también en el contexto de profilaxis secundaria, particularmente tras un segundo episodio de EH manifiesta.
Nivel de evidencia: I-A, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 91%, parcialmente de acuerdo 9%
La prevalencia de la EH manifiesta al momento del diagnóstico de cirrosis es 10-14% en general, 16-21% en cirrosis descompensada y 10-50% en pacientes con TIPS. La prevalencia acumulada indica que entre el 30-40% de los pacientes con cirrosis podrán presentarla a lo largo de su evolución clínica63,64. Rifaximina α, es un antibiótico pobremente absorbido, que ejerce su función en la EH, disminuyendo las bacterias productoras de amonio en el intestino65. Recientemente, un ECA demostró la eficacia de la combinación de rifaximina más lactulosa vs. lactulosa sola en pacientes con EH manifiesta grados II a IV, demostrando una alta probabilidad de resolución de la EH, acortamiento de la estancia hospitalaria y mejoría en la sobrevida66. Un estudio de dos bases de datos estadounidenses con 11,205 pacientes con EH tratados con rifaximina más lactulosa, disminuyeron las admisiones hospitalarias relacionadas a EH en el 33 al 34% comparado con lactulosa67. Un estudio aleatorizado demostró reducción en la mortalidad (p<0.05) con el uso de rifaximina más lactulosa vs. lactulosa sola. La mayoría de los pacientes tenían un MELD de 24.6 y el 81.7% EH grados III o IV en la clasificación de WH68.
- 19.
L-ornitina L-aspartato es una estrategia terapéutica efectiva en pacientes con EH manifiesta, tanto en monoterapia como en forma coadyuvante a lactulosa y rifaximina.
Nivel de evidencia: I-A, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 91%, incierto 4.5%, parcialmente desacuerdo 4.5%
Un ensayo clínico realizado por Ahmad et al. demostraron que la administración de LOLA en monoterapia a dosis de 20g al día/por 5 días fue superior al placebo para mejorar el estado mental en pacientes cirróticos con hiperamonemia y EH manifiesta69. Dos ensayos clínicos más recientes, doble ciego, aleatorizados, controlados con placebo evaluaron la eficacia de LOLA 30g al día/durante 5 días por vía intravenosa. En el primero, adicionada a lactulosa y ceftriaxona (cuidado estándar) vs. placebo más cuidado estándar en la reversión de episodios de EH manifiesta en pacientes con cirrosis. El grado de EH manifiesta fue significativamente menor en el grupo LOLA, en comparación con placebo, desde las primeras 24 a 48h y sostenidamente hasta el día 4. El tiempo medio necesario para la recuperación fue menor en el grupo LOLA en comparación con el grupo placebo (1.92±0.93 vs. 2.50±1.03 días; p=0.002; IC al 95%: −0.852 a −0.202). El amonio venoso en el día 5 y la duración de la estancia hospitalaria fueron significativamente más bajos en el grupo LOLA70. El segundo, demostró que LOLA en combinación con lactulosa y rifaximina fue superior al cuidado estándar exclusivo con lactulosa más rifaximina, logrando mayor reducción en las cifras de amonio, interleucina-6 (IL-6) y factor de necrosis tumoral alfa (TNFα) séricos. Se observaron tasas más altas de mejoría en el grado de EH (92.5 vs. 66%; p<0.001), menor tiempo de recuperación (2.7±0.46 vs. 3.0±0.87 días; p=0.03) y menor mortalidad a los 28 días (16.4 vs. 41.8%; p=0.001) en el grupo LOLA en comparación con placebo71.
- 20.
L-ornitina L-aspartato puede utilizarse como profilaxis primaria y secundaria para evitar el desarrollo de EH manifiesta en condiciones de alto riesgo.
Nivel de evidencia: I-A, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 91%, incierto 4.5%, parcialmente desacuerdo 4.5%
En un ECA abierto, Bai et al. encontraron que LOLA administrada a dosis de 30g/día por vía intravenosa/durante 7 días posterior a la colocación de TIPS, redujo de forma significativa el amonio al día 4 y 7, tanto en ayuno como posprandial, en comparación con el placebo. Durante el período de estudio, los pacientes en el grupo LOLA tuvieron mejor desempeño en las pruebas psicométricas en comparación con el grupo control; a pesar de que no se observó diferencia en cuanto al desarrollo franco de EH manifiesta durante el tratamiento, sí hubo una tendencia a menor frecuencia de la misma en el grupo que recibió LOLA (un paciente del grupo LOLA y 3 pacientes del grupo placebo; p=0.331). La administración de LOLA fue segura, ya que no hubo diferencias en las complicaciones, los eventos adversos o la mortalidad entre los 2 grupos72. La HV es otra condición de riesgo, donde hasta el 40% de los pacientes con esta complicación desarrollan además EH, Higuera-de la Tijera et al. encontraron que administrar LOLA en este contexto clínico a dosis de 10g/día por vía intravenosa/durante 7 días fue capaz de prevenir el desarrollo de EH de forma más eficiente que el placebo (22.7 vs. 54.5%; OR: 0.2; IC al 95%: 0.06-0.88; p=0.03), y no fue inferior administrada en monoterapia a otras medidas antiamonio (lactulosa o rifaximina; p=0.94)58.
Respecto a profilaxis secundaria, Varakanahalli et al. realizaron un ECA, doble ciego, controlado con placebo, que consistió en administrar 6g de LOLA por vía oral/3 veces al día/ durante 6 meses a pacientes con recuperación reciente de un episodio de EH manifiesta. La recurrencia de EH manifiesta fue significativamente menor en el grupo que recibió LOLA vs. el placebo (12.3 vs. 27.7%; p=0.02). En este mismo estudio, adicionalmente se demostró una mejoría objetiva en diversos parámetros de EHM y en las cifras de amonio sérico en el grupo que recibió LOLA vs. placebo: PHES (2.53±2.18 vs. −0.01±1.92; p<0.001), amonio (−23.58±14.8 vs. 1.41±13.34μmol/l; p<0.001), FCP (5.85±4.82 vs. 0.58±4.53; p<0.001) y puntuación mediante el cuestionario de perfil de impacto de la enfermedad (−7.89±5.52 vs. -0.95±4.25; p<0.001)73.
- 21.
L-ornitina L-aspartato es una estrategia superior al placebo para tratar la EHM y podría prescribirse como alternativa a la lactulosa o a la rifaximina.
Nivel de evidencia: I-A, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 87%, incierto 13%
En el estudio de Mittal et al. la administración de LOLA 6g por vía oral/3 veces al día/durante 3 meses fue superior al placebo para mejorar las alteraciones neuropsicométricas propias de la EHM, reducir las cifras de amonio sérico y mejorar la calidad de vida de pacientes con cirrosis; así mismo, en este estudio no hubo diferencia entre LOLA y el estándar de tratamiento; es decir, lactulosa74. Sharma et al. reportaron un ECA, controlado con placebo en donde evidenciaron mejoría de parámetros neuropsicométricos evaluados mediante la prueba de conexión numérica A (del inglés: Number Connection Test-A [NCT-A]), prueba de conexión de figuras A (del inglés: Figure Connection Test -A [FCT-A]) y prueba de símbolo de dígito (del inglés: Digit Symbol Test [DST]) y mediante la FCP en comparación con placebo y sin ser inferior a rifaximina (en este estudio no se comparó con lactulosa)68. Alvares-da-Silva et al. reportaron que la proporción de pacientes que progresaron de EHM a la forma de EH manifiesta fue significativamente menor en el grupo que estuvo recibiendo LOLA a dosis de 6g/3 veces al día por vía oral/durante 6 meses vs. el placebo (5 vs. 379%; p=0.016)75.
- 22.
La suplementación con aminoácidos de cadena ramificada puede mejorar las manifestaciones clínicas de la EH.
Nivel de evidencia: II-A, Grado de recomendación: 2
Nivel de acuerdo del panel: Totalmente de acuerdo 82.6%, parcialmente de acuerdo 13%, incierto 4.3%
Los aminoácidos de cadena ramificada (AACR), sirven como sustrato para la síntesis de proteínas en el músculo esquelético, los 3 principales son: leucina, isoleucina y valina. El metabolismo de los AACR se asocia con un incremento en la actividad de la glutamina sintetasa, favoreciendo la formación de glutamina y con ello la subsecuente detoxificación de amonio76–78.
Existe evidencia relacionada con la utilidad del uso de los AACR en la prevención de la recurrencia de la EH76–80. En una revisión de Cochrane publicada en 2015 en la que se incluyeron 16 estudios con un total de 827 pacientes, se comparó la utilidad de AACR con lactulosa, neomicina, dieta, placebo o no intervención, Gluud et al. reportaron un efecto benéfico a favor de los AACR en EH, sin embargo, estos beneficios no se observaron en desenlaces como calidad de vida, mortalidad o parámetros nutricionales80. Es por ello que se ha propuesto su uso solo como una alternativa o de forma adicional en pacientes con EH refractaria11.
- 23.
No hay evidencia suficiente actualmente para recomendar el uso de zinc, L-carnitina, probióticos, o trasplante de microbiota fecal.
Nivel de evidencia: II-A, Grado de recomendación: 2
Nivel de acuerdo del panel: Totalmente de acuerdo 87%, parcialmente de acuerdo 8.7%, incierto 4.3%
El zinc es un cofactor en las reacciones enzimáticas asociadas con la conversión de amonio en urea vía ornitina transcarbamilasa en el hígado y vía glutamina sintetasa en el músculo esquelético. Tomando como referencia dos revisiones sistemáticas con meta-análisis, Chávez-Tapia et al. evaluaron los estudios publicados respecto al uso de zinc comparado con no tratamiento o placebo, el uso de este, se asoció con mejoría en la ejecución de la prueba de conexión numérica en los pacientes con EH, sin mejoría respecto a otros desenlaces clínicos o bioquímicos81.
Shen et al. evaluaron estudios en los que se utilizó la suplementación de zinc comparada con placebo u otros tratamientos, concluyendo que la combinación de zinc más lactulosa de 3 a 6 meses también mejora la ejecución de la prueba de conexión numérica, comparada con el uso de lactulosa sola, en pacientes con EHM82.
La acetil-L-carnitina (ALC) es un éster endógeno de la L-carnitina que se ha asociado con una disminución en las concentraciones de amonio en sangre y cerebro. La aplicabilidad de las formulaciones orales o intravenosas de L-carnitina, fueron evaluadas en una revisión de Cochrane publicada en 2019, en la que se incluyeron 5 estudios que compararon el uso de la L-carnitina contra la terapia estándar en pacientes con EH. Sin embargo, a pesar de que el uso de ésta parece estar asociada con disminución en los niveles séricos de amonio, no mostró beneficio sobre placebo en la disminución de la fatiga o calidad de vida. No existen datos que evalúen efectos adversos, readmisiones hospitalarias o mortalidad83.
El potencial benéfico en el uso de probióticos para el manejo de la EH, se basa en el efecto que ejercen a través de la disminución de la carga de bacterias intestinales patogénicas promoviendo una barrera intestinal sana y atenuando el efecto tóxico de la traslocación bacteriana. La mayor parte de los estudios han evaluado la aplicabilidad de VSL3 (Visibiome®)84. Sin embargo, a pesar de que en fases tempranas el uso de probióticos mostró resultados prometedores, no han mostrado evidencia suficiente que demuestre mejoría en la cognición de los pacientes con EH. Una revisión de Cochrane publicada en 2017 en el que se evaluaron 21 estudios (más de 1,400 pacientes), concluyó que los probióticos parecen no tener un efecto benéfico en EH cuando se comparó con placebo, es importante mencionar que la mayor parte de la evidencia se consideró de baja calidad85. Además, aún existe la inquietud de conocer si el uso de probióticos se asocia con alteraciones en la composición del microbioma que pueda favorecer resistencias.
El trasplante de microbiota fecal (TMF) fue propuesto por primera vez como reporte de caso en 2016, sin embargo, el efecto benéfico reportado parece haber sido transitorio en un paciente con EH grados I a II86. Un año más tarde se llevó a cabo un ensayo clínico que tuvo como objetivo evaluar el efecto terapéutico del TMF de forma combinada con lactulosa y rifaximina en 10 pacientes, comparados con 10 en los que solo se usó rifaximina y lactulosa, mostrando diferencia significativa en el número de hospitalizaciones asociadas con EH recurrente y mejoría global en la cognición87. Este estudio dio paso a un ensayo similar sin antibióticos pretratamiento y usando una cápsula de TMF en lugar de vía enema, a pesar de mostrar seguridad y buena tolerancia, no tuvo el poder estadístico para evaluar la eficacia de ésta modalidad respecto a la mejoría en la EH88.
- 24.
El polietilenglicol ha demostrado eficacia en el tratamiento para EH episódica, pero se requiere mayor evidencia para poder recomendarlo.
Nivel de evidencia: I-A, Grado de recomendación: 2
Nivel de acuerdo del panel: Totalmente de acuerdo 82.6%, parcialmente de acuerdo 13%, incierto 4.3%
El polietilenglicol (PEG) es un laxante osmótico seguro. Varios ECA evaluaron la efectividad de PEG vs. lactulosa en el tratamiento de EH episódica; sin embargo, los resultados han sido inconsistentes89–92. Una primera revisión sistemática con meta-análisis incluyó cuatro ensayos con 229 pacientes. El algoritmo de puntuación de EH (del inglés: Hepatic Encephalopathy Scoring Algorithm [HESA]) combina indicadores clínicos con los derivados de pruebas neuropsicológicas simples, e intenta estandarizar y objetivar la clasificación de los diferentes grados de EH; sin embargo, aún le falta mayor validación. En comparación con la lactulosa, de acuerdo a HESA, el tamaño del efecto agrupado demostró una puntuación media significativamente menor a las 24h (diferencia de medias [DM]=−0.68; IC al 95%: −1.05 a −0.31; p<0.001), una mayor proporción de pacientes con reducción de la puntuación de HESA en ≥1 grado a las 24h (cociente de riesgos [CR]=1.40; IC al 95%: 1.17-1.67; p<0.001), una mayor proporción de pacientes con una puntuación HESA de grado 0 a las 24h (RR=4.33; IC al 95%: 2.27-8.28; p<0.001) y un menor tiempo hasta la resolución del grupo EH (DM=−1.45; IC al 95%: −1.72 a −1.18; p<0.001) a favor de los pacientes tratados con PEG93.
Un metaanálisis más reciente que incluyó un total de 434 pacientes que participaron en 7 estudios aleatorizados, encontró que hubo una ventaja significativa de la terapia con PEG vs. lactulosa en el aumento de la eficacia clínica (RR=1.46; IC al 95%: 1.26-1.68; p=0.001; I2=0%) y la disminución de la estancia hospitalaria (DM=−1.78; IC al 95%: −2.72-0.85; p=0.001; I2=90.1%). No hubo diferencias significativas en la incidencia de eventos adversos ni en el nivel de amoníaco sérico después de 24h entre los 2 grupos. Por tanto, se propone que PEG puede conducir a una resolución de EH más rápida durante las primeras 24h y acortar la duración de la estancia sin aumentar la tasa de efectos adversos. Sin embargo, los mismos autores de dicho meta-análisis indican que hay varias limitaciones que deben tenerse en cuenta. En primer lugar, este meta-análisis está limitado por el número pequeño y la calidad deficiente de los ensayos incluidos. En segundo lugar, todavía existe una heterogeneidad significativa en los resultados de los estudios, y la fuente de heterogeneidad puede incluir la edad, el sexo, la cultura y muchos otros factores correspondientes. Además, sólo se realizó el seguimiento a corto plazo en estos estudios incluidos. En el futuro, se deben realizar más estudios prospectivos con el seguimiento a largo plazo94.
Condiciones especiales: encefalopatía hepática en insuficiencia hepática aguda y en falla hepática aguda sobre crónica- 25.
La aparición clínica de EH es criterio para el diagnóstico de IHA.
Nivel de evidencia: II-B, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 95.7%, parcialmente de acuerdo 4.3%
La IHA es un síndrome caracterizado por el deterioro rápido del funcionamiento hepático normal posterior a un insulto agudo en un paciente sin patología hepática previamente conocida95. Se caracteriza por el deterioro en las pruebas de funcionamiento hepático, con potencial involucro y disfunción en otros órganos. El desarrollo clínico de la insuficiencia hepática involucra la presencia de ictericia, coagulopatía y EH.
La definición más aceptada de la IHA es la establecida por ÓGrady y se divide en 3 tipos acorde al inicio de la EH. Estas definiciones son importantes dado que en virtud de la forma del diagnóstico se establece la posible etiología y el pronóstico95:
- a.
Hiperaguda: EH en los 7 días posteriores al inicio de la ictericia. Causas como acetaminofén, hepatitis A, hepatitis E, hipoperfusión hepática. Suele presentarse con aumento importante de transaminasas, coagulopatía severa, riesgo importante de edema cerebral y alta mortalidad sin trasplante.
- b.
Aguda: EH que se presenta entre los 7 y 28 días de iniciada la ictericia. Atribuida principalmente a hepatitis B. Presenta moderada elevación de transaminasas, bilirrubinas y coagulopatía, con riesgo intermedio de edema cerebral, y mejor sobrevida comparado con la forma hiperaguda.
- c.
Subaguda: EH que se presenta entre los 28 días y 26 semanas de iniciada la ictericia. Atribuido a daño hepático idiosincrático por fármacos. Se manifiesta por leve elevación de transaminasas, importante elevación de bilirrubinas, bajo riesgo de edema cerebral y baja mortalidad96.
- 26.
En el contexto de IHA, se recomienda un abordaje diagnóstico de exclusión de otras causas de alteración neurológica.
Nivel de evidencia: II-B, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 95.7%, parcialmente de acuerdo 4.3%
El diagnóstico diferencial debe ser hecho principalmente con etiologías infecciosas como malaria, leptospirosis, dengue, rickettsia, fiebre tifoidea, síndrome hemofagocítico, así como enfermedades neurológicas que cursen con estado mental alterado, coagulopatía e ictericia97.
- 27.
Los pacientes con IHA que presentan niveles de amonio sérico >200μmol/l presentan mayor riesgo para desarrollar edema cerebral e hipertensión intracraneal.
Nivel de evidencia: II-B, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 87%, parcialmente de acuerdo 8.7%, parcialmente en desacuerdo 4.3%.
El edema cerebral en los pacientes con IHA causa incremento en la presión intracraneal (PIC). Los pacientes con alto riesgo de aumento en la PIC son aquellos con fenotipos hiperagudos o agudos, que se caracterizan por período más corto de presentación de EH una vez aparecida la ictericia, aunado a edad joven, compromiso renal e incremento en los niveles de amonio. La elevación persistentemente arriba de >200μmol/l, inclusive posterior al inicio del tratamiento y medidas anti-edema es altamente sugestivo de incremento en la PIC98.
- 28.
El manejo de EH en pacientes con IHA grave debe contemplar el uso de medidas anti-edema cerebral.
Nivel de evidencia: II-B, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 87%, parcialmente de acuerdo 13%
Los pacientes con IHA, EH y riesgo de aumento en la PIC deben ser manejados en un ambiente tranquilo, con vigilancia del sodio sérico (manteniendo niveles entre 140 y 145mmol/l), y medidas para manejo de EH con lactulosa y rifaximina. Dentro de las medidas generales se sugiere levantar la cabecera a 30 grados, evitar fiebre, hipoglicemia o hiperglicemia. Se debe monitorizar la PIC la cual se debe mantener entre 20 y 25mmHg, con una presión de perfusión cerebral arriba de 50mmHg99. Cuando la PIC es mayor a 25mmHg se debe agregar al tratamiento bolos de solución salina hipertónica o manitol intravenoso al 20%100.
- 29.
La presencia de EH en un paciente con ACLF confiere un pronóstico adverso, aumentando el riesgo de mortalidad a corto y largo plazo.
Nivel de evidencia: II-B, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 100%
ACLF es un síndrome dinámico que involucra puntajes pronósticos para establecer el diagnóstico. Los aparatos, sistemas y órganos involucrados en el mismo son: Hígado, riñón, cerebro, coagulación, circulación y respiratorio101. Un modelo pronóstico se ha desarrollado para estratificar a los pacientes con ACLF, se denomina puntaje CLIF-C-ACLF (del inglés: Chronic Liver Failure-Consortium-Acute-on-Chronic Liver Failure; disponible en: http://www-clifconsortium.com), y para los pacientes que no cumplen criterios de ACLF se denomina CLIF-C-AD (del inglés: Chronic Liver Failur –Consortium-Acute Decompensation)102. A nivel cerebral se establece 1 punto en pacientes con EH grado 0 de WH, 2 puntos grados I a II, y 3 puntos para grados III a IV. Se ha establecido que dos factores en particular, la presencia de lesión renal aguda y la falla cerebral, en pacientes con ACLF son predictores independiente de mortalidad a 28 y 90 días103; estimándose así que la mortalidad en pacientes con ACLF grado 1 va del 23 al 41%, en pacientes con ACLF grado 2 va del 31 al 55%, y en pacientes con ACLF grado 3 va del 74 al 78% a 28 y 90 días, respectivamente104.
Cuidados específicos adicionales en pacientes con cirrosis y encefalopatía hepática- 30.
En pacientes con cirrosis el uso de algunos fármacos puede precipitar EH.
Nivel de evidencia: II-B, Grado de recomendación: 1
Nivel de acuerdo del panel: Totalmente de acuerdo 100%
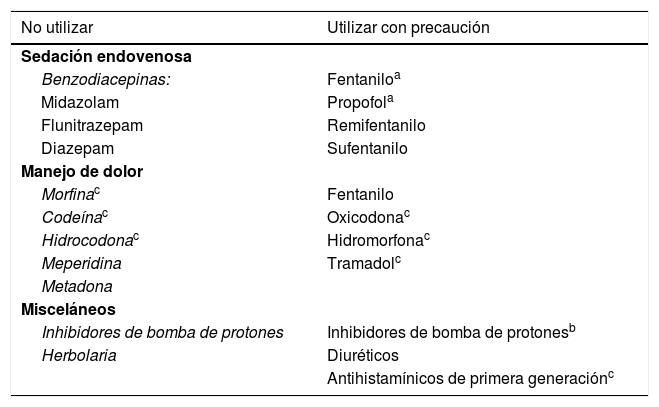
Los pacientes con cirrosis habitualmente son sometidos a estudios endoscópicos. La esofagogastroduodenoscopia (EGD) es crucial en los pacientes con cirrosis para el escrutinio y seguimiento de las várices esofágicas o gástricas, que son manifestaciones de la hipertensión portal. El midazolam es el fármaco que suele utilizarse para la sedación de los pacientes que serán sometidos a EGD, ya que puede hacer que olviden las molestias durante el procedimiento debido a la amnesia anterógrada con una sedación adecuada. Sin embargo, dado que el midazolam, y la mayoría de las benzodiacepinas se metabolizan principalmente en el hígado, su tasa metabólica puede disminuir en pacientes con cirrosis. Además, el midazolam se ha reportado como un factor de riesgo para desarrollar EH manifiesta y encubierta105. Por otra parte, el propofol es un fármaco que puede utilizarse como sedante para la endoscopia y no se sabe que tenga diferencias farmacocinéticas en pacientes con insuficiencia renal o hepática. El propofol ha demostrado no producir cambios cognitivos significativos, un periodo de recuperación más corto en comparación con el midazolam, y un mejor perfil de seguridad y eficacia106–108.
Es importante señalar que fuera de sedación endovenosa, si se necesita utilizar una benzodiacepina para manejo de trastorno de ansiedad generalizado o trastornos del sueño, se pueden utilizar con precaución lorazepam y oxazepam, ya que estos principalmente se metabolizan en el hígado solo en la fase II de biotransformación que incluye solo la conjugación con compuestos endógenos, mecanismo que suele estar preservado incluso en pacientes cirróticos; al contrario de los que se biotransforman en fase I (que incluye la hidrólisis, reducción u oxidación), como el resto de las benzodiacepinas, las cuales no son recomendables109.
Todos los pacientes con EH grado III o IV de WH y puntuación <8 de la escala de coma de Glasgow deben ser considerados para intubación como medida de protección de la vía aérea. Para la sedación en cuidados críticos deben utilizarse fármacos de acción corta, como el propofol o la dexmedetomidina. Este último fármaco se asocia a la preservación de la función cognitiva y a la reducción de la duración de la ventilación mecánica en los pacientes de la unidad de terapia intensiva. Además, puede utilizarse para el tratamiento de la abstinencia de alcohol, lo que puede permitir la disminución de la administración de benzodiazepinas. Tanto la dexmedetomidina como el propofol se asocian a efectos secundarios hemodinámicos similares110,111. La dexmedetomidina ha sido bien tolerada en pacientes con enfermedad hepática crónica, sin presentar un aumento de los efectos secundarios, aunque los pacientes necesitaron más tiempo antes de la extubación una vez que se suspendió la medicación112.
Los opioides con frecuencia se emplean en combinación con una benzodiacepina para llevar a cabo una sedación moderada. Se unen a receptores del sistema nervioso central y actúan aumentando el umbral del dolor y alterando la percepción del mismo. Cuando se emplean juntos en pacientes cirróticos aumenta la probabilidad de efectos adversos113.
En general, los opioides deben evitarse en pacientes cirróticos. Tienen efectos adversos bien establecidos como depresión respiratoria, sedación y constipación lo que puede generar EH o exacerbarla, por lo tanto, deben utilizarse con precaución. Cuando un agente opioide es requerido como parte de cuidados paliativos en pacientes con enfermedades hepáticas, se sugiere utilizar lactulosa de manera profiláctica para evitar estreñimiento, así como un seguimiento estrecho del paciente y de los efectos adversos. Se prefieren utilizar como opioides de primera línea: Hidromorfona a dosis bajas (1mg vía oral o 0.4mg vía intravenosa) u oxicodona (2,5mg vía oral) con intervalos de dosis más extendidos, así como fentanilo vía intravenosa en hospitalizados o en parches en pacientes ambulatorios. Se recomienda evitar: Morfina y codeína pues se han asociado a múltiples efectos adversos dentro de los cuales se citan la EH e hipoglucemia114. A pesar de los recientes reportes en contra del tramadol y buprenorfina se requiere de más investigación en pacientes con cirrosis, en el manejo del dolor tramadol a dosis bajas de 25-50mg/cada 12h es una adecuada opción en nuestro país, siempre y cuando se vigile de manera estrecha los efectos adversos.
La meperidina tiene eliminación hepática prolongada en pacientes con enfermedad hepática avanzada por lo que se debe evitar su uso, sin embargo, la eliminación de fentanilo no se prolonga en pacientes con cirrosis hepática y es una buena opción como sedante o para manejo del dolor, siempre y cuando se utilice con precaución113.
Metadona en el pasado era un analgésico atractivo para pacientes con enfermedad hepática, sin embargo, hoy se ha demostrado que tiene una vida media larga y que se acumula en pacientes cirróticos, por lo que no recomienda utilizarla115.
El uso de inhibidores de la bomba de protones (IBP) en pacientes con cirrosis se ha asociado con disbiosis, sobrecrecimiento bacteriano intestinal, infección por C. difficile y con el desarrollo de peritonitis bacteriana espontánea por lo que tienen un riesgo potencial de EH. Es necesario asegurar la existencia de una indicación clara de uso de los IBP en estos pacientes, y de tenerla se deben utilizar a la menor dosis por el menor tiempo necesario116,117.
La furosemida y espironolactona son los diuréticos más empleados en pacientes con hepatopatía crónica y retención hídrica. Todos los pacientes que inician diuréticos deben ser monitoreados para detectar eventos adversos, cuya prevalencia varía entre el 19 y el 33%. Casi la mitad con eventos adversos requieren la suspensión del diurético o la reducción de la dosis. En los pacientes hospitalizados tratados con diuréticos, se observa EH hasta en un 25%117,118 (tabla 4).
Fármacos que pueden precipitar encefalopatía hepática
| No utilizar | Utilizar con precaución |
|---|---|
| Sedación endovenosa | |
| Benzodiacepinas: | Fentaniloa |
| Midazolam | Propofola |
| Flunitrazepam | Remifentanilo |
| Diazepam | Sufentanilo |
| Manejo de dolor | |
| Morfinac | Fentanilo |
| Codeínac | Oxicodonac |
| Hidrocodonac | Hidromorfonac |
| Meperidina | Tramadolc |
| Metadona | |
| Misceláneos | |
| Inhibidores de bomba de protones | Inhibidores de bomba de protonesb |
| Herbolaria | Diuréticos |
| Antihistamínicos de primera generaciónc | |
EH: encefalopatía hepática; IBP: inhibidores de bomba de protones.
Fátima Higuera de la Tijera es conferencista para Gilead, Abbott, Grünenthal y Merz Pharma.
José A. Velarde-Ruiz Velasco es conferencista para Megalabs.
Ricardo H. Raña Garibay no tiene conflicto de intereses.
Graciela E. Castro Narro sin conflicto de intereses.
Juan Miguel Abdo Francis es conferencista para Medix, Abbott y Grünenthal.
Rosalba Moreno Alcántar es conferencista para Grünenthal, Gilead y Abbvie.
José L. Pérez Hernández es conferencista para Gilead y Grünenthal.
Aldo Torre es conferencista para Grünenthal, Alfa Wassermann, Viatrix, Grifols, Medix y Astra.
Raúl Contreras Omaña es conferencista para Megalabs.
Ana Cano Contreras no tiene conflicto de intereses.
Mauricio Castillo Barradas sin conflicto de intereses.
Juanita Pérez Escobar no tiene conflicto de intereses.
Juan Manuel Aldana Ledesma no tiene conflicto de intereses,
Eira Cerda Reyes es conferencista para Gilead, Abbvie, Medix, Bayer, MSD y Sanfer.
Nicolás Fernández Pérez es conferencista para Gilead y Megalabs.
Javier Meza Cardona no tiene conflicto de intereses.
Nayelli Cointa Flores García es conferencista para Gilead, Abbott, Grünenthal y Merz Pharma.
Mónica Reyes Bastidas no tiene conflicto de intereses.
Jorge Emilio Lira Vera no tiene conflicto de intereses.
Edgar Santino García Jiménez no tiene conflicto de intereses.
Daniel Santana Vargas es conferencista para Grünenthal.
Victor Manuel Páez Zayas es conferencista para Alfa Wassermann.
Norberto Chávez Tapia no tiene conflicto de intereses.
Ernesto Márquez Guillén no tiene conflicto de intereses.
FinanciaciónEsta guía clínica se realizó con recursos propios de la Asociación Mexicana de Gastroenterología A.C. y con el apoyo logístico de Grünenthal de México.