En la actualidad la funduplicatura laparoscópica tipo Nissen se considera el tratamiento quirúrgico de elección para la enfermedad por reflujo gastroesofágico (ERGE) y su efectividad a largo plazo es mayor del 90%. Dentro de los factores predictores de buena respuesta clínica están la adecuada selección del paciente y la experiencia del cirujano. Sin embargo, la prevalencia de síntomas nuevos, persistentes y recurrentes posteriores al procedimiento antirreflujo puede ser de hasta un 30%. Las causas son múltiples pero en general se deben a una o más alteraciones en la anatomía y en la función esofagogástrica. Ante la persistencia de los síntomas posterior al procedimiento quirúrgico se debería de utilizar el término «falla». En el caso de que un paciente inicialmente manifieste control de sus síntomas y posteriormente estos reaparezcan, se pudiera emplear el término «disfunción». Por otra parte, ante el empeoramiento de los síntomas o la aparición de síntomas o situaciones clínicas que no existían antes de la cirugía, debe de considerarse una «complicación». La disfagia postoperatoria y los síntomas dispépticos son muy frecuentes y requieren un abordaje integral para poder determinar el mejor tratamiento posible. En esta revisión se detallan los aspectos fisiopatológicos, de diagnóstico y tratamiento de los síntomas y las complicaciones posteriores a la funduplicatura para el manejo de la ERGE.
Laparoscopic Nissen fundoplication is currently considered the surgical treatment of choice for gastroesophageal reflux disease (GERD) and its long-term effectiveness is above 90%. Adequate patient selection and the experience of the surgeon are among the predictive factors of good clinical response. However, there can be new, persistent, and recurrent symptoms after the antireflux procedure in up to 30% of the cases. There are numerous causes, but in general, they are due to one or more anatomic abnormalities and esophageal and gastric function alterations. When there are persistent symptoms after the surgical procedure, the surgery should be described as “failed”. In the case of a patient that initially manifests symptom control, but the symptoms then reappear, the term “dysfunction” could be used. When symptoms worsen, or when symptoms or clinical situations appear that did not exist before the surgery, this should be considered a “complication”. Postoperative dysphagia and dyspeptic symptoms are very frequent and require an integrated approach to determine the best possible treatment. This review details the pathophysiologic aspects, diagnostic approach, and treatment of the symptoms and complications after fundoplication for the management of GERD.
En la actualidad, las indicaciones para el tratamiento quirúrgico de la enfermedad por reflujo gastroesofágico (ERGE) incluyen al menos alguna de las siguientes situaciones: a) ERGE erosiva sintomática en pacientes jóvenes con adecuada respuesta al uso de inhibidores de la bomba de protones (IBP); b) evidencia de hernia hiatal grande o disfunción del esfínter esofágico inferior (EEI); c) pacientes que desean suspender el tratamiento por costo o comodidad; d) intolerancia a tratamiento médico, y d) síntomas severos, en especial con reflujo nocturno y regurgitaciones1.
También se reconoce que antes de someterse a cirugía, los sujetos se evalúen de manera completa y adecuada para corroborar que sus síntomas estén relacionados a ERGE. Esto se logra mediante estudios endoscópicos, esofagograma, pH-metría ambulatoria y manometría esofágica; este abordaje prequirúrgico es fundamental y puede confirmar o no la indicación quirúrgica y, en algunos casos, predecir la respuesta.
Dentro de todos los procedimientos quirúrgicos, la funduplicatura laparoscópica tipo Nissen se considera el de elección, la efectividad de esta técnica es mayor del 90% a largo plazo y es similar a los IBP2-5. Los factores predictores de buena respuesta clínica son la adecuada selección del paciente y la experiencia del cirujano. Sin embargo, en general, el control sintomático disminuirá con el tiempo (90% a 3 años vs. 67% a 7 años)4,5, aunque es de esperar que esta respuesta sea diferente dependiendo del tipo de funduplicatura (360o, 270° o 180°).
El principal mecanismo fisiopatológico para ERGE es un incremento de las relajaciones transitorias del EEI. Solo un 10% de los pacientes tienen hipotonía del esfínter y algunos tienen una longitud corta del segmento abdominal del EEI. La función de barrera del EEI dependerá de su presión basal, que confiere competencia de válvula, y de la concordancia entre el EEI y el pinzamiento con la crura diafragmática, que se somete a una apertura durante las fases del ciclo respiratorio y cuando es sometido a tensión por la distensión gástrica. La incompetencia resultante expondrá la mucosa esofágica al ácido6,7. La funduplicatura (360°) alrededor del esófago distal fortalecerá la válvula evitando el reflujo y promoverá la corrección del segmento intraabdominal corto y la concordancia del pinzamiento diafragmático en el hiato esofágico7.
Una vez que un sujeto se somete a una funduplicatura, los desenlaces clínicos pueden ser los siguientes:
- a.
Respuesta completa: no hay síntomas residuales de la ERGE,
- b.
Respuesta parcial: síntomas residuales leves o de menor magnitud.
- c.
Aparición de síntomas «nuevos».
- d.
Ausencia de respuesta clínica.
Aunque en la actualidad no existe una definición estandarizada, pudiera pensarse que los pacientes que no responden o en quienes aparecen síntomas de novo son los que fallaron a la cirugía antirreflujo8.
Como se mencionó anteriormente, ante la persistencia de los síntomas posterior al procedimiento quirúrgico se debería de utilizar el término «falla». En el caso de que un paciente inicialmente manifieste control de sus síntomas y posteriormente los síntomas reaparezcan, se pudiera emplear el término «disfunción». Por otra parte, la presencia de empeoramiento de los síntomas o la aparición de síntomas o situaciones clínicas que no existían antes de la cirugía debe considerarse una «complicación».
¿Por qué falla, disfunciona o se complica un paciente que se sometió a cirugía antirreflujo? Aunque existen muchas respuestas, parece ser que la mala selección de pacientes y/o a la falla de la técnica quirúrgica son las respuestas para esta inquietante pregunta.
La respuesta al IBP no define el fenotipo de la ERGE, ya que la prueba terapéutica tiene muy baja especificidad y los sujetos con enfermedades relacionadas con el ácido pueden responder satisfactoriamente9-12. El IBP solo cambia el pH del material refluido pero no tiene efecto directo sobre el reflujo10. Así, la ganancia terapéutica del IBP es mayor en los erosivos (EE) que en los no erosivos (ERNE) (48% [IC del 95%: 24.6-93.8] vs. 27.2% [IC del 95%: 20.9-35.3])13. De forma similar, se postula que la respuesta clínica a la cirugía será diferente entre ambos, ya que aunque pueden tener diferentes grados de exposición al ácido, además se pueden asociar a diferentes mecanismos fisiopatológicos. Mientras que para EE el tamaño de la hernia hiatal, la bolsa de ácido residual supradiafragmática, la baja presión basal del EEI y la alteración del vaciamiento esofágico13 son los principales mecanismos, para la ERNE lo son las relajaciones transitorias del EEI y la hipersensibilidad esofágica13,14. Esta última es una entidad muy heterogénea, más refractaria, y la exposición esofágica anormal al ácido solo está presente en el 35 al 42%9,10,14,15. Los estudios fisiológicos (pH-metría de 24h y manometría esofágica) pueden disminuir el riesgo, durante la selección del candidato para cirugía, de pasar por alto enfermedades preexistentes no visibles cuyos síntomas pueden exacerbarse en el postoperatorio.
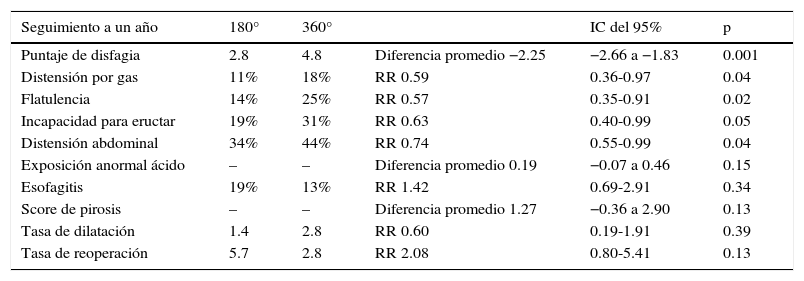
Las técnicas antirreflujo incluyen la funduplicatura parcial, anterior (Dor 180°) o posterior (Toupet 270°) y total (Nissen 360°), con reaproximación crural16 (tabla 1). La disfagia y el síndrome de burbuja (gas) son los principales malestares asociados a la funduplicatura de 360°. Con el objetivo de reducir su incidencia, se han propuesto técnicas como la funduplicatura de Toupet y la de Dor, que son eficaces para controlar el reflujo y la regurgitación17. La incidencia de disfagia postoperatoria (Nissen 360°) disminuye significativamente cuando se calibra (52 French) el esófago durante la construcción de la funduplicatura, cuando no se ancla a la pared esofágica y cuando se cortan los vasos cortos para la adecuada movilización del esófago (disminución de la tensión en la funduplicatura)17.
Eficacia y seguridad entre dos métodos de cirugía antirreflujo
| Seguimiento a un año | 180° | 360° | IC del 95% | p | |
|---|---|---|---|---|---|
| Puntaje de disfagia | 2.8 | 4.8 | Diferencia promedio −2.25 | −2.66 a −1.83 | 0.001 |
| Distensión por gas | 11% | 18% | RR 0.59 | 0.36-0.97 | 0.04 |
| Flatulencia | 14% | 25% | RR 0.57 | 0.35-0.91 | 0.02 |
| Incapacidad para eructar | 19% | 31% | RR 0.63 | 0.40-0.99 | 0.05 |
| Distensión abdominal | 34% | 44% | RR 0.74 | 0.55-0.99 | 0.04 |
| Exposición anormal ácido | – | – | Diferencia promedio 0.19 | −0.07 a 0.46 | 0.15 |
| Esofagitis | 19% | 13% | RR 1.42 | 0.69-2.91 | 0.34 |
| Score de pirosis | – | – | Diferencia promedio 1.27 | −0.36 a 2.90 | 0.13 |
| Tasa de dilatación | 1.4 | 2.8 | RR 0.60 | 0.19-1.91 | 0.39 |
| Tasa de reoperación | 5.7 | 2.8 | RR 2.08 | 0.80-5.41 | 0.13 |
Tomado de Pennathur et al.19.
La prevalencia de síntomas posquirúrgicos nuevos, persistentes y recurrentes es del 2 al 20%17,18. Las causas son múltiples pero en general se deben a una o más anormalidades en la anatomía y la función esofagogástrica19. Se ha reportado que, posterior a la cirugía antirreflujo, existe una prevalencia de persistencia de reflujo que es del 8.2 y el 10.1%, y disfagia del 7.5 y el 5.1% a 2 años y 5 años del postoperatorio, respectivamente20.
Estas manifestaciones clínicas pueden hacerse manifiestas de forma inmediata o temprana (hasta en las primeras 4 semanas) o de forma tardía (más de 4 semanas).
- 1.
Manifestaciones tempranas. La disfagia postoperatoria es la manifestación más común y su incidencia es muy variable y depende de la experiencia del cirujano con la técnica, el tipo de la técnica y el tiempo de seguimiento. Esta manifestación común puede ser temporal debido a edema e inflamación del tejido involucrado en el procedimiento y puede resolverse en 2 a 4 semanas. Las complicaciones inmediatas graves son infrecuentes. El neumotórax o el enfisema están relacionados con la excesiva disección del hiato. Puede sospecharse de disrupción de la funduplicatura y/o la perforación (esófago o estómago) en presencia de dolor de gran intensidad, vómito persistente, fiebre, taquicardia y leucocitosis5,20.
- 2.
Manifestaciones tardías. La aparición del síndrome de distensión por gas (síndrome de burbuja gástrica) es una complicación infrecuente con fisiopatología desconocida, caracterizada por plenitud y/o dolor abdominal (sensación de gas intestinal), dificultad para eructar, aerofagia y retraso del vaciamiento gástrico. El manejo debe incluir modificaciones dietéticas, como disminuir o suspender el consumo de bebidas carbonatadas, fermentables y alimentos que retrasen el vaciamiento gástrico. Si los síntomas son leves, pueden emplearse la simeticona y procinéticos. En los casos severos puede requerirse de cirugía y desmantelar la funduplicatura y/o la conversión de la funduplicatura de 360° a 180°21.
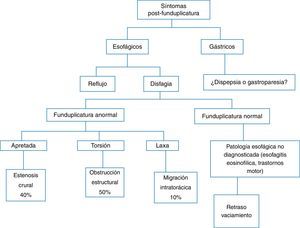
En la figura 1 se propone un algoritmo diagnóstico basado en la aparición de síntomas posteriores a la funduplicatura.
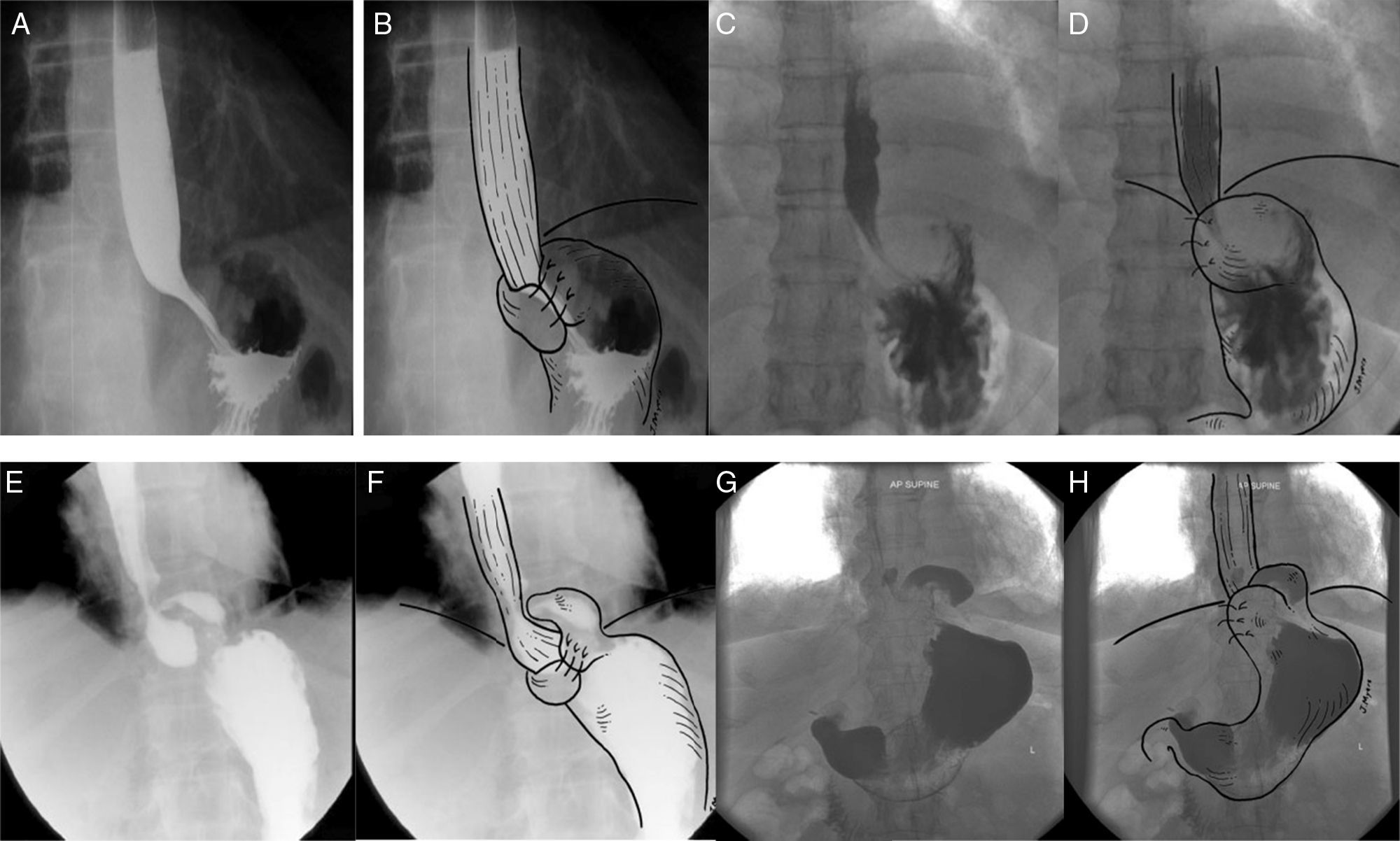
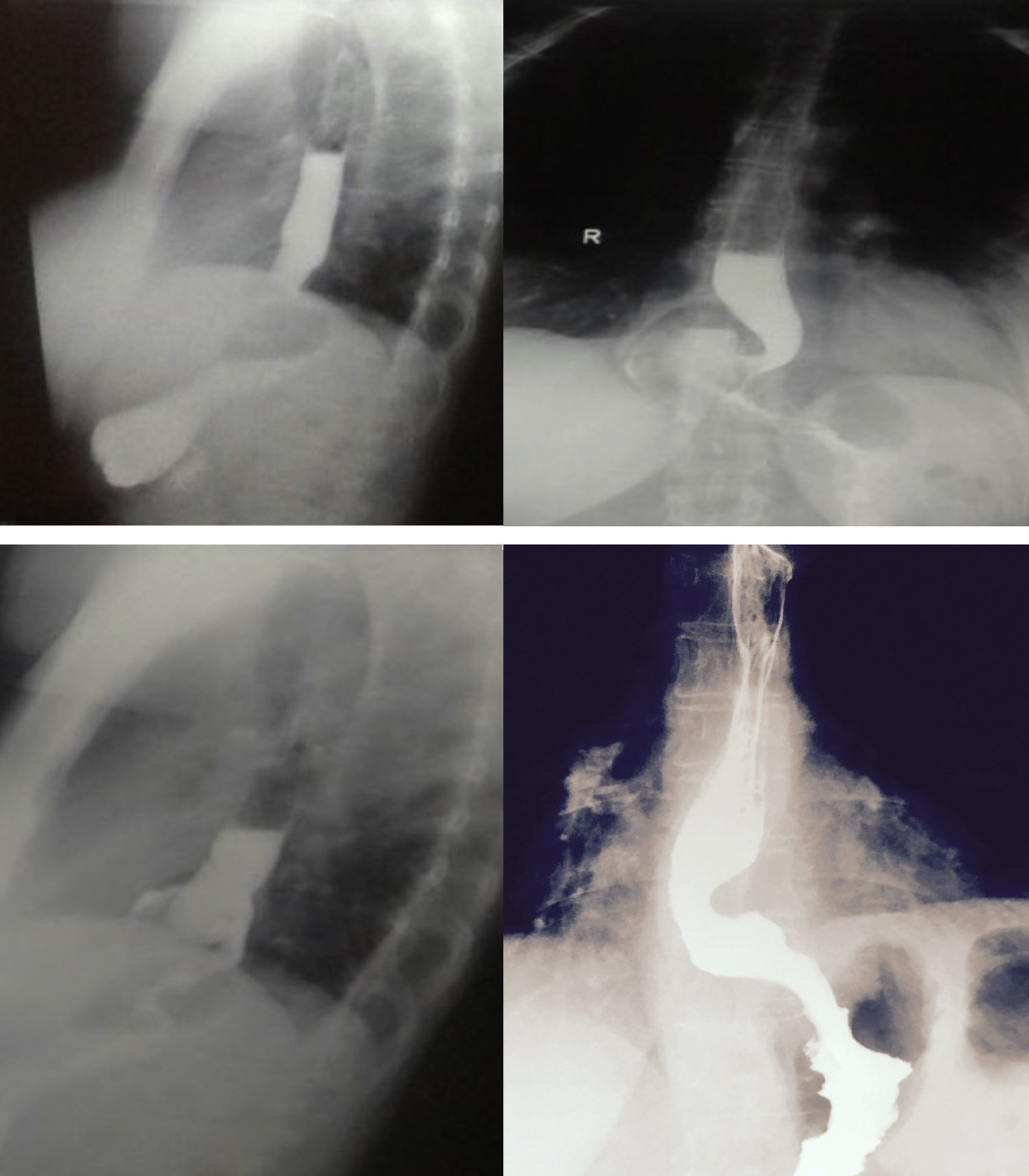
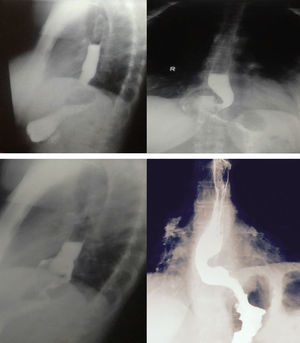
Síntomas esofágicosA. Disfagia. La disfagia postoperatoria tiene alta incidencia (76%), en general es de leve intensidad y se resuelve en las primeras semanas. Hasta un 20% persistirá durante un año y entre el 5 y el 8% por más tiempo. Si la disfagia es persistente, es recomendable realizar un esofagograma con contraste5 (fig. 2). La presencia preoperatoria de disfagia, el retraso en el vaciamiento gástrico, una menor presión de amplitud en el esófago distal, la presencia de hernia hiatal y la mayor presión basal en la unión esofagogástrica (UEG) son predictores de disfagia posquirúrgica21,22.
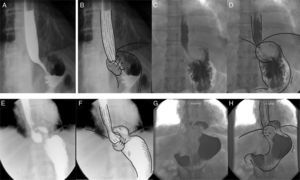
Evaluación radiológica con contraste en diferentes escenarios de la funduplicatura. A) Trago de bario con proyección antero-posterior de la funduplicatura tipo Nissen 360° en donde el fondo del estómago está envolviendo el esófago distal en forma completa. B) Trago de bario con esquema sobrepuesto. C) Trago de bario con proyección antero-posterior de la funduplicatura tipo Nissen 180° en donde el fondo envuelve parcialmente el esófago distal. D) Trago de bario con esquema sobrepuesto. E) Trago de bario con proyección antero-posterior de una funduplicatura tipo Nissen 360° con migración tipo i, observándose la herniación por arriba y la UEG por debajo del diafragma. F) Trago de bario con esquema sobrepuesto. G) Trago de bario con proyección antero-posterior de una funduplicatura tipo Nissen 180° con migración tipo i, observándose la herniación por arriba y la UEG por debajo del diafragma. H) Trago de bario con esquema sobrepuesto.
Tomado de Raeside et al.34.
La disfagia posfunduplicatura puede estar relacionada con una peristalsis ineficaz o con un tránsito del bolo esofágico anormal, especialmente cuando el músculo liso del esófago no tiene la reserva peristáltica necesaria para superar el efecto obstructivo de la funduplicatura23. Los pacientes con motilidad esofágica inefectiva pueden tener distintos patrones de comportamiento (persistencia, modificación o resolución) posfunduplicatura. La obstrucción distal creada por la cirugía puede mejorar la amplitud de contracción del cuerpo esofágico, particularmente en el segmento S2, que ha sido relacionado con la contracción tardía del músculo liso («latencia proximal») y ser determinante en la presencia de disfagia postoperatoria24-26.
La presencia de disfagia postoperatoria puede deberse a:
- a.
Diagnóstico incorrecto. Siempre debe considerarse una enfermedad preexistente no diagnosticada. La manometría de alta resolución (MAR) es el estándar de referencia para identificar trastornos de la motilidad esofágica (motilidad inefectiva y otros trastornos motores primarios, incluidos los de hipercontractilidad esofágica y acalasia)23. Una de las situaciones que ha hecho que todos los pacientes que se van a someter a cirugía antirreflujo sean evaluados manométricamente es el hecho de descartar uno de estos trastornos, específicamente la acalasia.
- b.
Alteraciones funcionales. La obstrucción funcional de salida de la UEG es secundaria a la estenosis crural ocasionada por una funduplicatura apretada que, en ocasiones, no es evidente con el esofagograma y/o endoscopia. La MAR es el estándar de referencia para este diagnóstico23,27.
- c.
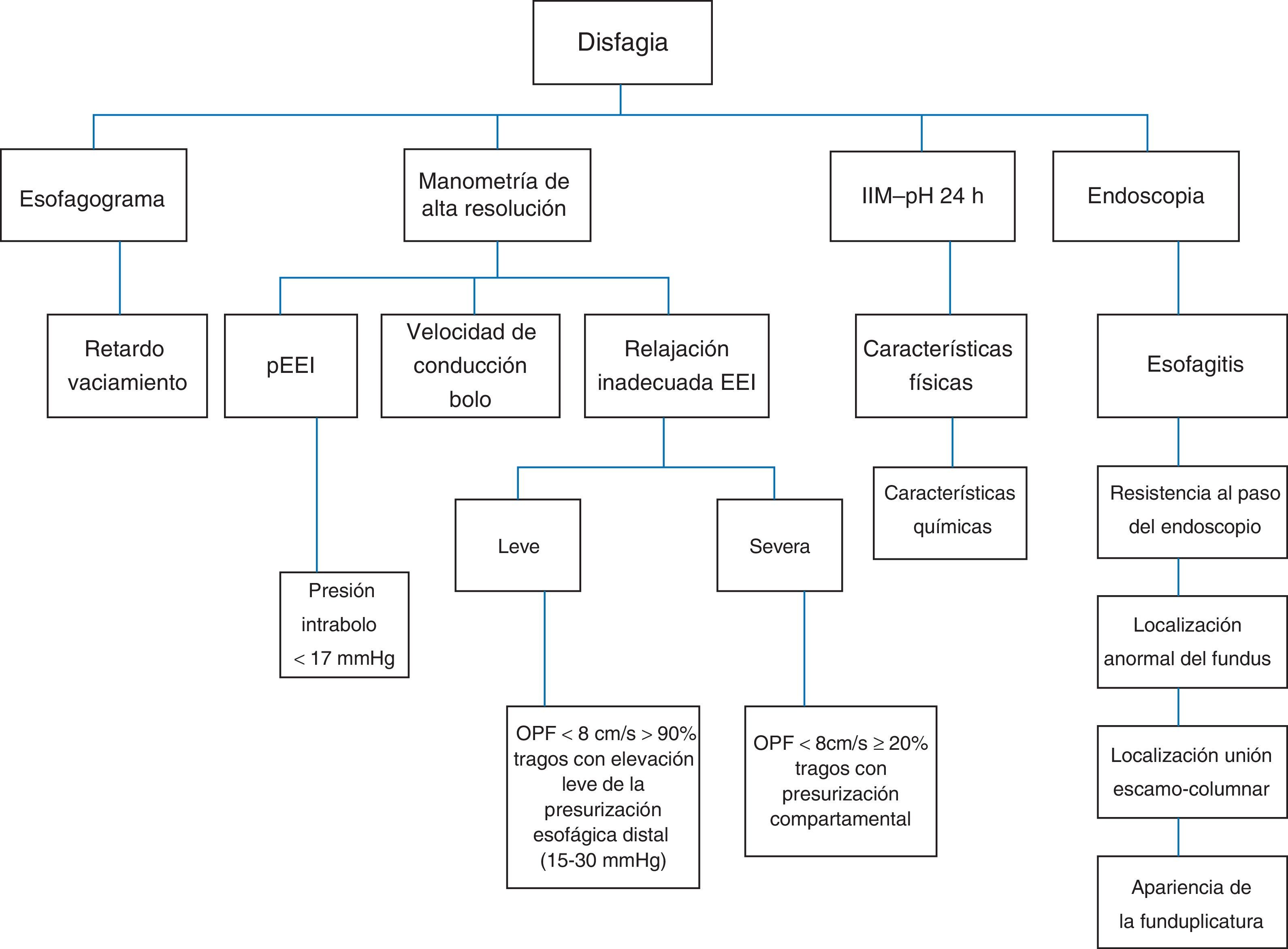
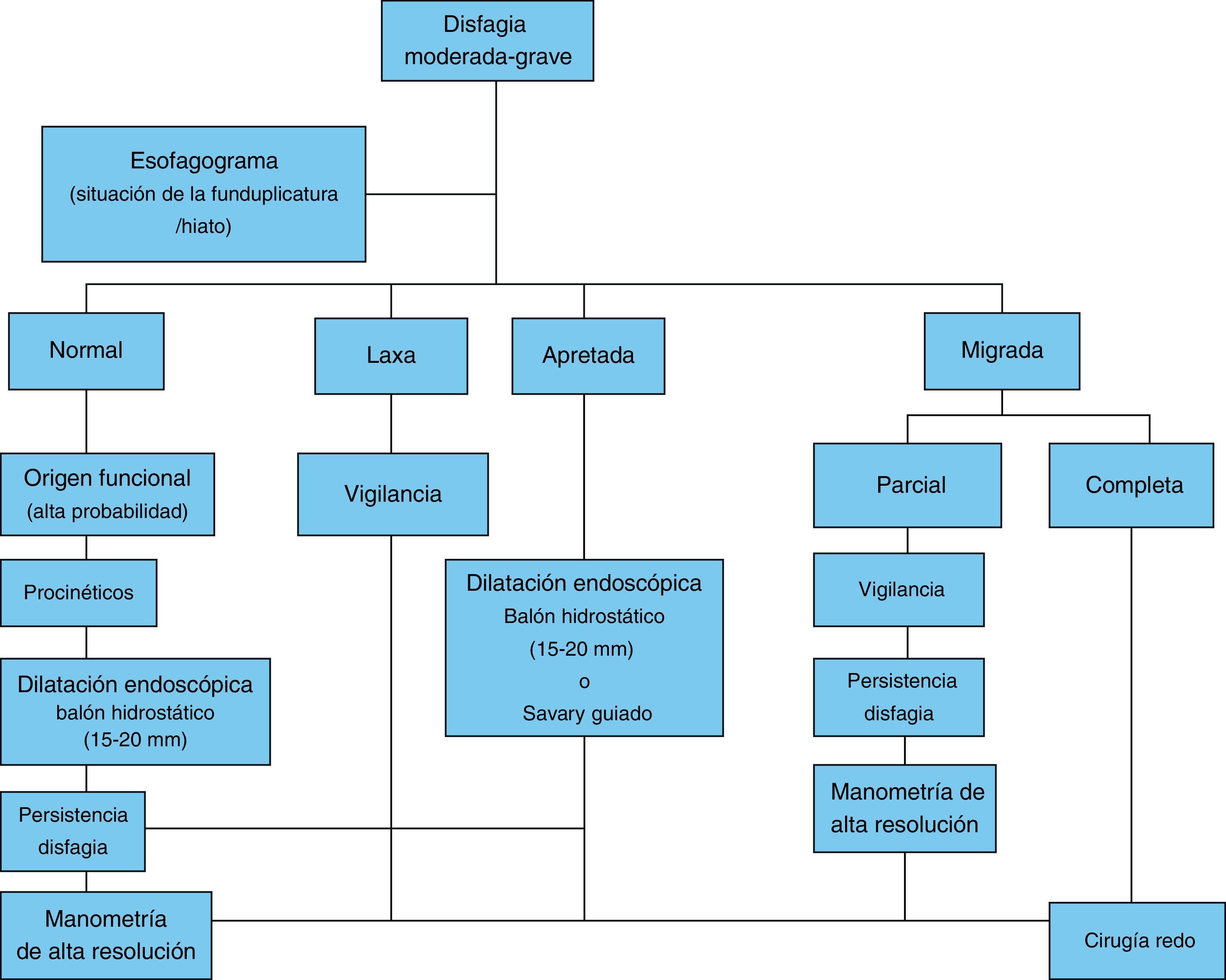
Alteraciones estructurales. Existen al menos 3 alteraciones bien definidas en este contexto que son: 1) la migración de la funduplicatura (50%) debida a laxitud de la plastia; 2) obstrucción en o por arriba de la UEG (40%) secundaria a torsión, y c) estenosis (10%) por funduplicatura apretada (fig. 1)28. La funduplicatura apretada o larga producirá estrechamiento distal, dilatación proximal y retraso en el vaciamiento del contraste radiológico. En la figura 3 se resumen los métodos de diagnóstico a emplearse en los pacientes con disfagia posfunduplicatura6.
Se han descrito varias clasificaciones en relación con la disfunción y/o la falla de la funduplicatura. A continuación, se describen 2 de las más utilizadas:
- 1.
Tipos de disfunción de la funduplicatura (Hinder)29:
- –
Se asocia a recurrencia de la hernia hiatal; en el esofagograma y la endoscopia se puede observar un pequeño defecto fúndico debido a la herniación. Puede ser causada por materiales de sutura inadecuados o aumento de la presión intraabdominal por esfuerzo físico extremo o de la presión intragástrica debida a náuseas y vómito persistentes.
- –
Malposicionamiento. La funduplicatura está intacta sin deslizamiento supradiafragmático del estómago. Podemos observar una imagen en reloj de arena en el esofagograma y la endoscopia.
- –
Formación de una bolsa por debajo de la crura. Se observa la herniación de la funduplicatura a través del diafragma, evidenciándose deformación de la región, angulación pronunciada de los elementos, dificultad al paso del endoscopio y retención del alimento en el esófago.
- –
- 2.
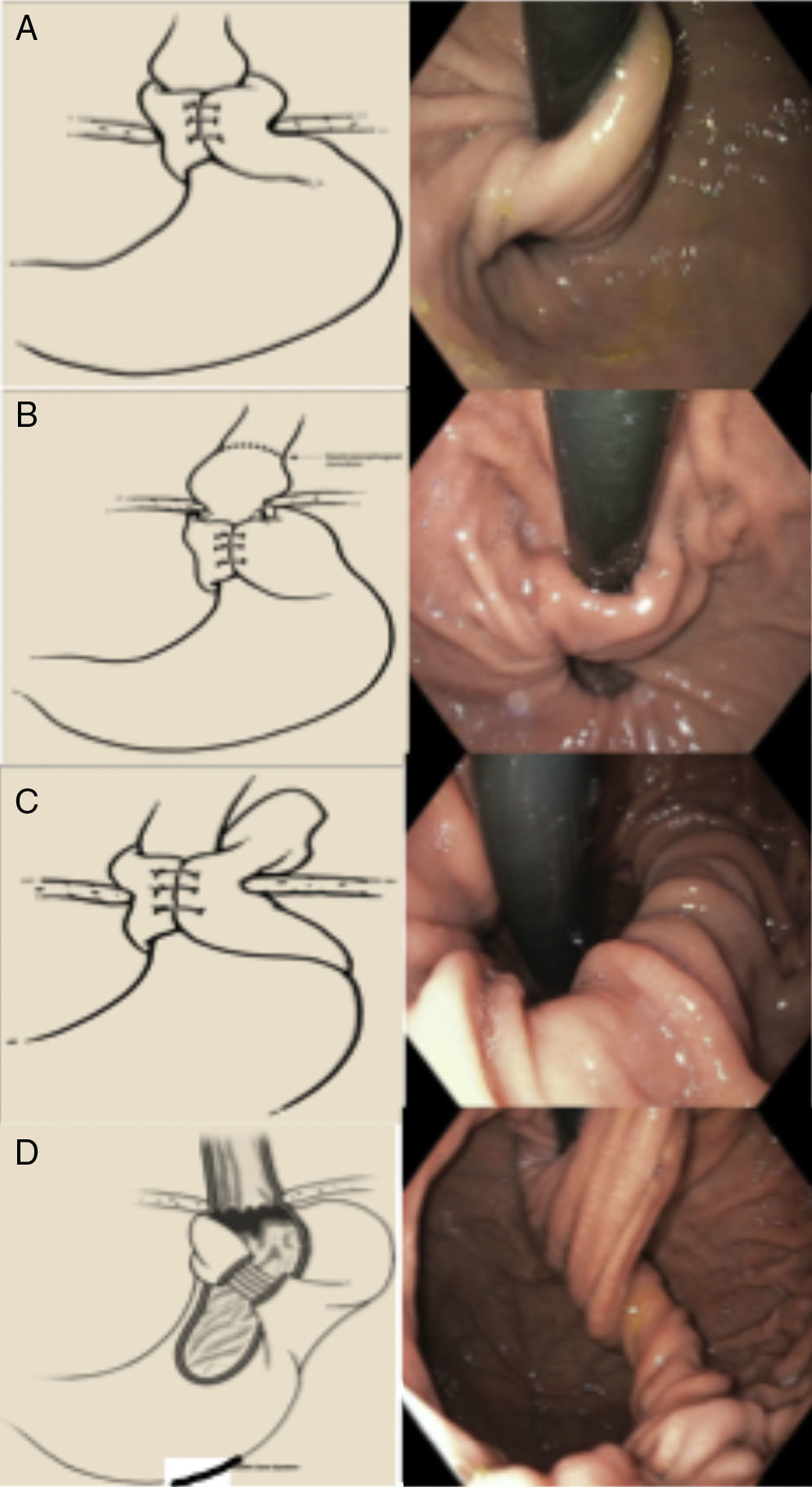
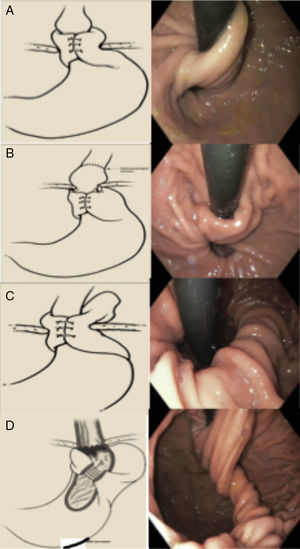
Clasificación de Horgan para la funduplicatura fallida30 (fig. 4):
- –
Tipo I: UEG herniada a través del hiato, con funduplicatura (IA) o sin la funduplicatura (IB).
- –
Tipo II: involucra un componente paraesofágico resultado de una plicatura redundante.
- –
Tipo III: malformación (defecto en la posición o construcción) de la plicatura.
Figura 4.Tipos de funduplicatura fallida (clasificación de Horgan). A) Tipo Ia: hernia sin herniación de la funduplicatura. B) Tipo Ib: con herniación de la funduplicatura. C) Con desplazamiento paraesofágico. D) Defecto en la formación de la plicatura.
Tomado de Horgan y Pellegrini30.
(0,16MB). - –
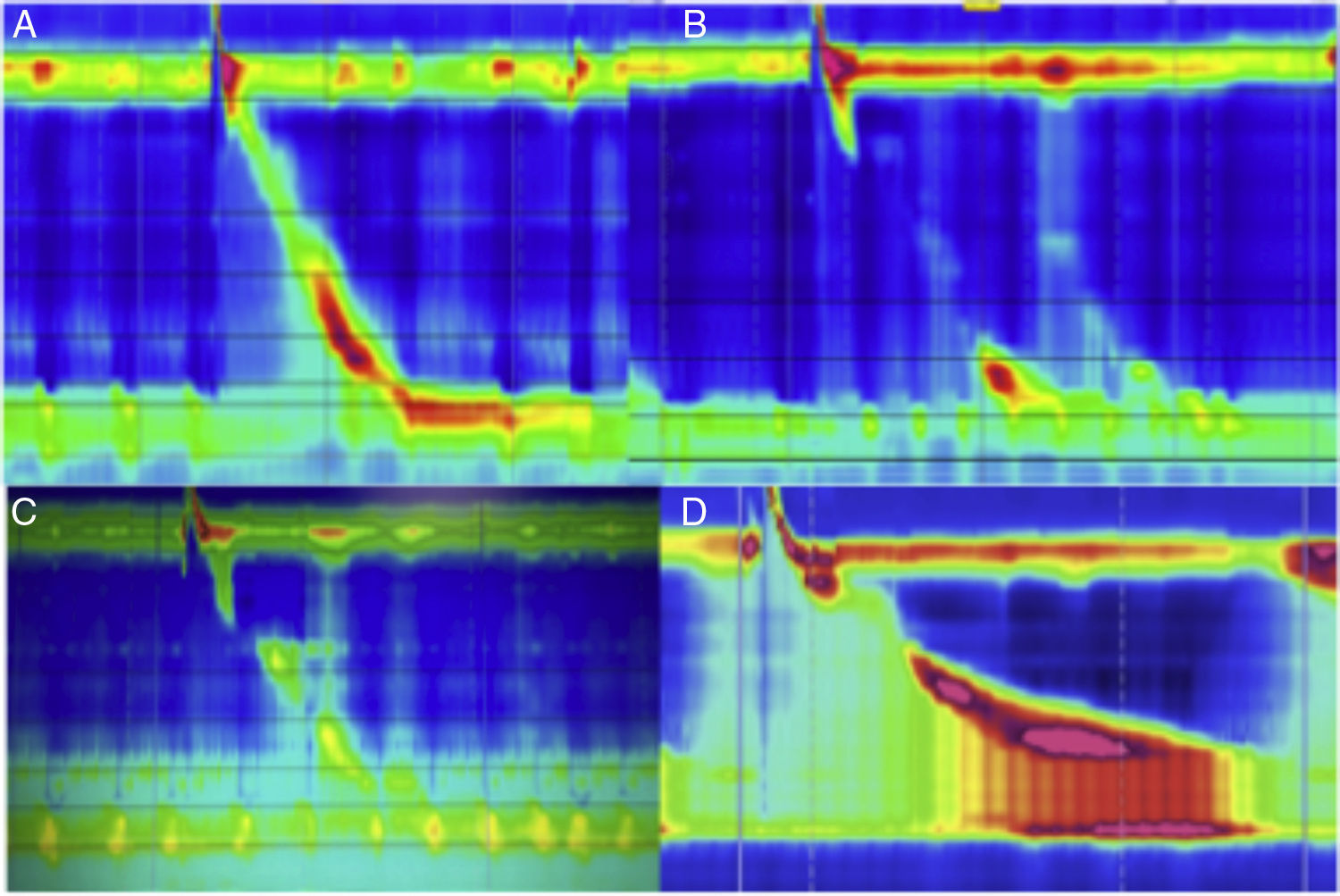
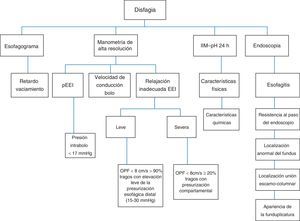
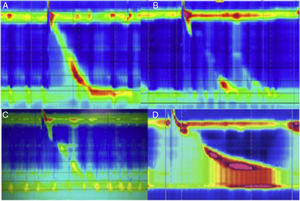
La disfagia puede ser persistente si la funduplicatura está muy apretada o larga, o si el cierre de los pilares del hiato es muy ajustado; otras causas son la angulación excesiva de la UEG, la penetración intraluminal de material protésico (suturas), la torsión del esófago abdominal por mala orientación espacial de la funduplicatura, vólvulo gástrico longitudinal, fibrosis seudotumoral en torno a la UEG, etc. (fig. 5). La MAR se ha vuelto una prueba muy útil para la evaluación de la disfagia postoperatoria (fig. 6), ya que permite evaluar la obstrucción del tracto de salida o la presencia de un inadecuado aclaramiento esofágico (si se realiza con impedanciometría); ambas situaciones no son percibidas o evidentes con estudios convencionales como la endoscopia y el esofagograma.
A) Deglución normal, peristalsis normal con EEI competente en paciente con funduplicatura. B) Deglución normal, peristalsis fallida con EEI incompetente en paciente con funduplicatura. C) Deglución normal, amplitud disminuida y falta de relajación del EEI en paciente con funduplicatura. D) Deglución normal, amplitud aumentada, falta de relajación del EEI y evidente obstrucción del tracto de salida con incremento de la presión intrabolo (frontalización).
La disfagia postoperatoria es mayor en la funduplicatura laparoscópica que en la abierta31. Entre el 6 y el 12% requerirá de dilataciones endoscópicas para paliar la disfagia32. En una serie de casos, 12.4% (29/233) requirieron entre 1 a 5 dilataciones (promedio 1.5) en un tiempo de 3 a 330 días (promedio 72 días), lográndose un diámetro promedio de 18.6mm con respuesta clínica muy variable, dependiendo de la causa, y sin complicaciones graves. La disfagia fue resuelta en el 67% (12 de 18) y 6 fueron reoperados, con resolución sintomática en la mitad de estos casos. Ningún caso mostró mejoría cuando la indicación de la dilatación fue distinta de la disfagia32.
Aunque las dilataciones endoscópicas son el tratamiento más utilizado en el caso de la obstrucción del tracto de salida y la estenosis, no existen guías clínicas sobre dilatación endoscópica en la disfagia posfunduplicatura. Faltan consensos sobre el tipo de dilatadores, el número y la periodicidad de las sesiones, el diámetro máximo óptimo y, sobre todo, una definición universal de éxito clínico. En general, los lineamientos se basan en las guías de manejo para las estenosis benignas. La disfagia secundaria a funduplicatura apretada puede mejorar después de las dilataciones endoscópicas en la mayoría de los casos. La persistencia puede deberse a: 1) disminución de la peristalsis secundaria por efecto de la distensión esofágica, y 2) defectos en la contracción durante el trago. La falla puede deberse no solo a un problema en el acortamiento axial de la capa muscular longitudinal externa, sino además en la contracción de la capa muscular circular interna26.
En una serie retrospectiva se reportó buena respuesta clínica en 9 de 14 (64%) pacientes con disfagia posterior a dilatación neumática con balón (30-40mm); la presión residual más baja del EEI fue el único predictor de éxito y fue mayor entre los respondedores (promedio 10 vs. 5mmHg). Los autores concluyeron que la dilatación neumática es segura y efectiva en la disfagia postoperatoria33.
La cicatrización excesiva, la migración intratorácica, la disrupción de la funduplicatura o del hiato y la estenosis o angulación son causas estructurales que deben ser resueltas a la brevedad, ya que afectarán la calidad de vida e incrementarán el riesgo de complicaciones graves8,34. En estos casos, la dilatación endoscópica no tendrá un efecto benéfico.
La decisión de una nueva cirugía por obstrucción mecánica dependerá de la intensidad de la disfagia, ya que diferirla puede provocar dilatación esofágica, esofagitis por retención, dolor torácico y broncoaspiración. Sin embargo, no existe un tiempo de espera definido; este dependerá de la causa, el grado de malestar, la calidad de vida o el riesgo de complicaciones graves, por lo que habrá de individualizarse en cada caso.
La incidencia de falla posquirúrgica es del 2 al 30%; la frecuencia de hernia paraesofágica posfunduplicatura es del 7%35,36 y la reoperación puede ser necesaria si no hay una buena respuesta clínica. La frecuencia de reoperación es del 4 al 9%; sin embargo, habrá que considerar que la disfagia poscirugía es muy alta (33%)37-39. La migración ascendente de la funduplicatura hacia el tórax puede ser progresiva y pone en peligro la vida del paciente. Otros autores han reportado tasas de reintervención por disfagia persistente entre el 1.8 y el 10.8%40-42.
Otras series informan de que la herniación y la migración son dependientes del tipo de técnica quirúrgica y han sido reportadas en el 0.8 y 26%, respectivamente39. Las indicaciones de revisión quirúrgica (funduplicatura «redo» o «reoperación») más frecuentes fueron41: disfagia (48%), reflujo (33%), hernia paraesofágica (15%) y síntomas atípicos (4%). La falla al tratamiento de reoperación posfunduplicatura de Nissen es de aproximadamente el 10%.
El desmantelamiento de una funduplicatura y rehacerla está indicado si los síntomas están asociados a anormalidades fisiológicas o defectos anatómicos. De igual forma, debe considerarse candidatos a cirugía a aquellos pacientes que no responden adecuadamente a la dilatación endoscópica38. Hasta 46.8% de aquellos con falla de la funduplicatura (recurrencia de la hernia 71.1%) requieren una nueva cirugía o reconstrucción de esta y el éxito de esto puede ser tan alto como el 78 al 96%; sin embargo, la tasa de morbilidad asociada puede ser de hasta el 38%43.
Los principios de una funduplicatura que se reconstruye incluyen la identificación de la UEG, la movilización adecuada del esófago, la protección de los nervios vagos, la reducción completa del contenido de la hernia y la disección adecuada de los pilares del hiato, con la preservación de la fascia muscular44. Es fundamental que el cirujano tenga gran experiencia en reintervenciones quirúrgicas, asesoría o conocimiento de la fisiopatología esofágica.
Es necesario discernir tempranamente en la etapa posquirúrgica mediata (6 meses posteriores) si la falla quirúrgica se debe propiamente a una complicación relativamente «esperada» posterior al procedimiento quirúrgico o si bien se trata de una técnica quirúrgica deficiente desde el principio por inexperiencia del cirujano (360°, 270° o 180°). Para esto, se recomienda rutinariamente llevar a cabo en todo paciente con funduplicatura un estudio de esofagograma contrastado, inicialmente con al menos 50ml de material hidrosoluble a las 72 h posteriores al procedimiento quirúrgico para detectar retraso en el vaciamiento del mismo y, en caso de no existir ninguno, proceder con bario, ya que en este período el tejido involucrado ya se ha desinflamado lo suficiente y de esta simple manera se puede ver y documentar objetivamente la funcionalidad y la pulcritud técnica del procedimiento. De igual forma, se recomienda repetir este procedimiento a los 6 meses posteriores a la cirugía para valorar y documentar la vigencia y la viabilidad funcional del procedimiento. Esta sencilla recomendación permitirá al médico evaluador determinar si el paciente que se encuentra estudiando verdaderamente tiene síntomas incidentes o, en realidad, siempre han sido persistentes por una deficiente técnica.
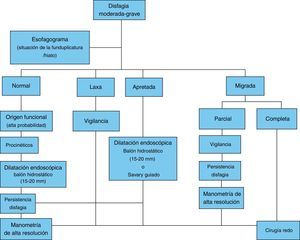
En la figura 7 se propone un algoritmo para el manejo de la disfagia moderada a severa posfunduplicatura.
B. Regurgitaciones. La cirugía antirreflujo mejora significativamente la regurgitación (el 87 al 97%)6; sin embargo, la tasa de recurrencia del síntoma, regurgitación ácida o no ácida, puede alcanzar hasta el 23%5,7. En una serie de casos, la regurgitación fue el síntoma preoperatorio más común asociado al fracaso del tratamiento médico (54%)45. La presencia de este síntoma debe hacer pensar en disfunción y/o falla secundaria a alteraciones estructurales descritas en el apartado anterior46-52.
C. Pirosis. Se ha establecido que la cirugía antirreflujo debe considerarse solo si existe una clara asociación entre la pirosis y la exposición al ácido previa a la intervención43,44. En una serie de casos, la ERGE cuyos síntomas se asociaron al ácido fue la indicación más común (88%) para cirugía antirreflujo y la mejoría fue del 82%, con satisfacción a la cirugía en el 94% de los casos45. A pesar de la mejoría significativa de la pirosis, la tasa de recurrencia es mayor al 10%53. Se ha indicado que un índice de síntomas positivo con pH-IIM en pacientes con IBP puede predecir una favorable respuesta al tratamiento médico o quirúrgico. Los eventos de reflujo de gas débilmente ácido pueden producir distensión del esófago proximal, generando síntomas en los pacientes con funduplicatura. El esófago proximal es más sensible a la estimulación química y mecánica en comparación con el esófago distal. Woodland y Sifrim54 reportaron que los nervios aferentes de la mucosa proximal se localizan más superficialmente, lo cual puede tener implicaciones fisiológicas (prevención de la aspiración de el reflujo gastroesofágico) y patológicas (percepción de reflujo o disfagia). El reflujo de gas puro asociado con descenso del pH («vapor de ácido») puede ser percibido como pirosis y regurgitación. La falla al IBP como a la cirugía pueden deberse a una mala clasificación de la enfermedad, aunque alrededor del 20% (15-27%) de aquellos correctamente diagnosticados no responderán a IBP o cirugía2,51,52,55.
D. Dolor torácico. Este es uno de los síntomas más frecuentes de disfunción post-funduplicatura. Es indistinguible del dolor isquémico del corazón y requiere del diagnóstico diferencial razonable que haya excluido una causa cardiaca. En pacientes no operados el origen puede ser por ERGE, dismotilidad o hipersensibilidad, el dolor esofágico que se presenta posterior a la cirugía puede ser inducido por distensión mecánica, exposición al ácido, temperatura y estímulos relacionados con la osmolaridad. En ausencia de ácido, las posibles explicaciones sobre la génesis de los síntomas son: a) estímulos químicos (reflujo débilmente ácido, bilis y enzimas proteolíticas) que pueden activar los quimiorreceptores de la mucosa, b) estímulos mecánicos (distensión o contracción) debido a la activación de los mecanorreceptores en la pared esofágica por liquido o gas que producen cambios reactivos sobre las capas musculares circular (interna) y longitudinal (externa); y c) hipersensibilidad periférica y central55-59.
E. Síndrome de la burbuja o distensión por gas. En este síndrome se incluye un grupo mal definido de malestares asociados a la incapacidad para ventilar gas desde el estómago hacia el esófago después de la funduplicatura. Los síntomas son distensión abdominal (subjetiva), incapacidad para eructar, llenura posprandial, náuseas, flatulencia, incapacidad para vomitar y dolor epigástrico.
Es más prevalente en la funduplicatura completa tipo Nissen que en la parcial tipo Toupet (31.19% vs. 23.91%, RR 1.31, IC del 95% [1.05, 1.65], p=0.02). La incapacidad para eructar es más prevalente en la funduplicatura completa (14.9% vs. 8.4%; RR 1.79, IC del 95% [1.06, 3.03], p=0.03). Se ha reportado el síndrome de la burbuja en 18.64%/10.34%, flatulencia en 74.58% y 67.24%, y epigastralgia en 25.42%/31.03% después de la cirugía antirreflujo completa y parcial, respectivamente60.
En una serie de 1,063 pacientes operados, 101 (9,5%) refirieron insatisfacción después del procedimiento, siendo el síndrome de la burbuja la causa más frecuente de malestar en postoperatorio a un año (59%)61.
La causa del síndrome es poco clara, pero los mecanismos propuestos incluyen: 1) la incapacidad de la UEG para relajarse en respuesta a la distensión gástrica; 2) aerofagia, un hábito frecuente entre los pacientes con ERGE severo, la cual se vuelve problemático después de funduplicatura cuando el aire no puede ser ventilado; 3) a la alteración en relajación receptiva y acomodación en respuesta al alimento con rápido vaciamiento gástrico, y 4) una lesión quirúrgica en el nervio vago, que retrasa el vaciado gástrico e interfiere con la relajación transitoria.
Las terapias recomendadas, aunque sin evidencia convincente de su eficacia, incluyen: 1) modificaciones en la dieta, evitando alimentos productores de gas y las bebidas carbonatadas; 2) comer más lento para evitar la aerofagia; 3) suspender del tabaco; 4) usar agentes reductores de gas, tal como simeticona, y 5) fármacos procinéticos62.
Síntomas gastroduodenalesA. Síntomas dispépticos. Los síntomas dispépticos se presentan en la mayoría de los pacientes con funduplicatura. Después de la cirugía, la plenitud, la distensión abdominal y la saciedad temprana se desarrollarán en más del 30% de los pacientes y solo algunos desarrollarán una disfunción gástrica severa (gastroparesia)63. Los síntomas dispépticos posfunduplicatura son el resultado de cambios en la función sensorial y motora del estómago proximal, pero también son resultado de la técnica de funduplicatura y no necesariamente de una la lesión vagal64,65. El reflejo de acomodación es un mecanismo importante de la fisiología gástrica66. En la dispepsia funcional, es el mecanismo fisiopatológico responsable de los síntomas en el 40% de los casos, pero también en trastornos gastrointestinales superiores, como gastropatía diabética y síndrome posfunduplicatura. El reflejo de acomodación gástrica permite el almacenamiento temporal de los alimentos antes de su paso controlado hacia el intestino. Este reflejo está compuesto de una reducción en el tono y un aumento en la capacitancia gástrica en respuesta a la ingesta de alimentos, lo cual aumentará el volumen sin incremento de la presión intragástrica. En condiciones fisiológicas, esta relajación adaptativa no es percibida67. La alteración en la acomodación produce una disfunción del sistema nervioso autónomo. La disfunción aferente incrementa la percepción al estímulo visceral (fisiológico o nocivo) debida a impulsos vagales que estimulan las neuronas nitrérgicas68-70. La funduplicatura de Nissen ha sido asociada con más alteraciones en la acomodación gástrica. Los síntomas son de mayor intensidad cuando se realiza una funduplicatura de 360° comparada con la de 180°. Lindeboom et al.67 demostraron que la relajación fúndica máxima se reduce significativamente en pacientes que se someten a una funduplicatura completa (p<0.01) y esto tiene una correlación positiva entre la duración de la cirugía y el grado de relajación fúndica (r=0.67; p<0.001). Los pacientes diabéticos y aquellos con funduplicatura tendrán más alteraciones de la acomodación gástrica68. La alteración de la acomodación alterada («disfunción diastólica») puede asociarse a disfunción del sistema nervioso autónomo. La disfunción aferente o «estómago irritable» incrementa la percepción al estímulo visceral (fisiológico o nocivo) debida a impulsos vagales que estimulan las neuronas nitrérgicas69,70.
Por otra parte, cuando se documenta el retraso del vaciamiento gástrico, la causa más probable como mecanismo fisiopatológico de los síntomas dispépticos es la lesión del nervio vago.
B. Gastroparesia. Desde el punto de vista clínico, a veces es muy difícil distinguir la dispepsia de la gastroparesia. Esta última pudiera considerarse la etapa final o la expresión máxima de los síntomas dispépticos y clínicamente se caracteriza por la presencia de náuseas y vómitos de muy difícil manejo. Para establecer el diagnóstico es necesario documentar retraso en el vaciamiento gástrico con alguna de las técnicas disponibles, como gammagrafía con radionúclidos a 4 h, píldora inteligente (smart pill) o pruebas de aliento71. La gastroparesia posfunduplicatura es secundaria a vagotomía o lesión del nervio vago. La saciedad temprana en el 88% y la distensión abdominal/flatulencia en el 64% son los síntomas más comunes en los primeros 3 meses del postoperatorio y tienen una tasa de resolución sintomática a un año mayor del 90%72-75. El tratamiento médico inicial debe encaminarse a la restauración de fluidos y electrolitos, apoyo nutricional y evitar la pérdida de peso. Si la ingesta oral es insuficiente, la alimentación enteral por sonda de yeyunostomía deberá usarse72. Si bien se pueden utilizar procinéticos (como en el caso de la gastroparesia diabética o idiopática), la evidencia que demuestre la resolución de los síntomas es muy escasa. Los procinéticos a utilizarse deben seleccionarse sobre la base de su perfil de seguridad e interacciones medicamentosas, e incluyen: domperidona, itoprida, metoclopramida, levosulpirida y eritromicina, entre otros76-79. Aunque se ha descrito el uso de toxina botulínica para gastroparesia diabética e idiopática, se desconoce su efectividad en los casos de gastroparesia posfunduplicatura. Esto mismo sucede con el uso del marcapasos gástrico (Enterra therapy, Medtronic, Inc, Minneapolis, MN). En casos extremos, la gastrectomía subtotal puede indicarse, sobre todo si existen síntomas refractarios y pérdida de peso que condicione desnutrición severa80-83.
Manifestaciones extraesofágicasSe desconoce la frecuencia de manifestaciones extraesofágicas (tos, laringitis, asma, ataques de ansiedad, alteraciones del sueño) posteriores a una funduplicatura84,85. Sin embargo, se asume que la aparición o reaparición de estas, al igual que la pirosis y las regurgitaciones, son indicadores de falla o disfunción del procedimiento. Cuando los síntomas extraesofágicos aparecen de novo en el postoperatorio, se sugiere la pH24h con impedancia con la finalidad de documentar existencia y asociación de los síntomas con reflujo (ácido o no ácido).
Además de las manifestaciones laríngeas, una gama muy amplia de síntomas (arritmia, trastornos del sueño, ataques de ansiedad, etc.) puede manifestarse con una frecuencia variable a lo largo del postoperatorio, sin existir una evidente causa que explique su aparición. Estos síntomas pueden asociarse a disautonomía preexistente no documentada o bien simplemente a que la inervación del esófago y el corazón tiene el mismo origen embriológico. Estas manifestaciones generalmente son subestimadas y su etiología es atribuida a problemas gastrointestinales primarios. Las alteraciones del ritmo cardiaco relacionadas con la deglución son muy frecuentes en los sujetos con ERGE, dispepsia o con cirugía antirreflujo. En la disfunción esofágica postoperatoria, sin evidencia de trastorno motor del esófago previo, las arritmias pueden ser desencadenadas por la distensión esofágica durante la ingesta de alimentos secos o voluminosos, o de bebidas frías y/o carbonatadas, e incluso después del eructo, probablemente secundarias a la obstrucción funcional al bolo. La arritmia puede ser reproducida experimentalmente durante la deglución de alimentos o con la insuflación del balón dentro del esófago86-88.
El mecanismo detrás de síncope posdeglución es la estimulación de los mecanorreceptores hipersensibles de la pared del esófago que provoca distensión a través de un reflejo vaso-vagal autonómico que resulta en un efecto cronotrópico negativo mediado parasimpáticamente. Otro mecanismo propuesto es la estimulación simpática seguida de vasodilatación colinérgica o liberación de vasodilatadores que incrementan inicialmente la presión arterial, seguida de una hipotensión profunda y finalmente bradicardia. El mecanismo desencadenante de las taquiarritmias provocadas por la deglución es menos claro. Sin embargo, se cree que los latidos ectópicos auriculares pueden desencadenar las taquicardias aurículo-ventriculares. Cuando ocurren en presencia de bloqueo aurículo-ventricular, la automaticidad aumentada puede ser el mecanismo detrás de la arritmia86-88.
La hipótesis más aceptada es que el mecanismo iniciador es un reflejo neural resultante de la estimulación autonómica. El aumento en el tono vagal puede paradójicamente causar taquicardia; es plausible que los mecanismos mediados por el parasimpático están involucrados en todas las arritmias asociadas a la deglución; provocando bradicardia en algunos casos y taquicardia en otros88.
ConclusionesLas complicaciones asociadas a la funduplicatura para el tratamiento de la ERGE son frecuentes, aunque en su mayoría son leves y transitorias. Un grupo menor de pacientes tendrá persistencia, recurrencia o la aparición de nuevos síntomas. La frecuencia de síntomas incidentes será diferente debido a que existen diversas técnicas de funduplicatura (Nissen 360°, 180°, Toupet, Hill, etc.), lo que conlleva a una durabilidad variable de su efectividad en el tiempo. La aparición de nuevos síntomas puede ser desencadenada por la cirugía en afecciones no detectadas con anterioridad. Por ello, la evaluación preoperatoria es fundamental para decidir el tipo de procedimiento quirúrgico. El seguimiento deberá ser sistemático, con radiología de contraste en tiempos específicos, como el período de resolución del edema para todos los casos, e individualizarse de acuerdo con la durabilidad de la intervención (efectividad). El adecuado abordaje de diagnóstico y de tratamiento permitirá mejorar la calidad de vida en el paciente con síntomas incidentes después de la cirugía. Consideramos que hacen falta estudios que describan el comportamiento y los mecanismos fisiopatológicos de las diferentes complicaciones extraesofágicas relacionadas con la falla de la funduplicatura. Además de la carencia de guías para el seguimiento y la definición del tiempo de respuesta a un determinado tratamiento para tomar la decisión de una reintervención quirúrgica.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este estudio.
Conflicto de interesesSergio Sobrino-Cossío es miembro del Consejo Asesor de Takeda Pharmaceuticals. Ponente para Takeda.
Julio César Soto-Pérez. Ponente para Takeda.
Gualberto Mateos Pérez es miembro del Consejo Asesor de Takeda Pharmaceuticals. Ponente para Takeda.
Óscar Teramoto Matsubara es miembro del Consejo Asesor de Takeda Pharmaceuticals. Ponente para Takeda.
Miguel Morales Arámbula es miembro del Consejo Asesor de Takeda Pharmaceuticals. Ponente para Takeda.
Adolfo Sáez Ríos trabaja en Takeda Pharmaceuticals (Medical Marketing Manager).
José Antonio Vargas Romero trabaja en Endo Pharmaceuticals-Grupo SOMAR (director médico).
Enrique Coss-Adame es ponente de Laboratorios Takeda de México. Ha sido consultante y colabora con Laboratorios Asofarma de México.
José Tawil, Manuel Vallejo Soto, Ángel Mario Zárate-Guzmán, Elymir Galvis García, José Antonio Carrasco Rojas y Óscar Quiroz Castro no tienen conflictos de interés.
José María Remes-Troche es miembro del Consejo Asesor de Takeda Pharmaceuticals, Alfa-Wassermann, Asofarma y Almirall. Ponente para Takeda, Asofarma, Alfa-Wassermann, Almirall y Astra-Zeneca.