Esta revisión de la Asociación Mexicana de Gastroenterología sobre edulcorantes no calóricos (ENC) se realizó con el fin de analizar y responder a través de una amplia revisión bibliográfica, algunas de las preguntas y preocupaciones más frecuentes sobre la ingestión de ENC en pacientes con alteraciones gastrointestinales. Un grupo de gastroenterólogos, expertos en nutrición, toxicología, microbiología y endocrinología, revisó y analizó la literatura publicada en este tópico. El grupo de trabajo generó conclusiones basadas en la evidencia científica publicada para emitir una opinión respecto a su ingestión. En este sentido, la evidencia existente hasta el día de hoy no confirma el potencial carcinogénico de los ENC; sin embargo, los estudios evaluados mostraron que la sacarina podría tener un efecto proinflamatorio y los polioles pueden causar síntomas y manifestaciones gastrointestinales dependiendo del tipo y dosis del compuesto. La ingestión de xilitol, eritritol, sucralosa, aspartame, acesulfame K y sacarina podrían incrementar la secreción de hormonas gastrointestinales reguladoras de la motilidad intestinal. Los glucósidos de esteviol podrían tener un efecto favorable en el porcentaje de grasa hepática. Se debe tener precaución en la recomendación de la ingestión de aspartame en pacientes con hepatopatía crónica debido a que disminuye la relación entre aminoácidos de cadena ramificada y aromáticos. Además, la ingestión de ENC podría modificar la composición de la microbiota intestinal y esto tener efectos sobre los síntomas y manifestaciones gastrointestinales. Es importante que se continúe realizando estudios de causalidad en humanos para poder establecer recomendaciones sobre la ingestión de ENC.
The present review of noncaloric sweeteners (NCSs) by the Asociación Mexicana de Gastroenterología was carried out to analyze and answer some of the most frequent questions and concerns about NCS consumption in patients with gastrointestinal disorders, through a thorough review of the medical literature. A group of gastroenterologists and experts on nutrition, toxicology, microbiology, and endocrinology reviewed and analyzed the published literature on the topic. The working group formulated conclusions, based on the scientific evidence published, to give an opinion with respect to NCS ingestion. Current evidence does not confirm the carcinogenic potential of NCSs. However, the studies analyzed showed that saccharin could have a proinflammatory effect and that polyols can cause gastrointestinal symptoms and manifestations, depending on the dose and type of compound. The ingestion of xylitol, erythritol, sucralose, aspartame, acesulfame K, and saccharin could increase the secretion of the gastrointestinal hormones that regulate intestinal motility, and stevia and its derivatives could have a favorable effect on the percentage of liver fat. Caution should be taken in recommending aspartame consumption in patients with chronic liver disease because it reduces the ratio of branched-chain amino acids to aromatic amino acids. In addition, NCS ingestion could modify the composition of the intestinal microbiota, having an effect on gastrointestinal symptoms and manifestations. It is important to continue conducting causality studies on humans to be able to establish recommendations on NSC consumption.
Los hidratos de carbono (HCO) constituyen una parte importante y necesaria en la alimentación. De acuerdo con la Food and Agriculture Organization1, la ingestión de HCO debe oscilar entre un 45 y 60% de la energía diaria en adultos y niños mayores de un año. Una parte importante de los HCO disponibles en los alimentos la componen los monosacáridos y disacáridos, comúnmente denominados azúcares. Los requerimientos de estos en la dieta se cubren principalmente con frutas, jugos de fruta, verduras, productos lácteos, cereales y alimentos que pudieran contener esos azúcares añadidos e hidrolizados de almidón2. El consumo de alimentos con alto contenido de HCO ha aumentado a nivel mundial, además se han relacionado con enfermedades como el síndrome metabólico (SM), las enfermedades cardiovasculares y la diabetes mellitus (DM) tipo 2. Por este motivo, han surgido nuevos ingredientes para aportar a los alimentos el mismo sabor dulce, pero sin los efectos atribuidos a los azúcares como los edulcorantes no calóricos (ENC); actualmente estos son ampliamente utilizados en la formulación de alimentos y bebidas, principalmente por su bajo o nulo aporte calórico, bajo costo y elevado poder edulcorante respecto a la sacarosa (azúcar de mesa) u otros edulcorantes calóricos3,4. Los ENC fueron introducidos en la industria de los alimentos hace más de 100 años y han ido ganando popularidad debido a la percepción de beneficios para la salud como reducción de peso y mejora de las concentraciones de glucosa en sangre5.
Dentro de la industria de los alimentos, existen diferentes ENC utilizados de forma regular dependiendo de la normatividad de cada país; sin embargo, la Food and Drug Administration (FDA) ha aprobado seis ENC; sacarina, aspartame, neotame, acesulfame K, sucralosa y advantame; y dos generalmente reconocidos como seguros (GRAS, por sus siglas en inglés), estevia y luo han guo6. Cada uno de ellos tiene diferente poder edulcorante, fórmula química y metabolismo asociados a síntomas y manifestaciones gastrointestinales como se muestran en la tabla 13,6.
Principales ENC existentes en el mercado, poder edulcorante, fuentes y característica de interés en la producción de síntomas y manifestaciones gastrointestinales
| Edulcorantes | Características principales |
|---|---|
| Sacarina | Tiene sabor amargo o metálico, se usa como sal de sodio o calcio y es 200 a 700 veces más dulce que la sacarosa |
| Aspartame | Es un éster metílico de un dipéptido (ácido aspártico y fenilalanina), que bajo condiciones muy ácidas o alcalinas puede generar metanol por hidrólisis y es 200 veces más dulce que la sacarosa |
| Neotame | Es un derivado del compuesto dipeptídico de ácido aspártico y fenilalanina, de 7,000 a 13,000 veces más dulce que la sacarosa |
| Acesulfame K | Es una sal de potasio, cristalina, 200 veces más dulce que la sacarosa |
| Sucralosa | Se absorbe del 11 al 27% y el resto permanece en el tracto gastrointestinal hasta su excreción en heces, 600 veces más dulce que la sacarosa |
| Advantame | Es 20,000 veces más dulce que la sacarosa |
| Stevia | Es un edulcorante de origen natural, estable al calor y 200 a 400 veces más dulce que la sacarosa |
| Luo han guo | Es 100 a 250 veces más dulce que la sacarosa |
| Polioles(xilitol, manitol sorbitol, maltitol) | Son alcoholes de cuatro carbonos de azúcar, producto de la fermentación de glucosa y sacarosa, poco digeribles y de elevado potencial osmótico de la luz intestinal, 60 a 80% más dulce que la sacarosa |
Para la aprobación de cada ENC la FDA requiere diversos estudios para establecer la cantidad aceptable y segura para su ingestión denominada ingestión diaria aceptable (IDA) (tabla 2), esto se establece a través de estudios de toxicidad en diversas especies animales durante las diferentes etapas de la vida y en varias generaciones, así como también la capacidad de absorción, digestión, metabolismo y excreción en humanos6,7.
Ingestión diaria aceptable de cada edulcorante aprobado por la FDA
| Edulcorante | IDA |
|---|---|
| Sacarina | 5 mg/ kg de peso corporal |
| Ciclamato | 7 mg/ kg de peso corporal |
| Aspartamo | 50 mg/ kg de peso corporal |
| Sucralosa | 15 mg/ kg de peso corporal |
| Acesulfame K | 15 mg/ kg de peso corporal |
| Estevia | 4 mg/ kg de peso corporal |
FDA: Food and Drug Administration; IDA: ingestión diaria aceptable.
Fuente: FDA8.
En la actualidad, la ingestión de estos ENC ha aumentado en población con DM y personas sanas como resultado del cambio en el estilo de vida a nivel mundial, específicamente en aquellos países que llevan una dieta occidental. Por lo anterior, cada vez es más frecuente encontrarlos en alimentos y bebidas; y no necesariamente etiquetados como bajos en calorías o adicionado con ENC8. Un ejemplo de esto es Estados Unidos de América, donde recientemente se publicó un estudio, el cual mostró que del 2005 al 2009 el 15% del volumen de producción de alimentos y bebidas contiene ENC y esta cifra ha ido aumentando paulatinamente9.
No obstante, algunos estudios han relacionado la ingestión de los ENC con el aumento del riesgo de obesidad, SM y DM tipo 2; sin embargo, debido a la complejidad de su evaluación en humanos, son pocos los ensayos clínicos aleatorizados que han evaluado su efecto en la salud, por lo que la mayoría de los estudios han sido cuestionados en su metodología5,10–18.
Específicamente, los estudios en microbiota intestinal han sido los más controversiales dada su diversidad dependiente de las diferentes condiciones del huésped y su interacción con la dieta, por lo anterior la mayoría de las mediciones se han realizado a través de la asociación del microbioma (genoma de la microbiota), la presencia de los ENC en el colon y las posibles manifestaciones clínicas19,20. Además, los ENC que no se absorben en su totalidad en intestino delgado, podrían generar alteraciones en la microbiota intestinal modificando el equilibrio bacteriano21, lo cual podría desencadenar cambios en el hábito y motilidad intestinal, generando aumento de manifestaciones gastrointestinales en pacientes con alguna enfermedad gastrointestinal22.
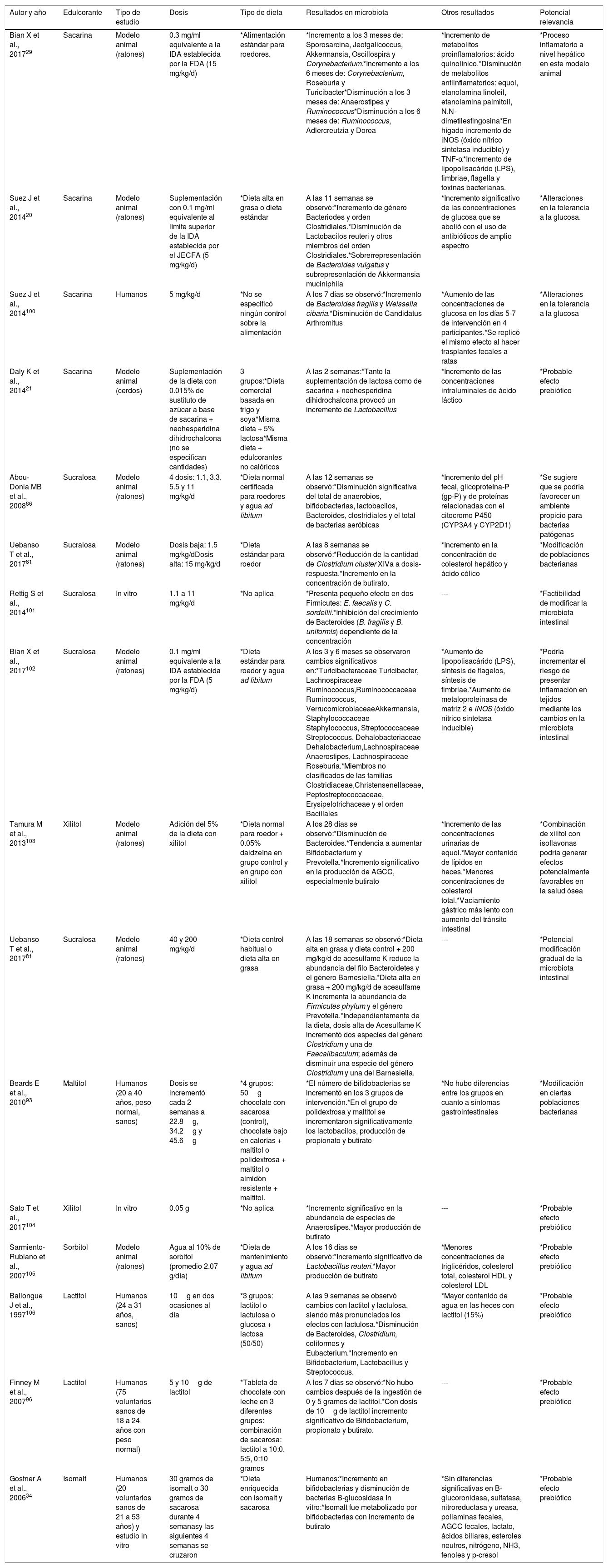
Por lo anterior, el objetivo de este trabajo fue emitir una opinión de expertos respecto al efecto de la ingestión de ENC sobre la salud gastrointestinal en función a la evidencia científica publicada a través de una revisión exhaustiva de la literatura existente (tabla 3).
Sistematización de la bibliografía utilizada para el estudio
| Autor y año | Edulcorante | Tipo de estudio | Dosis | Tipo de dieta | Resultados en microbiota | Otros resultados | Potencial relevancia |
|---|---|---|---|---|---|---|---|
| Bian X et al., 201729 | Sacarina | Modelo animal (ratones) | 0.3 mg/ml equivalente a la IDA establecida por la FDA (15 mg/kg/d) | *Alimentación estándar para roedores. | *Incremento a los 3 meses de: Sporosarcina, Jeotgalicoccus, Akkermansia, Oscillospira y Corynebacterium.*Incremento a los 6 meses de: Corynebacterium, Roseburia y Turicibacter*Disminución a los 3 meses de: Anaerostipes y Ruminococcus*Disminución a los 6 meses de: Ruminococcus, Adlercreutzia y Dorea | *Incremento de metabolitos proinflamatorios: ácido quinolínico.*Disminución de metabolitos antiinflamatorios: equol, etanolamina linoleil, etanolamina palmitoil, N,N-dimetilesfingosina*En hígado incremento de iNOS (óxido nítrico sintetasa inducible) y TNF-α*Incremento de lipopolisacárido (LPS), fimbriae, flagella y toxinas bacterianas. | *Proceso inflamatorio a nivel hepático en este modelo animal |
| Suez J et al., 201420 | Sacarina | Modelo animal (ratones) | Suplementación con 0.1 mg/ml equivalente al límite superior de la IDA establecida por el JECFA (5 mg/kg/d) | *Dieta alta en grasa o dieta estándar | A las 11 semanas se observó:*Incremento de género Bacteriodes y orden Clostridiales.*Disminución de Lactobacilos reuteri y otros miembros del orden Clostridiales.*Sobrerrepresentación de Bacteroides vulgatus y subrepresentación de Akkermansia muciniphila | *Incremento significativo de las concentraciones de glucosa que se abolió con el uso de antibióticos de amplio espectro | *Alteraciones en la tolerancia a la glucosa. |
| Suez J et al., 2014100 | Sacarina | Humanos | 5 mg/kg/d | *No se especificó ningún control sobre la alimentación | A los 7 días se observó:*Incremento de Bacteroides fragilis y Weissella cibaria.*Disminución de Candidatus Arthromitus | *Aumento de las concentraciones de glucosa en los días 5-7 de intervención en 4 participantes.*Se replicó el mismo efecto al hacer trasplantes fecales a ratas | *Alteraciones en la tolerancia a la glucosa |
| Daly K et al., 201421 | Sacarina | Modelo animal (cerdos) | Suplementación de la dieta con 0.015% de sustituto de azúcar a base de sacarina + neohesperidina dihidrochalcona (no se especifican cantidades) | 3 grupos:*Dieta comercial basada en trigo y soya*Misma dieta + 5% lactosa*Misma dieta + edulcorantes no calóricos | A las 2 semanas:*Tanto la suplementación de lactosa como de sacarina + neohesperidina dihidrochalcona provocó un incremento de Lactobacillus | *Incremento de las concentraciones intraluminales de ácido láctico | *Probable efecto prebiótico |
| Abou-Donia MB et al., 200886 | Sucralosa | Modelo animal (ratones) | 4 dosis: 1.1, 3.3, 5.5 y 11 mg/kg/d | *Dieta normal certificada para roedores y agua ad libitum | A las 12 semanas se observó:*Disminución significativa del total de anaerobios, bifidobacterias, lactobacilos, Bacteroides, clostridiales y el total de bacterias aeróbicas | *Incremento del pH fecal, glicoproteína-P (gp-P) y de proteínas relacionadas con el citocromo P450 (CYP3A4 y CYP2D1) | *Se sugiere que se podría favorecer un ambiente propicio para bacterias patógenas |
| Uebanso T et al., 201781 | Sucralosa | Modelo animal (ratones) | Dosis baja: 1.5 mg/kg/dDosis alta: 15 mg/kg/d | *Dieta estándar para roedor | A las 8 semanas se observó:*Reducción de la cantidad de Clostridium cluster XIVa a dosis-respuesta.*Incremento en la concentración de butirato. | *Incremento en la concentración de colesterol hepático y ácido cólico | *Modificación de poblaciones bacterianas |
| Rettig S et al., 2014101 | Sucralosa | In vitro | 1.1 a 11 mg/kg/d | *No aplica | *Presenta pequeño efecto en dos Firmicutes: E. faecalis y C. sordellii.*Inhibición del crecimiento de Bacteroides (B. fragilis y B. uniformis) dependiente de la concentración | --- | *Factibilidad de modificar la microbiota intestinal |
| Bian X et al., 2017102 | Sucralosa | Modelo animal (ratones) | 0.1 mg/ml equivalente a la IDA establecida por la FDA (5 mg/kg/d) | *Dieta estándar para roedor y agua ad libitum | A los 3 y 6 meses se observaron cambios significativos en:*Turicibacteraceae Turicibacter, Lachnospiraceae Ruminococcus,Ruminococcaceae Ruminococcus, VerrucomicrobiaceaeAkkermansia, Staphylococcaceae Staphylococcus, Streptococcaceae Streptococcus, Dehalobacteriaceae Dehalobacterium,Lachnospiraceae Anaerostipes, Lachnospiraceae Roseburia.*Miembros no clasificados de las familias Clostridiaceae,Christensenellaceae, Peptostreptococcaceae, Erysipelotrichaceae y el orden Bacillales | *Aumento de lipopolisacárido (LPS), síntesis de flagelos, síntesis de fimbriae.*Aumento de metaloproteinasa de matriz 2 e iNOS (óxido nítrico sintetasa inducible) | *Podría incrementar el riesgo de presentar inflamación en tejidos mediante los cambios en la microbiota intestinal |
| Tamura M et al., 2013103 | Xilitol | Modelo animal (ratones) | Adición del 5% de la dieta con xilitol | *Dieta normal para roedor + 0.05% daidzeína en grupo control y en grupo con xilitol | A los 28 días se observó:*Disminución de Bacteroides.*Tendencia a aumentar Bifidobacterium y Prevotella.*Incremento significativo en la producción de AGCC, especialmente butirato | *Incremento de las concentraciones urinarias de equol.*Mayor contenido de lípidos en heces.*Menores concentraciones de colesterol total.*Vaciamiento gástrico más lento con aumento del tránsito intestinal | *Combinación de xilitol con isoflavonas podría generar efectos potencialmente favorables en la salud ósea |
| Uebanso T et al., 201781 | Sucralosa | Modelo animal (ratones) | 40 y 200 mg/kg/d | *Dieta control habitual o dieta alta en grasa | A las 18 semanas se observó:*Dieta alta en grasa y dieta control + 200 mg/kg/d de acesulfame K reduce la abundancia del filo Bacteroidetes y el género Barnesiella.*Dieta alta en grasa + 200 mg/kg/d de acesulfame K incrementa la abundancia de Firmicutes phylum y el género Prevotella.*Independientemente de la dieta, dosis alta de Acesulfame K incrementó dos especies del género Clostridium y una de Faecalibaculum; además de disminuir una especie del género Clostridium y una del Barnesiella. | --- | *Potencial modificación gradual de la microbiota intestinal |
| Beards E et al., 201093 | Maltitol | Humanos (20 a 40 años, peso normal, sanos) | Dosis se incrementó cada 2 semanas a 22.8g, 34.2g y 45.6g | *4 grupos: 50g chocolate con sacarosa (control), chocolate bajo en calorías + maltitol o polidextrosa + maltitol o almidón resistente + maltitol. | *El número de bifidobacterias se incrementó en los 3 grupos de intervención.*En el grupo de polidextrosa y maltitol se incrementaron significativamente los lactobacilos, producción de propionato y butirato | *No hubo diferencias entre los grupos en cuanto a síntomas gastrointestinales | *Modificación en ciertas poblaciones bacterianas |
| Sato T et al., 2017104 | Xilitol | In vitro | 0.05 g | *No aplica | *Incremento significativo en la abundancia de especies de Anaerostipes.*Mayor producción de butirato | --- | *Probable efecto prebiótico |
| Sarmiento-Rubiano et al., 2007105 | Sorbitol | Modelo animal (ratones) | Agua al 10% de sorbitol (promedio 2.07 g/día) | *Dieta de mantenimiento y agua ad libitum | A los 16 días se observó:*Incremento significativo de Lactobacillus reuteri.*Mayor producción de butirato | *Menores concentraciones de triglicéridos, colesterol total, colesterol HDL y colesterol LDL | *Probable efecto prebiótico |
| Ballongue J et al., 1997106 | Lactitol | Humanos (24 a 31 años, sanos) | 10g en dos ocasiones al día | *3 grupos: lactitol o lactulosa o glucosa + lactosa (50/50) | A las 9 semanas se observó cambios con lactitol y lactulosa, siendo más pronunciados los efectos con lactulosa.*Disminución de Bacteroides, Clostridium, coliformes y Eubacterium.*Incremento en Bifidobacterium, Lactobacillus y Streptococcus. | *Mayor contenido de agua en las heces con lactitol (15%) | *Probable efecto prebiótico |
| Finney M et al., 200796 | Lactitol | Humanos (75 voluntarios sanos de 18 a 24 años con peso normal) | 5 y 10g de lactitol | *Tableta de chocolate con leche en 3 diferentes grupos: combinación de sacarosa: lactitol a 10:0, 5:5, 0:10 gramos | A los 7 días se observó:*No hubo cambios después de la ingestión de 0 y 5 gramos de lactitol.*Con dosis de 10g de lactitol incremento significativo de Bifidobacterium, propionato y butirato. | --- | *Probable efecto prebiótico |
| Gostner A et al., 200634 | Isomalt | Humanos (20 voluntarios sanos de 21 a 53 años) y estudio in vitro | 30 gramos de isomalt o 30 gramos de sacarosa durante 4 semanasy las siguientes 4 semanas se cruzaron | *Dieta enriquecida con isomalt y sacarosa | Humanos:*Incremento en bifidobacterias y disminución de bacterias B-glucosidasa In vitro:*Isomalt fue metabolizado por bifidobacterias con incremento de butirato | *Sin diferencias significativas en B-glucoronidasa, sulfatasa, nitroreductasa y ureasa, poliaminas fecales, AGCC fecales, lactato, ácidos biliares, esteroles neutros, nitrógeno, NH3, fenoles y p-cresol | *Probable efecto prebiótico |
AGCC: ácidos grasos de cadena corta; FDA: Food and Drug Administration; HDL: lipoproteínas de alta densidad; IDA: ingestión diaria aceptable; JECFA: Joint FAO/WHO Committee Report on Food Additives; LDL lipoproteínas de baja densidad.
Se designaron 2 coordinadores generales del área de gastroenterología y nutrición (RVF y NBH) y se invitaron expertos en gastroenterología, nutrición, toxicología, microbiología y endocrinología. Se realizó una búsqueda exhaustiva de la literatura en diferentes bases de datos: CENTRAL (The Cochrane Central Register of Controlled Trials), MEDLINE (PubMed), EMBASE (Ovid), LILACS, CINAHL, BioMed Central y World Health Organization International Clinical Trials Registry Platform (ICTRP). La búsqueda incluyó literatura del periodo comprendido entre 1969 y 2018. Los criterios de búsqueda incluyeron los siguientes términos: «artificial sweeteners», «non-caloric sweeteners» combinado con los siguientes términos: «stevia», «sucralose», «aspartame», «acesulfame-k», «saccharin», «inflammation», «polyols», «microbiota», «carcinogenesis», «treatment», «gastrointestinal symptoms», «cirrhosis», «cancer», «therapy», «NAFLD», «NASH », «review», «guidelines» y sus equivalentes en español. Toda la bibliografía se distribuyó a todos los miembros del equipo. Posteriormente, los coordinadores elaboraron preguntas las cuales se sometieron a una primera valoración vía electrónica cuya finalidad fue evaluar la redacción, contenido y relevancia clínica de las mismas. Se integraron 4 equipos de 4 o 5 colaboradores de cada uno, los cuales debían responder 5 preguntas en función a la evidencia científica evaluada. Cada una de las respuestas, basadas en la revisión de la evidencia, se presentó, discutió, analizó y consensuó por todos los participantes de forma abierta. Una vez consensuada la respuesta y opinión, se redactó un resumen para después integrar un documento final.
ResultadosCaracterísticas generales de los edulcorantes no calóricosLa absorción, metabolismo y excreción de los ENC, varía dependiendo del compuesto y la cantidad del mismo (tabla 1).
El acesulfame K es un derivado de ácido orgánico hidrofílico que se absorbe casi en su totalidad en el intestino delgado por acción de las microvellosidades para después llegar a circulación sistémica y distribuirse en sangre a los tejidos de todo el cuerpo. La porción no absorbible se excreta sin metabolizarse, 99% en orina y menos de 1% en materia fecal23.
El aspartame es una unión química de dos aminoácidos (fenilalanina y ácido aspártico), su hidrólisis y absorción se lleva a cabo en el tracto gastrointestinal por las estereasas y peptidasas, sus productos absorbibles en mucosa intestinal son metanol (10%), ácido aspártico (50%) y fenilalanina (40%), los cuales toman diferentes rutas metabólicas dependiendo su composición24.
La sacarina es una amida o-sulfobenzoica que se absorbe en intestino delgado aproximadamente del 85 al 95%, se une reversiblemente a proteínas del plasma y se distribuye a todos los órganos, la porción no absorbible es eliminada en la orina sin metabolizarse y en materia fecal24.
Los glucósidos de esteviol también conocidos como «stevia», se obtienen de una planta (Stevia rebaudiana Bertoni) de cuyas hojas producen extractos de esteviósido y el rebaudiósido, que son dos de los glucósidos dulces presentes en sus hojas. Son absorbidos lentamente hacia la circulación portal, pueden ser glucuronizados a nivel hepático y transportados de nuevo a través de la bilis al intestino25.
El ciclamato es la sal de sodio o calcio del ácido ciclámico (ácido ciclohexilsulfámico), aproximadamente el 40% es absorbido a nivel intestinal y se elimina en orina sin ser metabolizado, de la porción no absorbida el 30% es metabolizado por la microbiota (Enterococcus) hasta ciclohexilamina, ciclohexanol y ciclohexanona26,27.
Edulcorantes no calóricos y su relación con el proceso inflamatorio gastrointestinalNo hay estudios en humanos sobre el efecto de los ENC y el proceso inflamatorio, la evidencia es limitada y proviene de líneas celulares o estudios en modelos animales28.
En este sentido, un estudio realizado en un modelo murino mostró que la sacarina administrada durante 6 meses induce el incremento en la expresión de algunos factores de inflamación tales como la enzima óxido nítrico sintetasa inducible (iNOS) y el factor de necrosis tumoral-alfa (TNF-α) en el hígado de ratones machos (C57BL/6J). Este estudio sugirió que la expresión del mRNA de genes que codifican estos factores podrían estar asociados indirectamente con la alteración de la microbiota intestinal y su metabolismo29.
Por otro lado, se ha visto que el glucósido de esteviol y sus compuestos relacionados, ejercen efectos antioxidantes y antiinflamatorios. El esteviósido ha demostrado suprimir significativamente la liberación de TNF-α y de la interleucina IL-1ß inducida por lipopolisacáridos y la supresión ligera de óxido nítrico en monocitos THP-1 (línea celular derivada de la leucemia) sin ejercer ningún efecto tóxico directo30. De igual forma, diversos estudios han mostrado que concentraciones altas de esteviósido y esteviol, disminuyó la viabilidad de líneas celulares de carcinoma de colon humano, específicamente el esteviol aumentó la secreción de cloro y atenuó la producción de IL-8 estimulada por TNF-α31. A su vez, el esteviósido inhibió de forma dependiente de dosis la expresión de TNF-α, IL-6 y IL-1β en células RAW264 (monocitos macrófagos murinos) estimuladas con lipopolisacáridos y ejerció una propiedad antiinflamatoria al inhibir la activación de NF-κβ, la señalización de proteína cinasa activada por mitógeno y la liberación de citocinas proinflamatorias32. En otros estudios, el esteviósido y el esteviol, no mostraron citotoxicidad en cultivos celulares y ambos compuestos tuvieron efectos mediadores del proceso inflamatorio mediante la liberación potencial de TNF-α, IL-1β e IL-6. Los hallazgos hasta el momento sugieren que el esteviósido podría ser un agente terapéutico en las enfermedades inflamatorias y que junto con el rebaudiósido A, esteviol e isosteviol, podrían ofrecer beneficios terapéuticos, ya que se han asociado a acciones antihiperglicémicas, antihipertensivas, antiinflamatorias, antitumorales, antidiarreicas, diuréticas e inmunomoduladoras33.
En conclusión, a nivel experimental existe escasa evidencia del potencial efecto proinflamatorio de la sacarina en forma directa. Por el contrario, existe evidencia respecto al poder antiinflamatorio del esteviol y sus derivados; sin embargo, no existen estudios clínicos al respecto.
Polioles y manifestaciones gastrointestinalesPara analizar los síntomas y las manifestaciones gastrointestinales asociadas a la ingestión de ENC es importante diferenciar a los de alto poder edulcorante de los compuestos que imparten volumen y textura; entre estos últimos se encuentran los polioles utilizados como aditivos o para conferir volumen, textura y dulzor a los alimentos34.
Los polioles como el eritritol, isomaltol, lactitol, maltitol, poliglicitol, manitol, sorbitol, xilitol y la tagatosa son HCO hidrogenados presentes en algunas frutas, verduras, hongos y algunos alimentos industrializados35,36. Especialmente dado que el eritritol se absorbe sin metabolizar en el intestino delgado, se tolera una ingestión de 80g al día37; sin embargo, el isomaltol se absorbe parcialmente y es altamente fermentable por la microbiota intestinal del colon (90% aproximadamente)34. En consecuencia, estos HCO poco digeribles pueden causar diarrea y otras manifestaciones gastrointestinales como flatulencia, distensión y malestar abdominal38; los síntomas varían dependiendo de la dosis, si es líquido o sólido, si se consume con otros alimentos y la velocidad de ingestión, entre otros39.
Respecto al vaciamiento gástrico Wolnerhanssen et al. realizaron un ensayo clínico aleatorizado, doble ciego con 10 sujetos por grupo para evaluar el efecto del xilitol (50g), el eritritol (75g) comparado con placebo (75g glucosa) sobre la liberación de GLP-1 (péptido 1 similar a glucagón), la CCK (colecistoquinina) y el vaciamiento gástrico. Los resultados mostraron que voluntarios que consumieron eritritol y xilitol tuvieron un retardo en el vaciamiento gástrico y aumento en la secreción de GLP-1 y CCK40.
Por otra parte, en otros estudios se han probado dosis para evidenciar recomendaciones en función a la tolerabilidad de estos ENC, las dosis probadas oscilan entre 20g/día (manitol) y 40g/día (isomaltol, maltitol y poliglicitol)41 no obstante, algunos estudios han mostrado que una dosis superior a 20g/día de lactitol causa flatulencia y distensión. De igual forma, el sorbitol a dosis de 20-30g/día provoca dolor abdominal y a más de 50g/día diarrea osmótica42.
Por lo anterior se puede concluir que los polioles, pueden causar síntomas y manifestaciones gastrointestinales dependiendo del tipo de compuesto y la dosis ingerida.
Edulcorantes no calóricos y motilidad intestinalExiste poca evidencia directa que pueda relacionar la ingestión de los ENC con modificaciones en la motilidad intestinal, los resultados en modelos animales sugieren que ciertos ENC pueden promover la liberación de GLP-1 o péptido inhibidor gástrico los cuales modifican el movimiento intestinal43,44.
Estudios realizados in vivo e in vitro44,45 han mostrado que la sucralosa, el aspartame y el acesulfame K, ocasionan estimulación de las células enteroendócrinas incrementando la liberación de GLP-1, CCK y péptido YY (péptido anorexigénico liberado por las células del colon). Una de las hipótesis es la activación de los receptores de sabor dulce en la boca; sin embargo, se ha visto que ocurren respuestas similares al infundir los ENC directamente al intestino por la presencia de receptores de sabor dulce en el intestino delgado. Los ENC podrían unirse a estos receptores de sabor dulce, estimulando la liberación de péptido inhibidor gástrico y GLP-1, los cuales modifican el movimiento intestinal; sin embargo, en ensayos clínicos no se han visto efectos contundentes sobre la motilidad intestinal, el incremento de GLP-1 o insulina46. Además, en los estudios con aspartame y sacarina tampoco se ha encontrado evidencia clínica de alteraciones en el vaciamiento gástrico47–49.
Por el contrario, los resultados de Meyer-Gerspach et al., mostraron que tras la ingestión de acesulfame K se presenta mayor estimulación del apetito y disminución en la saciedad en comparación con un grupo placebo en el que no se presentan estos cambios50. Por su parte, Brown et al. publicaron que la ingestión de sucralosa y acesulfame K en bebidas gaseosas previo a una carga de glucosa, produce una elevación significativa de GLP-151; estos resultados fueron reproducibles en otras poblaciones en las que se vio una asociación significativa entre la ingestión de estos ENC más glucosa con una mayor liberación de GLP-152,53.
En conclusión, existen estudios en modelos animales en los que se ha observado incremento en la secreción de hormonas gastrointestinales relacionadas con la motilidad intestinal de manera indirecta; sin embargo, no hay evidencia suficiente en humanos que sostenga que los ENC per se, afecten de manera directa la motilidad intestinal. Por tanto, hacen falta más estudios que establezcan su papel en el funcionamiento del aparato digestivo.
Edulcorantes no calóricos y cáncer en el aparato digestivoEstudios realizados a principios de la década de los años setenta en modelos animales expuestos a elevadas dosis de sacarina, demostraron efectos carcinogénicos en la vejiga. Lo anterior, desencadenó una serie de estudios clínicos en humanos, que evaluaron el efecto carcinogénico de los ENC y los resultados no fueron reproducibles. De igual forma, hasta el momento no se ha publicado evidencia científica en humanos que describa su efecto carcinogénico en vejiga54. A su vez, el ciclamato también fue estudiado bajo estas mismas condiciones y hasta el momento no se han descrito efectos cancerígenos en vejiga55. Un estudio de casos y controles (556 casos de cáncer gátrico o de páncreas vs. 1,199 controles) en población italiana que tenía como objetivo evaluar el riesgo de cáncer con la ingestión de sacarina y aspartame, tampoco mostró diferencias estadísticamente significativas para el desarrollo de cáncer gástrico o de páncreas. Se concluyó que no existe incremento del riesgo para neoplasias comunes en esta población56.
Otro estudio de casos y controles que evaluó el papel de la sacarina y otros ENC sobre el cáncer de esófago, colon y recto, mostró que la ingestión mayor a 2 sobres (24mg de sucralosa) o tabletas por día de ENC vs. ninguno, no aumenten el riesgo de cáncer de esófago, colon o rectal. Para los consumidores vs. los no consumidores de otros ENC, principalmente aspartame, los resultados encontrados fueron similares para cáncer de colon y de recto. Los autores del estudio concluyeron que no hay evidencia estadísticamente significativa que sustente que la sacarina y el aspartame aumenten el riesgo de cáncer en humanos57.
Lohner publicó una revisión en el 2017 sobre los posibles efectos positivos o negativos para la salud de los ENC en sujetos sanos. La revisión incluyó 372 estudios, de los cuales 51 estudios primarios evaluaron la asociación entre la ingestión de ENC y el riesgo de cáncer. Del total de estudios, únicamente cuatro eran de casos y controles, evaluaron el riesgo de cáncer en el aparato digestivo. Uno de ellos, evaluó el riesgo de cáncer colorrectal, demostrando un aumento significativo con el uso de ENC; sin embargo dos estudios investigaron el riesgo de cáncer pancreático, sin encontrar asociación con los ENC y otro estudio evaluó el riesgo de cáncer de vías biliares, en las que no se describieron asociaciones significativas58.
En cuanto al desarrollo de carcinoma hepatocelular, un estudio que evaluó la seguridad del ciclamato en el que se incluyeron 21 macacos, a los que se les administró ciclamato a dosis de 100mg/kg/día o 500mg/kg/día, desde el nacimiento hasta los 24 años, tres de los 21 macacos presentaron cáncer, siendo uno de estos, carcinoma hepatocelular. Dicho estudio utilizó dosis mayores a la IDA en humanos (11mg/kg/día) y por un largo periodo de ingestión; por lo que, pese los casos de cáncer hepático observado, la evidencia no es contundente respecto a que el ciclamato produce un riesgo para el desarrollo de carcinoma hepatocelular, ya que la incidencia de neoplasias en estos animales es normal acorde a lo discutido por los autores en el estudio26.
Es importante mencionar que el último reporte monográfico de la International Agency for Research on Cancer (IARC, por sus siglas en inglés), sobre la evaluación del riesgo carcinogénico en humanos, establece que los ENC son considerados aditivos de alta prioridad a reevaluarse en futuras investigaciones, por su alto interés público y porque aún no existe evidencia concluyente59, lo anterior debido a estudios en roedores que vincularon la ingestión de ENC con el desarrollo de tumores60,61.
En conclusión, la mayoría de la evidencia científica existente hasta el día de hoy, no apoya el potencial carcinogénico de los ENC; sin embargo, debido al aumento en el número de publicaciones en diferentes modelos animales, se requieren más estudios epidemiológicos y de causalidad en humanos que establezcan lo anterior de manera definitiva.
Edulcorantes no calóricos en la enfermedad por hígado graso y esteatohepatitisCon respecto al efecto de los ENC sobre la fisiopatología y evolución de Nonalcoholic Fatty Liver Disease (NAFLD) y Nonalcoholic Steatohepatitis (NASH), hasta el momento no se han descrito estudios realizados en humanos. No obstante, en un estudio realizado por Holvoet et al. en el que se evaluó el efecto de compuestos derivados de la estevia en la acumulación de lípidos en hígado de ratones genéticamente modificados para no producir la hormona leptina (OB/OB), divididos en un grupo control, un grupo con esteviosido (10mg/kg/día), un grupo con rebaudiosido A (12mg/kg/día) y un grupo con esteviol (5mg/kg/día), se observó una disminución en el porcentaje de grasa en hígado en todos los grupos que utilizaron compuestos derivados de estevia, de igual manera dichos compuestos mostraron mejoría en el metabolismo hepático de glucosa y protección contra estrés oxidativo62.
Otro estudio realizado por el grupo de Janssen et al. evaluó el efecto de la glucosa, fructosa y aspartame sobre el metabolismo lipídico a través de la técnica de espectroscopia por resonancia magnética (MRS), para establecer su efecto en el desarrollo de esteatosis hepática en ratas Wistar, en el que la intervención consistía en una solución al 13% de glucosa, 13% de fructosa o bien al 4% de aspartame durante 7 semanas. Este estudio mostró que en el grupo de glucosa y fructosa había una acumulación significativa de lípidos hepáticos, inducida por un aumento en la lipogénesis de novo, mientras que el aspartame no afectó significativamente el contenido de lípidos en hígado63.
En conclusión, existe poca evidencia sobre el efecto de la ingestión de ENC en NAFLD y NASH; sin embargo, los estudios en modelos animales sugieren que el aspartame no parece estar asociado a la fisiopatología de NASH, mientras que los derivados de estevia podrían tener un efecto favorable en el porcentaje de grasa hepática. Se requieren más estudios que establezcan causalidad en ensayos clínicos con pacientes.
Edulcorantes no calóricos durante el proceso inflamatorio de la cirrosis hepática y sus complicacionesHasta el momento existe un estudio en humanos, otros en modelos animales en el que se evaluaron los efectos de diversos ENC en enfermedades hepáticas.
Un estudio realizado por Hertelendy et al. evaluó la ingestión de aspartame en pacientes con hepatopatía crónica por alcohol. En este ensayo clínico se asignó una aleatorizada cruzada con 13 pacientes, a quienes en la fase 1 del estudio se les adicionó a su dieta habitual 15mg/kg/peso/día de aspartame y posterior a un periodo de lavado de dos días se les inició la fase 2 con la administración de un placebo. Los resultados mostraron una media de ingestión de aspartame igual a 1,154±278mg al día y un contenido aproximado de 650mg de fenilalanina. En el grupo de aspartame, se observó una disminución significativa en la relación aminoácidos de cadena ramificada (AACR)/aminoácidos aromáticos (AAA), esta alteración no se encontró durante la intervención con placebo. No se observó un incremento en las concentraciones de amonio ni episodios de encefalopatía clínica inmediatamente después de las intervenciones. En este sentido el estudio muestra la seguridad de una única dosis de aspartame; sin embargo, no se evaluó el efecto a largo plazo ni el efecto de la ingestión sostenida de aspartame, pues la reducción de la relación AACR/AAA podría hacer más susceptibles a estos pacientes a presentar encefalopatía hepática a mediano y largo plazo64. Por lo anterior, se debe tener precaución en la recomendación de la ingestión de aspartame en pacientes con hepatopatía crónica.
Respecto a la falla hepática aguda, hasta el momento solo existe un estudio, realizado por Latha et al., en un modelo animal de falla hepática aguda inducida por lipopolisacáridos (LPS) en 32 ratas Wistar, en el que se evaluó el efecto de la hoja cruda Stevia rebaudiana (500mg/kg) y esteviósido (250mg/kg). Se observó una disminución de la aspartato-aminotransferasa (AST) y de la alanino-aminotransferasa (ALT) con ambos compuestos. Además, se encontró aumento en la capacidad antioxidante y disminución de citocinas proinflamatorias con ambos agentes, aunque con mayor aumento en el grupo que recibió esteviósido. Con estos resultados se concluye que a dosis muy altas, tanto Stevia rebaudiana como el esteviósido no purificados podrían tener un efecto protector en el hígado, mejorando el cuadro clínico de falla hepática aguda con su administración65; sin embargo, esta dosis es significativamente mayor a la IDA para extractos de estevia de alta pureza en humanos y que por tanto no sería equivalente a la estevia comercializada y aprobada.
Tras la evaluación de dichos estudios, podría existir un efecto favorable de los compuestos del estevia frente a la falla hepática aguda, mostrando mayor beneficio la Stevia rebaudiana; sin embargo, las dosis utilizadas son superiores a las esperadas en la humano, además el tipo de compuesto en las preparaciones comerciales disponibles y aprobadas, contienen esteviosidos altamente purificados que no son equivalentes a las concentraciones utilizadas en el experimento mencionado.
Respecto al daño hepático los diversos estudios publicados son realizados en modelos animales, en los cuales se evalúa la ingestión de aspartame y su efecto en la función hepática.
En un estudio realizado en ratones que evaluó el efecto de la administración crónica de aspartame en el estado redox de glutatión y en la vía de transulfuración hepática, con 3 grupos: grupo control, grupo con aspartame (80mg/ kg, preparado en solución de NaCl al 0.9%) y grupo con aspartame tratado con N-acetilcisteína (163mg/kg, pH 6.8-7.2) durante 90 días. Mostró que la administración de aspartame aumentó significativamente las concentraciones de ALT y AST, así como una marcada disminución de las concentraciones hepáticas de glutatión reducido, glutatión oxidado y γ-glutamilcisteína, además de disminuir los metabolitos de la vía de transulfuración, como la cisteína, la S-adenosilmetionina y la S-adenosilhomocisteína. Se observó también una atenuación en estos efectos en aquellos ratones que además de aspartame recibieron N-acetilcisteína66.
Otros estudios han evaluado el efecto de la ingestión de aspartame a largo plazo en ratas Wistar. En los estudios que se han suplementado dosis de 75, 500 y 1,000mg/kg peso, la dosis de 75mg/kg disminuyó significativamente de la capacidad antioxidante, por la disminución del glutatión y de la enzima glutatión-reductasa. El efecto fue significativamente mayor a dosis de 500mg/kg peso, mientras que con la dosis de 1,000mg/kg peso, además de la depleción severa de glutatión, sí hubo disminución significativa de la glutatión peroxidasa (GPX) y glutatión reductasa y aumento significativo de las transaminasas, de la fosfatasa alcalina y de la gamaglutamil transpeptidasa (GGT), así como infiltración de leucocitos en el tejido hepático67,68.
El aspartame es el ENC más evaluado y con resultados consistentes entre los diversos estudios en modelos animales que utilizaron dosis inferiores y superiores a la IDA; sin embargo, en estas condiciones lo que se observó de manera consistente es que el aspartame reduce la capacidad antioxidante del hígado, produciendo una alteración en pruebas de función hepática en modelos animales. De igual forma, los resultados mostrados en humanos a pesar de no presentar manifestaciones clínicas significativas, sí mostraron una disminución de la relación AACR/AAA lo que potencialmente podría afectar a pacientes susceptibles a encefalopatía hepática (tabla 4).
Efecto de diversos ENC en el hígado. Estudios en animales
| ENC | Efectos observados | Efecto |
|---|---|---|
| Estevia(no representa la forma aprobada para uso comercial)56 | Menor acumulación de lípidos en el hígadoProtege para falla hepática aguda inducida por LPSMenos radicales libres, TNF-α, IL-8 e IL-6Mayor capacidad antioxidante | Potencialmente favorable |
| Aspartame(a dosis variables)58–60 | Menor capacidad antioxidanteDaño hepatocelular (aumento de ALT, AST, FA, GGT)Infiltración de leucocitosDisminuye la vía de transulfuraciónDisminuye la relación AACR/AAA | Potencialmente desfavorable |
| Ciclamato(dosis superiores a la IDA)57 | Desarrollo de un caso carcinoma hepatocelular en 1 de 21 macacos con ingestión diaria elevado durante 24 años | Neutral |
AACR/AAA: aminoácidos de cadena ramificada; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; FA: fosfatasa alcalina; GGT: gamma-glutamil transpeptidasa; IL: interleucina; LPS: lipopolisacáridos; TNF-α: factor de necrosis tumoral α.
Se puede concluir, que los compuestos del estevia podrían tener un beneficio parcial frente a la falla hepática aguda. En el caso del aspartame se debe tener precaución en su recomendación en pacientes con hepatopatía crónica debido a la disminución en la relación AACR/AAA lo que potencialmente podría afectar a pacientes susceptibles a encefalopatía hepática.
Edulcorantes no calóricos y su interacción con la microbiota intestinalLa microbiota del tracto gastrointestinal consta de más de 100 mil millones de microorganismos, de al menos 1,000 especies diferentes de bacterias, las cuales tienen una participación crucial en los procesos fisiológicos y fisiopatológicos que ocurren en el huésped69,70. Tomando en cuenta esto, la microbiota del tracto gastrointestinal supera el número de células humanas y contiene 100 veces más genes que el genoma humano71,72.
El tipo y número de las bacterias intestinales se ven alteradas por diferentes mecanismos, entre ellos la composición de la dieta73 y tipo de alimentación de cada región del mundo74.
Actualmente, se sabe que la población de microorganismos tiene múltiples funciones en el intestino; como la promoción de la maduración y la integridad del epitelio intestinal, protección contra patógenos, modulación inmunológica, equilibrio inmunológico intestinal y prevención de la inflamación71. La alteración en la misma se ha vinculado a diferentes enfermedades, como alergias alimentarias, enfermedad inflamatoria intestinal, enterocolitis necrosante, obesidad, hígado graso, cáncer de colon, entre otras72.
Existes estudios que han evaluado la relación dieta y la microbiota intestinal, lo cual ha llevado al estudio del efecto de la ingestión de los ENC sobre la microbiota intestinal75; sin embargo, han existido limitaciones relacionadas con las técnicas de medición, dosis utilizadas, la dieta y la determinación de sus metabolitos como los ácidos grasos de cadena corta (AGCC)21. Por lo anterior, actualmente se prefiere el uso de métodos que logren representar más la diversidad bacteriana como la secuenciación del DNA bacteriano (microbioma) para obtener un perfil microbiológico más completo76.
Hasta hace unos años los ENC eran considerados metabólicamente inertes y sin aparentes efectos fisiológicos; sin embargo, algunos de estos experimentan múltiples cambios en el intestino, interactuando con la microbiota y modificando así sus metabolitos en los diversas regiones del intestino77 (tabla 5).
ENC y plausibilidad biológica de su presencia significativa en el colon
| Edulcorantes no calóricos | De acuerdo a su digestión y absorción, mayor interacción con la microbiota |
|---|---|
| Acesulfame K | No |
| Aspartame | No |
| Sacarina | Sí |
| Glucósidos de esteviol | Sí |
| Sucralosa | Sí |
Adaptado de Magnuson et al.24.
Por lo anterior a continuación se enumeran cada uno de los edulcorantes y su posible interacción con la microbiota.
Acesulfame K: un estudio controlado aleatorizado en modelos animales mostró que la ingestión de Acesulfame K (37.5mg/kg/día durante 4 semanas), desencadenó cambios significativos en la microbiota intestinal; en este estudio se realizó una división por sexo en el cual se observó que en los machos aumentaron los Bacteroides y Anaerostipes y en las hembras hubo disminución en Lactobacillus, Clostridium, así como bacterias Ruminococcaceae y Oxalobacteraceae. Cabe mencionar que en este estudio se realizó con una concentración superior a la IDA en humanos (mayor a 15mg/kg/día)78. Otro estudio realizado en humanos (estudio transversal) que incluyó 31 voluntarios, no mostró modificaciones en la microbiota intestinal, ni diferencias significativas en la abundancia relativa por sexos en consumidores y no consumidores de Acesulfame K79; no obstante, en una revisión realizada por Nettleton et al., mostraron cambios en la microbiota y en los metabolitos que esta produce, tras la ingestión de Acesulfame K específicamente sobre los AGCC como es piruvato y butirato. Los autores no especifican el mecanismo por el cual se altera la microbiota, una hipótesis es a través de metabolitos sistémicos derivados del metaboloma de bacterias específicas interactuando con el aditivo11,80. Sin embargo, un estudio realizado en ratones en el cual se incluyó un grupo con una solución de Acesulfame-K a 15mg/kg de peso no mostró diferencias en la abundancia de bacterias en heces ni en la relación de Firmicutes y Bacteroidetes. Los autores concluyen que no hubo diferencias significativas en la microbiota81.
Por su parte, Bian et al. mostraron asociación entre la genotóxicidad del Acesulfame K, con la inhibición de la fermentación de la glucosa por las bacterias intestinales, lo cual ejerce actividad antimicrobiana, por pertenecer a la clase de las sulfonamidas. Por lo anterior el Acesulfame K podría tener un impacto significativo sobre el contenido y diversidad microbiana78. El Acesulfame K, en elevadas dosis ocasiona modificaciones en la composición bacteriana de modelos animales.
Aspartame: el aspartame es hidrolizado en fenilalanina, ácido aspártico y metanol, este último corresponde al 10% del peso corporal, en un consumo habitual82. Algunos estudios, han mostrado que el metanol afecta el crecimiento de anaerobios y concentraciones elevadas inhiben completamente el crecimiento de Escherichia coli (E. coli), de anaerobios y microorganismos facultativos presentes en la microbiota de humanos83. Un estudio en modelos animales (44 ratas macho) mostró que una dieta alta en grasas y aspartame aumenta la proporción de Firmicutes y Clostridium cluster CXI. Específicamente la adición de aspartame modificó la proporción Firmicutes - Bacteroidetes, a expensas de un incremento en Firmicutes y en concreto en los clústeres de C. CXI84. Otro estudio en modelos animales mostró que a dosis bajas, el aspartame modifica metabolitos séricos como lisina, serina, glicina, propionato, creatina, 3 hidroxibutirato, metanol, glicerol y urea. Este mismo estudio del metabolismo de aspartame se asoció con elevación de las concentraciones de propionato (AGCC); sin embargo, en humanos no se ha demostrado que el aspartame modifique la tolerancia a la glucosa o las concentraciones de insulina. De igual forma el aspartame ocasionó cambios significativos sobre la microbiota, como incremento en Enterobacteriaceae y Clostridium leptum, modulación en el incremento de Firmicutes y Bacteroidetes y elevación de Roseburia ssp. Es importante mencionar que a diferencia de otros estudios en los que se utilizaron dosis superiores a la IDA en este estudio los efectos encontrados fueron con dosis bajas de aspartame (aproximadamente 5-7mg/kg/día)84.
En conclusión, el aspartame libera una molécula de metanol que tiene efectos ya descritos sobre el crecimiento de anaerobios y E. coli; sin embargo, no se conoce el efecto con una ingestión habitual y a largo plazo de aspartame a nivel sistémico, no obstante dado que puede modificar la composición de la microbiota, es importante que se recomiende con precaución en pacientes con alguna hepatopatía crónica y se realicen más estudios para establecer sus implicaciones en el desarrollo de enfermedades metabólicas.
Sacarina: este es uno de los edulcorantes más utilizado por la industria y con el mayor número de estudios. Un estudio realizado por Suez et al., en el que utilizaron ratones machos adultos C57BL/6, mostró que tanto en animales delgados como en obesos la ingestión de sacarina, sucralosa y aspartame comparados con agua, glucosa o sacarosa produce intolerancia a la glucosa. Mediante el trasplante de microbiota fecal de ratones que consumieron sacarina o glucosa a ratones libres de gérmenes, los investigadores mostraron que los roedores libres de gérmenes que recibieron el trasplante fecal del grupo que consumió sacarina desarrollaron intolerancia a la glucosa comparados con los que se alimentaron con glucosa. Los autores sugieren que los efectos de los ENC en los parámetros metabólicos como la resistencia a la insulina son debidos, en parte, a los cambios inducidos en la microbiota intestinal20.
El mismo grupo de investigadores estudió el efecto de la sacarina en el control de la glucemia en 7 voluntarios sanos. Cuatro de los siete sujetos mostraron intolerancia a la glucosa a dosis máxima aceptable (5mg/kg) en 3 dosis diarias. Los autores concluyeron que el efecto de los ENC sobre la heterogeneidad de la microbiota intestinal humana podría hacer a unos individuos más vulnerables que a otros para desarrollar intolerancia a la glucosa después de la ingestión de sacarina20. Este estudio ha sido criticado por algunos autores ya que en sus conclusiones menciona que todos los edulcorantes afectan la microbiota, produciendo intolerancia a la glucosa y en el estudio se evalúa principalmente sacarina.
Por otro lado, otros autores han demostrado que muchos de los géneros y las especies encontrados en los roedores, no están presentes en humanos21. El estudio de Bian et al., evaluó el efecto de la ingestión de sacarina en un modelo murino C57BL/6J de 8 semanas de edad. El grupo de intervención recibió sacarina disuelta en agua a 0.3mg/ml durante 6 meses mientras que el grupo control recibió solamente agua. En el grupo de sacarina se observaron efectos en la microbiota y modificaciones en diversos géneros bacterianos a los 3 y a los 6 meses, además de aumento en la expresión del mRNA de genes proinflamatorios como iNOS y TNFα29.
Otro estudio en un modelo porcino publicado por Daly et al., en el cual se estudiaron dos grupos, ambos con una dieta estándar y en una adicionada con sacarina; en este último grupo, se encontró aumento significativo en las familias de Ruminococcaceae, Veillonellaceae y en particular Lactobacillaceae; sin embargo, el estudio no cuantificó la ingestión de alimentos y la dosis de sacarina no se menciona21,85.
Sucralosa: un estudio realizado en ratones por Donia et al., demostró una disminución significativa de anaerobios, bifidobacteria, lactobacilli y Bacteroides así como, disminución de la abundancia de clostridia y del total de bacterias aeróbias; no obstante, la sucralosa utilizada (Splenda) contenía 99% de maltodextrinas y dextrosa y solo 1% de sucralosa pura86,87. Además, Uebanso et al., evaluaron el efecto de la sucralosa y acesulfame-K en la microbiota intestinal y el metabolismo, esto durante 8 semanas en tres grupos de ratones (grupo con sucralosa a 1.5mg/kg de peso, grupo con sucralosa a 15mg/kg de peso y grupo control). No se encontraron diferencias en la cantidad de bacterias fecales, ni en la abundancia de Firmicutes y Bacteroidetes; sin embargo, la abundancia de clúster XVIa de Clostridium y la producción de butirato disminuyeron significativamente, siendo esta disminución dependiente de la dosis de sucralosa81.
Estevia: los glucósidos de esteviol son el producto absorbible final del metabolismo de la bacterias en el colon76,88. Estos glucósidos no se absorben en intestino delgado, por lo que son hidrolizados por bacilos del grupo Bacteroides de la microbiota intestinal89,90.
Existe poca información que haya relacionado el efecto de estos metabolitos sobre el balance de la microbiota. No obstante, algunos estudios demuestran que los extractos completos de estevia tienen propiedades antimicrobianas que pueden influir en la población de la microbiota en el intestino. Estos cambios han mostrado alteraciones en la actividad digestiva enzimática, la producción de AGCC y la salud en de los animales89,91. Además, otros estudios demuestran que los glucósidos de esteviol inhiben el crecimiento de Lactobacillus reuteriin vitro92; sin embargo, estos resultados hasta el momento no son extrapolables a las presentaciones comerciales que contienen glucósidos de esteviol altamente purificados.
Polioles: diversos estudios han analizado el efecto de los polioles sobre la microbiota intestinal; sin embargo, cada poliol contiene características individuales que pueden producir diferentes manifestaciones intestinales asociadas a su consumo (tabla 3)42,87,93–95.
Los polioles más estudiados hasta el momento son el isomalt, lactitol, maltitol, xilitol, eritritol y estudios tanto en modelos animales como en humanos han mostrado que la parte no absorbible en intestino delgado de estos ENC, llega íntegra a colon y es fermentada rápidamente por acción de la microbiota produciendo AGCC, CO2, CH4 y H234. Algunos polioles como el lactitol y eritritol tienen mayor interacción con la microbiota intestinal asociada a alteraciones digestivas. En el caso del lactitol las pequeñas cantidades de hidrógeno y AGCC que genera son utilizadas como fuente de energía por las Bifidobacterium y Lactobacillus spp., lo cual disminuye el pH intestinal, así como la producción y absorción de amoniaco (NH3)42,96–98. El eritritol inhibe el crecimiento de Streptococcus mutans42,99 y es poco fermentable por la microbiota intestinal, lo que le podría conferir cualidades prebióticas99.
Con estos resultados, se puede concluir que los ENC potencialmente podrían modificar la composición de la microbiota intestinal y esto podría tener efectos sobre algunas manifestaciones gastrointestinales; sin embargo, es importante que se realicen más estudios para establecer sus implicaciones en el desarrollo de enfermedades relacionadas con estos cambios.
ConclusionesNo hay evidencia clínica de un posible efecto inflamatorio sobre el intestino causado por los ENC.
Los ENC no son causantes de alteraciones gastrointestinales, pero los edulcorantes que imparten volumen y textura, como los polioles pueden causar síntomas y alteraciones digestivas como diarrea y distensión principalmente, dependiendo del tipo del compuesto y la dosis.
Los ENC de alto poder edulcorante no afectan de manera directa la motilidad intestinal.
No se ha demostrado un potencial carcinogénico de los ENC.
Los estudios en modelos animales sugieren que el aspartame no influye en la fisiopatología de la EHGNA, mientras que los derivados de estevia parecen tener un efecto favorable en el porcentaje de grasa hepática, no obstante se requieren estudios clínicos que establezcan esta posible asociación.
En pacientes con hepatopatía crónica, el aspartame debe recomendarse con precaución en aquellos susceptibles a desarrollar encefalopatía hepática hasta contar con evidencia clínica de mejor calidad.
Estudios en modelos experimentales muestran cambios en la composición de la microbiota intestinal asociados a la ingestión de ENC.
Se requieren más estudios clínicos para poder definir si estos cambios tienen un impacto en la microbiota intestinal humana y sus consecuencias en la salud digestiva.
FinanciaciónLa Asociación Mexicana de Gastroenterología obtuvo financiación no condicionada para fines logísticos de Heartland Consumer Products México y del Instituto de Bebidas de Coca-Cola de México. La agenda científica, la discusión y las conclusiones emitidas en este documento fueron establecidas con autonomía y redactadas de manera independiente por los integrantes del grupo de trabajo.
Conflicto de interesesN. Bueno-Hernández es conferenciante en Carnot, Abbvie y Takeda. R. Vázquez-Frías es conferenciante y ha recibido apoyo para investigación de Alexión, BioGaia, Carnot, Mayoly-Spindler, Nestlé y Sanofi. A.T. Abreu y Abreu es asesor y conferenciante de laboratorios Sanofi, AB Biotics, Takeda, Mayoly-Spindler, Carnot, MD Pharma, Menarini Biocodex, Columbia y Abott. P. Almeda-Valdés es conferenciante de Boehringer Ingelheim, Eli-Lilly, Sanofi, AstraZeneca y asesora de Boehringer Ingelheim, Sanofi, Abbot y Servie. R.I. Carmona-Sánchez es asesor de Asofarma, y conferenciante para Mayoly-Spindler, Asofarma y Chinoin. A. Consuelo-Sánchez es asesora de Laboratorios Sanofi y conferenciante de Sanofi y Mead Johnson Nutrition. Apoyo para la investigación y asesor científico Alexion Pharmaceuticals Inc. V. Hernández-Rosiles es conferenciante en Nestlé. M.E. Icaza-Chávez es conferenciante de Asofarma y Takeda. A. Noble-Lugo es conferenciante de Asofarma y Takeda. A. Ruiz-Margaín es conferenciante en Victus y apoyo para investigación de Novartis. M.A. Valdivinos-Díaz es asesor de Biocodex, Sanofi, Takeda, conferenciante para Takeda, Ferrer, Mayoly-Spindler, Columbia, Biocodex, Menarini, ha recibido apoyo para el desarrollo académico de Takeda. F.E. Zárate-Mondragón es asesora y conferenciante de Mead Johnson. A. Romo-Romo, L.A. Barajas-Nava y A.J. Espinosa-Flores declaran no tener conflicto de intereses.