El manejo de la coagulación en el paciente con cirrosis ha sufrido una transformación significativa a partir de principios de este siglo con el concepto de un rebalanceo entre los factores procoagulantes y anticoagulantes. Esto ha cambiado el paradigma de que las personas con esta enfermedad tienen una mayor tendencia a la hemorragia. Además, ha traído a la luz la presencia de complicaciones relacionadas a eventos trombóticos en este grupo de sujetos.
En estas guías se detallan aspectos asociados con los mecanismos fisiopatológicos que intervienen en el mantenimiento de la hemostasia en el paciente con cirrosis, la relevancia de la hipertensión portal, los factores mecánicos para el desarrollo de sangrado, las modificaciones en la síntesis hepática de los factores de coagulación, y los cambios en el sistema reticuloendotelial en la descompensación hepática aguda e insuficiencia hepática aguda sobre crónica (IHAC). Se abordan nuevos aspectos vinculados a las complicaciones hemorrágicas en sujetos con esta entidad, considerando el riesgo de hemorragia durante los procedimientos diagnósticos o terapéuticos, así como la utilidad de diferentes herramientas diagnósticas de la coagulación y recomendaciones en el tratamiento farmacológico y transfusión de hemoderivados en el contexto de hemorragia. En estas guías se actualiza el conocimiento respecto al diagnóstico y abordaje de las complicaciones relacionadas con la hipercoagulabilidad en estos casos, así como la eficacia y seguridad de la terapia con diferentes esquemas de anticoagulación. Finalmente, se mencionarán recomendaciones en el manejo de la coagulación en el contexto de IHAC, descompensación hepática aguda y aspectos específicos relacionados al paciente en protocolo de trasplante hepático (TH).
Coagulation management in the patient with cirrhosis has undergone a significant transformation since the beginning of this century, with the concept of a rebalancing between procoagulant and anticoagulant factors. The paradigm that patients with cirrhosis have a greater bleeding tendency has changed, as a result of this rebalancing. In addition, it has brought to light the presence of complications related to thrombotic events in this group of patients.
These guidelines detail aspects related to pathophysiologic mechanisms that intervene in the maintenance of hemostasis in the patient with cirrhosis, the relevance of portal hypertension, mechanical factors for the development of bleeding, modifications in the hepatic synthesis of coagulation factors, and the changes in the reticuloendothelial system in acute hepatic decompensation and acute-on-chronic liver failure. They address new aspects related to the hemorrhagic complications in patients with cirrhosis, considering the risk for bleeding during diagnostic or therapeutic procedures, as well as the usefulness of different tools for diagnosing coagulation and recommendations on the pharmacologic treatment and blood-product transfusion in the context of hemorrhage. These guidelines also update the knowledge regarding hypercoagulability in the patient with cirrhosis, as well as the efficacy and safety of treatment with the different anticoagulation regimens. Lastly, they provide recommendations on coagulation management in the context of acute-on-chronic liver failure, acute liver decompensation, and specific aspects related to the patient undergoing liver transplantation.
Los pacientes con cirrosis presentan frecuentemente alteraciones en el sistema de hemostasia identificadas mediante estudios convencionales de coagulación como el índice internacional normalizado (INR), el tiempo de protrombina (TP), el de tromboplastina parcial activada (TTPa) y el recuento plaquetario. Históricamente, existía la concepción de una mayor tendencia a la hemorragia en sujetos con esta afección, sin embargo, se ha observado que las pruebas convencionales de hemostasia pueden no representar adecuadamente el funcionamiento del sistema hemostático en personas con enfermedad hepática crónica, secundario a un rebalanceo entre los factores pro y anticoagulantes.
Además, se reconoce que, aunque los pacientes con enfermedad hepática crónica pueden experimentar complicaciones hemorrágicas, en la mayoría estas no se relacionan con alteraciones en el sistema hemostático. La hipertensión portal y lesiones vasculares mecánicas durante procedimientos invasivos desempeñan un papel importante en la etiología de la hemorragia en estos casos. Asimismo, los sujetos con cirrosis pueden ser susceptibles a requerir terapia anticoagulante de forma preventiva o terapéutica de episodios trombóticos, lo cual puede originar controversia en el contexto de alteración del sistema hemostático. A este respecto, existe una carencia de estudios clínicos, aleatorizados y controlados en la literatura médica, y se observa una importante heterogeneidad en el diseño y metodología de estos. Sin embargo, de acuerdo con la experiencia del presente panel de expertos en hepatología y la evidencia clínica disponible, consideramos de relevancia proveer una guía con la finalidad de modificar antiguos paradigmas respecto al abordaje de estos pacientes.
La mesa directiva de la Asociación Mexicana de Hepatología (AMH) ha designado un panel de expertos en el abordaje de pacientes con enfermedad hepática crónica avanzada para la elaboración del presente documento, con el objetivo de proveer una guía de práctica clínica con aplicabilidad en el manejo de sujetos con cirrosis y alteración del sistema hemostático. Se ha recopilado evidencia científica basada en fundamentos clínicos y bioquímicos respecto a la prevención y abordaje de complicaciones hemorrágicas o trombóticas en personas con esta enfermedad. El panel de expertos fue organizado en cuatro temas considerados de relevancia para el clínico, los cuales representan una necesidad práctica para la toma de decisiones. Los temas fueron 1) fisiología y fisiopatología del sangrado y coagulación en el paciente con cirrosis, 2) complicaciones relacionadas a sangrado en sujetos hospitalizados con cirrosis sometidos a diferentes procedimientos diagnóstico y terapéuticos, 3) complicaciones relacionadas a la hipercoagulabilidad en el individuo con cirrosis y su abordaje, y 4) manejo de la coagulación en pacientes con insuficiencia hepática aguda sobre crónica (IHAC) o sometidos a trasplante hepático (TH). Cada uno fue desarrollado bajo la supervisión de un coordinador experto en el área de interés.
Se realizó una extensa búsqueda bibliográfica utilizando PubMed, Embase, Cochrane y Scopus. Las palabras clave ingresadas fueron: «coagulación», «hemostasia», «trombocitopenia», «hipofibrinogenemia», «fibrinólisis», «trombólisis», «hemorragia» o «hemorragia secundaria a procedimientos» o «hemostasia» o «pruebas de coagulación convencionales» o «pruebas viscoelásticas» o «trombosis» o «antagonista de vitamina k» o «heparina de bajo peso molecular» o «anticoagulantes orales de acción directa» y «cirrosis hepática» o «enfermedad hepática crónica». La información científica recopilada para la formulación de recomendaciones se clasificó de acuerdo al grado de evidencia en 1) metaanálisis, 2) revisiones sistemáticas de estudios aleatorizados controlados, ensayos controlados aleatorios o estudios observacionales con diseño adecuado, 3) revisiones sistemáticas de estudios no aleatorios o retrospectivos, 4) aquellos de cohorte no aleatorizada, de seguimiento con brazo control, 5) series de casos, estudios de casos y controles y 6) opinión de expertos basada en fundamentos bioquímicos. Debido a que no existe suficiente información en la literatura para generar un consenso de expertos, se crearon estas guías cuyas recomendaciones fueron sometidas a discusión por vía remota, debido a las restricciones de contacto en relación con el riesgo de infección por COVID-19 durante su postulación.
Fisiología y fisiopatología del sangrado y coagulación en el paciente con cirrosisRecomendación 1. En pacientes con cirrosis existe un rebalanceo entre factores pro y anticoagulantes, incrementando el riesgo de eventos trombóticos.
Los sujetos con enfermedad hepática crónica avanzada presentan complicaciones hemorrágicas relacionadas al tubo digestivo alto con mayor frecuencia. Estos poseen una deficiencia en la producción de factores de coagulación al deteriorarse la función sintética hepática. Aunado a esto, la identificación de trombocitopenia es recurrente, relacionada al secuestro esplénico por el incremento de la presión porto-esplénica. Por estas razones, han sido tradicionalmente catalogados como pacientes con coagulopatía adquirida. En otras palabras, como «naturalmente anticoagulados»1. Sin embargo, existen otros factores simultáneos en esta población, como son los niveles elevados del factor de Von Willebrand (FvW) y de factor VIII, y aquellos disminuidos de factores anticoagulantes también sintetizados por el hígado como la proteína C, proteína S y la antitrombina III2,3. Como consecuencia, se produce un rebalanceo entre los factores pro y anticoagulantes creando un estado de adecuada hemostasia. Es importante notar que este equilibrio muestra mayor fragilidad en comparación con las personas sanas.
Recomendación 2. Los eventos de hemorragia en el paciente con cirrosis se deben primordialmente a complicaciones relacionadas con hipertensión portal o daño mecánico a un vaso sanguíneo.
Los eventos de hemorragia se vinculan con factores ajenos a los trastornos de coagulación, siendo la hipertensión portal y la punción o rotura vascular los más importantes. Los estadios más avanzados de enfermedad hepática e hipertensión portal clínicamente significativa se han asociado con mayor riesgo de hemorragia en este contexto4. Estudios prospectivos han demostrado que, a pesar de un mayor riesgo de hemorragia en pacientes con recuento plaquetario menor a 30,000/μL, niveles de fibrinógeno menores a 60 mg/dL y TTPa mayor a 100 s, estos fueron atribuidos a complicaciones por hipertensión portal, lesión vascular o posprocedimiento5.
En un estudio realizado en candidatos para TH, Giannini et al., reportaron una incidencia de complicaciones hemorrágicas de 20% en pacientes con recuento plaquetario menor a 75,000/μL. A pesar de esta observación, los sujetos que recibieron transfusión profiláctica de plaquetas previa al procedimiento fueron más propensos a presentar eventos hemorrágicos. Esto sugiere que la trombocitopenia grave (menor a 50,000 plaquetas/μL) es un fenómeno relacionado con las complicaciones de la cirrosis y el mecanismo fisiopatológico responsable de la hemorragia es el incremento en el gradiente de presión venosa portal6. Por este motivo, las intervenciones dirigidas específicamente al control de la fuente de hemorragia, como son la prevención y el manejo de la hipertensión portal, los protocolos de erradicación de várices esofágicas y la reparación de lesiones vasculares son el aspecto más importante en el tratamiento de estos pacientes.
Recomendación 3. Existe un defecto en la capacidad sintética hepática de los factores de coagulación, anticoagulantes naturales y factores fibrinolíticos en pacientes con cirrosis.
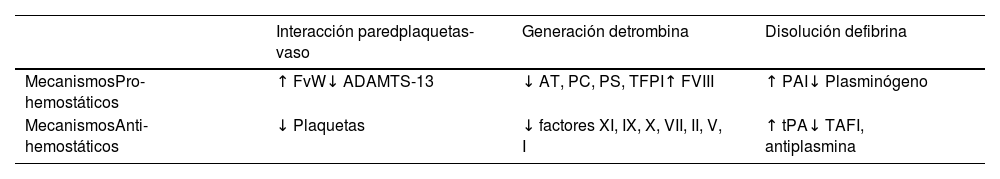
El sujeto con cirrosis muestra múltiples alteraciones en el sistema hemostático, de las cuales las más relevantes son: 1) defectos en la capacidad sintética hepática de los factores de coagulación (FII, FV, FVII, FIX, FX y FXI), que a su vez se contrarresta con una reducción concomitante de inhibidores de coagulación (proteína C, proteína S y antitrombina) y factores fibrinolíticos (plasminógeno)7. Esto resulta en un equilibrio que impide razonablemente el sangrado esperado que podría ser consecuencia de la disminución de factores procoagulantes; 2) incremento en la síntesis de proteínas hemostáticas provenientes del sistema retículo endotelial (FvW, activador tisular del plasminógeno, inhibidor del activador del plasminógeno-1) debido a una activación crónica de las células endoteliales (tabla 1).
Rebalanceo de la hemostasia en pacientes con cirrosis
| Interacción paredplaquetas-vaso | Generación detrombina | Disolución defibrina | |
|---|---|---|---|
| MecanismosPro-hemostáticos | ↑ FvW↓ ADAMTS-13 | ↓ AT, PC, PS, TFPI↑ FVIII | ↑ PAI↓ Plasminógeno |
| MecanismosAnti-hemostáticos | ↓ Plaquetas | ↓ factores XI, IX, X, VII, II, V, I | ↑ tPA↓ TAFI, antiplasmina |
FvW: factor de Won Willebrand; AT: antitrombina; PC: proteína C; PS: proteína S; TFPI: inhibidor del factor tisular de plasminógeno; FVIII: factor VIII; PAI: inhibidor del activador del plasminógeno; tPA: activador del plasminógeno tisular; TAFI: inhibidor activable de la fibrinolisis de trombina.
Recomendación 4. La disminución en la síntesis de plaquetas, secuestro esplénico y destrucción acelerada de estas es compensada por un incremento en la síntesis de proteínas de adhesión plaquetaria, FvW y una disminución de la metaloproteasa similar a la disintegrina con trombospondina tipo 1 motif 13 (ADAMTS-13).
La trombocitopenia afecta a 70% de los pacientes con cirrosis y su descenso puede ser leve (100,000-150,000/μL) a moderado (50,000-100,000/μL), valores menores son considerados como graves8. Múltiples factores contribuyen al desarrollo de trombocitopenia y estos pueden dividirse en aquellos que causan disminución de la producción, secuestro esplénico y aumento de la destrucción. En los sujetos con cirrosis existe un equilibrio en la función plaquetaria, ya que estos presentan trombocitopenia relacionada a la hipertensión portal o a la enfermedad hepática de base, reducción en la metaloproteinasa ADAMTS-13 y alteraciones en la marginalización ocasionadas por la disminución en el hematocrito. Además, existen factores compensatorios como los niveles elevados del FvW.
Los pacientes con cirrosis y trombocitopenia tienen niveles más bajos de trombopoyetina circulante que aquellos con recuentos plaquetarios normales. También ocurre una disminución de la producción de plaquetas en la médula ósea derivada de la reducción de la trombopoyetina o por toxicidad directa sobre todo en personas con consumo de alcohol, algunas infecciones virales crónicas (virus de la hepatitis B y C [VHB y VHC]), sobrecarga de hierro y algunos medicamentos (azatioprina, interferón y antibióticos)9. Una de las primeras y principales causas descritas de trombocitopenia en los pacientes con cirrosis es la ocasionada por el secuestro esplénico. Otro motivo a tomar en consideración sobre todo en aquellos con daño hepático crónico de origen autoinmune o en infección por VHC, es la destrucción mediada por anticuerpos antiplaquetarios. Las situaciones específicas en las que se encuentra la trombocitopenia inmune incluyen la púrpura trombocitopénica inmune (PTI), la hepatitis C crónica, infección y algunos medicamentos10–12. Los individuos con cirrosis se consideran inmunodeprimidos y tienen mayor riesgo de contraer infecciones; en los procesos infecciosos y sobre todo en la sepsis se liberan múltiples citocinas inflamatorias, entre las más importantes están la interleucina 6 (IL-6) y el factor de necrosis tumoral alfa (FNT-α) que aceleran la destrucción de plaquetas, además del aumento en la fibrinólisis13,14. Una de las razones por las cuales el FvW se encuentra elevado es por un incremento en la síntesis por las células endoteliales y una menor actividad sérica de ADAMTS-13, que es una metaloproteinasa sintetizada por el hígado, que se une e inactiva al FvW15–18.
Recomendación 5. Las pruebas convencionales de coagulación (PCC) (TP, INR, TTPa y recuento plaquetario) no reflejan con precisión los cambios hemostáticos y el riesgo de hemorragia en el paciente con cirrosis.
El hígado tiene un papel clave en el proceso de la coagulación, ya que representa el órgano en el cual se sintetiza la mayoría de los factores de esta, así como sus inhibidores19,20. La hemostasia es el resultado de una compleja interacción entre plaquetas, factores de coagulación y endotelio21,22. El TP e INR son pruebas diseñadas para la vigilancia de la anticoagulación en pacientes tratados con antagonistas de la vitamina K. Vieira et al.4 demostraron que las pruebas tradicionales de hemostasia (INR y determinación de plaquetas) no predicen adecuadamente el riesgo de hemorragia en pacientes con cirrosis y ligadura de várices esofágicas. Sin embargo, estos marcadores no reflejan adecuadamente el estado de coagulación in vivo en el sujeto con cirrosis. El INR únicamente evalúa la vía procoagulante y no analiza los defectos de la vía anticoagulante, por lo que no es adecuada en la evaluación de personas con cirrosis que van a someterse a un procedimiento23,24.
Complicaciones relacionadas a sangrado en el paciente hospitalizado con cirrosis sometido a diferentes procedimientos diagnósticos y terapéuticosRecomendación 6. La trombocitopenia en pacientes con cirrosis se correlaciona con la presencia de hipertensión portal clínicamente significativa, sin embargo, su utilidad como predictor de riesgo de hemorragia no está bien establecido.
Existen resultados contradictorios respecto a la asociación de trombocitopenia grave con la presencia de eventos hemorrágicos posterior a procedimientos, pero la mayor evidencia apoya que no hay una relación directa entre el recuento de plaquetas y el riesgo de hemorragia25,26. Los pacientes con enfermedad hepática avanzada y trombocitopenia grave (plaquetas ≤ 50 × 103/μL) sometidos a un procedimiento invasivo pueden tener mayor riesgo de hemorragia, comparado con la trombocitopenia moderada. Sin embargo, existe discrepancia respecto al punto de corte de plaquetas y riesgo de hemorragia en diferentes guías de práctica clínica27. Consideramos que la utilidad clínica del recuento de plaquetas como factor de riesgo de hemorragia en sujetos con cirrosis debe ser analizada en estudios prospectivos.
La evaluación del riesgo de hemorragia en procedimientos diagnósticos o terapéuticos debe tomar en cuenta el grado de hipertensión portal, el estadio de la enfermedad, las comorbilidades, los factores sistémicos y la experiencia del operador. El riesgo de hemorragia está determinado en gran medida por el tipo de procedimiento y la experiencia de quien realiza la intervención. Sin embargo, el grado de insuficiencia hepática, factores sistémicos como la presencia de lesión renal aguda (LRA) e infección pueden contribuir aumentando dicho riesgo28. Shah et al., reportaron en un estudio prospectivo que un grupo de pacientes con cirrosis sometidos a procedimientos de bajo riesgo (principalmente paracentesis) con alteraciones de los parámetros convencionales de coagulación (INR > 1.5, plaquetas < 50,000) no mostraron complicaciones hemorrágicas, al compararse con un grupo con cirrosis con pruebas de coagulación normales o discretamente alteradas29.
Recomendación 7. Las pruebas viscoelásticas (PVE) permiten una evaluación más completa y detallada de la homeostasia de la coagulación en pacientes con cirrosis, en comparación con las convencionales.
La tromboelastografía (TEG) es una técnica de laboratorio utilizada para evaluar la coagulación sanguínea en tiempo real. Proporciona información integral sobre la formación, estabilización y lisis del coágulo, lo que permite una evaluación más completa de la función de la coagulación en comparación con las PCC. La TEG mide la viscoelasticidad de la sangre durante la formación de un coágulo. Consiste en una muestra de sangre que se coloca en una cámara y se somete a un estímulo de activación, como el ácido caolín o el citrato de calcio. A medida que se forma el coágulo, se registran varios parámetros, incluyendo el tiempo de inicio de la coagulación (R), el tiempo de formación del coágulo (K), el ángulo alfa (α), la amplitud máxima (MA) y el tiempo de lisis del mismo (LY30).
La TEG proporciona información valiosa sobre la función de las plaquetas y los factores de coagulación en la formación del coágulo. El R refleja la velocidad de formación de este y está influenciado principalmente por las plaquetas y el fibrinógeno. El K indica la velocidad a la que el coágulo se vuelve lo suficientemente estable como para soportar la tensión. El α representa la velocidad de la formación de fibrina y está relacionado con la actividad de la trombina. La MA indica la firmeza del coágulo y está influenciada por la función plaquetaria y la actividad de la trombina. El LY30 evalúa la capacidad del mismo para disolverse y refleja la actividad fibrinolítica.
La utilidad clínica de la TEG radica en su capacidad para detectar trastornos de la coagulación, tanto hereditarios como adquiridos e identificar deficiencias de factores de coagulación, disfunción plaquetaria y hiperfibrinólisis. Además, la TEG es de utilidad en el monitoreo de la terapia anticoagulante, la evaluación de la coagulopatía en pacientes críticamente enfermos y la predicción del sangrado perioperatorio30.
Recomendación 8. En pacientes con cirrosis que serán sometidos a procedimientos quirúrgicos o invasivos es importante determinar el riesgo asociado a estos para determinar las pautas de intervención.
Los pacientes con cirrosis tienen mayor riesgo de hemorragia ante ciertos procedimientos invasivos; los mecanismos relacionados con mayor riesgo de hemorragia son multifactoriales donde destacan el tipo de intervención, el grado de descompensación hepática, las comorbilidades como la enfermedad renal crónica, medicamentos y alteraciones en la vasculatura por el aumento de la presión portal31,32. Los procedimientos considerados de bajo riesgo de hemorragia se caracterizan por un riesgo estimado < 1.5% de sangrado significativo, así como un adecuado acceso para controlar el sangrado activo en caso de que ocurra. Por el contrario, las intervenciones de alto riesgo confieren una mayor posibilidad de sangrado (riesgo estimado >1.5% de sangrado mayor) y/o difícil control de hemorragia con consecuencias catastróficas incluso en pequeñas cantidades33,34.
Esta clasificación está basada en la opinión de expertos y fundamentada generalmente en el contexto de anticoagulación terapéutica previo a un procedimiento. Sin embargo, es de utilidad al incluir una evaluación multidisciplinaria del riesgo de hemorragia. La habilidad y experiencia técnica del operador impacta directamente en este aspecto. El uso de la guía ecográfica para llevar a cabo diferentes procedimientos como toracocentesis en pacientes con trastornos de coagulación o accesos vasculares durante la realización de derivación transyugular portosistémica intrahepática (TIPS), reduce el riesgo de hemorragia35 (tabla 2).
Clasificación de procedimiento invasivos y quirúrgicos más frecuentes en el paciente con cirrosis según su riesgo de hemorragia
| Bajo riesgo | Moderado riesgo | Alto riesgo |
|---|---|---|
| - Colocación de catéter venoso central.- Cateterización cardiovascular.- Extracción dental- Endoscopia o colonoscopia diagnóstica- Gradiente de presión venosa hepática- Ligadura electiva de várices esofágicas- Paracentesis- Toracocentesis | - Biopsia hepática por vía percutánea o transyugular- Biopsia de otros órganos o lesiones- Colocación de cortocircuito transyugular intrahepático portosistémico (TIPS)- Endoscopia avanzada (esfinterotomía, cistogastrostomía, biopsia mediante ultrasonido endoscópico)- Punción lumbar- Quimioembolización transarterial o percutánea locorregional para tratar hepatocarcinoma | - Cirugía intraabdominal- Cirugía ortopédica- Neurocirugía- Cirugía cardiaca- Inserción de catéter intracraneal- Polipectomía endoscópica- Resección endoscópica de la mucosa o disección endoscópica de submucosa. |
En personas con cirrosis que serán sometidas a procedimientos de bajo riesgo, no se recomienda la transfusión de plaquetas. Se sugiere tener una cifra de > 50,000/μL en quienes serán sometidos a intervenciones de moderado riesgo y mantener metas de plaquetas > 100,000/μL previo a cirugías con riesgo alto de hemorragia como la de columna, cardiaca o colocación de TIPS36,37.
La transfusión de cinco a seis concentrados plaquetarios o de una aféresis plaquetaria logra un aumento de entre 5,000 a 10,000/μL en el paciente con un volumen total infundido de aproximadamente 250 mL de plasma. Por lo cual esto puede conducir a un efecto deletéreo en la hemodinamia de hipertensión portal e inmunológica, generando poco beneficio38.
Recomendación 9. La administración de agonistas de trombopoyetina (TPO) en pacientes con trombocitopenia grave puede ser de utilidad previa a procedimientos invasivos.
La disminución de la producción de plaquetas por los megacariocitos debido a la baja concentración de trombopoyetina es uno de los factores que contribuye a la trombocitopenia en los pacientes con cirrosis hepática. Los TPO son una buena alternativa a la transfusión de plaquetas exclusivamente en caso de procedimientos electivos o programados, ya que su efecto es transitorio y requiere un tiempo de alrededor de 10 días para lograr la elevación requerida en la cifra de plaquetas. Los agonistas de TPO aumentan el recuento de estas al estimular el receptor de TPO. En un estudio que examinó la generación de trombina, los recuentos de plaquetas superiores a 56,000/μL se asociaron con la producción normal de esta38. Existen dos agonistas de TPO que han demostrado eficacia y seguridad en personas con cirrosis y trombocitopenia grave que fueron sometidas a procedimientos invasivos moderados a alto riesgo. El avatrombopag se administra entre 10 a 13 días previos al procedimiento en dosis de 40 mg al día si la cifra de plaquetas del paciente está entre 40,000 a 50,000/ μL y a dosis de 60 mg al día si es inferior a 40,000/μL, la vía de administración es oral y la duración de esta terapia es por cinco días; la mediana en el incremento en la cantidad de plaquetas alcanzada es de 26,500/μL y 34,500/ μL, respectivamente y el tiempo máximo que lograremos mantener la cifra por arriba de 50,000/μL es de unos 20 días; sin embargo, el procedimiento deberá programarse entre dos a ocho días posteriores a la última dosis de avatrombopag para asegurar la cantidad plaquetaria requerida.
Lusutrombopag se administra por vía oral a dosis de 3 mg al día por siete días, debe comenzarse de ocho a 14 días previos al procedimiento, la mediana en el incremento en la cantidad de plaquetas alcanzado es de 45,000/μL y el tiempo máximo que lograremos mantener la cifra por arriba de 50,000/μL es de unos 20 días; no obstante, el procedimiento deberá programarse entre cinco a ocho días posteriores a la última dosis de lusutrombopag para asegurar la cantidad plaquetaria requerida. Ambos análogos de TPO tienen un riesgo trombótico similar al placebo y están contraindicados en el embarazo y en pacientes con historia o que cursan con trombosis venosa portal (TVP) o mesentérica. Otros análogos de TPO como eltrombopag y romiplostim no han sido evaluados en este contexto clínico y por tanto no pueden recomendarse en este momento39–42.
Recomendación 10. No se aconseja el uso rutinario de plasma fresco congelado (PFC) debido al riesgo incrementado de sobrecarga de volumen y daño pulmonar agudo asociado en pacientes con cirrosis sometidos a procedimientos invasivos.
En sujetos con cirrosis cada 100 mL de plasma incrementa 1.4 mmHg la presión portal, la transfusión de más de dos unidades aumentan el volumen circulante y la presión portal más de 7 mmHg, lo que eleva la probabilidad de hemorragia por hipertensión portal. Estudios en esta población han demostrado que, si bien la administración de PFC puede corregir el TP y el INR, no tiene un impacto en cuanto a la generación de trombina. Incluso un estudio más reciente evidenció que, aunque la transfusión de PFC mejora las pruebas de coagulación convencionales, solo logra aumentar la generación de trombina en un número muy limitado de pacientes, e incluso, 34% de los casos analizados presentó una disminución de esta en respuesta a la transfusión de PFC. Los autores sugieren que la transfusión de PFC podría reducir la generación de trombina al reponer la proteína C, una razón más para no recomendar su uso con el fin de corregir el INR en personas con cirrosis43.
Los eventos adversos adicionales que se han relacionado a la transfusión de PFC que deben tomarse en cuenta son: reacciones transfusionales, daño pulmonar agudo, transmisión de infecciones, hipercoagulabilidad y generación de eventos trombóticos, respuesta inflamatoria sistémica, mayor mortalidad, formación de anticuerpos HLA (antígeno leucocitario humano).
Recomendación 11. Se recomienda mantener niveles séricos de fibrinógeno > 120 mg/dL mediante la administración de fibrinógeno sintético o crioprecipitados en caso de hemorragia o previo a un procedimiento invasivo de alto riesgo.
Los pacientes con cirrosis compensada suelen tener niveles normales de fibrinógeno sérico. Estos disminuyen conforme progresa la enfermedad hepática crónica, ocurriendo en hasta 76% de los que padecen cirrosis. La disfibrinogenemia se ha reportado hasta en 76% de los sujetos con esta última enfermedad. La hipofibrinogenemia es un factor de riesgo independiente relacionado al incremento de sangrado en esta población. La frecuencia de eventos hemorrágicos graves particularmente aumenta en aquellos con cirrosis y un nivel de fibrinógeno por debajo de 60 mg/dL43. Además, las concentraciones de esta proteína son un predictor independiente asociado con mayor mortalidad en pacientes cirróticos, demostrándose un aumento de 29% en la mortalidad por cada reducción de 100 mg/dL en el fibrinógeno sérico. En la actualidad se carece de estudios que hayan evaluado y determinado cuales son los valores óptimos en estos sujetos que serán sometidos a procedimientos quirúrgicos o invasivos de moderado a alto riesgo. La mayoría de los expertos sugieren que mantener concentraciones mayores a 100-120 mg/dL puede ser apropiado ya que esta estrategia ha resultado efectiva en el contexto de pacientes con hemorragia aguda para el control hemostático44,45.
Para el reemplazo de fibrinógeno, los datos más claros han sido en traumatismos severos sin cirrosis donde los niveles > 200 mg/dL se asociaron a una hemostasia más efectiva y en pacientes con cirrosis, de manera histórica las concentraciones por debajo de 120 mg/dL han requerido corrección16,46. Su reemplazo convencionalmente se ha realizado con crioprecipitado el cual tiene un volumen de 10 a 20 mL/U. El aumento de fibrinógeno plasmático a partir de 1 U de crioprecipitado por 10 kg de peso corporal será de aproximadamente 50 mg/dL. Una dosis promedio es de 5 a 10 U (50 a 200 mL). Los concentrados de fibrinógeno (50 mg/kg) tienen un volumen más bajo, contenido más estandarizado y falta de compatibilidad cruzada lo que favorecen su uso en la cirrosis y datos recientes sugieren una clara mejora en la hemostasia, pero se requieren más estudios para justificar su uso. Existen ensayos aislados de concentrados de complejo de protrombina que se han utilizado como terapia anticoagulante, ya que la dosis se basa en el contenido del factor IX, a una cantidad de 25-30 UI/kg. Datos recientes sugieren que cifras más bajas pueden ser efectivas en cirrosis, sin embargo, se necesita más evidencia y persiste la preocupación sobre el incremento de riesgo de trombosis31.
El PFC contiene 200 a 450 mg/dL de fibrinógeno; sin embargo, se desaconseja su uso por los motivos expuestos en el enunciado anterior47. Los crioprecipitados contienen entre 1,500 a 1,700 mg/dL de esta proteína y pueden utilizarse como una alternativa cuando no se dispone de otras estrategias para corregir las cifras en el paciente con cirrosis. Además de altas concentraciones de fibrinógeno, los crioprecipitados contienen factores de coagulación completos, incluyendo factores VIII, XIII y FvW; se elaboran mediante el descongelamiento controlado de PFC y, por ello, presentan potenciales riesgos asociados semejantes a los mencionados para el PFC48,49.
El concentrado de fibrinógeno es pasteurizado y se hace de plasma humano; está disponible en un vial simple que contiene de 900 a 1,300 mg de fibrinógeno liofilizado concentrado en polvo para su reconstitución50. Este ofrece una atractiva alternativa para productos sanguíneos alogénicos, por la purificación e inactivación viral durante su fabricación minimizando de manera importante el riesgo asociado con el uso de hemoderivados. También permite una rápida administración de una cantidad estandarizada de fibrinógeno sin causar hemodilución o sobrecarga de volumen. La administración debe ser guiada mediante TEG o tromboelastometría.
Complicaciones relacionadas a la hipercoagulabilidad en el paciente con cirrosis y su manejoRecomendación 12. La incidencia de trombosis venosa profunda en pacientes con cirrosis es similar o mayor a la observada en aquellos sin esta enfermedad.
Como se ha mencionado previamente, el paradigma de la anticoagulación en el paciente cirrótico ha tenido como consecuencia que no se realicen medidas profilácticas para trombosis venosa profunda. El riesgo de tromboembolismo venoso (TEV) en el indiviuo con cirrosis, es igual o más frecuente que en los que no la padecen51,52.
Se ha descrito una incidencia de TEV significativamente menor (0.5%) en pacientes con cirrosis que reciben profilaxis comparada con la del grupo que no se somete a dicho tratamiento (1.8%), con p = 0.05. En estudios retrospectivos se ha demostrado la prevalencia de TEV en personas con cirrosis similar a la población general. En un estudio de casos y control realizado en Dinamarca incluyendo a 99,444 pacientes con TEV y 496,872 controles, se observó que aquellos con cirrosis hepática tenían un riesgo relativo mayor a desarrollar trombosis venosa profunda comparado con el grupo control o con sujetos con enfermedad hepática sin cirrosis. En un metaanálisis que incluyo 695,012 personas con cirrosis comparados con 1,494,660 controles en 11 estudios demostraron un incremento en el riesgo de TEV en aquellos con la enfermedad (odds ratio [OR]: 1.703; intervalo de confianza [IC 95%]: 1.333, 2.175; p < 0.0001)53.
Recomendación 13. Se recomienda el uso de anticoagulación profiláctica en pacientes con cirrosis con riesgo de desarrollar TEV. La posibilidad de complicaciones de sangrado por anticoagulación profiláctica en estos es similar a la que ocurre en aquellos sin la enfermedad.
En pacientes con cirrosis se ha demostrado la subutilización de la profilaxis para trombosis venosa profunda y embolia pulmonar. La prevalencia de sangrado no aumenta en los cirróticos que reciben profilaxis para TEV. Varios estudios han demostrado un incremento de casi el doble en el riesgo de desarrollar TEV en personas con enfermedades hepáticas comparado con el riesgo de grupos control. Se ha descrito que sujetos con cirrosis relacionada a esteatohepatitis y a hepatitis C tienen un mayor riesgo de desarrollar TEV. La mortalidad a 30 días después de la trombosis venosa profunda en aquellos con cirrosis (7%) es mayor que en los que no la padecen (3%)54. Los pacientes con cirrosis y fibrilación auricular han sido excluidos de estudios de anticoagulación profiláctica. En un estudio observacional realizado en Taiwán que incluyó 10,336 sujetos con estos dos padecimientos, el empleo de warfarina en aquellos con cirrosis se asoció a un menor riesgo a desarrollar eventos de isquemia vascular y con un beneficio clínico comparado con el de un grupo control de pacientes sin cirrosis y fibrilación auricular que recibió tratamiento profiláctico55. Se ha demostrado que la anticoagulación no incrementa el riesgo de sangrado de tubo digestivo en personas con cirrosis, aún en aquellas sometidas a ligadura de várices esofágicas56. Debido a que la anticoagulación no aumenta el riesgo de sangrado en estos individuos, se recomienda el uso de profilaxis para TEV de la misma forma a la recomendada en pacientes sin cirrosis57–60.
Recomendación 14. Existe un incremento en la incidencia de TVP en relación con eventos de descompensación hepática en pacientes con cirrosis.
En pacientes con cirrosis, la hipertensión de la circulación porto-esplénica, así como la presencia de micro trombosis favorecen el riesgo de desarrollar TVP27. La incidencia reportada de esta en una serie de 885 sujetos sometidos a TH fue de 13.8%, de los cuales 1.6% presentaron trombosis de ramas intrahepáticas y 5.8% obstrucción completa del tronco principal de la vena porta60. La incidencia de TVP en personas sin cirrosis es baja. En un análisis estadístico en 247,728 necropsias realizadas en Japón, Okuda et al. reportaron una incidencia de TVP de 0.054% en pacientes sin cirrosis y 6.59% en aquellos con la enfermedad61. Un estudio epidemiológico en 779 individuos receptores de TH entre 1987 a 1996 reportó una incidencia de TVP de 8.1%. Yasir et al.62, informaron en un estudio de 461 pacientes con cirrosis de varias etiologías una incidencia de TVP de 9.8%. La mayoría (71.5%) se encontraban con la enfermedad descompensada. La TVP no se relacionó con una etiología en particular. Recientemente se ha observado un incremento gradual en la incidencia de TVP en personas con enfermedad hepática crónica. Cool et al.63 observaron una prevalencia de TVP de 1.5%, en un estudio observacional de una base de datos de 3,045,098 pacientes egresados de hospitales de EE. UU. de 1998 a 2014. Se halló un incremento en la prevalencia de 0.7 a 2.4%, con un cambio en el porcentaje anual de 9%. En un análisis de regresión logística se demostró que la TVP eleva significativamente el riesgo de LRA (OR 1.75, p < 0.001) y síndrome hepatorrenal (OR 1.62, p < 0.001), además se ha asociado a un incremento en la mortalidad (OR 1.12, p = 0.001).
Recomendación 15. La presencia de TVP en pacientes con cirrosis incrementa la dificultad técnica en la realización de TH y debe ser evaluada de forma rutinaria previo al mismo.
En 1985, Shaw et al.64 reportaron los primeros casos exitosos de TH en el contexto de TVP del receptor. Esta se consideraba una contraindicación absoluta para el TH debido al riesgo de mortalidad intraoperatoria y la dificultad técnica durante la cirugía. Los avances en la técnica, la mayor experiencia con el procedimiento quirúrgico y el mejor manejo de la anestesia, han hecho que el TH en pacientes con cirrosis y TVP sea cada vez más un procedimiento rutinario.
La TVP en cirrosis se asocia con una mayor complejidad operatoria y con el desarrollo de re-trombosis posoperatoria. La TVP en el paciente sometido a TH se ha vinculado a un mayor tiempo operatorio, a requerimientos más elevados de transfusión, mayor tasa de reintervención y menor tasa de supervivencia65. Además, la re-trombosis portal, el uso de diálisis y las complicaciones infecciosas aumentan en sujetos con TVP66. Kim et al. en un estudio de 2011, observaron que en pacientes sometidos a TH de donante vivo con injertos de lóbulo derecho y TVP tenían una mayor necesidad de transfusiones, estancias más prolongadas en la Unidad de Cuidados Intensivos y mayor probabilidad de hemorragias en comparación con aquellos sin TVP. La mayor utilización de recursos fue más pronunciada en personas con TVP oclusiva en comparación con aquellas con la modalidad no oclusiva67.
En un análisis de la base de datos de United Network of Organ Sharing (UNOS) se demostró que los receptores con TVP previa al trasplante tienen un mayor riesgo de desarrollar trombosis de la arteria hepática y pérdida del injerto68. En los centros de trasplante con experiencia en TH en pacientes con TVP, el uso de un enfoque multidisciplinario puede conducir a excelentes resultados a corto y largo plazo, incluso con TVP de alto grado. Aunque la innovación en técnicas quirúrgicas ha reducido el umbral para realizar TH en candidatos con TVP, aquellos con trombosis oclusiva y la que se extiende a las venas mesentéricas continúan teniendo resultados subóptimos, por lo que en casos de una oclusión extensa se puede contraindicar el trasplante a menos de que se someta al paciente a un tratamiento de apertura vascular69,70.
Recomendación 16. Se recomienda caracterizar la TVP de acuerdo con su localización, extensión, porcentaje de oclusión intraluminal y cronicidad.
Existe discrepancia en la literatura respecto a la terminología y sistemas de clasificación de la TVP, debido a la diversidad de manifestaciones clínicas, causas y opciones terapéuticas. Por este motivo, es necesario categorizar a estos pacientes de forma estandarizada para permitir comparaciones entre estudios clínicos. El tiempo de evolución es un factor que se ha asociado con la probabilidad de recanalización en sujetos con TVP. Plessier et al. demostraron en un estudio prospectivo en individuos con TVP de reciente diagnóstico, que la probabilidad de recanalización disminuye significativamente si esta se encuentra presente por más de seis meses. De hecho, aquellos con TVP de más de seis meses de duración tenían un riesgo mayor a desarrollar degeneración cavernomatosa de la porta, a pesar de haber sido tratados con terapia anticoagulante71.
De acuerdo con estos hallazgos, se ha justificado utilizar un punto de corte de seis meses para distinguir a los pacientes con TVP «crónica» (> 6 meses) o «reciente» (< 6 meses). El término «reciente» permite definir de manera más precisa el tiempo de evolución en lugar de «agudo», debido a que no todos presentan sintomatología al momento del diagnóstico61. Múltiples sistemas de clasificación han sido desarrollados para catalogar la TVP, primordialmente en sujetos enlistados para TH, considerando la localización, extensión, evolución y respuesta al tratamiento72,73.
Northup et al. han propuesto recientemente una nomenclatura estandarizada para la descripción de TVP para la utilización en el contexto clínico y con fines de investigación. En esta clasificación se considera el tiempo de evolución, el porcentaje de oclusión de la vena porta principal, la transformación cavernomatosa de la porta y la respuesta al tratamiento y/o evolución del trombo (tabla 3)27.
Nomenclatura estandarizada recomendada para la descripción de TVP en el contexto clínico y de investigación
| Tiempo de evolución | |
| - Reciente- Crónica | TVP presente por menos de 6 mesesTVP presente por más de 6 meses |
| Porcentaje de oclusión de la vena porta principal | |
| - Oclusión completa- Oclusión parcial- Oclusión mínima- Transformación cavernomatosa | Trombo persistente que obstruye 100% del lumen original del vasoTrombo que obstruye más de 50% del lumen original del vasoTrombo que obstruye menos de 50% del lumen original del vasoColaterales porto-portales sin vena porta original visible |
| Respuesta al tratamiento o cambios en intervalo | |
| - Progresiva- Estable- Regresiva | Trombo que aumenta de tamaño o progresa a oclusión completaAusencia de cambios apreciables en tamaño u oclusión completaDisminución en tamaño del trombo o grado de oclusión |
TVP (trombosis de la vena porta).
Recomendación 17. No se recomienda realizar una evaluación exhaustiva para identificar trastornos de hipercoagulabilidad primaria en sujetos con cirrosis y TVP.
En el paciente cirrótico coexisten múltiples factores de riesgo para el desarrollo de la TVP. Los principales son la enfermedad hepática subyacente y la severidad de la hipertensión portal. La descompensación previa de la cirrosis y la trombocitopenia son factores que pueden predecir el riesgo de TVP, lo cual sugiere el papel que desempeña la severidad de la hipertensión portal en la fisiopatología de la TVP. A pesar de que el desarrollo de esta última se asocia significativamente con la severidad de la enfermedad hepática basal, existe controversia al respecto, ya que en un estudio multicéntrico de 1,243 pacientes con cirrosis sin TVP vigilados durante 47 meses se demostró que la progresión de la enfermedad hepática no se asoció a la TVP74.
La disminución en la velocidad de flujo venoso portal determinado por el ultrasonido Doppler se ha asociado con el incremento del riesgo a presentar TVP. Stine et al., demostraron en una cohorte de 100 pacientes con cirrosis que la velocidad de flujo venoso portal fue el factor independiente de riesgo más importante para predecir el desarrollo de TVP. La velocidad de flujo venoso menor a 15 cm/s tuvo una asociación altamente significativa con esta entidad (hazard ratio [HR] 6.00, IC 95% 2.20-16.4, p = 0.0001)75. En sujetos con cirrosis relacionada a infección viral, se ha demostrado que el desarrollo de vasos colaterales puede ser un factor que predice la TVP76.
La hipercoagulabilidad, los cambios hemodinámicos y la lesión endotelial son los tres principales factores relacionados con el desarrollo de trombosis. Sin embargo, el papel de la hipercoagulabilidad en TVP en pacientes con cirrosis ha sido controversial. Múltiples estudios han identificado una disminución significativa en la concentración de inhibidores naturales de la coagulación en el sujeto cirrótico. Varios ensayos han tratado de elucidar la relación entre el desequilibrio procoagulante en estas personas y el riesgo a desarrollar TVP. A pesar de existir una disminución significativa en las concentraciones séricas de proteína C, proteína S y antitrombina en pacientes con TVP, únicamente la reducción en la velocidad de flujo venoso portal se ha vinculado de forma independiente con la presencia de TVP77.
Tang et al. reportaron en un estudio prospectivo de 151 pacientes con cirrosis con TVP (n = 20) y sin TVP (n = 131) una disminución significativa en los niveles séricos de proteína C, proteína S y antitrombina (p = 0.001, p = 0.05 y p = 0.001, respectivamente), con descenso progresivo a mayor severidad de la cirrosis. Sin embargo, no se identificó una asociación significativa entre la disminución de anticoagulantes naturales con el desarrollo de TVP78.
Recomendación 18. En pacientes con cirrosis de etiología autoinmune y presencia de TVP se recomienda evaluar, de acuerdo con el juicio clínico, los trastornos de hipercoagulabilidad primaria.
Las hepatopatías autoinmunes son enfermedades crónicas inflamatorias con un espectro clínico muy amplio que incluye la falla hepática aguda, el desarrollo de hepatopatía avanzada y/o carcinoma hepatocelular (CHC). Se han reportado casos de hepatitis autoinmune (HAI) asociados con trastornos trombóticos con una alta tasa de anticuerpos anticardiolipina positivos al compararlos con enfermos hepatópatas por otras etiologías79. En algunos estudios que incluyeron subgrupos pequeños de pacientes, se encontró una mayor prevalencia de TVP en aquellos con HAI80,81.
En un ensayo realizado en el Hospital Clínico, en Barcelona, se analizó una cohorte de 37 pacientes con HAI e indicación de TH. Se documentó TVP pretrasplante en 30% (n = 11) en comparación con 11% en el resto de la población de los 2,011 trasplantados entre 1998 a 2016 en ese mismo centro (p = 0.02). Al incluir solo a aquellos con cirrosis la TVP se presentó en 55% en el grupo de HAI, porcentaje significativamente mayor que 12% en la cohorte de trasplantados (p < 0.001). En los casos con TVP, se evaluó la presencia de algún trastorno protrombótico con la determinación de anticuerpos anticardiolipinas inmunoglobulina G (IgG) e inmunoglobulina M (IgM), deficiencia de proteína C y S en plasma, la mutación del factor V de Leiden y la del gen 20210 de la protrombina. En 13 de los sujetos se obtuvo el panel protrombótico y solo en un caso se documentó síndrome antifosfolípido. De forma interesante, en este pequeño estudio, de los 11 individuos con TVP pretrasplante, a cinco se les inició anticoagulación temprana por uno a seis meses. Ninguno de los que la recibió desarrollo TVP en comparación con 2/6 que no se anticoagularon, uno a los nueve y el otro a los 20 meses postrasplante. Este estudio sugiere la posible contribución en la TVP de factores protrombóticos en la población de cirrosis autoinmune y el potencial beneficio de la anticoagulación temprana en este grupo de pacientes, sin embargo, se requieren más estudios que confirmen estos hallazgos82.
Recomendación 19. Se recomienda realizar estudios para la detección temprana de CHC en pacientes con cirrosis y TVP.
La prevalencia de la TVP es mayor en sujetos con cirrosis hepática y CHC y oscila entre 35 y 40%1,2. En un estudio israelita, se documentó que 38.4% de los casos de diagnóstico de TVP reciente se asoció a la detección concomitante de CHC83. La invasión tumoral de la vena porta con trombosis es una complicación frecuente del mismo con incidencias reportadas de 36 a 44%84,85. Al detectar TVP debe investigarse la presencia de CHC y definir si está o no asociada a lesión tumoral, ya que el pronóstico y manejo subsecuente se debe adecuar a los diferentes escenarios.
El diagnóstico de TVP puede realizarse con el ultrasonido semestral de vigilancia del CHC con una sensibilidad y especificidad de 80 a 100% que varía de acuerdo con la experiencia del operador86. Sin embargo, para la detección y confirmación del CHC se debe efectuar estudios dinámicos (tomografía multifásica y/o resonancia magnética) de acuerdo con las guías internacionales87,88. Estás últimas dos modalidades de imagen permiten evaluar la extensión de la trombosis, hacer un mapeo de las colaterales porto-sistémicas y diagnosticar si la TVP está vinculada a invasión tumoral de la vena porta.
Recomendación 20. Se recomienda iniciar anticoagulación (preferentemente con heparina no fraccionada) en pacientes con TVP aguda y sospecha de isquemia intestinal.
En sujetos con cirrosis e hipertensión portal que desarrollan TVP, la isquemia intestinal es mucho menos frecuente comparado con aquellos sin cirrosis, debido al desarrollo de colaterales porto sistémicas formadas con anterioridad61. El síntoma principal de la TVP aguda es el dolor abdominal (90%) que abarca desde un cuadro inespecífico de dispepsia hasta uno de abdomen agudo con isquemia intestinal, sobre todo en caso de afectación de las venas mesentéricas. La presencia de isquemia intestinal debe sospecharse cuando el cuadro clínico se acompaña de hematoquecia o rectorragia, irritación peritoneal, leucocitosis y acidosis metabólica89.
En todos los pacientes con TVP aguda y sospecha de isquemia intestinal, la anticoagulación es esencial y debe iniciarse de manera inmediata vía subcutánea o parenteral. Los objetivos del tratamiento son recanalizar las venas trombosadas y prevenir el desarrollo tanto del infarto intestinal como de las complicaciones de la hipertensión portal. Se recomienda iniciar la anticoagulación de forma inmediata, ya sea con heparina no fraccionada en infusión o heparina de bajo peso molecular (HBPM)90,91. En el caso de isquemia intestinal con posibilidad de intervención quirúrgica, falla renal o riesgo de sangrado elevado, se prefiere utilizar heparina no fraccionada, ya que la coagulación puede corregirse en un tiempo menor por su vida media corta (una a dos horas), y posteriormente emplear HBPM.
Se recomienda en isquemia intestinal la valoración por un equipo multidisciplinario (cirugía, hepatología, cuidados intensivos, radiología intervencionista y hematología) además del ayuno y antibióticos profilácticos. En caso de infarto intestinal se sugiere un abordaje quirúrgico.
Recomendación 21. Se recomienda la utilización de anticoagulantes orales de acción directa (AOAD), en lugar de antagonistas de vitamina K (AVK), en pacientes con cirrosis compensada que requieren anticoagulación a largo plazo.
Existe controversia respecto el beneficio del tratamiento anticoagulante en sujetos con cirrosis y TVP. Si bien se ha descrito la recanalización espontánea de la TVP en un porcentaje importante de pacientes cuando la TVP es parcial, también se ha observado una elevada posibilidad de progresión de la trombosis (48-70% en un seguimiento de dos años). Al momento de considerar el inicio del tratamiento anticoagulante se debe tener en consideración los siguientes puntos92,93:
- -
Si el paciente está en lista de TH o si es potencialmente trasplantable.
- -
Respecto a la extensión de la trombosis, si esta es reciente y se pueden identificar los vasos o es una trombosis crónica con degeneración cavernomatosa de la vena porta.
- -
En pacientes con cirrosis y trombosis reciente de ramas portales pequeñas intrahepáticas o de vena porta principal mínima (< 50% de obstrucción de la luz), se recomienda vigilancia con estudios de imagen seriados cada tres meses sin anticoagulación. En caso de progresión del trombo, se sugiere iniciar tratamiento anticoagulante.
- -
En personas con cirrosis y TVP principal o mesentérica, ya sea oclusiva o parcial (> 50% de obstrucción de la luz) de reciente aparición, está indicada la anticoagulación para evitar la progresión de la trombosis y que pudiera afectar en un futuro la posibilidad del TH.
- -
En aquellos sujetos con trombosis crónica y oclusión total de la vena porta con formación cavernomatosa, que presenten colaterales establecidas no se recomienda la anticoagulación o tratamiento intervencionista, por lo que en el manejo debe centrarse en las complicaciones de la hipertensión portal.
Tratamiento de la TVP en candidatos a TH: la TVP tiene un mayor impacto en el contexto del TH ya que puede llegar a contraindicar el trasplante. Los pacientes con una TVP extensa y sobre todo cuando afecta la vena mesentérica superior (VMS) pueden requerir la realización de una anastomosis no-fisiológica durante el TH, lo que se ha asociado a una mayor morbi-mortalidad postrasplante. Por ello, en personas en lista de espera o posibles candidatos a trasplante con TVP es indicado el tratamiento anticoagulante con el objetivo de permitir una reconstrucción fisiológica porto-portal, recanalizando la vena porta o al menos evitando la progresión del trombo y extensión a VMS94.
Tratamiento de la TVP en pacientes no candidatos a TH: la extensión de la TVP a la VMS con isquemia intestinal es una indicación incuestionable de tratamiento anticoagulante95.
Tratamiento farmacológico: el tratamiento anticoagulante se recomienda con enoxaparina 1 mg/12 h o 1.5 mg/24 h. La HBPM se sugiere por cuatro semanas pasada la fase aguda, se podría sustituir por anticoagulantes orales (AVK o AOAD) si no hay contraindicaciones. Los anticoagulantes orales y la heparina se consideran seguros en los pacientes con cirrosis, con tasas de hemorragia similares a las de la población general. El riesgo de hemorragia por várices tampoco se incrementa si se realiza una adecuada profilaxis primaria o secundaria. Por ello, antes del inicio de anticoagulación deberá efectuarse una gastroscopia para descartar várices esofágicas e iniciar profilaxis de acuerdo con los hallazgos endoscópicos.
En pacientes con TVP, históricamente se ha utilizado la heparina no fraccionada, HBPM y los AVK. La terapia con AVK puede verse afectada por una prolongación basal del INR en los sujetos con cirrosis, creando una incertidumbre con respecto al objetivo terapéutico. Por otro lado, las HBPM tienen el inconveniente de la aplicación subcutánea que dificulta su utilización a largo plazo.
En pacientes con cirrosis compensada, los AOAD parecen tener un perfil de seguridad similar a la que presentan los sujetos sin la enfermedad. El uso de los AOAD en quienes padecen cirrosis se basa en pequeños estudios de cohorte y se ha expandido a diferentes indicaciones, incluyendo fibrilación auricular, trombosis venosa profunda y TVP96,97. Los AOAD (dabigatrán, apixabán, rivaroxabán y edoxabán) parecen ser una buena opción terapéutica, ya que permiten un mejor apego farmacológico por diferentes razones, entre ellas, su administración oral y no necesidad de ajuste de dosis de acuerdo con el TP. Sin embargo, se requieren más estudios en esta población para establecer su seguridad y eficacia. Se recomienda utilizarlos con precaución en pacientes con hipertensión portal significativa. En casos de cirrosis descompensada e insuficiencia renal es preferible el empleo de AVK98-100.
Recomendación 22. Se recomienda considerar la realización de trombólisis local o sistémica, asociada o no a terapia con derivación portosistémica intrahepática transyugular (TIPS), en pacientes con isquemia intestinal persistente a pesar del tratamiento anticoagulante.
La trombólisis (local o sistémica) se ha propuesto como tratamiento para lograr la recanalización en aquellos casos de TVP reciente, con resultados muy similares a los de la anticoagulación. No se recomienda utilizar la trombólisis de forma rutinaria debido a que se asocia a un mayor riesgo de morbilidad y mortalidad que la anticoagulación.
En aquellos casos que exista una trombosis porto-mesentérica expansiva con datos de isquemia intestinal, con riesgo de infarto intestinal y muerte, la trombólisis combinada con anticoagulación puede ser una alternativa para lograr la recanalización. En un estudio reciente de serie de casos (siendo el de mayor número de casos reportados hasta la actualidad), se incluyeron 22 pacientes con mal pronóstico y alto riesgo de infarto intestinal, sometidos a trombólisis sistémica escalonada (alteplase), logrando recanalización en 86% de los casos. Las tasas de complicaciones fueron de 9%, bajas en comparación a lo publicado previamente101. El TIPS es una terapia complementaria eficaz para reducir la hipertensión portal y también para recanalizar la vena porta, que permite una permeabilidad sostenida de dicha estructura vascular. A través del TIPS se puede realizar un acceso directo de la vena porta para poder efectuar la trombólisis y la angioplastia de los vasos afectados con el objetivo de recanalizar el flujo portal. En un estudio que incluyó 70 sujetos consecutivos con cirrosis hepática y TVP, se les colocó un TIPS, logrando la recanalización completa en 57%, manteniéndose permeable durante el seguimiento en 95%. La trombectomía transyugular, la fibrinólisis local y/o el TIPS, son alternativas de tratamiento que deben considerarse solo en casos muy seleccionados, sobre todo en los que la isquemia intestinal persista a pesar de la anticoagulación.
Recomendación 23. La recanalización de la vena porta seguida de TIPS se considera en pacientes que serán sometidos a trasplante o en aquellos con sangrado variceal recurrente y/o ascitis refractaria.
Los pacientes cirróticos con TVP candidatos a TH y complicaciones de la hipertensión portal refractarias al tratamiento habitual, se deberán valorar para realizar recanalización portal ± TIPS mediante técnicas de angio-radiología intervencionista, con la intención de permitir una anastomosis fisiológica entre el injerto y vena porta del receptor. Se debe considerar la recanalización portal con TIPS en sujetos que presenten progresión de la TVP a pesar de la anticoagulación, y en aquellos con TVP crónica o cavernoma con complicaciones graves de la hipertensión pulmonar (HTP), por ejemplo, en hemorragia por várices o ascitis refractaria. Cuando se considera la colocación de TIPS, es crucial tener un estadiaje detallado de la TVP (tiempo de evolución del trombo, ramas portales identificables, presencia de cavernoma). El TIPS puede ser más factible técnicamente en pacientes con trombosis reciente y con vaso identificable, incluso si la trombosis es completa. No obstante, en aquellos casos con TVP crónica y/o cavernomatosis portal puede ser necesaria la realización de una recanalización portal con TIPS, procedimiento que requiere frecuentemente un acceso por vía percutánea transesplénica o transhepática102. En algunos estudios pequeños retrospectivos se ha demostrado que el abordaje transesplénico para acceder a la vena porta trombosada es superior que el transhepático, con alta tasa de éxito (60 de 61 casos)103. La anticoagulación después de la colocación de TIPS en general no es necesaria, pero ello deberá ser individualizado teniendo en cuenta la persistencia de los restos de trombo subsidiarios de recanalización y/o el reconocimiento de una enfermedad protrombótica subyacente.
Manejo de la coagulación en pacientes con insuficiencia hepática aguda sobre crónica (IHAC) o trasplante hepáticoRecomendación 24. En el paciente con cirrosis e IHAC, ocurren de manera simultánea condiciones que favorecen la hipocoagulabilidad (sepsis, LRA y disfunción endotelial) e hipercoagulabilidad (activación plaquetaria, estasis venosa, inflamación y deshidratación).
Existe un perfil fibrinolítico mixto en sujetos con cirrosis y descompensación aguda, pudiendo observar tanto la presencia de hiper o hipofibrinólisis. Se ha demostrado la hipofibrinólisis asociada a sepsis, falla orgánica y mortalidad a corto plazo en esta población, secundaria a defectos en la depuración de microtrombos intraorgánicos104. Hay una menor agregación y secreción plaquetaria en los pacientes con cirrosis y LRA lo que condiciona un incremento en la tendencia a la hemorragia. Además, en estos sujetos el factor VIII aumenta y las proteínas C, S y la antitrombina están disminuidas y al conjuntarse con mayor producción de trombina favorece la hipercoagulabilidad. El factor XIII se reduce en presencia de LRA lo cual eleva la tendencia a la hemorragia.
La LRA es una complicación frecuente en pacientes con cirrosis, la cual se asocia con mayor riesgo de hemorragia. Intagliata et al. demostraron una reducción significativa en los niveles del factor XIII en sujetos con cirrosis descompensada y LRA. Estos hallazgos sugieren que la deficiencia de factor XIII en estos casos puede incrementar el riesgo de hemorragia105. En personas con cirrosis descompensada, la LRA se asocia con características de hipocoagulabilidad e hipercoagulabilidad, lo cual incrementa potencialmente el riesgo de hemorragia y trombosis. Zanetto et al., demostraron en una población con cirrosis descompensada y LRA, menor agregación plaquetaria, aumento de factor VIII, disminución de proteína C, proteína S y antitrombina, lo que junto con una mayor generación de trombina favorece un estado de hipercoagulabilidad. Por el contrario, se observó disminución del factor XIII en estos pacientes, lo cual confiere riesgo de hemorragia. Finalmente, a pesar de los cambios hipofibrinolíticos e hiperfibrinolíticos presentes en la LRA, un mayor complejo plasmina-antiplasmina indicó un estado hiperfibrinolítico. Después de la resolución de la LRA, la fibrinólisis permaneció hiperactivada106.
La cirrosis descompensada y la IHAC responden de igual manera a la sepsis que está asociada a cambios hemostáticos, debido a la respuesta inflamatoria del huésped a los agentes infecciosos que llevan a la sobreexposición de mediadores inflamatorios. Se cree que esto, junto con los microorganismos y sus derivados, favorecen los cambios que condicionan la formación masiva de trombina y esta a su vez la de fibrina. Esto produce el deterioro de las vías fisiológicas anticoagulantes debido a la disfunción de las células endoteliales, por la sobreproducción del inhibidor del activador de plasminógeno tipo 1 por las células endoteliales disfuncionales y que genera la supresión de fibrinólisis y probablemente también a la activación mediada por trombina del inhibidor de fibrinólisis activable por trombina.
Recomendación 25. Los pacientes con IHAC suelen presentar prolongación del tiempo de coagulación y retraso en la formación y firmeza del mismo.
De acuerdo con los resultados de un estudio prospectivo diseñado específicamente para caracterizar el perfil de la TEG en pacientes con IHAC en comparación con aquellos con descompensación aguda, se demostró que los individuos con IHAC frecuentemente presentan un patrón de hipocoagulabilidad con retraso en el inicio y en la velocidad de formación del coágulo y disminución de su firmeza. Estas alteraciones empeoraron después de la admisión hospitalaria y se correlacionaron con la presencia de inflamación sistémica, vinculándose así con mayor mortalidad a corto plazo. Por otra parte, dichas alteraciones persistieron durante el seguimiento de los sujetos con IHAC y en cambio, tendieron a normalizarse en aquellos con descompensación aguda sin IHAC107.
La hipocoagulabilidad se ha observado en pacientes con cirrosis hepática descompensada sin IHAC, de hecho, Kleinegris et al.108 evaluaron la generación de trombina plasmática y la formación de coágulo sanguíneo (tromboelastometría rotacional [ROTEM]) en 73 sujetos descompensados y reportaron retraso en la formación del coágulo y disminución de su firmeza en la TEG, lo cual se asoció con un incremento en la gravedad de la cirrosis. Asimismo, es importante considerar otros factores que contribuyen a las alteraciones de la coagulación en personas con IHAC y que favorecen la tendencia a la hemorragia, como es la insuficiencia renal que es frecuente en este grupo y que implica un riesgo mayor de sangrado debido principalmente a la disfunción plaquetaria adquirida109.
Recomendación 26. Los parámetros basales de la TEG tienen una mayor capacidad pronóstica que el INR en pacientes con IHAC.
La TEG es un estudio global y dinámico de la coagulación que evalúa las propiedades viscoelásticas de la sangre no centrifugada desde la formación inicial del coágulo hasta su firmeza final en sangre completa. La TEG se considera como una prueba más confiable para evaluar la coagulación que otras estándar de coagulación para guiar las transfusiones en pacientes que requieren cirugías mayores, incluido el TH107. La TEG suele ser normal en aquellos con cirrosis hepática compensada. En algunos estudios se ha observado que este análisis constituye una herramienta pronóstica adicional en personas con IHAC que se correlaciona mejor con la supervivencia a corto plazo en comparación con los resultados de los estudios de coagulación estándar107.
Manejo de la coagulación en pacientes con insuficiencia hepática agudaRecomendación 27. En pacientes con insuficiencia hepática aguda (IHA) que serán sometidos a un procedimiento invasivo, las PVE comparadas con las PCC (TP, TTPa, INR, plaquetas) son de mayor utilidad para evaluar el riesgo de sangrado y disminuir los requerimientos transfusionales.
La IHA es un síndrome caracterizado por el desarrollo de encefalopatía hepática y coagulopatía dentro de 26 semanas del inicio de la enfermedad hepática aguda110,111. Los pacientes con IHA tienen un sistema hemostático «reequilibrado» con características similares a las observadas en aquellos con cirrosis. Cursan con hipercoagulabilidad e hipofibrinólisis, además de un disbalance en el eje FvW/ADAMTS-13, niveles elevados de micropartículas procoagulantes y factor VIII, estas alteraciones incrementan el riesgo de trombosis intrahepática y sistémica112,113. En la IHA, la elevación del TP/INR no significa que haya un riesgo de sangrado mayor, ya que solo mide la actividad de factores procoagulantes, pero continúa siendo de utilidad como indicador pronóstico de resultado y de la necesidad de TH114.
Estudios clínicos han mostrado una discrepancia entre los resultados de las pruebas de PCC y las PVE a pesar de los valores anormales de los primeros115. Hawkins y Seetharan et al., observaron en 51 pacientes con IHA que a pesar de tener un INR elevado, dos tercios (63%) tenían PVE sin alteraciones y cuatro (8%) tenían un estado de hipercoagulabilidad, también reportaron que el número de complicaciones trombóticas fue más alto que los eventos de sangrado116,117.
Agarwal et al., evaluaron 20 pacientes con IHA y sus resultados fueron similares, sin observar correlación entre los valores de TP y el perfil de las PVE, encontrando trazos hipocoagulables en 20%, normales en 45% e hipercoagulables en 35%. No hubo complicaciones de sangrado significativas y no se requirieron transfusiones118. Basados en la evidencia reciente de una hemostasia balanceada, la transfusión profiláctica de hemoderivados no está justificada y puede exponer a los pacientes a efectos adversos como sobrecarga de volumen, infecciones y reacciones transfusionales. Se debe corregir la coagulación solo en caso de procedimientos invasivos con alto riesgo de sangrado (inserción de monitores de PIC (presión intracraneal), punción lumbar, etc.) y en la presencia de hemorragia activa significativa119-121. En conclusión, las PVE son útiles, sin embargo, no representan el verdadero equilibrio hemostático en IHA porque carecen de información acerca de la activación del sistema anticoagulante de la proteína C y son insensibles al FvW122. Estas pruebas pueden eventualmente tener un papel en la evaluación de la coagulación, aunque actualmente no existe evidencia clínica de alta calidad. En un futuro, su estandarización es probable que represente una forma más completa de manejar las alteraciones de la coagulación en este grupo de pacientes.
Manejo de la coagulación en pacientes con trasplante hepaticoRecomendación 28. En pacientes con cirrosis que serán sometidos a un TH, los métodos viscoelásticos comparados con las PCC (INR, TPT, plaquetas) son de mayor utilidad para evaluar el riesgo de sangrado.
Las PVE se utilizan en el trasplante de hígado desde 1985 y son parte de los protocolos estándar en muchas instituciones117,123-126. Las alteraciones de la coagulación en el paciente que será sometido a trasplante de hígado son complejas y pueden diferir de acuerdo con la enfermedad subyacente y condiciones del donador, entre otros factores. El trasplante de hígado es una intervención que involucra varias fases siendo las etapas anhepática y de reperfusión donde se producen los trastornos de coagulación más severos, además la isquemia y el trauma tisular pueden desencadenar alteraciones similares a la coagulopatía inducida por trauma e hiperfibrinólisis. Este procedimiento tampoco está exento de la presencia de eventos trombóticos, los cuales contribuyen a un incremento sustancial en la mortalidad, por lo que mantener la hemostasia y evitar la trombosis en estos pacientes es un reto127. De acuerdo con diversos estudios clínicos, las PVE reflejan mejor que las PCC la compleja dinámica de la coagulación, evaluando en tiempo real la coagulopatía pretrasplante, la coagulopatía dilucional y la hipofibrinogenemia o hiperfibrinólisis y con ello permiten guiar una estrategia de resucitación juiciosa de productos sanguíneos en el TH128-134. Aunque, aún se requieren estudios prospectivos de alta calidad para evaluar su utilidad real.
Recomendación 29. En pacientes con cirrosis que serán sometidos a un TH, el uso de PVE disminuye la transfusión de productos sanguíneos comparado con las PCC (INR, TPT, plaquetas).
En 2010 Wang et al., realizaron un estudio prospectivo aleatorizado incluyendo a 28 pacientes quienes serían sometidos a trasplante de hígado, se asignaron a estrategias de transfusión de acuerdo con PCC y PVE. Los sujetos del grupo de PVE tuvieron menores requerimientos transfusionales de PFC, casi 50%, y sus pérdidas sanguíneas fueron menores, demostrando que el empleo de PVE fue seguro y benéfico, aunque el tamaño de la muestra fue pequeño para lograr una significancia estadística131. Smart et al., efectuaron un estudio retrospectivo en un solo centro, se incluyeron 34 pacientes a quienes se realizó TH, utilizando ROTEM para guiar la transfusión y se comparó con 34 controles con terapia transfusional guiada por PCC. El grupo de ROTEM tuvo menores pérdidas sanguíneas y menores requerimientos de plasma, sin embargo, tuvo mayor transfusión de crioprecipitados135.
Álamo et al.134, describen una serie de casos control en 303 receptores de trasplante de hígado, mostrando que, en pacientes con un alto riesgo de sangrado durante el trasplante, se observó una reducción en el uso de productos transfusionales, en complicaciones posoperatorias e insuficiencia renal y mejor preservación del injerto, con menor prevalencia de disfunción y falla primaría del implante. Se han realizado muchos estudios en el periodo perioperatorio para correlacionar los resultados de sujetos con trasplante de hígado y comparar las diferentes PVE obteniendo valores muy diversos dependiendo de las pruebas empleadas. La evidencia disponible sugiere que la implementación de las PVE comparadas con las PCC implica una mejora en los métodos actuales, con la importante ventaja de disminuir la necesidad de transfusiones sanguíneas. Existen todavía limitaciones, como la experiencia del cirujano, el manejo anestésico, las características del donador, además de la propia heterogeneidad del paciente con cirrosis, lo cual dificulta la aplicación de algoritmos de transfusión estándar136.
Recomendación 30. La administración del complejo protrombínico en la cirugía de TH es superior al uso de PFC para corregir la coagulación durante el perioperatorio.
Los complejos protrombínicos son producidos por intercambio de iones por cromatografía de grandes cantidades de plasma después de remover la antitrombina y el factor XI. Diferentes técnicas en el proceso llevan a la producción de concentrado de tres factores (II, IX y X) o cuatro (II, VII, IX, X) con una concentración de aproximadamente 25 veces más alta que en plasma normal137. También pueden contener inhibidores naturales de la coagulación como la proteína S y proteína C138-142. Algunos estudios han sugerido que la administración de complejos protrombínicos es un método efectivo para normalizar un TP prolongado en pacientes con cirrosis hepática.
Existen reportes desde 1976 del uso del complejo protrombínico. La indicación actual para su uso es sangrado y profilaxis perioperatoria de sangrado adquirido o deficiencia congénita de uno o cuatro factores de coagulación dependientes de vitamina K. Esto incluye la deficiencia observada en pacientes con cirrosis143.
Durante el TH, el uso de concentrado de complejos protrombínicos lleva a una reducción en los requerimientos de transfusión, sin observarse complicaciones tromboembólicas relacionadas a su uso. No hay datos prospectivos disponibles sobre la eficacia de la sustitución de factores de coagulación para TH. Por lo tanto, cada centro de trasplante debe tener sus propias guías. La decisión de usar CCP debe fundamentarse en estas y ser individualizada.
Las estrategias clínicas para reducir las pérdidas sanguíneas incluyen el uso de derivados hemáticos para corregir la coagulopatía, como PFC, concentrados plaquetarios y crioprecipitados. Una gran desventaja del uso del PFC es la sobrecarga de volumen, lo cual puede llevar a incremento a la presión venosa central y portal que puede originar mayor riesgo de sangrado.
La transfusión masiva durante el TH está asociada con un incremento en el riesgo de mortalidad, falla multiorgánica y reducción en la sobrevida del injerto. Durante el trasplante el uso de complejo protrombínico, además de corregir la coagulopatía, incluye baja administración de volumen, condiciones de almacenamiento al aire ambiente, rápida reconstitución, disponibilidad inmediata, falta de especificidad de grupo sanguíneo y mejor perfil de seguridad.
Recomendación 31. El empleo de ácido tranexámico durante la cirugía de TH reduce significativamente la cantidad de sangrado y los requerimientos transfusionales.
La hiperfibrinólisis primaria es una de las principales causas del incremento en las pérdidas sanguíneas durante el trasplante y conlleva una evidencia para mayor terapia guiada por metas con fármacos antifibrinolíticos. Están disponibles como inhibidores directos del plasminógeno: ácido tranexámico y ácido épsilon aminocaproico e inhibidores de plasmina (aprotinina)144-146.
El ácido tranexámico ha sido analizado durante el trasplante de hígado en cuatro estudios prospectivos, controlados, doble ciego, dos de ellos comparados con placebo. Los resultados mostraron que el ácido tranexámico reduce significativamente las pérdidas sanguíneas en el intraoperatorio y el uso de derivados sanguíneos. También se observó menos sangrado comparado con el placebo. Sin embargo, a pesar de una reducción en la fibrinólisis, el ácido tranexámico en dosis de 2 mg/kg/h no provee una reducción en los requerimientos transfusionales. En dos grandes estudios, Savate et al., examinaron los tres antifibrinolíticos. El primer ensayo incluyó 124 pacientes de los cuales 42 recibieron ácido tranexámico, 42 ácido épsilon aminocaproico y 40 placebo. En el grupo de ácido tranexámico (10 mg/kg/h) la fibrinólisis medida por TEG fue menor y la transfusión de paquetes globulares se redujo significativamente comparado con los otros dos grupos. No hubo diferencias en los requerimientos de PFC, plaquetas y crioprecipitados entre los tres grupos.
En el segundo estudio de 127 pacientes, se compararon el ácido tranexámico y la aprotinina. En 64 sujetos se administró ácido tranexámico a 10 mg/kg/h y aprotinina en 63 a dosis de 2 x 106 kg UI seguido de una infusión de 0.5 x 106 kg UI/h. No se observaron diferencias significativas en los requerimientos de transfusión, en eventos tromboembólicos, reintervención por sangrado y mortalidad. Los rangos fueron similares en ambos grupos. El ácido tranexámico ha sido usado en varias dosis y regímenes. Dosis bajas de 2 mg/ kg/h suprimen la fibrinólisis y las más altas (10-40 mg/kg/h) reducen significativamente las pérdidas sanguíneas intraoperatorias y los requerimientos transfusionales143-149.
Boylan et al., publicaron un estudio doble ciego, aleatorizado, controlado con placebo, concluyendo que las altas dosis de ácido tranexámico reducen significativamente las pérdidas sanguíneas y requerimientos de sangre, con marcada reducción en plaquetas y crioprecipitados150.
Molenaar et al., en 2007 realizaron una revisión y metaanálisis de los artículos publicados controlados sobre el uso de fármacos antifibrinolíticos en TH. Se identificaron un total de 23 estudios con un total de 1,407 pacientes, mostrando que el ácido tranexámico y aprotinina reducen los requerimientos transfusionales comparados con placebo. No se observó incremento en el riesgo de trombosis de la arteria hepática, eventos tromboembólicos o mortalidad perioperatoria para alguno de los fármacos en estudio. Se recomienda una dosis de 10 mg/kg/h intravenoso antes de la cirugía seguido de 1 mg/ kg/h durante la cirugía151.
Recomendación 32. La administración de fibrinógeno sintético corrige de manera más eficaz los problemas de sangrado asociados a hipofibrinogenemia durante el perioperatorio del TH comparado con el uso de crioprecipitados.
Los niveles bajos de fibrinógeno están reconocidos como un factor de riesgo independiente para un mayor sangrado en pacientes con cirrosis. Los eventos de mayor sangrado están aumentados en sujetos con cirrosis con niveles de fibrinógeno por debajo de 60 mg/dL. En aquellos con cirrosis admitidos a hospital, por cada reducción de 100 mg/ dL de fibrinógeno se incrementa la mortalidad hasta 29%. Mantener niveles de 100-120 mg/ dL ha sido propuesto por muchas sociedades y grupo de expertos en el escenario de pérdidas agudas de sangre.
Noval-Padillo et al. realizan un trabajo para evaluar la estabilidad y firmeza del coágulo basado en fibrina (FIBTEM test) en la tromboelastometría (ROTEM). El fibrinógeno sintético (Haemocomplettan) fue administrado para alcanzar un máximo de firmeza de coágulo basado en el peso del paciente y el sangrado quirúrgico. Incluyeron 20 sujetos para TH y se comparó con un grupo de 59 de un año previo. El fibrinógeno sintético fue administrado en 45% de los 20 pacientes. Hubo una reducción de 53% en el uso de paquetes globulares, una disminución de 65% en el uso de PFC. La transfusión de plaquetas se redujo a 50%. Igualmente, 20% de los individuos trasplantados no recibieron transfusiones de productos sanguíneos comparado con 3.5% del periodo anterior. La incorporación de fibrinógeno sintético en el tratamiento de los desórdenes hemostáticos de un TH reduce el uso de productos sanguíneos alogenicos152.
En TH, los niveles plasmáticos de fibrinógeno son bajos en muchos pacientes durante la cirugía. La administración de este para corregir la hipofibrinogenemia tiene un impacto positivo sobre el sangrado quirúrgico. Sin embargo, hay escasez de literatura acerca de su administración, por lo tanto, esta debe ser ajustada a normalizar los niveles en rangos recomendados o guiados por la tromboelastometria153-156.
El tratamiento guiado por ROTEM con concentrados de factores de coagulación fue evaluado en un estudio de TH, en el cual el concentrado de fibrinógeno fue administrado con un objetivo de FIBTEM (análisis de la contribución del fibrinógeno en la formación del coágulo) MCF (firmeza máxima del coagulo) de 6 mm y el concentrado de complejo protrombínico fue aplicado con un EXTEM MCF (análisis de la vía extrínseca de la coagulación en la tromboelastografía) de 35 mm. La transfusión de productos alogénicos fue baja, con una media promedio de 2 U de paquetes globulares y sin unidades de PFC y plaquetas. Las ventajas del uso de fibrinógeno en comparación con PFC son la reducción de la transmisión de patógenos, así como la disminución en el riesgo de lesión pulmonar asociada a transfusión (TRALI) o a la sobrecarga circulatoria (TACO). La concentración de fibrinógeno puede ser fácilmente monitoreada por ROTEM y la terapia sustitutiva guiada, de acuerdo con la firmeza del coágulo reducen la transfusión en el número de paquetes globulares, PFC y plaquetas por más de 50%. Adicionalmente, el número de trasplantes sin transfusión se elevó de 3.5 a 20%157.
Consideraciones éticasEl proyecto actual es el resultado de la iniciativa de un grupo de colaboradores especialistas en el área de la Hepatología. El desarrollo de estas guías se fundamenta en información clínica de ensayos clínicos, obtenida de metaanálisis, revisiones sistemáticas, ensayos clínicos aleatorizados controlados, estudios de cohorte, casos y controles, estudios ecológicos y series de casos. La información obtenida fue clasificada y analizada por un comité de expertos en investigación clínica de acuerdo con los niveles de evidencia. Por este medio, hacemos constar que este proyecto no involucra el manejo de información personal de pacientes al no incluir sujetos de estudio para análisis o recolección de información clínica. No es posible identificar a los pacientes a través de imágenes o datos clínicos incluidos en los proyectos revisados. Asimismo, no fue necesario redactar un consentimiento informado o someterlo a evaluación por comité de ética o bioseguridad. El actual proyecto cumple con la normativa vigente en investigación bioética y se encuentra apegado a la Ley General de Salud y su reglamento en Materia de Investigación; y las Guías de la Conferencia Internacional de Armonización (ICH) sobre las Buenas Prácticas Clínicas (GPC).
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.