El terreno del paciente con cirrosis que requiere una intervención quirúrgica ha sido poco explorado. En México, a la fecha no contamos con un posicionamiento formal o recomendaciones de expertos que ayuden a la toma de decisiones clínicas en este contexto.
ObjetivosRevisar la evidencia existente sobre el riesgo, pronóstico, precauciones, cuidados especiales y manejo o proceder específico para los pacientes con cirrosis que requieren ser intervenidos quirúrgicamente o mediante procedimientos invasivos, para emitir recomendaciones por un panel experto, basadas en la mejor evidencia publicada para la atención oportuna, de calidad, eficiente y con el menor riesgo posible en este grupo específico de pacientes.
ResultadosSe obtuvieron 27 recomendaciones, en donde se abordan el terreno preoperatorio, el escenario transoperatorio y el seguimiento y cuidados postoperatorios.
ConclusionesLa valoración y el cuidado del paciente con cirrosis que requiere un procedimiento quirúrgico o invasivo mayor debe estar a cargo de un equipo multidisciplinario que brinde soporte al cirujano durante todo el perioperatorio; este equipo debe incluir al anestesiólogo, al hepatólogo, al gastroenterólogo y al nutriólogo clínico. En el paciente descompensado puede ser necesario involucrar especialistas en nefrología, ya que la función renal es un parámetro implicado también en el pronóstico de estos pacientes.
Management of the patient with cirrhosis of the liver that requires surgical treatment has been relatively unexplored. In Mexico, there is currently no formal stance or expert recommendations to guide clinical decision-making in this context.
AimsThe present position paper reviews the existing evidence on risks, prognoses, precautions, special care, and specific management or procedures for patients with cirrhosis that require surgical interventions or invasive procedures. Our aim is to provide recommendations by an expert panel, based on the best published evidence, and consequently ensure timely, quality, efficient, and low-risk care for this specific group of patients.
ResultsTwenty-seven recommendations were developed that address preoperative considerations, intraoperative settings, and postoperative follow-up and care.
ConclusionsThe assessment and care of patients with cirrhosis that require major surgical or invasive procedures should be overseen by a multidisciplinary team that includes the anesthesiologist, hepatologist, gastroenterologist, and clinical nutritionist. With respect to decompensated patients, a nephrology specialist may be required, given that kidney function is also a parameter involved in the prognosis of these patients.
La fibrosis hepática y la cirrosis son condiciones crónicas que incrementan la morbilidad y la mortalidad de los pacientes1-6. Estos pacientes son también más vulnerables a sufrir complicaciones ante procedimientos invasivos o quirúrgicos, requieren cuidados especiales para evitar la descompensación de su enfermedad de base tras el evento quirúrgico y, por tanto, deben ser evaluados minuciosamente en el preoperatorio, vigilados para evitar la sobrecarga de volumen durante el transoperatorio, particularmente cuando además cursan con hipertensión portal clínicamente significativa (HPCS)7. Existen pocos estudios que hayan evaluado este contexto, y en México específicamente no contamos con recomendaciones formales para un óptimo cuidado de estos pacientes. Así, el objetivo principal de este consenso fue revisar la evidencia existente sobre el riesgo, el pronóstico, las precauciones, los cuidados especiales y el manejo o proceder específico para los pacientes con cirrosis que requieren ser intervenidos quirúrgicamente o mediante procedimientos invasivos, con el objetivo específico de emitir recomendaciones por un panel experto, basadas en la mejor evidencia publicada para la atención oportuna, de calidad, eficiente y con el menor riesgo posible en este grupo específico de pacientes.
MetodologíaA iniciativa de la mesa directiva y del comité científico de la Asociación Mexicana de Gastroenterología A.C. (AMG) se designaron dos coordinadores generales, José Antonio Velarde Ruiz Velasco (JAVRV) y Fátima Higuera de la Tijera (FHT), que contribuyeron equitativamente a la concepción del presente manuscrito. JAVRV y FHT realizaron una revisión de la bibliografía utilizando como criterios de búsqueda las palabras «cirugía, cirrosis» en combinación con los siguientes términos: «cuidados» o «valoración», «preoperatorio», «postoperatorio», «perioperatorio», «transoperatorio», «pronóstico», «complicaciones», «cuidados especiales», «escalas», así como sus términos equivalentes en inglés. La búsqueda se realizó en PubMed, Google académico, Scopus, Medline, Embase, Science Direct, TRIP Database y se consideraron publicaciones en el periodo comprendido entre enero de 2010 a junio de 2023. Se incluyeron todas las publicaciones en inglés y en español. Se dio preferencia a los consensos, guías, revisiones sistemáticas y metaanálisis, ensayos clínicos, estudios de cohorte, pero no se limitó a este tipo de artículos. También se realizaron búsquedas electrónicas y manuales complementarias en los archivos de la REVISTA DE GASTROENTEROLOGÍA DE MÉXICO y en todas las publicaciones que los coordinadores consideraron relevantes hasta junio de 2023. Se evidenció tras esta búsqueda y análisis de las publicaciones que existen pocos estudios originales de calidad que hayan evaluado el tema en cuestión, no existen suficientes revisiones sistemáticas y metaanálisis, ensayos clínicos, estudios de cohorte de calidad metodológica suficiente para diseñar una guía clínica; por tanto, se decidió realizar un consenso utilizando el método Delphi modificado8 con la finalidad de lograr un acuerdo general entre expertos en lo referente al tema.
Durante el proceso de consenso se revisaron específicamente los siguientes apartados: 1)Evaluación del panorama preoperatorio en cirrosis. 2)Escenario transoperatorio. 3)Seguimiento y cuidados postoperatorios. Luego de realizar la revisión exhaustiva de cada tema, se empleó el sistema Patient, Intervention, Comparison, Outcomes (PICO) para generar interrogantes con cuatro características: P: población referida/afectada, I: tipo de intervención a analizar, C: comparador, O: resultados obtenidos tras el análisis de datos o revisión sistemática. A partir de aquí, se elaboraron enunciados representativos, y estos fueron enviados a todos los miembros del panel de expertos (excepto a JAVRV, quien fungió como monitor y analista de los datos) para una primera votación anónima por vía electrónica mediante la siguiente escala: A)totalmente de acuerdo, B)parcialmente de acuerdo, C)incierto, D)parcialmente en desacuerdo y E)totalmente en desacuerdo. En esta primera ronda de votación los panelistas adicionalmente pudieron emitir sugerencias de mejora a la redacción y calidad de cada enunciado. En caso de obtener un acuerdo mayor al 75% (sumatoria de A y B), se determinó que el enunciado podría ser ratificado en la siguiente ronda de votación. Los enunciados con el 75% o más de desacuerdo (sumatoria de D y E) se eliminaron. Los enunciados con menos del 75% de acuerdo, pero también menos del 75% de desacuerdo fueron replanteados tomando en cuenta los comentarios emitidos por los panelistas. Fueron necesarias dos rondas de votación electrónica anónima y una votación semipresencial llevada a cabo mediante conexión en vivo de todos los panelistas a través de la plataforma Zoom®. Se obtuvieron de forma final 27 enunciados, y la evidencia que da sustento a cada enunciado se evaluó y calificó mediante el sistema Grading of Recommendations Assessment, Development and Evaluation (GRADE)9 (tabla 1).
Sistema GRADE9
| Niveles de evidencia | |
|---|---|
| Alto | Estamos relativamente seguros de que el efecto real de la intervención se encuentra cerca de nuestra estimación |
| Moderado | El efecto real de la intervención probablemente se encuentra cerca de nuestra estimación, pero existe la posibilidad de que sea sustancialmente diferente |
| Bajo | El efecto real de la intervención puede ser sustancialmente diferente de nuestra estimación |
| Muy bajo | Es probable que el efecto real de la intervención sea sustancialmente diferente de nuestra estimación |
| Grados de recomendación | ||
|---|---|---|
| Recomendación fuertea | Recomendación débila | |
| Significado | La alternativa recomendada puede ser seguida con todos o casi todos los pacientes. Una conversación detallada con el paciente o una revisión cuidadosa de la evidencia que fundamenta la recomendación pudiera no ser necesaria | Si bien la alternativa recomendada es apropiada para la mayoría de los pacientes, la decisión debiera ser individualizada, idealmente mediante un enfoque de decisiones compartidas |
| Calidad de la evidencia | Generalmente alta o moderada (baja o muy baja en ciertas circunstancias excepcionales) | Baja o muy baja |
| Balance de beneficios y riesgos | Una alternativa es claramente superior | El balance de beneficios y riesgos es cercano |
| Valores y preferencias de los pacientes | Todos o casi todos los pacientes informados toman la misma decisión | Existe variabilidad o incertidumbre respecto de lo que decidirán pacientes informados |
| Consideraciones de recursos | El costo de la intervención se justifica plenamente | El costo de la intervención pudiera no estar justificado en algunas circunstancias |
GRADE: Grades of Recommendation, Assessment, Development, and Evaluation.
1. En pacientes con antecedente de enfermedad hepática crónica por cualquier etiología, que requieran algún procedimiento quirúrgico electivo, se recomienda valorar la presencia de fibrosis avanzada mediante métodos no invasivos.
Totalmente de acuerdo 76.6%, parcialmente de acuerdo 21.4%.
Nivel de evidencia moderado, fuerte a favor de la recomendación.
La condición por sí misma que incrementa el riesgo de complicaciones postoperatorias en pacientes con enfermedad hepática crónica es el deterioro de la síntesis hepática en conjunto con la presencia de HPCS. Bajo esta consideración, la enfermedad hepática crónica sin fibrosis no debería incrementar sustancialmente el riesgo de complicaciones quirúrgicas; sin embargo, los pacientes con cirrosis compensada cursan asintomáticos, y es por ello que en pacientes con enfermedad hepática crónica, independientemente de su etiología (hepatitis viral, autoinmunidad, enfermedad hepática esteatósica asociada a disfunción metabólica [MASLD], consumo de alcohol, entre otras), que no tengan manifestaciones clínicas o diagnóstico conocido de cirrosis e HPCS, se recomienda la evaluación no invasiva de la fibrosis hepática previo a algún procedimiento quirúrgico electivo1,2.
El índice fibrosis-4 (FIB-4) es uno de los métodos serológicos no invasivos más validados en el contexto de diversas etiologías que condicionan cirrosis y se considera adecuado para la evaluación inicial del paciente3. Un estudio de cohorte histórica, que incluyó 19,861 sujetos, encontró que el 10% presentaban fibrosis avanzada según el FIB-4. Un FIB-4 ≥2.67 (fibrosis avanzada/cirrosis) se asoció de forma independiente en un modelo multivariado ajustado, con un aumento de la mortalidad intraoperatoria (razón de momios [OR], 3.63; intervalo de confianza del 95% [IC95%], 1.25-10.58), mayor mortalidad intrahospitalaria (OR: 3.14; IC95%: 2.37-4.16), y también dentro de los 30días poscirugía (OR: 2.46; IC95%: 1.95-3.10). Además, a mayor categoría según el FIB-4 se evidenció un aumento de la mortalidad: ≤1.3 (referencia), >1.3 y <2.67, y ≥2.67, respectivamente; durante la hospitalización (OR: 1.89; IC95%: 1.34-2.65 y OR: 4.70; IC95%: 3.27-6.76) y dentro de los 30 días poscirugía (OR: 1.77; IC95%: 1.36-2.31 y OR: 3.55; IC95%: 2.65-4.77). En una muestra emparejada por propensión 1:1 (n=1,994 por grupo), las diferencias en la mortalidad persistieron. Comparando los grupos FIB-4 ≥2.67 versus FIB-4 <2.67, respectivamente, la mortalidad durante la hospitalización fue del 5.1% frente al 2.2% (OR: 2.70; IC95%: 1.81-4.02), y la mortalidad a los 30 días fue del 6.6% frente al 3.4% (OR: 2.26; IC95%: 1.62-3.14)4.
Dentro de los métodos no invasivos radiológicos, la elastografía de transición (Fibroscan®) también ha demostrado utilidad para estimar el pronóstico en pacientes que serán electivamente programados para cirugía. En 105 pacientes sometidos a cirugía cardíaca, la medición de la rigidez hepática (LSM) preoperatoria ≥9.5kPa se asoció con un tiempo significativamente más prolongado de hospitalización postoperatoria en comparación con pacientes con LSM <6kPa. Esta asociación pareció ser independiente de las comorbilidades preoperatorias comúnmente asociadas con enfermedad coronaria5.
Los pacientes con fibrosis avanzada y aquellos con cirrosis tienen mayor riesgo de complicaciones posquirúrgicas. Posterior a cirugía colorrectal, la tasa general de fuga anastomótica se ha estimado en el 2.7%. En pacientes con cirrosis o fibrosis avanzada, la tasa de fuga anastomótica se ha reportado hasta en el 12.5%, mientras que se ha reportado tan solo en el 2.5% en aquellos sin cirrosis o fibrosis avanzada (p=0.024)6.
2. La estadificación de la gravedad de la enfermedad hepática en pacientes con cirrosis se debe evaluar con las escalas de MELD y Child-Pugh.
Totalmente de acuerdo 76.6%, parcialmente de acuerdo 21.4%.
Nivel de evidencia alto, fuerte a favor de la recomendación.
La evaluación preoperatoria de pacientes con cirrosis debe estar enfocada en la identificación de factores que puedan aumentar la morbilidad y la mortalidad perioperatorias. Además de la evaluación de riesgo cardiovascular, de las comorbilidades y del estado funcional, que se realiza en cualquier paciente que será sometido a una cirugía, es indispensable evaluar el grado de disfunción hepática, determinando la presencia de HPCS y descompensación clínica actual o previa (ascitis, hemorragia variceal y/o encefalopatía hepática [EH])7. Los puntajes Child-Turcotte-Pugh (CTP) y el Modelo para la Enfermedad Hepática en Estadio Terminal (MELD) son los más utilizados para la evaluación de la gravedad de la enfermedad hepática10. La clasificación de CTP predice la supervivencia a largo plazo en pacientes con cirrosis11. Puntajes más altos de CTP se asocian con aumento de la morbimortalidad perioperatoria, los pacientes con CTP claseA tienen un 10% de riesgo de mortalidad intrahospitalaria después de la cirugía, mientras que los claseB un 30%, y este riesgo aumenta hasta el 76-82% en pacientes con CTP claseC12. A su vez, el puntaje MELD predice la mortalidad a 3meses en pacientes con cirrosis en lista de trasplante hepático13,14 y ha demostrado ser un buen predictor preoperatorio de mortalidad quirúrgica: por cada punto de MELD por encima de 20, existe un aumento en la tasa de mortalidad del 2%15. El desempeño de ambas escalas pronósticas para predecir el desenlace posquirúrgico en pacientes con cirrosis es similar (área bajo la curva [AUROC] 0.755 ± 0.066 para MELD frente a AUROC 0.696 ±0.070 para CTP, p=0.3)2. Además, algunos estudios han demostrado que la combinación de CTP y MELD es mejor predictor de mortalidad que ambas escalas por separado16.
Los niveles de sodio sérico (Na) representan un predictor independiente de mortalidad en cirrosis17, y se ha descrito que los nuevos modelos basados en MELD que incorporan el nivel de Na como MELD-Na, el MELD integrado (iMELD) la relación MELD a sodio (MESO), son superiores al puntaje MELD para predecir el pronóstico a corto e intermedio plazo en pacientes con cirrosis descompensada18. Los índices basados en MELD han demostrado tener un adecuado desempeño pronóstico en pacientes con cirrosis hepática sometidos a cirugía electiva, siendo el iMELD el mejor parámetro predictor de mortalidad operatoria (AUROC 0.80, IC95%: 0.63-0.97, p=0.04), con un potencial predictivo superior al de CTP y de MELD19.
Sin embargo, tanto MELD como MELD-Na utilizan el nivel de creatinina sérica, lo cual podría sobrestimar la función renal en pacientes con sarcopenia y mujeres con pobre masa muscular. Debido a estas limitaciones, se han desarrollado nuevos puntajes pronósticos, como el MELD3.0, que incluye además el sexo femenino y el nivel de albúmina sérica, las interacciones entre la bilirrubina y el sodio y entre albúmina y creatinina, además de un límite superior para creatinina (3.0mg/dl), y que ha demostrado predecir la mortalidad con mayor exactitud en comparación con MELD-Na en pacientes con cirrosis en lista de espera para trasplante20.
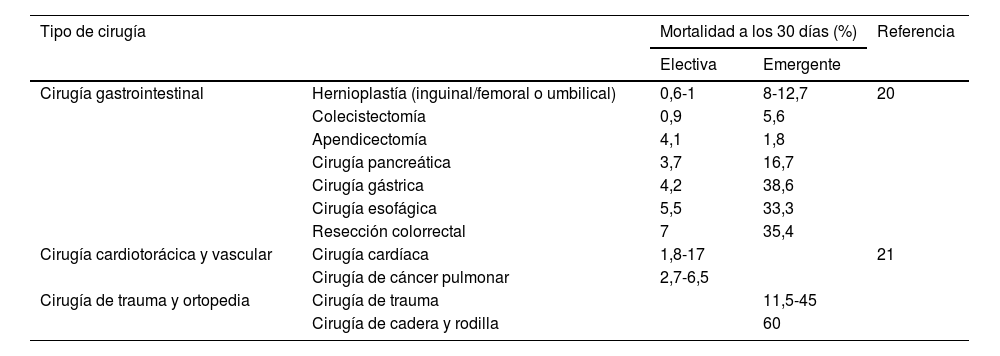
La mortalidad hospitalaria varía sustancialmente en función del tipo de procedimiento quirúrgico21, y en general el desenlace es mejor en las cirugías electivas10, reportando una mortalidad postoperatoria hasta 6 veces mayor en la cirugía de emergencia22. Las cirugías de la pared abdominal, como las hernioplastias umbilicales e inguinales, la colecistectomía y las cirugías mínimamente invasivas, tienen una menor morbimortalidad, mientras que la cirugía pancreática, la cirugía abdominal mayor, la cardiovascular y la cirugía de trauma presentan la mayor tasa de morbimortalidad21,23,24. La mayoría de los procedimientos pueden llevarse a cabo de manera segura en pacientes sin HPCS, CTPA o con puntuaciones bajas de MELD13; en el caso de reparación electiva de hernias inguinales, los pacientes con puntajes de MELD <15 y CTP claseA oB puede ser intervenidos sin un aumento significativo de la mortalidad25. En la tabla 2 se resume la mortalidad a los 30días reportada para los distintos tipos de cirugías, ya sean electivas o de emergencia.
Mortalidad asociada al tipo de cirugía en cirrosis22,23
| Tipo de cirugía | Mortalidad a los 30 días (%) | Referencia | ||
|---|---|---|---|---|
| Electiva | Emergente | |||
| Cirugía gastrointestinal | Hernioplastía (inguinal/femoral o umbilical) | 0,6-1 | 8-12,7 | 20 |
| Colecistectomía | 0,9 | 5,6 | ||
| Apendicectomía | 4,1 | 1,8 | ||
| Cirugía pancreática | 3,7 | 16,7 | ||
| Cirugía gástrica | 4,2 | 38,6 | ||
| Cirugía esofágica | 5,5 | 33,3 | ||
| Resección colorrectal | 7 | 35,4 | ||
| Cirugía cardiotorácica y vascular | Cirugía cardíaca | 1,8-17 | 21 | |
| Cirugía de cáncer pulmonar | 2,7-6,5 | |||
| Cirugía de trauma y ortopedia | Cirugía de trauma | 11,5-45 | ||
| Cirugía de cadera y rodilla | 60 | |||
3. En todo paciente con cirrosis que será sometido a algún procedimiento quirúrgico electivo se debe evaluar la presencia de hipertensión portal clínicamente significativa y descompensación hepática.
Totalmente de acuerdo 85.7%, parcialmente de acuerdo 14.3%.
Nivel de evidencia moderado a alto, fuerte a favor de la recomendación.
La hipertensión portal es la principal consecuencia de la cirrosis hepática y la causa de la mayoría de sus complicaciones: ascitis, hemorragia variceal y EH26. La cirrosis se clasifica en dos etapas pronósticas distintas: compensada y descompensada27; la cirrosis compensada o enfermedad hepática crónica avanzada compensada (cACLD) se subdivide a su vez en función de la presencia o ausencia de HPCS, que se define como un gradiente de presión venosa hepática (GPVH) ≥10mmHg o por la presencia de manifestaciones clínicas como ascitis o presencia de varices esofagogástricas26 y se asocia con aumento en el riesgo de desarrollar eventos de descompensación clínica, hemorragia de várices esofágicas y carcinoma hepatocelular28-30.
La presencia de HPCS se asocia con aumento en la mortalidad perioperatoria31, por lo que además de un interrogatorio completo sobre el antecedente de descompensación clínica previa y el examen físico para evaluar la presencia de manifestaciones clínicas de HPCS, en la evaluación prequirúrgica de los pacientes con cirrosis se debe considerar la realización de esofagogastroduodenoscopia (EGD) para determinar la presencia de várices esofágicas y/o gastropatía hipertensiva portal, y un estudio de imagen como ultrasonido o tomografía computada para evaluar la presencia de ascitis, esplenomegalia y colaterales portosistémicas32.
En algunos casos podría ser necesaria la medición del GPVH, el estándar de oro para la evaluación de la presión portal, un procedimiento invasivo que implica la realización de cateterismo de la vena suprahepática derecha o media y que representa el gradiente entre la presión de la red capilar sinusoidal hepática y la presión sistémica26,27,33. Se ha demostrado que valores de GPVH ≥16mmHg, en especial cuando es ≥20mmHg, se asocian con riesgo elevado de mortalidad posquirúrgica, mientras que aquellos pacientes con un GPVH <10mmHg tienen poco riesgo de descompensación en el periodo postoperatorio34.
La LSM correlaciona con el GPVH35; recientemente se ha publicado que en pacientes con cACLD, una LSM≥25kPa es suficiente para diagnosticar HPCS, así como una medición ≤15kPa y un conteo plaquetario >150×109/l la descartan. Además, aquellos pacientes con LSM entre 20 y 25kPa y conteo plaquetario <150×109/l o LSM entre 15 a 20kPa y conteo plaquetario <110×109/l tienen un riesgo de HPCS alrededor del 60%26,27,35-37.
La medición de la rigidez esplénica (SSM) mejora significativamente la capacidad para el diagnóstico de HPCS. En el estudio de Dajti et al.38, el algoritmo diagnóstico de BavenoVII (LSM ≤15kPa +recuento de plaquetas ≥150×109/l para descartar HPCS, y LSM >25kPa para confirmarla) fue validado; sin embargo, entre el 40% y el 60% de los pacientes permanecieron en la zona gris. La adición de SSM (40kPa) al modelo redujo significativamente la zona gris al 7%-15%, manteniendo valores predictivos negativos y positivos adecuados. Todos los eventos de descompensación ocurrieron en la zona de «confirmación» del modelo que incluía SSM. Por tanto, cuando se tenga esta herramienta disponible, sería recomendable incorporarla en la evaluación de los pacientes.
4. Se recomienda realizar una evaluación preoperatoria de las comorbilidades no hepáticas que deberá incluir la evaluación preoperatoria habitual (electrocardiograma para estimación de enfermedad cardiovascular, determinaciones de escala de la sociedad Americana de Anestesiólogos e índice de Goldman).
Totalmente de acuerdo 85.7%, parcialmente de acuerdo 14.3%.
Nivel de evidencia alto, fuerte a favor de la recomendación.
El riesgo quirúrgico en pacientes con cirrosis se basa en múltiples factores: valoración de la función hepática, presencia de HPCS, urgencia del procedimiento y tipo de procedimiento, así como la presencia de comorbilidades. Los pacientes con cirrosis tienen mayor riesgo de presentar coagulopatía, desnutrición, disfunción inmune, cardiomiopatía del cirrótico, alteraciones pulmonares y renales39,40.
En relación con la estimación de la función cardiovascular, la evaluación prequirúrgica debe incluir la clasificación de la Sociedad Americana de Anestesiología (ASA); los pacientes con cirrosis en fase compensada se clasifican en ASAIII, y los descompensados, en ASAIV, por lo cual desde el inicio el riesgo quirúrgico es considerable (tabla 3)41.
Clasificación del estado físico de la Sociedad Americana de Anestesiólogos (ASA)40
| Clasificación | Definición |
|---|---|
| ASA I | Paciente sano |
| ASA II | Enfermedad sistémica sin limitación funcional |
| ASA III | Enfermedad sistémica grave con limitación funcional definida |
| ASA IV | Paciente con enfermedad sistémica grave que representa una amenaza constante para la vida |
| ASA V | Paciente moribundo con pocas probabilidades de sobrevivir 24 horas con o sin operación |
5. Previo a una cirugía se recomienda calcular la puntuación de los índices de riesgo de Mayo y VOCAL-Penn para la predicción de riesgo quirúrgico y mortalidad postoperatoria de pacientes con cirrosis.
Totalmente de acuerdo 92.9%, parcialmente de acuerdo 7.1%.
Nivel de evidencia moderado, fuerte a favor de la recomendación.
En la evaluación preoperatoria de los pacientes con cirrosis hepática se requiere una historia clínica detallada, exploración física minuciosa y el cálculo de las puntuaciones Mayo y VOCAL-Penn. La puntuación de Mayo fue el primer modelo de predicción de riesgo quirúrgico en los pacientes con cirrosis hepática. Evalúa la clasificación de ASA (considera 3 para cirrosis compensada y 4 para cirrosis descompensada), el cociente internacional normalizado (INR, por sus siglas en inglés), bilirrubina total, creatinina, edad y etiología de la enfermedad hepática. Nos estima mortalidad a los 7 días, 30 días, 90 días, 1 año y 5 años con la limitante de sobreestimación de riesgo y no estratifica de acuerdo con el tipo de cirugía, ni tiene en cuenta todas las etiologías. Esta puntuación es de libre acceso y cuenta con calculadora disponible en línea en el sitio web de la Mayo Clinic:
La puntuación de VOCAL-Penn se desarrolló recientemente para la estimación del riesgo quirúrgico en pacientes con cirrosis. Incluye los siguientes parámetros evaluados en el preoperatorio: edad, albúmina, bilirrubina total, recuento plaquetario, índice de masa corporal (IMC), etiología por MASLD, tipo de procedimiento quirúrgico (cirugía abdominal laparoscópica o abierta, cirugía de pared abdominal, vascular, ortopédica o cardiaca), indicación (electiva o urgente) y clasificación de ASA. Esta puntuación es de libre acceso y se puede encontrar disponible en línea: <https://www.vocalpennscore.com/>. Estima riesgo de mortalidad posoperatoria a 30, 90 y 180 días, con discriminación superior a MELD, MELD-Na, CTP y el índice de riesgo de Mayo. Aunado a ello, puede estimar el riesgo de descompensación hepática a 90 días. Este índice incluye variables dependientes del individuo, del tipo de cirugía y de la propia hepatopatía, ha sido validado externamente, predice la mortalidad y la descompensación, es fácil de utilizar y gratuito, lo que le hace extraordinariamente útil. Quizá su mayor inconveniente es que los datos se han obtenido casi exclusivamente en hombres44-46. Se debe señalar que estos predictores de riesgo quirúrgico son de apoyo en la evaluación y la toma de decisiones clínicas, teniendo como limitante el no considerar como parte de la evaluación a la fragilidad y la sarcopenia, y por ende, no sustituyen el criterio médico ponderando riesgo beneficio de las intervenciones quirúrgicas22-24.
6. En los pacientes con cirrosis que requieran cualquier procedimiento de cirugía electivo se recomienda evaluación multidisciplinaria, que podría incluir a especialistas en hepatología o gastroenterología, medicina interna, nutrición, anestesiología y del área quirúrgica involucrada.
Totalmente de acuerdo 92.9%, parcialmente de acuerdo 7.1%.
Nivel de evidencia bajo, débil a favor de la recomendación.
La tasa de morbilidad y mortalidad postoperatoria es mayor en pacientes con cirrosis22,23, y este aumento en la mortalidad se ha asociado a distintos factores que caracterizan al paciente con cirrosis, tales como: alteraciones en la coagulación, trombocitopenia, disfunción plaquetaria, aumento de la inflamación sistémica, translocación bacteriana, circulación hiperdinámica, miocardiopatía cirrótica, sarcopenia, deficiencia de micronutrientes que llevan a un aumento en el riesgo de trombosis, infecciones, sangrado, lesión renal, alteraciones en la cicatrización y descompensación hepática, por lo que la evaluación preoperatoria debe incluir la participación de un equipo multidisciplinar (hepatología, gastroenterología, medicina interna, nutrición, anestesiología, cardiología y cirugía)32,39. Por supuesto, en cirugía urgente nunca deberá retrasarse el procedimiento cuando no se cuenta con este equipo multidisciplinario, debiendo individualizar cada caso sin poner en riesgo la vida del paciente por diferir el procedimiento esperando a estas valoraciones. Siempre que sea viable o posible, los pacientes con cirrosis descompensada deberían ser evaluados y atendidos en centros especializados.
Así mismo, la prehabilitación, un concepto que obviamente solo es posible en cirugía electiva, resulta útil para lograr mejores condiciones para el paciente previo a operarlo. En este concepto, la prescripción de un plan de ejercicio físico programado, aeróbico o anaeróbico, diseñado según la situación funcional y otras comorbilidades de paciente, supervisado por un fisioterapeuta y orientado a resultados se considera complementario. También, el abandono de tóxicos, especialmente alcohol y tabaco, lograr un adecuado control glucémico, y el control de otras comorbilidades, resultan relevantes39.
7. Previo a una intervención quirúrgica, se recomienda contar con una evaluación nutricional completa, que incluya la detección de sarcopenia y de fragilidad en pacientes con cirrosis; en cirugía electiva deben implementarse estrategias que permitan mejorar dichas condiciones previamente al procedimiento, ya que está establecido que ambas tienen impacto en el pronóstico y la supervivencia en el postoperatorio.
Totalmente de acuerdo 85.7%, parcialmente de acuerdo 14.3%.
Nivel de evidencia moderado a bajo, débil a favor de la recomendación.
La sarcopenia está asociada con mayor mortalidad en pacientes con cirrosis, y en cirugía se relaciona con retraso en la cicatrización de la herida y pobre evolución posquirúrgica, mayor riesgo de descompensación hepática, menor calidad de vida, mayor riesgo de infección y hospitalización prolongada. Incluso aumenta la mortalidad en pacientes postrasplantados47,48.
Idealmente, todo paciente con cirrosis debe tener una valoración nutricional integral. Se reporta una prevalencia mundial de malnutrición de hasta el 80% y de sarcopenia del 25 al 70%47. En México se ha reportado una prevalencia de malnutrición del 59% en pacientes hospitalizados y de sarcopenia del 88%49. En otro estudio mexicano se reportó una prevalencia general de malnutrición del 54%, donde los pacientes compensados tuvieron una prevalencia de malnutrición del 37-50%, mientras que en los descompensados alcanzó hasta el 60-71%. En el análisis multivariado se observó mayor mortalidad en los pacientes con malnutrición con un cociente de riesgo (HR) 2.15; IC95%: 1.18-3.922 (p=0.024)50. Así mismo, la malnutrición en pacientes con cirrosis se ha asociado con peor calidad de vida, mayor dolor generalizado, disnea durante las actividades diarias, disminución de apetito, debilidad generalizada y sensación de menor energía diaria51.
El estado nutricional puede ser valorado mediante varias herramientas, las más recomendadas actualmente son la Royal Free Hospital-Nutritional Prioritizing Tool (RFH-NPT) y la Royal Free Hospital-Subjective Global Assessment (RFH-SGA). Es importante señalar que el IMC no es una herramienta adecuada, ya que subestima los casos de malnutrición47,49,52.
Se han propuesto múltiples herramientas para detección de sarcopenia en el paciente con cirrosis, como el índice tomográfico musculoesquelético en L3, siendo considerado el método ideal; sin embargo, no es un estudio de fácil acceso. Otras herramientas, de fácil acceso y reproducibles, son la valoración antropométrica y la fuerza de prensión manual, utilizándose esta última incluso como herramienta para el diagnóstico de síndrome de fragilidad. Otra forma aceptada para diagnóstico de sarcopenia es la impedancia bioeléctrica; sin embargo, con resultados alterados en pacientes con ascitis47,49.
Existe evidencia reciente con el uso de ultrasonido como herramienta para el diagnóstico de sarcopenia en cirróticos, demostrando buena correlación con estudios tomográficos (r=0.70) con AUROC >0.95. Es ventaja su bajo costo y aplicabilidad al pie de cama o en consultorio; sin embargo, es operador dependiente y necesita una curva de aprendizaje53,54.
8. La forma más eficiente para evaluar la coagulación, y, en su caso, guiar la terapia transfusional en pacientes con cirrosis que requieren un procedimiento quirúrgico, es a través de pruebas viscoelásticas.
Totalmente de acuerdo 92.9%, parcialmente de acuerdo 7.1%.
Nivel de evidencia bajo, débil a favor de la recomendación.
A diferencia de las coagulopatías hereditarias, la cirrosis afecta a todo el espectro de la cascada de la coagulación; es decir, incluye a factores procoagulantes, anticoagulantes, proteínas antifibrinolíticas y profibrinolíticas. Además, se asocia tanto a una hiperactividad plaquetaria como a un aumento de los niveles del factor de Von Willebrand, todo lo cual da lugar a una «hemostasia reequilibrada». Este nuevo equilibrio es frágil y puede inclinarse fácilmente hacia un fenotipo prohemorrágico o protrombótico. Por tanto, no existe la prueba o estudio ideal para la valoración de la coagulación en pacientes cirróticos, ya que ninguna incluye variables como estado de volumen, función renal o disfunción endotelial55. El INR es una manipulación matemática del tiempo de protrombina (TP) y mide factores procoagulantes: I, II, V, VII y X. No mide el déficit de los anticoagulantes, como la proteínaC. Se le llama «normalizado» porque se normaliza con pacientes anticoagulados con warfarina basados en la actividad de una tromboplastina disponible comercialmente; al usar distintas tromboplastinas comerciales, se ocasiona variación significativa en el INR en cirróticos en distintos hospitales, dependiendo de cuál tromboplastina comercial se utiliza. Recientemente el fibrinógeno ha emergido como potencial estudio de laboratorio más específico que el INR, sobre todo en paciente cirróticos críticos. Se han sugerido niveles de 120-150mg/dl como seguros, junto a niveles de plaquetas para predecir el riesgo de sangrado en procedimientos invasivos en cirróticos56,57. En cuanto a las plaquetas, no existen estudios clínicos que apoyen un corte específico. Se ha tomado como corte «50,000/μl» plaquetas de estudios in vitro donde a este nivel se asociaron con producción normal de trombina. Actualmente, por recomendación de expertos, se sugiere que se debe «individualizar» de acuerdo al riesgo de sangrado del procedimiento y el escenario clínico, y se han propuesto niveles de plaquetas 30,000-75,000/μl como seguras, aunque, como ya se mencionó, la cifra más habitual es 50,000/μl56,58.
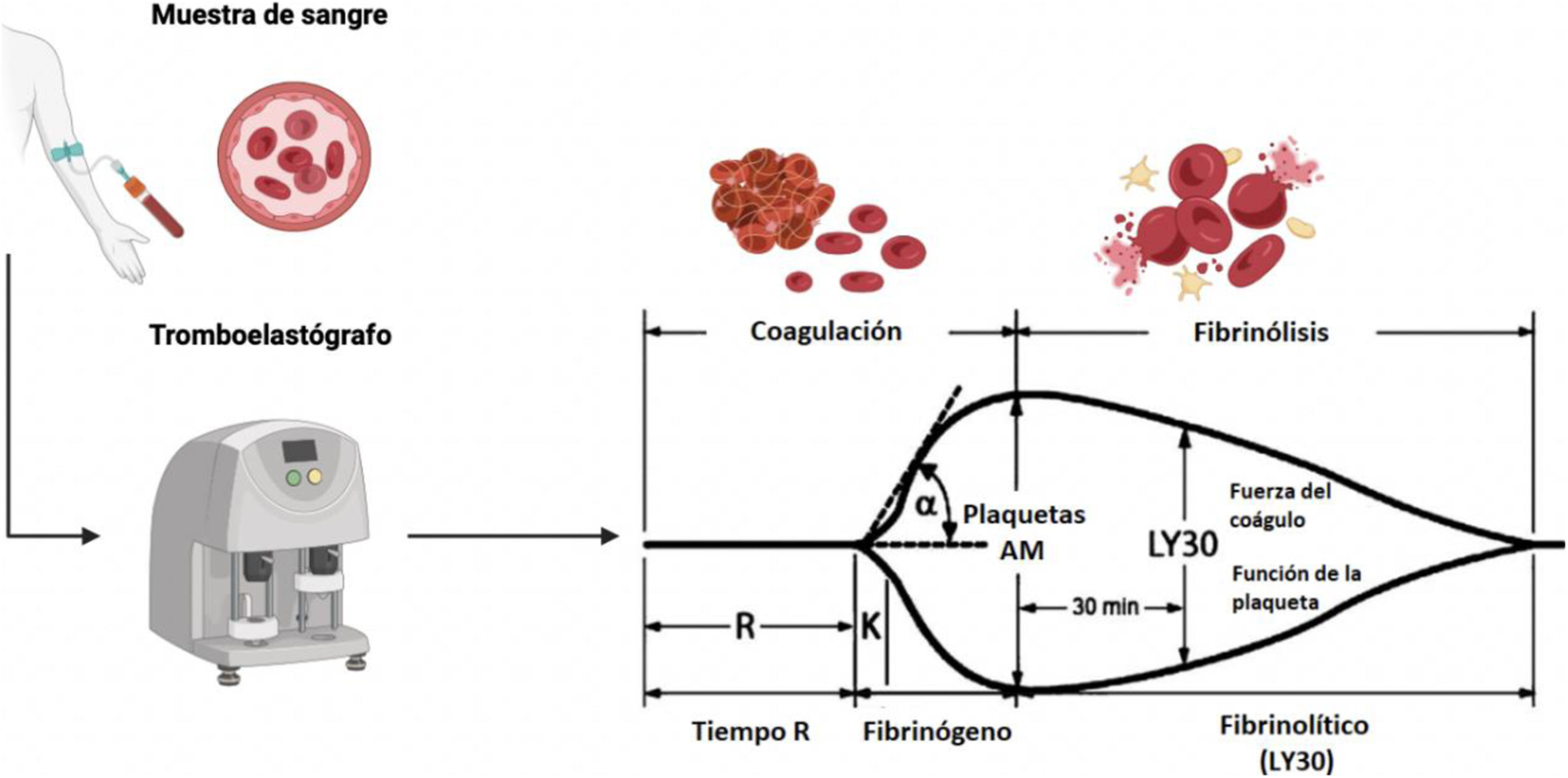
Las pruebas viscoelásticas (tromboelastografía [TEG] y tromboelastometria [TEM]) se consideran la mejor estrategia para guiar la terapia transfusional en los pacientes cirróticos sometidos a procedimientos invasivos. Estas pruebas reportan la formación del coágulo en sangre no centrifugada, así como la fuerza del coágulo, la presencia de hiperfibrinólisis o disolución prematura del coágulo59. En Norteamérica y en nuestro país la prueba más conocida y comercialmente más accesible es la TEG. Esta prueba mide las propiedades del coágulo usando un pequeño recipiente que contiene una muestra de sangre y oscila lentamente. Un alfiler sostenido por un alambre fino de torsión, que está suspendido en la sangre, une el recipiente y el alfiler a medida que se forma el coágulo. La torsión del alambre se mide y se convierte en una señal eléctrica. La fuerza del coágulo es directamente proporcional a la torsión del alambre (fig. 1). Uno de los parámetros que determina la TEG es la amplitud máxima (AM), con valores normales entre 50-70mm, y refleja la fuerza máxima del coágulo (estabilidad general del coágulo) y refleja directamente la interacción de la función plaquetaria y los factores de coagulación plasmáticos59,60. En un estudio reciente, Zanetto y García-Tsao60 demostraron que el AM <30mm se puede convertir en el límite para identificar pacientes con cirrosis descompensada con mayor riesgo de sangrado peri-procedimiento en quien considerar utilizar hemoderivados antes del procedimiento.
Parámetros de la tromboelastografía58. La tromboelastografía (TEG) nos proporciona varios parámetros:
• Tiempo R. Definido como el tiempo del inicio del trazo del TEG hasta que la amplitud del trazo alcanza 2mm (normal: 5-10min); representa la tasa de la formación inicial del coágulo (fase de iniciación). Se relaciona primariamente con la actividad de los factores de coagulación procoagulantes y anticoagulantes. Su prolongación es resultado de deficiencias de factores de coagulación o hipofibrinogenemia severa.
• Tiempo K. Definido como el tiempo del «Tiempo R» hasta que la amplitud del trazo alcanza 20mm (normal: 1-3min); representa una formación dinámica del coágulo (fase de amplificación) y está relacionado con la actividad de los factores de coagulación, fibrinógeno y plaquetas.
• α. Es el ángulo de la línea tangencial del trazo en desarrollo (rango normal: 53° a 72°); mide la velocidad en la que el entrecruzamiento de la fibrina ocurre (fase de propagación de trombina) y la función de las plaquetas y factores plasmáticos en la superficie de las plaquetas.
• AM. La amplitud máxima del trazo del TEG (normal: 50-70mm) refleja la fuerza máxima del coágulo (estabilidad general del coágulo) y refleja directamente la interacción de la función plaquetaria y los factores de coagulación plasmáticos.
• LY30. Es el porcentaje de disminución en amplitud a 30 minutos después de la AM (normal 0-8%); refleja la disolución inicial del coágulo (fibrinólisis).
Figura creada con Biorender.com. Modificada de Turco et al.59.
Una revisión sistemática que incluyó 8 estudios (n=118) concluyó que aquellos que guiaron la terapia transfusional con TEG utilizaron menos transfusiones de plasma fresco congelado (PFC), plaquetas y crioprecipitados, no hubo aumento de sangrado y se presentaron menos efectos adversos asociados a transfusión (30.6% frente al 74.5%, p=0.01)61. Así mismo, en una metaanálisis que incluyó 7 estudios (n=421), aquellos pacientes en los que se utilizaron pruebas viscoelásticas para guiar terapia transfusional tuvieron menos transfusiones de PFC (riesgo relativo [RR]: 0.52; IC95%: 0.35-0.77), menor transfusiones de plaquetas (RR: 0.34; IC95%: 0.16-0.73) y menor riesgo de efectos adversos asociados a transfusión (RR: 0.42; IC95%: 0.27-0.65), sin existir cambios en mortalidad de los pacientes sometidos a procedimientos invasivos ni aumentar eventos de sangrado62. La Asociación Americana de Gastroenterología, en sus guías sobre coagulación en cirróticos, propone tres parámetros que se deben cumplir para llevar a un paciente con cirrosis a cirugía: hematocrito >25%, plaquetas >50,000/μl y fibrinógeno >120mg/dl, ya que estos parámetros tienen mayor utilidad clínica para guiar la terapia transfusional56.
No se recomienda corrección de parámetros de coagulación de manera profiláctica, ni tampoco el uso de concentrados plaquetarios o agonistas de receptores de trombopoyetina (r-TPO), cuando las plaquetas son >50,000/μl, o cuando el sangrado se puede controlar con hemostasia local. En procedimientos de alto riesgo donde las plaquetas se encuentren <50,000/μl, se recomienda considera la transfusión plaquetaria 1hora previa al procedimiento en caso de procedimiento urgente, y en procedimientos electivos preparar al paciente 7días antes con uso de agonistas de r-TPO (avatrombopag o lusutrombopag). No se recomienda el uso rutinario de ácido tranexámico para disminuir la tasa de hemorragia posterior al procedimiento63,64.
9. Siempre que sea posible, en todo paciente con cirrosis, pero especialmente en aquellos con cirrosis descompensada, ascitis y terapia con diuréticos, se recomienda evaluar y corregir la función renal, los electrólitos séricos y el equilibrio ácido-base.
Totalmente de acuerdo 92.9%, parcialmente de acuerdo 7.1%.
Nivel de evidencia moderado, fuerte a favor de la recomendación.
La presencia de ascitis aumenta el riesgo de infección peritoneal, fístulas y dehiscencia de heridas, y para evitar estas complicaciones habitualmente los pacientes están bajo tratamiento con diuréticos, dieta baja en sal y paracentesis evacuatorias, lo que puede llevar a complicaciones por hipovolemia, como lesión renal aguda (acute kidney injury [AKI]), desequilibrio electrolítico y trastornos ácido-base48.
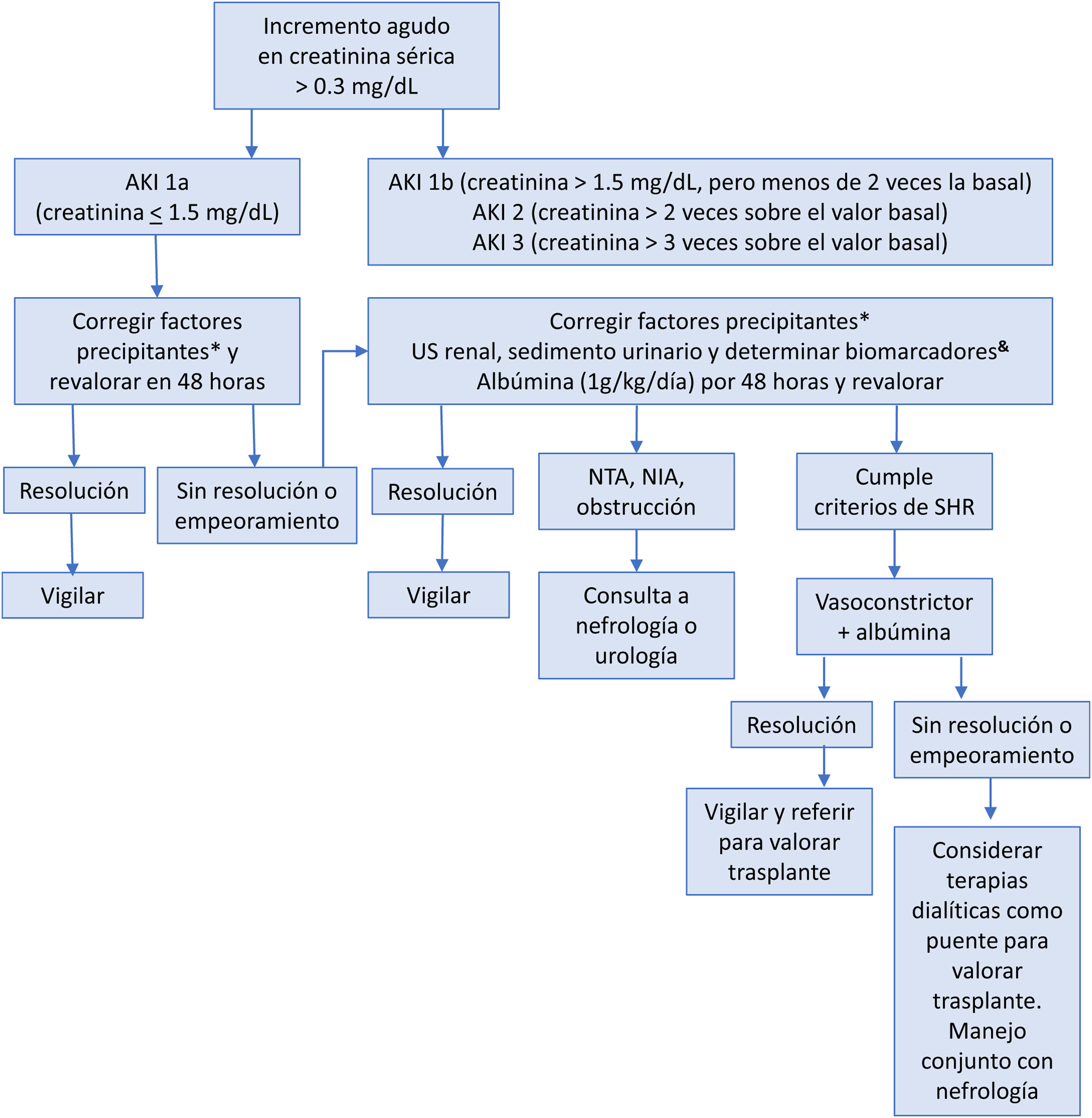
Hasta el 50% de los pacientes cirróticos hospitalizados desarrollan AKI, generalmente secundaria a una de combinación de factores como la disminución del volumen circulante, vasoconstricción y alteración de la regulación renal. Es importante detectar los posibles precipitantes de AKI, como infecciones, hiperbilirrubinemia, hemorragia gastrointestinal, uso de diuréticos u otros nefrotoxicos65. En el paciente con cirrosis, AKI se define cuando la creatinina sérica aumenta en ≥0.3mg/dl en un plazo de 48horas, o aumenta en ≥50% con respecto al valor basal, o cuando la producción de orina se reduce por debajo de 0.5ml/kg/h durante más de 6horas66,67. En la evaluación prequirúrgica se debe prevenir el desarrollo de AKI en la cirrosis, considerando evitar medicamentos potencialmente nefrotóxicos, como los antiinflamatorios no esteroides (AINE), el uso excesivo o no supervisado de diuréticos o beta bloqueadores no selectivos (BBNS), la paracentesis de gran volumen sin reposición de albúmina y el consumo de alcohol66. En aquellos pacientes con cirrosis que cursan con AKI se recomienda seguir el algoritmo de manejo que se muestra en la figura 2. Así mismo, conviene mantener una presión arterial media (PAM) >60mmHg para asegurar una adecuada presión de perfusión renal68.
Valoración y manejo de la lesión renal aguda en pacientes con cirrosis65,66.
AKI: lesión renal aguda; ELISA: ensayo por inmunoabsorción ligado a enzimas; NIA: nefritis intersticial aguda; NTA: necrosis tubular aguda; SHR: síndrome hepatorrenal; US: ultrasonido.
* Retirar diuréticos, beta bloqueadores no selectivos, analgésicos antinflamatorios no esteroideos, otros nefrotóxicos. Tratar infecciones. Restitución de volumen intravascular.
& Los mejores valores de corte para la lipocalina asociada a gelatinasa neutrofílica (NGAL) con el fin de diferenciar entre la NTA y otros tipos de AKI, incluyendo el SHR-AKI, son 365ng/ml y 220μg/g de creatinina para las técnicas de ELISA y turbidimetría mejorada por partículas, respectivamente. Una fracción de excreción de sodio (FENa) <1% puede sugerir SHR.
La hiponatremia se define como una concentración sérica de sodio <135mmol/l, y está presente en el 49% de los pacientes con cirrosis y ascitis67,68. La hiponatremia hipervolémica es la más frecuente en el paciente cirrótico con ascitis y edema debido a la expansión de volumen extracelular, y es secundaria a la activación del sistema de renina angiotensina aldosterona debido a la disminución del volumen circulante asociado a la vasodilatación esplácnica. La hiponatremia debe tratarse solo cuando el sodio sérico es <125mmol/l. El tratamiento consiste en restricción de líquidos a <1,000ml/día y suspensión de diuréticos, para lograr un balance negativo. En casos con síntomas severos, como crisis convulsivas (sodio sérico <120mmol/l), se pueden administrar soluciones salinas hipertónicas, con lo que presentan mejoría rápida de la natremia pero aumenta la sobrecarga de volumen, empeorando la ascitis y el edema. En el escenario de un paciente que pasará a cirugía y tiene hiponatremia aguda severa con síntomas severos se recomienda administrar solución salina al 3% en bolos de 100ml para 15-30minutos, pudiendo repetir la dosis hasta tres veces, siendo la meta el aumento del sodio sérico de 4-6mmol/l en las primeras 6horas. En el caso de hiponatremias crónicas sintomáticas o graves se puede administrar solución salina al 0.9% a una velocidad de 15-30ml/h. Se recomienda no aumentar la concentración de sodio sérico más de 8mmol/l para evitar una mielinólisis pontina; sin embargo, la evidencia reciente sugiere que aumentar la concentración de sodio sérico >10mmol/l se asocia a menos mortalidad y estancia hospitalaria, sin aumentar el riesgo de mielinólisis pontina65,69.
Otra opción actual para la corrección de la hiponatremia es la administración de albúmina intravenosa, la cual produce el aumento del sodio sérico al incrementar el aclaramiento urinario de agua libre secundario a la expansión del volumen intravascular. Se ha demostrado en pacientes cirróticos hospitalizados una mayor tasa de respuesta a la hiponatremia, así como una mejoría en la sobrevida a 30días70. El uso de antagonistas de receptores de vasopresina en cirróticos con hiponatremia hipervolémica puede aumentar las concentraciones de sodio sérico durante el tratamiento. Sin embargo, se debe usar por períodos cortos de <30días, por riesgo de daño hepatocelular67, y en México no están disponibles.
La hipopotasemia en el cirrótico es multifactorial, y las principales causas son el uso de diuréticos de asa, pérdidas gastrointestinales (diarrea y vómitos), alcalosis respiratoria, hiperaldosteronismo secundario, acidosis tubular renal e hipomagnesemia por malnutrición crónica. La hipopotasemia induce acidosis intracelular en las células del túbulo proximal, que produce un aumento en la reabsorción y el metabolismo de la glutamina que conlleva a la amoniogénesis y a riesgo de EH. Por tanto, los niveles séricos óptimos de potasio son >4mEq/l. En aquellos que presenten déficit la corrección debe ser lenta; de tener disponible la vía oral, se pueden utilizar sales de potasio, y en aquellos en los que no se disponga o se necesiten correcciones rápidas, se puede utilizar la vía parenteral65,71,72.
Por otro lado, los pacientes cirróticos también pueden desarrollar hiperpotasemia, generalmente secundaria al uso de diuréticos ahorradores de potasio (espironolactona, amilorida o eplerenona). Los pacientes con mayor riesgo de desarrollarla son aquellos con AKI y pacientes con dosis de espironolactona >100mg/día. Si un paciente presenta niveles de potasio sérico >6mEq/l, se recomienda suspender la espironolactona65,67,72.
Todo cirrótico descompensado con acidosis metabólica se debe evaluar y determinar su causa, siendo las más comunes la hipovolemia y las infecciones. La corrección oportuna de la hipovolemia y de las infecciones son cruciales para el pronóstico67,73.
10. En pacientes que requieren procedimientos quirúrgicos electivos es conveniente el control del factor etiológico de la cirrosis en el preoperatorio, siempre que sea posible. Sin embargo, en el paciente que requiere cirugía urgente nunca debe retrasarse el manejo quirúrgico, independientemente de la causa de la cirrosis y del control de la misma.
Totalmente de acuerdo 92.9%, parcialmente de acuerdo 7.1%.
Nivel de evidencia moderado a bajo, débil a favor de la recomendación.
La cirrosis tiene varias causas, y es bien sabido que el control del factor etiológico es crucial para prevenir la descompensación en aquellos que se encuentran compensados, prevenir la progresión de la descompensación y mejorar la sobrevida en aquellos que ya están basalmente descompensados74,75, y reducir el riesgo de desarrollo de carcinoma hepatocelular73. Así mismo, sabemos que los procedimientos quirúrgicos pueden ser causa de descompensación en el paciente con cirrosis7,24,76; por tanto, siempre que sea posible es conveniente, en la etapa preoperatoria, identificar la causa de la cirrosis77-82, tratarla y controlarla, además de instaurar otras medidas de optimización del paciente26,68,77,83, que se resumen en la tabla 4. Sin embargo, en casos de cirugía de urgencia, el control del factor etiológico pasa a segundo plano, ya que el diferimiento del procedimiento quirúrgico podría impactar en una mayor morbilidad y mortalidad para el paciente. Por ejemplo, en un contexto general, la tasa de mortalidad a los 28días fue significativamente mayor entre los pacientes que tuvieron retraso en la atención por padecimientos urgentes frente a los pacientes que se atendieron en forma oportuna (10.4% frente al 2.5%, OR: 4.6 (IC95%: 1.3-16.5), p=0.038)84.
Aspectos más importantes del manejo preoperatorio para reducir el riesgo quirúrgico en pacientes con enfermedad hepática crónica avanzada / cirrosis76
| Identificar, tratar y controlar el factor etiológico | • Infección por virus de la hepatitis B77Maniobra. Todos los pacientes con cirrosis compensada o descompensada deben idealmente estar recibiendo tratamiento con análogos nucleós(t)idos con alta barrera a la resistencia (TDF, TAF o ETV). Los pacientes postrasplantados de hígado deben continuar tratamiento con TDF, TAF o ETV +HBIG con el fin de evitar la recidivaMeta. carga viral indetectablea |
| • Infección por virus de la hepatitis C78Maniobra. El tratamiento con AAD (esquemas libres de inhibidores de proteasa en el paciente descompensado) debe garantizarse idealmente en el preoperatorio electivo. En cirugía de trasplante hepático algunos pacientes descompensados podrían requerir primero ser trasplantados (Child-Pugh C, MELD > 20) y posteriormente recibir tratamiento con AAD.Meta. Respuesta viral sostenida a la semana 12 postratamiento | |
| • Hepatitis autoinmune79Maniobra. Terapia inmunosupresoraMeta. Inducir la remisión, definida como la normalización de las aminotransferasas e inmunoglobulina G a los seis meses, y mantener la remisión posteriormente | |
| • Enfermedad hepática asociada al alcohol80Maniobra. Apoyo familiar, psicosocial y farmacológicoMeta. Mantener abstinencia | |
| • Enfermedad hepática esteatósica asociada a disfunción metabólica81Maniobra. Cambios al estilo de vida, control metabólico y estrategias para reducir el riesgo cardiovascularMeta. Control de factores cardiometabólicos, mejoría de esteatosis, esteatohepatitis y fibrosis hepáticas | |
| Manejo y control de manifestaciones de descompensación | • Ascitis. Optimización de diuréticos, restricción de exceso de sodio en la dieta67 |
| • Encefalopatía hepática. Control de factor precipitante, optimización nutricional para prevenir o corregir la sarcopenia, terapia o profilaxis específica (lactulosa, rifaximina, L-ornitina L-aspartato)82 | |
| • Prevención de hemorragia variceal. BBNS se consideran la estrategia de primera línea. Solo en caso de intolerancia a los BBNS, considerar ligadura endoscópica (reduce riesgo de hemorragia, pero no tiene efecto en prevenir desarrollo o progresión de la descompensación, ni tampoco tiene efecto en sobrevida). En profilaxis secundaria la estrategia combinada (BBNS +ligadura endoscópica) se considera la estrategia más eficaz. De forma individual, considerar colocación de TIPS26 | |
| Estado nutricional y acondicionamiento físico | • Optimización de la dieta. Dieta variada que incluya entre 25 a 35 kcal/kg/día y 1.2 a 1.5g de proteína/kg/día. Comidas frecuentes, incluir colación nocturna76Ejercicio. Favorecer ejercicio aeróbico76 |
Respecto a la etiología de la cirrosis, en esta tabla se hace referencia a las causas más comunes.
La curación funcional de la infección por virus de hepatitis B debe definirse como la pérdida duradera del antígeno de superficie de la hepatitis B (HBsAg) con o sin seroconversión y carga viral indetectable en sangre tras el tratamiento sostenido. La cura parcial es un objetivo mucho más realista: HBsAg detectable, pero carga viral persistentemente indetectable en suero tras el tratamiento sostenido.
AAD: agentes antivirales de acción directa; BBNS: beta-bloqueadores no selectivos; ETV: entecavir; HBIG: inmunoglobulina anti-hepatitis B; MELD: Model for Endstage Liver Disease; TAF: tenofovir alafenamida; TDF: tenofovir disoproxil fumarato; TIPS: cortocircuitos intrahepáticos porto-sistémicos.
11. La encefalopatía hepática manifiesta debe corregirse siempre que sea posible antes de un procedimiento quirúrgico electivo.
Totalmente de acuerdo 100%.
Nivel de evidencia bajo a muy bajo, débil a favor de la recomendación.
La cirugía es un factor que se relaciona con riesgo de descompensación en el paciente con cirrosis; por ello, ante procedimientos electivos es crucial corregir todos los posibles factores adversos en el preoperatorio77. Por citar un ejemplo, dentro de los 90 días posteriores a una cirugía ortopédica, los pacientes operados tuvieron más descompensación en comparación con controles emparejados (12.8% frente a 4.9%)76. Durante el postoperatorio, los pacientes con cirrosis tienen mayor riesgo de padecer EH, ascitis, sepsis y hemorragia; por tanto, los procedimientos quirúrgicos en pacientes con cirrosis conllevan mayor mortalidad85. Posterior a un procedimiento quirúrgico electivo, los factores que se han asociado de forma independiente con mayor riesgo de mortalidad al año después de la cirugía son los niveles de fosfatasa alcalina, la puntuación MELD y la presencia de EH preoperatoria, donde esta última presenta un HR de 4.4 (IC95%: 1.3-15.4) como factor independiente de riesgo asociado a mortalidad a un año de seguimiento tras la cirugía86.
Adicionalmente, es bien sabido que ciertos fármacos sedantes o anestésicos pueden relacionarse a mayor riesgo de EH83; por tanto, corregir o en su caso mejorar la EH manifiesta es importante previo a un procedimiento quirúrgico electivo. Así mismo, el anestesiólogo debe tomar en cuenta aspectos de seguridad y eficacia propios de los agentes sedantes y anestésicos. Por ejemplo, varios estudios han encontrado que el propofol monoterapia resulta ser una estrategia sedante igualmente efectiva, pero más segura en pacientes con cirrosis compensada o descompensada cuando se ha comparado con midazolam o la combinación propofol más midazolam, ya que se ha relacionado a menor riesgo de desarrollo y de progresión de EH mínima y manifiesta87-91.
12. En pacientes con cirrosis e indicación de cirugía urgente, el procedimiento nunca deberá retrasarse por priorizar el evaluar otros parámetros, sabiendo que el tiempo de demora podría poner en riesgo la vida del paciente.
Totalmente de acuerdo 100%.
Nivel de evidencia bajo, fuerte a favor de la recomendación.
Como se ha expuesto antes, el retraso en la atención de urgencia de un paciente confiere mayor mortalidad84. Existe poca información en el contexto específico del paciente con cirrosis; sin embargo, extrapolado del contexto general, limitar el acceso expedito y oportuno a pacientes que requieren cirugía de emergencia ha resultado en un aumento de las complicaciones intraoperatorias, la morbilidad general, la duración de la estancia hospitalaria, la estancia en la unidad de cuidados intensivos y también en la mortalidad92.
13. A pesar de que la disfunción inmune en el paciente con cirrosis aumenta el riesgo de infecciones, no existe evidencia que respalde la administración de antibióticos de manera profiláctica ante procedimientos quirúrgicos en pacientes por el hecho de padecer cirrosis per se. La indicación de profilaxis con antibiótico previo a una cirugía dependerá del tipo de procedimiento quirúrgico y se instaurará en pacientes con cirrosis de igual forma a como se indica habitualmente en pacientes sin cirrosis.
Totalmente de acuerdo 92.9%, parcialmente de acuerdo 7.1%.
Nivel de evidencia moderado a bajo, débil a favor de la recomendación.
Los pacientes con cirrosis, particularmente aquellos descompensados, presentan disfunción inmunológica; por lo tanto, la infección bacteriana representa un evento relativamente común en estos pacientes, que además puede empeorar la hipertensión portal, deteriorar la función hepática y afectar a órganos extrahepáticos93,94. Entre las estrategias farmacológicas para prevenir la infección, la profilaxis antibiótica sigue siendo la primera opción en pacientes con hemorragia aguda por várices, proteínas bajas en ascitis y episodios previos de peritonitis bacteriana espontánea (PBE) que no se deberán suspender si el paciente es programado para alguna intervención quirúrgica electiva o urgente95,96.
Por otro lado, la profilaxis antibiótica no se recomienda de forma rutinaria para los procedimientos intervencionistas electivos en pacientes con cirrosis. Debe considerarse cuidadosamente en pacientes de alto riesgo, como aquellos con anastomosis bilioentérica, mientras que debe adoptarse de forma rutinaria en pacientes con colangitis esclerosante primaria sometida a colangiopancreatografía retrógrada endoscópica (CPRE)97.
14. En pacientes con cirrosis que, de acuerdo con el consenso de Baveno VII, estén recibiendo profilaxis primaria o secundaria con betabloqueadores no selectivos, esta deberá mantenerse siempre y cuando no existan contraindicaciones específicas para continuarla ante ciertos procedimientos quirúrgicos o anestésicos. Si estuviera indicado llevar a cabo la ligadura variceal, esta deberá realizarse antes del procedimiento quirúrgico electivo.
Totalmente de acuerdo 85.7%, parcialmente de acuerdo 14.3%.
Nivel de evidencia alto, fuerte a favor de la recomendación.
El tratamiento con BBNS está indicado para la prevención de la descompensación en pacientes con HPCS; así como en la profilaxis primaria y secundaria de hemorragia variceal. El carvedilol tiene efectos vasodilatadores intrínsecos anti-alfaadrenérgicos que contribuyen a un mayor efecto reductor de la presión del portal en comparación con los BBNS convencionales26. Además del efecto hemodinámico, los BBNS reducen la permeabilidad gastrointestinal anormal y la translocación bacteriana, y también regulan la actividad fagocítica de monocitos y granulocitos después de la exposición a productos bacterianos98. Las contraindicaciones para el uso de BBNS son: hiperreactividad bronquial, enfermedad pulmonar obstructiva crónica y bloqueo auriculoventricular de segundo y tercer grado99. El beneficio que aportan los BBNS a los pacientes con cirrosis está basado en el apego al tratamiento, por lo que no se deben suspender, excepto cuando exista un efecto secundario (bradicardia grave o hipotensión); en cirugía electiva no requieren suspenderse con antelación, y una vez el paciente tolere la vía oral, si se encuentra hemodinámicamente estable, sin AKI, sin procesos de tipo infeccioso y al alta pueden reiniciarse. En pacientes que serán programados para cirugía electiva, que ameritan ligadura variceal, esta deberá realizarse 2 a 3 semanas previamente26.
15. La colocación de una derivación transyugular intrahepática porto-sistémica (TIPS) puede reducir el riesgo de presentar hemorragia gastrointestinal asociada con hipertensión portal grave.
Totalmente de acuerdo 78.6%, parcialmente de acuerdo 7.1%, incierto 14.3%.
Nivel de evidencia moderado, fuerte a favor de la recomendación.
La HPCS es una complicación principal de la cirrosis y se caracteriza por el desarrollo de várices, hemorragia variceal y ascitis100. Estas complicaciones se asocian con una morbilidad y mortalidad significativas, por lo que es necesario un tratamiento eficaz y/o la prevención de estos eventos. La colocación de una derivación transyugular intrahepática portosistémica (TIPS) es un tratamiento intervencionista eficaz y seguro de la hipertensión portal101. Es importante destacar que la asignación basada en la evidencia para la colocación del TIPS, así como la selección óptima de los pacientes antes de la implantación del TIPS, es esencial para mejorar el pronóstico de estos pacientes. En pacientes con hemorragia por várices, la implantación de TIPS se puede realizar como terapia de rescate (TIPS de rescate), como TIPS preventivo (temprano) o para la profilaxis secundaria de la hemorragia por várices. En algunos pacientes, el tratamiento endoscópico no consigue detener la hemorragia, y en estas situaciones el rescate con la colocación de TIPS con embolización con espiral de las várices sangrantes es altamente eficaz, con una tasa de éxito de aproximadamente el 90%102, y varios estudios han demostrado una reducción significativa de las tasas de recurrencia de hemorragia. Además, estos estudios también han demostrado una mejora significativa de la supervivencia a 1año103. De acuerdo con estos estudios positivos, el consenso de Baveno recomendó el implante preventivo de TIPS a las 72horas después del evento de sangrado variceal en pacientes con alto riesgo de recurrencia de hemorragia68. Incluso los pacientes con falla hepática aguda o crónica (ACLF) después de una hemorragia variceal pueden beneficiarse de la implantación de TIPS104.
Respecto a la colocación de TIPS previo a un evento quirúrgico programado existen varias áreas de oportunidad, como son:
- a)
No existe una indicación rutinaria de TIPS previo a un evento quirúrgico.
- b)
La bibliografía al respecto es muy escasa.
- c)
En pacientes descompensados, la colocación de un TIPS puede «recompensar» la enfermedad hepática. En estos pacientes descompensados es muy importante evaluar detenidamente la indicación del TIPS porque, quizá, ya estuviera indicado independientemente del evento quirúrgico.
- d)
En pacientes compensados no hay criterios de selección claros, pero en cirugías de alto riesgo quizás un gradiente >16mmHg pudiera ser útil; sin embargo, es claro que una cirugía necesaria o con mayor razón una urgente nunca deberá de postergarse en razón de colocar un TIPS35.
- e)
Si existe una indicación clara de colocación de TIPS, siempre que sea posible convendría diferir la cirugía hasta la colocación del TIPS. Si no se cuenta con oportunidad de colocación de TIPS en el centro donde se está manejando el paciente, es conveniente referir a centros especializados donde se pueda lograr.
16. La presencia de ascitis aumenta el riesgo de infección peritoneal, fuga de líquido y dehiscencia de la herida quirúrgica en cirugía abdominal; por tanto, se recomienda un control óptimo de la ascitis antes de una cirugía electiva.
Totalmente de acuerdo 100%.
Nivel de evidencia bajo, débil a favor de la recomendación.
La acumulación de líquido en la cavidad peritoneal no solo aumenta la dificultad de la técnica quirúrgica, sino que también eleva significativamente el riesgo de infección peritoneal, fuga de líquido y dehiscencia de la herida quirúrgica. La presencia de ascitis en pacientes con cirrosis está asociada con una mortalidad del 37% al 83%105. Puede causar compromiso respiratorio al reducir la expansión pulmonar, eventración de la pared abdominal y dehiscencia de suturas. Es esencial abordar y controlar eficazmente la ascitis antes de la cirugía electiva para mejorar los resultados postoperatorios y la morbimortalidad en esta población de pacientes de alto riesgo. Fleming et al.106 demostraron que la presencia de ascitis es un factor predictivo de mayor riesgo en la ocurrencia de complicaciones quirúrgicas y también asociado a mayor mortalidad, ambas situaciones independientemente del puntaje de MELD. En este mismo estudio, los autores sugieren que el puntaje MELD puede subestimar el riesgo quirúrgico en pacientes con ascitis. Para mejorar la precisión de las evaluaciones de riesgo perioperatorio para estos pacientes complejos, los modelos predictivos deben incluir la ascitis como un parámetro crítico. Esto es importante para la toma de decisiones clínicas y destaca la necesidad de un enfoque matizado en las intervenciones quirúrgicas en presencia de ascitis.
Ciertos procedimientos están contraindicados en pacientes con ascitis; por ejemplo, la gastrostomía percutánea debido al riesgo elevado de infección está contraindicada en pacientes con ascitis y, por lo general, debe evitarse en pacientes con hipertensión portal107.
En general, la ascitis debe tratarse agresivamente con diuréticos y/o paracentesis evacuatoria y administración de albúmina si es necesario. Si no se logra drenar antes de la cirugía, se puede realizar durante la laparotomía, cuantificando la cantidad drenada y reponiendo la albúmina que sea necesaria semejante a cuando se realiza una paracentesis evacuadora (6 a 8g/l evacuado a partir de >5l drenados)68. La ascitis debe analizarse para descartar PBE y tratarse si está presente107.
Los pacientes que requieren cirugía de urgencia tienen un riesgo significativo de desarrollar disfunción hepática debido a la menor oportunidad de corregir factores reversibles, como alteraciones electrolíticas, coagulopatía y manifestaciones de hipertensión portal, como ascitis y EH. La cirugía de urgencia es un factor de peor pronóstico, con una diferencia significativa en comparación con los pacientes sometidos a cirugía electiva (mortalidad en cirugía de urgencia a los 3meses del 44% frente al 21% en cirugía electiva)108.
17.En el paciente con cirrosis, a quien se le realizará algún procedimiento invasivo o endoscópico clasificado como de alto riesgo, no se ha demostrado contundentemente un beneficio en reducir el riesgo de hemorragia al corregir el INR prolongado transfundiendo hemoderivados. Tampoco está indicado transfundir concentrados plaquetarios ni agonistas de trombopoyetina cuando el conteo plaquetario es >50,000/μl.
Totalmente de acuerdo 100%.
Nivel de evidencia moderado a bajo, débil a favor de la recomendación.
La administración profiláctica de hemoderivados con el objetivo de prevenir el sangrado durante el procedimiento en pacientes con cirrosis no debe realizarse de forma rutinaria, particularmente cuando los procedimientos que se prevé realizar son de bajo riesgo. En este contexto, optimizar las medidas generales que se muestran en la tabla 5 resulta mucho más relevante para prevenir y reducir el riesgo de hemorragia109.
Manejo peri-procedimientos quirúrgicos, no quirúrgicos y endoscópicos en el paciente con cirrosis55,108,111
| Medidas generales | • Optimizar la anemia restituyendo potenciales carencias: hierro, complejo B, ácido fólico |
| • Tratar infecciones | |
| • Optimizar función renal | |
| • Corregir desequilibrio ácido-base (acidosis) | |
| • Pacientes con terapia anticoagulante o con antiagregantes plaquetarios deben ser valorados cuidadosamente y retirar previo a procedimiento electivo; en casos urgentes explicar al paciente riesgo-beneficio | |
| • Consultoría multidisciplinaria para toma de mejores decisiones | |
| Pruebas de hemostasia | • El tiempo de protrombina y el INR no predicen el riesgo de hemorragia |
| • Es incierto si el conteo plaquetario y las cifras de fibrinógeno predicen con certeza el riesgo de hemorragia | |
| • Es incierto si las pruebas viscoelásticas predicen con certeza el riesgo de hemorragia. Pero sí ayudan de forma más certera, en comparación con otras pruebas convencionales, a guiar la necesidad de terapia transfusional en el paciente con cirrosis | |
| • No es recomendable la realización rutinaria de pruebas de hemostasia con el fin de predecir el riesgo de hemorragia. Pero sí son útiles previamente a un procedimiento para tener un valor basal en caso de que la hemorragia ocurra | |
| • Son indicadores de la severidad de la enfermedad | |
| Profilaxis en pacientes con pruebas hemostásicas alteradas | • No se recomienda administrar plasma fresco congelado en forma profiláctica, aun en presencia de prolongación de tiempo de protrombina e INR |
| • No se recomienda de forma rutinaria administrar concentrados plaquetarios, concentrados de fibrinógeno o crioprecipitados para profilaxis | |
| • En pacientes en quienes se realizarán procedimientos quirúrgicos de alto riesgo y que presentan cuenta plaquetaria <50,000/ml o fibrinógeno <120mg/dl, se recomienda discutir en grupo multidisciplinario e individualizar decisión. Además de mantener hematocrito >25%. Algunos expertos recomiendan INR <2, aunque este parámetro se considera todavía muy controversial | |
| • En pacientes en quienes se realizarán procedimientos invasivos no quirúrgicos de alto riesgo y que presentan cuenta plaquetaria <50,000/ml o fibrinógeno <100mg/dl, se recomienda discutir en grupo multidisciplinario e individualizar decisión. Conviene mantener hematocrito >25%. Algunos expertos recomiendan INR <2, aunque este parámetro se considera todavía muy controversial | |
| • En pacientes en quienes se realizarán procedimientos invasivos no quirúrgicos de bajo riesgo y que presentan cuenta plaquetaria <30,000/ml se recomienda discutir en grupo multidisciplinario e individualizar decisión. Otros parámetros no requieren ajuste |
Se debe recordar que los pacientes con cirrosis enfrentan un incremento en el riesgo de hemorragia de origen multifactorial, no solo debido a alteraciones hemostáticas asociadas a la enfermedad hepática, que incluyen trombocitopenia y la disminución de factores de coagulación, sino también asociado a la propia HPCS, y más importantemente relacionado a la naturaleza del procedimiento a realizar110-112.
En un estudio que incluyó 1,187 pacientes con cirrosis hospitalizados, en quienes se realizaron 3,006 procedimientos no quirúrgicos en 20 centros internacionales, el sangrado en términos generales se reportó en el 3% de los procedimientos. Se informó hemorragia mayor en el 2.3% de los ingresos de pacientes y en el 0.9% de los procedimientos. Los pacientes con hemorragia tenían más probabilidades de tener esteatohepatitis metabólica (MASH) (43.9% frente a 30%), mayor IMC (31.2 frente a 29.5) y MELD más elevado (24.5 frente a 18.5). En el análisis multivariado, con respecto a la variabilidad potencial entre los centros participantes, se encontró que los procedimientos de alto riesgo (OR: 4.64; IC95%: 2.44-8.84), la puntuación de MELD (OR: 2,37; IC95%: 1.46-3.86) y un IMC más alto (OR: 1.40; IC95%: 1.10-1.80) predijeron de forma independiente el riesgo de hemorragia. Por el contrario, ni el INR previo al procedimiento, ni el nivel de plaquetas, ni el uso de antitrombóticos fueron predictivos de hemorragia113.
Se clasifican como procedimientos de alto riesgo en el paciente con cirrosis aquellos con una incidencia de hemorragia superior al 1.5%110 (tabla 6). Uno de los procedimientos endoscópicos de alto riesgo más frecuentes es la polipectomía, que presenta tasas de hemorragia post-resección que oscilan entre el 0.3% y el 6.1%, siendo más común cuando se utiliza corriente de corte pura. Los factores de riesgo más relevantes para presentar hemorragia post-polipectomía son la edad superior a los 65años, un tamaño del pólipo mayor a 1cm, enfermedad cardiovascular y el uso de terapia antitrombótica114,115.
Clasificación de los procedimientos de acuerdo al riesgo en pacientes con cirrosis111
| Procedimientos de bajo riesgo |
| Endoscópicos |
| Colangiografía retrógrada endoscópica (CPRE) con colocación de stent biliar o pancreático sin esfinterotomía |
| Hemostasia endoscópica con argón plasma |
| Videocápsula endoscópica |
| Ultrasonido endoscópico sin aspiración con aguja fina |
| Retiro de stent enteral |
| Polipectomía <1cm |
| Panendoscopia diagnóstica con o sin toma de biopsias |
| Enteroscopia diagnóstica asistida por balón |
| Enteroscopia de empuje |
| Rectosigmoidoscopia flexible con o sin toma de biopsias |
| Colonoscopia diagnóstica con o sin toma de biopsias |
| Vasculares |
| Colocación de catéter venoso central |
| Colocación de catéter venoso central por vía periférica |
| Retiro de acceso vascular central |
| Cateterismo cardiaco |
| Ecocardiografía transesofágica |
| Angiografía coronaria diagnóstica |
| Colocación de filtro de vena cava inferior |
| Hepáticos |
| Biopsia hepática transyugular |
| Medición del gradiente de presión venosa hepática |
| Paracentesis diagnóstica y terapéutica |
| Pulmonares |
| Toracocentesis |
| Broncoscopia sin toma de biopsias |
| Urológicos |
| Cistoscopia |
| Ureteroscopia |
| Ginecológicos |
| Colposcopia con biopsia cervical |
| Histeroscopia diagnóstica |
| Misceláneos |
| Limpieza dental |
| Inyección intraarticular |
| Biopsia percutánea de ganglio linfático |
| Biopsia de piel |
| Recambio de catéter de drenaje |
| Procedimientos sin consenso respecto al riesgo |
| Endoscópicos |
| CPRE con dilatación papilar con balón sin esfinterotomía |
| Dilatación de estenosis |
| Ultrasonido endoscópico con aspiración con aguja fina |
| Ligadura variceal |
| Inyección de varices gástricas |
| Enteroscopia terapéutica asistida por balón |
| Vasculares |
| Colocación de vía arterial |
| Angiografía coronaria terapéutica |
| Angiografía o venografía con intervención |
| Radiológicos |
| Ablación por radiofrecuencia |
| Hepáticos |
| Biopsia hepática percutánea |
| Biopsia hepática laparoscópica |
| Recanalización portal |
| Derivación transyugular intrahepática portosistémica (TIPS) |
| Ablación percutánea de hepatocarcinoma |
| Colocación de catéter para drenaje de ascitis |
| Pulmonares |
| Broncoscopia con biopsias |
| Broncoscopia terapéutica |
| Colocación de sonda endopleural |
| Urológicos |
| Litotripsia (riñones, vejiga, ureteral) |
| Neurológicos |
| Punción lumbar |
| Ginecológicos |
| Histeroscopia con biopsia |
| Amniocentesis |
| Misceláneos |
| Extracción dental |
| Punción intraarticular |
| Procedimientos de alto riesgo |
| Endoscópicos |
| CPRE con esfinterotomía biliar o pancreática |
| Resección de la mucosa |
| Disección de la submucosa |
| Cistogastrostomía |
| Polipectomía > 1 cm |
| Miotomía endoscópica peroral |
| Resección ampular |
| Gastrostomía |
| Yeyunostomía |
| Hepáticos o biliares |
| Drenaje biliar percutáneo |
| Colecistostomía |
| Pulmonares |
| Biopsia intratorácica |
| Urológicos |
| Biopsia de próstata |
| Biopsia renal percutánea |
| Colocación de catéter de nefrostomía |
| Neurológicos |
| Colocación de catéter epidural |
| Procedimientos que involucren el sistema nervioso central |
| Misceláneos |
| Biopsia de órgano sólido intraabdominal no hepático |
Modificado de Riescher-Tuczkiewicz et al.112.
Como ya se ha mencionado con anterioridad en este posicionamiento, la terapia transfusional en pacientes con cirrosis debe de forma ideal guiarse con pruebas viscoelásticas59. Cuando no se dispone de ellas, podría, de acuerdo con el juicio clínico, individualizarse cada caso y, de forma semejante a los procedimientos quirúrgicos, considerar ante procedimientos endoscópicos u otros procedimientos no quirúrgicos de alto riesgo110,111 (tabla 6) optimizar la formación del coágulo mediante las medidas generales109 citadas en la tabla 5 y manteniendo los siguientes parámetros: hematocrito >25%, recuento de plaquetas >50,000/μl y fibrinógeno >120mg/dl56; este último parámetro preferentemente debe ser corregido a través de concentrados de fibrinógeno, ya que el volumen muy bajo, la estandarización del contenido de fibrinógeno y la falta de necesidad de pruebas cruzadas favorecen su uso en la cirrosis111. Cabe destacar que corregir el INR en este contexto carece de respaldo de evidencia, y la excedencia en transfundir PFC podría resultar deletérea, ya que con esto se incrementa el riesgo de hemorragia asociado a incremento de la hipertensión portal109,116-118.
18. En pacientes con cirrosis que requieren un procedimiento invasivo o endoscópico de bajo riesgo no se recomienda la administración de hemoderivados con el fin de corregir alteraciones en las pruebas hemostásicas convencionales.
Totalmente de acuerdo 100%.
Nivel de evidencia bajo a muy bajo, débil a favor de la recomendación.
Un estudio reciente demostró que los pacientes con cirrosis, particularmente aquellos descompensados, muestran una agregación plaquetaria significativamente aumentada en sangre. Esta agregación plaquetaria particularmente elevada está asociada con el riesgo de mayores complicaciones y muerte119. En el estudio PROLIVER, que investigó prospectivamente a 280 pacientes con cirrosis estable, el riesgo de sangrado anual fue del 3.5% por año y del 1.8% por año para sangrados mayores y menores, respectivamente. Hubo 3 complicaciones por sangrado que ocurrieron principalmente en el tubo gastrointestinal, y no se encontró relación entre el recuento de plaquetas y el sangrado120. No existe evidencia suficiente y contundente a favor de recomendar la corrección plaquetaria en pacientes que serán intervenidos con procedimientos de bajo riesgo; la decisión en pacientes con trombocitopenia severa (<30,000/μl) debe tomarse en base a una discusión en un equipo multidisciplinario. La corrección de otros parámetros, como INR, fibrinógeno, TP, ante procedimientos de bajo riesgo, no se justifica112.
Escenario transoperatorio19. La necesidad de transfundir hemoderivados durante la cirugía debe guiarse por la magnitud de la hemorragia intraoperatoria, el estado hemodinámico del paciente, las cifras de fibrinógeno sérico, las plaquetas y las pruebas viscoelásticas cuando estas últimas estén disponibles.
Totalmente de acuerdo 100%.
Nivel de evidencia moderado, débil a favor de la recomendación.
Las pruebas viscoelásticas que se han comentado con anterioridad parecen ser la mejor alternativa hasta el momento para guiar la terapia transfusional durante el procedimiento quirúrgico. Dos estudios recientes mostraron que la mayoría de los pacientes con enfermedad hepática crónica avanzada compensada tienen un rango normal de valores en la TEG121,122. Cuando no se dispone de pruebas viscoelásticas, se puede guiar la necesidad de transfusión de acuerdo con las recomendaciones que se muestran en la tabla 5.
Semejante a las recomendaciones para procedimientos invasivos o endoscópicos anteriormente comentados, no se debe realizar transfusión profiláctica de PFC, incluso en pacientes con niveles de PT/INR anormales, porque puede aumentar significativamente la presión portal, el riesgo de hemorragia y los efectos secundarios a nivel pulmonar56.
Se prefieren el concentrado de complejo de protrombina, los concentrados de fibrinógeno o los crioprecipitados (que contienen fibrinógeno, factor Von Willebrand y factorVIII) porque equilibran la hipofibrinogenemia con menos sobrecarga de volumen. No se aconseja el uso de fármacos antifibrinolíticos, como el ácido tranexámico. La trombocitopenia grave está relacionada con eventos hemorrágicos periprocedimiento, pero no hay evidencia de que la transfusión profiláctica de plaquetas mejore el potencial hemostático111. En pacientes con coagulopatía grave (recuento de plaquetas <50,000/μl o nivel de fibrinógeno <100mg/dl) sometidos a procedimientos de alto riesgo sin posibilidad de hemostasia local se puede considerar la administración profiláctica de análogos de trombopoyetina (avatrombopag o lusutrombopag), concentrados plaquetarios; y concentrados de fibrinógeno63,109.
20. Para limitar el daño hepático en pacientes con cirrosis, los objetivos intraoperatorios generales deben ser mantener el flujo sanguíneo hepático y el suministro de oxígeno; así como minimizar la exposición a agentes hepatotóxicos.
Totalmente de acuerdo 100%.
Nivel de evidencia moderado, fuerte a favor de la recomendación.
Los líquidos y electrólitos deben vigilarse estrechamente y corregirse según sea necesario. El desarrollo o el empeoramiento de la hiponatremia se consideran un hallazgo importante debido a que implican la sobrecarga de líquidos resultante de la reducción del aclaramiento de agua libre de solutos. Puede originar ascitis grave, EH, AKI y aumento del tiempo de estancia hospitalaria123. Se recomienda la evaluación del estado de volumen con métodos invasivos o no invasivos dependiendo de la disponibilidad en el centro donde se encuentra el paciente, entendiendo la limitación de dichas herramientas en los pacientes con cirrosis. Métodos que pueden ser empleados incluyen la PAM, la ecocardiografía con método Point of Care Ultrasound (PoCUS) y el catéter arterial pulmonar124. Debido a que es escasa la evidencia de objetivos hemodinámicos en pacientes con cirrosis, se recomienda mantener una PAM ≥60mmHg125. En casos de PAM <60mmHg persistente se debe considerar el uso temprano de vasopresor cuando falla la reanimación hídrica. El vasopresor de elección es la norepinefrina126.
Los pacientes con cirrosis tienen mayor riesgo de hipoxia secundaria a enfermedad pulmonar restrictiva debido a la presencia de ascitis o derrame pleural, anomalías de difusión debidas a la vasodilatación arterial y venosa además de a cortocircuitos vasculares, y a la presencia de hipertensión pulmonar. Los pacientes con ascitis de gran volumen también están predispuestos a la aspiración broncopulmonar. Es por ello que se recomienda un suministro suficiente de oxígeno durante el procedimiento quirúrgico, asegurando la permeabilidad de la vía aérea en todo momento127.
Distintos AINE suelen usarse para el manejo de dolor quirúrgico, incluso durante el tiempo intraoperatorio para su prevención posquirúrgica. Sin embargo, conllevan un alto riesgo de desarrollar hemorragia gastrointestinal y lesión renal en los pacientes con cirrosis, por lo que deberían evitarse. Otros fármacos a evitar incluyen opioides y benzodiacepinas de acción prolongada128.
21. En pacientes con cirrosis se pueden usar medicamentos anestésicos convencionales, y en aquellos que requieran cirugía mayor se prefiere la anestesia general.
Totalmente de acuerdo 100%.
Nivel de evidencia bajo a muy bajo, débil a favor de la recomendación.
La enfermedad hepática modifica la farmacocinética de los anestésicos al alterar la unión a proteínas, el metabolismo y el volumen de distribución; sin embargo, en aquellos con enfermedad compensada pueden seleccionarse fármacos convencionales similares a los utilizados en otros pacientes129.
Deben considerarse modificaciones (p.ej., reducción de la dosis) en pacientes con enfermedad avanzada o descompensada, especialmente cuando se acompañan de hipertensión portal (como aquellos con varices esofágicas, ascitis o gastropatía/colopatía portal) o lesión renal130.
Respecto a los sedantes hipnóticos, los pacientes con enfermedad hepática presentan tasas similares de eliminación de las dosis de inducción utilizadas en la práctica clínica habitual, como el propofol, el etomidato y el metohexital, en comparación con los pacientes sin cirrosis. El tiempo medio de eliminación y los niveles de fármaco libre de las benzodiacepinas aumentan en la cirrosis, a excepción del oxazepam y el temazepam129-131.
La dexmedetomidina tiene aclaramiento disminuido y la semivida de eliminación puede prolongarse en pacientes con enfermedad hepática grave. La dosificación puede verse limitada por la bradicardia132.
Para los procedimientos que requieren sedación, el propofol es preferible a las benzodiacepinas, ya que su tiempo de acción es más corto y el tiempo de recuperación es menor en los pacientes con cirrosis133. El propofol es el agente de inducción de elección para la anestesia general debido a su rápida redistribución, pero puede causar vasodilatación y reducir potencialmente la perfusión hepática. El propofol también puede administrarse mediante infusión controlada por objetivo, requiriéndose menos cantidad134.
La tiopentona puede tener una duración de acción prolongada debido a una reducción de las proteínas plasmáticas, lo que resulta en un aumento de la fracción no unida del fármaco135.
Deben utilizarse dosis reducidas de opiáceos con intervalos mayores para evitar la acumulación del fármaco. Deben evitarse los opioides de acción prolongada, como la morfina y la meperidina, pero los opioides de acción más corta, como el fentanilo y la hidromorfona, se toleran bien cuando se utilizan en dosis más bajas129,130,135.
En cuanto a los agentes neuromusculares aminoesteroides, rocuronio y vecuronio, su duración de acción puede prolongarse en caso de insuficiencia hepática. Los agentes neuromusculares de bencilisoquinolina, atracurio y cisatracurio, no se ven afectados en la insuficiencia hepática. La succinilcolina es metabolizada por la colinesterasa plasmática; aunque la duración de la acción de la succinilcolina es prolongada, no es clínicamente significativa135,136.
Los anestésicos volátiles halogenados modernos son seguros en pacientes cirróticos. El isoflurano y el desflurano se metabolizan menos que el halotano en cloruro de trifluoroacetilo (TFA), que ha demostrado estar implicado en la toxicidad hepática del halotano (20% para el halotano, 0.2% para el isoflurano y 0.02% para el desflurano). La lesión hepática es extremadamente rara, si es que existe, con isoflurano y desflurano. El sevoflurano no se metaboliza en TFA y no se ha asociado a lesión hepática inmunomediada137.
Seguimiento y cuidados postoperatoriosLa disfunción hepática en el postoperatorio se caracteriza por el deterioro en las propiedades sintéticas, excretoras y de detoxificación. Habitualmente aparece en los primeros cinco días tras la cirugía. La gravedad y la naturaleza de la disfunción hepática pueden variar según diversos factores, como el tipo de cirugía, el grado de deterioro en la función hepática previa del paciente y otros factores comórbidos individuales. Algunas de las causas comunes de disfunción hepática postoperatoria incluyen: isquemia hepática, lesiones durante la cirugía, reacciones a medicamentos, infecciones postoperatorias y complicaciones de la anestesia. Por supuesto, la ocurrencia de esta condición tiene un impacto negativo en la supervivencia del paciente; de ahí que una vigilancia estrecha y cuidadosa del postoperatorio resulta muy importante138.
22. En el posquirúrgico, se debe vigilar la nutrición, la indicación de tromboprofilaxis, el uso de analgesia, la vigilancia de la herida quirúrgica (dehiscencia, sangrado, infección), el reinicio de medicamentos utilizados para el control de la cirrosis, y supervisión del desarrollo de descompensaciones propias de la cirrosis.
Totalmente de acuerdo 92.9%, parcialmente de acuerdo 7.1%.
Nivel de evidencia moderado a bajo, fuerte a favor de la recomendación.
Los principales apartados de esta recomendación se desglosarán en los siguientes enunciados a continuación.
23. NUTRICIÓN. La desnutrición y la hipoalbuminemia son factores de riesgo para mal pronóstico, por lo que debe priorizarse el restablecimiento temprano de alimentación, preferentemente enteral.
Totalmente de acuerdo 100%.
Nivel de evidencia moderado, fuerte a favor de la recomendación.
Una vez establecido el estado basal de nutrición (idealmente en la etapa prequirúrgica), debe actuarse en consecuencia, es decir, si se identifica desnutrición, depleción de proteínas o deficiencia de oligoelementos, se debe intentar restablecer el mejor estado posible antes del procedimiento. En el periodo postoperatorio, se asume que se ha establecido ya el estado de nutrición y se han implementado las estrategias necesarias para mejorar las deficiencias identificadas. Sin embargo, en la fase postoperatoria se debe reevaluar y reclasificar a los pacientes, ya que la cirugía se considera un factor agresor y una causa potencial de descompensación mayor de la enfermedad y, por ende, de la desnutrición. Existen factores asociados, entre ellos, algunos relacionados con la enfermedad, y otros relacionados con el manejo médico específico139.
Relacionados con la enfermedad. Algunos pacientes pueden desarrollar descompensaciones de la cirrosis, como EH, ascitis a tensión o hemorragia de tracto digestivo, que podrían impedir la adecuada alimentación. Otros factores pueden ser trastornos en la motilidad gastrointestinal, íleo posquirúrgico, íleo metabólico, etc. Los niveles de albúmina disminuyen ante episodios de trauma o cirugía e incluso pueden relacionarse con la gravedad. En esos escenarios, existe permeabilidad vascular y fuga de albúmina, con redistribución de la misma139. Los niveles de albúmina sérica están incluidos en el puntaje preoperatorio de VOCAL-Penn, por lo que se ha estudiado como un marcador pronóstico de descompensaciones y mortalidad, a niveles menores, mayor tasa de descompensación y riesgo de muerte postoperatoria44. A pesar de ello, no se ha demostrado beneficio de administrar albúmina intravenosa, y la suplementación con albúmina en la dieta se ha utilizado solamente como recomendación de expertos139.
Relacionados con el manejo médico específico. Usualmente, en una hospitalización por un evento quirúrgico se utilizan medicamentos que pueden provocar hiporexia, náuseas, malestar abdominal, entre otros, que pueden impedir la adecuada alimentación en el posquirúrgico. Es importante tomar en cuenta dichas alteraciones y manejarlas de forma oportuna. Además, dentro de la toma de decisiones, se debe especificar el momento en el que se reinicie la dieta, idealmente enteral, lo cual debe ocurrir en las primeras 12-24horas desde la cirugía. Esta decisión no debe retrasarse de forma injustificada. Ante el escenario en el que no sea posible reiniciar la dieta enteral, la nutrición parenteral es superior al ayuno y a la administración de líquidos y electrólitos intravenosos140.
24. TROMBOPROFILAXIS. A pesar del potencial estado de disfunción en la coagulación inherente a la cirrosis, la tromboprofilaxis debe considerarse y llevarse a cabo en pacientes de alto riesgo.
Totalmente de acuerdo 92.9%, parcialmente de acuerdo 7.1%.
Nivel de evidencia bajo, débil a favor de la recomendación.
La incidencia de trombosis venosa profunda (TVP) y tromboembolia pulmonar (TEP) en el paciente con cirrosis es del 0.5-7%64. El riesgo de desarrollar TVP o TEP es similar a pacientes sin cirrosis, pero confiere mayor mortalidad63.
Riesgo tromboembólico. El riesgo se evaluará mediante las escalas predictivas de Padua o IMPROVE; si bien la evidencia es baja en el escenario de pacientes con cirrosis hepática, la recomendación actual es evaluar el riesgo con cualquiera de estas dos escalas. No se recomienda la evaluación con pruebas de laboratorio (TP, INR, recuento plaquetario, niveles de fibrinógeno); en este caso las pruebas viscoelásticas tampoco han sido ampliamente validadas y, por tanto, no pueden recomendarse63,141.
Profilaxis mecánica. En pacientes de bajo riesgo se recomiendan medidas no farmacológicas de tromboprofilaxis. Los dispositivos mecánicos para la prevención del tromboembolismo venoso actúan sobre la estasis venosa e incluyen sistemas estáticos: las medias de compresión graduada (medias elásticas o medias anti-embolismo) y sistemas dinámicos: compresión neumática intermitente y bomba venosa de pie142.
Herramientas farmacológicas. En pacientes de alto riesgo se prefiere el uso de heparinas de bajo peso molecular sobre la heparina no fraccionada a dosis estándar. La enoxaparina cuenta con un perfil de seguridad razonable en pacientes con cirrosis Child-PughA, B yC, aunque la eficacia mostrada hasta el momento es poco clara. En casos de insuficiencia renal, el tratamiento de elección serán las heparinas de bajo peso molecular en lugar de las heparinas no fraccionadas. Los anticoagulantes de acción directa se consideran seguros para los pacientes con cirrosis Child-PughA yB; a pesar de tener un perfil de seguridad razonable, en estos pacientes la evidencia acerca de su eficacia aún es limitada. En pacientes con cirrosis Child-PughC no se recomiendan142.
25.ANALGESIA. La analgesia debe elegirse de acuerdo con el mejor perfil de seguridad de los fármacos.
Totalmente de acuerdo 100%.
Nivel de evidencia bajo, débil a favor de la recomendación.
La analgesia puede iniciarse con analgésicos no opioides/opioides de acuerdo con los valores referidos por el paciente tomando como referencia la Escala Visual Análoga. El uso de los AINE está contraindicado143.
AINE. Los AINE deberán ser evitados en pacientes con cirrosis, ya que hasta el momento no se cuenta con evidencia suficiente para definir el perfil de seguridad de estos en pacientes con cirrosis.
Paracetamol. El paracetamol no inhibe la acción de la ciclooxigenasa, por lo tanto, no tiene actividad antiinflamatoria144. Se ha determinado que su uso en pacientes con cirrosis hepática es seguro, siempre y cuando no se exceda la dosis de 2g/día145.
Opioides. El uso de opioides en estos pacientes es seguro; sin embargo, debe tomarse en cuenta que, debido a la cirrosis hepática, las vidas medias de estos fármacos pueden ser más prolongadas, lo cual incrementa el riesgo de EH. En estos pacientes debe preferirse el uso de formulaciones de liberación inmediata, evitando las liberaciones prolongadas; de igual forma, deben preferirse intervalos extendidos entre prescripciones, en lapsos de 6 a 12horas145,146.
Tramadol. El tramadol puede causar menor sedación y depresión respiratoria; sin embargo, se ha reportado menor tolerancia en comparación con otros opioides. La dosis inicial es de 50mg cada 12horas en intervalos prolongados, con especial cuidado en aquellos pacientes que consuman inhibidores de la recaptura de serotonina o antidepresivos tricíclicos, debido al potencial riesgo de desarrollar crisis convulsivas145.
Morfina. La morfina posee propiedades analgésicas con potenciales efectos neurotóxicos como confusión, convulsiones y depresión respiratoria, principalmente en escenarios de falla renal. La recomendación es iniciar con 5mg cada 6horas y evitar su uso en aquellos pacientes que presenten falla renal145.
Fentanilo. El fentanilo transdérmico, en casos de dolor prolongado, es la primera elección, ya que no produce metabolitos activos; sin embargo, puede acumularse en el tejido adiposo a nivel visceral, por varios días, para después ser depurado por el hígado145.
26. Recomendaciones sobre el reinicio de medicamentos utilizados para el control de la cirrosis.
Totalmente de acuerdo 92.9%, parcialmente de acuerdo 7.1%.
- a)
Se recomienda el inicio o reinicio temprano de los fármacos (lactulosa, rifaximina, L-ornitina/L-aspartato) para profilaxis de EH77.
- b)
No existe evidencia para la suspensión de los diuréticos en pacientes con tolerancia preoperatoria probada de estos fármacos. En ausencia de hipovolemia o daño renal, pueden utilizarse en el postoperatorio intrahospitalario77.
- c)
No existe evidencia para la suspensión de los beta-bloqueadores en el perioperatorio. Si se llegaran a suspender, su reinicio es adecuado, al garantizar la estabilidad hemodinámica en el postoperatorio intrahospitalario77.
- d)
El uso de albúmina intravenosa en el posquirúrgico no está indicado a menos que el paciente presente alguna descompensación que justifica su administración77.
27. Se recomienda hacer vigilancia del desarrollo de descompensaciones propias de la cirrosis: ascitis, hemorragia variceal, encefalopatía hepática y falla hepática aguda sobre crónica.
Totalmente de acuerdo 100%.
Nivel de evidencia moderado a bajo, fuerte a favor de la recomendación.
La mortalidad en los pacientes con cirrosis sometidos a un procedimiento quirúrgico es más elevada que en pacientes sin cirrosis, con un incremento del riesgo de descompensación en los 90 días posteriores al procedimiento quirúrgico. Por lo tanto, debe prestarse especial atención en los factores de descompensación más comunes, como ascitis, hemorragia y EH77.
- a)
Ascitis. Restricción de sodio en la dieta y reinicio de diuréticos en caso de haberse suspendido. Se recomienda la medición del peso diario para vigilancia de la ascitis y su respectivo ajuste con terapia diurética. Los drenajes quirúrgicos deberán removerse tan pronto como sea posible. Vigilar así mismo el desarrollo de PBE y establecer el manejo específico en caso necesario. En pacientes que presenten ascitis de difícil control posquirúrgica (ascitis intratable) la terapia con TIPS puede ser considerada una opción147.
- b)
Hemorragia variceal. El factor agregado más importante asociado a una cirugía y al manejo de volumen transoperatorio es el inevitable aumento en la presión portal. El manejo deberá establecerse de acuerdo con el consenso de BavenoVII26.
- c)
EH. Evitar el estreñimiento es crucial. La extubación, en caso de apoyo ventilatorio mecánico, deberá realizarse lo antes posible para evaluar el estado neurológico del paciente. La profilaxis de EH deberá reiniciarse en cuanto el paciente tolere la vía oral, con medidas antiamonio; lactulosa de primera línea si el paciente lo tolera, ya que se asocia frecuentemente con distensión, que podría resultar poco tolerable en el paciente postoperado de cirugía abdominal; considerar rifaximina o L-ornitina L-aspartarto pueden ser una opción como fármacos concomitantes83.
- d)
ACLF. La determinación de niveles de creatinina y uresis requiere seguimiento estrecho para la identificación temprana de daño renal. En presencia de descompensación hepática se deberá descartar, como primera posibilidad, la presencia de infección. Debe vigilarse el nivel sérico de bilirrubinas y el INR como indicadores tempranos más sensibles de falla hepática, y el desarrollo de ACLF deberá evaluarse mediante las escalas de puntuación correspondiente. Debe tenerse disponible una unidad de cuidados intensivos147.
La valoración y el cuidado del paciente con cirrosis que requiere un procedimiento quirúrgico o invasivo mayor deben estar a cargo de un equipo multidisciplinario que brinde soporte al cirujano durante todo el perioperatorio; este equipo debe incluir al anestesiólogo, al hepatólogo, al gastroenterólogo y al nutriólogo clínico. En el paciente descompensado, puede ser necesario involucrar especialistas en nefrología, ya que la función renal es un parámetro implicado también en el pronóstico de estos pacientes.
FinanciaciónEste consenso se realizó exclusivamente con el apoyo de la Asociación Mexicana de Gastroenterología A.C. y no se recibió ningún tipo de recurso económico externo. Los autores no recibieron honorario alguno por su participación.
Conflicto de interesesLos autores no tienen conflictos de intereses que declarar.