En México, las complicaciones de la cirrosis son la tercera causa de muerte en adultos de sexo masculino. En años recientes el carcinoma hepatocelular ha demostrado incremento en su incidencia global. El objetivo de este estudio fue determinar las características del carcinoma hepatocelular en dos hospitales mexicanos de tercer nivel.
Material y métodosEstudio observacional, transversal y retrospectivo, de enero de 2008 a abril de 2014; se describen las características clínicas y epidemiológicas, así como el diagnóstico y tratamiento, de 148 pacientes con carcinoma hepatocelular.
ResultadosEl carcinoma hepatocelular se presentó predominantemente en el sexo masculino y en la sexta década de la vida, asociado a enfermedad hepática en el 87% de los casos; la etiología más frecuente fue la cirrosis secundaria a alcohol, el virus de la hepatitis C y la esteatohepatitis no alcohólica. Al diagnóstico, el 60% estaban en Child-Pugh A, el 75.5% presentaron tumor único, y el 27.7% tuvieron la alfafetoproteína normal. El 39.9% de los pacientes con enfermedad hepática conocida se encontraban bajo un programa de vigilancia. El 64.3% de pacientes tuvieron tumores más grandes de 5cm al momento del diagnóstico, y las lesiones bien diferenciadas fueron las detectadas con mayor frecuencia. Más del 70% de los pacientes se diagnosticaron en una etapa no curativa. Al llegar al punto de corte en el 2014, el 77.7% de los pacientes ya habían fallecido. El tratamiento se determinó de acuerdo con la disponibilidad de cada centro y las guías internacionales se siguieron en el 45.3% de los casos, impactando en la supervivencia.
ConclusionesSe requiere mejorar el escrutinio para detectar la enfermedad en etapas tempranas; sin embargo, se debe adaptar el tratamiento dependiendo de la experiencia en cada centro.
In Mexico, complications of cirrhosis are the third leading cause of death in adult males. In recent decades, the incidence of hepatocellular carcinoma has increased worldwide. The aim of this study was to determine the characteristics of patients with hepatocellular carcinoma at two Mexican tertiary care hospitals.
Material and methodsAn observational, cross-sectional, retrospective study was conducted between January 2008 and April 2014. We described the clinical features, epidemiologic characteristics, diagnosis, and treatment of patients with hepatocellular carcinoma.
ResultsOne hundred and forty-eight patients were included. There was a predominance in males and disease manifestation in the sixth decade of life. Liver disease was associated in 87% of subjects and was mainly attributed to alcohol abuse, hepatitis C infection, and nonalcoholic steatohepatitis. Sixty percent (60%) of cases were classified as Child-Pugh stage A cirrhosis, 75.5% harbored a single tumor at diagnosis, 27.7% had normal alpha-fetoprotein values, and only 39.2% of patients with known liver disease were under a surveillance program. Tumors were larger than 5cm at diagnosis in 64.3% of patients, and well-differentiated lesions were most frequently detected. Over 70% of patients were diagnosed at a non-curative stage. By the 2014 study cutoff point, 77.7% of patients had died. Treatment was determined by the means available at each center and followed the therapeutic recommendations in international guidelines in 45.3% of cases, clearly impacting survival.
ConclusionsBetter surveillance methods are required to diagnose the disease at its early stages, but treatment still requires individual adaptation to each center's available resources.
En décadas recientes, la incidencia de carcinoma hepatocelular (CHC) ha incrementado progresivamente a nivel mundial y el factor de riesgo principal para su desarrollo es la presencia de cirrosis subyacente. Entre las patologías principales que causan cirrosis están la infección viral por hepatitis B y/o C y el alcoholismo, y la esteatohepatitis no alcohólica (EHNA) se considera ahora como una emergente e importante etiología de cirrosis y CHC1-3. Se han empleado varios algoritmos para la vigilancia y el tratamiento de cada enfermedad, y todos son respaldados plenamente por varias asociaciones internacionales4,5. En México, la actual información epidemiológica sobre el CHC y su relación con la enfermedad hepática subyacente es insuficiente, así como la falta de información sobre las características de tumores al momento del diagnóstico, del manejo, y de la supervivencia. El objetivo de este estudio fue caracterizar una cohorte de 148 pacientes a quienes se diagnosticó CHC en dos hospitales mexicanos de tercer nivel.
Materiales y métodosSe incluyeron en el estudio a los pacientes a quienes se diagnosticó CHC entre enero de 2008 y abril de 2014 en los siguientes dos hospitales mexicanos de tercer nivel: la Unidad Médica de Alta Especialidad n.o25, Instituto Mexicano del Seguro Social, Monterrey, Nuevo León (UMAE 25) (norte de México) y el Instituto de Seguridad Social del Estado de México y Municipios (ISSEMyM), Toluca, Estado de México (centro de México). El protocolo de estudio fue aprobado por el Comité de Investigación y Ética de la UMAE 25 IMSS y por el Comité de Ética del ISSEMyM.
La información epidemiológica documentada incluyó: la etiología de la enfermedad hepática subyacente, el estadio de la enfermedad hepática al momento del diagnóstico, y el estadio del CHC de acuerdo con el sistema de estadificación del Barcelona Clinic Liver Cancer (BCLC). Se siguió a los pacientes desde enero de 2008 hasta abril de 2014, el punto de corte del estudio. La vigilancia consistió en imágenes por ultrasonido del hígado obtenidas cada 6-12 meses. Se midieron los niveles de la alfafetoproteína (AFP) al momento del diagnóstico y se registró la supervivencia de cada grupo. El estudio fue observacional, transversal, y retrospectivo.
El análisis estadístico fue llevado a cabo empleando medidas de tendencia central a través de la media, mediana, desviación estándar, y porcentaje.
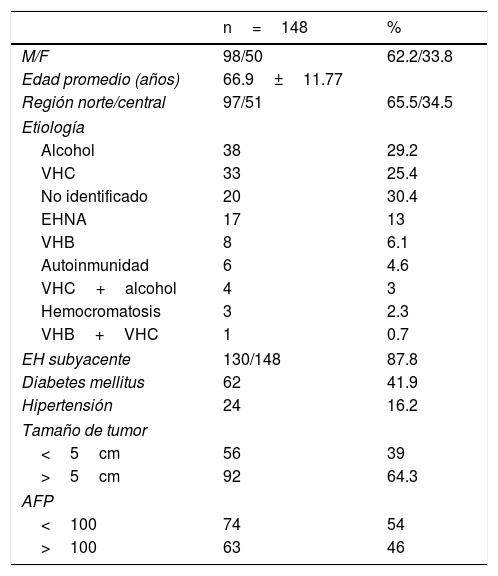
ResultadosInformación general. Se incluyeron a 148 pacientes: 98 (66.2%) eran hombres y 50 (33.8%) eran mujeres. La edad promedio fue de 63.9 años (DE: ±11.77; rango de 52-76 años). Noventa y siete pacientes (65.5%) eran del norte de México y 51 (34.5%) eran del centro de México. Las comorbilidades mayores incluyeron la diabetes mellitus tipo 2 en 62 (41.9%) casos e hipertensión en 24 pacientes (16.2%).
Enfermedad hepática. Fue posible documentar la enfermedad hepática crónica subyacente en 130 (87.8%) pacientes, y se muestran las etiologías en la tabla 1, en orden descendiente de frecuencia. Como era de esperarse, el alcoholismo y la infección crónica del virus de la hepatitis C (VHC) fueron las causas más frecuentes de enfermedad hepática. La categoría de «no identificado» se aplicó a los casos sin historial significativo de alcoholismo, marcadores negativos para la hepatitis viral, y sin estudios confirmando otros posibles factores etiológicos. La tercera causa identificada fue la EHNA. Cincuenta y uno (39.2%) de los 130 pacientes con enfermedad hepática subyacente fueron observados por medio de un programa de vigilancia y diagnosticados bajo esa estrategia. Los pacientes restantes fueron diagnosticados a partir de síntomas reportados y/o hallazgos clínicos asociados al tumor. Algunos de esos pacientes presentaron diagnósticos simultáneos de enfermedad hepática y CHC.
Información clínica y epidemiológica en pacientes mexicanos con CHC
| n=148 | % | |
|---|---|---|
| M/F | 98/50 | 62.2/33.8 |
| Edad promedio (años) | 66.9±11.77 | |
| Región norte/central | 97/51 | 65.5/34.5 |
| Etiología | ||
| Alcohol | 38 | 29.2 |
| VHC | 33 | 25.4 |
| No identificado | 20 | 30.4 |
| EHNA | 17 | 13 |
| VHB | 8 | 6.1 |
| Autoinmunidad | 6 | 4.6 |
| VHC+alcohol | 4 | 3 |
| Hemocromatosis | 3 | 2.3 |
| VHB+VHC | 1 | 0.7 |
| EH subyacente | 130/148 | 87.8 |
| Diabetes mellitus | 62 | 41.9 |
| Hipertensión | 24 | 16.2 |
| Tamaño de tumor | ||
| <5cm | 56 | 39 |
| >5cm | 92 | 64.3 |
| AFP | ||
| <100 | 74 | 54 |
| >100 | 63 | 46 |
AFP: alfafetoproteína; CHC: carcinoma hepatocelular; EH: enfermedad hepática; EHNA: esteatohepatitis no alcohólica; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
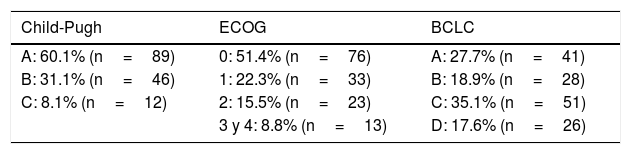
Al momento del diagnóstico, 89 (60.1%) fueron clasificados con enfermedad de estadio A según la clasificación Child-Pugh, 46 (31.1%) con estadio B, 12 (8.1%) con estadio C, y un caso no se clasificó (tabla 2).
Estadificación al momento del diagnóstico
| Child-Pugh | ECOG | BCLC |
|---|---|---|
| A: 60.1% (n=89) | 0: 51.4% (n=76) | A: 27.7% (n=41) |
| B: 31.1% (n=46) | 1: 22.3% (n=33) | B: 18.9% (n=28) |
| C: 8.1% (n=12) | 2: 15.5% (n=23) | C: 35.1% (n=51) |
| 3 y 4: 8.8% (n=13) | D: 17.6% (n=26) |
BCLC: clasificación Barcelona Clinic Liver Cancer; ECOG: Grupo Oncológico Cooperativo del Este.
Características de tumor. Al momento del diagnóstico, 108 (75.5%) casos presentaban un único tumor localizado, mientras que 39 (27.2%) pacientes albergaban lesiones múltiples o difusas. Al establecer el diagnóstico, los tumores en 56 (39%) pacientes eran menores de 5cm, y mayores de 5cm en 92 (64.3%) casos (*n=147, un valor faltante).
La AFP se determinó en 145 (97%) pacientes, con un nivel promedio de 8,271.5ng/ml (rango de 0.83 a 431,880ng/ml). El valor de la AFP al momento del diagnóstico fue normal en 41 (27.7%) pacientes y mayor de 20ng/ml en el 70.3% (n=104).
Se realizó una biopsia hepática en la mayoría de los pacientes para establecer un banco de tejidos para la investigación futura. A 94 pacientes se les practicó la biopsia hepática, y se estableció el grado de diferenciación histopatológica en 47 casos: el tumor era bien diferenciado en 25 (16.9%) casos, moderadamente diferenciado en 18 (12.2%) y pobremente diferenciado en 4 (2.7%) pacientes. No se documentó siembra tumoral en las biopsias. Tres pacientes presentaron CHC fibrolamelar con los siguientes rasgos clínicos destacados: a) un hombre de 46 años con cirrosis secundaria a la infección por hepatitis B y un tumor difuso que progresó y no fue tratado, debido a su estado avanzado; b) un hombre de 23 años sin enfermedad hepática concomitante y un tumor de 15cm que se extirpó quirúrgicamente, y c) una mujer de 23 años sin enfermedad hepática concomitante y un tumor de 6.8cm que se extirpó quirúrgicamente.
Treinta y cinco pacientes con enfermedad hepática subyacente, de los 51 bajo vigilancia (35/51) (68%), presentaban lesiones menores de 5cm de diámetro, mientras que 70 de todos los pacientes que no estaban bajo vigilancia (70/97) (72.1%) presentaban lesiones mayores de 5cm. El diámetro promedio de los tumores diagnosticados en el monitoreo fue de 4.5cm, mientras que el de los demás fue de 8.8cm. La estadificación BCLC al momento del diagnóstico fue la siguiente, A: 41 (27.7%) casos; B: 28 (18.9%) casos; C: 51 (35.1%) casos; y D: 26 (17.6%) casos. El estatus de desempeño se determinó según el Grupo Oncológico Cooperativo del Este (ECOG, por sus siglas en inglés) y se distribuyó de la siguiente manera, 0: 76 (51.4%); 1: 33 (22.3%); 2: 23 (15.5%); 3: 10 (6.8%); y 4: 3 (2%) (tabla 2). De acuerdo con la estadificación BCLC, un total de 48 pacientes bajo vigilancia se encontraban en los siguientes estadios, A: 20; B: 15; C: 8; y D: 5. Un total de 95 pacientes que no estaban bajo observación se clasificaron en los estadios A: 20; B: 12; C: 42; y D: 21 (la clasificación de la BCLC/vigilancia no estuvo disponible en 5 pacientes).
Se realizó tratamiento quirúrgico en 22 pacientes e incluyó 19 resecciones y 3 trasplantes de hígado. Se llevó a cabo tratamiento locorregional en 30 casos, con 14 ablaciones por radiofrecuencia (ARF), 10 quimioembolizaciones transarteriales (TACE), manejo combinado con ARF/TACE en 3 casos, y 3 crioablaciones. Sesenta y cuatro pacientes recibieron terapia sistémica: 55 casos fueron tratados con sorafenib y 9 pacientes recibieron otras quimioterapias sistémicas. De acuerdo con la clasificación BCLC, 77 (45.3%) pacientes recibieron el tratamiento recomendado, mientras que el 54.7% recibieron una opción de tratamiento diferente. La tabla 3 muestra el protocolo de tratamiento administrado de acuerdo con el estadio BCLC.
Tipos de tratamiento y supervivencia
| BCLC | Tipo de tratamiento | Supervivencia |
|---|---|---|
| A (n=41) | TH (3), RQ (23), ARF (6) sorafenib (9) | 16.5 meses |
| B (n=28) | RQ (2), TACE (3), ARF (7), sorafenib (16) | 13.4 meses |
| C (n=51) | RQ (2), ARF (1), sorafenib (26), QT sistémica (6), tratamiento combinado (2), QT (5), ninguno (9) | 8.9 meses |
| D (n=26) | Ninguno | 4.5 meses |
ARF: ablación por radiofrecuencia; BCLC: clasificación Barcelona Clinic Liver Cancer; QT: quimioterapia; RQ: resección quirúrgica; TACE: quimioembolización transarterial; TH: trasplante de hígado.
Los pacientes cuya enfermedad evolucionó, independientemente de su estado inicial, pudieron recibir más de una modalidad de tratamiento después de la reestadificación, si los tratamientos se encontraban disponibles. Al punto de corte en abril de 2014, 115 (77.7%) pacientes habían muerto y 33 (22.3%) seguían vivos. Las causas de muerte en orden descendente de frecuencia fueron: evolución de la enfermedad en 68 (45.9%) casos, sepsis en 6 (4.1%), y hemoperitoneo en 2 (1.4%) casos. Veintiocho (18.9%) pacientes se perdieron para el seguimiento. El 70% de los pacientes con enfermedad en estadio A según la clasificación Child-Pugh, el 84% de los pacientes en estadio B, y el 100% de los pacientes en estadio C murieron.
La mortalidad, de acuerdo con la estadificación BCLC, fue A: 25/41 (60.9%); B: 17/28 (60.7%); C: 47/51 (92.1%); y D: 26/26 (100%). El análisis de la diferenciación histológica del tumor y las tasas de mortalidad asociadas fueron: 64% (16/25) de los pacientes en el grupo bien diferenciado, 94.4% (17/18) en el grupo moderadamente diferenciado, y 100% (4/4) en el grupo pobremente diferenciado. Al punto de corte, el promedio de supervivencia en meses de acuerdo con la estadificación BCLC e independientemente del tratamiento recibido fue A: 16.5 meses; B: 13.4 meses; C: 8.9 meses; y D: 4.5 meses (tabla 3).
Discusión y conclusionesEn la presente serie de 148 casos de CHC en México, predominó el sexo masculino, lo cual coincide con la literatura médica internacional, pero difiere del Consenso mexicano sobre CHC publicado recientemente. Aquel análisis, abarcando los años 1965 a 2013, incluyó a 372 pacientes y sugiere que existe una prevalencia similar entre ambos sexos6. La tendencia para la aparición del CHC alrededor de la sexta década de vida continúa, y el factor de riesgo principal para su desarrollo es la enfermedad hepática subyacente, presente en el 87% de los casos. Los factores etiológicos primarios en nuestra cohorte fueron el VHC y el alcoholismo, coincidiendo con las causas primarias de cirrosis reportadas en México7. Ante las nuevas tendencias epidemiológicas, la enfermedad de hígado graso no alcohólico (EHGNA) se ha identificado como una tercera causa. De hecho, su prevalencia es sorprendente y coexiste frecuentemente con la diabetes mellitus y la hipertensión, a tasas similares a aquellas descritas en adultos en la Encuesta Nacional de Salud y Nutrición 20128.
El 25% de tumores en el presente análisis se detectaron inicialmente como lesiones múltiples o difusas y los niveles de AFP fueron normales en el 27.7% de casos al momento del diagnóstico, tal y como lo describieron Arrieta et al.9. En nuestro estudio, 44 pacientes cumplieron los criterios de Milán al ser diagnosticados, pero solo 3 pacientes tuvieron trasplante, todos en Monterrey, México. Los pacientes restantes no recibieron trasplante ya que el procedimiento no podía realizarse como lo recomienda las directrices de ambos hospitales, debido a la falta de recursos.
La tasa de mortalidad mayor en nuestros pacientes, a pesar de la anterior estadificación BCLC, y en comparación con otras series de casos, podría ser un reflejo de la escasa disponibilidad de modalidades de tratamiento (es decir, trasplante) en los dos hospitales involucrados, así como de causas secundarias, como úlcera péptica perforada, neumonía, sepsis, y sangrado del tracto gastrointestinal superior. Además, el punto de corte de nuestro estudio fue en el 2014, impidiendo una perspectiva completa y adecuada de la mortalidad.
El grado de diferenciación tumoral se ha descrito como un factor pronóstico independiente. Tamura et al. analizaron el impacto de la diferenciación sobre la supervivencia postrasplante en pacientes10. Nuestro análisis de población demostró que la vigilancia fomenta el diagnóstico de tumores más pequeños e incrementa su potencial de resolución. Sin embargo, la vigilancia activa se llevó a cabo únicamente en el 39.2% de los pacientes, un problema ya mencionado por varios autores. Davila et al. realizaron una revisión retrospectiva de 1,873 pacientes a quienes se diagnosticó CHC en los Estados Unidos y encontraron que se realizó un diagnóstico formal mediante vigilancia en solo el 17% de los casos11. Idealmente, la detección temprana debe favorecer la terapia curativa y por tanto mejorar la supervivencia, como se ha mostrado previamente.
Existen limitaciones claras en nuestro estudio, en particular la falta de disponibilidad de los recursos recomendados al intentar seguir de manera estricta las directrices internacionales actuales. Además, el uso de las modalidades alternas en nuestros hospitales podría ciertamente prolongar el seguimiento de nuestra cohorte. Varios pacientes se presentaron con síntomas llevando a diagnósticos simultáneos de CHC y cirrosis. Esto podría ser una falla en el sistema de detección temprana de pacientes en riesgo y/o una falta de conocimiento de las recomendaciones de vigilancia para aquella población. En nuestro grupo, más del 70% de pacientes fueron diagnosticados en etapas no curativas, es decir, en estadios B, C, y D, según el BCLC.
El tratamiento proporcionado se basó en los recursos disponibles en cada hospital. Los abordajes quirúrgicos de trasplante y resección se realizaron en el hospital en el norte de México, en una cantidad limitada de pacientes. Se llevaron a cabo ARF, TACE, y la administración de sorafenib en el hospital en el centro de México.
La adherencia a las recomendaciones de tratamiento del BCLC tenía que adaptarse de acuerdo con la disponibilidad. Esta realidad es común, como lo documentó el grupo de estudio BRIDGE12. Incluyeron a más de 5,000 pacientes en estadio C de la clasificación BCLC (después de la aprobación de sorafenib) de 19 países en un estudio longitudinal realizado en una cohorte multirregional y reportaron que menos del 1% de la población recibió tratamiento de acuerdo con las recomendaciones de las guías internacionales. Como en nuestra cohorte, el uso de terapias alternas fue frecuente. Sorprendentemente, la supervivencia global de la cohorte BRIDGE fue de 23 meses, una clara disociación de la supervivencia esperada en pacientes con el estadio C. Sin embargo, esta estrategia no es novedad, dado que un grupo de expertos ha sugerido que los estadios intermedios y avanzados deben ser «subclasificados» para individualizar la terapia y consecuentemente mejorar la supervivencia13,14. Por lo tanto, una cantidad exponencial de información y protocolos nuevos se están publicando, evaluando la terapia combinada en aquellos estadios. Incluyen la administración de sorafenib posresección15, TACE y ARF16,17, TACE y sorafenib18,19, y ARF más sorafenib20, entre otros.
En nuestro grupo de pacientes con CHC, el sexo masculino predominó y la edad fue similar a la reportada previamente en la literatura médica internacional. La frecuencia de enfermedad hepática subyacente fue alta y las etiologías fueron similares a aquellas reportadas en estudios mexicanos previos sobre la cirrosis. El diagnóstico sigue realizándose en etapas avanzadas de la enfermedad, en las cuales la terapia curativa ya no es una opción. Nuestra disponibilidad limitada de estrategias de tratamiento, como el trasplante y la resección, claramente afectan la supervivencia. Es por esto que el uso de estrategias de tratamiento combinado, de acuerdo con su disponibilidad en cada hospital, es crucial.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo/estudio.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.