La enfermedad de Crohn (EC) es un subtipo de la enfermedad inflamatoria intestinal (EII) crónica e incurable que puede afectar a todo el tracto gastrointestinal y cuya etiología es desconocida.
ObjetivoEstablecer los aspectos más relevantes relacionados a las definiciones, diagnóstico, seguimiento, tratamiento médico y quirúrgico de la EC en nuestro país.
Material y métodosSe invitaron a especialistas de la República Mexicana de las áreas de gastroenterología y EII. Se dividió el consenso en cinco módulos, con 69 enunciados. Se aplicó el método de panel Delphi, para ello se envió las preguntas previó a la reunión a todos los participantes para que fueran editadas y ponderadas. Durante la reunión presencial se mostraron los artículos seleccionados al nivel de evidencia clínica y se llevó a cabo la discusión y votación final del grado de acuerdo en todos los enunciados.
ResultadosEs el primer consenso mexicano de la EC en donde se establecen las recomendaciones para las definiciones, clasificaciones, aspectos diagnósticos, seguimiento, tratamiento médico y quirúrgico.
ConclusionesSe dan recomendaciones actualizadas enfocadas a las definiciones, clasificaciones, los criterios diagnósticos, seguimiento y pautas del tratamiento médico convencional, biológico y moléculas pequeñas, así como el manejo quirúrgico.
Crohn's disease (CD) is a subtype of chronic and incurable inflammatory bowel disease. It can affect the entire gastrointestinal tract and its etiology is unknown.
ObjectiveThe aim of this consensus was to establish the most relevant aspects related to definitions, diagnosis, follow-up, medical treatment, and surgical treatment of Crohn's disease in Mexico.
Material and methodsMexican specialists in the areas of gastroenterology and inflammatory bowel disease were summoned. The consensus was divided into five modules, with 69 statements. Applying the Delphi panel method, the pre-meeting questions were sent to the participants, to be edited and weighted. At the face-to-face meeting, all the selected articles were shown, underlining their level of clinical evidence; all the statements were discussed, and a final vote was carried out, determining the percentage of agreement for each statement.
ResultsThe first Mexican consensus on Crohn's disease was produced, in which recommendations for definitions, classifications, diagnostic aspects, follow-up, medical treatment, and surgical treatment were established.
ConclusionsUpdated recommendations are provided that focus on definitions, classifications, diagnostic criteria, follow-up, and guidelines for conventional medical treatment, biologic therapy, and small molecule treatment, as well as surgical management.
La enfermedad de Crohn (EC) es un subtipo de la enfermedad inflamatoria intestinal (EII) crónica e incurable que puede afectar a todo el tracto gastrointestinal desde la boca a la región anal que se caracteriza por remisiones y exacerbaciones de la misma, cuya etiología se desconoce1.
El estudio EPIMEX que incluyó pacientes de todos los estados del país en donde se demostró un incremento de la incidencia y prevalencia de cuatro veces más en un periodo de 15 años del 2000 al 20152. Esta enfermedad se caracteriza por diarrea crónica de tipo inflamatorio con la presencia de moco y sangre microscópica, así como dolor abdominal, fiebre y pérdida de peso.
El diagnóstico se establece con la correlación de hallazgos clínicos, bioquímicos, endoscópicos, radiológicos y/o histopatológicos3. Después del diagnóstico, la enfermedad debe de ser clasificada de acuerdo con la clasificación de Montreal la cual incluye edad al diagnóstico, localización y fenotipo: (A1) menor de 16 años, (A2) entre 17 y 40 años y (A3) mayor de 40 años. La localización puede ser ubicada en el íleon terminal (L1), en colon (L2), íleo colónica (L3) y tracto gastrointestinal superior (L4). De acuerdo con su fenotipo pueden ser clasificados como: inflamatorio (B1), estenosante (B2) o fistulizante (B3)4. De acuerdo con el estudio EPIMEX2, se encontró que la localización más frecuente fue la ileocolónica en el 50% seguida de la colónica en el 25%, ileal en el 23% y la localización de tubo digestivo alto fue del 3%.
La elección del medicamento ideal para un paciente está dirigida dependiendo del fenotipo de la enfermedad, grado de actividad y comorbilidades, es importante evaluar los efectos secundarios del medicamento y las complicaciones a largo plazo. El principal objetivo del tratamiento es lograr la remisión clínica, disminuir las recaídas, menores tasas de complicaciones y lograr la cicatrización de la mucosa (CM), la cual se asocia con una disminución de recaídas, hospitalización y cirugías. Existen dos estrategias de tratamiento de la EC ya sea el protocolo ascendente en donde se inicia con terapia convencional principalmente esteroides e inmunomoduladores en aquellos pacientes sin factores de mal pronóstico. Por otro lado, en aquellos pacientes con factores de mal pronóstico la edad al diagnóstico menor de 40 años, fenotipo estenosante y fistulizante, enfermedad perianal, afectación de tubo digestivo alto y enfermedad extensa del intestino en donde tendremos que utilizar la estrategia descendente con el inicio de terapia biológica y al final el uso de esteroides3.
A continuación, se enlistan algunas definiciones de las características de la EC como son:
Grado de actividad: Crohn's Disease Activity Index (CDAI)
- i.
Leve: 150-220 puntos
- ii.
Moderada: 220-450 puntos
- iii.
Grave: >450 puntos
Remisión: clínicamente con CDAI <150.
Respuesta a tratamiento: disminución >100 puntos CDAI.
Recaída: exacerbación de síntomas en un paciente con EC que había estado en remisión clínica ya sea de manera espontánea o después de tratamiento médico y de acuerdo con el CDAI con incremento de 70 puntos.
Recaída temprana: exacerbación de síntomas en un paciente con EC en remisión de duración menor a tres meses bajo tratamiento médico.
Patrón de recaída: infrecuente: ≤ 1 vez año; frecuente: ≥ 2 veces por año y continuo: sintomatología persistente de EC activa sin periodo de remisión.
Enfermedad refractaria a esteroides: pacientes con actividad de la enfermedad a pesar de la administración de hasta 0.75mg/kg/día por un periodo de cuatro semanas.
Enfermedad esteroide dependiente: pacientes que son incapaces de reducir los esteroides por debajo del equivalente de 10mg/día de prednisolona (budesonida por debajo de 3mg/día) dentro de los primeros tres meses de haber recibido esteroides, sin enfermedad activa recurrente o aquellos con recaída en los primeros tres meses después de haber interrumpido el uso de los esteroides. Requiere que la duración total de esteroides no exceda los tres meses antes de que se alcance el límite de prednisolona de 10mg/día o equivalente.
Recurrencia: reaparición de lesiones después de haberse sometido a una resección quirúrgica.
Recurrencia clínica: reaparición de síntomas después de la resección macroscópica de la enfermedad una vez que se ha confirmado la recurrencia de lesiones.
Recurrencia endoscópica: criterios de Rutgeerts:
- -
i0: sin lesiones evidentes
- -
i1: menos de cinco lesiones aftosas
- -
i2: más de cinco lesiones con mucosa normal entre las lesiones
- -
i3: ileítis aftosa difusa con mucosa inflamada
- -
i4: inflamación ileal con nódulos, úlceras, estrechamientos
Enfermedad localizada: afección intestinal de la EC cuya extensión no pasa los 30cm.
Enfermedad extensa: afección intestinal de la EC cuya extensión pasa los 100cm independientemente de su localización. Incluye la sumatoria de zonas inflamadas alternantes.
Paciente nuevo o primeravez: paciente con EC que se presenta con actividad al momento del diagnóstico o poco después de ésta sin tratamiento previo para EC.
Establecer los aspectos más relevantes relacionados a las definiciones, diagnóstico, seguimiento, tratamiento médico y quirúrgico de la EC en nuestro país.
MetodologíaLos panelistas fueron invitados de acuerdo con su trayectoria y experiencia en la atención de la EC en las áreas de gastroenterología y alta especialidad en EII de toda la República Mexicana. Para la organización de este primer consenso mexicano de la EC, el coordinador general Dr. Yamamoto lo dividió en cinco módulos que a su vez fueron distribuidos tal como se menciona a continuación:
Módulo 1. Definiciones, epidemiología, clasificaciones e índices. Coordinador: Dr. López
Módulo 2. Diagnóstico (aspectos clínicos, bioquímicos, endoscópicos, radiológicos e histopatológicos) Coordinador: Dr. Bosques
Módulo 3. Monitoreo y seguimiento de la enfermedad con las herramientas establecidas incluyendo treat to target, así como la medición de niveles y anticuerpos en contra de la terapia biológica. Coordinador: Dr. Martínez.
Módulo 4. Tratamiento convencional y biológico. Coordinador: Dr. Yamamoto.
Módulo 5. Tratamiento quirúrgico incluyendo la enfermedad perianal. Coordinador: Dr. de León.
Es importante mencionar que el resto de expertos emitieron su voto y sugerencias para cada uno de los enunciados basados en la evidencia científica disponible.
Se llevó a cabo una búsqueda sistemática de la literatura en inglés y español para cada oración generada por los coordinadores utilizando Medline/PubMed, Cochrane Database, EMBASE (Ovid) y LILACS. La estrategia de búsqueda incluyó los siguientes términos MeSH: enfermedad de Crohn, definiciones, epidemiología, diagnóstico, calprotectina fecal, cicatrización mucosa, colonoscopia, enteroresonancia magnética, 5-aminosalicilatos, tiopurinas, inmunomoduladores, terapia biológica, anti-TNF alfa, infliximab, adalimumab, certolizumab pegol, vedolizumab, ustekinumab, risankizumab, inhibidores JAK, upadacitinib, tratamiento quirúrgico, resección intestinal, recurrencia posquirúrgica y estricturoplastía. Se incluyeron todos los ensayos clínicos aleatorizados, metaanálisis, revisiones sistemáticas, estudios de cohorte y estudios de casos y controles publicados en los últimos 25 años (1998-2023).
El grupo del primer consenso mexicano en la EC incluyó 16 participantes (gastroenterólogos y especialistas en EII). Los coordinadores de cada módulo, tal como se mencionó anteriormente, se encargaron de desarrollar los enunciados iniciales y documentar la evidencia científica. Se utilizó una plataforma en línea (Survey Monkey) para encuestar a los participantes y realizar modificaciones a las oraciones. Es importante mencionar que los patrocinadores solamente apoyaron con los viáticos de los participantes del consenso sin intervenir en el contenido y desarrollo de las preguntas, además de que nadie recibió honorarios. A través de la plataforma electrónica, se realizó una votación previa por método Delphi para observar el nivel de acuerdo previo de las oraciones y se realizaron comentarios sobre referencias específicas o modificaciones sugeridas para los enunciados. Los enunciados fueron votados y se realizaron las modificaciones finales.
La reunión final del consenso se llevó a cabo de manera presencial en la ciudad de Monterrey donde los 69 enunciados finales se aceptaron cuando >75% de los participantes votaban 4 o 5, en una escala de 1 a 5.
Las recomendaciones se basan en el nivel de la evidencia disponible, de acuerdo con la clasificación Grading of Recommendations Assessment, Development and Evaluation (GRADE): grado A, evidencia de nivel 1 que corresponde a ensayos clínicos aleatorizados; grado B, que corresponde a nivel 2 o 3 de evidencia que son estudios de cohorte o de casos y controles; grado C, recomendaciones basadas en estudios con nivel 4 de evidencia, es decir series de caso o estudios de cohorte de pobre calidad y grado D, que son recomendaciones basadas en evidencia de nivel 5, que corresponde a opinión de expertos como se ilustra en la tabla 15. La calidad de la evidencia para cada recomendación se clasificó como alta, moderada, baja o muy baja. El grado de cada recomendación se asignó como fuertes (se recomienda…) o débiles (se sugiere…). La fuerza de recomendación se compone de cuatro aspectos: balance riesgo/beneficio, preferencias y valores del paciente, disponibilidad de recursos y calidad de la evidencia. Se redactó el manuscrito final por los coordinadores de cada módulo y fue aprobado por todos los autores.
Clasificación de la calidad de la evidencia y la fuerza de las recomendaciones5
| Calidad de la evidencia |
| Alta A |
| Moderada B |
| Baja C |
| Muy baja D |
| Fuerza de la recomendación |
| Fuerte a favor de la intervención 1 |
| Débil a favor de la intervención 2 |
| Débil en contra de la intervención 2 |
| Fuerte en contra de la intervención 1 |
1. La EC es una EII crónica, incurable y de curso clínico impredecible la cual se caracteriza por afectar desde la boca al ano de manera discontinua y transmural. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
La EC es una enfermedad inflamatoria crónica inmunomediada que puede afectar a cualquier parte del tubo digestivo, de localización más frecuente en íleon terminal y colon proximal6. Los síntomas de presentación suelen ser heterogéneos e insidiosos. La presentación clínica depende de la ubicación de la enfermedad, la gravedad de la inflamación y el comportamiento de la enfermedad. El escenario clínico más común es un paciente joven que presenta dolor abdominal en el cuadrante inferior derecho, alteración de hábitos intestinales y pérdida de peso. En pacientes con afectación del colon, el sangrado rectal o la diarrea sanguinolenta pueden ser los principales síntomas7.
El proceso inflamatorio es segmentario y transmural, así como progresivo que conduce a daño intestinal y discapacidad. La mayoría de los pacientes presentan un fenotipo inflamatorio en el momento del diagnóstico, pero con el tiempo se desarrollarán complicaciones como estenosis, fístulas y abscesos en la mitad de los pacientes, lo que a menudo resulta en cirugía6–8.
2. La EC temprana es aquella que se diagnostica en los primeros 18 meses de haber iniciado los síntomas sin exposición previa a inmunomoduladores y/o tratamiento con biológicos. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
Las evidencias basadas en la historia natural de la EC y los estudios clínicos sugieren la conveniencia de usar fármacos modificadores de la EC en un periodo de la enfermedad, para que tal intervención pueda mejorar el pronóstico9.
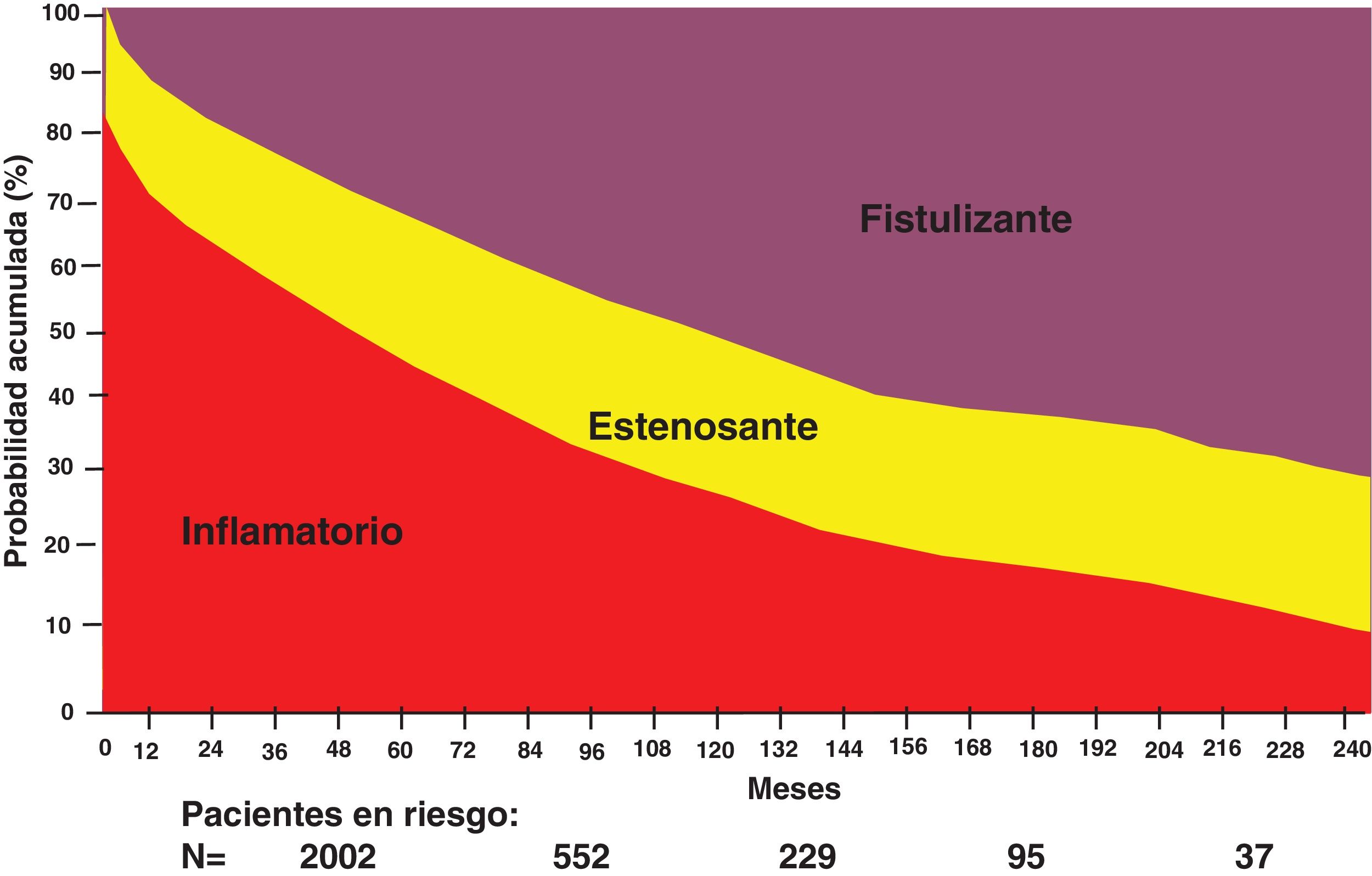
Una proporción de pacientes presentan progresión de la enfermedad. Louis et al. reportaron que, entre 125 pacientes seguidos por al menos 10 años, el 77% tenía enfermedad con patrón inflamatorio (no complicada con estenosis o fístulas) al tiempo del diagnóstico, mientras que el 11% presentaban estenosis y el 16% fístulas. A 10 años de seguimiento, el 46% había cambiado el comportamiento, de modo que las proporciones para los patrones inflamatorio, estenosante y fistulizante fueron 30.6%, 32.6% y 37.6%, respectivamente, observándose un cambio de progresión de inflamatorio a estenosante en el 27.1% y a fistulizante en el 29.4% de los pacientes (p <0.0001, en ambos casos)10.
Las estenosis, fístulas y abscesos son las principales indicaciones de cirugía en la EC, y los estudios de cohorte poblacionales describen un riesgo acumulado de la cirugía entre el 40% y el 71% en el plazo de 10 años después del diagnóstico. Así, el requerimiento quirúrgico en un tiempo medio de 13.2 años en Omstem County entre 1940-2001 (n=314) fue del 58%, la mitad con dos resecciones. Munkholm et al. reportaron en un estudio danés en el que de 373 pacientes un 70% fueron sometidos a cirugía en 15 años. En la misma, cabe señalar que más de un tercio de los casos (36%) requirieron dos o más cirugías, incluyendo un 22% de los pacientes que fueron sometidos a tres o más operaciones8. En el estudio EPIMEX2 se encontró que la frecuencia de tratamiento quirúrgico en pacientes mexicanos con EC fue del 19%.
Se ha observado incremento en el riesgo de resección intestinal a lo largo de la evolución de pacientes con EC el cual aumenta desde un 25% al diagnóstico hasta un 80% en un periodo de 20 años8, así como la progresión de patrón fistulizante hasta un 45% como se ilustra en la figura 1.
Se han propuesto diferentes definiciones de EC temprana, a fin de ser usadas en los ensayos clínicos de fármacos modificadores de la enfermedad. Un consenso de expertos en la reunión internacional de EII en París, estableció la actual definición de EC temprana, como una enfermedad ≤ 18 meses de duración y sin previo uso de agentes modificadores de la enfermedad, los cuales comprenden inmunomoduladores y/o biológicos, lo cual se refiere a una EC temprana11.
3. La etiopatogenia de la EC es desconocida, pero se considera de origen multifactorial en donde intervienen factores ambientales, genéticos e inmunológicos en su desarrollo. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
La etiopatogenia de la EC es desconocida, pero podría ser entendida como una relación multidireccional entre factores genéticos, respuestas inmunes -tanto innatas como adaptativas-, factores microbianos y otros ambientales12.
La EC resulta de muchos factores que finalmente influencian a un huésped genéticamente susceptible. En estudios en gemelos monocigotos se ha observado una concordancia del 40 a 50% en EC. De esto se derivan dos observaciones: los factores ambientales siguen siendo determinantes en la patogenia de la EC, pero, por otro lado, los factores genéticos tienen un papel importante en el inicio de la enfermedad13.
Los estudios de asociación del genoma han demostrado la presencia de polimorfismos genéticos en distintas moléculas y genes relacionados con el desarrollo, susceptibilidad y evolución de la EC. Las mutaciones en los genes nucleotide oligomerization domain 2, (NOD2), situados en el cromosoma 16, el gen DLG5 del cromosoma 10 y el gen IBD5 del cromosoma 5, predisponen al desarrollo de la enfermedad y determinan algunas de las características fenotípicas como localización ileal, edad de comienzo más precoz y comportamiento fibroestenosante14.
4. Las mutaciones en el gen NOD2/CARD15 se asocia con incremento en el riesgo para desarrollar EC, así como la localización ileal, edad menor de 40 años al diagnóstico, resección intestinal, fenotipos estenosante y fistulizante. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
El año 2001 se describió la primera región de asociación genética de la EC, localizada en el cromosoma 16. En este cromosoma se encuentra el gen NOD2 con tres polimorfismos posibles15. Las alteraciones del gen NOD2/CARD15 se asocian con alteraciones de los receptores toll-like, relacionados con el sistema inmune innato, cuya función es iniciar la activación del factor nuclear kappa B, que tiene que ver con la inhibición de la apoptosis de las células del sistema inmunológico. Por lo que hay una gran cantidad de receptores y estímulos ambientales que, en pacientes que tienen un componente genético, actúan como factores de riesgo permitiendo el desarrollo de la enfermedad16.
La edad de diagnóstico temprano es un factor de riesgo asociado con complicaciones y disminución en la calidad de vida en la EC. En este sentido, se ha encontrado que el polimorfismo del gen NOD2 rs2076756 está asociado con una de edad al diagnóstico menor de 25 años en estos pacientes17. El polimorfismo del gen NOD2 3020insC se asoció con la necesidad de múltiples cirugías y con un menor intervalo entre el diagnóstico y la cirugía18.
La contribución del riesgo genético en la patogenia de las manifestaciones extraintestinales (MEI) se ilustra mediante una superposición significativa entre los loci de riesgo genético para MEI y EII. La primera variante de riesgo identificada en pacientes con EC, NOD2/CARD15, también se ha asociado con sacroilitis y uveítis19.
5. El tabaquismo es el factor de riesgo ambiental modificable más importante en la EC ya que se ha asociado con la aparición de fístulas, mayor riesgo de recaídas, refractariedad al tratamiento, así como el aumento en el número de resección intestinal y mayor riesgo de recurrencia posquirúrgica. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
El tabaquismo incrementa el riesgo de desarrollar EC y agrava el curso de la enfermedad en comparación con los no fumadores14. Los fumadores tienen un riesgo aumentado de desarrollar EC, cercana al doble que los no fumadores. Los metaanálisis de Calkins y Logan demostraron para la EC un riesgo relativo (RR) de 2.0 (intervalo de confianza [IC] 95%: 1.7-2.5) y 2.4 (IC 95%: 2.0-2.9). El riesgo para EC en relación con el tabaquismo se reportó mayor en las mujeres (razón de momios [RM]=4.1; IC 95%: 2.0-4.2) que en hombres (RM=1.5; IC 95%: 0.8-6.0)20.
Parte del proceso patogénico está vinculado a alteraciones en la microcirculación de la mucosa intestinal, así también el tabaquismo puede afectar vías de la inmunidad innata. En un estudio, se demostró un aumento en la autofagia de los enterocitos como respuesta a un daño oxidativo asociada al tabaco21.
El tabaquismo aumenta el riesgo de aparición de fistulas; así como el riesgo de por lo menos una cirugía en algún momento en el curso de la enfermedad22.
En un estudio prospectivo los fumadores tuvieron más años de enfermedad en actividad, independientemente de la cantidad de cigarrillos fumados y del tratamiento. Kane et al., evaluaron 59 pacientes sometidos a cirugía por la enfermedad y encontraron que fumar tabaco incrementaba el riesgo de recurrencia clínica al doble (50% vs. 25%; p=0.02) y además ocurría más tempranamente (130 vs. 234 semanas; p <0.001)23.
6. Existe un incremento de la incidencia y prevalencia de la EC, así como del número de hospitalizaciones en nuestro país. Porcentaje de acuerdo: 100%.Calidad de la evidencia: B. Débil a favor de la intervención: 2.
Los estudios epidemiológicos de EII en América Latina son heterogéneos. Una revisión sistemática de 25 estudios publicados entre 2002 y 2015 reportó una incidencia para EC de 0.24 a 3.50 y una prevalencia de 0.24 a 14.90 por 100,000 habitantes24.
En México, un estudio publicado por Yamamoto et al., encontró en 2015 una prevalencia de EC que va del 8.1 al 8.4, el número total de casos atendidos (prevalencia de casos atendidos) de EC en mujeres fue de 5,009 (8.1) y en hombres fue de 4,944 (8.4). Los casos hospitalizados de EC en dicho año fueron de 1,097. Los pacientes ≥ 50 años representaron el 43.7% del total. Las defunciones en EC fueron (tasa de muertes específicas): mujeres 32 (0.52) y hombres 36 (0.50), representando un incremento de 2.44 veces en la tasa de mortalidad de EC en un periodo de 10-25 años25.
7. La clasificación de Montreal es utilizada para evaluar las características fenotípicas clave de los pacientes con EC tales como edad al diagnóstico, localización y fenotipo de la enfermedad con el fin de registrar el cambio en la ubicación y el comportamiento de la enfermedad a lo largo del tiempo, y considerando la presencia del fracaso del crecimiento en la población pediátrica con EII, se desarrolló la clasificación de París como una modificación de la de Montreal. Porcentaje de acuerdo: 100%. Calidad de la evidencia: D. Débil a favor de la intervención: 2.
La clasificación de Montreal es utilizada ampliamente para clasificar las características fenotípicas clave de los pacientes con EC, la cual categoriza la enfermedad en fenotipos según: 1) edad de diagnóstico: A1 (menor de 16 años), A2 (17-40 años) y A3 (mayor de 40 años), 2) localización de las lesiones: L1 (íleon), L2 (colon), L3 (íleon+colon), y L4 (tracto gastrointestinal superior) y 3) comportamiento: B1 (inflamatorio o no fistulizante/no estenosante), B2 (estenosante) y B3 (fistulizante)4.
Las modificaciones importantes desarrolladas en la clasificación de París incluyeron clasificar la edad en el momento del diagnóstico como A1a (0 a <10 años), A1b (10 a <17 años), A2 (17 a 40 años) y A3 (> 40 años), distinguiendo la enfermedad por encima del íleon distal como L4a (proximal al ligamento de Treitz) y L4b (ligamento de Treitz por encima del íleon distal), lo que permite clasificar tanto la enfermedad estenosante como la penetrante en el mismo paciente (B2B3); así también la presencia de retraso del crecimiento en el paciente pediátrico como G(1) vs. G(0) sin falla en el crecimiento26.
8. El CDAI se ha utilizado en el pasado en ensayos clínicos, pero tiene una serie de limitaciones, incluidos los parámetros utilizados para definir la remisión (CDAI <150), y el diseño contemporáneo de los ensayos ya no favorece el uso del CDAI. Porcentaje de acuerdo: 87.5%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
El CDAI se desarrolló y validó a fines de la década de 197027, y se utilizó en el pasado en ensayos clínicos, pero tiene una serie de limitaciones, incluidos los parámetros utilizados para definir la remisión (CDAI <150).
La EC es una entidad compleja que puede modificarse por complicaciones de la enfermedad, factores influenciados por la subjetividad y síntomas funcionales. La heterogeneidad de la enfermedad dificulta la precisión de la cuantificación de los índices de actividad, cuando estos se comparan con la presencia y magnitud de las lesiones estructurales. En la práctica clínica, los criterios de evaluación del CDAI son extensos y el cálculo es complejo, además, no está validado en pacientes posquirúrgicos y no es aplicable a pacientes con estomas, por lo que su uso en la práctica clínica tiende a ser limitado28.
9. El índice Harvey Bradshaw (HBI) es fácil de calcular y medir, y es menos susceptible a factores de confusión que dependen solo de parámetros clínicos, pero está fuertemente ponderado por la diarrea. A menudo se utiliza una puntuación HBI ≤ 4 para definir la remisión clínica. Porcentaje de acuerdo: 93.8%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
El HBI se desarrolló a principios de la década de 1980, y proporciona una medida simple y práctica de la actividad clínica de la EC29.
El HBI se correlaciona con el CDAI, pero es menos complejo. El HBI es considerado adecuado para el seguimiento a largo plazo de los pacientes y para ser utilizado en la práctica clínica por ser más sencillo de implementar. Consta de cinco parámetros clínicos: estado general del paciente, dolor abdominal, masa palpable, presencia de complicaciones, pero está fuertemente ponderado por el número de deposiciones. En general, una puntuación HBI ≤ 4 se considera representativo de remisión clínica y criterio de respuesta a un descenso del HBI ≥ 330.
10. Los dos índices endoscópicos más utilizados para evaluar la actividad endoscópica son el índice endoscópico de gravedad de la EC (CDEIS) y la puntuación de actividad endoscópica simplificada para la EC (SES-CD). Mientras que el CDEIS es complejo de calcular, el SES-CD es un puntaje endoscópico simple, reproducible y confiable. Porcentaje de acuerdo: 100%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
La medición objetiva de actividad de la EC, incluyen los índices de inflamación endoscópica, los cuales son útiles como objetivos de tratamiento en los ensayos clínicos y pueden impulsar la toma de decisiones terapéuticas en la práctica clínica.
El SES-CD fue propuesto para simplificar la clasificación endoscópica de la EC, está basado en cuatro variables endoscópicas, con escala del 0-3, en los mismos cinco segmentos considerados en el CDEIS, ambos se utilizan para evaluar la cicatrización completa de la mucosa como criterio de valoración en los ensayos clínicos31.
Con un índice de reproducibilidad interobservador del 0.87 y un índice de reproducibilidad intraobservador del 0.91, la SES-CD se presenta como una herramienta altamente confiable en la evaluación de la actividad inflamatoria en la EC32.
11. La puntuación de Rutgeerts se utiliza específicamente para evaluar la recurrencia de la EC en el íleon neoterminal después de la cirugía. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
Los pacientes con EC a menudo requieren resección quirúrgica debido a complicaciones, como estenosis y abscesos, o enfermedad refractaria al tratamiento médico. El riesgo de cirugía tras el diagnóstico es del 16.3% a un año, del 33.3% a los cinco años y del 46.6% a los 10 años33. En el manejo evolutivo de los pacientes con EC después de la cirugía, se deben identificar los factores de riesgo para la recurrencia posoperatoria, así como una evaluación endoscópica posoperatoria.
El estudio publicado por Rutgeerts et al. a finales de 1990 observaron lesiones recurrentes endoscópicamente en el íleon neoterminal dentro del año de la cirugía en el 73% de los pacientes, aunque solo el 20% de los pacientes tenían síntomas. Tres años después de la cirugía, la tasa de recurrencia endoscópica había aumentado al 85% y la recurrencia sintomática se presentó en el 34%. El curso final de la enfermedad fue mejor predicho por la severidad de las lesiones posoperatorias tempranas, observadas en la ileoscopia34.
A pesar de que la puntuación de Rutgeerts no ha sido validada, se acepta que aquellos pacientes que presentan una puntuación de ≥ i2 o una puntuación de Rutgeerts modificado de ≥ i2b deben recibir tratamiento inmunomodulador o terapia biológica, incluso si se encuentran asintomáticos, ya que las posibilidades de presentar recurrencia clínica y complicaciones a corto plazo son elevadas35.
Módulo 2. Diagnóstico de la enfermedad de Crohn12. Se requiere de una historia clínica y un examen físico apropiados, así como la correlación con hallazgos de laboratorio, de la ileocolonoscopia, imágenes radiológicas del intestino delgado y/o histología para establecer el diagnóstico. Porcentaje de acuerdo: 100%. Calidad de la evidencia: D. Débil a favor de la intervención: 2.
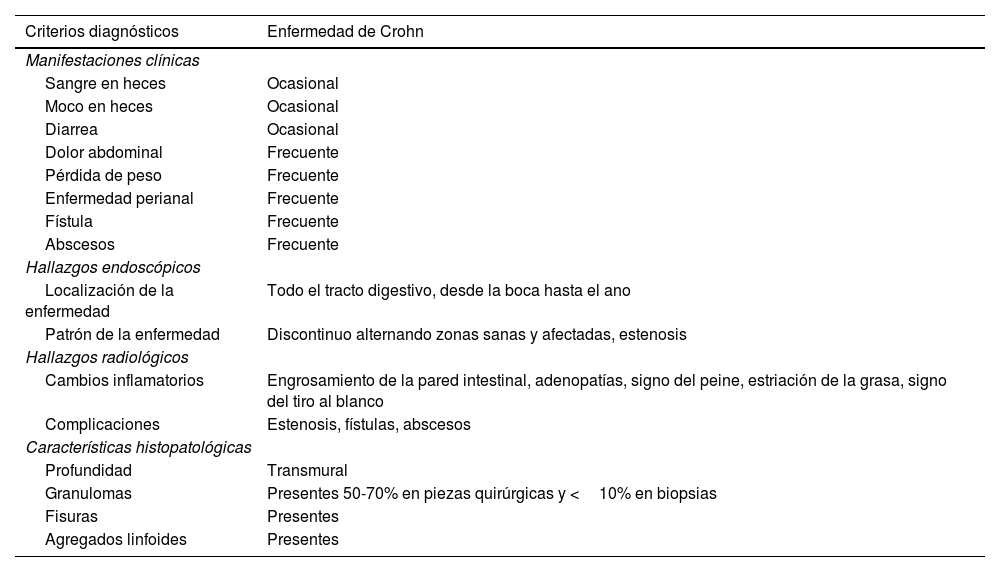
El diagnóstico de la EC debe incluir un interrogatorio y exploración clínica completa, laboratorios séricos, estudio de las heces, estudios de imagen y endoscopia con histopatología del intestino delgado y grueso. Dentro del abordaje se debe descartar una infección incluida Clostridioides difficile y en pacientes con alta sospecha clínica, pero con endoscopia normal, se debe considerar la cápsula endoscópica para valorar la totalidad del intestino delgado36. En la tabla 2 se ilustran los criterios diagnósticos de la EC.
Criterios diagnósticos de la enfermedad de Crohn
| Criterios diagnósticos | Enfermedad de Crohn |
|---|---|
| Manifestaciones clínicas | |
| Sangre en heces | Ocasional |
| Moco en heces | Ocasional |
| Diarrea | Ocasional |
| Dolor abdominal | Frecuente |
| Pérdida de peso | Frecuente |
| Enfermedad perianal | Frecuente |
| Fístula | Frecuente |
| Abscesos | Frecuente |
| Hallazgos endoscópicos | |
| Localización de la enfermedad | Todo el tracto digestivo, desde la boca hasta el ano |
| Patrón de la enfermedad | Discontinuo alternando zonas sanas y afectadas, estenosis |
| Hallazgos radiológicos | |
| Cambios inflamatorios | Engrosamiento de la pared intestinal, adenopatías, signo del peine, estriación de la grasa, signo del tiro al blanco |
| Complicaciones | Estenosis, fístulas, abscesos |
| Características histopatológicas | |
| Profundidad | Transmural |
| Granulomas | Presentes 50-70% en piezas quirúrgicas y <10% en biopsias |
| Fisuras | Presentes |
| Agregados linfoides | Presentes |
13. La sospecha de la EC debe investigarse con ileocolonoscopia con toma de biopsias de la mucosa incluso de apariencia normal de los seis segmentos (recto, colon sigmoides, descendente, transverso, ascendente e íleon) para buscar enfermedad microscópica; y con imágenes para evaluar la ubicación y la extensión de la enfermedad del intestino delgado. Porcentaje de acuerdo: 100%. Calidad de la evidencia: D. Débil a favor de la intervención: 2.
Ante la sospecha de EII, se debe realizar una ileocolonoscopia con toma de biopsias de mucosa en los segmentos tanto inflamados como en los que no están inflamados, a excepción del caso de una colitis aguda grave por riesgo alto de perforación intestinal. Se recomienda realizar endoscopia digestiva superior en pacientes con síntomas digestivos superiores sugestivos de EC. Aunque ninguna característica endoscópica es específica de la EC, se debe realizar diagnóstico con al menos tres de los siguientes hallazgos histológicos36:
- ∘
Presencia de granuloma epitelioide
- ∘
Anomalías arquitectónicas focales de las criptas
- ∘
Preservación de mucina en los sitios activos
- ∘
Inflamación crónica focal sin presencia de atrofia de las criptas
14. Se sugiere que las imágenes transversales, específicamente la resonancia magnética (RM), la tomografía axial computarizada (TAC) y el ultrasonido (US), han reemplazado en gran medida las técnicas convencionales de medicina nuclear y fluoroscópica con bario y tienen la ventaja de evaluar la enfermedad luminal y extraluminal. El US y la enterografía por RM son dos procedimientos precisos para el diagnóstico de la EC y como ventaja no exponen a los pacientes a la radiación ionizante. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
Numerosos estudios recientes han demostrado que los procedimientos no invasivos como TAC, RM y US presentan alta precisión diagnóstica ya que se puede establecer el grosor y el realce de la pared para la evaluación de pacientes con EII37–40. Sin embargo, dentro de la opinión de expertos se recomienda que la evaluación inicial de la EC sea mediante el US o la enterografía por RM por la nula exposición a la radiación32. Dos revisiones sistemáticas de estudios prospectivos mostraron que no había diferencia significativa entre los dos procedimientos en cuanto a sensibilidad y especificidad41,42. Se deben considerar varias limitaciones de la ecografía, incluida la duración relativamente larga de la exploración, que depende en gran medida de la habilidad y experiencia del ecografista/radiólogo43.
15. Los signos radiológicos de la actividad de la enfermedad incluyen aumento en el grosor y la vascularización de la pared intestinal y mesenterio, realce del contraste en T2 y señal de imagen ponderada por difusión (para MRE), e identificación de ulceración y complicaciones extraluminales agudas. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
El diagnóstico de la EC está basado predominantemente en la medida de la pared del intestino, en la literatura se ha considerado un espesor de la pared intestinal mayor o igual a 4mm como patológico42. Existe una alta correlación entre la gravedad de las lesiones intestinales evaluadas mediante endoscopia y la intensidad de los cambios en la ecografía, la RM o la tomografía computarizada (TC)42.
El US, la TC y la RM tienen una alta sensibilidad y especificidad para el diagnóstico de fístulas y abscesos intraabdominales, con precisiones diagnósticas similares42.
16. El uso de la cápsula endoscópica debe restringirse a aquellos con una alta sospecha de EC incluyendo cuadro clínico sugestivo, calprotectina fecal (CF) elevada, ileocolonoscopia normal y estudios de imagen sin alteraciones o no concluyentes. Porcentaje de acuerdo: 100%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
Dentro de la opinión de expertos se recomienda usar la cápsula endoscópica en pacientes con una alta sospecha clínica y paraclínica de EC y que tengan estudios de imagen normales o no concluyentes. Las contraindicaciones para la cápsula endoscópica incluyen obstrucción gastrointestinal, estenosis y trastornos de la deglución40.
17. Se sugiere que la cápsula endoscópica tiene una mayor sensibilidad para la afectación de mucosa del intestino delgado en la EC comparada con las técnicas de imagen radiológica, y se puede realizar cuando se sospecha enfermedad inflamatoria del intestino delgado a pesar de las imágenes transversales normales o equívocas. Porcentaje de acuerdo: 100%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
Pacientes con sospecha clínica de EC y con endoscopia sin alteraciones deben ser considerados para realización de cápsula endoscópica, ya que es una herramienta sensible para detectar anomalías de la mucosa del intestino delgado y es una herramienta útil para el pronóstico debido a que el involucro en este segmento se asocia con un mayor riesgo de cirugía40.
18. La enteroscopia asistida por balón, puede visualizar la mucosa del intestino delgado más allá del alcance de la panendoscopia e ileocolonoscopia, lo que permite la toma de biopsia de tejido para la evaluación histológica. Porcentaje de acuerdo: 100%. Calidad de la evidencia: D. Débil a favor de la intervención: 2.
Por medio de la enteroscopia asistida por balón se puede visualizar en su totalidad la mucosa del intestino delgado, además es posible tomar biopsias y permite realizar intervenciones para el control de sangrado o dilatar zonas de estenosis44.
19. La enteroscopia asistida con balón debe reservarse para pacientes con alta sospecha clínica de EC a pesar de una ileocolonoscopia negativa, que tienen imágenes transversales o en cápsula endoscópica sospechosas, pero no diagnósticas, particularmente si los hallazgos alterasen la estrategia terapéutica, o en pacientes donde un diagnóstico histológico firme alteraría el manejo. Porcentaje de acuerdo: 100%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
La enteroscopia asistida por balón a pesar de ser un excelente estudio diagnóstico el cual además tiene la capacidad de ser terapéutico, no es un estudio diagnóstico de rutina en los pacientes con sospecha de EC, ya que al ser invasivo requiere sedación y existe riesgo de perforación de casi el 2% (en la mayoría de los casos esta es secundaria a dilatación de estenosis), sin embargo, es útil en los casos en los que se requiere visualizar la mucosa del intestino delgado y toma de biopsia para poder llegar a un diagnóstico definitivo lo cual nos daría pauta a un tratamiento dirigido44,45
20. La enteroscopia asistida con balón tiene un papel en la EC establecida donde se necesita intervención terapéutica, como la dilatación de una estenosis. Porcentaje de acuerdo: 93.8%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
La enteroscopia asistida por balón para la dilatación de las estenosis del intestino delgado asociadas a EC tiene una eficacia clínica del 82% a corto plazo y tiene bajas tasas de complicaciones. Sin embargo, en el seguimiento, el 48% de los pacientes presentaron recurrencia de síntomas obstructivos, el 39% requirió dilataciones de las estenosis repetitivas y el 27% de cirugía46.
21. Los hallazgos histológicos en los pacientes con EC son inconstantes, sin embargo, en las biopsias endoscópicas o de resección quirúrgica se suele mostrar inflamación focal o irregular y/o distorsión de la cripta. Los segmentos discontinuos de la enfermedad «lesiones en parches», la afectación ileal, la inflamación transmural y la inflamación granulomatosa son sugestivos de EC. Porcentaje de acuerdo: 100%. Calidad de la evidencia: D. Débil a favor de la intervención: 2.
La EC se identifica en aproximadamente partes iguales con afección ileal, ileocolónica o colónica y <15% de los pacientes van a presentar cambios en el área afectada con el tiempo45.
Para llegar a un diagnóstico confiable de EC se debe de realizar una ileocolonoscopia con la toma de ≥ 2 biopsias de las zonas inflamadas, además la toma de biopsias de zonas sin inflamación macroscópica y de cada segmento colónico son útiles para el diagnóstico. En las biopsias de pacientes con EC normalmente al examen macroscópico muestran un patrón discontinuo de inflamación; segmentos enfermos separados por áreas de intestino no afectado (lesiones en parche), en cuanto a los hallazgos histológicos la arquitectura vellosa irregular de la mucosa ileal secundaria al infiltrado inflamatorio discontinuo es la alteración más frecuente y característica en estos pacientes, además de este hallazgo otras de las características con mayor valor diagnóstico en EC son la inflamación crónica discontinua (en parches) y no confinada a mucosa superficial, la distorsión arquitectónica focal de las criptas y los granulomas no relacionados con lesión de las criptas; estas lesiones se observan a lo largo del intestino delgado e intestino grueso, además de esófago, estómago y duodeno47.
Es importante recordar que la arquitectura de las criptas puede estar preservada en una etapa muy temprana de la enfermedad, sin embargo, se debe descartar de que se trate de una colitis infecciosa. La presencia de granulomas y anormalidades arquitectónicas focales de las criptas acompañados de inflamación crónica o irregular; con linfocitos y células plasmáticas y conservación de mucina en sitios con enfermedad activa son hallazgos compatibles con EC; la inflamación en parches es típica en pacientes sin tratamiento44.
A pesar de que la presencia de granulomas es uno de los hallazgos característicos de la EC, únicamente están presentes en aproximadamente el 40 a 60% de los especímenes quirúrgicos, y 15 a 36% en muestras de biopsias endoscópicas48.
22. A los patólogos les resulta más fácil distinguir entre EII y no EII que separar la EC de la colitis ulcerosa crónica idiopática (CUCI), y el diagnóstico se ve enriquecido en gran medida por la discusión en una reunión del equipo multidisciplinario con médicos y patólogos presentes. Los estudios han demostrado que alrededor del 3% de los pacientes con CUCI serán reclasificados como Crohn colónico, y a la inversa, un pequeño número (0.6-3%) será reclasificado a CUCI después de un diagnóstico inicial de EC. Porcentaje de acuerdo: 100%. Calidad de la evidencia: D. Débil a favor de la intervención: 2.
En aproximadamente el 5% de los pacientes con sospecha clínica de EII no se puede realizar un diagnóstico definitivo de CUCI o EC esto secundario a falta de información clínica, radiológica o endoscópica, así como superposición de datos de ambas patologías, en estos casos se puede usar el término de EII no clasificada. Los estudios epidemiológicos indican que estos pacientes en su mayoría terminan con diagnóstico de CUCI.
El enviar las biopsias con patólogos especialistas en aparato digestivo ayudará a disminuir este porcentaje de errores, ya que la mayoría de los patólogos en unidades hospitalarias sobre todo de segundo nivel no están familiarizados con las imágenes de EII.
Módulo 3. Monitoreo y seguimiento de la enfermedad con las herramientas establecidas incluyendo treat to target, así como la medición de niveles y anticuerpos en contra de la terapia biológica23. La respuesta clínica es un objetivo de tratamiento inmediato, esta se define como disminución de al menos un 50% en desenlaces reportados por el paciente (PRO2) que incluye dolor abdominal y frecuencia de deposiciones. Porcentaje de acuerdo: 100%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
Los síntomas clínicos correlacionan pobremente con el grado de inflamación de la mucosa en la EC y no es infrecuente descubrir una inflamación significativa de la mucosa durante la remisión clínica completa, sin embargo, este índice es únicamente una medida de utilidad como una medida clínica de respuesta al manejo de forma inicial que nos permite identificar que el paciente presenta mejora que pudiera sustentar continuar en espera de la remisión clínica. El grupo votó a favor de utilizar esta medida clínica como parte de la evaluación49.
24. La remisión clínica es un objetivo de tratamiento intermedio (es decir, a mediano plazo) la cual debe definirse como: PRO2 (dolor abdominal 1 y frecuencia de deposiciones 3) o HBI <5. Porcentaje de acuerdo: 100%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
Aun cuando la respuesta es deseable, el nivel de evidencia proviene de recomendación de expertos, es deseable que esta medida se correlacione con los índices de mayor significancia49.
25. La normalización de la reacción en cadena de la polimerasa (PCR) (a valores por debajo del límite superior de la normalidad) y la CF (100-250mg/g) es un objetivo de tratamiento intermedio en la EC. Considerar la optimización o cambio de tratamiento si no se ha logrado este objetivo.Porcentaje de acuerdo: 100%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
En análisis retrospectivos de pacientes con EC, se ha encontrado que las mediciones de CF realizadas durante el control de rutina pueden identificar a los pacientes en riesgo de progresión de la enfermedad, independientemente de los síntomas o la ubicación de la enfermedad50. Por lo tanto, es importante evaluar a los pacientes asintomáticos en busca de inflamación de la mucosa y buscar la resolución completa de la inflamación.
Aun cuando se requieren estudios más precisos para establecer el nivel exacto, la evidencia proveniente de un primer metaanálisis que evalúa el nivel de CF y obtiene un excelente valor de corte para distinguir si los pacientes recaerán en un futuro cercano, lo que es más útil para la práctica clínica. Se sugiere que un valor de corte de CF de 150μg/g se asocia con una precisión diagnóstica óptima para la recurrencia endoscópica posoperatoria en EC51. El panel decidió dejar un rango en función de con más estudios modificar la recomendación original de 152μg/g.
26. La cicatrización endoscópica es un objetivo a largo plazo definido como SES-CD <3 puntos o ausencia de ulceraciones la cual debe evaluarse por ileocolonoscopia y considerar optimización o cambio del tratamiento si no se ha logrado este objetivo. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Las pruebas objetivas de la actividad de EC han desplazado las evaluaciones basadas en síntomas. A pesar de sus limitaciones, la CM se ha convertido en un importante objetivo de tratamiento asociado con mejores resultados a largo plazo. La CM se puede evaluar en la mayoría de los pacientes mediante ileocolonoscopia. Sin embargo, los métodos no invasivos, aunque utilizados clínicamente, aún no han demostrado ser confiables para la evaluación de la HM, especialmente para la EC del intestino delgado, y se necesitan más estudios. Aunque apuntar a la CM puede ser el objetivo más importante en la evaluación de las opciones terapéuticas en la EC, es posible que no sea alcanzable en la práctica clínica para muchos pacientes52.
27. La remisión transmural (evaluada por enterografía por TC, MRE o US intestinal) no es un objetivo de tratamiento todavía en la EC. No obstante, en la EC debe utilizarse como complemento de la remisión endoscópica para representar un nivel más profundo de remisión. Porcentaje de acuerdo: 93.8%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
Un estudio retrospectivo observacional en 214 pacientes con EC encontró que aquellos pacientes con remisión transmural (definida como remisión endoscópica y por RM en conjunto) tuvieron menores tasas de cirugía, hospitalización y escalamiento de terapia a 12 meses comparado con pacientes con solo CM (15.2% vs. 44.2%, p=0.005) y sin curación (15.2% vs. 63.6%, p <0.001)53. Por otro lado, un estudio multicéntrico retrospectivo que incluyó 404 pacientes valoró los desenlaces de hospitalización, cirugía, uso de esteroides y escalamiento de la terapia a cinco años en aquellos pacientes con remisión transmural (definida previamente) comparado con los pacientes con solo remisión radiológica, endoscópica o sin remisión y reportó que aquellos con remisión transmural tenían menor riesgo de hospitalización (RM 0.244 [0.111-0.538], p <0.001), cirugía (RM 0.132 [0.030-0.585], p <0.001), uso de esteroides (RM 0.283 [0.159-0.505], p <0.001) y escalamiento del tratamiento (RM 0.088 [0.044-0.176], p <0.001)54.
28. La remisión histológica no es un objetivo de tratamiento en la EC. Porcentaje de acuerdo: 81.3%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
En estudios retrospectivos aproximadamente el 61% de los pacientes con EC activa que lograron la remisión clínica y endoscópica con la optimización del tratamiento lograron simultáneamente la remisión histológica, lo que se asoció con un menor riesgo de fracaso del tratamiento. Determinar si la remisión histológica debe ser un objetivo de tratamiento en la EC requiere evaluación en ensayos aleatorios55.
29. La monitorización terapéutica de fármacos (MTF) reactiva debe realizarse en pacientes con falta de respuesta primaria y pérdida de respuesta confirmada a la terapia biológica (anti-factor de necrosis tumoral (TNF), vedolizumab, ustekinumab u otro mecanismo de acción). Es más rentable que la optimización de la terapia anti-TNF de manera empírica. Porcentaje de acuerdo: 93.6%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
Se ha observado que los niveles de infliximab de 4.4μg/mL con rango intercuartílico (IQR) de: 3.3-6.5 y de adalimumab de 6.3μg/mL con RIC de: 4.2-8.2μg/mL han demostrado mayores tasas de CM o remisión profunda comparado con los niveles más bajos de infliximab 2.3μg/mL (IQR: 1.1-4.2μg/mL) y de adalimumab de 3.9μg/mL (IQR: 2.4-5.5μg/mL) en donde se ha observado mayores tasas de resección intestinal56.
Se ha observado que concentraciones mayores de 5.0μg/mL para infliximab (área bajo la curva de 0.92; IC 95%: 0.82-1.00) y de adalimumab mayores a 5.9μg/mL (área bajo la curva de 0.89; IC 95%: 0.71-1.00) se asociaron con cierre de la fistula en pacientes con EC perianal57.
La medición temprana de niveles de infliximab posterior a la primera infusión de infliximab se observó que a la semana dos, los niveles menores de 6.8μg/mL (área bajo la curva=0.68, p=0.002, sensibilidad 50%, especificidad 86%) y niveles anticuerpos contra infliximab >4.3μg/mL (área bajo la curva=0.78, p=0.0004, sensibilidad 77%, especificidad 71%) fueron predictores de no respondedores primario58.
La monitorización posinducción ha demostrado en el análisis multivariado que del único factor asociado a la falta de respuesta primaria a la semana 14 fue la baja concentración de anti-TNF siendo para infliximab con una RM: 0.35 (IC 95%: 0.20-0.62), p=0.00038; y de adalimumab: RM: 0.13 (IC 95%: 0.06-0.28), p <0.0001, se concluyó que la concentración óptima a la semana 14 asociada a remisión fueron los niveles de 7μg/mL para infliximab y 12μg/mL para adalimumab59.
Es importante comentar que en nuestro país no se puede realizar un monitoreo proactivo de los niveles de la terapia anti-TNF, ya que se carece de la medición rutinaria de los niveles de biológicos principalmente anti-TNF por lo que la conducta que se adopta es la reactiva, es decir, cuando un paciente presenta pérdida de la respuesta secundaria.
Como opinión de expertos: el monitoreo reactivo para vedolizumab y ustekinumab en pacientes con sospecha de falla primaria o secundaria. La American Gastroenterological Association (AGA) recomendación condicional: en los pacientes tratados con anti-TNF podría existir un beneficio, la medición sérica del biológico (TDM) reactiva para cambiar el tratamiento, y evitar escalar o cambiar de manera empírica56.
30. El aumento de la eliminación de la terapia anti-TNF se asocia con anticuerpos antifármaco, sexo masculino, albúmina baja, PCR inicial alta e índice de masa corporal (IMC) alto. Porcentaje de acuerdo: 100%. Calidad de la evidencia: D. Débil a favor de la intervención: 2.
Esta información ha sido provista de diferentes estudios retrospectivos o de estudios prospectivos, tales como los estudios de Adalimumab que sustentan el treat to target, una crítica del panel es que los estudios randomizados evitan pacientes que tengan cargas inflamatorias demasiado altas por lo que la recomendación es fuerte y son factores importantes a tomar en cuenta36. Existen otros factores que pueden modificar los niveles de la terapia anti-TNF como del paciente al ser fumador, hispano, menor de 40 años; relacionados a la enfermedad como PCR elevada y leucocitosis; o bien al tratamiento como drug holidays de más de 11 semanas, el no usar inmunomodulador concomitante, iniciar dosis de infliximab menor a 7.5μg/mL, uso concomitante de antibióticos (cefalosporinas, penicilina) y la inmunogenicidad previa a otros anti-TNF60.
31. Los pacientes con pérdida secundaria de respuesta a la terapia anti-TNF debido al desarrollo de anticuerpos anti-fármaco de alto título no se debe aumentar la dosis, sino que deben cambiar a una terapia con mecanismo de acción distinto. Sin embargo, al considerar el cambio dentro de la clase de fármaco en caso de pérdida secundaria de respuesta a un primer fármaco anti-TNF debido al desarrollo de anticuerpos antifármaco, se debe agregar un inmunomodulador a una terapia anti-TNF. Porcentaje de acuerdo: 100%. Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
En pérdida secundaria debido a anticuerpos se acepta como una conducta adecuada el cambio de mecanismo, sin embargo, el panel acepta la posibilidad de que algunos pacientes tendrán que mantener un segundo anti-TNF y la evidencia proviene sobre todo de opiniones de expertos, no así un estudio que sostenga la conducta de uso de anti-TNF y adición de inmunomodulador. El estudio REACT apoya el uso de inmunomodulador y de este podemos tomar cierta evidencian en el contexto de la EC61.
32. Los títulos bajos de anticuerpos antidrogas pueden superarse mediante la optimización del tratamiento (aumento de la dosis, acortamiento del intervalo de dosis y/o adición de un inmunomodulador). Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
La terapia concomitante con inmunomoduladores reduce la formación de anticuerpos a la infliximab (ATI) asociada con el tratamiento con infliximab y mejora la farmacocinética de infliximab. No hay diferencia entre metotrexato y azatioprina en la reducción de estos riesgos. Anticuerpos vs. infliximab influyen profundamente en la farmacocinética de infliximab. La formación de los ATI >8 μg/mL se asocia con niveles séricos más bajos de infliximab desde cuatro semanas de su primera administración62.
En un metaanálisis, se demostró que la adición de inmunomoduladores a los inhibidores de TNF-α restaura la respuesta clínica en el 74% de los pacientes al disminuir o eliminar por completo los niveles de anticuerpos antifármaco63. Se necesitan más estudios multicéntricos a largo plazo para validar estos hallazgos.
33. El HLA-DQA1*05 está asociado con un mayor riesgo de desarrollar anticuerpos contra infliximab y adalimumab. La formación de anticuerpos contra infliximab o adalimumab puede reducirse mediante el uso de inmunomoduladores. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
En un estudio observacional, se encontró una asociación significativa en todo el genoma entre HLA-DQA1*05 y el desarrollo de anticuerpos contra agentes anti-TNF (infliximab y adalimumab)64, sin embargo, aun cuando otros estudios retrospectivos han encontrado la evidencia no es una médica recomendada como predicción a la luz que de que este momento no existen estudios prospectivos que validen tal afirmación.
Módulo 4. Tratamiento médico de la enfermedad de Crohn34. En la EC ileocecal con actividad leve, se recomienda el uso de budesonida de liberación ileal a una dosis de 9mg/día. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Estudios clínicos han mostrado que la budesonida es superior al placebo (RR=1.96, IC 95%: 1.19-3.23) y mesalazina (RR 1.63, IC 95%: 1.23-2.16). Se prefiere la budesonida a la prednisolona porque es asociada con eventos adversos menores (RR 0.64, IC 95%: 0.28-0.95). La tasa de remisión con budesonida es del 51-60% en 8-10 semanas, según varios estudios65,66.
35. El uso de sulfasalazina o mesalazina ha demostrado ser eficaz como terapia de inducción y mantenimiento en pacientes con EC leve de localización colónica. Porcentaje de acuerdo: 88% Calidad de la evidencia: B. Débil a favor de la recomendación: 2.
Un metaanálisis de tres ensayos clínicos grandes no encontró una eficacia clínica significativa con mesalazina en pacientes con EC ileocecal de actividad leve a moderada63. Un metaanálisis más reciente encontró una tendencia hacia un efecto benéfico relacionado con el uso de la sulfasalazina, en comparación con placebo (dos estudios), con un RR de fracaso en lograr remisión de 0.83 (IC 95%: 0.69-1.00). Una revisión sistemática y un metaanálisis de ensayos controlados aleatorizados reportaron ningún beneficio con mesalazina (cuatro estudios) (RR: 0.91, IC 95%: 0.77-1.06). En la EC, de moderada a grave, la sulfasalazina fue más efectiva que placebo (RR 0.78, IC 95%: 0.65–0.93), pero en el mantenimiento libre de corticoesteroides, no fue superior a placebo (RR 0.98, IC 95%: 0.82–1.17). La eficacia de la mesalazina en la inducción a la remisión en la EC es incierta y probablemente no sea efectiva en el mantenimiento de la remisión (sulfasalazina: RR=0.98; IC 95%: 0.82–1.17 y 5-aminosalicilatos: RR=1.02; IC 95%:0.92–1.16)67,68.
36.El uso de corticoesteroides sistémicos orales es recomendado para la inducción de la remisión en pacientes con EC activa de moderada a grave de cualquier localización. El uso de corticoesteroides no es recomendado como terapia de mantenimiento de remisión. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
La prednisolona es una opción apropiada para la EC leve a severa. Una revisión sistemática Cochrane con dos estudios mostró que los corticoesteroides son más efectivos que placebo para la inducción de remisión, con un RR de 1.99 (IC 95%: 1.51-2.64, p <0.00001)69. La idea es minimizar la exposición prolongada con esteroides en pacientes con EC, dada la falta de eficacia en el mantenimiento de remisión.
37. En pacientes con EC que logran remisión con corticoesteroides sistémicos, se recomienda el uso de tiopurinas. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Un metaanálisis de seis estudios clínicos comparó azatioprina con placebo y encontró una tasa de remisión del 71% vs. 52%, respectivamente (RM=2.32; IC 95%: 1.55-3.49, con número necesario a tratar [NNT] 6, para prevenir recaída), con un efecto de respuesta a dosis de 1mg/kg/día (RM: 1.2; IC 95%: 0.60-2.41), 2mg/kg/día (RM=3.01; IC 95%: 1.66-5.45) y 2.5mg/kg/día (RM=4.13; IC 95%: 1.59-10.71)70.
38. El uso de metotrexato es eficaz en la inducción y mantenimiento de la remisión en pacientes con EC. Porcentaje de acuerdo: 88% Calidad de la evidencia: C. Débil a favor de la intervención: 2.
Metaanálisis que incluyó siete estudios (cuatro ensayos clínicos controlados) con un total de 495 pacientes en donde un estudio en donde se utilizó metotrexato a dosis de 25mg por vía intramuscular cada semana en donde el 39% indujo la remisión de manera significativa comparado con el 19% del grupo placebo (RR=0.75, IC 95%: 0.61-0.93; NNT=5)67 mientras que otras dosis de 12.5, 15 y 20mg semanal administradas por vía oral no mostraron diferencias significativas con respecto al grupo placebo71.
Un estudio comparó metotrexato a dosis de 15mg por semana, por vía intramuscular vs. placebo, para el mantenimiento de la remisión en pacientes con EC. A las 40 semanas, las tasas de remisión eran del 65% vs. 39% del grupo placebo (p=0.04)72.
39. La terapia biológica contra el anti-TNF-α como infliximab, adalimumab y certolizumab pegol, está recomendada en pacientes con EC moderada a grave que han sido refractarios o intolerantes al tratamiento convencional a base de esteroides e inmunomoduladores. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
El estudio ACCENT 1 evaluó la eficacia y la seguridad de infliximab en pacientes con EC a través de un ensayo multicéntrico, aleatorizado, doble ciego, controlado por placebo, de 54 semanas que involucró a 573 pacientes con un puntaje del CDAI >220. Un total de 335 pacientes que respondieron a dosis de inducción fueron aleatorizados en tres grupos: grupo I con placebo; grupo II con infliximab con dosis de mantenimiento de 5mg/kg; y grupo III con infliximab con dosis de mantenimiento de 10mg/kg. A las semanas 30 y 54, la proporción de pacientes en remisión fue más alta en los grupos de infliximab (39%) y (45%), de los grupos II y III comparado con el grupo I (21%) (p=0.002). No se encontró diferencia en las tasas de remisión entre los grupos recibiendo 5mg/kg y 10mg/kg de infliximab. A la semana 54, el 29% de los pacientes en los grupos de infliximab estaban en remisión clínica y habían descontinuado su tratamiento con corticoesteroides, en comparación con el 9% en el grupo placebo (p=0.004). Este ensayo mostró que la administración de infliximab era efectiva y segura en pacientes con EC73.
El estudio CLASSIC 1 fue un ensayo multicéntrico, aleatorizado, doble ciego, controlado por placebo, con diferentes rangos de dosis de inducción. En este estudio, pacientes con EC moderada a grave sin previa terapia anti-TNF recibieron terapia de inducción en las semanas cero y dos con adalimumab 40mg/20mg, 80mg/40mg, 160mg/80mg o placebo, y tuvieron seguimiento a la semana cuatro. El resultado primario medido de este estudio fue la eficacia de terapia de inducción con adalimumab en pacientes con EC. Un total de 299 pacientes fueron aleatorizados en la semana cero para recibir inducción con placebo, adalimumab 40mg/20mg, adalimumab 80mg/40mg o adalimumab 160mg/80mg. Se encontró una diferencia estadísticamente significativa (p=0.004) en las tasas de remisión entre los grupos de pacientes que recibieron adalimumab 80mg/40mg (24%), adalimumab 160mg/80mg (36%) o placebo (12%) en la semana cuatro. Este estudio mostró que la dosis de inducción 160mg/80mg de adalimumab fue superior a las otras dosis de adalimumab y placebo en pacientes con actividad de la EC moderada a grave74.
El estudio CLASSIC II incluyó a pacientes que lograron remisión después de una inducción de cuatro semanas en el estudio CLASSIC I y que también mantuvieron remisión por cuatro semanas adicionales (semanas cero y cuatro de CLASSIC II) con dosis de adalimumab de 40mg cada dos semanas, en la fase de etiqueta abierta. Los pacientes fueron subsecuentemente aleatorizados para recibir adalimumab o placebo por otras 56 semanas en un ensayo doble ciego. De un total de 256 pacientes, hubo una diferencia significativa en la tasa de remisión entre los grupos tratados con 40mg de adalimumab cada dos semanas (79%) y 40mg de adalimumab cada semana (83%), comparado con placebo (44%) (p <0.05).
Los resultados de este estudio apoyan la eficacia de adalimumab en la inducción y el mantenimiento de remisión en pacientes con EC moderada a grave sin previa terapia con infliximab. La terapia con adalimumab resultó en un incremento de remisión clínica en el 46% de los pacientes a la semana 5675.
El estudio CHARM, un ensayo de fase 3, aleatorizado, doble ciego, controlado por placebo, de 56 semanas de duración, evaluó la eficacia y la seguridad de adalimumab en el mantenimiento de respuesta, así como remisión, en pacientes con EC moderada a severa. En la primera visita, todos los pacientes recibieron una dosis de etiqueta abierta de adalimumab de 80mg, seguida de una dosis de 40mg en la semana dos. En esa semana, 778 pacientes fueron aleatorizados en tres grupos: adalimumab 40mg cada dos semanas, adalimumab 40mg cada semana o placebo, y continuaron hasta la semana 56. El porcentaje de pacientes que respondieron a la semana cuatro y estuvieron en remisión a la semana 56 fue: 36% adalimumab 40mg cada dos semanas, 41% adalimumab 40mg semanalmente y 12% placebo (p <0.001). La diferencia entre los grupos de adalimumab no fue estadísticamente significativa (p=0.34). Los resultados de este ensayo confirman que adalimumab es más efectivo que el placebo en el mantenimiento de remisión a largo plazo en pacientes con EC moderada a severa que respondieron inicialmente a adalimumab76.
El objetivo del estudio ADHERE fue evaluar el efecto a largo plazo de la terapia con adalimumab a los dos años en un ensayo abierto, como una extensión del ensayo CHARM, e incluyó a 467 pacientes. A la semana 60, la remisión clínica fue del 37.6, el 41.9% y el 49.8% en pacientes que recibieron placebo, adalimumab 40mg cada dos semanas y adalimumab 40mg cada semana, respectivamente. Un total de 84.1% de pacientes que recibieron adalimumab en el ensayo CHARM mantuvieron remisión hasta el final del estudio ADHERE. Este estudio mostró que la terapia con adalimumab puede mantener la remisión a largo plazo y reducir la cantidad de hospitalizaciones en pacientes con EC moderada a grave77.
El propósito del estudio GAIN fue determinar la eficacia de adalimumab en pacientes con EC que no mejoraron o que perdieron la capacidad de responder a infliximab. El ensayo incluyó a 325 pacientes con EC moderada a grave que fueron aleatorizados para recibir dosis de inducción de adalimumab 160mg/80mg a la semana cero y dos o placebo durante cuatro semanas. Al final de la semana cuatro, el 21% del grupo de adalimumab logró remisión clínica, comparado con el 7% de pacientes en el grupo placebo (p <0.001). La terapia con adalimumab fue superior a placebo para la inducción de remisión y repuesta en pacientes con EC moderada a grave que no toleraron infliximab o que perdieron la capacidad de responder a infliximab78.
El estudio PRECISE 1 fue un ensayo de 26 semanas, multicéntrico, aleatorizado, doble ciego, controlado por placebo. Un total de 662 pacientes con EC fueron divididos en dos grupos: 1) certolizumab pegol 400mg, y 2) placebo. Entre los pacientes con ≥ 10mg/L en niveles basales de PCR, el 22% en el grupo certolizumab pegol tuvo una reducción de por lo menos 100 puntos en el CDAI a la semana 26, comparado con el 12% en el grupo placebo (p=0.05). El tratamiento con certolizumab pegol se asoció con un beneficio modesto en las tasas de respuesta, pero no hubo mejoría en las tasas de remisión comparado con placebo en pacientes con EC moderada a grave79.
El estudio PRECISE 2 fue diseñado como un estudio multicéntrico, aleatorizado, doble ciego, controlado por placebo. Evaluó la eficacia de certolizumab pegol como terapia de mantenimiento en pacientes con EC moderada a grave. En este estudio, los pacientes recibieron una dosis de etiqueta abierta de inducción de 400mg a las semanas cero, dos y cuatro. Los pacientes que respondieron a la terapia de inducción a la semana seis fueron aleatorizados para recibir 400mg de certolizumab pegol o placebo. El seguimiento se realizó a la semana 26. En total, 213 pacientes tenían niveles basales de PCR ≥ 10mg/L. Un total de 62% de pacientes en el grupo certolizumab pegol tuvieron respuesta clínica, comparado con el 34% en el grupo placebo (p <0.001). La tasa de remisión clínica fue del 48% en el grupo certolizumab pegol, comparado con el 29% en el grupo placebo (p <0.001). Este estudio mostró que la administración continua de certolizumab pegol fue superior a la administración de placebo en el 64% de los pacientes con EC moderada a grave80.
40. La terapia anti-TNF basada en infliximab y adalimumab ha demostrado ser efectiva en el cierre de fístulas y en el mantenimiento de ese cierre en pacientes con EC. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
El estudio ACCENT II evaluó la eficacia de infliximab en el tratamiento de la EC fistulizante. En comparación con placebo, la mayoría de los pacientes que recibió infliximab 5mg/kg respondió al tratamiento, definido como una disminución del 50% o más en el drenaje de fístula (p=0.002). Hubo una respuesta completa (cierre de fístula) en el 55% de los pacientes que recibieron infliximab 5mg/kg, comparado con el 13% de los pacientes en el grupo placebo (p=0.001). El ensayo ACCENT II incluyó a pacientes con EC y fístula simple o compleja. Se observó que a la semana 54, el 23% de los pacientes en el grupo placebo tuvieron respuesta (definida como una disminución del 50% en el drenaje de fístula), comparado con el 46% de los pacientes que recibieron infliximab (p=0.001)81.
En un subestudio del ensayo ACCENT II82 que evaluó a los pacientes con fístula recto-vaginal, el 71.4% de los pacientes que recibieron infliximab lograron curación de la fístula, comparado con el 54.5% en el grupo placebo. El grupo francés GETAID232 realizó un estudio retrospectivo y multicéntrico en pacientes con fístulas enterocutáneas recibiendo tratamiento anti-TNF. Mostró que únicamente el 33% de los pacientes estudiados lograron curación completa de la fístula enterocutánea. En el análisis multivariado, se asoció la falta de curación con trayectos de fístulas múltiples (cociente de riesgo [CR]: 5.80, IC 95%: 1.07-31.5, p=0.04) y con la presencia de estenosis intestinal (CR: 4.67, IC 95%: 1.05-20.82, p=0.04). La terapia con adalimumab se ha mostrado efectiva en la inducción y el mantenimiento del cierre de fístulas perianales por un periodo mayor a dos años76,77,83.
Una revisión sistemática de la literatura79 demostró que el tratamiento combinado de terapia farmacológica (anti-TNF e inmunomoduladores) y cirugía es la estrategia con las mejores tasas de curación, comparado con la terapia farmacológica o quirúrgica por sí solas.
41. La terapia combinada de infliximab con azatioprina es superior a la monoterapia con un agente anti-TNF o azatioprina en pacientes con EC, en cuanto a la respuesta y remisión clínica, cicatrización de la mucosa y remisión libre de esteroides. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Un ensayo multicéntrico, aleatorizado, doble ciego, de 30 semanas de duración llamado SONIC84, el cual reclutó un total de 508 pacientes diagnosticados con EC fueron divididos en tres grupos de acuerdo con la terapia administrada: 1) monoterapia con azatioprina; 2) monoterapia con infliximab, y 3) terapia combinada con infliximab y azatioprina. A la semana 26, el 56.8% de los pacientes que recibieron terapia combinada se encontraban en remisión libre de esteroides, comparado con los pacientes que recibieron monoterapia con azatioprina (30%, p <0.001) y los pacientes que recibieron monoterapia con infliximab (44.4%, p=0.02).
También hubo una diferencia estadísticamente significativa en la curación de la mucosa entre pacientes que recibieron terapia combinada vs. azatioprina (p <0.001) e infliximab (p=0.06). La incidencia de eventos adversos fue similar entre los tres grupos, con ninguna diferencia significativa.
42. En pacientes con EC con predictores de pronóstico pobre, se recomienda comenzar terapia intensiva (top-down), la cual consiste en iniciar la terapia biológica de primera línea. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Se han identificado factores de pronóstico pobre en pacientes con EC. Por ejemplo, edad joven en el momento de diagnóstico (< 40 años de edad), patrón estenosante y fistulizante que incluye enfermedad perianal, afectación del tracto digestivo superior, enfermedad extensa (más de 70cm) y tabaquismo activo85,86.
En el estudio top-down87 que incluyó a 133 pacientes con nuevos diagnósticos de la EC fueron aleatorizados en dos grupos: el primer grupo recibió tratamiento temprano con inmunosupresores combinados (infliximab y tiopurinas) y el segundo grupo recibió tratamiento convencional con corticoides. A la semana 52, el 61.5% de los pacientes que recibieron tratamiento temprano con inmunosupresión estaban en remisión clínica, comparado con el 42.2% de los pacientes que recibieron tratamiento convencional (p=0.0278, IC 95%: 2.4-36.3). Después de la semana 52, no se encontraron diferencias entre los dos grupos. A la semana 104, se encontró curación de la mucosa en el 73.1% de los pacientes con el abordaje top-down, comparado con el 30.4% con el protocolo step-up (p=0.002). El estudio demostró que la terapia temprana con agentes inmunosupresores combinados produjo un porcentaje más grande de pacientes en remisión clínica, normalización más rápida de los niveles de la PCR e inducción de remisión en pacientes con EC no tratados previamente con corticoides, tiopurinas o fármacos biológicos, comparado con pacientes que recibieron terapia convencional.
43. El vedolizumab es una terapia eficaz en la inducción y mantenimiento de la remisión clínica en pacientes con EC moderada a grave refractaria a tratamiento convencional y terapia anti-TNF. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
El estudio GEMINI 2 demostró la eficacia del vedolizumab en EC, y los resultados demostraron que se alcanzó remisión clínica del 15% con vedolizumab comparado al 7% del placebo (p=0.02) durante la inducción a la semana 6. En la fase de mantenimiento (300mg cada cuatro u ocho semanas), los que respondieron a la inducción presentaron remisión de la EC a la semana 52 en el 36% (p=0.004) y el 39% de ambos grupos con grupos con vedolizumab (p <0.001), respectivamente, comparado con el 22% del placebo88. El estudio GEMINI 3 evaluó la eficacia de vedolizumab en pacientes con EC moderada a grave que habían tenido falla al menos a un anti-TNF-α, que fueron aleatorizados para recibir placebo o vedolizumab a dosis de 300mg/día a las semanas 0, 2 y 6. El desenlace primario fue la remisión clínica a la semana 6, que se encontró en el 15.2% del grupo de vedolizumab comparado con el 12.1% del placebo (p=0.433). Sin embargo, como desenlace secundario se evaluó la remisión clínica a la semana 10 documentándose una diferencia estadística a favor del grupo de vedolizumab del 26.6% vs. el 12.1% del placebo (p=0.001)89.
44. La terapia con vedolizumab es igual de efectiva que la terapia anti-TNF de primera línea en pacientes con EC. Porcentaje de acuerdo: 100% Calidad de la evidencia: B. Débil a favor de la intervención: 1.
El estudio EVOLVE de tipo cohorte retrospectivo de 24 meses en donde se incluyeron un total de 1,095 pacientes con EC (n=491) y CUCI (n=604) a quienes se les había dado terapia de primera línea con vedolizumab o anti-TNF. Los resultados mostraron que la tasa de persistencia al tratamiento con vedolizumab en pacientes con EC fue comparable con la terapia anti-TNF (67.2 vs. 67.2%) a los 24 meses, así como también las tasas de exacerbaciones de la EC fueron menores para el grupo de vedolizumab comparado con la terapia anti-TNF sin alcanzar diferencia estadística (razón de riesgo [RR]=0.84, IC 95%: 0.59-1.19) concluyéndose que ambos tratamientos son igualmente efectivos90.
45. El tratamiento con vedolizumab es una terapia muy segura en pacientes con EC ya que no incrementa los eventos adversos como procesos infecciosos ni neoplásicos. Hasta la fecha, no se ha documentado ningún caso de leucoencefalopatía focal progresiva. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Los principales efectos adversos descritos son: nasofaringitis, cefalea, artralgias e infecciones del tracto respiratorio superior. La principal diferencia entre natalizumab y vedolizumab es que natalizumab inhibe el tráfico de leucocitos en múltiples órganos, incluido el cerebro, mientras que vedolizumab actúa específicamente con heterodímeros α4β7 intestinales y, por lo tanto, inhibe el tráfico de linfocitos selectivamente en el intestino sin complicaciones sobre el sistema nervioso central hasta el momento. Debido a que vedolizumab actúa selectivamente en el intestino tiene nulo efecto sistémico, lo cual traduce menores eventos adversos88,89.
46. La terapia con ustekinumab es eficaz en la inducción y mantenimiento de la respuesta y remisión clínica en pacientes con EC moderada a grave refractarios a la terapia convencional y/o terapia anti-TNF. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Se evaluó el ustekinumab en EC con actividad moderada a grave refractaria a anti-TNF-α. Durante la fase de inducción, 526 individuos fueron asignados aleatoriamente para recibir ustekinumab intravenoso a dosis de 1, 3 o 6mg/kg, respectivamente, o placebo. Durante la fase de mantenimiento, 145 que tuvieron respuesta al tratamiento a las seis semanas entraron a una fase aleatoria donde recibieron inyecciones subcutáneas de ustekinumab (90mg) o placebo a la semana 8 y 16. La respuesta clínica a la semana 6 fue del 36.6%, 34.1% y del 39.7% para las dosis de 1, 3 y 6mg/kg de ustekinumab, respectivamente, comparado con el 23.5% de los que recibieron placebo (p=0.005 en comparación con el grupo de 6mg/kg). La terapia de mantenimiento con ustekinumab, comparada con placebo, demostró significativamente la remisión clínica (41.7% vs. 27.4%, p=0.03) y respuesta clínica (69.4% vs. 42.5%, p <0.001) a las 22 semanas, por lo que el uso de ustekinumab en EC con actividad moderada a grave refractaria a anti-TNF-α resulta ser efectivo en comparación con placebo. La EC moderada a grave con historia de falla al tratamiento con anti-TNF-α presenta el 34.3% de respuesta clínica a la semana 6 con ustekinumab. Por otra parte, en aquellos que no han estado expuestos a anti-TNF-α se observó respuesta clínica en el 55.5% a la semana 6. Es interesante comentar que ustekinumab presenta un rápido inicio de acción a partir de la semana 3 y la remisión clínica se mantiene en el 53.1% a la semana 4491,92.
47. La terapia con ustekinumab puede ser considerada de primera línea en aquellos pacientes con EC que presenten alguna contraindicación para el uso de terapia anti-TNF. Porcentaje de acuerdo: 94% Calidad de la evidencia: C. Débil a favor de la intervención: 2.
En un estudio retrospectivo de la vida real que incluyó 156 pacientes con EC que usaron como primera terapia anti-TNF y 50 con ustekinumab, todos vírgenes a terapia biológica. Se encontró que la respuesta clínica fue del 64% y 86% en los grupos de ustekinumab y anti-TNF, respectivamente a los tres meses (p=0.01) mientras que al año de tratamiento en el análisis multivariado ajustado por duración de la enfermedad, localización, uso de inmunomoduladores y esteroides, la remisión clínica fue independientemente asociada con el tipo de terapia biológica recibida (RM=2.6 para anti-TNF vs. ustekinumab; p=0.02) sin diferencias en el abandono del tratamiento ni seguridad93.
48. El tratamiento con ustekinumab es muy segura ya que no incrementa los eventos adversos infecciosos ni neoplásicos a lo largo de cinco años de tratamiento en pacientes con EC. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Los efectos adversos más frecuentes son vómito, nasofaringitis, eritema en el sitio de inyección, candidiasis vulvovaginal, bronquitis, prurito, infecciones del tracto urinario y sinusitis. No incrementa el riesgo de neoplasias ni se ha asociado a muertes a cinco años de tratamiento94.
49. La terapia con risankizumab es eficaz y segura en la inducción y mantenimiento de la remisión en pacientes con EC moderada a grave que han sido refractarios a terapia convencional y biológica. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Ensayo clínico controlado fase 3 que constó de dos cohortes (ADVANCE y MOTIVATE) en la fase de inducción en donde se incluyeron pacientes con EC moderada a grave refractarios a terapia convencional y biológica de cualquier mecanismo de acción quienes fueron aleatorizados a recibir risankizumab a dosis de 600mg y 1,200mg, así como placebo. Los resultados mostraron que en la cohorte ADVANCE, la remisión clínica por CDAI fue del 45% con risankizumab 600mg y del 42% con risankizumab 1,200mg vs. 25% del grupo placebo. La frecuencia en las evacuaciones y el dolor abdominal mejoró en el 43% con risankizumab 600mg y del 41% con risankizumab 1,200mg comparado con el 22% (38/175) del placebo. La mejoría endoscópica fue del 40% con risankizumab 600mg y 32% con risankizumab a dosis de 1200mg vs. 12% del placebo. En la otra cohorte MOTIVATE, la remisión clínica por CDAI fue del 42% con risankizumab 600mg y 40% con risankizumab 1,200mg comparado con el 20% del grupo placebo, así como también la frecuencia en las evacuaciones y dolor abdominal mejoraron en el 35% con risankizumab 600mg y 40% con risankizumab 1,200mg vs. 19% del placebo. Finalmente, la respuesta endoscópica fue del 29% con risankizumab 600mg, 34% con risankizumab 1,200mg y el 11% con placebo con diferencias significativas en todas las comparaciones de los grupos de risankizumab comparado con placebo95.
En el estudio FORTIFY es la fase de mantenimiento con risankizumab en pacientes con EC en donde se reportaron mejor remisión clínica por CDAI en el 52% y mejoría endoscópica en el 47% en el grupo de risankizumab de 360mg comparado con placebo. Se observaron mejores tasas de remisión clínica y respuesta endoscópica con la dosis de 180mg subcutánea con la dosis de 180mg pero no con la frecuencia en las evacuaciones y dolor abdominal con respecto al grupo placebo (p=0.124). Los eventos adversos fueron similares en todos los grupos96.
50. Upadacitinib es una terapia eficaz y segura en pacientes con EC con actividad moderada a grave que han sido refractarios e intolerantes a la terapia convencional y biológica incluyendo anti-TNF, antiintegrinas y antiinterleucinas. Porcentaje de acuerdo: 100% Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
En un ensayo clínico controlado fase 3 el cual incluyó dos cohortes (U-EXCEL y U-EXCEED) en donde se incluyeron pacientes con EC moderada a grave quienes recibieron 45mg de upadacitinib por vía oral y placebo. Los resultados mostraron una mejoría significativa de los pacientes que recibieron 45mg de upadacitinib comparado con placebo en cuanto a remisión clínica (en U-EXCEL, 49.5% vs. 29.1%; en U-EXCEED, 38.9% vs. 21.1%) y respuesta endoscópica (en U-EXCEL, 45.5% vs. 13.1%; en U-EXCEED, 34.6% vs. 3.5%) (p <0.001 para todas las comparaciones). A la semana 52, en la cohort U-ENDURE, un alto porcentaje de pacientes presentaron remisión clínica con 15mg de upadacitinib (37.3%) vs. 30mg de upadacitinib (47.6%) y placebo (15.1%) así como alto porcentaje de respuesta endoscópica con 15mg de upadacitinib (27.6%), 30mg de upadacitinib (40.1%) y placebo (7.3%) (p <0.001 para todas las comparaciones). Los eventos adversos fueron similares en los tres grupos a excepción de la infección por herpes zóster que fueron más frecuentes en los dos grupos de upadacitinib 15 y 30mg así como las alteraciones en la función hepática y neutropenia se presentaron más frecuentemente en el grupo de upadacitinib en la dosis de 30 mg97.
Módulo 5. Tratamiento quirúrgico incluyendo la enfermedad perianal51. Existen varios factores en la EC asociados al tratamiento quirúrgico como: edad temprana al diagnóstico, la localización ileal, enfermedad perianal, fenotipo estenosante o penetrante, el tabaquismo actual, tratamiento con corticoesteroides al momento del diagnóstico o dependencia a los corticoesteroides y enfermedad extensa. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
EC puede requerir tratamiento quirúrgico en algunos casos. Varios factores han sido asociados con la necesidad de cirugía en pacientes con EC. Estos factores incluyen:
- 1.
Edad temprana al diagnóstico: se ha observado que los pacientes diagnosticados con EC a una edad más temprana tienen un mayor riesgo de requerir cirugía en comparación con aquellos diagnosticados más tarde en la vida98.
- 2.
Localización ileal: la afectación del intestino delgado, específicamente la localización ileal, se ha relacionado con un mayor riesgo de necesitar cirugía en pacientes con EC99.
- 3.
Enfermedad perianal: la presencia de enfermedad perianal, que incluye fisuras anales, fístulas y abscesos, se ha asociado con un mayor riesgo de requerir cirugía en pacientes con EC100.
- 4.
Fenotipo estenosante o penetrante: los pacientes con EC que presentan un fenotipo estenosante (estrechamiento del intestino) o penetrante (formación de fístulas) tienen un mayor riesgo de necesitar cirugía.
- 5.
Tabaquismo actual: fumar tabaco se ha identificado como un factor de riesgo para la progresión de la enfermedad y la necesidad de cirugía en pacientes con EC100.
- 6.
Tratamiento con corticoesteroides al momento del diagnóstico o dependencia a los corticoesteroides: el uso prolongado de corticoesteroides para el tratamiento de la EC, especialmente al momento del diagnóstico o como dependencia a largo plazo, se ha asociado con un mayor riesgo de requerir cirugía101.
- 7.
Enfermedad extensa: la afectación de múltiples segmentos del tracto gastrointestinal se ha relacionado con un mayor riesgo de necesitar cirugía en pacientes con EC102.
Estos factores pueden ayudar a identificar a los pacientes con EC que podrían tener un mayor riesgo de requerir tratamiento quirúrgico. Sin embargo, es importante tener en cuenta que cada paciente es único y la decisión de realizar una cirugía debe basarse en una evaluación integral de la condición de cada individuo.
52. La cirugía de urgencia está indicada en obstrucción intestinal completa o que no responda a manejo conservador, ante la sospecha de isquemia intestinal o peritonitis. La cirugía es la opción preferida en pacientes con EC ileocecal localizada (estenosis cortas no candidatas a tratamiento endoscópico), con síntomas obstructivos, pero sin evidencia significativa de inflamación activa. Porcentaje de acuerdo: 100% Calidad de la evidencia: D. Débil a favor de la intervención: 2.
La estenosis intestinal ocurre con frecuencia en el curso de la EC. La obstrucción aguda del intestino delgado generalmente se presenta con náuseas/vómitos incontrolables, distensión abdominal y ausencia de canalización de gases o heces. En ausencia de peritonitis, el manejo conservador es la opción preferida, que incluye reposo intestinal, descompresión gástrica y terapia intravenosa con líquidos. En presencia de enfermedad inflamatoria activa, se debe considerar el uso de esteroides intravenosos103,104. El manejo conservador primario permite optimizar el estado nutricional e inmunosupresor antes de una cirugía potencial105.
Por otro lado, cuando los signos clínicos o radiológicos indican una perforación intestinal, se requiere cirugía de emergencia y resección del segmento intestinal afectado. Se recomienda encarecidamente la valoración quirúrgica temprana para evaluar la indicación quirúrgica y monitorear conjuntamente el curso clínico del paciente ante un tratamiento conservador. Los episodios de obstrucción subaguda del intestino delgado tienden a recurrir con el tiempo; por lo tanto, el asesoramiento quirúrgico es importante en el contexto de la atención interdisciplinaria y la discusión de las opciones de tratamiento103.
Las directrices de la European Crohn's and Colitis Organisation (ECCO), han declarado que la resección (laparoscópica) es la opción preferida en pacientes con EC ileocecal localizada con síntomas obstructivos, pero sin inflamación activa103.
En un ensayo multicéntrico se compararon 143 pacientes con EC activa no estenosante que involucraba menos de 40cm del íleon terminal y en los que había fracasado la terapia convencional. Estos pacientes fueron asignados al azar para recibir infliximab o resección ileocecal laparoscópica. No hubo diferencia en el resultado primario de calidad de vida según el Cuestionario de Enfermedad Inflamatoria Intestinal (IBDQ) a los 12 meses, ni en la calidad de vida general medida por el cuestionario de calidad de vida SF-36. Sin embargo, los pacientes sometidos a cirugía obtuvieron una puntuación 3.1 puntos mejor (IC 95%: 4.2-6.0) en la subescala física de este cuestionaria. No hubo diferencias en las complicaciones graves entre los grupos médico y quirúrgico. Durante un seguimiento de cuatro años, el 37% de los pacientes tratados con infliximab requirieron resección, mientras que el 26% de los pacientes sometidos a resección inicial recibieron infliximab. Por lo tanto, la resección laparoscópica tanto de la enfermedad estenosante y fibrosa del íleon terminal como de un íleon terminal con enfermedad activa (< 40cm) se puede ofrecer como una opción terapéutica sólida en un contexto interdisciplinario, con un perfil de beneficios y riesgos comparable al tratamiento médico106.
53. Se recomienda el control preoperatorio de la sepsis previo a la cirugía abdominal por EC. La sepsis pélvica y la EC perianal refractarias a las intervenciones médicas o quirúrgicas pueden controlarse mediante un estoma de derivación. Sin embargo, la tasa de curación de la fístula y la tasa de cierre del estoma son limitadas. Porcentaje de acuerdo: 100%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
La calidad de la evidencia para el uso de un estoma de derivación en la EC perianal es baja y no se han realizado ensayos controlados aleatorizados que comparen la estoma de derivación con otras intervenciones quirúrgicas o médicas. Existen varias series de casos pequeñas y heterogéneas con diferentes tipos de estoma y definiciones de éxito107–109. Un metaanálisis que incluyó a 556 pacientes reportó una respuesta clínica en el 63.8% de los pacientes110. La respuesta clínica fue similar tanto en la era previa a la terapia biológica como en la era de los tratamientos biológicos, tanto en pacientes que no respondieron a terapia biológica como en aquellos que no los recibieron105,106. Se intentó la restauración del tránsito intestinal en el 34.5% de los pacientes, pero solo tuvo éxito en el 16.6%. La ausencia de afectación rectal estuvo consistentemente asociada con una mayor posibilidad de restitución del tránsito intestinal. Además, aproximadamente una cuarta parte de los pacientes a los que se les revirtió la estoma requirieron una nueva derivación debido a una recurrencia grave de la enfermedad. En última instancia, el 41.6% de los pacientes que tuvieron una derivación temporal fallida requirieron una proctectomía. Se han reportado resultados similares en un estudio posterior unicéntrico que incluyó 77 pacientes, de los cuales 57 recibieron tratamiento con terapia biológica de manera concomitante. Aquí, la restitución exitosa del tránsito intestinal fue algo mayor (27%) y alcanzó el 48% en ausencia de enfermedad perianal activa. La calidad de vida no se discutió en ninguno de los estudios. A pesar de la baja evidencia y la baja tasa de cicatrización de las fístulas, la estoma de derivación puede ofrecer una alternativa a la resección extensa o la proctectomía y permitir tiempo para que el paciente aceote o asimile la confección de un estoma permanente.
El control de la sepsis pélvica es multidisciplinario y requiere la intervención de radiología intervencionista, infectología, gastroenterología y cirugía de colon y recto. El soporte nutricional es clave para obtener resultados óptimos en este contexto, especialmente si se crea un estoma. La imagenología (RM pélvica o endosonografía), el drenaje rápido mediante colocaciones de setón, el inicio de terapia antimicrobiana, el tratamiento médico intensificado para el control de la enfermedad son los pilares del tratamiento. En casos de control deficiente de la sepsis, un estoma de derivación puede proporcionar alivio y permitir la optimización clínica antes de realizar un procedimiento quirúrgico111.
54. Se recomienda como primera línea de tratamiento el drenaje de los abscesos intraabdominales bien definidos y accesibles por vía percutánea guiada por imagen. Después de un drenaje percutáneo exitoso, se puede considerar el manejo médico sin cirugía. Se recomienda no retrasar el tratamiento quirúrgico en caso de que el manejo médico no sea exitoso. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
El drenaje percutáneo (DP) se recomienda como tratamiento principal para los abscesos uniloculares bien definidos cuando son accesibles mediante radiología intervencionista, y se han informado tasas de drenaje exitoso del 74% al 100%112. El DP bajo guía ecográfica o tomográfica es un procedimiento seguro con una baja tasa de complicaciones. Cuando es exitoso, el DP puede evitar la cirugía de emergencia posterior en el 14% al 85% de los pacientes con abscesos intraabdominales relacionados con la EC113,114. Existe una evidencia limitada sobre el manejo óptimo de pacientes con EC que tienen abscesos intraabdominales y han sido sometidos a DP. En particular, se desconoce el momento óptimo para la intervención quirúrgica después del drenaje del absceso. Hasta el 30% de los pacientes pueden evitar la cirugía después de un exitoso DP110. La identificación de aquellos que pueden ser tratados sin cirugía adicional es desafiante y actualmente se basa en el juicio clínico en lugar de la evidencia. Sin embargo, se debe considerar la cirugía electiva después de controlar o resolver la sepsis mediante DP y terapia antimicrobiana, ya que la recurrencia del absceso es hasta 6.5 veces mayor después del DP como terapia única que después del DP seguido de una resección quirúrgica. La enfermedad refractaria al tratamiento médico, la presencia de estenosis o una fístula enterocutánea, ya sea establecida de forma primaria o como consecuencia del DP, aumentan la probabilidad de cirugía. Por otro lado, la cirugía de emergencia sin un DP previo y control de la sepsis se asocia con una mayor tasa de complicaciones y estoma en comparación con el DP inicial seguido de cirugía115. Un DP exitoso se puede considerar como un puente hacia la cirugía electiva, permitiendo la optimización nutricional y médica y, por lo tanto, mejorando los resultados posoperatorios111,112.
El control de los abscesos intraabdominales se asemeja al enfoque para la sepsis pélvica, involucrando radiología intervencionista, infectología, gastroenterología y cirugía de colon y recto, junto con el soporte nutricional. El monitoreo frecuente y la consulta quirúrgica son críticos. Afortunadamente, en la mayoría de los casos se puede posponer la cirugía. El manejo definitivo no quirúrgico puede ser exitoso, pero debe valorarse cuidadosamente y discutirse con el paciente individualmente116.
55. El uso preoperatorio de corticoesteroides se asocia con un mayor riesgo de complicaciones posoperatorias. La reducción preoperatoria de las dosis de corticoesteroides puede reducir las complicaciones posoperatorias, pero debe controlarse cuidadosamente para evitar una recaída de la enfermedad. Se debe considerar la construcción de un estoma temporal si los esteroides no se pueden retirar o reducir significativamente antes de la cirugía. Porcentaje de acuerdo: 100%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
El tratamiento con 20mg de prednisolona diarios, o su equivalente, durante más de seis semanas es un factor de riesgo reconocido para complicaciones quirúrgicas e hiperglucemia, según se informa en las directrices de la ECCO103,117. Esto ha sido ampliamente documentado, aunque no se han realizado grandes ensayos clínicos aleatorizados dedicados específicamente a este tema. Dos metaanálisis de estudios prospectivos y retrospectivos, que incluyeron a 1,714 pacientes con EII118 y a 3,807 pacientes con EC119, informaron un aumento de hasta el doble de las infecciones del sitio quirúrgico en pacientes que recibían esteroides. Se observó un aumento de las complicaciones quirúrgicas cuando se utilizaban dosis de entre 10mg y 40mg de prednisolona diarios durante más de tres a seis semanas, y recomiendan reducir gradualmente los esteroides siempre que sea posible antes de la cirugía. Por otro lado, los tiopurinas pueden continuarse de manera segura perioperatoriamente103,117–122. Un procedimiento quirúrgico en etapas con un estoma temporal puede considerarse cuando no es posible reducir dosis altas de esteroides (cirugía de emergencia) y/o cuando están presentes otros factores de riesgo (por ejemplo, sepsis, desnutrición, tabaquismo). Por último, hay poca evidencia que respalde la práctica común de administrar dosis de estrés de esteroides perioperatoriamente para pacientes que reciben corticoesteroides a largo plazo, en lugar de continuar con la dosis preoperatoria, convertida a equivalentes intravenosos cuando sea necesario123. Dos pequeños ensayos clínicos aleatorizados (37 pacientes) y cinco estudios de cohorte (462 pacientes) no demostraron ningún beneficio de la administración de dosis de estrés de esteroides. La evaluación del eje hipotalámico-hipofisario-adrenal puede considerarse de manera individual para evaluar la supresión adrenal124.
56. Se debe realizar una evaluación nutricional preoperatoria a todos los pacientes con EC que requieran tratamiento quirúrgico. Se recomienda la optimización nutricional previa a la cirugía, con nutrición enteral o parenteral, en aquellos pacientes en los que se identifiquen deficiencias nutricionales. Porcentaje de acuerdo: 100%. Calidad de la evidencia: C Débil a favor de la intervención: 2.
Las deficiencias nutricionales son comunes en los pacientes con EC que requieren cirugía. La inflamación de la mucosa intestinal persistente o recurrente, las fístulas entericas o estenosis, la diarrea crónica y los efectos secundarios de los medicamentos ponen en riesgo el estado nutricional, lo cual a su vez es un factor importante en los desenlaces médicos y quirúrgicos125,126. Aunque faltan ensayos clínicos aleatorizados, los centros de referencia en EII han integrado desde hace mucho tiempo el soporte nutricional en equipos multidisciplinarios.
Estudios observacionales han demostrado que la optimización preoperatoria en pacientes desnutridos mejora los resultados. En un metanálisis en el que se incluyeron 1,111 pacientes con EC que recibieron suplementación enteral o parenteral preoperatoria en comparación con la atención estándar, la suplementación nutricional preoperatoria redujo las complicaciones posoperatorias (20% vs. 61.3%, RM 0.26, IC 95% 0.07-0.99; p <0.001). En particular, la nutrición enteral condujo a una morbimortalidad posoperatoria notablemente reducida (21.9% vs. 73.2%, RM 0.09, IC 95% 0.06-0.13, p <0.01) con un número necesario para tratar de dos. La nutrición parenteral basada en objetivos debe considerarse siempre que la nutrición enteral se vea obstaculizada127.
57. La evidencia actual sugiere que el tratamiento preoperatorio con terapia anti-TNF, vedolizumab o ustekinumab no aumenta el riesgo de complicaciones posoperatorias en pacientes con EC sometidos a cirugía abdominal. Suspender la terapia biológica antes de la cirugía no es obligatorio. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
Terapia anti-TNFEl uso de terapia biológica en pacientes con EC programados para cirugía ha sido motivo de controversia. Se planteó la preocupación de que al modular la respuesta inmunitaria, los medicamentos biológicos pudieran aumentar las infecciones del sitio quirúrgico y la morbilidad. Algunas directrices recientes aún advierten contra el uso de terapia anti-TNF en este contexto; sin embargo, se desconoce el periodo más seguro para su suspensión103.
El metaanálisis más reciente sobre este tema incluyó 18 estudios controlados no aleatorizados en el que se tomaron en consideración 1,407 pacientes que recibían infliximab y 4,589 que no lo recibían128. No se encontraron diferencias en la aparición de complicaciones entre los pacientes que recibían infliximab y los que no lo recibían: RM para complicaciones mayores 1.41, IC 95% 0.85-2.34; RM para complicaciones menores 1.14, IC 95% 0.81-1.61; RM para complicaciones infecciosas 1.23, IC 95% 0.87-1.74; RM para complicaciones no infecciosas 1.06, IC 95% 0.88-1.28; RM para reingreso 1.46, IC 95% 0.8-2.66. Esto también fue aplicable para la necesidad de reintervención quirúrgica y la mortalidad consideradas como eventos por separado o incluidas en las complicaciones mayores.
Los resultados del estudio prospectivo denominado PUCCINI, que incluyó a 955 pacientes con EII, mostraron que la exposición a la terapia anti-TNF, incluida la medición de los niveles de medicamento, no tuvo efecto en la aparición de ninguna infección del sitio quirúrgico o fuga anastomótica129.
VedolizumabLos datos iniciales, incluido un análisis retrospectivo multicéntrico que comparó los resultados posoperatorios de 146 pacientes que recibieron vedolizumab en comparación con 289 pacientes que recibieron terapia anti-TNF, revelaron una tasa significativamente mayor de infecciones del sitio quirúrgico después de cirugía abdominal en pacientes que recibieron vedolizumab130. Sin embargo, el metaanálisis más reciente, que comparó a 307 pacientes con EII tratados con vedolizumab en comparación con 490 pacientes con terapia anti-TNF y 535 pacientes no expuestos a terapia biológica preoperatoria, no encontró diferencias en las complicaciones infecciosas y generales posoperatorias (RR 0.99 y 1.00, respectivamente) entre los pacientes tratados con vedolizumab y los pacientes sin terapia biológica. Se observó un resultado similar al comparar a los pacientes tratados con vedolizumab con aquellos tratados con terapia anti-TNF para la aparición de complicaciones infecciosas y generales posoperatorias (RR 0.99 y 0.92, respectivamente)131. Aunque se necesitan estudios más grandes y aleatorizados que incluyan el monitoreo perioperatorio de medicamentos, el tratamiento con vedolizumab parece ser seguro en el contexto quirúrgico.
UstekinumabDos estudios retrospectivos de cohortes multicéntricas compararon a pacientes con EC expuestos preoperatoriamente a ustekinumab (durante tres a seis meses) con aquellos que recibieron terapia anti-TNF (seguimiento hasta seis meses después de la cirugía). En el análisis univariado, se observó que los pacientes tratados con ustekinumab tenían más probabilidades de requerir la confección de un estoma (70% vs. 12.5%; p <0.001), recibir terapia combinada (25% vs. 2.5%; p=0.01) y ser reoperados (16% vs. 5%; p=0.01)132,133. Sin embargo, no se observaron aumentos en las complicaciones posoperatorias tempranas o tardías en el análisis multivariado al comparar los resultados quirúrgicos de esos 60 pacientes tratados con ustekinumab con 209 pacientes que recibieron terapia anti-TNF132,133. Nuevamente, se necesitan estudios de mejor diseño y con un mayor número de pacientes para confirmar estos resultados.
58. La dilatación endoscópica con balón o la cirugía son opciones de tratamiento viables en pacientes con EC con estenosis fibróticas cortas (< 5cm) a nivel del íleon terminal. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B Débil a favor de la intervención: 2.
Aunque las estenosis cortas sintomáticas son frecuentes en pacientes con EC, no se ha realizado ningún ensayo clínico aleatorizado que compare la cirugía con la dilatación endoscópica con balón. El estudio más grande que ha abordado los beneficios y riesgos de la dilatación con balón es un análisis conjunto publicado en 2017 por Bettenworth et al., mismo que incluyó 1,493 pacientes que se sometieron a un total de 3,213 dilataciones endoscópicas con balón134. Un 98.6% de las estenosis eran ileales y el 62% eran anastomóticas. La tasa de éxito técnico primario (paso del endoscopio a través de la estenosis) fue del 89.1% y del 80.8% para la eficacia clínica (ausencia de síntomas al final del seguimiento). Se produjeron complicaciones (perforación y/o sangrado) en el 2.8% de los procedimientos. A pesar de la alta tasa de éxito inicial, el 73.5% de los pacientes requirieron una nueva dilatación en un plazo de 24 meses y el 42.9% necesitaron una resección quirúrgica. Resultados similares se reportaron en una revisión sistemática realizada por Morar et al., que analizaron a 1,089 pacientes y 2,664 dilataciones, y reportó una tasa de éxito técnico del 90.6% y una tasa de éxito clínico del 70.2%. Las complicaciones ocurrieron en el 6.4% de las dilataciones con balón. A los cinco años de seguimiento, el 75% de los pacientes se había sometido a cirugía135. No hubo diferencias en los resultados cuando se dilataron estenosis primarias o anastomóticas. Estudios observacionales recientes han revelado resultados comparables136–138. Por lo tanto, la dilatación endoscópica con balón tanto de estenosis cortas primarias como anastomóticas en la EC parece ser segura y efectiva a corto plazo. Sin embargo, la recurrencia es común y la necesidad de cirugía es frecuente en los siguientes cinco años.
59. Las estricturoplastias son una opción segura para tratar las estenosis del intestino delgado relacionadas con la EC. La estricturoplastia puede ser preferible a la resección de segmentos largos de intestino, con una reducción potencial de las tasas de recurrencia quirúrgica. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
La estricturoplastia es una opción quirúrgica establecida y segura para tratar las estenosis relacionadas con la EC y es una alternativa a la resección intestinal139,140. Se recomienda realizar una estricturoplastia siempre que sea razonable y técnicamente factible, especialmente en casos de múltiples estenosis fibrosas que requerirían una resección intestinal más extensa103,141. Un metaanálisis en el que se incluyeron un total de 1,112 pacientes que se sometieron a 3,259 estricturoplastias (81% técnica de Heineke-Mikulicz, 10% técnica de Finney, 5% anastomosis latero-lateral isoperistáltica) antes de la era de la terapia biológica reveló una tasa de recurrencia a los cinco años del 28%142. La técnica de Heineke-Mikulicz es preferible para segmentos estenóticos de hasta 6-8cm, mientras que las técnicas de Finney y latero-lateral isoperistáltica se utilizan para tratar estenosis más largas o múltiples143. La morbimortalidad quirúrgica oscila entre el 8% y el 15% y no está relacionada con la longitud de la estenosis143,144. Se han reportado resultados favorables a largo plazo140,143,144 y sugieren mejores resultados con la estricturoplastia en comparación con la resección intestinal. Una gran serie japonesa que incluyó a 526 pacientes, de los cuales 435 se sometieron sólo a resecciones intestinales y 91 tuvieron un total de 199 estricturoplastias; a los 10 años, la tasa acumulativa de reintervención quirúrgica en el sitio de la anastomosis fue del 18% en comparación con el 7% en el sitio de la estricturoplastia (p <0.01)145.
Cuando sea posible, la cirugía electiva es preferible a un procedimiento de emergencia en casos de obstrucción aguda del intestino delgado debido a una estenosis por EC. Esto se puede lograr en la mayoría de los casos con un manejo conservador primario, como la hidratación por vía endovenosa y la descompresión nasogástrica. Debe seguirse una discusión interdisciplinaria de las opciones de tratamiento, que también debe incluir las opiniones del paciente. Cuando la cirugía se vuelve necesaria, es importante evaluar minuciosamente el intestino, idealmente mediante una enterografía por RM nuclear (RMN) antes de realizar el procedimiento quirúrgico. La RMN puede revelar una distinción entre estenosis inflamatorias (susceptibles de ser tratadas con terapia médica intensificada) y estenosis fibrosas. La evaluación del intestino durante la cirugía también puede ser muy útil para identificar los sitios de estenosis. Para maximizar la preservación del intestino, el cirujano especialista en EII debe estar familiarizado con los diferentes tipos de estrictraloplastias, incluidas las estrictraloplastias no convencionales. Sin embargo, no se recomienda la estrictraloplastia del colon103,146.
60. La resección laparoscópica en pacientes con EC ileocecal limitada, no estenosante (que involucra <40cm del íleon terminal) es una alternativa razonable a la terapia anti-TNF en especial con infliximab. Porcentaje de acuerdo: 100%. Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Como se ha mencionado anteriormente, en un ensayo clínico que se llevó a cabo en múltiples centros en Europa, se compararon 143 pacientes que padecían EC activa, pero no estenosante que afectaba menos de 40cm del íleon terminal y que no habían respondido a tratamientos convencionales. Estos pacientes se dividieron aleatoriamente en dos grupos: uno que recibió infliximab y otro que se sometió a una resección ileocecal laparoscópica. Los resultados principales de este estudio, que incluyeron la evaluación de la calidad de vida a los 12 meses mediante el IBDQ y de la calidad de vida general mediante el Cuestionario SF-36, no mostraron diferencias significativas entre los dos grupos. Sin embargo, se observó que los pacientes que se sometieron a la cirugía obtuvieron una puntuación 3.1 puntos mayor en la subescala física de este cuestionario, con un IC 95% de 4.2 a 6.0 puntos. Además, las tasas de complicaciones graves no difirieron entre los grupos médicos y quirúrgicos. Durante un seguimiento promedio de cuatro años, el 37% de los pacientes tratados con infliximab finalmente necesitó una resección, mientras que el 26% de los pacientes sometidos inicialmente a resección recibieron infliximab en algún momento106.
En un estudio de costo-efectividad, cuyo objetivo principal era determinar la rentabilidad de la resección ileocecal laparoscópica en comparación con el tratamiento con infliximab en pacientes con EC en el íleon terminal que no habían respondido adecuadamente al tratamiento convencional, se llevó a cabo un ensayo clínico aleatorizado en 29 centros médicos ubicados en los Países Bajos y el Reino Unido. En este ensayo, se incluyeron pacientes adultos con EC en el íleon terminal que no habían experimentado una mejoría significativa después de recibir tratamiento con inmunomoduladores o esteroides durante más de tres meses y que no mostraban signos de estenosis críticas. Estos pacientes se asignaron aleatoriamente para someterse a una resección ileocecal laparoscópica o para recibir infliximab. Los resultados se midieron en términos de años de vida ajustados por calidad (AVAC), utilizando los cuestionarios EuroQol (EQ) 5D-3L y el IBDQ. Los resultados principales del estudio de costo-efectividad mostraron que los costes directos de atención médica por paciente con EC durante el primer año fueron significativamente menores en el grupo de resección ileocecal laparoscópica en comparación con el grupo de infliximab, con una diferencia media de €-8,931 (IC 95% €-12,087 a €-5,097). Además, aunque la diferencia no fue estadísticamente significativa, los costos totales desde una perspectiva societal tendieron a ser más bajos en el grupo de resección, con una diferencia media de €-5,729 (IC 95% €-10,606 a €172). En términos de rentabilidad, se encontró que la probabilidad de que la resección fuera una opción rentable en comparación con el infliximab fue alta en diferentes niveles de disposición a pagar por mejoras en la calidad de vida. Esta probabilidad fue del 0.96 con una disposición a pagar de €0 por AVAC ganado y por mejora en la puntuación del IBDQ, y aumentó al 0.98 con una disposición a pagar de €20,000 por AVAC ganado y al 0.99 con una disposición a pagar de €500 por punto de mejora en la puntuación del IBDQ147.
En un estudio de seguimiento retrospectivo, se evaluaron las consecuencias a largo plazo de dos modalidades de tratamiento para pacientes con EC ileocecal no estenosante y refractaria a inmunomoduladores: la resección ileocecal laparoscópica y el uso de infliximab. El análisis se basó en un conjunto de datos de 134 pacientes, de los cuales 69 fueron asignados al grupo de resección y 65 al grupo de infliximab, con un seguimiento promedio de 63.5 meses. En el grupo de resección intestinal, se observó que un 26% de los pacientes requirió iniciar terapia anti-TNF, sin embargo, ninguno de ellos necesitó una segunda resección durante el periodo de seguimiento. De manera interesante, un 42% de los pacientes en este grupo lograron mantenerse sin necesidad de medicamentos adicionales relacionados con la EC, aunque cabe destacar que el 48% de estos pacientes recibieron terapia inmunomoduladora profiláctica. En contraste, en el grupo de infliximab, un 48% de los pacientes tuvo que someterse a una resección relacionada con la EC, mientras que el resto mantuvo, modificó o intensificó su terapia con infliximab. Se encontró que la duración del efecto del tratamiento fue comparable en ambos grupos, con un tiempo promedio sin necesidad de tratamiento adicional relacionado con la EC de 33.0 meses en el grupo de resección y 34.0 meses en el grupo de infliximab, sin diferencias estadísticamente significativas (p de log-rank=0.52). Un hallazgo importante fue que, en ambos grupos, el uso de un inmunomodulador adicional al tratamiento asignado se asoció con una prolongación significativa en la duración del efecto terapéutico. En el grupo de resección, el CR fue de 0.34, mientras que en el grupo de infliximab fue de 0.49, lo que indica que esta terapia coadyuvante influyó positivamente en el resultado clínico a largo plazo148.
61. La colectomía segmentaria es el tratamiento quirúrgico apropiado para pacientes con un solo segmento colónico afectado en la EC. Porcentaje de acuerdo: 100%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
Cuando se enfrenta una situación en la que solo un segmento del colon está afectado, se recomienda llevar a cabo una colectomía segmentaria. Sin embargo, cuando varios segmentos del colon se ven comprometidos, la opción preferida generalmente es realizar una colectomía subtotal. Un metaanálisis realizado por Tekkis et al.149 compararon los resultados de 223 colectomías subtotal/total con anastomosis ileorrectal y 265 colectomías segmentarias para tratar la EC colónica. Aunque no se encontraron diferencias significativas en las tasas de recurrencia, complicaciones y la necesidad de un estoma permanente, se observó que la recurrencia ocurrió en promedio 4.4 años más tarde en los casos de colectomía subtotal/total, y esto resultó ser estadísticamente significativo (p <0.001).
En otro metaanálisis más reciente realizado por Angriman et al., se evaluaron 1,436 pacientes sometidos a diferentes procedimientos quirúrgicos para tratar la EC en el colon. Se encontró que las complicaciones eran más frecuentes después de la colectomía segmentaria en comparación con la colectomía subtotal. Esto sugiere que, en términos de seguridad, la colectomía subtotal podría ser la opción preferida. No obstante, la colectomía segmentaria resultó en una menor probabilidad de requerir un estoma permanente en comparación con la colectomía subtotal150. En lo que respecta a la recurrencia de la EC, se observó que la colectomía subtotal presentaba un mayor riesgo de recurrencia y de necesidad de tratamiento quirúrgico de repetición en comparación con una proctocolectomía total. Sin embargo, no se encontraron diferencias significativas en cuanto a la recurrencia entre la colectomía segmentaria y la colectomía subtotal151.
En situaciones excepcionales en las que dos segmentos distintos del colon se ven afectados, podría considerarse la posibilidad de realizar dos resecciones segmentarias en lugar de optar por una colectomía subtotal103. La determinación de la extensión de la resección del colon se basa en la situación clínica, que puede ser una cirugía planificada o de emergencia, y en el número de segmentos del colon afectados. En la medida en que sea factible, se prefiere llevar a cabo una colectomía segmentaria146.
62. Las anastomosis mecánicas latero-laterales ileocólicas o de intestino delgado se asocian con tasas más bajas de complicaciones posoperatorias que las anastomosis término-terminales en la EC. La anastomosis de Kono-S y la resección extendida de mesocolon son técnicas quirúrgicas promisorias para evitar la recurrencia posquirúrgica en la EC. Porcentaje de acuerdo: 100%. Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Los aspectos técnicos en cirugía son fundamentales y pueden verse afectados por diversos factores, como la formación previa del cirujano, su experiencia, la disponibilidad de recursos y la situación clínica del paciente. La elección de la técnica de anastomosis óptima en las resecciones del intestino delgado e ileocólicas ha sido objeto de debate. En los últimos 10 años, ha surgido evidencia que respalda cada vez más la preferencia por una anastomosis latero-lateral, y esta evidencia se ha consolidado con el tiempo.
Un metaanálisis realizado por Simillis et al., que incluyó a 661 pacientes, reveló que la tasa de fugas anastomóticas era significativamente mayor en las anastomosis término-terminales en comparación con las anastomosis latero-laterales (RM 4.37; p=0.02), incluso cuando se enfocaba en el subgrupo de anastomosis ileocólicas (RM 3.8; p=0.05). Como resultado de esta diferencia, las complicaciones posoperatorias en general también fueron más frecuentes (RM 2.64; p <0.001), y la duración de la estancia hospitalaria fue considerablemente más larga (2.81 días adicionales; p=0.007) cuando se realizaba una anastomosis término-terminal151.
En un metaanálisis posterior liderado por Guo et al., se reafirmó la superioridad de la anastomosis latero-lateral en comparación con otras configuraciones en términos de complicaciones posoperatorias en general (RM 0.6; p=0.01). Sin embargo, no se observaron diferencias estadísticamente significativas en la tasa de fugas anastomóticas, la recurrencia endoscópica y sintomática, ni en la necesidad de una reintervención debido a la recurrencia152.
Otro metaanálisis llevado a cabo por He et al., compararon 396 casos de anastomosis latero-lateral mecánica y 425 casos de anastomosis término-terminales manuales. Los resultados mostraron que las anastomosis latero-lateral mecánicas fueron superiores en todos los aspectos analizados: complicaciones posoperatorias en general (RM 0.54, IC 95% 0.32–0.93), tasa de fugas anastomóticas (RM 0.45, IC 95% 0.20–1.00), recurrencia (RM 0.20, IC 95% 0.07–0.55) y necesidad de reintervención debido a la recurrencia (RM 0.18, IC 95% 0.07–0.45)153.
Un metaanálisis en red que englobó datos de 11 ensayos clínicos y 1,113 pacientes confirmó la superioridad de la anastomosis latero-lateral mecánica en términos de complicaciones posoperatoria en general, recurrencia clínica y necesidad de reintervención debido a la recurrencia. En cuanto a la tasa de fugas anastomóticas, infecciones en el sitio quirúrgico, mortalidad y duración de la estancia hospitalaria, no se observaron diferencias significativas asociadas a la elección de la técnica de anastomosis154.
Recientemente, el mesenterio ha sido reconocido como un órgano inmune activo que podría desempeñar un papel en la fisiopatología de la EC155. Se han desarrollado dos técnicas con el objetivo de reducir la influencia del mesenterio en la EC luminal. La anastomosis Kono-S (AKS), tal como la describió Kono et al. en 2011, es una anastomosis manual latero-lateral antimesentérica con un lumen intestinal amplio156,157. Un ensayo clínico reciente (CD-SuPREMe) mostró que la AKS, en comparación con la anastomosis latero-lateral mecánica, se asoció con un menor riesgo de recurrencia endoscópica posterior a la cirugía, con una recurrencia grave (Rutgeerts ≥ i2) que ocurrió en un 18% vs. 30% después de dos años153. Posteriormente, Coffey et al.158 describieron la extirpación mesentérica extendida (EME). En una serie de casos prospectiva, en comparación con controles históricos, encontraron que la recurrencia quirúrgica fue menor después de la EME (2.9% vs. 40%)159.
Un metaanálisis se enfocó en evaluar estas dos técnicas quirúrgicas innovadoras, la AKS y la EME, con el objetivo de reducir la recurrencia en pacientes sometidos a cirugía por EC. Tras revisar nueve estudios que incluyeron a un total de 896 pacientes, se observó que la AKS estaba asociada con una incidencia más baja de recurrencia endoscópica (0% vs. 3.4%) y quirúrgica (15% vs. 24.4%), así como tasas reducidas de complicaciones, especialmente en la tasa de fuga anastomótica (1.8% vs. 9.3%). No obstante, es importante destacar que el nivel de evidencia en general fue limitado (Grado IV), lo que subraya la necesidad de investigaciones adicionales. Además, se identificó que la preservación del mesenterio, un componente de la técnica Kono-S, podría tener un impacto en la recurrencia de la enfermedad, lo que resalta la importancia de considerar tanto la técnica de anastomosis como la extirpación mesentérica en futuros estudios160.
La elección de la técnica de anastomosis en cirugía en EC, particularmente en resecciones del intestino delgado e ileo-colónicas, es un aspecto crítico que puede afectar significativamente los resultados posoperatorios. Los estudios respaldan la preferencia por la anastomosis latero-lateral mecánica en cirugías de resección intestinal, ya que esta técnica se asocia con menores complicaciones posoperatoria y tasas reducidas de fugas anastomóticas. Las técnicas quirúrgicas innovadoras como la AKS y la EME son promisorias en la reducción de la recurrencia de la enfermedad, pero se requiere una mayor validación científica para confirmar estos resultados.
63. La proctocolectomía restauradora con anastomosis del reservorio ileoanal se puede considerar en pacientes seleccionados con EC pancolónica refractaria sin antecedentes de enfermedad perianal, tomando en consideración el alto riesgo de falla del reservorio. Porcentaje de acuerdo: 100%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
Varios centros especializados han compartido sus experiencias en el uso de la proctocolectomía restaurativa y la anastomosis ileo-anal (IPAA) en pacientes con EC pancolónica refractaria. Las directrices de la ECCO enfatizan las tasas más elevadas de complicaciones y fallos asociados con la IPAA en casos de EC, recomendando que esta opción se reserve para pacientes altamente motivados/empoderados y que se realice bajo la supervisión de equipos multidisciplinarios, preferiblemente cuando no existan enfermedades concurrentes en el intestino delgado y afectación perianal103.
Reese et al.161, llevaron a cabo un metaanálisis en el que se incluyeron 3,103 pacientes, de los cuales 225 se sometieron a una IPAA debido a EC (EC-IPAA). En comparación con otros pacientes, los que tenían EC-IPAA experimentaron el doble de estenosis en el sitio de anastomosis y seis veces más fallos en el reservorio (32% vs. 4.8%, p <0.01). Sin embargo, en aquellos pacientes con EC confinada al colon, no se observaron diferencias significativas en las complicaciones posoperatoria o en la tasa de fallos del reservorio (8% en pacientes con EC-IPAA vs. 7.1% en pacientes con IPAA por CUCI). Es importante destacar que los pacientes con EC colónica no presentaron más complicaciones ni un mayor índice de fallos del reservorio en comparación con los pacientes con CUCI. A pesar de esto, la función del reservorio en los pacientes con EC fue inferior (experimentaron el doble de incontinencia y urgencia), aunque la frecuencia de las deposiciones fue similar. En una serie de casos extensa, no se observaron diferencias en las puntuaciones de calidad de vida, independientemente de la razón por la que se realizó la IPAA162.
64. La cirugía de mínima invasión en la EC requiere que los cirujanos no sólo tengan experiencia en el tratamiento de la EC en cirugía abierta, sino también habilidades quirúrgicas laparoscópicas/robóticas avanzadas. Porcentaje de acuerdo: 100%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
Un metanaálisis y una revisión de Cochrane que involucraron ensayos clínicos aleatorizados163,164 no encontraron diferencias estadísticamente significativas en los resultados entre la cirugía laparoscópica y la cirugía abierta para tratar la EC en el intestino delgado. Sin embargo, un metaanálisis más reciente que incluyó tanto ensayos clínicos aleatorizados como estudios observacionales, reveló que el abordaje laparoscópico conllevaba menos complicaciones y menos casos de hernias incisionales165. Otra revisión conjunta evaluó la resección laparoscópica en casos de EC recurrente, confirmando que esta técnica es factible y segura cuando se realiza por cirujanos con la experiencia adecuada166. En este contexto, se observó que la conversión a cirugía abierta era 2.5 veces más frecuente, aunque no hubo un aumento en las complicaciones. Por lo tanto, tanto en la EC del intestino delgado en su forma primaria como recurrente, los pacientes se benefician de un abordaje laparoscópico, ya que implica menos complicaciones después de la cirugía y menos casos de hernias incisionales. En situaciones en las que no haya experiencia disponible para llevar a cabo una cirugía laparoscópica, el tratamiento quirúrgico de emergencia no debe demorarse.
El uso de una plataforma quirúrgica robótica permite una mejor visualización, un mayor control del campo quirúrgico y una mayor destreza por parte del cirujano. Una mejor visión contribuye a eliminar adherencias o resecar el intestino afectado sin dañar órganos adyacentes. Además, la aplicación de un abordaje robótico puede abordar potencialmente las limitaciones ergonómicas y visuales de la cirugía laparoscópica, especialmente en el contexto de enfermedades complejas y en espacios estrechos, como la pelvis. Además, al realizar procedimientos como la exéresis intramesorrectal o la exéresis total del mesorrecto, el uso de la tecnología robótica puede ayudar en la preservación de los nervios cercanos a lo largo del plano quirúrgico167,168. Hasta la fecha, solo ha habido algunas series de casos pequeñas que informan sobre el uso de la cirugía robótica para la EC. Aydinli et al. informaron sobre la resección ileocólica robótica, con un tiempo de recuperacion de la función intestinal más corto y un tiempo quirúrgico más largo en comparación con la laparoscopia estándar169. La cirugía robótica requiere un conjunto de habilidades y una curva de aprendizaje completamente diferentes a la cirugía abierta/laparoscópica y aumenta significativamente los costos para el paciente. Con mayor experiencia, destreza quirúrgica y avances tecnológicos continuos, estos problemas asociados con la cirugía robótica para la EC podrían mitigarse. En consecuencia, la cirugía robótica puede convertirse en un instrumento valioso para que los cirujanos gestionen eficazmente las complicaciones relacionadas con la EC. En ciertas circunstancias únicas, una combinación de técnicas robóticas y laparoscópicas puede simplificar procedimientos quirúrgicos complejos168.
A pesar de las dificultades que plantea el manejo quirúrgico de la EC la cirugía de mínima invasión se ha convertido en una opción cada vez más popular. La aparición de la cirugía de EC como un campo especializado, con cirujanos que se enfocan en el manejo quirúrgico de la EII, ha contribuido a establecer el papel óptimo de la cirugía de mínima invasión en el tratamiento de la EC. Dadas las características complejas de la cirugía de la EC, el abordaje laparoscópico debe ser utilizado cuidadosamente por cirujanos altamente experimentados. Se puede llevar a cabo un enfoque progresivo en el manejo quirúrgico de la EC, comenzando con casos menos complejos, como la EC ileal con estenosis cortas, para luego abordar casos más desafiantes, como la resección del colon, y finalmente tratando formas avanzadas de la EC, como la enfermedad recurrente o penetrante. La decisión de adoptar qué procedimiento de cirugía de mínima invasión debe tomarse caso por caso y debe depender de la experiencia del cirujano y las características del paciente.
65. En los pacientes sometidos a una intervención quirúrgica es importante estratificar el riesgo de recurrencia posquirúrgica con base en sus antecedentes e instaurar de forma pertinente el tratamiento y seguimiento posoperatorio. Porcentaje de acuerdo: 100%. Calidad de la evidencia: B. Débil a favor de la intervención: 2.
A pesar de que un número considerable de pacientes con EC requieren cirugía en algún momento de su vida, es importante entender que la cirugía no constituye una cura para esta enfermedad y que es común que los síntomas reaparezcan después de la cirugía7. Hasta un 93% de los pacientes pueden mostrar signos de recurrencia en los estudios endoscópicos dentro del primer año después de la cirugía, y alrededor del 20% al 30% experimentan síntomas recurrentes34,169–172. La necesidad de una cirugía adicional, denominada recurrencia quirúrgica, se ha observado en un 25% al 45% de los pacientes en los 10 años posteriores a su primera cirugía intestinal173.
Se ha desarrollado un sistema de puntuación conocido como el puntaje de Rutgeerts para evaluar los hallazgos endoscópicos en el área del intestino que se ha sometido a cirugía. Este puntaje ayuda a predecir la probabilidad de que ocurra una recurrencia clínica. Un puntaje bajo, como i0 o i1, indica una remisión endoscópica y se asocia con una baja probabilidad de recurrencia clínica en los siguientes tres años. Por otro lado, puntajes más altos, como i2, i3 e i4, indican recurrencia endoscópica y se asocian con mayores probabilidades de recurrencia clínica174. Diversos estudios han investigado los factores que predicen la recurrencia después de la cirugía en la EC. Estos factores incluyen el tabaquismo, cirugías intestinales previas, un tipo de enfermedad más agresivo (penetrante-fistulizante), y la afectación perianal175–178. De estos factores, el tabaquismo es el más importante y puede aumentar significativamente el riesgo de recurrencia. Dejar de fumar puede reducir este riesgo179. También se ha observado que la plexitis mientérica, una característica histológica, se asocia con enfermedad recurrente en pacientes con EC180.
Las tasas de recurrencia posoperatoria varían dependiendo de si se considera la recurrencia clínica, endoscópica o quirúrgica. La recurrencia endoscópica precede a la recurrencia clínica y es un indicativo del curso clínico de la EC. Una recurrencia endoscópica severa predice un pronóstico desfavorable34,181.
Dado el alto nivel de evidencia con respecto al riesgo de recurrencia posoperatoria en fumadores, siempre se debe promover la abstinencia del tabaco, con un asesoramiento y apoyo dedicados, antes de la resección quirúrgica. Además, siempre se debe considerar la terapia profiláctica para la EC después de la cirugía, y se recomienda iniciar el tratamiento en pacientes con al menos un factor de riesgo de recurrencia, dentro de las cuatro semanas posteriores a la cirugía117,181. Se han investigado numerosos medicamentos farmacológicos para prevenir la recurrencia endoscópica o clínica posoperatoria en la EC, con diversos perfiles de eficacia.
Las directrices más recientes de la ECCO117, la Asociación Estadounidense de Gastroenterología (AGA)34 y el Colegio Estadounidense de Gastroenterología (ACG)45 se publicaron en 2016, 2017 y 2018, respectivamente. Todas estas organizaciones coinciden en la importancia de que los pacientes dejen de fumar. Sin embargo, en cuanto a las recomendaciones sobre el uso de medicamentos, existen diferencias en cuanto a la orientación práctica y los niveles de evidencia. En pacientes con remisión inducida por cirugía de la EC, la AGA sugiere no usar 5-aminosalicilatos. La alta dosis de mesalazina es una opción en pacientes con una resección ileal aislada, según la ECCO, y también es una opción en pacientes con una resección ileal aislada y sin factores de riesgo para la recurrencia en las pautas de la ACG35,45,117. Tanto la AGA como la ECCO sugieren que los medicamentos anti-TNF y/o las tiopurinas son los más adecuados para prevenir la recurrencia después de la cirugía en pacientes con al menos un factor de riesgo34,45. Sin embargo, la ACG propone los agentes anti-TNF sobre las tiopurinas en pacientes de alto riesgo178. Además, se menciona que los antibióticos imidazoles pueden ser efectivos después de la resección ileocólica, aunque su tolerancia puede ser un problema según la ECCO. La ACG considera que estos antibióticos pueden usarse después de la resección del intestino delgado para prevenir la recurrencia, y la AGA menciona que los pacientes con menor riesgo de recurrencia o que desean evitar el riesgo de eventos adversos con tiopurinas y/o tratamiento anti-TNF pueden optar por los antibióticos nitroimidazoles durante un periodo específico35,45,117.
Finalmente, se mencionan las directrices del Instituto Nacional de Salud y Atención Sanitaria (NICE) del Reino Unido, que sugieren el uso de azatioprina en combinación con metronidazol para mantener la remisión en pacientes con EC ileocolónica que han tenido una resección completa en los últimos tres meses, y desaconsejan el uso de tratamientos biológicos en esta situación. También se destaca la rentabilidad de las tiopurinas, aunque se señala la necesidad de análisis a largo plazo para evaluar los costos de rehospitalización y cirugía recurrente182.
Debido a la eficacia de los agentes anti-TNF, se considera su uso creciente para prevenir la recurrencia después de la cirugía en la EC. En un algoritmo clínico propuesto, se dividen los pacientes en grupos según los factores de riesgo y la respuesta previa a los anti-TNF. Los anti-TNF podrían ser una opción después de la cirugía. Si previamente no hubo éxito con los anti-TNF a pesar de un manejo adecuado, se podrían considerar otras opciones como vedolizumab o ustekinumab. Dado que hay poca información sobre nuevos medicamentos biológicos, se necesita más investigación al respecto. En general, se recomienda un abordaje personalizado basado en la evaluación endoscópica y la medición de calprotectina fecal temprana. En el futuro, con el uso más común de los biológicos después de la cirugía, podríamos considerar estrategias de tratamiento de «arriba hacia abajo» en pacientes en remisión, pero esto aún necesita ser respaldado por estudios clínicos183.
66. El tratamiento médico/quirúrgico combinado para el tratamiento de la EC perianal compleja es aconsejable para controlar el foco séptico y la actividad luminal de la enfermedad. Porcentaje de acuerdo: 100%. Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Un grupo heterogéneo de estudios retrospectivos que compararon el tratamiento con anti-TNF con diversas aproximaciones quirúrgicas se combinó en un metaanálisis publicado en 2014. Los resultados de este análisis sugieren que el tratamiento combinado puede tener efectos beneficiosos adicionales en comparación con el tratamiento quirúrgico o médico por separado. Sin embargo, la heterogeneidad de los estudios incluidos, la naturaleza retrospectiva del análisis y la baja calidad de los estudios impiden llegar a conclusiones o recomendaciones firmes83.
En un estudio denominado PISA se asignó aleatoriamente a pacientes con fístulas perianales por EC de alto riesgo y un solo orificio fistuloso interno inicialmente drenado a: setón de drenaje; o anti-TNF durante un año; o plastia de avance bajo anti-TNF durante cuatro meses. El resultado principal fue la reintervención relacionada con la fístula (cirugía y/o reinicio de anti-TNF). Este ensayo clínico aleatorizado se detuvo después de incluir a 44 de los 126 pacientes planificados, basándose en un análisis de futilidad. El uso de setón de drenaje se asoció con la tasa más alta de reintervención en 1.5 años (10/15 pacientes vs. 6/15 pacientes con anti-TNF y 3/14 pacientes con plastia de avance+anti-TNF; p=0.02). No se observaron diferencias en la calidad de vida ni en el índice de actividad de la enfermedad perianal. Los autores concluyeron que el tratamiento con setón de drenaje no debería recomendarse como el único o el tratamiento superior para la fístula perianal por EC184.
En una revisión sistemática y un metaanálisis en red, se llevaron a cabo evaluaciones exhaustivas de diversas terapias biológicas en pacientes con EC fistulizante. En cuanto a la inducción de respuesta, se observó que infliximab superó a adalimumab (RM=0.24; 95% CI, 0.06-0.99), aunque no se encontraron diferencias significativas en la inducción de remisión entre ambos (RM=0.31; IC 95%, 0.04-2.27). Los antagonistas del factor de necrosis tumoral (TNF) demostraron ser superiores a un grupo de pacientes que recibieron placebo tanto en la inducción de respuesta (RM=0.51; IC 95%, 0.35-0.75) como en la inducción de remisión (RM=0.36; IC 95%, 0.22-0.58). Infliximab también mostró superioridad sobre el placebo en la inducción de respuesta (RM=0.36; IC 95%, 0.17-0.75) y la inducción de remisión (RM=0.17; IC 95%, 0.03-0.87). Ustekinumab resultó ser más efectivo que el placebo en la inducción de respuesta (RM=0.48; IC 95%, 0.26-0.86), pero no en la inducción de remisión (RM=0.50; IC 95%, 0.13-1.93). En las comparaciones entre las diferentes terapias biológicas, no se encontraron diferencias estadísticamente significativas en la inducción de remisión. Vedolizumab, por otro lado, no se destacó como superior al placebo en la inducción de remisión (RM=0.32; IC 95%, 0.04-2.29). Finalmente, certolizumab no demostró ser superior al placebo ni en la inducción de respuesta (RM=0.78; IC 95%, 0.40-1.55) ni en la inducción de remisión (RM=0.78; IC 95%, 0.40-1.55). Este estudio concluye que los antagonistas del TNF son efectivos en la inducción de respuesta y remisión en pacientes con EC fistulizante. Infliximab se destaca como la opción preferida para la inducción de respuesta. No obstante, se requiere una mayor investigación y ensayos clínicos especializados para evaluar completamente la eficacia de estas terapias en esta población de pacientes185.
En la práctica clínica, las decisiones de manejo deben ser tomadas por el gastroenterólogo y el cirujano de colon y recto, considerando la información clínica y los recursos disponibles. La cirugía desempeña un papel importante en el control de la sepsis perianal mediante la exploración bajo anestesia y el drenaje adecuado mediante la colocación de setones. Es fundamental destacar que cualquier signo de infección debe abordarse rápidamente, ya que el uso de medicamentos anti-TNF está contraindicado en presencia de sepsis activa o infección.
67. Los colgajos de avance, pegamentos de fibrina y la ligadura del trayecto interesfintérico son una opción terapéutica para pacientes seleccionados con EC y fístulas perianales complejas, aunque su eficacia es limitada. Los tapones para fístulas anales no deben considerarse de forma rutinaria para el cierre de fístulas perianales en la EC, ya que el uso de setones es igualmente eficaz. Porcentaje de acuerdo: 100%. Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Un metaanálisis agrupó datos de 135 pacientes con fístulas perianales por EC tratados con un avance de colgajo en 11 estudios retrospectivos186. En conjunto, se alcanzó una tasa de éxito del 66%. Sin embargo, es importante destacar que las definiciones de éxito y los periodos de seguimiento variaron considerablemente en estos estudios, lo que condujo a resultados heterogéneos y un nivel general de evidencia considerado bajo.
Un análisis más reciente realizado por Stellingwerf et al. evaluaron a 35 pacientes con fístulas perianales por EC y encontró una tasa de éxito del 61% con el uso de avance de colgajo. Esta tasa no mostró diferencias significativas en comparación con el procedimiento de ligadura del trayecto fistuloso interesfintérico (LIFT), que tuvo una tasa de éxito del 53%. Sin embargo, es importante tener en cuenta que las tasas de incontinencia fueron significativamente más altas en los pacientes sometidos a avance de colgajo en comparación con el LIFT, con un 7.8% vs. un 1.6%, respectivamente187. Dado que llevar a cabo un ensayo clínico aleatorizado que compare directamente el avance de colgajo con la ausencia de cirugía sería éticamente cuestionable, se enfatiza la necesidad de colaboración para reunir un mayor número de casos tratados con avance de colgajo en pacientes con EC perianal. Estos casos deben estar respaldados por definiciones claras de resultados y un seguimiento adecuado para poder establecer de manera más precisa el papel de esta técnica en el tratamiento de la EC perianal.
Se realizó un estudio para evaluar la eficacia del uso de pegamento de fibrina en el tratamiento de las fístulas perianales en pacientes con EC188. Este estudio fue un ensayo clínico de etiqueta abierta en el que se incluyeron 71 pacientes con EC. Los pacientes fueron asignados al azar para recibir la instilación de pegamento de fibrina en las fístulas o no recibir ningún tratamiento adicional después del retiro de un setón. Los resultados del estudio mostraron que, después de ocho semanas de seguimiento, el 38% de los pacientes tratados con pegamento de fibrina lograron la remisión clínica, en comparación con solo el 16% en el grupo de observación (p=0.04). Esto sugiere que el uso del pegamento de fibrina fue significativamente más efectivo en la inducción de la remisión de las fístulas perianales en pacientes con EC. Es importante tener en cuenta que la duración del seguimiento en este estudio no fue suficiente para llegar a una conclusión definitiva sobre la verdadera tasa de éxito a largo plazo de esta terapia en pacientes con EC. Además, varios estudios de cohorte con un número limitado de pacientes con EC informaron tasas de éxito variables al utilizar pegamento de fibrina para tratar las fístulas perianales. Sin embargo, se destacó de manera consistente que esta técnica tenía un perfil de seguridad aceptable, ya que no se reportaron lesiones en los músculos esfintéricos como resultado del tratamiento con pegamento de fibrina189.
La LIFT es una opción en el arsenal de tratamientos quirúrgicos para las fístulas perianales. Sirany et al. llevaron a cabo una revisión sistemática de la literatura e identificaron 26 estudios que incluyeron un total de 713 pacientes, de los cuales 13 tenían EC190. Entre estos estudios, se encontraba un único ensayo clínico aleatorizado, que excluyó, sin embargo, a los pacientes con EC, y 25 cohortes o series de casos. Los estudios presentaban heterogeneidad en cuanto a una amplia variedad de medidas de resultado y tiempos de seguimiento. Las técnicas utilizadas solo se describían parcialmente e incluían siete variaciones técnicas. Las tasas de cicatrización primaria oscilaban entre el 47% y el 95%; por lo tanto, incluso el extremo inferior de este rango parece prometedor en comparación con otras opciones terapéuticas. Muy pocas y leves complicaciones se asociaron con el LIFT clásico o cualquiera de sus variaciones (se informaron tres complicaciones en seis estudios). A pesar de esto, debido a la falta de datos, no está claro cuál es el papel del procedimiento LIFT en el tratamiento de las fístulas perianales en la EC, aunque parece que la tasa de complicaciones es relativamente baja. Para aclarar el papel del LIFT en las fístulas de EC, se requieren ensayos clínicos aleatorizados, posiblemente comparándolo con el procedimiento de colgajo de avance como grupo de control.
Se realizó un ensayo clínico aleatorizado para evaluar el uso de tapones de fístula anal de colágeno (AFP) en pacientes con fístulas perianales por EC. El estudio comparó dos grupos: uno en el que se retiraban los setones y se insertaban los AFP en el tracto de la fístula, y otro en el que solo se retiraban los setones y se observaba a los pacientes. Participaron 106 pacientes con EC en el estudio. Después de 12 semanas, se observó que la tasa de cierre de las fístulas en el grupo de AFP fue del 33.3% en pacientes con fístulas complejas y del 30.7% en pacientes con fístulas simples. Esto se comparó con tasas del 15.4% y 25.6%, respectivamente, en el grupo en el que solo se retiraban los setones. Sin embargo, estas diferencias no alcanzaron significancia estadística, posiblemente debido al tamaño limitado del estudio. Es importante destacar que se observó una tendencia hacia una mayor incidencia de eventos adversos a las 12 semanas en el grupo de AFP en comparación con el grupo de setones (17% vs. 8%), aunque esta diferencia tampoco fue estadísticamente significativa (p=0.07). Sin embargo, a los 12 meses de seguimiento, las tasas acumulativas de eventos adversos fueron similares en ambos grupos191. Se llevó a cabo una revisión sistemática que involucró 12 estudios observacionales, los cuales incluyeron a 84 pacientes con un seguimiento de nueve meses (con un rango de tres a 24 meses). En general, se encontró que alrededor del 58.3% de las fístulas anales cerraron satisfactoriamente. Sin embargo, cuando se examinó un subgrupo más pequeño de pacientes con fístulas anales recurrentes después de tratamientos previos, el éxito fue del 40%. Es importante destacar que no había una definición uniforme para lo que se consideraba el cierre de las fístulas, y los regímenes de seguimiento variaban ampliamente entre los estudios. Se debe tener en cuenta que la calidad de la evidencia obtenida de esta revisión sistemática se consideró baja debido a preocupaciones sobre el sesgo y la falta de precisión en los datos192. El uso de AFP en pacientes con EC parece ser relativamente seguro y puede considerarse para pacientes seleccionados que estén conscientes de la baja tasa de éxito.
En pacientes con EC y fístulas perianales complejas, opciones como avance de colgajos, pegamentos de fibrina y LIFT pueden considerarse, pero su eficacia es limitada. Los AFP no se recomiendan de rutina. El LIFT es prometedor, pero se necesitan ensayos clínicos para confirmar su eficacia. El pegamento de fibrina muestra resultados positivos en la inducción de remisión de fístulas perianales en pacientes con EC, pero se requiere seguimiento a largo plazo para evaluar el éxito y las complicaciones. Se necesita más investigación para comprender mejor estas opciones en pacientes con EC y fístulas perianales.
68. La terapia alogénica con células madre derivadas de tejido adiposo podría ser un tratamiento eficaz y seguro para las fístulas perianales complejas en pacientes con EC. Las células madre derivadas de tejido adiposo autólogo pueden tener un efecto positivo para los pacientes con EC y fístulas perianales complejas con buena tolerabilidad y seguridad. Porcentaje de acuerdo: 93.8%. Calidad de la evidencia: A. Fuerte a favor de la intervención: 1.
Se realizó un estudio crucial de fase 3 (ensayo ADMIRE CD) para evaluar el uso de células madre alogénicas derivadas del tejido adiposo en pacientes con fístulas perianales por EC, en el que participaron 212 pacientes193–195. Todos los pacientes se sometieron a curetaje del trayecto de la fístula y cierre del orificio fistuloso interno (OFI), y luego se asignaron al azar para recibir la aplicación de células madre o un placebo alrededor del OFI y a lo largo de los trayectos de la fístula. Se excluyeron del estudio a los pacientes con más de dos OFI o tres orificios fistulosos externos (OFE), pacientes con fístula rectovaginal y aquellos con estenosis anal o rectal o proctitis. A los 12 meses, se observó una remisión combinada significativamente mayor (definida como el cierre del OFE en el examen físico y la ausencia de abscesos en la RM) en los pacientes tratados con células madre en comparación con el placebo (56.3% vs. 38.6%; p=0.010).
Un metaanálisis de 11 estudios, que incluyó tres ensayos clínicos aleatorizados, siendo el ADMIRE CD el más grande, mostró tasas de cicatrización mejoradas en comparación con los grupos de control196. Es importante destacar que en ninguno de los estudios se comparó el modo y la técnica de administración de las células madre.
Según el informe de Dozois et al., se observaron tasas de cicatrización más altas cuando las células madre se combinaron con pegamento de fibrina o se impregnaron en un tapón de fístula Gore Bio-A® en comparación con la aplicación directa (71% y 83%, respectivamente, vs. 50%)197.
La terapia con células madre alogénicas puede ser un enfoque efectivo y seguro para tratar fístulas perianales complejas en pacientes con EC. Sin embargo, se deben realizar estudios adicionales para determinar la selección de pacientes, el modo óptimo de administración, la dosis y frecuencia de las aplicaciones195.
69. Las fístulas ano y recto-genitales relacionadas con la EC son muy complejas y raras; por lo tanto, deben ser tratadas por un equipo multidisciplinario experimentado. Porcentaje de acuerdo: 100%. Calidad de la evidencia: C. Débil a favor de la intervención: 2.
Se realizó una revisión sistemática que englobó un total de 23 estudios sobre fístulas rectovaginales asociadas a EC. Estos estudios incluyeron un ensayo clínico aleatorizado, seis estudios prospectivos y 16 estudios retrospectivos, y en total abarcaron 137 casos de fístulas rectovaginales en pacientes con EC. Entre estos estudios, tres se centraron en el tratamiento combinado médico y quirúrgico de estas fístulas y reportaron una tasa de curación del 44.2%198.
Por otro lado, Hotouras et al. llevaron a cabo una revisión que evaluó 17 estudios con un total de 106 pacientes que se sometieron a una intervención quirúrgica conocida como interposición del músculo gracilis para el tratamiento de las fístulas rectovaginales. La mayoría de estos estudios fueron retrospectivos y no aleatorizados. De estos pacientes, solo 34 tenían fístulas por EC. Después de un seguimiento promedio de 21 meses, se encontró que el 50% de las fístulas de EC que se habían sometido a la interposición del músculo gracilis habían sanado, en comparación con tasas de curación que oscilaban entre el 60% y el 90% en el caso de las fístulas rectovaginales que no estaban relacionadas con la EC199.
El tratamiento de las fístulas rectovaginales en pacientes con EC presenta desafíos significativos, y la elección entre opciones médicas y quirúrgicas debe considerarse cuidadosamente, a menudo en el contexto de un equipo multidisciplinario de expertos en EC.
FinanciaciónSe obtuvo financiamiento para la transportación y hospedaje de los participantes del primer consenso mexicano de la enfermedad de Crohn de manera presencial por parte de los laboratorios AbbVie, Janssen y Takeda. Cabe aclarar que no estuvieron presentes durante el desarrollo del consenso.
Conflicto de interesesJesús Kazuo Yamamoto Furusho es miembro del Advisory Board, líder de Opinión y ponente para Abbvie Laboratories de México, Abbvie Internacional, Takeda Internacional, Takeda México, Pfizer Internacional y regional, Janssen Cilag internacional y México. Es líder de opinión y ponente para Alfasigma, Celltrion, Ferring y Farmasa Schwabe. Asesor de investigación para UCB México. Ha recibido recursos para estudios de investigación de los laboratorios Shire, Bristol Myers Squib, Pfizer, Takeda y Celgene.
Francisco Bosques-Padilla. Ponente para Abbvie, Janssen, Takeda y Ferring.
Jesús Gerardo López Gómez ha sido ponente para Abbvie, Janssen y Takeda.
Manuel Martínez-Vázquez. Ponente para Abbvie, Janssen y Takeda.
Jorge Luis de León Rendón ha sido ponente para Janssen, Schwabe pharma y Takeda.
Grupo del Primer Consenso Mexicano de enfermedad de CrohnAzucena Casanova Lara ha sido ponente para Abbvie y Takeda.
Carlos Manuel Del real Calzada ha sido ponente para Abbvie.
Fabiola Maely González Ortiz ha sido ponente para Abbvie.
Raquel Yazmín López Pérez ha sido ponente para Janssen y Schwabe pharma.
Francisca Martínez ha sido ponente para Abbvie.
Arturo Mayoral Zavala ha sido ponente para Abbvie y Janssen.
Rosa María Miranda Cordero ha sido ponente para Abbvie, Janssen y Takeda.
Laura Ofelia Olivares Guzmán ha sido ponente para Pfizer, Takeda.
Azalia Ruiz Flores ha sido ponente para Janssen y Takeda.
Los demás autores declaran no tener ningún conflicto de intereses.
Consideraciones éticasEn el presente estudio no participan ni se usan datos de pacientes, por lo que no fue necesario obtener consentimiento informado. De la misma manera, debido a que no existe intervención, maniobra o manejo de información, el estudio se considera de bajo riesgo y no requirió revisión o aprobación por el comité de ética local. Aun así cumple con la normativa vigente de investigación y la confidencialidad de los datos de identificación y personales, y el anonimato de los participantes (todos trabajadores de la salud que participaron voluntariamente) está garantizado. El presente artículo no contiene información personal que permita la identificación de los participantes
Azucena Casanova Lara. Hospital Regional del Instituto Mexicano del Seguro Social (IMSS), Cancún, México.
Carlos Manuel Del Real Calzada. Centro Médico Nacional La Raza, IMSS, Ciudad de México, México.
Fabiola Maely González Ortiz. Piedras Negras, México.
Raquel Yazmín López Pérez. Servicio de endoscopia, Hospital General de México, Ciudad de México, México.
Francisca Martínez. Centro Médico Nacional La Raza, IMSS, Ciudad de México, México.
Arturo Mayoral Zavala. Centro Médico Nacional Siglo XXI, IMSS, Ciudad de México, México.
Rosa María Miranda. Centro Médico Instituto de Seguridad Social del Estado de México y Municipios (ISSEMYM), Toluca, Estado de México.
Laura Ofelia Olivares Guzmán. Hospital General de Culiacán, Sinaloa, México.
Ariadnee Irma Reyna Aréchiga. Departamento de Gastroenterología, Hospital Universitario de la Universidad Autónoma de Nuevo León, Monterrey, Nuevo León, México.
Azalia Ruiz Flores. Hospital de Alta Especialidad del IMSS, Monterrey, México.
Luis Salgado. Hospital Zambrano Hellion Tec Salud, Monterrey, Nuevo León, México.
Leticia Santoyo Fexas. Departamento de Gastroenterología, Hospital Universitario de la Universidad Autónoma de Nuevo León, Monterrey, Nuevo León, México.
Juan Antonio Villanueva Herrero. Servicio de Coloproctología, Hospital General de México.