La Helicobacter pylori (H. pylori) está asociada con un mayor riesgo de úlcera péptica y cáncer gástrico. La presencia de la bacteria no es un factor determinante para el desenlace clínico, sino que la cepa y otros factores del huésped interactúan para determinar el riesgo a adquirir la enfermedad. El objetivo del presente estudio fue investigar la asociación entre la carga bacteriana, el tipo de cepa y los síntomas gástricos en personas con positividad a H. pylori.
Materiales y métodosEn una encuesta dirigida a la comunidad se contactaron 302 voluntarios que no estuvieran tomando antibióticos, antiácidos ni inhibidores de la bomba de protones un mes antes del diagnóstico de H. pylori utilizando la prueba de la ureasa en aliento. Se seleccionaron 25 sujetos con edades entre los 25 y los 74 años, positivos a H. pylori, para una encuesta de síntomas gástricos y determinar la presencia del genotipo cagA en el jugo gástrico obtenido con Entero-test®. La carga bacteriana se determinó como medida de la actividad de la ureasa utilizando el valor 13C-delta sobre el valor basal obtenido en la prueba de aliento.
ResultadosEl 48% de los sujetos positivos a H. pylori fueron cagA+. Se encontró una asociación positiva entre el estado de cagA y la alta actividad de la ureasa gástrica (p<0.0001), que además resultó significativamente asociada con la presencia de síntomas (p<0.0001).
ConclusiónLa actividad de la ureasa gástrica está fuertemente asociada con los síntomas de dispepsia y la presencia de H. pylori cagA+. Los valores elevados de 13C-delta sobre el valor basal pudieran ser usados como indicadores de mayor riesgo de enfermedad gástrica.
Helicobacter pylori (H. pylori) is associated with a higher risk of peptic ulcer and gastric cancer. The sole presence of the bacterium is not a determinant of clinical outcome, but rather the interaction of strain type and host factors determines the risk of disease. Our aim was to study the association between bacterial load, strain type, and gastric symptoms in H. pylori-positive subjects.
Materials and methodsIn a community survey, a diagnostic 13C-urea breath test for H. pylori was performed on 302 volunteers that were not taking antibiotics, antacids, or proton pump inhibitors one month prior to the test. The breath test produced 25 H. pylori-positive subjects, between 25-74 years of age, who then took a gastric symptoms survey and were tested for the presence of the cagA genotype in gastric juice, using the Entero-test®. Bacterial load was determined as a measure of urease activity, utilizing the delta over baseline value, obtained in the 13C-urea breath test.
ResultsA total of 48% of the H. pylori-positive subjects were cagA+. A positive association was found between cagA status and high gastric urease activity (P<.0001) and the latter was significantly associated with the presence of symptoms (P<.0001).
ConclusionGastric urease activity was strongly associated with dyspeptic symptoms and cagA+ H. pylori. Elevated 13C-delta over baseline values could be used as indicators of a higher risk for gastric disease.
La colonización de Helicobacter pylori (H. pylori) es un factor de riesgo bien conocido para el desarrollo de enfermedades gástricas en el estómago humano1–3, aunque la mayoría de las personas infectadas permanecerá asintomática durante toda su vida. La seroprevalencia de la infección por H. pylori reportada en México fue del 66% y la edad fue el factor de riesgo de infección más fuerte4. Según el cuarto consenso mexicano sobre H. pylori1, la asociación entre dispepsia funcional e infección por H. pylori es controvertida. Varios estudios han evidenciado que la variabilidad genética de H. pylori y el huésped5, al igual que factores medioambientales, determinan el desenlace clínico6. La H. pylori es genéticamente diversa, y las cepas de tipo i, las cuales son positivas al gen A asociado a citotoxicidad (cagA+) y secretan la citotoxina vacuolizante VacA, son las más virulentas7,8 y están asociadas con ulceración duodenal9,10, dolor abdominal, sangrado, gastritis activa11, síntomas de dispepsia12,13, daño de ADN en la mucosa gástrica14 y carcinoma gástrico15,16.
Atherton et al. encontraron evidencia histológica de mayor densidad de H. pylori en la mucosa gástrica colonizada por cepas cagA+ que en el epitelio colonizado por cepas cagA+17. Otros autores también han encontrado una relación significativa entre la densidad de colonización de H. pylori y la presencia de cepas cagA+ y vacAs118–20, lo cual demuestra la importancia de la determinación de la carga bacteriana como un predictor de enfermedad gástrica. Perri et al. y Zagari et al. propusieron el uso de 13C-delta sobre el valor basal (DOB) como predictor de carga bacteriana intragástrica y gravedad de gastritis por H. pylori en pacientes referidos para endoscopia21,22. Matthews et al. también encontraron que los valores de 13C-DOB eran significativamente más altos en sujetos sintomáticos con gastritis antral moderada y grave que en aquellos con gastritis leve o sin inflamación23. Sin embargo, no encontraron correlación entre la carga de H. pylori medida por medio de cultivo bacteriano y los valores 13C-DOB23. Machado et al. reportaron que en niños con síntomas dispépticos, el 13C-DOB no señala la gravedad de las medidas histológicas de colonización bacteriana24. La falta de correlación puede ser debida a la diferencia de virulencia entre cepas de H. pylori o debido a los estimados de densidad bacteriana (por medio de cultivo bacteriano22 o estimación histológica24), los cuales no son indicativos de la carga real de H. pylori en la mucosa.
La prueba del aliento con urea marcada con 13C es la más sensible y específica para determinar la presencia de H. pylori1. Utiliza el valor 13C-DOB como el criterio de corte, el cual es indicativo de la actividad de la ureasa y, en consecuencia, de la carga bacteriana. La determinación de la virulencia de la cepa de H. pylori es posible por medio de análisis moleculares e inmunológicos complementarios. Planteamos la hipótesis de que un valor 13C-DOB más alto, además de indicar la carga bacteriana, podría también indicar la presencia del genotipo cagA+. Así, el objetivo principal de nuestro estudio fue investigar la asociación entre la actividad de la ureasa gástrica (13C-DOB), los síntomas de dispepsia y la cagA+ H. pylori en una población abierta. También exploramos la relación entre las variables sociodemográficas con la presencia de H. pylori y determinamos las variables que explicaban mejor el valor de 13C-DOB.
Materiales y métodosPoblaciones de estudioSe seleccionó a 302 personas que no estaban tomando antibióticos, antiácidos o inhibidores de la bomba de protones por medio de una encuesta comunitaria en el norte de México (Hermosillo, Sonora) para que hicieran una prueba de la ureasa en aliento para H. pylori (dentro del marco temporal de junio a noviembre del 2004). Veinticinco de dichos individuos dieron positivo para H. pylori, con un rango de edad de 25-74 años (media de 34 años), y fueron elegidos aleatoriamente para completar una encuesta sobre síntomas gástricos y proporcionar una muestra de jugo gástrico utilizando el Entero-test® (Enterotest HP, HDC Corporation, San Jose, CA, EE. UU.).
Los sujetos eran clínicamente sintomáticos, presentando 2 o más síntomas de enfermedad péptica, tales como dolor epigástrico, ardor epigástrico, pesadez posprandial, saciedad precoz, inflamación, eructos, náuseas y vómitos. La cronicidad, la variedad o la intensidad de los síntomas no fueron considerados en el cuestionario.
Datos sociodemográficosSe evaluó el nivel educativo de acuerdo con la siguiente escala: 1, primaria; 2, secundaria; 3, preparatoria; 4, semiprofesional; 5, profesional; 6, posgrado. El ingreso familiar fue expresado en unidades de salario mínimo mensual. Con base en los datos de la literatura relevante, se calculó una puntuación para el riesgo de presentar H. pylori con relación a la condición socioeconómica. El nivel educativo, el empleo, el ingreso familiar, las características de la vivienda (material de construcción de la vivienda, techo y piso, presencia y tipo de sistema de drenaje y agua potable en el hogar), el hacinamiento (3 o más personas compartiendo una habitación), la presencia de animales domésticos dentro o fuera de la casa y la crianza de animales fueron considerados para la puntuación. Las características asociadas con un alto riesgo de presentar H. pylori fueron codificadas numéricamente (sin riesgo: 0-2; riesgo moderado: 3-5; riesgo alto>5).
Detección del estatus de Helicobacter pyloriEl estatus de H. pylori fue determinado por medio de la prueba del aliento con urea marcada con 13C. Se obtuvieron muestras de aliento antes, 30 y 45min después de la administración de 50mg de ureasa etiquetada 13C, en conjunto con jugo natural de naranja, para obtener condiciones gástricas de acidez. La prueba del aliento con urea marcada con 13C tiene un 98% de sensibilidad. La ureasa secretada por la H. pylori en el estómago hidroliza la urea para liberar 13CO2 de la urea etiquetada ingerida, la cual entra en el bicarbonato corporal y se excreta en el aliento. Medimos la razón de 13CO2/12CO2 por medio de espectrometría de masas de razón de isotopos (BreathMAT Plus, 1998, Finnigan MAT GmbH, Bremen, Alemania) y expresamos los resultados en razones de intensidad (13CO2/12CO2, 45/44). La 13C-DOB fue considerada positiva cuando H. pylori era≥3.5‰.
Identificación de cepas cagA+ de Helicobacter pyloriLas muestras de jugo gástrico fueron obtenidas de los sujetos H. pylori positivos después de un ayuno nocturno, utilizando una prueba del hilo (Entero-test® prueba pediátrica, Enterotest HP, HDC Corporation, San Jose, CA, EE. UU.). La prueba consistió en la ingestión de 90cm de fibra de nailon en una cápsula de gelatina de 2.5cm de largo que se disuelve en el estómago. El hilo permaneció en el estómago durante una hora, después de la cual fue recuperada por vía oral y colocada en 15ml de solución salina para aislamiento de ADN.
El hilo fue sacudido vigorosamente en solución salina y centrifugado para la extracción del ADN del pellet resultante utilizando un Mini Kit QIAamp® DNA (Qiagen Inc., Valencia, CA, EE. UU.). El ADN se sometió a amplificación mediante PCR de los genes glmM y cagA, utilizando los siguientes primers: cagA-F: 5́-ATAATGCTAAATTAGACAACTTGAGCGA-3́; cagA-R: 5́-AGAAACAAAAGCAATACGATCATTC-3́, tamaño de producto: 120bp25; glmM-F: 5́-GGATAAGCTTTTAGGGGTGTTAGGGG-3́; glmM-R: 5́-GCTTACTTTCTAACACTAACGCGC-3́, tamaño de producto: 300bp26.
Se utilizaron gránulos PCR PuReTaq Ready-To-Go™ (Amersham Biosciences, GE Healthcare Life Sciences, Pittsburg, PA, EE. UU.) para la amplificación de PCR. Cada gránulo PCR reconstituido a 25μl contenía 10pmol de primadores cagA-F y cagA-R o glmM-F y glmM-R (Sigma-Genosys, Spring, TX, EE. UU.), 200μM de desoxi nucleósidos trifosfatos, 50mM KCl, 1.5mM MgCl2, 10mM Tris-HCl y aproximadamente 100ng de ADN genómico. Se realizaron 35 ciclos de 1min a 95°C, 1min a 52°C y 1min a 72°C. Los productos PCR fueron visualizados por medio del procedimiento estándar de electroforesis en 2% de geles de agarosa27.
Análisis estadísticoLos datos fueron analizados utilizando el Windows Number Cruncher Statistical System (Kaysville, UT, EE. UU.). La estadística descriptiva fue utilizada para caracterizar a la población estudiada. Se realizó un análisis de correlación para encontrar asociaciones entre las variables sociodemográficas y los marcadores de infección con H. pylori, ajustando por sexo (mujer, 0; hombre, 1) y edad. Para determinar las variables que explicaron mejor la carga bacteriana (13C-DOB), desarrollamos un modelo que incluyó las siguientes variables en el proceso de selección: ingreso familiar, hacinamiento, características de casa habitación, cepa cagA+ H. pylori (ausente, 0; presente, 1) y la presencia de síntomas (ausentes, 0; presentes, 1), ajustados por sexo y edad.
ResultadosEn la tabla 1 se muestran las características sociodemográficas de los participantes. Solo uno de los 25 participantes identificados como positivos por medio de la prueba del aliento dio negativo en la amplificación PCR para glmM, el marcador genético de Helicobacter.
Características sociodemográficas de los sujetos
| Edad (años) | 34.5 |
| Rango | 25-74 |
| Sexo, n | |
| Femenino | 7 |
| Masculino | 18 |
| Nivel educativoa | 6 |
| Ingreso mensual familiar (salario mínimo) | 5-10 |
| Porcentaje de participantes en riesgo de presentar H. pylori relacionado con condición socioeconómicab | |
| Sin riesgo | 44 |
| Riesgo moderado | 44 |
| Riesgo alto | 12 |
El nivel educativo fue evaluado utilizando la siguiente escala: 1, primaria; 2, secundaria; 3, preparatoria; 4, semiprofesional; 5, profesional; 6, posgrado.
Calculado en la forma descrita en la sección de Materiales y métodos, considerando el nivel educativo, empleo, ingreso familiar, características de casa habitación, hacinamiento, la presencia de animales dentro o fuera de la casa, y la crianza de animales. Las características asociadas con un alto riesgo de presentar H. pylori fueron codificadas numéricamente (los valores finales fueron: sin riesgo, 0-2; riesgo moderado, 3-5; y riesgo alto>5).
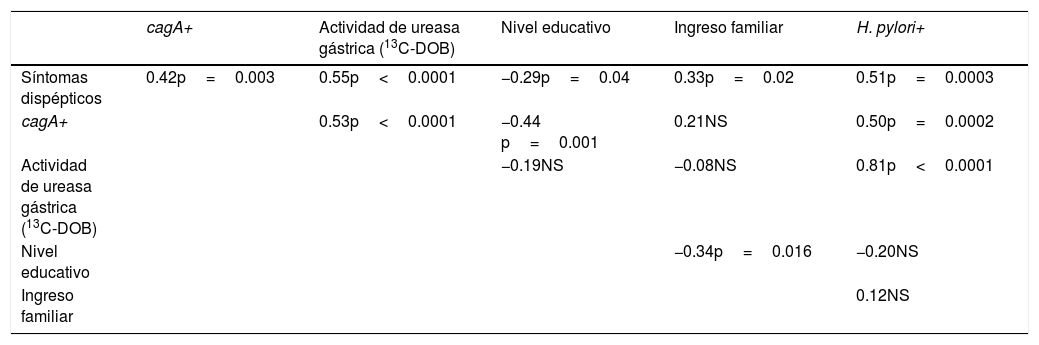
Se encontraron cepas cagA+ de H. pylori en el 48% de los sujetos. Al dividir por presencia de síntomas, el 66% de los sujetos sintomáticos tenía cepas cagA+ H. pylori frente al 33% de los sujetos asintomáticos. La presencia de cepas cagA+ H. pylori estuvo significativamente asociada con los síntomas de dispepsia (r=0.42; p=0.003) y asociada negativamente con el nivel educativo (r=-0.44; p=0.001) (tabla 2).
Coeficientes de correlación y valores p del análisis de correlación (ajustado por edad y sexo) para asociaciones entre variables sociodemográficas y marcadores de infección por H. pylori
| cagA+ | Actividad de ureasa gástrica (13C-DOB) | Nivel educativo | Ingreso familiar | H. pylori+ | |
|---|---|---|---|---|---|
| Síntomas dispépticos | 0.42p=0.003 | 0.55p<0.0001 | −0.29p=0.04 | 0.33p=0.02 | 0.51p=0.0003 |
| cagA+ | 0.53p<0.0001 | −0.44 p=0.001 | 0.21NS | 0.50p=0.0002 | |
| Actividad de ureasa gástrica (13C-DOB) | −0.19NS | −0.08NS | 0.81p<0.0001 | ||
| Nivel educativo | −0.34p=0.016 | −0.20NS | |||
| Ingreso familiar | 0.12NS |
DOB: delta sobre el valor basal; NS: no significativo.
Una actividad alta de la ureasa estuvo asociada con síntomas, dado que el 87.5% de los participantes positivos para H. pylori con alta actividad gástrica de ureasa (valores 13C-DOB>20‰) tenían síntomas de dispepsia, frente al 35% de los sujetos positivos para H. pylori con ureasa gástrica baja (valores 13C-DOB<20‰) y el 12% de los sujetos negativos para H. pylori.
La actividad gástrica de la ureasa, la cual es un marcador de carga de H. pylori, mostró una asociación significativa con la presencia de dispepsia (r=0.55; p<0.0001) y cepas de cagA+ H. pylori (r=0.53; p<0.0001) (tabla 2).
Las variables que explicaron mejor el valor 13C-DOB fueron la presencia de síntomas (p=0.0003), la cepa cagA+ H. pylori (p=0.0004) y el ingreso familiar ajustado por edad y sexo (p<0.01) (tabla 3).
Análisis de regresión multivariante para evaluar la actividad de la ureasa gástrica
| Variable dependiente | Variable independiente | β±EE | p |
|---|---|---|---|
| Actividad de ureasa gástrica (13C-DOB) | Intercept | −3.02±5.06 | 0.55 |
| Síntomas | 10.93±2.7 | 0.0003 | |
| Cepa cagA+ H. pylori | 11.63±3.02 | 0.0004 | |
| Ingreso familiar | −3.99±1.45 | 0.0090 | |
| Sexo | −3.24±2.38 | 0.1809 | |
| Edad | 0.23±0.12 | 0.0719 |
DOB: delta sobre el valor basal; β±EE: coeficiente de regresión±error estándar.
R2=0.5396 (p<0.0001).
La presencia de cepas cagA+ H. pylori estuvo asociada con el cagA+ y el nivel educativo (r=−0.44; p=0.001). En otras palabras, los portadores de cagA+ H. pylori tenían un nivel educativo más bajo que los portadores de cagA− H. pylori.
El gen cagA es un marcador de la isla de patogenicidad cag y su presencia está asociada con enfermedades más graves11,28,29. La inyección de proteína cagA en células epiteliales gástricas afecta su proliferación, migración y adhesión, al igual que a otras vías de transducción de señales relacionadas con respuestas proinflamatorias, e induce la interleucina-8 vía señales de NF-κB29. Encontramos una asociación entre la colonización cagA+ H. pylori y la presencia de síntomas. Loffeld et al. encontraron resultados similares en pacientes con cagA+ H. pylori que presentaban más síntomas de dispepsia que pacientes con cepas de cagA− H. pylori30.
Al utilizar la actividad de la ureasa gástrica como indicador de intensidad de colonización o de carga bacteriana22, encontramos que una mayor actividad gástrica estaba correlacionada con más síntomas, coincidiendo con resultados reportados por otros17-22.
La principal limitación del presente estudio fue su tamaño de muestra pequeño. Sin embargo, hasta donde nosotros sabemos, es el primer análisis que investiga y muestra una asociación positiva entre 13C-DOB y cepas cagA+ H. pylori, lo cual evidencia que un valor elevado de 13C-DOB podría ser indicativo de patogenicidad. Otra limitación de nuestro estudio fue el hecho de que la cronicidad, la variedad o la intensidad de los síntomas dispépticos no fueron incluidos, lo cual no permitió hacer un examen a mayor profundidad de la asociación entre la actividad de la ureasa, la cepa H. pylori y los síntomas.
En conclusión, nuestros datos apoyan la asociación entre la alta actividad de la ureasa (valores elevados de 13C-DOB), la colonización cagA+ y la presencia de síntomas gástricos. Los valores altos de 13C-DOB en los pacientes podría ser un criterio para realizar la identificación del genotipo de H. pylori y tomar la decisión de iniciar tratamiento clínico. Se requieren más estudios que ayuden a establecer un posible valor de corte para el riesgo de enfermedad.
Responsabilidades éticasProtección de personas y animales. Nuestro estudio fue evaluado y aprobado por el Comité de Ética del Centro de Investigación en Alimentación y Desarrollo, A. C., con base en los estándares internacionales manifestados en la Declaración de Helsinki y en la Regulación Legal General de Salud relacionada con la Investigación en materia de Salud del estado de Sonora, México.
Confidencialidad de los datos. Los autores declaran que trataron la información de todos los pacientes con confidencialidad y anonimidad, siguiendo los protocolos de su centro de trabajo.
Derecho a la privacidad y consentimiento informado. Todos los participantes firmaron consentimientos informados escritos con anterioridad a la participación en el estudio. Se garantizó la estricta confidencialidad de los datos y los autores declaran que la información contenida en el presente estudio no permite la identificación de los participantes.
FinanciaciónEl presente trabajo fue apoyado por el Acuerdo Regional de Cooperación para la Promoción de la Ciencia y la Tecnología en América Latina-Organismo Internacional de la Energía Atómica (ARCAL-OIEA), beca# ARCAL-RLA/6/042. MFMO recibió financiación de CONACYT No. de registro 42473 (México).
AutoríaM.F. Moreno-Ochoa participó en la recogida, análisis e interpretación de datos y aprobó la versión final del manuscrito. M.E. Valencia participó en la concepción y el diseño del estudio, el análisis y la interpretación de los datos, la realización del borrador del manuscrito y aprobó la versión final del manuscrito. G.G. Morales-Figueroa participó en el análisis y la interpretación de los datos y aprobó la versión final del manuscrito. S.Y. Moya-Camarena participó en la concepción y el diseño del estudio, el análisis y la interpretación de los datos, el borrador del manuscrito y aprobó la versión final del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosLos autores desean agradecer a los participantes del estudio, a Bertha Isabel Pacheco Moreno, Ana Cristina Gallegos Aguilar y María Guadalupe Galaz Sánchez por su excelente asistencia técnica, y a la Dra. María Gloria Domínguez-Bello por sus contribuciones clave para la preparación del estudio.