La tasa de detección de pólipos (PDR por sus siglas en inglés) se define como el porcentaje de colonoscopias con uno o más pólipos detectados. Se ha demostrado que está altamente correlacionado con la tasa de detección de adenomas. Este estudio tuvo como objetivo la evaluación de la PDR en la Unidad de Endoscopia Kasr Al-Ainy, de la Facultad de Medicina de la Universidad de El Cairo, Egipto, a través de las técnicas i-SCAN, Endocuff y colonoscópica subacuática.
Materiales y métodosEl estudio se realizó en 100 candidatos egipcios mayores de 50 años para quienes se midió la tasa de detección de pólipos a través de 4 técnicas colonoscópicas diferentes. Los pacientes fueron distribuidos en números iguales en 4 grupos: i-SCAN, Endocuff, técnica subacuática y el grupo control, quienes fueron examinados por medio de colonoscopio de luz blanca estándar. La evaluación colonoscópica incluyó el tipo de agente utilizado para la preparación, el grado de preparación intestinal y también el tiempo de retirada.
ResultadosLa PDR general fue del 48%. La técnica i-SCAN presentó el nivel más alto (56%), seguido de la técnica subacuática (52%) y luego la Endocuff (48%).
ConclusiónLas técnicas de exploración i-SCAN y colonoscópica subacuática mostraron una PDR más alta, aunque estadísticamente insignificante, con respecto a Endocuff o a la técnica estándar.
The polyp detection rate (PDR) is defined as the percentage of colonoscopies in which one or more polyps are detected, and has been shown to be highly correlated with the adenoma detection rate. The aim of the present study was to evaluate the PDR at the Endoscopy Unit of the Kasr Al-Ainy Hospital, Cairo University, Egypt, through the i-SCAN, Endocuff, and underwater colonoscopy techniques.
Materials and methodsThe study was conducted on 100 Egyptian subjects over 50 years of age. Their polyp detection rate was measured through 4 different colonoscopic techniques. An equal number of patients were divided into 4 groups: i-SCAN, Endocuff, underwater colonoscopy, and controls. The control group was examined using standard white light colonoscopy. The colonoscopy evaluation included the type of agent utilized for bowel preparation, preparation grade, and colonoscopy withdrawal time.
ResultsThe general PDR was 48%. The i-SCAN technique had the highest rate (56%), followed by the underwater (52%) and the Endocuff (48%) techniques.
ConclusionThe i-SCAN and underwater colonoscopy techniques produced higher PDR than the Endocuff-assisted and standard techniques, but with no statistical significance.
Los pólipos en el colon son protuberancias que ocurren en la luz del colon y normalmente son esporádicos o parte de otros síndromes. Los pólipos son clasificados como diminutos si miden≤5mm de diámetro, pequeños si miden entre 6 y 9mm de diámetro, y grandes si miden≥1cm de diámetro1. Usualmente se clasifican como neoplásicos (adenomatosos) y no neoplásicos (hiperplásicos, inflamatorios, hamartomatosos)2.
Los pólipos hiperplásicos son el tipo más común de pólipo colorrectal. No tienen potencial de malignidad, aunque hay múltiples líneas de evidencia que apuntan a que las variedades serradas son premalignas3. De tal manera que en pacientes de riesgo se recomienda la vigilancia colonoscópica cada 3 años, particularmente en aquellos con un fuerte historial familiar, para reducir el riesgo de carcinoma colorrectal (CCR). Cuando no es este el caso, los intervalos de vigilancia son más prolongados y las colonoscopias frecuentes son innecesarias4.
Los pólipos adenomatosos son comunes, especialmente en los países occidentales, y suman entre el 20 y el 40% de las colonoscopias de tamizaje en personas mayores de 50 años5, con al menos un pólipo detectado en el 34.3% de los pacientes asintomáticos en dichas colonoscopias6. Todos los tipos de adenomas exhiben cierto grado de displasia que está correlacionada con el tamaño del pólipo y el aspecto velloso7.
La incidencia de pólipos inflamatorios (pseudopólipos) es de entre el 10 y el 20% en pacientes con colitis ulcerosa y típicamente ocurren en la segunda o tercera década de la vida en pacientes con enfermedad inflamatoria intestinal8. Endoscópicamente no pueden ser distinguidos de los pólipos adenomatosos, lo cual hace la biopsia obligatoria9.
Los hamartomas son normalmente esporádicos (pólipos juveniles), pero pueden ocurrir como parte de un síndrome de poliposis hamartomatoso, como el síndrome de Peutz-Jeghers, la poliposis juvenil, la enfermedad de Cowden o el síndrome de Cronkhite-Canada10.
La tasa de detección de pólipos (PDR) se define por el porcentaje de colonoscopias en las cuales se detectan uno o más pólipos11. Es un sustituto de la tasa de detección de adenomas (ADR), la cual es el porcentaje de pacientes de≥50 años que se realizan una colonoscopia de tamizaje por primera vez, en la cual uno o más adenomas convencionales son detectados y retirados. La PDR ha demostrado correlacionar bien con la ADR, pero la medida de la primera es más viable porque no requiere verificación histológica12. Sin embargo, se ha descrito una correlación pobre en casos de pólipos de colon distal13.
La colonoscopia es el patrón oro para detectar pólipos de colon, pero la sensibilidad no es del 100%. Se ha reportado una tasa de omisión para pólipos de cualquier tamaño del 22% y una tasa de omisión para adenomas≥10mm del 2.1%, para adenomas de entre 5 y 10mm del 13%, y para aquellos entre 1 y 5mm, del 26%14. La colonoscopia completa es recomendada como estrategia de tamizaje cada 10 años, comenzando a los 50 años15.
La PDR puede ser afectada por varios factores que incluyen la edad, el sexo, el grado de preparación intestinal, la experiencia del endoscopista, el tiempo de retirada, la tasa de intubación cecal y la retroflexión16,17. Se han utilizado novedosas técnicas colonoscópicas para incrementar la ADR porque entre el 17 y el 24% de los pólipos no son detectados durante la colonoscopia18.
En la técnica i-SCAN se modifican características espectrales reduciendo el ancho de banda de la transmisión espectral, utilizando filtros ajustados a las características de absorción de hemoglobina19. Tiene una mayor capacidad para detectar pólipos no protuberantes, lo que conduce a una tasa de detección más alta para todos los pólipos colorrectales, especialmente lesiones planas, las cuales son un factor importante en la omisión de detección de pólipos20.
En la colonoscopia subacuática se utiliza una bomba de agua para introducir agua al colon. En comparación con la insuflación, el procedimiento con agua es seguro21. El intercambio de agua mejora la calidad de la preparación intestinal, y un colon lleno de agua proporciona una perspectiva única durante la inserción que puede facilitar la detección de pólipos. Debido a que el intestino está menos distendido con agua que con aire, los pólipos aparecen menos aplanados. Y, sobre todo, el agua tiene un efecto de ampliación que puede mejorar la visibilidad de los pólipos22. Además, el agua reduce el dolor en los pacientes que están sedados ligeramente o que no están sedados, y también facilita la intubación cecal y mejora la visibilidad23,24.
El Endocuff es un dispositivo de plástico con 2 hileras de brazos flexibles que ayudan a aplanar la mucosa del colon durante la retirada25. El beneficio de la colonoscopia con Endocuff es que es una medida segura que mejora la PDR y la ADR en la población de tamizaje, sin eventos adversos severos, incluso en pacientes con diverticulosis, al extender los pliegues del colon. Además, el tiempo de intubación cecal no es mayor, y se puede detectar un número significativo de pólipos pequeños en el lado derecho del colon26.
El objetivo de nuestro estudio fue evaluar las técnicas colonoscópicas subacuática, con i-SCAN y con Endocuff, en comparación con la colonoscopia convencional de luz blanca, en relación con la PDR.
Materiales y métodosSe realizó un estudio prospectivo aleatorizado en la Unidad de Endoscopia del Hospital Kasr El-Ainy para evaluar la PDR a través de las técnicas colonoscópicas i-SCAN, Endocuff y subacuática en comparación con la colonoscopia convencional con luz blanca.
El presente estudio incluyó 100 sujetos egipcios y fue aprobado por el Comité de Ética del Departamento de Medicina Endémica y la Facultad de Medicina de la Universidad de El Cairo.
Criterios de inclusión: a) ambos sexos, y b) edad≥50 años.
Criterios de exclusión: a) pacientes con poliposis adenomatosa familiar, CCR o enfermedad inflamatoria intestinal, y b) pacientes con preparación intestinal pobre.
Un número igual de pacientes fue asignado a cada uno de los grupos de cada una de las 4 técnicas colonoscópicas, siguiendo una secuencia de aleatorización en bloque. La PDR fue calculada por separado para todos los pacientes en cada grupo.
Todos los pacientes incluidos en el estudio: 1) completaron su historia clínica, con atención especial a síntomas de alarma (por ejemplo, astenia, sangrado rectal, anorexia, pérdida de peso significativa, percepción de masa corporal, anemia hipocrómica microcítica); 2) se les hizo un examen clínico (por ejemplo, organomegalia, masas palpables, linfadenopatía, manifestaciones anémicas y caquexia); 3) firmaron un consentimiento informado, y 4) se sometieron a una colonoscopia.
Cada colonoscopia incluyó: a) preparación intestinal: se utilizó una dosis dividida de solución de polietilenglicol en la mayoría de los pacientes, quizá debido a su disponibilidad en Egipto, y los endoscopistas evaluaron la calidad de la preparación intestinal de acuerdo con la escala de preparación intestinal de Boston27; b) sedación: se logró la sedación profunda utilizando midazolam como preinducción, seguida de propofol; los signos vitales fueron monitorizados (ritmo cardiaco y saturación de oxígeno) por medio de un oxímetro de pulso durante todo el procedimiento; c) posición: los pacientes fueron colocados en posición lateral izquierda, y bajo ciertas circunstancias se cambió a posición supina para facilitar la introducción más profunda del colonoscopio; d) examen: el primer paso fue la inspección de la región perianal y el examen rectal digital; en ocasiones se utilizó lubricante estándar para facilitar la inserción del endoscopio; e) la realización de una de las siguientes técnicas colonoscópicas: i) i-SCAN (se utilizó el Pentax EPK-i5000® i-SCAN durante la retirada de la colonoscopia); ii) Endocuff (este dispositivo aplana la mucosa del colon durante la retirada por medio de las 2 hileras de brazos flexibles); iii) colonoscopia subacuática (Olympus® OFP) (una bomba de agua conduce este líquido adentro del colon por medio de un catéter insertado en un canal dentro del colonoscopio, lo que permite que el colon se infle con agua, en lugar de aire); iv) colonoscopia convencional con luz blanca, utilizando un colonoscopio Olympus CLV-U40®; se conducen instrumentos por canales de trabajo para realizar biopsias, retirar pólipos o cauterizar sangrado; se puede aplicar agua, aire y succión para proporcionar un campo visual más claro para la inspección; f) en todos los casos un experto realizó un examen colonoscópico completo hasta el ciego, con un tiempo mínimo de retirada de aproximadamente 7min; la PDR fue evaluada en cada una de las técnicas, y g) examen histopatológico: se tomaron biopsias de los pólipos detectados, ya fuera por método caliente o frío.
Métodos estadísticosLos datos fueron recogidos y codificados utilizando el programa SPSS® versión 25. La información fue resumida utilizando media y desviación estándar para las variables cuantitativas y frecuencias (número de casos) y frecuencias relativas (porcentajes) para las variables categóricas. Se realizaron comparaciones entre grupos utilizando el análisis de la varianza (ANOVA) post hoc, prueba con comparaciones múltiples28. La prueba de chi cuadrado se usó para comparar los datos categóricos, pero se utilizó una prueba exacta cuando la frecuencia esperada fue menor de 529. Las medias fueron comparadas con la prueba t y una p<0.05 fue considerada estadísticamente significativa.
Consideraciones éticasEl presente estudio fue aprobado por el Comité de Ética del Departamento de Medicina Tropical. Todos los pacientes enrolados en el estudio firmaron declaraciones de consentimiento informado que incluyeron posibles complicaciones de colonoscopia. Estas formas no fueron incluidas para evitar revelar datos sobre los pacientes.
ResultadosEl estudio fue realizado en 100 sujetos egipcios de ambos sexos que tenían≥50 años de edad. Fueron enrolados de la sala de Colonoscopia de la Unidad de Endoscopia Gastrointestinal, dentro del periodo comprendido entre agosto de 2017 y marzo de 2018.
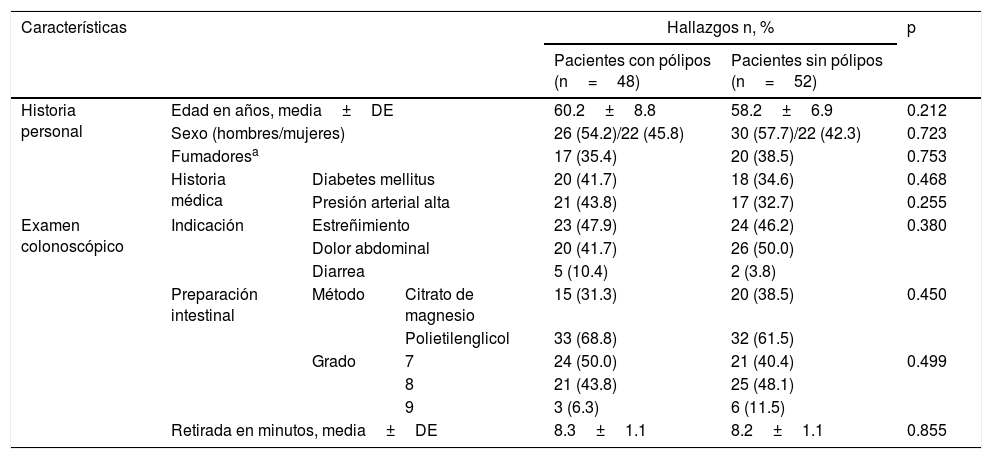
La tabla 1 muestra los parámetros de línea base, los datos demográficos generales y el examen colonoscópico de todos los pacientes participantes. La preparación intestinal fue llevada a cabo usando polietilenglicol en el 65% de los pacientes y citrato de magnesio en el 35%.
Parámetros de línea base de todos los sujetos del estudio
| Características | Hallazgos n, % | p | ||||
|---|---|---|---|---|---|---|
| Pacientes con pólipos (n=48) | Pacientes sin pólipos (n=52) | |||||
| Historia personal | Edad en años, media±DE | 60.2±8.8 | 58.2±6.9 | 0.212 | ||
| Sexo (hombres/mujeres) | 26 (54.2)/22 (45.8) | 30 (57.7)/22 (42.3) | 0.723 | |||
| Fumadoresa | 17 (35.4) | 20 (38.5) | 0.753 | |||
| Historia médica | Diabetes mellitus | 20 (41.7) | 18 (34.6) | 0.468 | ||
| Presión arterial alta | 21 (43.8) | 17 (32.7) | 0.255 | |||
| Examen colonoscópico | Indicación | Estreñimiento | 23 (47.9) | 24 (46.2) | 0.380 | |
| Dolor abdominal | 20 (41.7) | 26 (50.0) | ||||
| Diarrea | 5 (10.4) | 2 (3.8) | ||||
| Preparación intestinal | Método | Citrato de magnesio | 15 (31.3) | 20 (38.5) | 0.450 | |
| Polietilenglicol | 33 (68.8) | 32 (61.5) | ||||
| Grado | 7 | 24 (50.0) | 21 (40.4) | 0.499 | ||
| 8 | 21 (43.8) | 25 (48.1) | ||||
| 9 | 3 (6.3) | 6 (11.5) | ||||
| Retirada en minutos, media±DE | 8.3±1.1 | 8.2±1.1 | 0.855 | |||
DE: desviación estándar.
Los parámetros cuantitativos están expresados en medias±desviación estándar, y los parámetros cualitativos están expresados en números (porcentaje).
La tabla 2 muestra las características de los pólipos detectados por medio de las técnicas colonoscópicas evaluadas en el estudio. La PDR fue del 48% y la ADR fue del 17%. Ninguno de los pólipos fue maligno.
Características de los pólipos de colon detectados por las técnicas colonoscópicas evaluadas
| Características del pólipo | PDRn, % | Técnica colonoscópicaa, n (%) | ||||
|---|---|---|---|---|---|---|
| i-SCAN | Endocuff | Subacuática | Luz blanca | |||
| Pólipos detectados | 48 (48) | 14 (56/29.2) | 12 (48/25) | 12 (48/25) | 10 (40/20.8) | |
| Sitio | Derecho/descendiente | 17 (35.4) | 6 (24/35.3) | 3 (12/17.6) | 5 (20/29.4) | 3 (12/17.6) |
| Izquierdo/ascendente | 25 (52.1) | 6 (24/24) | 8 (32/32) | 5 (20/20) | 6 (24/24) | |
| Síncrono/derecho e izquierdo | 6 (12.5) | 2 (8/33.3) | 1 (4/16.7) | 2 (8/33.3) | 1 (4/16.7) | |
| Número | Único | 34 (70.8) | 9 (64.3/26.5) | 9 (75/26.5) | 10 (83.3/29.4) | 6 (60/17.6) |
| Múltiple | 14 (29.2) | 5 (35.7/35.7) | 3 (25/21.4) | 2 (16.7/14.3) | 4 (40/28.6) | |
| Histopatología | Hiperplásico | 27 (56.3) | 5 (35.7/18.5) | 10 (83.3/37) | 6 (50/22.2) | 6 (60/22.2) |
| Adenomatoso | 17 (35.4) | 9 (64.3/53) | 2 (16.7/11.8) | 2 (16.7/11.8) | 4 (40/23.5) | |
| Inflamatorio | 4 (8.3) | 0 | 0 | 4 (33.3/100) | 0 | |
PDR: tasa de detección de pólipos.
Las técnicas colonoscópicas evaluadas no tuvieron valores estadísticamente significativos mayores que los del procedimiento convencional, pero la tasa más alta fue la de la técnica i-SCAN (56%, p=0.26), seguida de la colonoscopia subacuática (48%, p=0.6) y la colonoscopia asistida con Endocuff (48%, p=0.4). Ninguno de los parámetros estuvo significativamente correlacionado con ninguna de las técnicas.
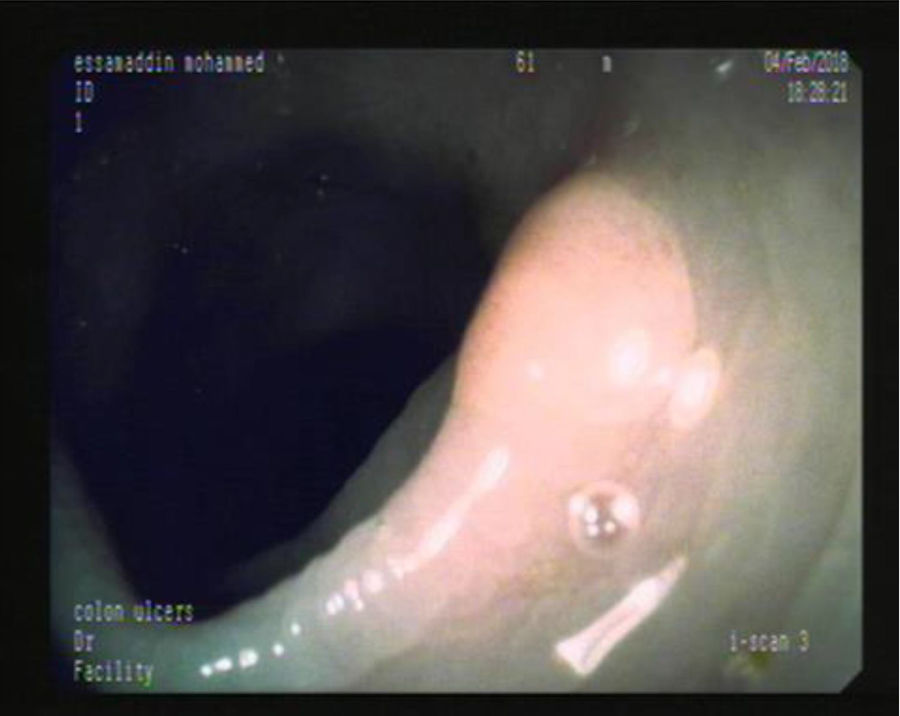
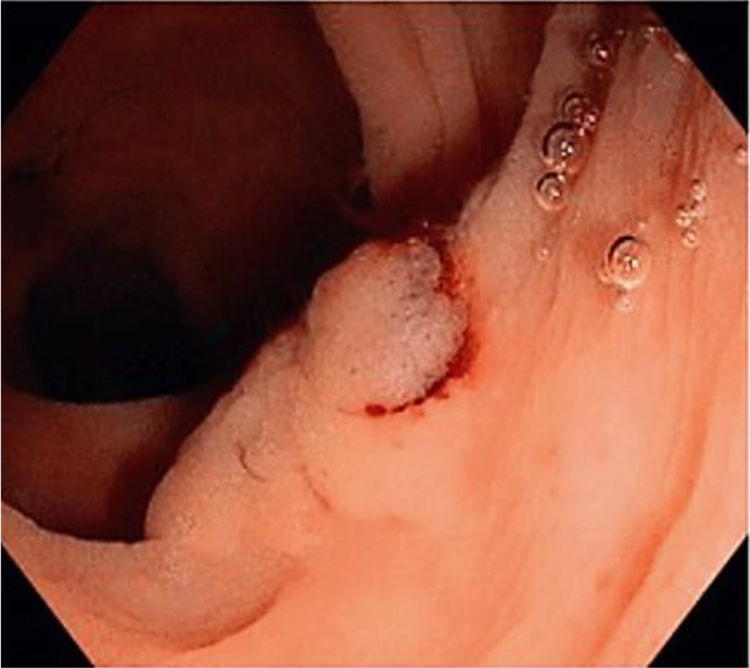
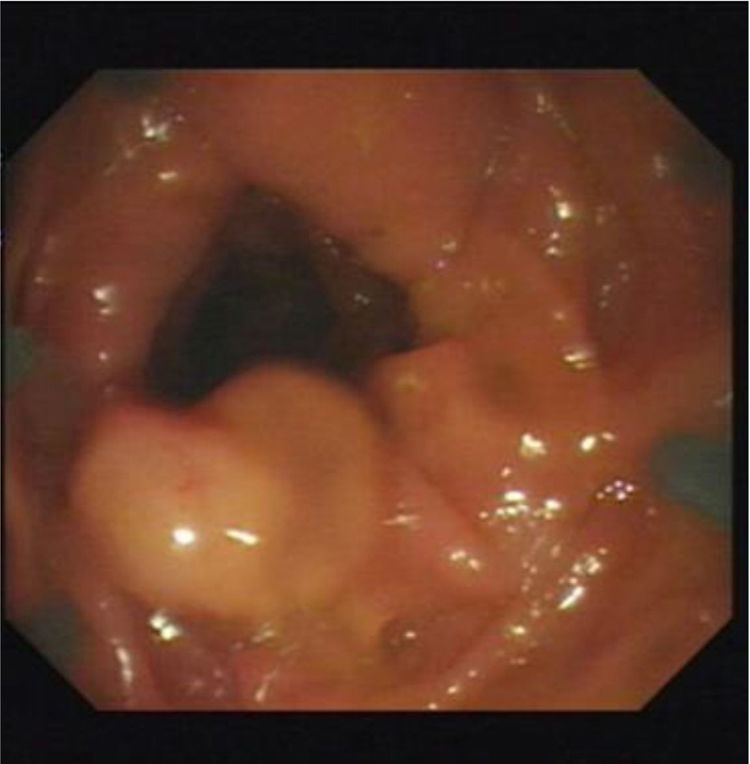
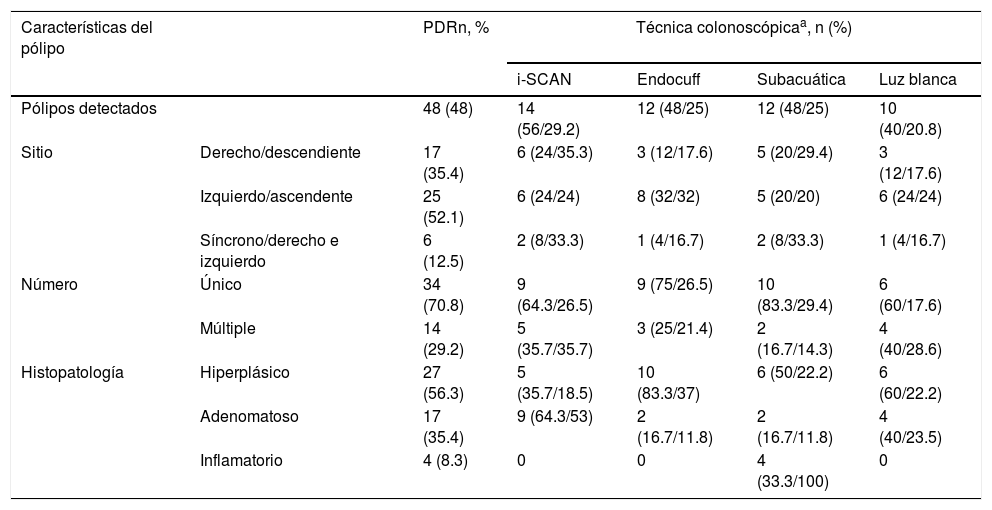
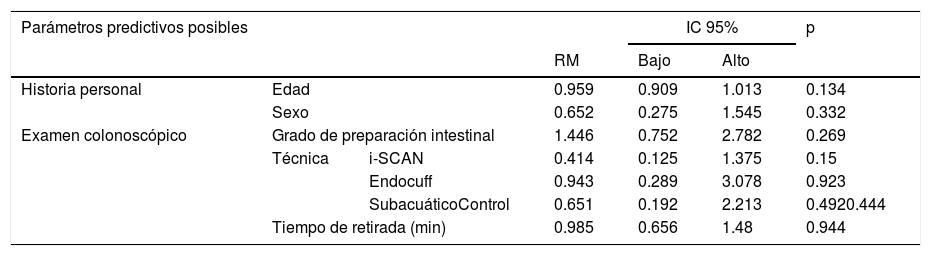
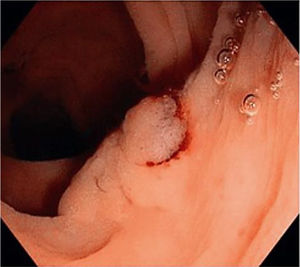
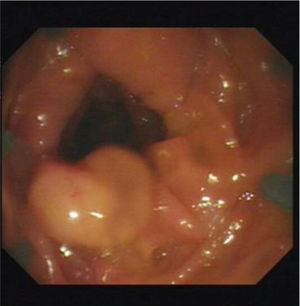
En las figuras 1, 2 y 3 se observan muestras de los pólipos detectados con las técnicas colonoscópicas i-SCAN, subacuática y Endocuff.
La tabla 3 muestra los resultados del análisis de la regresión logística univariada para predictores de la detección de pólipos.
Predictores de detección de pólipos por regresión logística univariada
| Parámetros predictivos posibles | IC 95% | p | ||||
|---|---|---|---|---|---|---|
| RM | Bajo | Alto | ||||
| Historia personal | Edad | 0.959 | 0.909 | 1.013 | 0.134 | |
| Sexo | 0.652 | 0.275 | 1.545 | 0.332 | ||
| Examen colonoscópico | Grado de preparación intestinal | 1.446 | 0.752 | 2.782 | 0.269 | |
| Técnica | i-SCAN | 0.414 | 0.125 | 1.375 | 0.15 | |
| Endocuff | 0.943 | 0.289 | 3.078 | 0.923 | ||
| SubacuáticoControl | 0.651 | 0.192 | 2.213 | 0.4920.444 | ||
| Tiempo de retirada (min) | 0.985 | 0.656 | 1.48 | 0.944 | ||
IC 95%: intervalo de confianza al 95%; RM: razón de momios.
Los pólipos de colon son protuberancias en la luz del colon. Normalmente aparecen de forma esporádica o como parte de otros síndromes y se clasifican en neoplásicos y no neoplásicos1.
Nuestro estudio incluyó 100 sujetos egipcios vistos en la sala de Colonoscopía de la Unidad de Endoscopia de Kasr El-Ainy. Los sujetos fueron divididos en 4 grupos con igual número de participantes para comparar 3 técnicas colonoscópicas diferentes (i-SCAN, subacuática, y Endocuff) con la colonoscopia convencional con luz blanca.
La técnica i-SCAN parece tener mayor sensibilidad para detectar pólipos no protuberantes. En consecuencia, se supone que esta técnica tiene una mejor PDR como resultado de su habilidad para detectar pólipos no protuberantes, lo cual conduce a una tasa general de detección más alta para todos los pólipos colorrectales, incluyendo los neoplásicos, los hiperplásicos y los inflamatorios20.
En el examen colonoscópico subacuático, el agua permanece en el colon, lo cual facilita la inserción del colonoscopio, y el agua se extrae principalmente durante la retirada del colonoscopio. Este método se enfoca principalmente en reducir el dolor durante una sigmoidoscopia o colonoscopia con o sin sedación. Sin embargo, existe la preocupación de que el agua contaminada con residuos de heces pueda disminuir la capacidad de detectar lesiones de mucosa sutiles debido a una visibilidad disminuida21. La infusión de agua ha probado mejorar la ADR. Hsieh et al.22 reportaron un incremento general en la ADR con intercambio de agua, en comparación con la insuflación de aire (56.7 vs. 43.3%). Los resultados positivos con la colonoscopia subacuática podrían ser debidos a una mejor calidad de la preparación intestinal y al hecho de que el intestino está menos distendido cuando está lleno de agua que cuando está lleno de gas, de tal forma que los pólipos aparecen menos aplanados. Además, el agua tiene un efecto de aumento que podría mejorar la visibilidad de los pólipos.
La colonoscopia asistida con Endocuff podría resultar en una ADR y PDR generales más altas. También podría ser más efectiva para detectar adenomas del lado derecho y permitir una mejor inspección de los pliegues del colon proximal. La detección de pólipos con mayor probabilidad de no ser visibles, especialmente en el reverso de los pliegues de la mucosa, podría llevar a realizar polipectomías más fácilmente. Una mayor fricción podría evitar el deslizamiento repentino del colonoscopio debido a que la hilera distal de los brazos del Endocuff puede ser utilizada para exponer el pólipo. Además, el dispositivo Endocuff no disminuye la visión de gran angular directa del colonoscopio y no causa mayores complicaciones30. Un estudio realizado para evaluar el efecto de la colonoscopia asistida con Endocuff en tasas de detección reveló una marcada mejora en la PDR (54.4 vs. 38.4%)31.
Los parámetros básicos en nuestro estudio de los pacientes que presentaron pólipos fueron similares a los de aquellos que no presentaron pólipos, lo cual implica que, a pesar de la falta de características específicas significativas, la detección de pólipos debería ser considerada para todos los candidatos mayores de 50 años de edad. Esto coincide con la U. S. Preventive Services Task Force para el tamizaje de CCR en individuos con un riesgo promedio y las recomendaciones de la Sociedad Americana de Endoscopia Gastrointestinal, las cuales especifican que la colonoscopia es una de las modalidades de tamizaje más eficientes. El Estudio Nacional de Pólipos demostró una reducción en la incidencia de CCR del 76% y una disminución de la mortalidad del 53% en pacientes que se sometieron a una polipectomía colonoscópica32.
Existió una predominancia comparable de hombres entre nuestros pacientes con y sin pólipos (54.2 y 57.7%, respectivamente), que fue similar a los hallazgos de Lieberman et al.33 y Kashiwagi et al.34. Estos autores reportaron una predominancia de hombres del 52 y el 69%, respectivamente. Dicha preponderancia podría ser explicada por el hecho de que los hombres buscan ese tipo de consulta médica más frecuentemente que las mujeres, muchas de las cuales encuentran el examen colonoscópico doloroso y vergonzoso, y la preparación intestinal, difícil. Además, muchas enfermedades del colon son más comunes en hombres. Por el contrario, Ritvo et al.35 demostraron una predominancia del 60% de mujeres en su estudio.
La PDR, el porcentaje de colonoscopias en las cuales se detecta uno o más pólipos, es un sustituto para la ADR36. El estándar mínimo para la PDR es estimado en un 40%, lo cual corresponde a una ADR del 25%37. En el presente estudio, la PDR fue del 48% y la detección de un solo pólipo tuvo una probabilidad de más de 2 veces con respecto a la detección de múltiples pólipos (70.8 vs 29.2%, respectivamente), pero sin diferencia estadísticamente significativa. Nuestra PDR fue similar a la reportada en estudios previos de España (45.8%)38 y los Estados Unidos (49%)39. En Francia se reportaron tasas ligeramente más bajas (35.5%)40, y en Irán (23.5%)41. Esta última tasa fue atribuida a la estructura de menor edad en los pacientes iranís42. Por otro lado, se reportaron tasas mucho menores en Kuwait (20%), Omán (12.1%) y Malasia (11.5%), las cuales podrían estar relacionadas con la relativamente baja media de la edad de la población en esos estudios41.
La detección de pólipos fue más alta en hombres (55%) en nuestro estudio, en coincidencia con los resultados de Kim et al.42, quienes reportaron una tasa de pólipos 1.5 veces más alta en hombres en comparación con mujeres de la misma edad. Esto podría ser atribuido a la mayor prevalencia de tabaquismo, considerado un factor de riesgo para el desarrollo de pólipos, en hombres que en mujeres. Ninguna de las mujeres en el presente estudio eran fumadoras43.
Histopatológicamente, los pólipos hiperplásicos tuvieron la mayor prevalencia (56.25%) en nuestro estudio, seguidos de los pólipos adenomatosos (35.4%) y los pólipos inflamatorios (8.35%). Uraoka et al.44 y Kumar et al.45 reportaron resultados similares, con una predominancia de pólipos hiperplásicos sobre pólipos adenomatosos (41 vs. 34%, respectivamente). Al contrario, Vişovan et al.46 y Filho et al.47 describieron una predominancia de pólipos adenomatosos sobre pólipos hiperplásicos (66 vs. 32% y 58.9 vs. 34.7%, respectivamente).
La mayoría de los pólipos adenomatosos se convierten en carcinoma de colon durante un periodo de 10 años. El Estudio Nacional de Pólipos mostró una reducción en la incidencia de CCR del 76% y una reducción de la mortalidad del 53% en los pacientes que se sometieron a una polipectomía colonoscópica32.
En nuestro estudio, la diferencia respecto a los pólipos detectados en pacientes de edad avanzada frente a aquellos en quienes no se detectaron pólipos fue insignificante, por ejemplo, la edad avanzada por sí misma es una potencialidad para presentar pólipos de colon. La edad avanzada es también un factor de riesgo para pólipos de lado derecho48.
La PDR fue mayor que la ADR (48 vs. 17%, respectivamente) en el presente estudio y la colonoscopia tradicional con luz blanca tuvo la tasa de detección más baja (40%).
Las colonoscopias con la técnica i-SCAN tuvieron la PDR más alta (56%) en nuestro estudio. Heresbach et al.20 y Bisschops et al.49 escribieron que la i-SCAN tuvo una mayor habilidad para detectar pólipos no protuberantes, lo cual llevó a una mayor tasa de detección para todos los pólipos colorrectales, especialmente las lesiones planas, que son fáciles de omitir. Sin embargo, en nuestros resultados, la PDR con el i-SCAN no fue significativamente más alta que la PDR con colonoscopia convencional con luz blanca. Esto coincidió con la revisión de Cochrane y el metaanálisis realizados, respectivamente, por Nagorni et al.50 y Dinesen et al.51, quienes no encontraron diferencias significativas en la ADR o la PDR al comparar la técnica i-SCAN con la colonoscopia de luz blanca. Al contrario, Kim et al.42 reportaron una PDR significativamente más alta en la colonoscopia con i-SCAN que con el procedimiento estándar con luz blanca (52 vs. 38.1%, p=0.004). Una explicación es el hecho de que el dispositivo i-SCAN tiene una mayor habilidad para detectar pólipos no protuberantes, lo cual es un factor importante de influencia en la omisión de pólipos20.
También reportamos una PDR más alta, aunque no estadísticamente significativa, de la colonoscopia subacuática (52%) en comparación con la colonoscopia estándar de luz blanca. Esto fue similar a los hallazgos de Cadoni et al.52 y Patel et al.53, quienes describieron una PDR más alta con intercambio de agua.
Además, se observó una PDR mayor, aunque no estadísticamente significativa, en el grupo con Endocuff (48%) en comparación con el grupo de colonoscopia estándar de luz blanca, en coincidencia con los estudios alemanes de Floer et al.31 y Biecker et al.54. Estos autores favorecieron la técnica con Endocuff sobre la técnica convencional por su PDR más alta (55.4 vs. 38.4% y 56 vs. 42%, respectivamente). Las mayores tasas podrían ser explicadas por un mayor desdoblamiento de la mucosa del colon durante la retirada del colonoscopio. Al contrario, un estudio holandés, realizado por Van Doorn et al.55, no encontró ninguna ventaja en la utilización del Endocuff respecto al número de pacientes con al menos un adenoma (ADR del 52% para ambos brazos del estudio).
Concluimos que la colonoscopia con i-SCAN es una técnica muy eficiente, pero reconocemos la necesidad de realizar un estudio con un mayor número de pacientes.
Limitaciones del estudioNuestro estudio fue llevado a cabo en un solo hospital, que aun siendo grande, la muestra de pacientes fue pequeña.
AutoríaM. Abdelbary: autor principal y diseño del estudio; S. Hamdy y H. Shehab: examen colonoscópico de los pacientes enrolados; N. ElGarhy: evaluación clínica, enrolamiento de pacientes y borrador de manuscrito; M. Menesy: análisis de datos e interpretación; R. Marzaban: revisión de literatura y revisión de manuscrito.
FinanciaciónNo se recibió ningún apoyo financiero con relación a este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.