El síndrome de vómitos cíclicos (SVC) es un trastorno caracterizado por episodios recurrentes e impredecibles de vómitos intensos, separados por periodos de bienestar aparente. Este trastorno, que afecta principalmente a niños y adolescentes, aunque puede persistir en la edad adulta, ha sido objeto de un extenso estudio y análisis en la literatura médica recientemente. El propósito de esta revisión es explorar los aspectos más importantes de la epidemiología, la fisiopatología, los subtipos, los criterios diagnósticos y el manejo actual del SVC. Aunque la etiología exacta sigue siendo desconocida, se postulan factores genéticos (polimorfismos), alteraciones del sistema nervioso y desregulación autonómica, y ambientales (uso y abuso de cannabinoides) como posibles desencadenantes. El SVC presenta desafíos significativos en términos de diagnóstico, ya que no existe una prueba específica para confirmar su presencia. Se requiere una evaluación minuciosa de los síntomas y la exclusión de otras posibles causas de vómitos recurrentes. En cuanto al tratamiento, el manejo del SVC suele adoptar un enfoque multidisciplinario. Se exploran opciones farmacológicas, como antieméticos y medicamentos preventivos, así como terapias conductuales y de apoyo psicológico. La personalización del tratamiento es esencial, adaptándolo a las necesidades individuales de cada paciente. A pesar de los avances en la comprensión del SVC, sigue siendo un desafío clínico significativo. Este trastorno impacta la calidad de vida de los afectados y sus familias, destacando la necesidad continua de investigación y desarrollo de estrategias de tratamiento más efectivas.
Cyclic vomiting syndrome (CVS) is a disorder characterized by recurrent and unpredictable episodes of intense vomiting, interspersed with periods of apparent wellbeing. This disorder, which primarily affects children and adolescents but can persist into adulthood, has recently been the subject of extensive study and analysis in the medical literature. The aim of the present review is to examine the most important aspects of the epidemiology, pathophysiology, subtypes, diagnostic criteria, and current management of CVS. Even though the exact etiology remains unknown, genetic factors (polymorphisms), nervous system alterations and autonomic dysregulation, and environmental factors (use and abuse of cannabinoids) are postulated as possible triggers. CVS has significant diagnostic challenges, given that there is no specific test for confirming its presence. Thorough evaluation of symptoms and the ruling out of other possible causes of recurrent vomiting are required. Management of CVS typically involves a multidisciplinary approach. Pharmacologic options are explored, such as antiemetics and preventive medications, as well as behavioral and psychologic support therapies. Treatment personalization is essential, adapting it to the individual needs of each patient. Despite advances in the understanding of CVS, it remains a significant clinical challenge. This disorder impacts the quality of life of those affected and their families, underscoring the ongoing need for research and the development of more effective treatment strategies.
El síndrome de vómitos cíclicos (SVC) es un trastorno crónico caracterizado por episodios de vómitos incoercibles que alternan con periodos asintomáticos o de síntomas mínimos1. El SVC fue descrito por Heberden en 1806, como una patología pediátrica que se caracteriza por vómitos recurrentes y que es influida por trastornos psicológicos2. Sin embargo, en la actualidad se conoce que puede tener un inicio en la adultez con un comportamiento clínico similar en ambos grupos de edad3.
Los episodios de emesis tienden a ser incapacitantes impactando negativamente la calidad de vida. Por lo tanto, el SVC ha sido objeto de mayor atención por parte de la comunidad científica en los últimos años, logrando avances sustanciales en su fisiopatología, factores asociados y tratamiento. A pesar de los avances realizados, el SVC sigue siendo una entidad poco reconocida en la actualidad por el gastroenterólogo. Esto fue observado en una cohorte de pacientes que cumplían criterios de Roma para dicha entidad, de estos solo el 4% recibió un diagnóstico de SVC4. Estos datos ponen de relieve el escaso reconocimiento del síndrome, provocando un retraso en el diagnóstico. Esto tiene como consecuencia una mayor frecuencia de visitas al Servicio de Urgencias, aumento de costos sanitarios y tratamientos subóptimos que derivan en malos resultados para los pacientes3,5,6.
Tomando en cuenta lo anterior, nuestro propósito se centrará en realizar una revisión bibliográfica detallada sobre la epidemiología, fisiopatología, subtipos, criterios diagnósticos y el manejo actual del SVC.
Material y métodosSe realizó una revisión que valoró y analizó los artículos publicados en la bibliografía nacional y mundial acerca del diagnóstico y tratamiento del SVC. Para ello, se llevó a cabo una búsqueda cruzada en MEDLINE, Embase, Web of Science y Scopus para todos los estudios disponibles desde enero de 2000 hasta diciembre de 2022 de los siguientes términos (en español y sus respectivas traducciones y abreviaturas en inglés): vómitos, cíclicos, náusea, síndrome, hiperémesis, cannabinoides, pediatría, epidemiología, diagnóstico, tratamiento, guías, consensos y revisión.
A criterio de los revisores, se identificaron los artículos más relevantes al respecto, se consideraron elegibles y se incluyó la información obtenida de revisiones técnicas, revisiones sistemáticas, metaanálisis y guías clínicas sobre SVC, así como la información proveniente de estudios observacionales, series de casos, reportes de caso y estudios de intervención en pacientes con SVC. Se ordenó la bibliografía y se realizó la revisión considerando los siguientes apartados: epidemiología, fisiopatología, subtipos, criterios diagnósticos y el manejo actual del SVC. De un total de 416 resúmenes de artículos encontrados en la búsqueda, se incluyó la información proveniente de 124 en extenso. Aquellos artículos en los que no fue posible su obtención en extenso fueron excluidos.
EpidemiologíaEl SVC afecta tanto a niños como adultos. Un estudio poblacional en adultos demostró una prevalencia del 2%, 1% y 0.7% en Estados Unidos, Reino Unido y Canadá, respectivamente7. Asimismo, un estudio argentino reportó una prevalencia del 1% en adolescentes8. La prevalencia del SVC en la población mexicana se desconoce. Sin embargo, un estudio realizado en escolares mexicanos evaluó la prevalencia de trastornos del eje cerebro-intestino encontrando una prevalencia de 0.3% de SVC en este grupo seleccionado9.
El SVC es más frecuente en mujeres y la edad media de presentación en adultos es de 37 años. Un estudio que evaluó 101 adultos con diagnóstico de SVC mostró que el 86% de la cohorte era del sexo femenino3. En la misma cohorte estudiada se encontró una predilección por la raza blanca en el 78%, un 17% de afroamericanos y un 5% de hispanos3.
El SVC se asocia a múltiples comorbilidades como migraña, trastorno de ansiedad generalizada, trastorno de pánico, depresión mayor, disfunción autonómica y consumo de cannabis10–12. La probabilidad de presentar una comorbilidad psiquiátrica en adultos con SVC es 40 veces mayor que en la población general, siendo la ansiedad y la depresión las más frecuentes, en el 69% y el 48%, respectivamente. Esto subraya la necesidad de realizar una evaluación biopsicosocial para obtener mejores resultados en los pacientes13. Otro hallazgo importante es que aproximadamente el 40% de los pacientes con SVC consumen o han consumido ocasionalmente cannabis e informan que esto mejora sus síntomas; por el contrario, el consumo diario y prolongado de cannabis se asocia a hiperémesis14,15.
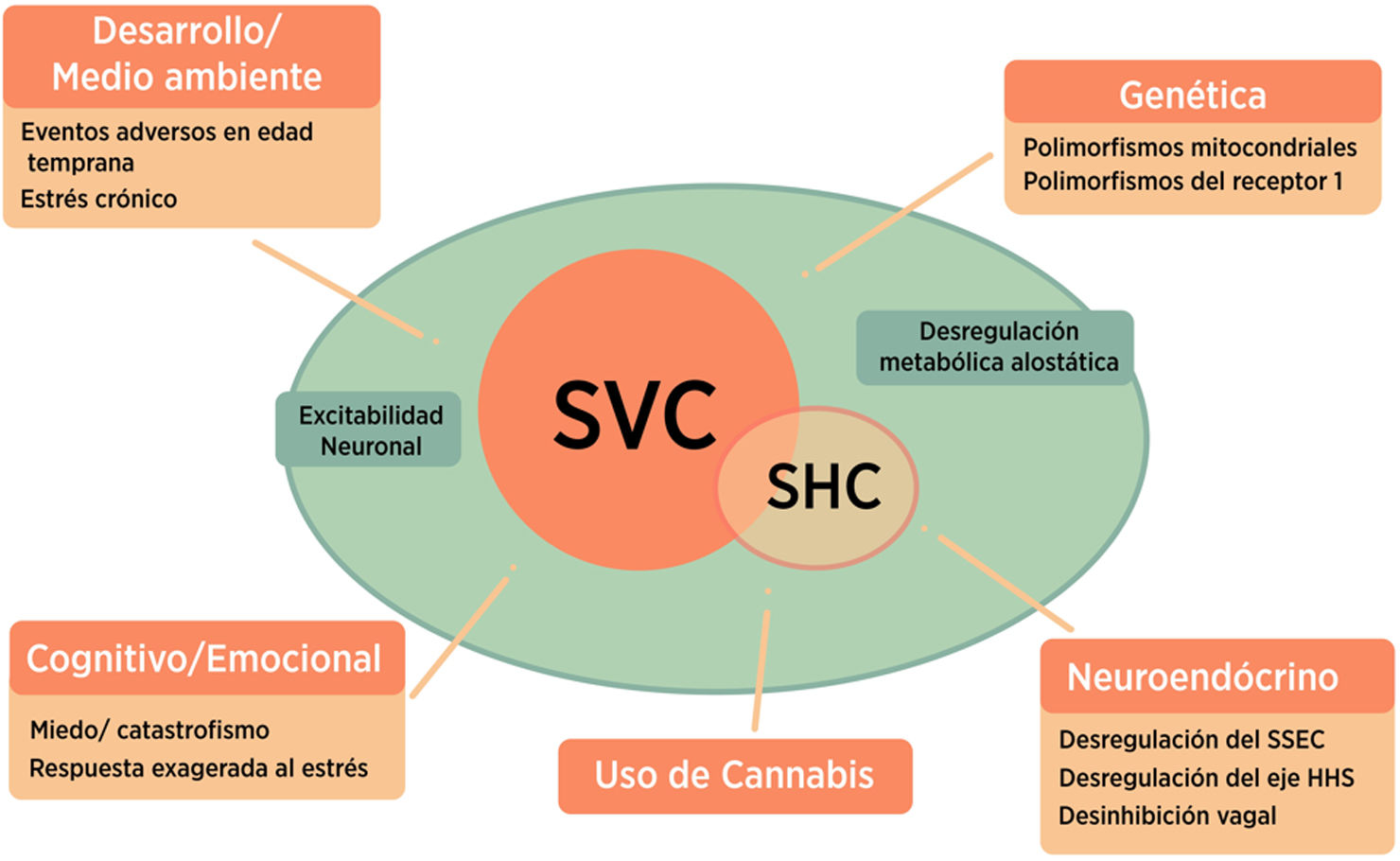
FisiopatologíaSe han descrito diversos mecanismos y comorbilidades que interactúan entre sí dando lugar a combinaciones que conducen a la emesis cíclica. Los mecanismos propuestos sobre la fisiopatología del SVC se mencionan a continuación (fig. 1).
Posibles mecanismos fisiopatológicos del SVC. Los datos actuales sugieren que el SVC se explica por una combinación de factores genéticos y del huésped que conducen a la emesis. Se cree que el SHC es un subconjunto del SVC y puede explicarse por el desarrollo de síntomas en individuos genéticamente predispuestos.
SHC: síndrome de hiperémesis cannabinoide; SVC: síndrome de vómitos cíclicos; SSEC: sistema de señalización endocannabinoide; HHS: eje hipotalámico-hipofisario-suprarrenal.
* Figura adaptada de la referencia 67.
Recientemente se ha identificado una mayor frecuencia de los polimorfismos mitocondriales (16519T y 3010A) en pacientes pediátricos con SVC en comparación con los controles16–18, sin embargo, esto no se encontró en la población pediátrica asiática, ni en adultos19,20. Esta variabilidad puede deberse al pequeño tamaño de muestras, el sesgo involuntario durante el reclutamiento de pacientes y las diferencias en las frecuencias alélicas entre las distintas etnias.
Alteraciones en el sistema de señalización endocannabinoideEl sistema de señalización endocannabinoide desempeña un papel importante en el SVC21,22. Este sistema está formado por ligandos endógenos, la N-araquidoniletanolamina, el 2-araquidonilglicerol (endocannabinoides) y dos receptores cannabinoides acoplados a proteínas G (el receptor cannabinoide tipo 1 [CNR1] y el receptor cannabinoide tipo 2 [CNR2]), los cuales regulan la motilidad gastrointestinal23,24. Los agonistas de los receptores CNR1 y CNR2 evitan los vómitos y, por el contrario, los antagonistas de los receptores CNR1 los provocan. Los polimorfismos en el gen del CNR1 rs806380 se asociaron con un riesgo mayor de padecer SVC. Además, la concentración sérica de lípidos relacionados con los endocannabinoides, N-oleoiletanolamida y la N-palmitoiletanolamida, es mayor en la fase sintomática del SVC y se correlacionan positivamente con varios de sus síntomas. Estos datos apoyan la hipótesis de que el consumo crónico de cannabis provoca un aumento de las respuestas al estrés durante el SVC21 y demuestran que las variaciones dentro de la vía endocannabinoide conllevan un mayor riesgo de desarrollar SVC.
Desregulación del sistema nervioso autónomoEl sistema nervioso autónomo desempeña un papel destacado en la emesis. Una serie de núcleos del tronco encefálico recibe información de los nervios aferentes vagales y simpáticos durante la estimulación emética. Posteriormente, se generan señales eferentes que inician las acciones musculares estereotipadas y coordinadas implicadas en el vómito. Muchos adultos con SVC presentan una desregulación del sistema nervioso simpático10,25,26. Algunos estudios han reportado aumentos del tono simpático en pacientes con SVC, esto consignado mediante diversas pruebas de la función autonómica, como el índice de ajuste postural, variabilidad de la frecuencia cardiaca, prueba de la mesa basculante y las pruebas sudomotoras10,27–29. El hallazgo más frecuente en estos informes fue una anomalía adrenérgica, además se notificaron anomalías coexistentes de la función colinérgica vagal. Basándose en estos estudios que describen características disautonómicas en pacientes con SVC, los investigadores han planteado la hipótesis de que este desequilibrio pueda causar que los pacientes sean más susceptibles de generar una respuesta descontrolada a las señales eméticas centrales27.
Durante la fase interepisódica de la enfermedad, los pacientes con SVC pueden presentar vaciado gástrico acelerado hasta en el 59% de los casos30. De hecho, el vaciado gástrico acelerado puede ser un marcador indirecto de la desregulación autonómica subyacente en el SVC. Es importante mencionar que ante la presencia de vaciado gástrico retardado esto no debe interpretarse como gastroparesia, especialmente en el contexto de vómitos episódicos típicos. Por lo anterior, no se recomienda la realización de pruebas de vaciamiento gástrico para el diagnóstico del SVC.
Esta desregulación observada del sistema nervioso autónomo tiene implicaciones en el tratamiento del SVC, como la neuromodulación vagal con estimulación eléctrica percutánea del campo nervioso31, la cual mejora los síntomas modulando la función vagal en pacientes con trastornos gastrointestinales del eje intestino-cerebro, incluidos aquellos con SVC32. Además, se ha demostrado que la neuromodulación beneficia predominantemente al subgrupo de pacientes que tienen una función vagal deficiente33.
AlostasisLa homeostasis no puede explicar completamente los cambios autonómicos que acompañan a los acontecimientos puramente cognitivos y emocionales. Un marco conceptual más completo para el control autonómico que da cuenta de estas observaciones se conoce como alostasis34. La regulación alostática requiere «comandos centrales» que orquestan cambios en la actividad autonómica y motora. Estas órdenes centrales pueden proceder en última instancia de la corteza cerebral y de una red de núcleos centrales esenciales para la regulación autonómica. En el marco de la regulación alostática, los acontecimientos cognitivos, la anticipación de los cambios de comportamiento y las necesidades fisiológicas, así como las asociaciones aprendidas, configuran los patrones de control autónomo a través de cambios en la actividad neuronal. La privación del sueño, los trastornos del estado de ánimo, el estrés crónico y los acontecimientos vitales adversos tempranos pueden conducir a una alteración de la regulación alostática a través de la plasticidad neural. Dicha plasticidad neural inadaptada podría conducir patrones anormales de actividad autonómica y neuroendocrina35,36. El hecho de que los vómitos y las arcadas durante la fase emética del SVC se produzcan principalmente cuando el estómago está vacío implica que los mecanismos alostáticos de retroalimentación son desordenados, lo que podría dar lugar a una disminución del umbral para vómitos y arcadas, independientemente de la necesidad fisiológica o de la información periférica. Este sistema neural podría desarrollarse de forma anormal para activarse mediante un umbral bajo ante estímulos mentales y/o fisiológicos. Esta observación puede ser análoga a los patrones anticipatorios de taquipnea en pacientes con ataques de pánico37. La predicción de este modelo sería que cualquier factor que alivie de manera aguda el estrés o la ansiedad en pacientes con SVC podría mejorar los patrones de vómitos impulsados centralmente.
La hiperexcitabilidad neuronal puede representar un vínculo común entre el SVC y otros trastornos del sistema nervioso central (SNC)38–40. La hiperexcitabilidad puede ser consecuencia de variantes genéticas en la estructura y función de los canales iónicos y/o receptores de neurotransmisores, o puede ser el resultado de un desarrollo aberrante de los circuitos neuronales. Los estudios que delinean alteraciones en la conectividad funcional de las redes cerebrales, en particular dentro de aquellas que implican a la amígdala y el córtex insular, pueden explicar mejor el papel de las anomalías cerebrales en el SVC41. En un estudio de casos y controles los pacientes con SVC mostraron una mayor integridad funcional de las redes de conectividad intrínseca de la saliencia con la ínsula media/posterior, una región cerebral clave para la náusea y el procesamiento viscerosensorial41. Es posible que esta hiperexcitabilidad neuronal y un umbral más bajo para provocar patrones específicos dentro del SNC predispongan a que se desencadenen los episodios estereotípicos de vómitos en el SVC.
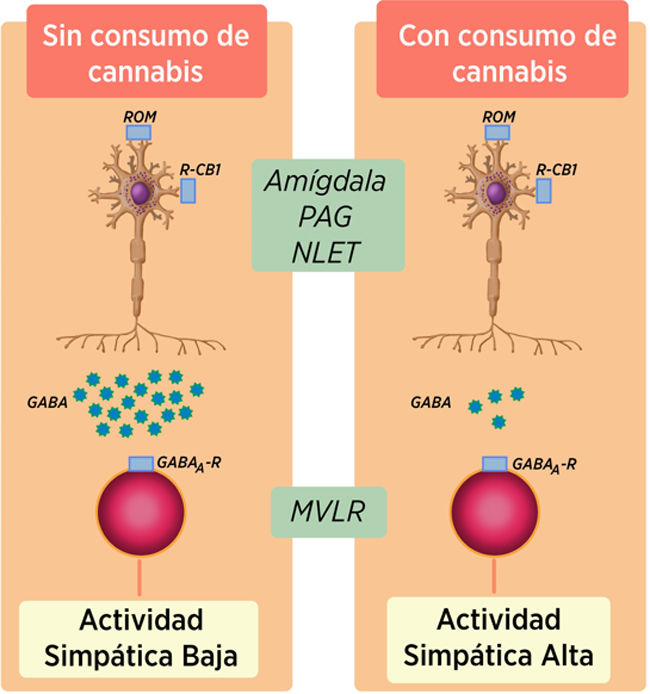
Asociación con cannabisEl cannabis se utiliza desde hace siglos con fines recreativos y medicinales. El ingrediente activo del cannabis es el Δ 9- tetrahidrocannabinol (THC), un agonista del CNR1 y el cannabidiol. Mientras que el THC ejerce sus efectos actuando sobre el CNR1, el cannabidiol no tiene ninguna actividad psicotrópica y actúa sobre los receptores 5-hidroxitriptamina 1A (5-HT1A)42. Existen datos clínicos que muestran que el cannabis tiene propiedades antieméticas y es empleado frecuentemente por los pacientes con SVC para aliviar los síntomas como la náusea y los vómitos, la falta de apetito y el estrés14. Contrario a esto, existen varias series de casos sobre el síndrome de hiperémesis cannabinoide (SHC) que implican al uso crónico de cannabis como causa de vómitos43–45. Aproximadamente el 20% de los pacientes con SHC consumen cannabis ≥ 4 veces a la semana, mientras que el resto son consumidores ocasionales. Es necesario determinar cómo el consumo de cannabis perpetúa los síntomas en el SHC. El consumo de cannabinoides se asocia de forma independiente con aumentos del flujo simpático46,47. Esta influencia en la actividad simpática se da mediante la inhibición de la actividad de las neuronas ácido gamma-aminobutírico (GABA)érgicas descendentes48–51. Dado que esta entrada GABAérgica descendente inhibe, en última instancia, la actividad de la médula rostral ventrolateral (rVLM)52, se esperaría que la inhibición crónica de cannabinoides de esta entrada aumentara la actividad de las neuronas rVLM diana (fig. 2). La disminución GABAérgica al núcleo del tracto solitario podría reducir el umbral del vómito.
Los expertos consideran que el SHC es un subconjunto del SVC, basándose en presentaciones clínicas similares y en la falta de pruebas objetivas que demuestren la causalidad se ha planteado la hipótesis de que el consumo crónico de cannabis puede desenmascarar los síntomas en individuos genéticamente predispuestos y provocar hiperémesis14. Además, la concentración de THC en los productos del cannabis ha aumentado exponencialmente con el tiempo, lo que también podría explicar los efectos paradójicos del consumo de cannabis al ser antiemético en dosis bajas y proemético en concentraciones altas53.
Subtipos clínicos del síndrome de vómitos cíclicosEl reconocimiento de los distintos subtipos del SVC es posible mediante una historia clínica detallada. Un enfoque terapéutico individualizado para cada subgrupo derivará en mejores resultados a corto y largo plazo.
Síndrome de vómitos cíclicos catamenialSe caracteriza por asociarse con el inicio de los periodos menstruales. Este subtipo resalta el papel de la influencia hormonal en el SVC, y algunas series de casos describen esta asociación54–56. Una relación similar entre la migraña y los periodos menstruales sugiere un paralelismo en la fisiopatología57. Este mecanismo desencadenante puede reflejar la sensibilidad a la disminución de estrógenos, que se produce justo antes de la menstruación. El tratamiento con análogos de la hormona liberadora de gonadotropina (GnRH), suplementos de estrógenos, anticonceptivos orales con dosis bajas de estrógenos o solo progesterona consiguen una prevención satisfactoria, lo que sugiere la importancia de mantener una adecuada regulación del eje hipotálamo-hipófisis en el SVC58,59. El reconocimiento de este subtipo pone de relieve la importancia de comprender más a fondo los mecanismos patológicos del SVC y, en consecuencia, otorgar un tratamiento personalizado altamente eficaz.
Síndrome de hiperémesis cannabinoideDestacamos la importancia del SHC como diagnóstico diferencial del SVC, ya que el tratamiento farmacológico será diferente para cada entidad. La mayoría de los pacientes con SVC acuden al Servicio de Urgencias con episodios de vómitos, náusea y dolor abdominal60. Estos síntomas son los mismos que aquejan al paciente con SHC. Por lo tanto, la diferenciación clínica puede ser difícil. Los puntos clave para su diferenciación radican en que la intensidad del consumo de cannabis y la cronicidad es mayor en el síndrome de hiperemésis cannabinoide además del alivio de los síntomas tras la abstinencia ayuda a definir el SHC según los criterios de Roma IV (tabla 1).
Criterios diagnósticos del síndrome de hiperémesis cannabinoide de acuerdo al consenso de Roma IV1
| Criterios diagnósticos del síndrome de hiperémesis cannabinoide |
|---|
| Episodios de vómito estereotipados similar a lo presente en el síndrome de vómitos cíclico en términos de inicio, duración y frecuencia. |
| Presentación posterior al consumo prolongado y excesivo de cannabis |
| Mejoría clínica posterior al cese prolongado del uso de cannabis |
| * Criterios cumplidos durante los últimos tres meses con inicio de los síntomas al menos seis meses antes del diagnóstico. |
Tabla adaptada de la referencia: Stanghellini et al.1
La ansiedad y la depresión son comorbilidades frecuentes del SVC. En un estudio se observó una prevalencia de ansiedad del 47% entre los niños con SVC11. Entre los adultos, la prevalencia de ansiedad varía ampliamente, del 15% al 84% y se asoció de forma significativa en un análisis multivariante61,62. De forma similar, se reporta que hasta el 78% de los adultos con SVC padecen depresión leve a severa62. Aunque los mecanismos fisiopatológicos directos de la ansiedad o la depresión en el SVC siguen sin estar claros, la elevada incidencia de estos trastornos sugiere que la regulación emocional tiene un rol importante en la fisiopatología y desarrollo del SVC. Por ejemplo, una proporción considerable de pacientes con SVC también ha señalado la «ansiedad anticipatoria» como posible factor desencadenante11,63. Además, aquellos con intolerancia a la incertidumbre experimentan un mayor impacto negativo en la calidad de vida, independientemente de la frecuencia real de los ataques de SVC experimentados64. Estos pacientes pueden beneficiarse especialmente de la terapia cognitivo-conductual. Por último, es interesante que los sujetos con SVC experimenten con frecuencia ataques de pánico. Tanto el trastorno de pánico como el SVC siguen un patrón de temporalidad similar y comparten signos clínicos de activación del sistema nervioso simpático, lo que sugiere que pueden compartir algunos mecanismos fisiopatológicos63. Diversos expertos sugieren que las experiencias adversas previas o el estrés crónico pueden ser factores de riesgo para el desarrollo de SVC65, ya que esto puede afectar al procesamiento neuronal y alterar la regulación alostática predisponiendo a determinados pacientes65–67. Debido a la alta prevalencia de los trastornos del estado de ánimo en el SVC, las directrices clínicas recientes sugieren que se ofrezca algún tipo de terapia «mente-cuerpo», como la meditación, las terapias de relajación o incluso la cognitivo-conductual a la mayoría de los pacientes68.
Relacionado con la dietaAunque, en la actualidad, la evidencia científica es escasa para establecer una relación entre alimentos específicos y el SVC, se ha descrito que el consumo de chocolate, queso y glutamato monosódico pueden desencadenar ataques de SVC60,69. Curiosamente, la ingesta de estos alimentos específicos se asocia desde hace tiempo con la migraña70. Existen varios mecanismos que pueden explicar estas asociaciones. Los olores específicos y posiblemente los sabores pueden precipitar las migrañas, y es posible que la codificación neuronal de estos estímulos contribuya a iniciar un ataque de SVC71. También han planteado la posibilidad de que las alergias alimentarias puedan actuar como desencadenantes de SVC. En una serie de pacientes con este fenotipo de SVC, la evitación del alimento para el que las pruebas confirmaron una sensibilidad específica provocó la resolución de los ataques de SVC72. Aunque estas pruebas siguen siendo limitadas, sugieren que las exposiciones ambientales, especialmente las relacionadas con los alimentos ingeridos, pueden ser objetivos terapéuticos relevantes.
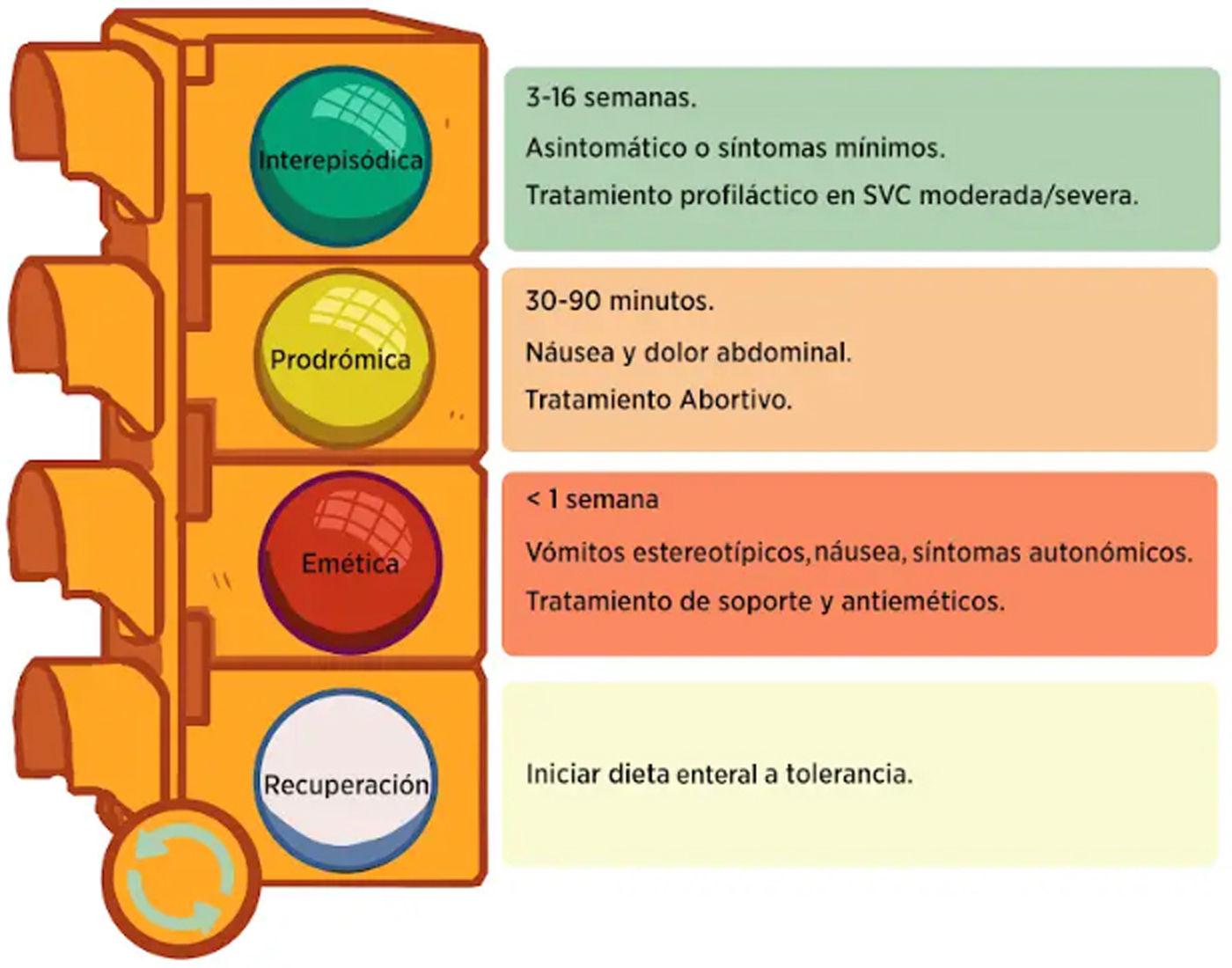
Fases clínicas del síndrome de vómitos cíclicosEl SVC consta de cuatro fases descritas detalladamente por Fleisher et al., las cuales se observan en la figura 363.
- 1.
Fase interepisódica. En esta fase, los pacientes están relativamente libres de síntomas, pero aproximadamente el 30% de los adultos presentan dispepsia y náusea interepisódica, lo que no debe excluir el diagnóstico de SVC.
- 2.
Fase prodrómica. La fase prodrómica precede a la fase emética y se registra en aproximadamente el 61-93% de los pacientes adultos3,63,73. Los síntomas pueden incluir náusea, dolor abdominal y múltiples síntomas autonómicos como diaforesis, intolerancia al frío y calor, sialorrea, palidez, letargo. Los pacientes también pueden experimentar síntomas de pánico. Tiene una duración 30 a 90 minutos y es una ventana importante para el uso de medicamentos abortivos64,74,75.
- 3.
Fase emética. El pródromo suele evolucionar a una fase emética si no se trata y se caracteriza por vómitos y arcadas severos e incesantes. El dolor abdominal se observa en el 80% de los pacientes y no excluye el diagnóstico de SVC27. Muchos pacientes dicen sentir alivio cuando su estómago está vacío y a veces intentan inducirse el vómito. Este comportamiento habitual no debe confundirse con una conducta fingida. La fase emética puede ser incapacitante y los pacientes a menudo pueden ser incapaces de comunicarse o deambular. Los pacientes pueden no mostrar signos de deshidratación hasta una fase avanzada del episodio.
- 4.
Fase de recuperación. Una vez que los vómitos remiten, los pacientes toleran lentamente la ingesta oral antes de volver a su rutina normal63. La frecuencia de los episodios del SVC oscila entre cada dos a tres semanas y tres veces al año. La duración de los episodios puede variar de unas horas a varios días54.
La historia clínica es fundamental en el diagnóstico del SVC, el cual se caracteriza por episodios de vómitos incoercibles, alternando con periodos de nulos o pocos síntomas.
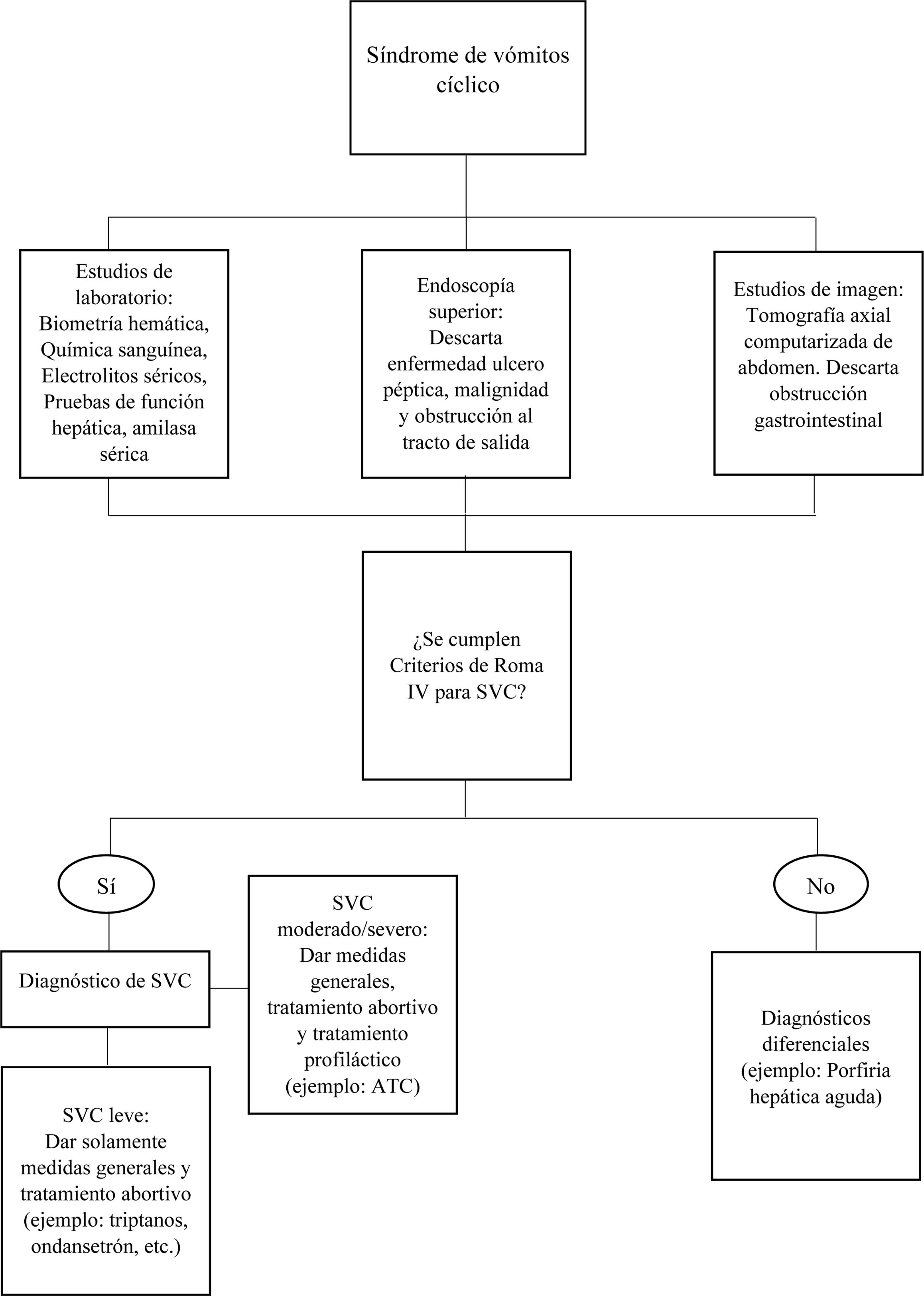
En primer lugar, debe realizarse un interrogatorio exhaustivo y determinar los factores de riesgo para desarrollar SVC y síntomas acompañantes. Aunque los vómitos son el rasgo distintivo del SVC, el dolor abdominal se observa hasta en el 80% de los pacientes76. Otros síntomas son fotofobia, sensibilidad al sonido y síntomas autonómicos (diaforesis, sialorrea, palidez y letargo)27. Los pacientes también describen el comportamiento de «beber y engullir» y tomarán grandes cantidades de agua y luego tratarán de inducirse el vómito e informarán alivio con esto (esto no debe ser malinterpretado como un trastorno psicológico/psiquiátrico)63. Además, es necesario excluir causas anatómicas/orgánicas que causen una sintomatología similar. Se deben solicitar estudios de laboratorio como un hemograma completo, química sanguínea, electrolitos séricos completos y amilasa sérica. Estudios de imagen como tomografía computarizada de abdomen, así como la realización de una endoscopía superior en orden de descartar cualquier obstrucción a nivel del tracto gastrointestinal (fig. 4).
Actualmente el diagnóstico definitivo se realiza en aquellos que cumplen con los criterios de Roma (tabla 2)1 y además se han excluido otras causas de emesis mediante la historia clínica detallada y los estudios previamente mencionados.
Criterios diagnósticos del síndrome de vómitos cíclicos de acuerdo al consenso de Roma IV1
| Criterios diagnósticos del síndrome de vómitos cíclicos |
|---|
| Episodios de vómito estereotipados. Inicio agudo y duración menor a una semana. |
| Al menos tres episodios en el año previo y dos episodios en los últimos seis meses (con un intervalo de al menos una semana). |
| Ausencia de náuseas y vómitos entre episodios, pero pueden presentarse otros síntomas leves entre estos. |
| Antecedentes personales o familiares de migraña. |
| * Criterios cumplidos durante los últimos seis meses con inicio de los síntomas al menos 12 meses antes del diagnóstico. |
Tabla adaptada de la referencia: Stanghellini et al.1
El diagnóstico diferencial es amplio, ya que los síntomas pueden deberse a trastornos gastrointestinales (malrotación, gastroparesia), intracraneales (masas intracraneales, hidrocefalia) o abdominales (cólicos renales), alteraciones metabólicas (trastornos de la oxidación de ácidos grasos o del ciclo de la urea, disfunción mitocondrial) o fármacos/toxinas (SHC)77. Los exámenes de laboratorio, radiográficos y endoscópicos detectan una proporción sustancial de estos diagnósticos diferenciales.
Las porfirias hepáticas agudas deben tenerse en cuenta en la evaluación de todos los pacientes, y especialmente en mujeres de 15-50 años con dolor abdominal intenso recurrente acompañado de náusea, vómito y neuropatía. Estas entidades son errores congénitos del metabolismo del grupo hemo e incluyen la porfiria aguda intermitente, la coproporfiria hereditaria, la porfiria variegata y la porfiria debida a la deficiencia de ácido 5-aminolevulínico dehidratasa78. La porfiria aguda intermitente es el tipo más común, con una prevalencia estimada de uno por 100,000 habitantes79,80.
Se debe aconsejar a todos los pacientes con porfirias hepáticas agudas que eviten los desencadenantes como el estrés, la ingesta excesiva de alcohol, el consumo de tabaco y la privación calórica, ya que son factores que inducen la expresión del ARN mensajero y la proteína delta-aminolevulinato sintasa 1 en los hepatocitos81–84. Este diagnóstico diferencial es mencionado en múltiples artículos, por lo que recientemente se evaluó la prevalencia de las porfirias hepáticas agudas en pacientes con diagnóstico de SVC. Este estudio reveló que, de 234 pacientes evaluados, en ninguno de ellos se realizó el diagnóstico de porfiria hepática aguda85.
TratamientoMedidas generales y modificación del estilo de vidaEs necesario reconocer y evitar los desencadenantes identificados por el paciente (insomnio, ayuno, estrés). Adicionalmente, se debe buscar la presencia de trastornos del estado del ánimo, para su correcta derivación a un psicólogo o psiquiatra. Los trastornos como la ansiedad, el pánico y la depresión son frecuentes en adultos con SVC62,63 y los síntomas derivados de estas afecciones pueden influir en la precipitación de episodios de SVC.
La migraña está estrechamente relacionada con el SVC1,86. La prevalencia de migraña en adultos con SVC varía entre el 13% y el 70%63,87. Además, el 57% de los pacientes adultos con SVC (con o sin migraña) tienen un familiar de primer y/o segundo grado con migraña o variantes de migraña63. No está claro si el tratamiento de la migraña mejora de forma independiente la evolución del SVC, pero muchos medicamentos son terapias profilácticas eficaces (como los antidepresivos tricíclicos [ATC] y los antiepilépticos) o terapias abortivas (como los triptanos) para ambas afecciones. Anecdóticamente, se ha observado que cuando el SVC y las migrañas coexisten, ambos pueden responder a los ATC, pero a distintas dosis, lo que obliga al médico a incrementar la cantidad del fármaco incluso cuando los síntomas de uno de los trastornos han desaparecido.
Dado que el consumo crónico de cannabis se asocia a la falta de respuesta al tratamiento, se debe suspender su consumo88. Los pacientes suelen beneficiarse de un enfoque multidisciplinario que incluya al gastroenterólogo, psicólogo/psiquiatra y personal de enfermería familiarizado con el síndrome.
Una característica única del SVC es la conducta de bañarse con agua caliente que proporcionar un alivio sintomático temporal89. Aunque esta conducta está muy asociada al consumo de cannabis, también se observa en aproximadamente el 50% de los pacientes sin consumo de cannabis75.
Terapia profilácticaDurante la fase interepisódica, el tratamiento es profiláctico y se recomienda a los pacientes con enfermedad moderada/grave, es decir, aquellos con> 4 episodios al año de náusea y vómitos graves que los llevan a solicitar atención médica en el Servicio de Urgencias o que requieren hospitalización. Los ATC son los fármacos de primera línea para la profilaxis del SVC y han demostrado reducir la duración, la gravedad y la frecuencia de los episodios, así como el número de visitas a urgencias y hospitalizaciones90. La amitriptilina, el ATC de elección, suele iniciarse con una dosis baja de 25mg y se aumenta gradualmente hasta una dosis objetivo de aproximadamente 100mg por la noche en adultos. Los ATC pueden provocar una prolongación del intervalo QT, por lo que debe realizarse un electrocardiograma al inicio y durante la titulación de ATC para monitorizarlo91.
Terapias profilácticas alternativasEn los pacientes que no toleran los ATC, puede considerarse el uso de anticonvulsivantes como la zonisamida o el levetiracetam. En un estudio no controlado de 20 pacientes que no toleraban los ATC y a los que se empezó a administrar zonisamida (dosis media de 400mg/día) o levetiracetam (dosis media de 1,000mg/día), el 75% tuvo una respuesta clínica moderada, mientras que el 20% tuvo una remisión completa de los síntomas92. El topiramato, otro anticonvulsivante y antimigrañoso, también puede utilizarse como tratamiento profiláctico93. Suele iniciarse con 25mg al día y se incrementa la dosis 25mg cada semana hasta alcanzar 100mg al día. El topiramato puede aumentar de manera discreta el riesgo de litiasis renal, por lo que debe recomendarse a los pacientes que optimicen la ingesta de líquidos. Adicionalmente, puede provocar una disminución de los niveles de bicarbonato, por lo que debe suplementarse si se comprueban niveles bajos.
AprepitantEl aprepitant es un agente antiemético antagonista de la sustancia P/receptor de neuroquinina 1 altamente selectivo y de alta afinidad94. Se une a los receptores del núcleo del tracto solitario que median el reflejo motor emético. Se ha utilizado para prevenir los vómitos inducidos por la quimioterapia, así como la náusea y vómito posoperatorios. Aunque la semivida plasmática es de nueve a 13 horas, los efectos clínicos pueden persistir durante tres a cinco días95. Los inhibidores e inductores significativos del sistema citocromo P450 (CYP)3A4 aumentan y disminuyen los niveles séricos del aprepitant, respectivamente, y deben evitarse si es posible96. Se recomienda usar con precaución en pacientes con enfermedad hepática grave. Existe un ensayo clínico de aprepitant utilizado de forma profiláctica para tratar el SVC en niños y adolescentes refractarios al tratamiento convencional97. Este ensayo incluyó adolescentes con un peso superior a 60kg que fueron tratados con 125mg dos veces por semana. A los 12 meses, en un análisis de intención a tratar, el 82% logró una resolución completa o respuesta parcial (reducción> 50% de la frecuencia e intensidad) de los episodios. Según estos criterios, el 19% tuvieron una respuesta completa y el 63% una respuesta parcial. Basándonos en los datos en niños y adolescentes y en la experiencia clínica de los expertos, actualmente se recomienda el aprepitant como tratamiento profiláctico alternativo en pacientes refractarios o no tolerantes a la terapia estándar con amitriptilina o topiramato. La dosis sugerida es de 125mg dos veces por semana para adultos> 60kg y de 80mg dos veces por semana en adultos de 40-60kg. El costo del aprepitant es elevado y debe tenerse en cuenta al prescribir este medicamento.
Coenzima Q10Se sugiere su uso como tratamiento único o combinado con los medicamentos profilácticos. Su recomendación se basa en algunos estudios que señalan a la disfunción mitocondrial como parte de la patogénesis del SVC98,99. Pacientes con migraña muestran una disminución de la función del complejo respiratorio mitocondrial y es probable que también esté presente en el SVC, aunque faltan estudios para afirmarlo100.
La coenzima Q10 (Co-Q10), un compuesto hidrofóbico natural derivado de los esteroides que actúa como transportador de electrones entre los complejos 1 o 2 y el complejo 3 de la cadena respiratoria mitocondrial. Un estudio retrospectivo comparó la eficacia de la Co-Q10 con la amitriptilina en niños con SVC101. El tratamiento profiláctico con Co-Q10 mostró una eficacia global del 68%, sin efectos secundarios101. Se recomienda una dosis de Co-Q10 de 10mg/kg al día en dos dosis divididas, hasta 200mg dos veces al día. Para los casos refractarios, sugieren obtener los niveles de Co-Q10 en sangre y aumentar la dosis para alcanzar un nivel sérico de 3mg/L.
Medicamentos abortivosTriptanosEl sumatriptán es un agonista de la serotonina aprobado por la Dirección de Alimentos y Medicamentos de los Estados Unidos para el tratamiento de la migraña102. Este se une a las subclases de receptores 5-hidroxitriptamina 1B (5-HT1B) y 5-hidroxitriptamina 1D (5-HT1D) en las meninges, produciendo la constricción de los vasos sanguíneos durales. La eficacia del sumatriptán en la migraña se debe a múltiples lugares de acción (vascular, neural y central) y la presentación utilizada es la inyectable o la intranasal. Existen informes sobre la eficacia del sumatriptán en la migraña abdominal, una afección clasificada en el subgrupo de síndromes periódicos infantiles103,104. Aunque los mecanismos que causan el SVC no están bien definidos, existe un claro paralelismo clínico, familiar, terapéutico y probablemente patogénico con las migrañas69. En un estudio efectuado en la población pediátrica se mostró una mayor eficacia del tratamiento con sumatriptán inyectable en comparación con la presentación intranasal. Asimismo, la respuesta fue mayor en aquellos pacientes con antecedentes familiares de migraña105. Es importante mencionar que el sumatriptán inyectable o en aerosol nasal no están disponibles en México, por lo que se necesitan estudios que documenten la eficacia del tratamiento vía oral. En cuanto a la eficacia del tratamiento con sumatriptán por vía oral, Okumura et al. reportan el caso de un paciente que fue tratado con una eficacia del 100% en sus últimos cinco pródromos, esto sugiere una eficacia similar a las otras vías de administración106.
Antagonistas de la serotoninaEl ondansetrón es un antagonista selectivo de los receptores de 5-hidroxitriptamina tipo 3 (5-HT3)107. Actúa bloqueando los receptores aferentes 5-HT3 del vago a nivel periférico y central en la zona desencadenante quimiorreceptora del área postrema dentro de la médula oblonga. Estas acciones provocan una disminución de la serotonina circulante a nivel de la zona desencadenante quimiorreceptora, reduciendo los síntomas de náusea y vómito en los pacientes afectados107,108. El ondansetrón se metaboliza en el hígado por CYP3A4, CYP1A2 y CYP2D6 y se excreta por vía renal109. Existen numerosos datos que demuestran la eficacia de estos agentes en la náusea y vómitos inducidos por quimioterapia y en el periodo posoperatorio110,111.
El comité de expertos de la Sociedad Americana de Neurogastroenterología y Motilidad y la Asociación del Síndrome de Vómitos Cíclicos recomiendan el ondansetrón como agente de primera línea para abortar un episodio de SVC. Según expertos, la combinación de los antagonistas de los receptores 5-HT3 con otros agentes abortivos como los ansiolíticos y fenotiazinas para la sedación puede ser más efectiva en abortar un episodio que la monoterapia.
Se sugiere realizar un electrocardiograma basal para comprobar la prolongación del intervalo QT en adultos antes de iniciar el tratamiento con este medicamento. Es recomendable utilizar 8mg de ondansetrón al inicio del pródromo en combinación con otros medicamentos abortivos como triptanos y ansiolíticos. Debe evitarse la vía oral, ya que los pacientes suelen ser incapaces de tolerar los preparados orales durante un episodio y también debido a la absorción impredecible de los medicamentos durante un episodio de vómitos.
AprepitantEl aprepitant como terapia abortiva se recomienda en pacientes que son refractarios al tratamiento estándar (sumatriptán y ondansetrón) y en aquellos que tienen un pródromo definido o una periodicidad predecible (episodio que se produce en relación con el ciclo menstrual) en el que este fármaco puede iniciarse uno o dos días antes del comienzo previsto la fase emética. Se recomienda utilizar un régimen de dosificación estándar de 125mg, 80mg y 80mg en tres días consecutivos; la primera dosis debe tomarse lo antes posible en el pródromo y antes de la aparición de los vómitos.
Se realizó un ensayo clínico de aprepitant oral utilizado como tratamiento abortivo del SVC en niños y adolescentes refractarios al tratamiento convencional97. Al cabo de 12 meses, este régimen abortivo recurrente redujo significativamente la duración de los episodios, el número de vómitos y el número de ingresos hospitalarios.
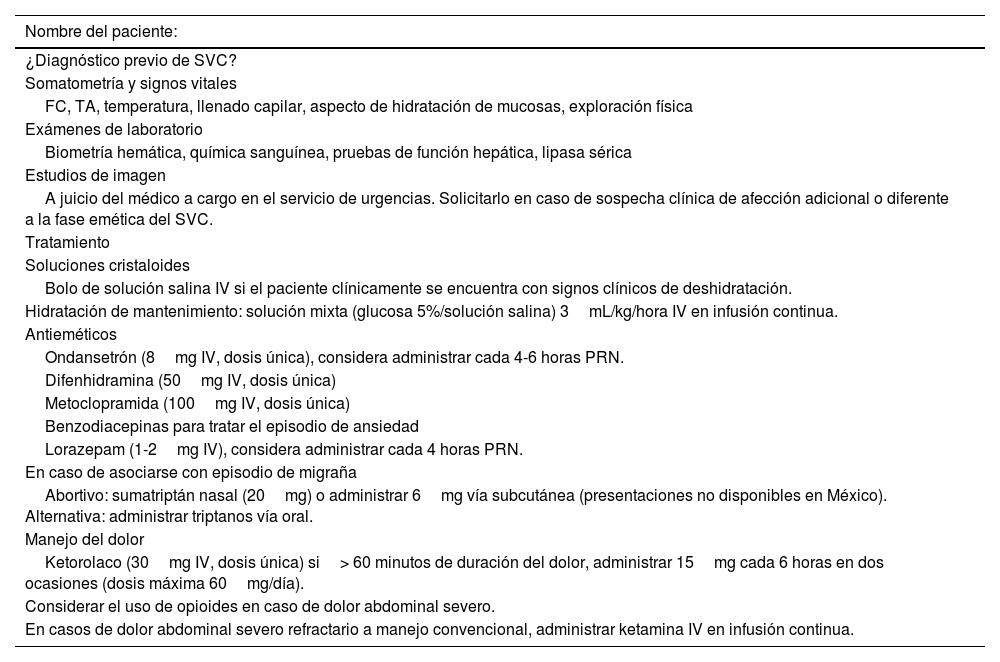
Manejo en urgencias durante la fase eméticaA pesar de la profilaxis, los pacientes con SVC pueden tener ataques intermitentes de vómitos que conducen a la atención en urgencias. Una encuesta de adultos con SVC mostró que la mediana de visitas al Servicio de Urgencias por síntomas relacionados con la enfermedad era de 15 (rango: 1-200). Es relevante mencionar que a muchos pacientes se les suele otorgar un tratamiento parcialmente eficaz debido a la falta de conocimiento sobre el trastorno112,113. Por ello, se recomienda que todos los pacientes con SVC tengan un plan de tratamiento individualizado para mejorar los resultados (tabla 3)114.
Protocolo de atención para pacientes con diagnóstico de SVC en el área de urgencias
| Nombre del paciente: |
|---|
| ¿Diagnóstico previo de SVC? |
| Somatometría y signos vitales |
| FC, TA, temperatura, llenado capilar, aspecto de hidratación de mucosas, exploración física |
| Exámenes de laboratorio |
| Biometría hemática, química sanguínea, pruebas de función hepática, lipasa sérica |
| Estudios de imagen |
| A juicio del médico a cargo en el servicio de urgencias. Solicitarlo en caso de sospecha clínica de afección adicional o diferente a la fase emética del SVC. |
| Tratamiento |
| Soluciones cristaloides |
| Bolo de solución salina IV si el paciente clínicamente se encuentra con signos clínicos de deshidratación. |
| Hidratación de mantenimiento: solución mixta (glucosa 5%/solución salina) 3mL/kg/hora IV en infusión continua. |
| Antieméticos |
| Ondansetrón (8mg IV, dosis única), considera administrar cada 4-6 horas PRN. |
| Difenhidramina (50mg IV, dosis única) |
| Metoclopramida (100mg IV, dosis única) |
| Benzodiacepinas para tratar el episodio de ansiedad |
| Lorazepam (1-2mg IV), considera administrar cada 4 horas PRN. |
| En caso de asociarse con episodio de migraña |
| Abortivo: sumatriptán nasal (20mg) o administrar 6mg vía subcutánea (presentaciones no disponibles en México). Alternativa: administrar triptanos vía oral. |
| Manejo del dolor |
| Ketorolaco (30mg IV, dosis única) si> 60 minutos de duración del dolor, administrar 15mg cada 6 horas en dos ocasiones (dosis máxima 60mg/día). |
| Considerar el uso de opioides en caso de dolor abdominal severo. |
| En casos de dolor abdominal severo refractario a manejo convencional, administrar ketamina IV en infusión continua. |
SVC: síndrome de vómitos cíclicos, FC: frecuencia cardiaca, TA: tensión arterial.
Tabla adaptada de la referencia Frazier et al.115.
Durante la fase aguda, una combinación de antieméticos y sedación con benzodiacepinas parece ser la mejor opción, ya que estas últimas se utilizan para aliviar la ansiedad y promover el sueño. Los antihistamínicos de primera generación como la difenhidramina inyectable pueden usarse115,116.
En pacientes con dolor abdominal, el analgésico de elección es el ketorolaco intravenoso. Si el dolor es severo, considerar el tratamiento con opioides. Si el dolor es refractario al tratamiento previamente mencionado, se ha descrito recientemente el uso de ketamina intravenosa en infusión117–119.
Adicionalmente, permitir que el paciente descanse en un entorno tranquilo y oscuro, mantener una buena hidratación con soluciones cristaloides incluso cuando no haya signos de deshidratación parecen ofrecer beneficios. En conjunto, este es el enfoque preferido para terminar con la fase emética del SVC113.
Direcciones futurasNeuromodulaciónAl conocer cada vez más la fisiopatología del SVC, se han producido avances en su tratamiento. Es ampliamente conocido que el nervio vago desempeña un papel importante en la náusea, vómito y el dolor120. Algunas de las ramas del nervio vago están situadas en el oído externo y se proyectan directamente desde el oído hasta el tronco encefálico junto con otros nervios craneales121. La estimulación auricular con neuroestimulación eléctrica transcutánea es eficaz en pacientes pediátricos con trastornos gastrointestinales del eje intestino cerebro y actualmente se encuentra aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos para el tratamiento del síndrome de intestino irritable en niños. Un tratamiento típico consiste en cuatro semanas de neuroestimulación auricular con cuatro electrodos adheridos al pabellón auricular, que administra frecuencias de longitud de onda indoloras32. A últimas fechas, se evaluó la eficacia de la neuroestimulación auricular en niños con SVC. El estudio demostró disminuir el dolor abdominal, mejorar la ansiedad y el sueño122.
Antagonistas del péptido relacionado con el gen de la calcitoninaLos estudios sobre migraña han demostrado que el péptido relacionado al gen de la calcitonina se libera durante un ataque agudo de migraña y el sumatriptán normaliza los niveles de este123. Esto condujo a la producción de antagonistas del péptido relacionado con el gen de la calcitonina y el uso de anticuerpos monoclonales contra el receptor de este péptido. Varios estudios han demostrado que son eficaces para reducir el número de días de migraña tanto episódica como crónica124. No se ha estudiado el papel de estos agentes en el SVC, pero, dada la fisiopatología compartida, debe tenerse en cuenta para futuros proyectos.
Eficacia del tratamiento con coenzima Q10 a largo plazo en pacientes pediátricos (ensayo COENZYME)El objetivo principal de este estudio es la comparación de la frecuencia de episodios de vómitos por año observada durante el año posterior al inicio del tratamiento con Co-Q10 con la frecuencia observada durante el año previo al inicio de este tratamiento en niños con SVC. Actualmente el ensayo se encuentra en desarrollo.
ConclusionesEl SVC es un trastorno crónico e incapacitante asociado a factores comórbidos, principalmente la migraña y el consumo de cannabinoides. El retraso en el diagnóstico del SVC es frecuente en la actualidad, por lo que el propósito de la presente revisión es sensibilizar a la comunidad médica para su diagnóstico y tratamiento oportuno.
Consideraciones éticasLos autores declaran que este artículo no contiene información personal que permita identificar a los pacientes.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.