La fibrosis hepática es una complicación de la enfermedad hepática esteatótica asociada a disfunción metabólica (MASLD). Dadas las limitaciones y los riesgos de la biopsia hepática, es necesario explorar sistemas de puntuación no invasivos y asequibles para la población. Nuestro objetivo fue evaluar y comparar el rendimiento diagnóstico de los puntajes APRI, FIB-4, NAFLD score y Hepamet para la detección de la fibrosis hepática, en individuos mexicanos con MASLD.
Material y métodosEstudio retrospectivo en una muestra de sujetos con MASLD. La fibrosis hepática se estimó mediante elastografía hepática transitoria. Se evaluaron variables sociodemográficas, epidemiológicas y bioquímicas. Se calcularon y compararon las puntuaciones: índice de fibrosis-4 (FIB-4), índice de la relación AST y plaquetas (APRI), Hepamet fibrosis score (HFS) y NAFLD score (NFS). Se generaron curvas ROC y se determinaron los puntos de corte óptimos usando el índice de Youden. Se calculó la sensibilidad, la especificidad, los valores predictivos positivos y negativos y las razones de verosimilitud.
ResultadosSe incluyeron 194 sujetos (63% mujeres), 150 (77.3%) fueron clasificados como MASLD y 44 (22.7%) como controles sin enfermedad hepática. La prevalencia de fibrosis avanzada fue del 15.3%. Los puntos de corte de 0.57 para APRI, 1.85 para FIB-4, 0.08 para HFS y −0.058 para NFS demostraron rendimientos diagnósticos con áreas bajo las curvas ROC de 0.79, 0.80, 0.70 y 0.68, respectivamente.
ConclusiónLos puntajes APRI, FIB-4, NFS y HFS son útiles para la evaluación de la fibrosis hepática en sujetos mexicanos con MASLD, siendo FIB-4 y APRI los de mejor rendimiento diagnóstico.
Liver fibrosis is a complication of metabolic dysfunction-associated steatotic liver disease (MASLD). Given the limitations and risks of liver biopsy, examining noninvasive scoring systems that are affordable for the population is necessary. Our aim was to evaluate and compare the diagnostic yield of the APRI, FIB-4, NAFLD score, and Hepamet fibrosis score instruments for detecting liver fibrosis in Mexican subjects with MASLD.
Material and methodsA retrospective study was conducted on a sample of subjects with MASLD. Liver fibrosis was calculated through transient liver elastography. Sociodemographic, epidemiologic, and biochemical variables were evaluated. Scores were calculated utilizing the fibrosis-4 (FIB-4) index, the aspartate aminotransaminase-to-platelet ratio index (APRI), the Hepamet fibrosis score (HFS), and the NAFLD score (NFS), and then compared. ROC curves were constructed, and the optimum cutoff points were determined utilizing the Youden index. Sensitivity, specificity, positive predictive value, negative predictive value, and likelihood ratio were calculated.
ResultsThe study included 194 subjects (63% women), of whom 150 (77.3%) were classified with MASLD and 44 (22.7%) as controls with no liver disease. There was a 15.3% prevalence of advanced fibrosis. The cutoff points of 0.57 for APRI, 1.85 for FIB-4, 0.08 for HFS, and −0.058 for NFS showed diagnostic yields with areas under the ROC curves of 0.79, 0.80, 0.70, and 0.68, respectively.
ConclusionThe APRI, FIB-4, NFS, and HFS scores are useful for evaluating liver fibrosis in Mexican subjects with MASLD. Better diagnostic yield was found with the FIB-4 and APRI scores.
La enfermedad por hígado graso no alcohólico (NAFLD) ha sido históricamente una entidad cuya denominación genera inexactitudes. Estas imprecisiones terminológicas dificultan la adecuada estadificación, el tratamiento preciso y la capacidad de establecer pronósticos certeros para la enfermedad. Para abordar este problema, en 2020, Eslam et al. encabezaron un consenso internacional proponiendo el término «enfermedad por hígado graso asociado con disfunción metabólica» (MAFLD). Esta nomenclatura refleja con mayor precisión la comprensión actual de la fisiopatología, subrayando la relación entre la esteatosis hepática y las alteraciones metabólicas y reconociendo al hígado graso como el componente hepático del síndrome metabólico. Abarca a los individuos con esteatosis que reúnen ciertos criterios metabólicos, independientemente de si tienen un consumo elevado de alcohol u otras razones subyacentes para la esteatosis1,2. Sin embargo, una reciente iniciativa propone evolucionar de MAFLD a «enfermedad hepática esteatótica asociada a disfunción metabólica» (MASLD), buscando atenuar el estigma vinculado con la enfermedad. Este cambio terminológico se fundamenta en 5 criterios metabólicos esenciales: sobrepeso/obesidad, insulinorresistencia o diabetes tipo 2, hipertensión, hipertrigliceridemia o irregularidades en HDL. Con esta nomenclatura, se denomina a la «enfermedad hepática metabólica asociada al consumo de alcohol» como METALD, refiriéndose a aquellos individuos con MASLD que consumen grandes cantidades de alcohol (140g por semana en mujeres y 210g por semana en varones), y a la esteatosis hepática sin criterios metabólicos de etiología desconocida como criptogénica3. El término enfermedad hepática esteatótica (SLD) se usa para agrupar a todas las condiciones que causan esteatosis.
A pesar de las preocupaciones asociadas con el cambio de nomenclatura, estudios de diversas poblaciones revelan que entre el 95-99% de los sujetos con NAFLD cumplen los criterios para MASLD4–6, esto sugiere que la historia natural de la enfermedad, el perfil clínico y las tasas de mortalidad son las mismas7–9. Si bien la sustitución del término «graso» por «esteatótico» podría contribuir a disminuir el estigma, es crucial fomentar una amplia difusión de la nueva terminología en el contexto científico. Además, resulta esencial explicar los cambios de manera comprensible a los pacientes, con el objetivo de promover una mayor concienciación sobre la condición5.
La prevalencia global de MASLD es preocupante, siendo considerada la principal causa de enfermedades hepáticas a nivel mundial10,11. En México, la prevalencia se estima entre el 41 y el 47%12,13, por lo tanto, es esencial identificar factores de riesgo y validar herramientas de detección temprana y asequibles para la fibrosis hepática en estos pacientes.
La fibrosis hepática, como indicador pronóstico en los pacientes con MASLD, es crucial debido a su fuerte correlación con el aumento de riesgo de enfermedades cardiovasculares, cirrosis hepática y hepatocarcinoma celular14. Aunque la biopsia hepática sigue siendo el estándar de oro, presenta limitaciones que obstaculizan su aplicación rutinaria. De ahí la urgente necesidad de explorar biomarcadores no invasivos, esto puede ser especialmente útil en áreas de Latinoamérica con limitación de recursos, las cuales podrían beneficiarse en mayor medida de los métodos no invasivos15. A pesar de la importancia clínica de la fibrosis hepática, aún no contamos con tratamientos eficaces, resaltando la necesidad de detección temprana y clasificación de riesgos.
Existen múltiples sistemas de puntuación, como el índice de fibrosis-4 (FIB-4), NAFLD score (NFS), puntaje de fibrosis hepática Hepamet (HFS) y el índice de la relación AST y plaquetas (APRI), entre otros utilizados para la evaluación de la fibrosis hepática16–21. Sin embargo, su eficacia diagnóstica en población mexicana sigue siendo en gran medida inexplorada. En el presente estudio, nuestro objetivo fue evaluar y comparar el rendimiento diagnóstico de los puntajes APRI, FIB-4, NFS y HFS para la detección de la fibrosis hepática, en individuos mexicanos con MASLD.
Material y métodosDiseño del estudioSe llevó a cabo un estudio observacional, retrospectivo y analítico, utilizando un muestreo no aleatorizado. Para garantizar la precisión diagnóstica, se aplicó la lista STARD.
Durante el año 2020, se realizó un proyecto para la evaluación de «hígado graso» en la ciudad de Veracruz, México12. Este programa involucró a 585 individuos de la población general. Estos participantes no presentaban enfermedades hepáticas conocidas, no consumían alcohol de manera significativa, ni utilizaban fármacos que pudieran asociarse a esteatosis. El programa consistió en una evaluación clínica y bioquímica detallada. Adicionalmente, se calculó el índice FIB-4 para todos los participantes. Aquellos con puntajes que indicaban un riesgo alto o indeterminado de fibrosis hepática fueron seleccionados para una evaluación más profunda a través de elastografía hepática transitoria (EHT), empleando el equipo de FibroScan®.
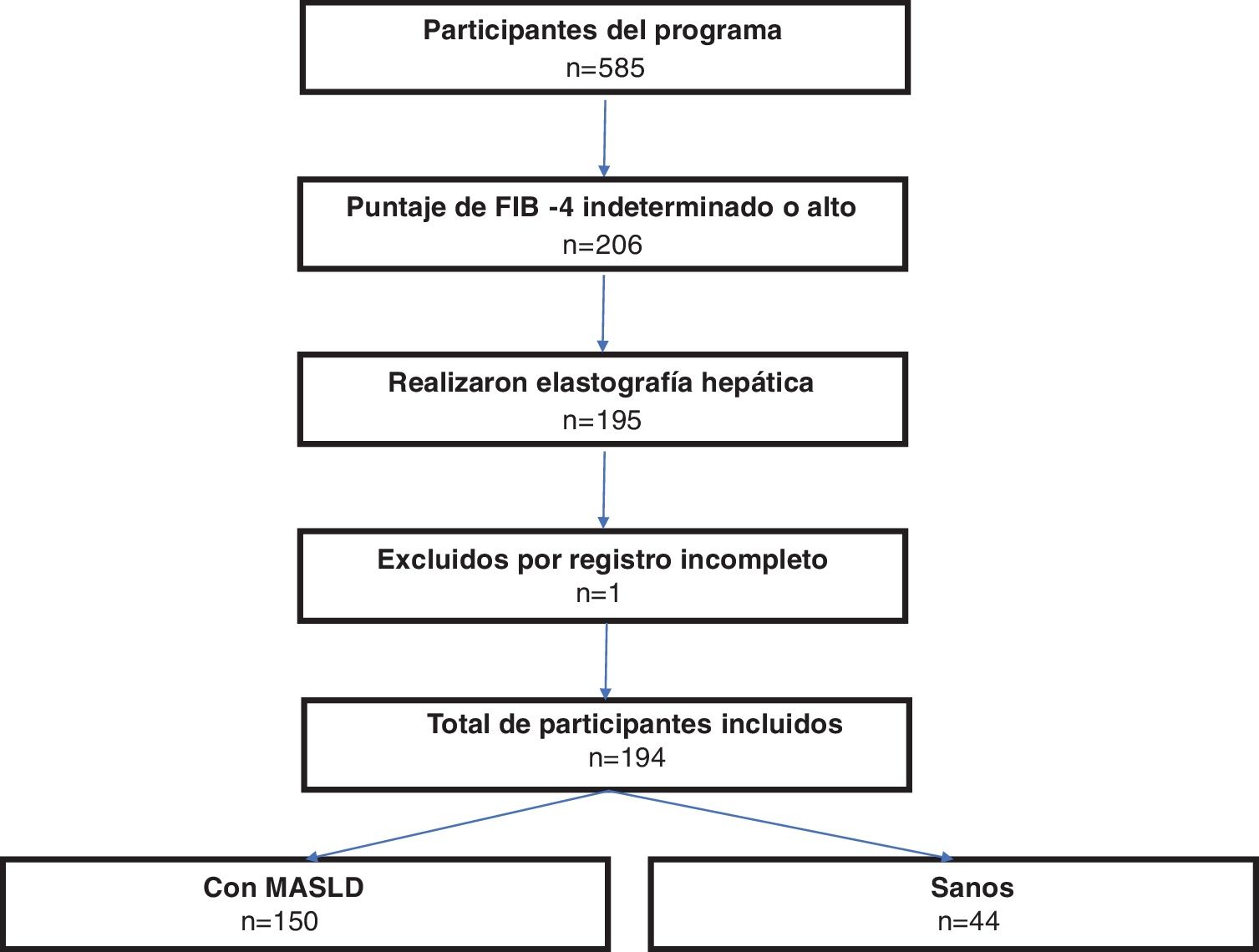
Este estudio se enfocó específicamente en los participantes mexicanos, todos mayores de 18 años, residentes de Veracruz, México, que completaron la EHT en el marco de este programa. Se llevó a cabo un proceso de selección que incluyó solo aquellos registros que estuvieran completos y contaran con un consentimiento informado firmado. Se descartaron los registros con información incompleta o faltante (fig. 1).
Es esencial destacar que la EHT estuvo a cargo de dos gastroenterólogos y un nutriólogo clínico, todos con certificaciones pertinentes y con una trayectoria consolidada en la técnica de elastografía, la interpretación de los resultados fue asesorada por un hepatólogo certificado.
Evaluación de la composición corporalSe obtuvieron las variables peso (kg), altura (cm), índice de masa corporal (IMC), cantidad de grasa visceral (l) y masa grasa (l) del equipo de antropometría por bioimpedancia SECA mBCA51422.
Evaluación clínica y bioquímicaLos parámetros clínicos y bioquímicos se obtuvieron de los registros médicos de los participantes. Estos parámetros incluyeron antecedentes personales patológicos y distintos parámetros bioquímicos como leucocitos, hemoglobina, hematocrito, creatinina, urea, ácido úrico, bilirrubina total (BT), fosfatasa alcalina (FA), lipoproteína de alta densidad (HDL), lipoproteína de baja densidad (LDL), aspartato aminotransferasa (AST), alanina aminotransferasa (ALT), triglicéridos, colesterol total y el modelo de homeostasis de resistencia a la insulina (HOMA-IR)23.
Evaluación de la esteatosis/fibrosis hepáticaSe utilizó la EHT como método de referencia para la evaluación de la fibrosis y la esteatosis hepática. La rigidez hepática se cuantificó y se expresó en kilopascales (kPa). Establecimos un punto de corte con el parámetro de atenuación controlada (CAP) con una mediana >248db/m para identificar la presencia de esteatosis24. Para la categorización de la fibrosis hepática avanzada utilizamos un punto de corte ≥12.1kPa21.
Diagnóstico de MASLDEl diagnóstico de MASLD se basó de acuerdo con los criterios establecidos por el consenso internacional, considerando a aquellos individuos que mostraron esteatosis hepática mediante la EHT. El diagnóstico requirió la presencia de al menos alguno de los criterios metabólicos siguientes: IMC≥25kg/m2 o una circunferencia de cintura ≥94cm. Glucosa sérica en ayuno ≥100mg/dl o niveles de glucosa a las 2h poscarga ≥140mg/dl, o en tratamiento para diabetes tipo 2. Presión arterial ≥130/85mmHg o tratamiento específico para la hipertensión. Triglicéridos plasmáticos ≥150mg/dl o tratamiento hipolipemiante. Colesterol HDL plasmático <40mg/dl en varones y <50mg/dl en mujeres, o tratamiento hipolipemiante3.
Puntajes de fibrosis hepáticaSe calcularon cuatro puntaciones no invasivas: APRI, FIB-4, HFS y NFS. Las fórmulas utilizadas para calcular las puntuaciones fueron la siguientes: APRI: (AST/LSN)×100/plaquetas(109/l)17. FIB-4: edad×AST (U/l)/plaquetas (109/l) ×√ALT (U/l)21. NFS: −1.675+0.037–edad+0.094–IMC (kg/m2)+1.13×IR/diabetes (sí=1, no=0) + 0.99×relación AST/ALT–0.013×recuento de plaquetas (×109/l)–0.66 ×albúmina (g/dl)17. HFS: 1 / (1+e (5.390–0.986×edad [45-64]–1.719×edad [>65]+0.875×masculino–0.896×AST [35-69IU/l]–2.126×AST [>70IU/l]–0.027×albúmina [4-4.49g/dl]–0.897×albúmina [4 sin DM]–2.184×diabetes mellitus–0.882×plaquetas×1.000/microl [155-219]–2.233×plaquetas×1.000/microl [<155])25.
Análisis estadísticoLa distribución de los datos se evaluó mediante la prueba de Kolmogórov-Smirnov y la homocedasticidad con Levene. Las variables numéricas se expresaron como media±desviación estándar o mediana con rango intercuartil, y su comparación se realizó utilizando la prueba t de Student o la prueba de Wilcoxon según correspondió. Las variables categóricas se presentaron como frecuencias y porcentajes, y su comparación se llevó a cabo utilizando la prueba de Chi-cuadrado o la prueba exacta de Fisher. Las correlaciones se realizaron con el coeficiente de Pearson o Spearman. Se utilizaron curvas con las características operativas del receptor (ROC) para determinar el área bajo la curva (AUC) de cada puntaje, mientras que la sensibilidad, la especificidad, el valor predictivo positivo (VPP), el valor predictivo negativo (VPN) y las razones de verosimilitud (LR) se calcularon usando el índice de Youden. Se consideró un valor p<0.05 como estadísticamente significativo. El análisis de datos se realizó utilizando R Studio versión 4.2.0 y SPSS® versión 25.
Consideraciones éticasTodos los participantes del estudio proporcionaron consentimiento informado, que fue revisado y aprobado por el Comité de Investigación y Ética de nuestra institución (folio llMB-007-2020) antes de su incorporación. Llevamos a cabo el estudio en estricta adhesión a las regulaciones oficiales de protección de datos y a los principios éticos establecidos en la Declaración de Helsinki, sin imponer ninguna carga financiera a los participantes. Todos los pacientes recibieron los resultados del estudio, con la opción de recibir asesoramiento médico y/o nutricional gratuito si lo solicitaban. Los datos de los participantes se trataron con estrictas medidas de confidencialidad y seguridad, incluida la desidentificación y el acceso restringido al personal autorizado. Los participantes tuvieron el derecho de retirarse del estudio en cualquier momento sin incurrir en ninguna penalización.
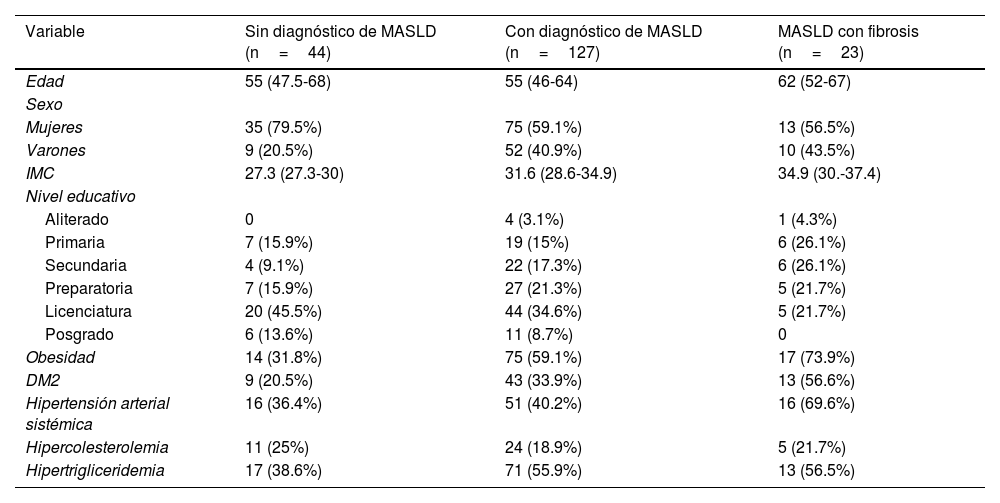
ResultadosCaracterísticas de la poblaciónSe incluyeron 194 sujetos, con una mediana de edad de 55 años (IQR: 48-65). De ellos, 129 (66.5%) eran mujeres y 65 (33.5%) varones. Basándonos en el CAP, 150 (77.3%) de los participantes fueron categorizados como MASLD, con un predominio de mujeres (62.5%) y una mediana de edad de 55 años (IQR: 47.7-64). Además, 44 (22.7%) participantes fueron clasificados sin enfermedad hepática. La tabla 1 proporciona un desglose detallado de las características sociodemográficas y epidemiológicas.
Variables sociodemográficas y epidemiológicas de la población estudiada
| Variable | Sin diagnóstico de MASLD (n=44) | Con diagnóstico de MASLD (n=127) | MASLD con fibrosis (n=23) |
|---|---|---|---|
| Edad | 55 (47.5-68) | 55 (46-64) | 62 (52-67) |
| Sexo | |||
| Mujeres | 35 (79.5%) | 75 (59.1%) | 13 (56.5%) |
| Varones | 9 (20.5%) | 52 (40.9%) | 10 (43.5%) |
| IMC | 27.3 (27.3-30) | 31.6 (28.6-34.9) | 34.9 (30.-37.4) |
| Nivel educativo | |||
| Aliterado | 0 | 4 (3.1%) | 1 (4.3%) |
| Primaria | 7 (15.9%) | 19 (15%) | 6 (26.1%) |
| Secundaria | 4 (9.1%) | 22 (17.3%) | 6 (26.1%) |
| Preparatoria | 7 (15.9%) | 27 (21.3%) | 5 (21.7%) |
| Licenciatura | 20 (45.5%) | 44 (34.6%) | 5 (21.7%) |
| Posgrado | 6 (13.6%) | 11 (8.7%) | 0 |
| Obesidad | 14 (31.8%) | 75 (59.1%) | 17 (73.9%) |
| DM2 | 9 (20.5%) | 43 (33.9%) | 13 (56.6%) |
| Hipertensión arterial sistémica | 16 (36.4%) | 51 (40.2%) | 16 (69.6%) |
| Hipercolesterolemia | 11 (25%) | 24 (18.9%) | 5 (21.7%) |
| Hipertrigliceridemia | 17 (38.6%) | 71 (55.9%) | 13 (56.5%) |
DM2: diabetes mellitus tipo 2; IMC: índice de masa corporal; MASLD: enfermedad hepática esteatótica asociada a disfunción metabólica.
De los 150 sujetos diagnosticados con MASLD, el 15.3% (n=23) fue clasificado con fibrosis hepática avanzada (kPa≥12.1). Comparados contra los individuos sin fibrosis, aquellos con fibrosis hepática exhibieron significativamente mayor kPa (17.1 [14.2-25.5] vs. 5.4 [4.4-6.3]; p<0.0001) y circunferencia de cintura (107.5 [98-118] vs. 100.5 [90.5-109]; p=0.013). No se observaron diferencias estadísticamente significativas en la edad (62 [52-67] vs. 55 [46-64]; p=0.126), IMC (33.2 [30-37.7] vs. 31.3 [27.9-34.4]; p=0.141), grasa visceral (3.85 [2.95-5] vs. 3.4 [2.6-4.5]; p=0.275) ni en el CAP (323 [283-339] vs. 307 [279-337]; p=0.652).
Al evaluar el nivel educativo, se identificaron diferencias significativas (p=0.031) entre los grupos con y sin fibrosis, donde aquellos con fibrosis hepática tuvieron menor escolaridad. Adicionalmente, los antecedentes de diabetes mellitus tipo 2 (56.5 vs. 33.9%, p=0.039) e hipertensión (69.6 vs. 33.9%; p=0.009) mostraron una prevalencia mayor en el grupo con fibrosis. Las distribuciones detalladas de estas y otras características sociodemográficas se presentan en la tabla 1.
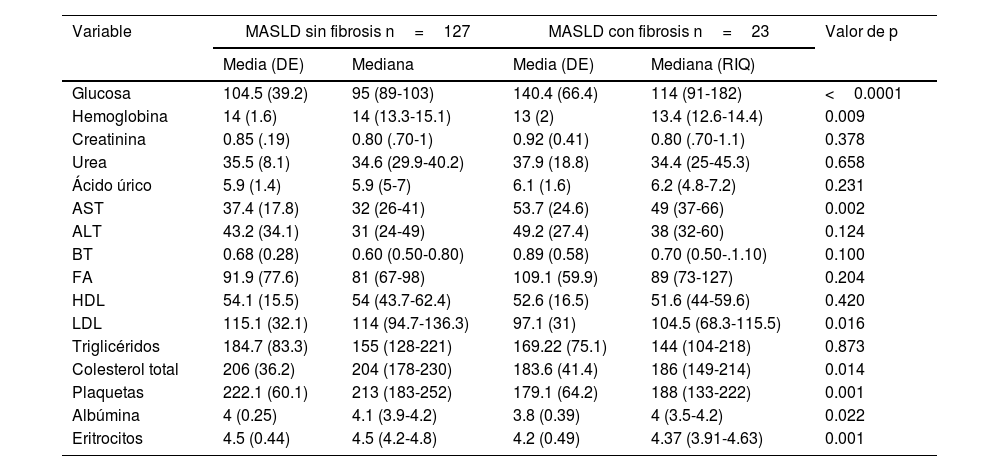
Diferencias bioquímicas en sujetos con MASLD y fibrosisEn los sujetos diagnosticados con MASLD, aquellos con fibrosis hepática mostraron diferencias bioquímicas significativas en comparación con los sujetos sin fibrosis. En el grupo con fibrosis, se observaron niveles elevados de glucosa en ayuno (114 [91-182] vs. 95 [89-103]; p<0.0001) y AST (49 [37-66] vs. 32 [26-41]; p=0.002). Por otro lado, este grupo presentó niveles disminuidos de LDL (97.1±31 vs. 115±32.1; p=0.015), colesterol total (183.6±41.4 vs. 204±36.2; p=0.008), albúmina (4 [3.5-4.2] vs. 4.1 [3.9-4.2]; p=0.022), eritrocitos (4.37 [3.91-4.63] vs. 4.5 [4.2-4.8]; p=0.001), hemoglobina (13.4 [12.6-14.4] vs. 14 [13.3-15.1]; p=0.011) y plaquetas (188 [133-222] vs. 213 [183-252]; p=0.002) en comparación con el grupo sin fibrosis hepática. La tabla 2 muestra la comparación entre el resto de las variables bioquímicas.
Comparación de las variables bioquímicas en individuos con MASLD
| Variable | MASLD sin fibrosis n=127 | MASLD con fibrosis n=23 | Valor de p | ||
|---|---|---|---|---|---|
| Media (DE) | Mediana | Media (DE) | Mediana (RIQ) | ||
| Glucosa | 104.5 (39.2) | 95 (89-103) | 140.4 (66.4) | 114 (91-182) | <0.0001 |
| Hemoglobina | 14 (1.6) | 14 (13.3-15.1) | 13 (2) | 13.4 (12.6-14.4) | 0.009 |
| Creatinina | 0.85 (.19) | 0.80 (.70-1) | 0.92 (0.41) | 0.80 (.70-1.1) | 0.378 |
| Urea | 35.5 (8.1) | 34.6 (29.9-40.2) | 37.9 (18.8) | 34.4 (25-45.3) | 0.658 |
| Ácido úrico | 5.9 (1.4) | 5.9 (5-7) | 6.1 (1.6) | 6.2 (4.8-7.2) | 0.231 |
| AST | 37.4 (17.8) | 32 (26-41) | 53.7 (24.6) | 49 (37-66) | 0.002 |
| ALT | 43.2 (34.1) | 31 (24-49) | 49.2 (27.4) | 38 (32-60) | 0.124 |
| BT | 0.68 (0.28) | 0.60 (0.50-0.80) | 0.89 (0.58) | 0.70 (0.50-.1.10) | 0.100 |
| FA | 91.9 (77.6) | 81 (67-98) | 109.1 (59.9) | 89 (73-127) | 0.204 |
| HDL | 54.1 (15.5) | 54 (43.7-62.4) | 52.6 (16.5) | 51.6 (44-59.6) | 0.420 |
| LDL | 115.1 (32.1) | 114 (94.7-136.3) | 97.1 (31) | 104.5 (68.3-115.5) | 0.016 |
| Triglicéridos | 184.7 (83.3) | 155 (128-221) | 169.22 (75.1) | 144 (104-218) | 0.873 |
| Colesterol total | 206 (36.2) | 204 (178-230) | 183.6 (41.4) | 186 (149-214) | 0.014 |
| Plaquetas | 222.1 (60.1) | 213 (183-252) | 179.1 (64.2) | 188 (133-222) | 0.001 |
| Albúmina | 4 (0.25) | 4.1 (3.9-4.2) | 3.8 (0.39) | 4 (3.5-4.2) | 0.022 |
| Eritrocitos | 4.5 (0.44) | 4.5 (4.2-4.8) | 4.2 (0.49) | 4.37 (3.91-4.63) | 0.001 |
Las mediciones se presentan como media con desviación estándar y mediana con rango intercuartil. La comparación entre grupos se realizó con la prueba t de Student o Wilcoxon según correspondió.
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; BT: bilirrubinas totales; DE: desviación estándar; FA: fosfatasa alcalina; HDL: lipoproteína de alta densidad; LDL: lipoproteína de baja densidad; MASLD: enfermedad hepática esteatótica asociada a disfunción metabólica; RIQ: rango intercuartílico.
Los individuos diagnosticados con MASLD y fibrosis hepática mostraron incrementos significativos en los puntajes de APRI (0.74 [0.51-1.2] vs. 0.45 [0.34-0.62]; p=0.004), FIB-4 (2.37 [1.74-3.47] vs. 1.57 [1.08-1.96]; p=0.007) y HFS (0.15 [0.06-0.58] vs. 0.04 [0.01-0.10]; p=0.009) en comparación con aquellos sin fibrosis. Aunque el puntaje NFS también fue mayor en individuos con MASLD y fibrosis (0.12 [−1.18-1.10] vs. (−0.96 [−1.91- −0.12]) esta diferencia no alcanzó significancia estadística (p=0.628).
Correlaciones entre puntajesLas correlaciones entre los puntajes APRI, FIB-4, HFS y NFS con el kPa fueron (r=.445, p=0.0001), (r=.230, p=0.005), (r=.247, p=0.002) y (r=.208, p=0.011), respectivamente. Además, todos los puntajes correlacionaron entre sí de forma moderada a fuerte.
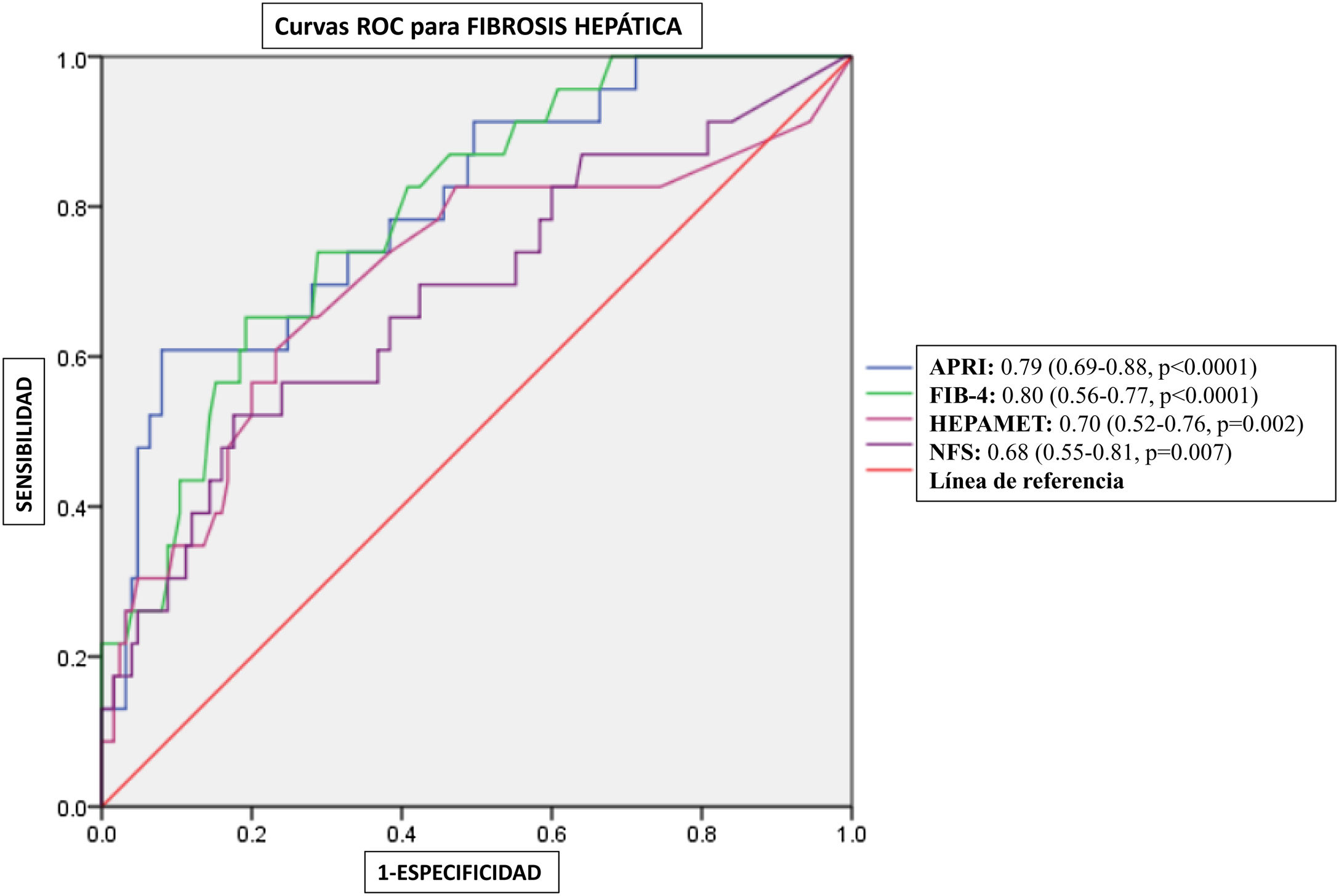
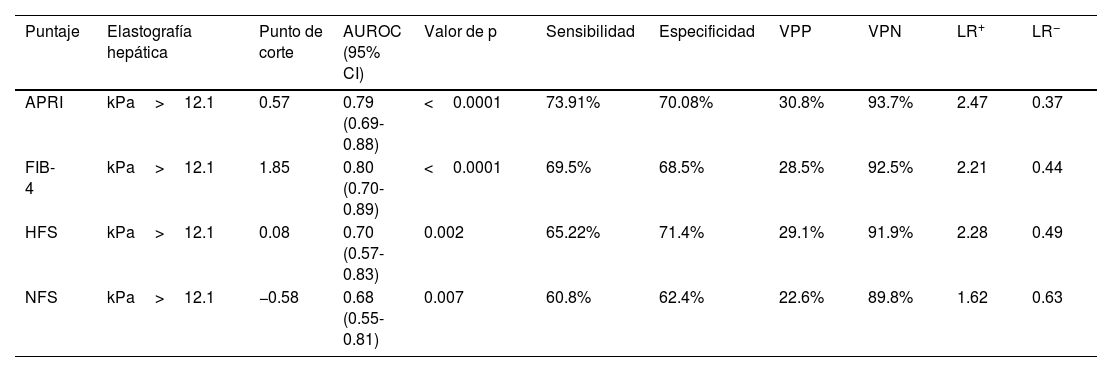
Rendimiento diagnóstico de los puntajes no invasivos para la fibrosis hepáticaLas curvas ROC para las puntuaciones APRI, FIB-4, HFS y NFS se muestran en la figura 2, ilustrando los valores del AUC de 0.79, 0.80, 0.70, y 0.68, respectivamente. Los puntos de corte equivalentes a >12.1kPa en la elastografía para cada uno fueron los siguientes: APRI: 0.56, FIB-4: 1.82, HFS: 0.08 y NFS: −0.54. La tabla 3 incluye un resumen de los puntos de corte, sensibilidad, especificidad, VPP, VPN, y las razones de verosimilitud para cada puntuación.
Rendimiento diagnóstico de FIB-4, APRI, HFS y NFS para la evaluación de la fibrosis hepática en MASLD. Se construyeron curvas de características de operación del receptor (ROC) para evaluar el rendimiento diagnóstico de diferentes puntajes no invasivos para la fibrosis hepática en sujetos con enfermedad hepática esteatótica asociada a disfunción metabólica (MASLD). La fibrosis hepática se evaluó mediante elastografía hepática transitoria, con un umbral de >12.1kPa indicando la presencia de fibrosis.
Desempeño diagnóstico de los distintos puntajes no invasivos para el asesoramiento de la fibrosis hepática en individuos mexicanos con MASLD
| Puntaje | Elastografía hepática | Punto de corte | AUROC (95% CI) | Valor de p | Sensibilidad | Especificidad | VPP | VPN | LR+ | LR− |
|---|---|---|---|---|---|---|---|---|---|---|
| APRI | kPa>12.1 | 0.57 | 0.79 (0.69-0.88) | <0.0001 | 73.91% | 70.08% | 30.8% | 93.7% | 2.47 | 0.37 |
| FIB-4 | kPa>12.1 | 1.85 | 0.80 (0.70-0.89) | <0.0001 | 69.5% | 68.5% | 28.5% | 92.5% | 2.21 | 0.44 |
| HFS | kPa>12.1 | 0.08 | 0.70 (0.57-0.83) | 0.002 | 65.22% | 71.4% | 29.1% | 91.9% | 2.28 | 0.49 |
| NFS | kPa>12.1 | −0.58 | 0.68 (0.55-0.81) | 0.007 | 60.8% | 62.4% | 22.6% | 89.8% | 1.62 | 0.63 |
Se exploró el punto de corte de >12.1 kPa.
APRI: relación aspartato aminotransferasa/plaquetas; AUROC: área debajo de la curva ROC; FIB-4: puntuación de fibrosis-4; HFS: puntuación de fibrosis Hepamet; kPa: kilopascales; LR: razón de verosimilitud; MASLD: enfermedad hepática esteatótica asociada a disfunción metabólica; NFS: puntuación NAFLD; VPP: valor predictivo positivo; VPN: valor predictivo negativo.
La fibrosis hepática, una complicación frecuente de MASLD, exige una evaluación detallada para una óptima gestión clínica. Nuestro estudio se centró en determinar y comparar el rendimiento diagnóstico de cuatro biomarcadores no invasivos (APRI, FIB-4, HFS y NFS) para el asesoramiento de la fibrosis hepática avanzada en sujetos mexicanos con MASLD. Los resultados indican que todas las puntuaciones analizadas presentaron un desempeño diagnóstico satisfactorio. Sin embargo, APRI y FIB-4 destacaron por encima de HFS y NFS. Estos hallazgos sugieren que un valor de FIB-4 superior a 1.85, y un valor superior a 0.57 en el índice APRI, podrían ser herramientas eficaces para la evaluación no invasiva de la fibrosis hepática en individuos con MASLD. Esto puede contribuir a una toma de decisiones clínicas más acertada y un seguimiento más efectivo de la progresión de la enfermedad, especialmente en áreas con limitaciones de recursos.
De acuerdo con nuestra elastografía hepática, el 15.3% de los participantes con MASLD mostraron signos de fibrosis hepática (>12.1kPa), concordando con investigaciones previas26. Sin embargo, es prudente interpretar con cautela la elevada prevalencia de MASLD (77.3%) en nuestra muestra, dada la selección específica de pacientes para la EHT, orientada a aquellos con esteatosis y mayor riesgo de fibrosis como se describe en el reporte completo del programa12. Aunque la prevalencia de MASLD puede parecer elevada, es probable que la prevalencia de fibrosis hepática esté bien estimada.
Nuestros resultados apuntan a que las puntuaciones no invasivas podrían ser biomarcadores útiles en la detección temprana de la fibrosis hepática en pacientes mexicanos con MASLD, sin embargo, es imperativo llevar a cabo más estudios en diferentes zonas de México para corroborar la validez diagnóstica de estas herramientas.
Se han realizado evaluaciones semejantes en diferentes poblaciones. Por ejemplo, Amernia et al. compararon FIB-4, APRI y el índice AST/ALT utilizando la EHT, encontrando que APRI y FIB-4 tuvieron el mayor desempeño diagnóstico27. Este resultado coincide con nuestros hallazgos y con los de Alqahtani et al., resaltando la eficacia diagnóstica de FIB-4 y APRI frente a otras herramientas no invasivas28. No obstante, otros autores han reportado una superioridad de FIB-4 y NFS sobre APRI en cuanto a la predicción de eventos hepáticos y mortalidad en pacientes con MASLD20.
Es importante considerar las limitaciones de nuestro estudio. Aunque el estudio proporciona información valiosa, la generalización de los resultados puede estar limitada debido a la naturaleza observacional y retrospectiva del estudio, así como al muestreo no aleatorizado y la concentración geográfica en Veracruz, México. La representatividad de la muestra de estudio es otra área de consideración crucial, dado que la selección de individuos se basó en criterios específicos de puntajes FIB-4, lo que podría sobreestimar el rendimiento diagnóstico y no capturar la heterogeneidad completa de la población con MASLD. Además, no se midió ni reportó la variabilidad interoperador en aquellos que realizaron la EHT, aunque todos los profesionales involucrados se encuentran certificados y cuentan con amplia experiencia en la realización de elastografías. También, es notable que un alto porcentaje de la muestra, específicamente el 91.3%, presentó condiciones de sobrepeso u obesidad, lo cual podría influir en la interpretación y aplicabilidad de los resultados. Al reconocer y abordar estas limitaciones, nuestro estudio no solo proporciona un marco contextual adecuado para sus hallazgos, sino que también sienta las bases para nuevas investigaciones, impulsando una mejora continua en la comprensión y el manejo de la fibrosis hepática en individuos con MASLD. Para superar estos retos, recomendamos que futuros estudios adopten un diseño longitudinal e incorporen herramientas diagnósticas más precisas, como la biopsia hepática. Además, la consideración de sistemas de puntuación alternativos que integren una gama más amplia de biomarcadores clínicos, bioquímicos y genéticos podría enriquecer significativamente el diagnóstico y tratamiento de esta condición. Estas estrategias, en su conjunto, prometen contribuir de manera sustancial a la evolución del conocimiento y la práctica clínica en el ámbito de la fibrosis hepática asociada a MASLD.
ConclusionesEn conclusión, este estudio demuestra que los puntajes APRI, FIB-4, NAFLD score y Hepamet son herramientas útiles para la evaluación de la fibrosis hepática en sujetos mexicanos con MASLD. Entre estos, FIB-4 y APRI tuvieron el mejor rendimiento diagnóstico.
FinanciaciónEsta investigación recibió apoyo mediante las becas Consejo Nacional de Humanidades, Ciencias y Tecnologías (CONAHCYT), CVU 1138232 (México) y SEP-CONAHCYT, Proyecto de Ciencia Básica #256235 (México).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.