La mastocitosis es una enfermedad rara caracterizada por la proliferación y la acumulación anómala de mastocitos en uno o más órganos. Se postula como patogenia mutaciones activadoras en el gen tirosina quinasa (c-kit), detectándose la mutación D816V en más del 90% de los casos. El acúmulo de mastocitos se puede producir a nivel cutáneo (mastocitosis cutánea) o a nivel de otros órganos (mastocitosis sistémica [MS]), donde se incluye la afectación gastrointestinal1.
Presentamos el caso de un varón de 73 años, sin antecedentes de interés, que derivan desde cardiología para estudio de síndrome anémico. En la exploración física destaca esplenomegalia. Se realiza tomografía computarizada (TC) donde se observa esplenomegalia de 23cm y adenopatías abdominales y mediastínicas. Se realiza biopsia de médula ósea y estudio de inmunohistoquímica (IHQ) revelando la presencia de mastocitos anómalos con positividad para CD68, CD117 y triptasa, con mutación c-kit positiva (D816V). El paciente es diagnosticado de MS asociada a hemopatía monoclonal con afectación cutánea, esplénica, ganglionar, ósea y medular. Ante la ausencia de progresión clínica, se decidió seguimiento periódico sin tratamiento.
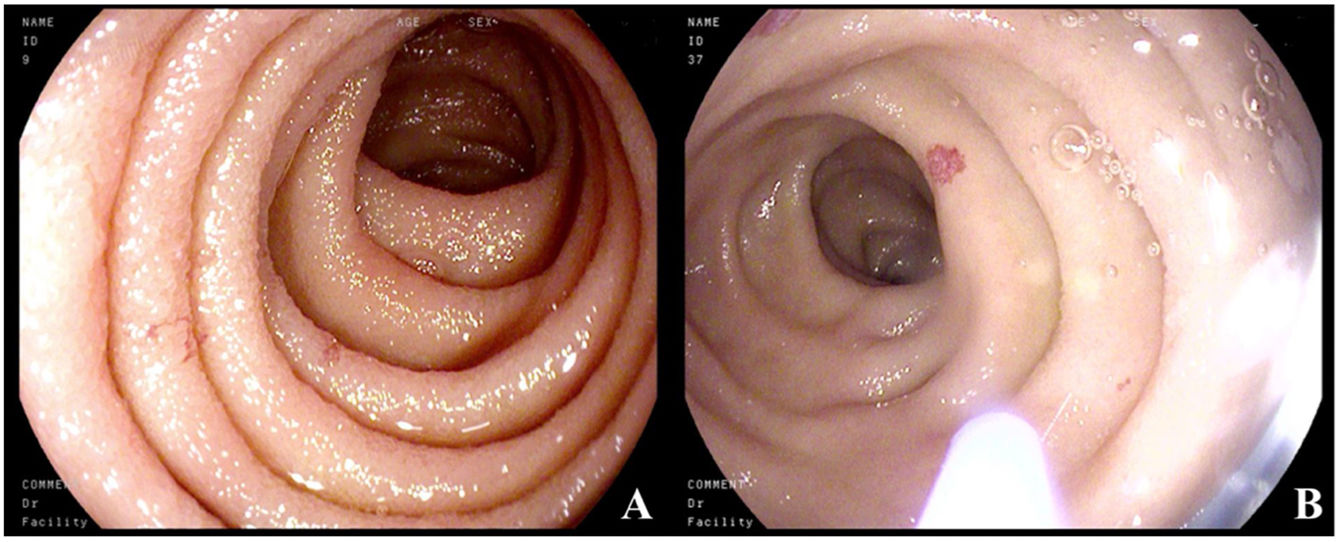
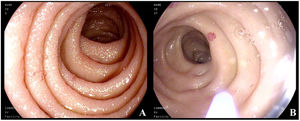
Cinco años más tarde, el paciente ingresó al servicio de gastroenterología por anemia microcítica (cifras de hemoglobina de 9.6g/dl), melenas de 15 días de evolución y diarrea crónica. Los estudios microbiológicos fueron negativos. Se realizaron estudios endoscópicos: la gastroscopia reveló lesiones seudovasculares milimétricas en segunda porción duodenal, friables al roce, que se fotocoagularon con argón plasma por sospecha de ser las responsables del sangrado digestivo (figs. 1A y B); colonoscopia sin hallazgos de interés. En ambas pruebas se tomaron biopsias aleatorias del tracto digestivo, que revelaron acúmulos celulares densos, con focos de más de 15 células de mastocitos anómalos c-kit y triptasa positiva con IHQ CD30+, CD2−, compatible con afectación gastrointestinal de la mastocitosis sistémica.
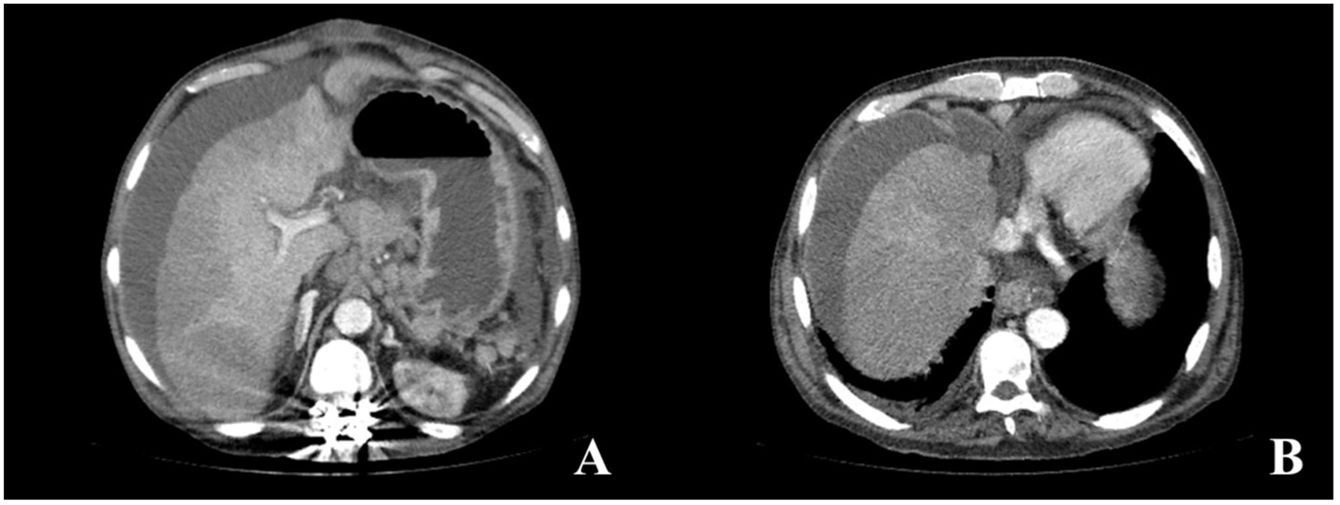
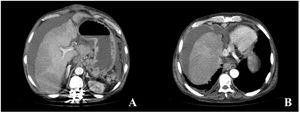
Seis meses más tarde, el paciente consultó en el servicio de urgencias por dolor abdominal brusco. Se realizó TC abdominal que describe trombosis crónica de venas suprahepáticas y vena cava inferior, desarrollo de colaterales venosas, enfermedad hepática crónica y ascitis, todo ello sugestivo de síndrome de Budd-Chiari crónico (figs. 2A y B). El paciente presentó una mala evolución en pocas horas, con fiebre e inestabilidad hemodinámica que precisó el inicio de antibiótico y aminas vasoactivas. Debido al desarrollo de shock séptico y ante la ausencia de un diagnóstico claro por imagen, se realizó laparotomía urgente identificando peritonitis fecaloidea y a 10cm de ángulo de Treitz, rotura completa circunferencial de un asa intestinal abierta a cavidad. Debido a la situación de peritonitis generalizada y shock séptico refractario en un paciente con enfermedad crónica, agresiva e incurable, se desestima actuación más allá que cirugía de control de daños (resección del asa intestinal afectada y cierre primario de la perforación), falleciendo el paciente a las pocas horas por fallo multiorgánico. Posteriormente, el informe histológico de la pieza quirúrgica confirmó que la perforación intestinal era secundaria al acúmulo de mastocitos anómalos con la mutación D816V del gen c-kit.
Imágenes de la TC abdominal con contraste intravenoso en fase portal, reconstrucción axial MIP. A y B) Signos de enfermedad hepática crónica, trombosis crónica de venas suprahepáticas y vena cava inferior, desarrollo de colaterales venosas perigástricas y perihepáticas, así como ascitis en todos los compartimentos.
El término mastocitosis hace referencia a un grupo heterogéneo de enfermedades caracterizadas por la proliferación anómala de mastocitos, con un espectro de presentación y clínica variable en función de la afectación orgánica. Las manifestaciones clínicas se relacionan con la liberación de mediadores mastocitarios, la infiltración tisular o con la presencia de otro trastorno hematológico asociado. La degranulación de los mastocitos condiciona una liberación de histamina, triptasa, prostaglandinas y leucotrienos que provoca episodios de hipotensión, síncope, cefalea, diarrea, dolor abdominal, enrojecimiento, urticaria, angioedema y en cuadros graves, shock anafiláctico1,2. De un 30-80% de los pacientes con MS presentan clínica gastrointestinal3. De un 5-15% presentan infiltración hepática que condiciona hepatomegalia, con o sin fibrosis portal, pero raramente condiciona hipertensión portal y ascitis (4%). El síndrome de Budd-Chiari se encuentra descrito en la literatura como una manifestación extremadamente rara. La afectación intestinal se presenta hasta en el 80% de los pacientes, con infiltración de la pared y atrofia de vellosidades, provocando cuadros de malabsorción con diarrea crónica y esteatorrea. En otras ocasiones se manifiesta como un síndrome similar al inducido por la enteropatía por AINE con náuseas y vómitos (28%), dolor abdominal (50%), erosiones y úlceras que provocan sangrado gastrointestinal (11%)3,4. Los hallazgos endoscópicos más frecuentes son la presencia de lesiones punteadas violáceas, pápulas urticaria-like y una mucosa edematosa y eritematosa con una pared adelgazada5. En nuestro caso, la perforación intestinal fue secundaria a la infiltración mastocitaria causante de inflamación, fibrosis, rigidez y zonas de debilidad de la pared intestinal. El diagnóstico de la MS se realiza mediante la demostración de la infiltración de mastocitos en los tejidos afectados y la presencia de la mutación en el gen KIT. Los hallazgos endoscópicos y radiológicos, aunque inespecíficos, pueden ayudarnos en el diagnóstico1,2.
El objetivo terapéutico es prevenir la degranulación mastocitaria para control de los síntomas secundarios, con el empleo de antihistamínicos, estabilizadores, inhibidores de leucotrienos (montelukast), inhibidores de la bomba de protones (omeprazol), corticoesteroides y/o anticuerpos monoclonales anti-IgE (omalizumab)6. En formas agresivas y de forma individualizada, se podría emplear tratamiento citorreductor (cladribina)2, inhibidores de tirosina quinasa (imatinib y nilotinib)7, midostaurin8 o avapritinib9, con resultados prometedores, pudiendo ser en ocasiones subsidiarios de trasplante de médula ósea.
Como conclusión, presentamos el caso de un paciente con MS asociada a hemopatía monoclonal que presenta una perforación intestinal en el contexto de infiltración mastocitaria masiva a nivel gastrointestinal, una entidad extremadamente infrecuente en la práctica clínica.
Consideraciones éticasSe trata de la descripción de un caso clínico. No se trata de un ensayo clínico ni se ha realizado experimentación con animales ni humanos.
Los autores de este manuscrito han seguido los protocolos de nuestro centro de trabajo (Hospital Universitario Central de Asturias) para la publicación de casos clínicos de pacientes y se ha preservado el anonimato del paciente.
El consentimiento informado no se solicitó para la publicación de este caso, porque en el presente artículo no se publican datos personales que permitan identificar al paciente.
FinanciaciónLos autores de este artículo declaran que, para la redacción y elaboración de este manuscrito, no se ha obtenido ninguna fuente de financiación.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses con ninguna organización en relación con el artículo que se remite para publicación.