La ecografía en el punto de atención (POCUS) se refiere a la utilización del ultrasonido (US) mediante dispositivos ultrasonográficos de bolsillo, al pie de la cama del paciente, con el objetivo de establecer un diagnóstico o dirigir un procedimiento y responder a una cuestión clínica de forma inmediata, su finalidad es ampliar la exploración física, no sustituir la evaluación ultrasonográfica convencional. POCUS ha evolucionado como un complemento del examen físico siendo adoptado por distintas especialidades médicas, incluyendo la hepatología. Se elaboró una síntesis de evidencia narrativa sobre las aplicaciones de POCUS en hepatología, describiendo la utilidad de POCUS en el diagnóstico de cirrosis hepática, enfermedad hepática esteatósica asociada a disfunción metabólica (MASLD, por sus siglas en inglés), cirrosis descompensada y el diagnóstico de hipertensión portal, así como las más recientes aplicaciones de POCUS en la evaluación hemodinámica del paciente con cirrosis hepática en estado crítico, otras enfermedades hepáticas y guía ultrasonográfica de procedimientos.
POCUS podría formar parte de la práctica clínica diaria de gastroenterólogos y hepatólogos, simplificando la evaluación inicial de los pacientes y optimizando el manejo clínico. Su accesibilidad, facilidad de uso y bajo perfil de efectos adversos la hacen una herramienta útil para el médico propiamente entrenado en el escenario clínico adecuado, por lo que el objetivo de esta revisión fue describir la evidencia que existe sobre la utilidad de POCUS en la práctica clínica diaria de gastroenterólogos y hepatólogos.
Point-of-care ultrasound (POCUS) refers to the use of ultrasound imaging through pocket-sized sonographic devices at the patient's bedside, to make a diagnosis or direct a procedure and immediately answer a clinical question. Its goal is to broaden the physical examination, not to replace conventional ultrasound studies. POCUS has evolved as a complement to physical examination and has been adopted by different medical specialties, including hepatology. A narrative synthesis of the evidence on the applications of POCUS in hepatology was carried out, describing its usefulness in the diagnosis of cirrhosis of the liver, metabolic dysfunction-associated steatotic liver disease (MASLD), decompensated cirrhosis, and portal hypertension. The review also encompasses more recent applications in the hemodynamic evaluation of the critically ill patient with cirrhosis of the liver, patients with other liver diseases, as well as in the ultrasound guidance of procedures.
POCUS could make up part of the daily clinical practice of gastroenterologists and hepatologists, simplifying the initial evaluation of patients and optimizing clinical management. Its accessibility, ease of use, and low adverse event profile make POCUS a useful tool for the properly trained physician in the adequate clinical setting. The aim of this review was to describe the available evidence on the usefulness of POCUS in the daily clinical practice of gastroenterologists and hepatologists.
Comprender el contexto vigente de la medicina moderna sería difícil sin las innovaciones y controversias del ejercicio de la medicina en el pasado. Las herramientas utilizadas en la exploración física convencional han tenido su curva de utilidad y vigencia. Es evidente que la auscultación a través de un estetoscopio de Pinard tuvo que existir para que después existiera el estetoscopio moderno o el Doppler para la auscultación fetal. Así, la tecnología en las estrategias clínicas avanza conforme se modifican las necesidades, como en un tipo de «prueba y error» que tal vez nunca culminará en la herramienta perfecta de exploración. Cabe destacar que más tecnología no significa mejor. Con el surgimiento de nuevas herramientas y avances, es probable que existan discrepancias en su aceptación. Para la adopción o rechazo de su implementación debemos hacernos algunas preguntas: ¿Lo rechazo porque no lo he aprendido de esta forma?, ¿lo rechazo porque lo desconozco?, ¿lo rechazo porque dudo de su utilidad?, ¿lo acepto solo porque es nuevo?1-4.
Si la respuesta es sí a cualquiera de las preguntas anteriores, es probable que hayamos elegido perder la oportunidad de otorgar validez a cualquier método involucrado en el proceso diagnóstico. No es solo la preferencia lo que debe guiar nuestro actuar en medicina. Así, no es equiparable preferir leer revistas en formato físico sobre leerlas en formato digital, que preferir utilizar una radiografía simple de tórax sobre una tomografía en un centro que disponga de ambas herramientas; pero mucho menos adecuado sería pretender reemplazar el método diagnóstico solo con ultrasonido (US) pulmonar por ser nuevo y disponer de este. El valor agregado inherente al US sería el explorar de forma global el estado hemodinámico, la función de bomba del corazón, el estado pulmonar, abdominal, entre otros, lo cual iría directamente a la cuestión central del diseño e implementación de herramientas diagnósticas: el beneficio de los pacientes2,5,6. Justo ahí radica la importancia de las palabras «point of care», que no es una prueba diagnóstica dicotómica, sino un medio que permite ofrecerle al paciente una evaluación instrumentada global dirigida a la toma de decisiones, tal como la exploración física lo ha ofrecido a lo largo de la historia2.
La ecografía en el punto de atención (POCUS, por sus siglas en inglés) se refiere a la utilización del US generalmente con dispositivos ultrasonográficos de bolsillo (fig. 1), al pie de la cama del paciente, con el objetivo de establecer un diagnóstico o dirigir un procedimiento y responder a una cuestión clínica de forma inmediata, su finalidad es ampliar la exploración física, no hacer US de modo sistemático como el que hacen los radiólogos, ni pretende sustituirlo. POCUS ha evolucionado como un complemento del examen físico siendo adoptado por distintas especialidades médicas, incluyendo la hepatología1-4.
MetodologíaSe elaboró la siguiente síntesis de evidencia narrativa de acuerdo con los siguientes pasos. Primer paso: se seleccionaron los tópicos enfocados a la ecografía en el punto de atención en hepatología. Segundo paso: los siguientes coautores (DKTC y JAVRV) evaluaron la información, la sintetizaron y la codificaron en los diversos tópicos. Tercer paso: posterior a esta codificación se desarrollaron preguntas dirigidas y se realizó una revisión sistemática en las bases de datos: DynaMed, Google Scholar y PubMed. Se utilizó la jerarquía de la pirámide de la evidencia preevaluada para la obtención de la información. Se inició por sumarios de evidencias (guías de práctica clínica, UpToDate y Dynamed), posterior síntesis/sinopsis de evidencia (revisiones sistemáticas) y, por último, estudios originales (estudios controlados aleatorizados y estudios observacionales). La búsqueda de información fue realizada en los idiomas español e inglés. Se utilizaron las siguientes palabras claves: «cirrosis», «cirrosis descompensada», «enfermedad hepática crónica compensada», «esteatosis», «enfermedad hepática grasa no alcohólica», «hipertensión portal», «POCUS», «ultrasonido hepático», «ultrasonido de bolsillo», «ultrasonido a pie de cama», con publicaciones desde 1992 hasta 2023. Los resultados obtenidos fueron enviados al equipo de coautores quienes, utilizando el formato estandarizado, extrajeron la información relevante para la inclusión de esta síntesis de evidencia narrativa. El objetivo de esta revisión narrativa fue describir la evidencia que existe sobre la utilidad de POCUS en la práctica clínica diaria de gastroenterólogos y hepatólogos. A continuación, se exponen los tópicos más relevantes.
POCUS en la enfermedad hepática crónica compensadaDiagnóstico de cirrosis hepáticaLa biopsia hepática es el estándar de oro para el diagnóstico de cirrosis hepática; sin embargo, es una herramienta invasiva lo que dificulta su uso en la práctica clínica diaria. El US hepático es una herramienta segura, fácil de realizar y poco costosa con una sensibilidad y especificidad para el diagnóstico de cirrosis del 55-80 y el 86%, respectivamente7,8. El US en modo B permite evaluar parámetros asociados a enfermedad hepática crónica como el tamaño del hígado y el bazo, atrofia del lóbulo hepático derecho, hipertrofia del lóbulo caudado, borde hepático redondeado, parénquima hepático granular, heterogeneidad del parénquima y superficie hepática nodular9,10.
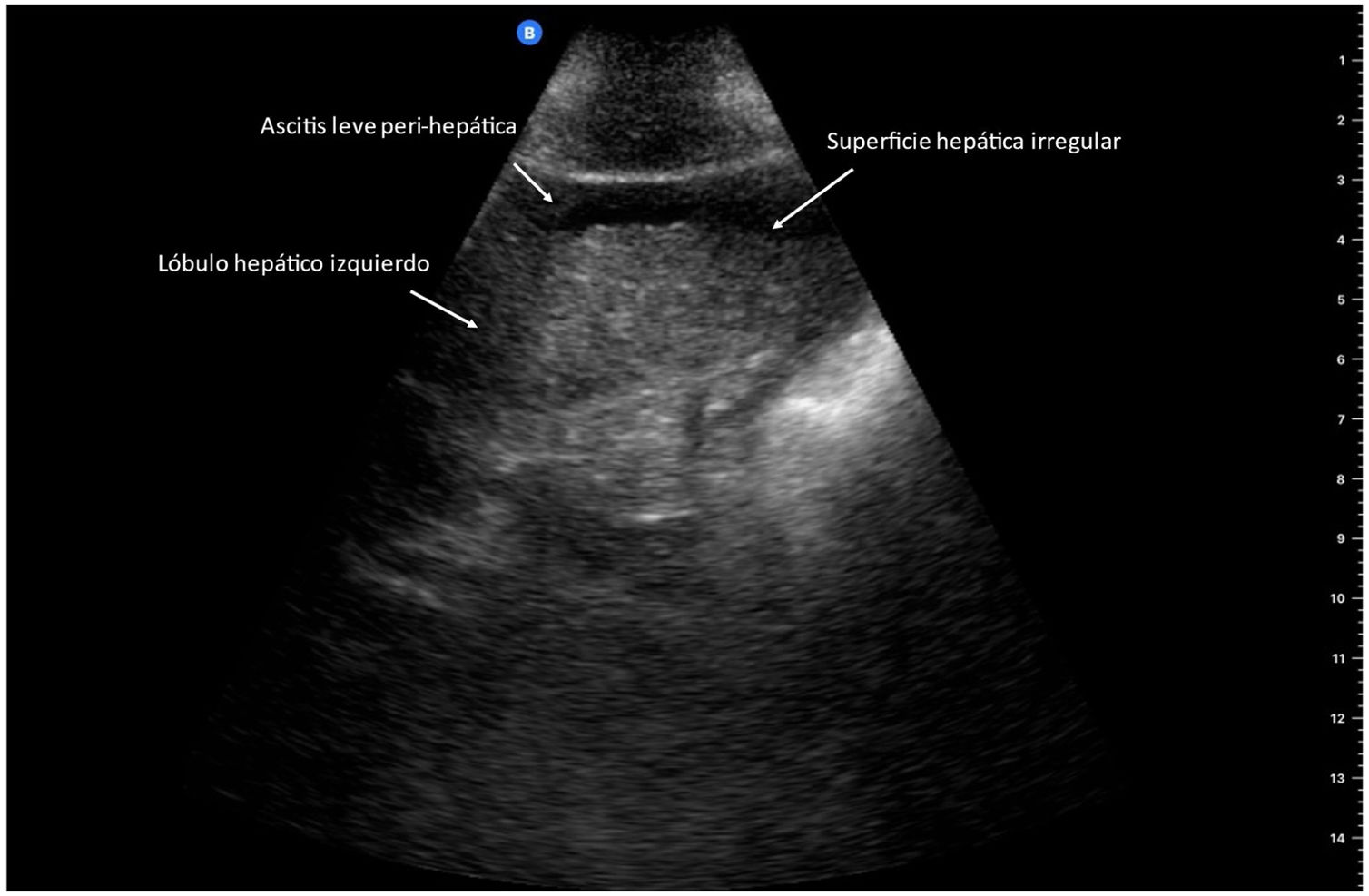
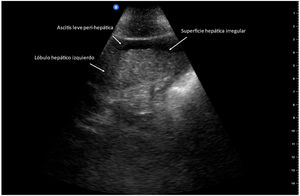
Se ha demostrado que POCUS es útil para diagnóstico de cirrosis hepática mediante la identificación de una superficie hepática nodular (fig. 2), el signo ultrasonográfico con mayor exactitud para el diagnóstico de cirrosis hepática, utilizando un dispositivo de bolsillo con un transductor de 5 a 12MHz, reportando una sensibilidad y especificidad del 87.5 y el 76.8%, respectivamente, y un adecuado acuerdo interobservador (coeficiente kappa de Cohen: 0.87), sugiriendo que POCUS puede ser utilizado como una herramienta de primera línea para identificar a los pacientes que requieren la realización de técnicas más especializadas, acortando el tiempo de toma de decisiones clínicas11.
Enfermedad hepática esteatósica asociada a disfunción metabólicaLa enfermedad hepática esteatósica asociada a disfunción metabólica (MASLD, por sus siglas en inglés)12, antes conocida como enfermedad hepática grasa no alcohólica (NAFLD) es la enfermedad hepática crónica más común, con una prevalencia a nivel mundial del 25%13.
Actualmente se describe a la MASLD como una enfermedad multisistémica con manifestaciones extrahepáticas y una estrecha relación con el síndrome metabólico (SMet), considerado la MASLD como la manifestación hepática del SMet. La prevalencia de la MASLD es mayor conforme aumentan los componentes del SMet como obesidad abdominal, dislipidemia, hipertensión arterial y diabetes mellitus tipo 2 (DM2)14-16.
Los nuevos conocimientos sobre la patogenia de la enfermedad y su asociación con el SMet y sus componentes han hecho necesaria la modificación de los criterios diagnósticos, actualmente la demostración de esteatosis hepática por estudios de imagen, biomarcadores séricos o biopsia hepática aunada a la presencia de sobrepeso u obesidad, DM2 o la evidencia de disfunción metabólica con al menos 2criterios de riesgo metabólico (circunferencia de cintura≥102/88cm en hombres/mujeres, presión arterial≥130/85mmHg, triglicéridos≥150mg/dl, colesterol HDL<40/50mg/dl en hombres/mujeres, prediabetes, HOMA>2.5 o proteína C reactiva> 2mg/l) es suficiente para establecer el diagnóstico de MASLD17.
Las guías actuales recomiendan la realización de US hepático como prueba de primera línea para el diagnóstico de esteatosis, el cual tiene una alta precisión para detectar esteatosis moderada a grave pero es poco confiable cuando la esteatosis es inferior al 20% y subóptimo en individuos con IMC> 40kg/m2 con una disminución de la sensibilidad y especificidad de hasta el 49 y el 75%, respectivamente17,18. Cuando la extensión de la esteatosis es≥20-30% el US alcanza una sensibilidad del 84.8% y una especificidad del 93.6%, con un área bajo la curva (AUROC) de 0.93 (0.91-0.95), similar a otros estudios de imagen como la tomografía o resonancia, aunque con una elevada variabilidad interoperador e interobservador19.
La esteatosis hepática produce un aumento en la ecogenicidad del tejido hepático con un aspecto de «hígado brillante», la imagen en modo B del US permite estimar la gravedad de la infiltración hepática de forma subjetiva en 4 grados: ausencia de esteatosis (grado 0): ecogenicidad del hígado normal en comparación con el riñón; leve (grado 1): aumento difuso de la ecogenicidad hepática con adecuada visualización del diafragma y la pared de la vena porta (VP); moderada (grado 2): aumento moderado en la ecogenicidad con borramiento de la pared de la VP y del diafragma, y grave (grado 3): marcado aumento de la ecogenicidad con ausencia de visualización de la pared de la VP, diafragma y parte posterior del lóbulo hepático derecho20.
La utilidad de POCUS en el diagnóstico de esteatosis hepática ha sido evaluada en distintos estudios, Riley et al. entrenaron a un grupo de gastroenterólogos (sin adiestramiento en US previo) para identificar una serie de características ultrasonográficas de esteatosis hepática mediante POCUS utilizando un ecógrafo portátil Sonosite (Bothell, WA, EE. UU.) con una sonda de matriz curva con frecuencia de banda ancha de 5-2MHz, reportando una elevada sensibilidad del 80% y una especificidad del 99% y con un adecuado acuerdo interobservador (Kappa 0.76)21. Stock et al. describieron el valor diagnóstico y tiempo utilizado en la evaluación POCUS mediante un US de bolsillo de 2-4MHz en comparación con un instrumento de gama alta de 2-6MHz matriz curva (Sonoline Antares), el dispositivo de bolsillo detectó 32 (84%) de los 38 hallazgos hepáticos patológicos, logrando identificar todos los casos de esteatosis hepática (n=20), aunque sin describir los criterios diagnósticos utilizados. El tiempo invertido en la examinación fue menor con el dispositivo de bolsillo (25.0 vs. 29.4min) (p <0.001), debido a mayor tiempo requerido para el traslado y preparación del equipo de gama alta, aunque que la duración verdadera de la exploración con el US fue menor con el instrumento de gama alta22. Miles et al. evaluaron el desempeño diagnóstico para la detección específica de esteatosis hepática del US de bolsillo (sonda con frecuencia de 5-1MHz) en comparación con el US convencional (GE Healthcare LOGIQ E9 con sonda curvilínea), las evaluaciones POCUS fueron realizadas por un médico internista certificado en POCUS y un radiólogo con 40 años de experiencia, la sonda de POCUS fue colocada en la línea axilar media derecha a nivel del apéndice xifoides y ajustada para la visualización intercostal, se obtuvieron imágenes de la interfase hepatorrenal en el modo 2D B. Se consideró como infiltración grasa si la ecogenicidad del hígado estaba aumentada en comparación con la corteza renal derecha para POCUS y para el US convencional se utilizó la clasificación subjetiva de la esteatosis (4 grados del 0 al 3). Se incluyó a 100 pacientes, un 40% tuvo infiltración grasa en ambas evaluaciones, la sensibilidad y la especificidad de POCUS en comparación con el US convencional fue del 91 y el 88%, respectivamente; los resultados fueron discordantes en 11 pacientes, realizando una segunda revisión donde se estableció que 2 de ellos presentaban esteatosis como lo había evidenciado la evaluación con POCUS, lo cual sugiere que la discrepancia entre ambas evaluaciones es poco frecuente; estos pacientes fueron mayores en comparación con el resto de la población (61± 9 vs. 53±15 años, p <0.05), pero la distribución de género y el IMC fueron similares23. Además, en un reciente estudio, Sourianarayanane y McCullough demostraron que el puntaje de actividad NAFLD en la histología se correlaciona con el índice de hígado graso ultrasonográfico (USFLI) del examen POCUS (r=0.59), un USFLI ≥ 6 es diagnóstico de esteatohepatitis asociada a disfunción metabólica (MASH, por sus siglas en inglés) con una sensibilidad del 81% y un valor ≤ 3 descarta MASH con una sensibilidad del 100%24.
Estos hallazgos sugieren que la evaluación de la MASLD mediante POCUS podría ser de utilidad como medio de cribado para determinar la presencia o ausencia de esteatosis aunque la cuantificación precisa de la extensión de la esteatosis y la evaluación del grado de fibrosis que es determinante en el pronóstico de la enfermedad están fuera del espectro de POCUS y deberían utilizarse otros métodos ya sea la estimación de fibrosis con el cálculo de puntajes no invasivos como el FIB-4 o métodos elastográficos como el FibroScan® (Echosens, París, Francia). La tabla 1 describe los hallazgos indicativos de MASLD en el US modo B y POCUS.
Diagnóstico de MASLD con US en modo B y POCUS
| US en modo B | POCUS |
|---|---|
| Aspecto de «hígado brillante»Clasificación subjetiva de la esteatosis (4 grados del 0 al 3)Ausencia de esteatosis (grado 0): ecogenicidad del hígado normal en comparación con el riñónLeve (grado 1): aumento difuso de la ecogenicidad hepática con adecuada visualización del diafragma y la pared de la vena portaModerada (grado 2): aumento moderado en la ecogenicidad con borramiento de la pared de la vena porta y del diafragmaGrave (grado 3): marcado aumento de la ecogenicidad con ausencia de visualización de la pared de la vena porta, diafragma y parte posterior del lóbulo hepático derecho | 1. Ecogenicidad del hígado aumentada en comparación con la corteza renal derecha2. Atenuación rápida de la imagen en los primeros 4-5cm de profundidad3. Aumento difuso de la ecogenicidad en los primeros 2-3cm de profundidad4. Ecogenicidad hepática uniformemente heterogénea5. Aumento del grosor del tejido subcutáneo> 2cm (distancia entre la superficie de la piel y la superficie hepática)6. Ocupación de todo el campo por el hígado con ausencia de visibilidad de los bordes hepáticos |
Con el aumento de la prevalencia de MASLD, la evaluación de la esteatosis por POCUS podría formar parte de la práctica clínica diaria de gastroenterólogos y hepatólogos, simplificando la evaluación inicial de los pacientes y limitando el número de visitas. A pesar de que POCUS no puede remplazar a la biopsia hepática en la monitorización de la progresión de esteatosis simple a esteatohepatitis ni a la elastografía en la evaluación del grado de fibrosis, su accesibilidad, facilidad de uso y bajo perfil de efectos adversos la hacen una herramienta útil para el médico propiamente entrenado en el escenario clínico adecuado25.
POCUS en la enfermedad hepática crónica descompensadaDetección de hipertensión portalLa hipertensión portal (HP) es la principal consecuencia de la cirrosis hepática y un factor determinante en el pronóstico de la enfermedad26. El aumento de la presión portal≥ 10mmHg, también denominado HP clínicamente significativa (HPCS) predice el desarrollo de descompensación clínica (ascitis, hemorragia variceal o encefalopatía hepática)27,28.
El estándar de oro para la evaluación de la presión portal es la medición del gradiente de presión venosa hepática (GPVH) que representa el gradiente entre la presión de la red capilar sinusoidal hepática y la presión de la vena suprahepática (VSH) libre29. La medición del GPVH es inadecuada para la práctica clínica diaria al ser una técnica invasiva, costosa y poco disponible9,29. Por lo que el uso de herramientas no invasivas para diagnosticar HP como el US hepático desempeña un papel importante.
El US en modo B permite determinar el tamaño del bazo, se ha descrito que la esplenomegalia (1 a 2 desviaciones estándar de la normalidad) determinada por el índice volumétrico esplénico es un predictor de HP30, además la combinación de parámetros como la elasticidad esplénica, el diámetro del bazo y el conteo plaquetario pueden ser utilizados para identificar a pacientes con HPCS31. Se ha demostrado que la aplicación de POCUS mediante un dispositivo de bolsillo permite identificar la presencia de esplenomegalia con una especificidad> 90% y una sensibilidad>70%, con una elevada concordancia entre el US convencional y POCUS (kappa> 0.6)32.
En pacientes con HP, la vena umbilical se encuentra frecuentemente recanalizada, es el signo ultrasonográfico más específico de HP, puede observase como una vena aumentada de tamaño a nivel del ligamento falciforme33.
El US modo Doppler permite evaluar la hemodinamia del sistema venoso portal mediante la determinación de parámetros como el flujo y volumen sanguíneo de la VP, la velocidad de la VP media y máxima (PVV), el índice de congestión de la VP y los índices de resistencia de las arterias hepática y esplénica34; además es posible analizar la forma de la onda de la VSH mediante el uso de Doppler pulsado, que en individuos sanos tiene un patrón trifásico con 2ondas negativas y una positiva, mostrando un patrón bifásico o monofásico en los pacientes con HP, con una sensibilidad del 76% y una especificidad del 82%9.
El diámetro normal de la VP es ≤ 13mm con la respiración normal, con un flujo hepatopetal (hacia el hígado) y una velocidad de flujo media de 15 a 18cm/s. Cuando existe aumento de la presión portal, el diámetro de la VP aumenta (> 13mm), la dirección del flujo puede invertirse (hepatófugo) y la PVV media se encuentra disminuida debido al aumento de la resistencia vascular intrahepática10, considerando <15cm/s el mejor punto de corte para la detección de HP35. Por otro lado, debido a la presencia de shunts porto-sistémicos, algunos pacientes con cirrosis hepática pueden presentar valores de PVV normales o elevados9, se ha demostrado una correlación significativa entre el GPVH y la PVV36. A pesar de que los nuevos dispositivos utilizados en POCUS cuentan con la herramienta Doppler, la determinación de las velocidades de flujo de la VP y los índices de resistencia están fuera del alcance de POCUS.
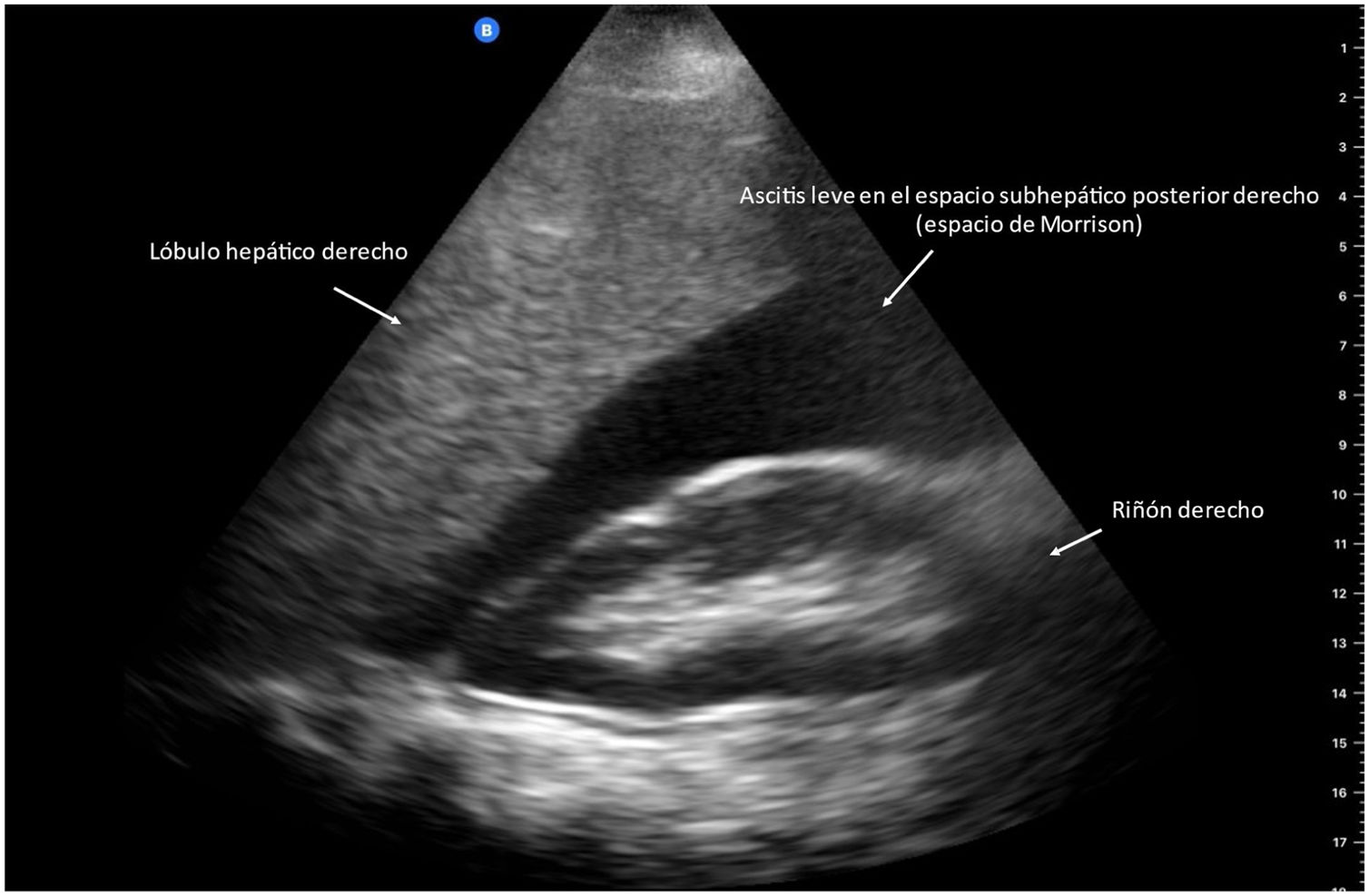
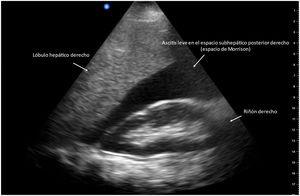
La ascitis es la descompensación clínica más frecuente de los pacientes con cirrosis hepática, se clasifica en 3 grados de acuerdo con la cantidad de líquido en la cavidad abdominal: grado 1 o leve (ultrasonográfica), grado 2 o moderada (clínica) y grado 3 o grave (a tensión)37. POCUS es una herramienta confiable para la evaluación de la ascitis, diversos estudios han demostrado una buena correlación entre el US con dispositivo de bolsillo y el US convencional con un instrumento de gama alta4,38, reportando una sensibilidad del 95.8% y especificidad del 81.8% para el diagnóstico de ascitis (fig. 3)39.
Evaluación hemodinámica en el paciente críticoLa monitorización hemodinámica básica del enfermo en estado crítico incluye la realización de la historia clínica completa con examen físico dirigido y evaluación de los signos vitales (frecuencia cardíaca, presión arterial media, frecuencia respiratoria, temperatura, saturación capilar de oxígeno y la cuantificación de gasto urinario); sin embargo, con la nueva evidencia disponible, este abordaje inicial podría ser insuficiente para la adecuada evaluación del estado hemodinámico en pacientes críticos40. La evaluación del estado hemodinámico ha evolucionado con la implementación de indicadores sonográficos del estado hídrico, mediante la utilización de POCUS es posible evaluar el corazón, las venas abdominales y los pulmones (enfoque: bomba-tuberías-fugas) obteniendo información sobre la hemodinámica sistémica y la optimizando el manejo clínico41.
El US pulmonar permite identificar la presencia de líquido en el intersticio pulmonar (líquido pulmonar extravascular) mediante la observación de líneas B indicativas de edema pulmonar difuso que son equivalentes a las líneas B de Kerley observadas en la radiografía de tórax41. Esta técnica permite la diferenciación entre neumonía, derrame pleural, edema intersticial y colecciones, además de determinar las causas de los fracasos del destete ventilatorio como derrames, atelectasia y neumotórax42,43. El desempeño diagnóstico de POCUS para detectar congestión pulmonar es superior a la exploración física, estableciendo el diagnóstico incluso antes de la aparición de los síntomas41,42.
El POCUS cardíaco se limita a la evaluación de la función ventricular izquierda y derecha y la presencia de derrame pericárdico41, se ha demostrado que el POCUS cardíaco es útil en la evaluación hemodinámica de pacientes con cirrosis hepática críticamente enfermos, en situaciones de hipotensión POCUS puede demostrar alteraciones en el movimiento del ventrículo izquierdo (VI) que reflejan la necesidad de expansión de volumen con cristaloides o albúmina para aumentar la precarga o disminución en la función sistólica que requieran el uso de inotrópicos44.
La evaluación de la vena cava inferior (VCI) por POCUS permite determinar el estado hídrico estimando la presión de la aurícula derecha (PAD), midiendo la altura del punto de colapso (análogo al punto más alto de pulsación venosa cuando se evalúa la presión venosa yugular por inspección [IVY])42. La VCI se colapsa durante la inspiración debido a la presión intratorácica negativa, un diámetro ≤ 2.1cm y un colapso> 50% indican una PAD normal de 3mmHg, mientras que un diámetro> 2.1cm y colapso inspiratorio <50% indican una PAD elevada (≥ 15mmHg)41. La IVY POCUS está sujeta a errores debido a un ángulo de elevación de la cabeza inapropiado, aplicación involuntaria de presión excesiva del transductor, acceso limitado al cuello debido a catéteres, collares de traqueostomía o aparatos ortopédicos42. El diámetro de la VCI y el índice de colapsabilidad (IVCCI) han demostrado ser un marcador confiable para la estimación del estado hídrico de pacientes con cirrosis hepática y respiración espontánea45; sin embargo, un reciente estudio demostró que la evaluación del índice de colapsabilidad del área transversal de la vena yugular interna a 30° por POCUS tiene una mejor correlación con la presión venosa central (r=–0.56, p=0.001) en comparación con el diámetro de la VCI46.
Las ecografías de la VCI o IVY son útiles para estimar la PAD, pero los efectos de la PAD elevada en los órganos deben medirse mediante US Doppler de las venas abdominales, típicamente la VSH, VP y los vasos renales, esta técnica es conocida como US de exceso venoso o VExUS42.
La evaluación del estado hídrico por VExUS presenta algunas dificultades en los pacientes con cirrosis hepática debido a los cambios hemodinámicos propios de la HP como la ausencia de pulsatilidad del flujo de la VP en casos de congestión grave y aumento de la pulsatilidad no asociada con la PAD o la presencia de patrón de flujo bifásico o monofásico en la VSH. Además, el diámetro de la VCI puede estar falsamente disminuido en casos de ascitis a tensión a pesar del exceso del volumen intravascular9,41,47. Es por esto que los resultados de la evaluación por POCUS y VExUS deben interpretarse en el contexto clínico del paciente41.
POCUS en la administración de albúminaCon las consecuencias de la sobrecarga iatrogénica de líquidos, la administración empírica de albúmina ha sido objeto de atención, los hallazgos sugieren una alta incidencia de complicaciones pulmonares48,49. Debido a que POCUS evalúa el estado hemodinámico con mayor precisión que el examen físico y los estudios de imagen convencionales47,50, sería prudente utilizarlo de forma rutinaria en pacientes con alto riesgo de hipervolemia50.
El diagnóstico de síndrome hepatorrenal tipo I (SHR-1) implica la ausencia de respuesta a la administración de albúmina durante 48 h51; sin embargo, ningún parámetro objetivo de la evaluación del estado hídrico es utilizado. Velez et al. demostraron que la medición del diámetro de la VCI y el IVCCI mediante POCUS permite evaluar el estado del volumen intravascular en pacientes con cirrosis y lesión renal aguda que hayan recibido albúmina intravenosa por sospecha clínica de SHR-1, solo el 36% (n=19) de los pacientes incluidos estaban euvolémicos, lo que sugiere que la dosis estándar de albúmina podría ser insuficiente para restablecer el volumen o por el contrario conducir a la sobrecarga hídrica en algunos pacientes, la modificación del tratamiento con administración de albúmina (1g/kg/día) en los pacientes con evidencia de depleción de volumen y furosemida (80-160mg/8-12 h) en los pacientes con sobrecarga hídrica en la evaluación POCUS, resultó en la mejoría temprana de la función renal en el 23% de los casos52.
Por lo tanto, la combinación de los parámetros hemodinámicos evaluados por POCUS permite detectar problemas pulmonares y cardíacos en pacientes con enfermedad hepática, determinar dosis de líquidos para reanimación, iniciar vasopresores oportunos y determinar la dosis de diálisis y la seguridad de albúmina o componentes sanguíneos en pacientes con sobrecarga de volumen43,53.
POCUS en otras enfermedades hepáticasPOCUS en trasplante hepáticoEl trasplante hepático (TH) es el tratamiento definitivo de las enfermedades hepáticas terminales y de la falla hepática aguda. Actualmente, la mejoría en la terapia de inmunosupresión y el perfeccionamiento de las técnicas quirúrgicas ha logrado incrementar la tasa de sobrevida hasta el 85, el 73 y el 62% al año, 5 y 10 años, respectivamente; sin embargo, las complicaciones postoperatorias conllevan a un elevado riesgo de morbimortalidad en el receptor con una incidencia que varía del 7 al 30%. El US en escala de grises y con técnica Doppler color permite identificar de manera temprana las alteraciones de las anastomosis arteriales, venosas y biliares logrando minimizar las complicaciones y evitar la pérdida del injerto54.
La trombosis de la arteria hepática es la complicación vascular del postrasplante hepático más temida ya que puede producir afectación de la vía biliar y pérdida del injerto; el daño ocasionado es directamente proporcional al tiempo de evolución. Por otro lado, la estenosis de la arteria hepática tiene una evolución más lenta e insidiosa, condicionando daño en la vía biliar por isquemia y formación de circulación colateral. Otras complicaciones menos frecuentes son la formación de seudoaneurisma y con menor frecuencia la hipoperfusión por robo arterial. Las manifestaciones clínicas iniciales de la trombosis y estenosis de la arteria hepática son específicas por lo que la vigilancia mediante ecografía Doppler color en el postoperatorio y seguimiento son cruciales para el diagnóstico oportuno y abordaje terapéutico55,56.
Las complicaciones de las anastomosis venosas son infrecuentes, su repercusión en la función del injerto y las manifestaciones clínicas son variables, pueden cursar asintomáticas o presentarse con características clínicas típicas de la HP, de acuerdo con la zona y extensión de la lesión. Ambas complicaciones muestran imágenes altamente indicativas en el examen Doppler color, aunado a la identificación de ascitis debido al incremento de la presión portal57.
La fuga biliar, formación de biloma y estenosis anastomótica y no anastomótica son las complicaciones biliares más frecuentes. Otras complicaciones biliares son la coledocolitiasis y el lodo biliar, las cuales están asociadas con denervación durante el procedimiento quirúrgico. El US en escala de grises nos permite identificar dilatación de la vía biliar intra o extrahepática, zonas de estenosis y dilatación, dando la pauta a realizar estudios de extensión, como la colangiorresonancia, para la caracterización completa y selección del tratamiento58,59.
El US en escala de grises y la evaluación con Doppler color en pacientes de trasplante hepático es un método fácil, preciso y rápido de realizar que permite detectar de manera temprana las alteraciones en las estructuras vasculares y de la vía biliar, seleccionar a los pacientes que requieran estudios de extensión para lograr el tratamiento oportuno, con lo cual se mejora la sobrevida evitando el daño y pérdida de los injertos58.
Absceso hepáticoEl absceso hepático es una lesión hepática infecciosa de etiología bacteriana (Escherichia coli, Klebsiella pneumoniae, Staphylococcus aureus o especies de Streptococcus) o amebiana (Entamoeba histolytica). La tríada clásica de síntomas, fiebre, ictericia y sensibilidad en el cuadrante superior derecho, está presente solo en el 7-43% de los casos60. El US es la herramienta diagnóstica de primera línea que alcanza una sensibilidad que varía del 67 al 86%; se ha descrito que POCUS puede ser una herramienta útil en el diagnóstico diferencial de las urgencias abdominales en el servicio de urgencias, incluyendo el absceso hepático, logrando optimizar el manejo clínico60,61. Blomquist et al. describieron un caso clínico de una paciente de 92 años con sepsis en quien la evaluación con POCUS previa a realización de tomografía abdominal facilitó el diagnóstico de absceso hepático y el inicio temprano de antibioticoterapia62.
Guía ecográfica de procedimientos: paracentesisLa ascitis es la acumulación patológica de líquido en la cavidad peritoneal. La cirrosis hepática es la principal etiología de la ascitis (80% de los casos). Esta se presenta hasta en 10% de los pacientes con cirrosis hepática compensada por año37.
La paracentesis abdominal consiste en extraer líquido ascítico insertando una aguja en la cavidad peritoneal, generalmente realizado a lado de la cama del paciente, puede ser diagnóstica o terapéutica y realizarse con técnica de venopunción «a ciegas» o guiada por US63. Existen escasas contraindicaciones absolutas para la realización de una paracentesis como la coagulación intravascular diseminada, con diversas contraindicaciones relativas como: embarazo, prolongación de tiempos de coagulación, trombocitopenia, adherencias, obstrucción intestinal, globo vesical, infección o hematoma en sitio de punción y la poca colaboración del paciente. En general, las complicaciones de la paracentesis son raras, como la persistencia de fuga del líquido ascítico, infección en el sitio de punción o hematoma de pared abdominal, algunas complicaciones más graves son la hemorragia con una incidencia estimada menor al 0.2%, punción de otros órganos o de la arteria epigástrica inferior64.
Los procedimientos diagnósticos y terapéuticos guiados por imagen son el pilar de la práctica clínica contemporánea ya que permiten reducir morbilidad y mejorar la seguridad y efectividad, la disponibilidad de dispositivos portátiles permite el uso de POCUS para guiar procedimientos en el momento de la evaluación clínica por el médico tratante1. La utilización del US permite realizar el diagnóstico de ascitis, identificar el sitio de punción previo al procedimiento y la evaluación en tiempo real de la inserción de la aguja63.
Se ha descrito que la realización de paracentesis guiada por US es más segura y eficaz que la paracentesis a ciegas65. Bard y Lafortune reportaron la presencia de asas intestinales llenas de gas entre la pared abdominal y el líquido en el trayecto esperado de la aguja en 6 de 8 pacientes en los que se había detectado líquido en el sitio habitual de la punción a ciegas (flancos)66. En un análisis retrospectivo de 1,297 paracentesis abdominales, 723 (56%) guiadas por US y 574 (44%) a ciegas, se reportó una menor incidencia de eventos adversos en los procedimientos guiados por US (1.4% vs. 4.5%, p=0.01), incluyendo infección posparacentesis (1.41% vs. 2.44%, p=0.01), hematoma (0.0% vs. 0.87%, p=0.01) y seroma (0.14 vs. 1.05%, p=0.03)67. El reciente estudio realizado por Rodrigues et al. es concordante con estos hallazgos, con necesidad de modificación del sitio de punción por≥ 5cm del sitio anatómico de punción convencional con la utilización de POCUS en hasta 69% de los 45 procedimientos realizados, además de una mayor cantidad de líquido en los sitios determinados por POCUS en comparación con el sitio de punción convencional (5.4±2.8cm vs. 3.0±2.5cm, p <0.005)68, en un estudio retrospectivo se reportó que de 72 casos de ascitis evaluada por POCUS, el 30% no eran subsidiarios de paracentesis al evidenciarse menos de 1cm de líquido en la cavidad peritoneal39. Por último, se ha demostrado que el uso de Power Doppler ahora disponible en la mayoría de los equipos de POCUS puede mejorar la visualización de la vasculatura abdominal y disminuir el riesgo de punción vascular y posible sangrado subsecuente69.
El uso de US para guiar procedimientos requiere que el clínico sea competente para realizar el procedimiento, en general, se requieren de 25 a 50 evaluaciones para asegurar la competencia en la mayoría de los procedimientos diagnósticos ultrasonográficos y de 10 para guiar los procedimientos terapéuticos con US1. Algunas recomendaciones para la realización de paracentesis guiada por POCUS son las siguientes65:
- –
Utilizar una sonda de matiz curvilínea de 3MHz para la evaluación inicial y una lineal de 10 Mhz para confirmar el sitio de punción.
- –
Localizar la bolsa de líquido de mayor tamaño (≥ 3cm).
- –
Identificar estructuras vasculares críticas como la arteria y vena epigástrica inferior (por imagen en modo B o por Doppler color).
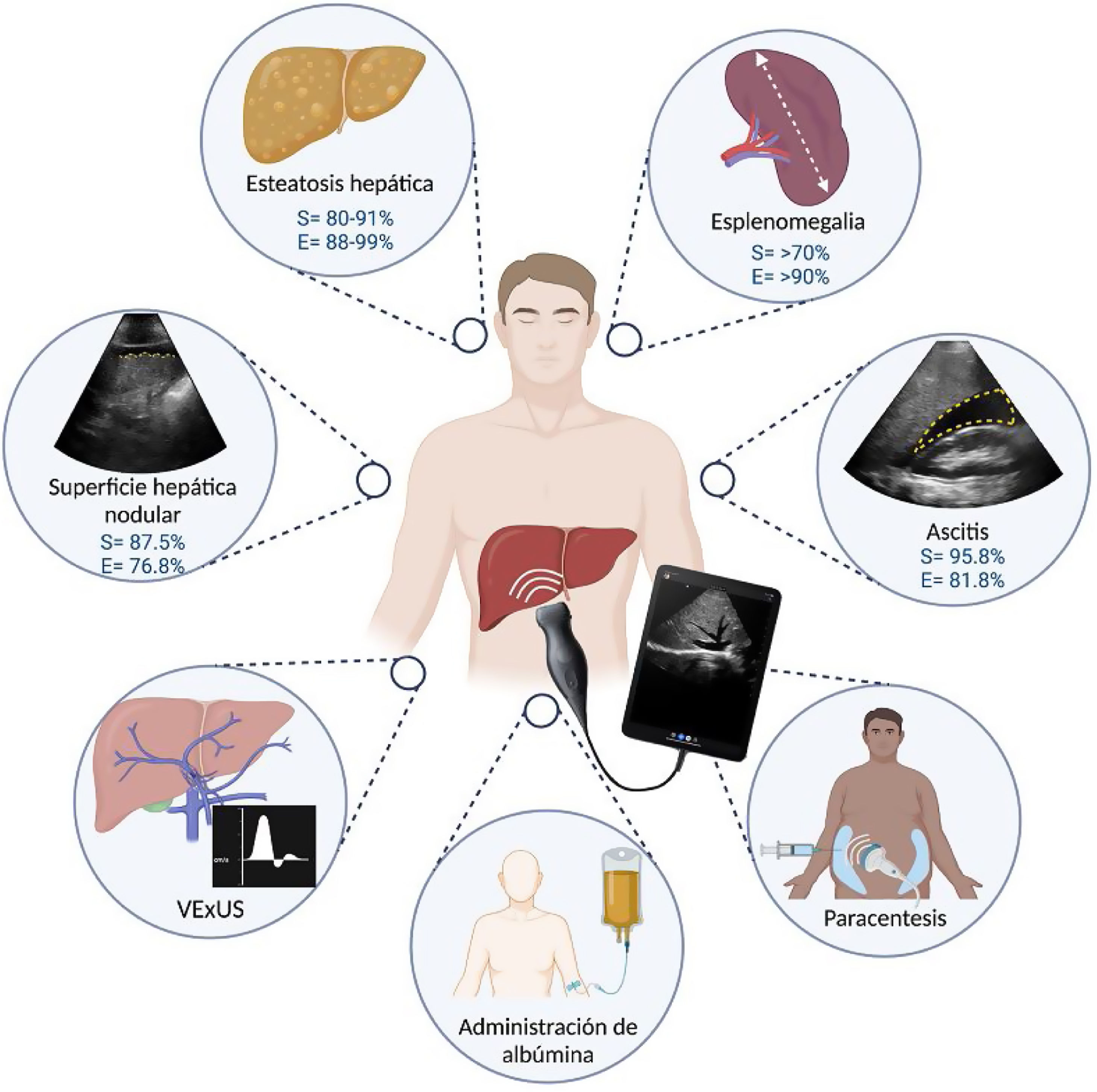
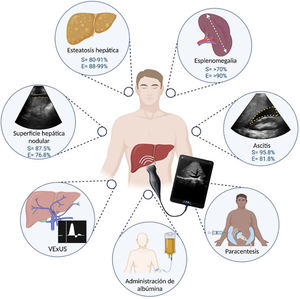
El impacto de POCUS en medicina va de la mano de su existencia y su disponibilidad, sin lograr aún sobrepasar las herramientas diagnósticas definitivas de cada condición médica; permite la toma de decisiones basadas en los criterios habituales: historia, síntomas y signos (hoy clínicos y paraclínicos). Quien demerite el valor del POCUS tendría que demeritar que, ante la evidencia de disnea y sibilancias pulmonares auscultadas con el estetoscopio convencional, se diera tratamiento inmediato en sospecha de agudización de asma. La importancia que tiene en el estándar de cuidado de los pacientes implica ofrecer lo mejor a través de contar con los recursos adecuados. De forma concreta, en las manos adecuadas, la implementación de POCUS ha demostrado su utilidad en el proceso de toma de decisiones, lo que impacta directa o indirectamente en rubros considerados como marcadores en la calidad de la atención, tales como: días de estancia hospitalaria, cambios significativos en el diagnóstico o tratamiento principal y adición de diagnósticos relevantes2,5,6. La pandemia de COVID-19ha demostrado que, en escenarios de toma rápida de decisiones, la disponibilidad de herramientas al pie de cama puede optimizar el proceso diagnóstico70. Además, coincide con alza en el entusiasmo de aprendizaje de POCUS, con los beneficios potenciales a nivel individual y en el sistema de salud, POCUS forma parte de la práctica clínica diaria de diversas especialidades y ha demostrado su utilidad en distintos escenarios clínicos de la hepatología (fig. 4), requiriendo un entrenamiento básico para la evaluación de la superficie hepática, esteatosis, esplenomegalia y procedimientos como la paracentesis diagnóstica y uno más especializado para la evaluación del estado hídrico (VExUS) como el que ofrece la Alianza para la Certificación y Avance de los Médicos11,21,23,32,39. Para adquirir un equipo de US de bolsillo se requiere de una inversión inicial que varía dependiendo de la calidad del equipo. Debido a que es una herramienta relativamente nueva, se requieren de más estudios comparativos que evalúen el desempeño de POCUS en las diferentes enfermedades que abarca la hepatología tales como la evaluación del estado hemodinámico en el paciente con cirrosis hepática críticamente enfermo y la administración de albúmina.
FinanciaciónLos autores declaran que no se recibió ningún tipo de financiamiento para este estudio.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de interés.