El Strongyloides stercoralis (S. stercoralis o Ss) es un nemátodo intestinal con una alta prevalencia en regiones tropicales de África, Asia y Suramérica1. Aproximadamente 50-100 millones de individuos están infectados en el mundo, particularmente en Brasil y Tailandia, con prevalencias entre el 13% y el 23.7%, respectivamente2. La mayoría de infectados permanecen asintomáticos, sin embargo algunos presentan manifestaciones severas, principalmente los inmunocomprometidos3–5.
Presentamos el caso de un varón de 16 años, procedente de Tabatinga, Amazonas (Brasil), quien consultó al hospital de Leticia por 3 semanas de fiebre, dolor abdominal epigástrico irradiado a la fosa ilíaca derecha, hiperémesis, diarrea sanguinolenta y pérdida de peso (20kg). Las pruebas de laboratorio realizadas reflejaron en el hemograma: leucocitosis (20,600mm3), neutrofilia (17,922/μl) y trombocitosis (610,000/μl); virus de inmunodeficiencia humana negativo; coprológico: detección de Ss manejado ambulatoriamente con albendazol, dosis subterapéutica.
Persistió febril, con vómito biliar e incremento del dolor abdominal a la semana del tratamiento. Consultó a urgencias donde documentaron signos de irritación peritoneal; realizaron laparotomía exploratoria con hallazgo de apéndice retrocecal indurada y posteriormente resecada.
No obstante, continuó con fiebre, hiperémesis y ausencia de deposiciones por una semana. Fue remitido al Hospital Internacional de Colombia (HIC) a los 10 días de estancia hospitalaria.
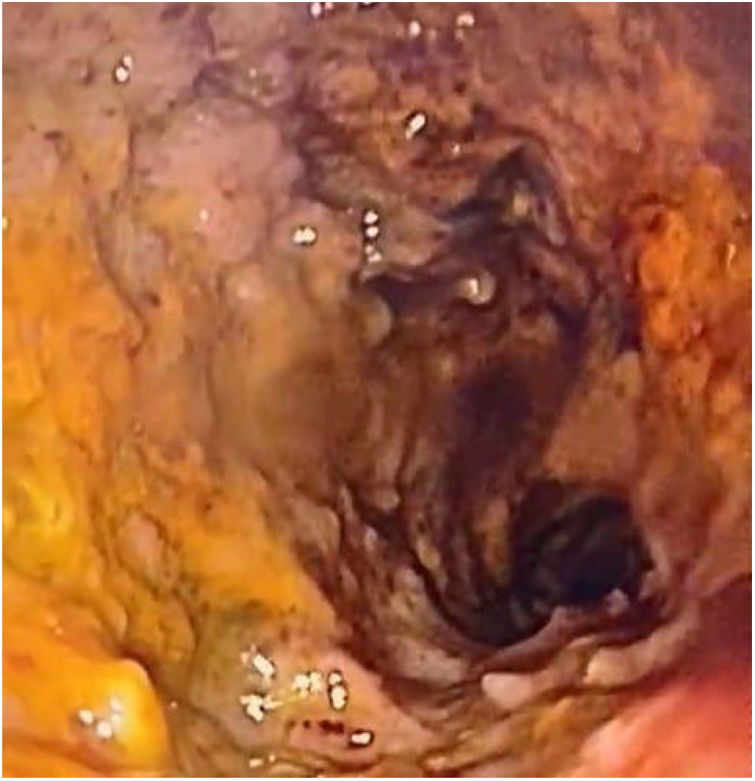
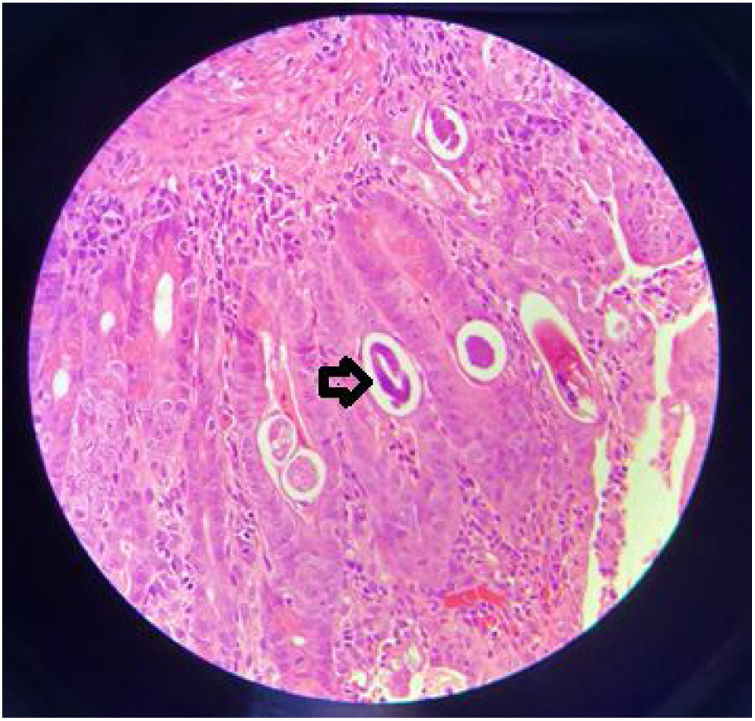
Ingresó en malas condiciones generales, inestable hemodinámicamente, con alto débito bilioentérico por sonda nasogástrica y signos de irritación peritoneal. Antropometría: peso 39kg (P0, –3.10DE), talla: 150cm (P0, –2.9DE), IMC: 17.3kg/m2 (P6, –1.5DE). Requirió soporte vasoactivo (norepinefrina). Se documentó anemia severa (Hb: 7g/dl) y se transfundieron glóbulos rojos. La tomografía de abdomen contrastada evidenció distensión generalizada de asas delgadas y engrosamiento de las paredes del duodeno. La panendoscopia documentó gastroduodenitis erosiva severa, pseudomembranas y múltiples pseudopólipos inflamatorios en el bulbo duodenal (fig. 1). La histología reportó gastroduodenitis severa por Ss (fig. 2). Se indicó manejo con ivermectina 200μ/kg/día, albendazol 800mg/día oral y piperacilina tazobactam 80mg/kg/dosis cada 6horas endovenosa, todos por 14 días. Dentro del tratamiento expulsó larvas durante 13 días. Coproscópico positivo para Ss. Los estudios para hepatitis B, hepatitis C, citomegalovirus y virus de Epstein-Barr fueron negativos. Virus linfotrópico humano de células T de tipo 1 (VLHT-1): 173.210 S/CO (normal<1 S/CO). Valoración oftalmológica sin compromiso ocular. Ecocardiograma con disfunción leve del ventrículo izquierdo y discinesia basal del septum. Hemocultivos de ingreso y control a las 2 semanas negativos.
El paciente presentó mejoría de los signos de íleo a los 10 días, tolerancia completa a la vía oral a los 14 días y coproscópicos negativos a las 2 semanas del tratamiento, con recuperación nutricional alcanzando los 44kg, logrando el egreso hospitalario a los 2 meses.
El Ss tiene un ciclo de vida complejo, con capacidad de existir y replicarse en el huésped durante décadas, debido a que las larvas maduran dentro del tracto gastrointestinal, invadiendo la piel perianal completando el ciclo de autoinfección6.
Existen 4 presentaciones clínicas: a) estrongiloidiasis aguda: comienza con erupción en el sitio de penetración de las larvas, tos, sibilancias, febrícula, malestar epigástrico, diarrea, náuseas o vómitos7; b) estrongiloidiasis crónica: suele ser asintomática, pero puede causar dolor abdominal, náuseas, vómitos, diarrea, síndrome malabsortivo, íleo paralítico, urticaria o larva currens (pápulas eritematosas serpentiginosas que progresan rápidamente) en el área perianal y en los muslos8; c) hiperinfección: ocurre cuando una gran carga de parásitos está presente, observándose predominantemente en zonas endémicas. Se limita al tracto gastrointestinal y los pulmones (ciclo de autoinfección acelerada). Su principal manifestación es diarrea generalmente de alto gasto, ocasionalmente disentérica, y se asocia a dolor abdominal y vómito. En fases avanzadas hay íleo paralítico, malabsorción, hipoalbuminemia, edema, pérdida de peso y/o hemorragia alveolar masiva7,8; y d) diseminada: evidencia de migración larvaria a sitios fuera del ciclo de replicación parasitaria, encontrando larvas en el sistema nervioso central, hígado, riñón y otros órganos4–6.
El principal factor de riesgo para una hiperinfección o diseminación es la inmunosupresión celular, generalmente secundaria (por ejemplo: uso de esteroides). Nuestro paciente presentó un cuadro de obstrucción intestinal secundario a una gastroduodenitis severa por un síndrome de hiperinfección. A pesar de que no había recibido esteroides tenía varios factores de riesgo como la procedencia, desnutrición e infección por HTLV-1 (virus que disminuye los linfocitos Th2, eosinófilos, mastocitos y varias interleucinas mediadoras de la respuesta inmune a parásitos)8.
El tratamiento debe ser agresivo, ya que sin este la mortalidad alcanza el 100%. El medicamento de elección es la ivermectina a dosis de 200mcg/kg/día9. Aunque no se ha definido la duración definitiva del tratamiento están indicados cursos prolongados de una a 2 semanas en pacientes inmunocomprometidos para evitar recaídas9. Como segunda línea de manejo se utiliza tiabendazol o albendazol10. Se ha sugerido la combinación de ivermectina y tiabendazol hasta obtener la ausencia de parásitos en los coproscópicos o mejoría del íleo10. Además, se recomienda adicionar antibióticos para cubrir gram negativos y anaerobios, que causan sepsis por traslocación bacteriana. Debido a la severidad del cuadro clínico de nuestro paciente combinamos ivermectina, albendazol y piperacilina tazobactam. No consideramos tiabendazol por su pobre perfil de seguridad. El tratamiento se prolongó durante 14 días ya que, a pesar de que mostró signos de tránsito intestinal desde el décimo día, persistió con salida de larvas hasta el día 13 de tratamiento.
En conclusión, el diagnóstico precoz de la hiperinfección por Ss precisa un alto índice de sospecha clínica, y debe incluirse en el diagnóstico diferencial de pacientes con obstrucción intestinal procedentes de áreas endémicas y/o inmunosuprimidos.
Responsabilidades éticasSe solicitó el consentimiento informado por escrito a la madre del paciente para la publicación de sus datos e imágenes. Manifestamos que este artículo no contiene información personal que permita identificar al paciente.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
AutoríaTodos los autores contribuyeron a la concepción y el diseño del trabajo, la adquisición de datos, la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses más allá del interés académico.