La hepatitis C crónica es de las principales causas de cirrosis hepática. El tratamiento con antivirales de acción directa (AAD) mejora la supervivencia. Existe controversia si los AAD generan un incremento del riesgo para desarrollar carcinoma hepatocelular (CHC). El objetivo del trabajo es determinar los factores de riesgo para desarrollar CHC en pacientes con hepatitis C crónica tratados con AAD.
Material y métodosEstudio de cohorte realizado de junio de 2017 a junio de 2018, incluyó a pacientes >18 años con hepatitis C crónica, genotipo 1 y 4, tratados con AAD, con un año de seguimiento para evaluar la presencia de CHC.
ResultadosAnalizamos 108 pacientes, 71 mujeres (65%), edad media de 56.24 años (±10.6), el genotipo más frecuente 1b (63%), el 49% recibió tratamiento con (ombitasvir, paritaprevir, ritonavir, dasabuvir). Treinta y cuatro pacientes (31%) tenían obesidad. El 53% tenía cirrosis (58) y el 82% en Child-Pugh A (89). La respuesta viral sostenida a las 12 semanas fue del 100%. Ocho pacientes (7%) desarrollaron CHC y el genotipo más asociado fue 1b (87%). La presencia de nódulos de regeneración >10mm (p<0.05), várices esofágicas (p<0.05), cirrosis hepática (p<0.05), Child-Pugh B y C (p<0.05) y alfafetoproteína >20UI/ml (p 0.20) un año postratamiento, se asociaron al desarrollo de CHC.
ConclusionesLos factores de riesgo para desarrollar CHC fue la presencia de cirrosis hepática, clase funcional Child-Pugh B, varices esofágicas y/o gástricas y genotipo 1b.
Chronic hepatitis C is one of the main causes of cirrhosis of the liver. Treatment with direct-acting antivirals (DAAs) improves survival. There is controversy as to whether AADs create an increased risk for the development of hepatocellular carcinoma (HCC). The aim of the present study was to determine the risk factors for developing HCC in patients with chronic hepatitis C treated with DAAs.
Materials and methodsA cohort study was conducted, within the time frame of June 2017 and June 2018, on patients >18 years of age, with chronic hepatitis C, genotypes 1 and 4, with one year of follow-up, to evaluate the presence of HCC.
ResultsWe analyzed 108 patients, 71 (65%) of whom were women. Mean patient age was 56.24 years (±10.6), 1b was the most frequent genotype (63%), and 49% of the patients received treatment with DAAs (ombitasvir/paritaprevir/ritonavir plus dasabuvir). Thirty-four (31%) patients were obese. Fifty-three percent (58) had cirrhosis and 82% (89) had Child-Pugh class A liver function. Sustained virologic response at 12 weeks was 100%. Eight (7%) patients developed HCC and 1b was the most frequently associated genotype (87%). The presence of regenerative nodules >10mm (P<.05), esophageal varices (P<.05), cirrhosis of the liver (P<.05), Child-Pugh B-C (P<.05), and alpha-fetoprotein >20IU/ml (P=0.20) one year after treatment were associated with the development of HCC.
ConclusionsThe risk factors for developing HCC were the presence of cirrhosis of the liver, Child-Pugh class B liver function, esophageal and/or gastric varices, and genotype 1b.
La hepatitis C es la principal causa de trasplante en Estados Unidos (EE. UU.) y a nivel mundial, en México tiene una prevalencia del 0.3-0.5% y representa una de las principales causas de cirrosis hepática junto con el consumo de alcohol1.
Teniendo en cuenta que la progresión a cirrosis es parte de la historia natural de la enfermedad en la hepatitis C crónica no tratada, el tratamiento oportuno ha logrado impactar en el pronóstico de este grupo de pacientes2.
El tratamiento ha tenido una evolución importante con la llegada de los antivirales de acción directa (AAD) reportando respuesta viral sostenida (RVS) mayor al 95%; las metas del tratamiento son evitar complicaciones de la cirrosis incluyendo carcinoma hepatocelular (CHC) el cual se considera el sexto cáncer más frecuente a nivel mundial y la tercera causa de muerte relacionada con el cáncer3,4.
A pesar de la alta eficacia de los AAD para erradicar la infección por el virus de la hepatitis C, el impacto en el desarrollo del CHC ha sido controversial, y algunas revisiones identificaron un incremento con el uso de estos medicamentos, documentando una incidencia de CHC del 7.4% en el primer año posterior a alcanzar RVS5,6, a pesar de que en la literatura los resultados son contradictorios7.
El tratamiento es novedoso y el tiempo de seguimiento en los pacientes tratados con estos medicamentos es por corto tiempo, por lo que se debe definir si hay incremento en el desarrollo de CHC.
El objetivo del presente estudio fue determinar los factores de riesgo para el desarrollo de CHC en pacientes con hepatitis C crónica tratados con AAD.
Material y métodosEstudio de cohorte, realizado en el Hospital de Especialidades Centro Médico Nacional Siglo XXI-IMSS, de junio de 2017 a junio de 2018. Se incluyeron pacientes >18 años, con diagnóstico de hepatitis C en fase de hepatitis crónica o cirrosis hepática; dicho diagnóstico basado en índices clínicos confiables (presencia de várices esofágicas y/o gástricas y FibroScan®>12.5kPa). Genotipo 1 y 4, tratados con AAD (ombitasvir, paritaprevir, ritonavir, dasabuvir o ledipasvir, sofosbuvir con o sin ribavirina), con un año de seguimiento para evaluar la presencia de CHC. Todos los pacientes; con o sin cirrosis se sometieron a realizar estudio de imagen (ultrasonido abdominal) y alfafetoproteína al menos 6 meses previo al inicio de tratamiento, con nueva determinación de los mismos de acuerdo a la presencia de cirrosis hepática (cada 6 meses). En pacientes con nódulos de regeneración en el ultrasonido basal se les realizó tomografía de abdomen trifásica para descartar CHC y se eliminaron estos pacientes con nódulos sospechosos de CHC ya que estos pacientes estuvieron en un seguimiento más estrecho de acuerdo a guías de práctica clínica.
Se excluyeron a pacientes con expediente clínico incompleto, que no firmaran carta de consentimiento informado, pacientes que fallecieron, con pérdida de seguimiento a un año y con diagnóstico previo de CHC o con nódulos sospechosos de CHC.
Se registraron los datos basales, al término del tratamiento, al tener RVS12 y un año después de haber concluido el tratamiento, se les realizó ultrasonido semestral al concluir tratamiento a todos los pacientes.
Análisis estadísticoLas características demográficas se describen en medias (± desviación estándar [DE]), medianas (rangos intercuartílicos [RI]) y porcentajes y la comparación de ambos grupos con la t de Student y la U de Mann-Whitney, de acuerdo a distribución de las variables. Las variables dicotómicas se analizaron con prueba de Chi-cuadrado y prueba exacta de Fisher. Para definir los factores de riesgo para CHC se realizó regresión logística. El análisis se realizó utilizando el paquete SPSS® versión 24.0.
El tamaño de la muestra se calculó con la fórmula para dos proporciones con sensibilidad del 95% y potencia del 80%, delta: 0.07, Z α: 1.96, prevalencia del 0.4%, prevalencia en los no expuestos: 10% y prevalencia en los expuestos: 20%.
Consideraciones éticasDe acuerdo a lo que se establece en La Ley General de Salud en materia de investigación para la salud en México, con bases legales y éticas vigentes, preservando el respeto a los participantes, se realizó la investigación, previamente autorizado por el Comité Local de Ética e Investigación de la institución (R-2020-3601-012).
Bajo los requisitos solicitados por el área de dirección y la normativa internacional de ética médica, define los principios que deben guiar cualquier investigación con seres humanos, complementándose entre sí, como el código de Núremberg que se centra principalmente en los derechos del paciente como parte de la investigación, y la Declaración de Helsinki, que pone especial énfasis en las obligaciones del investigador.
Se brindó prioridad al mantenimiento de la privacidad, al evitar manejar datos personales sobre los participantes; confidencialidad en lo referente a lo que nos permiten hacer y no hacer con sus datos; y anonimato al no otorgarse información alguna que permita la identificación de los participantes, lo cual queda asentado en su consentimiento. Se usó un código de números y el almacenamiento de todos los formularios y datos, particularmente la información con identificadores individuales resguardado por el investigador principal y de conocimiento al personal del Instituto Mexicano del Seguro Social, con un respaldo electrónico.
La carta de consentimiento informado se dio por escrito donde se incluyó la firma del participante y se detalla lo siguiente: 1) el propósito del protocolo de investigación; 2) significado de cada participación en el estudio; 3) mantenimiento de su confidencialidad; 4) el derecho a rehusar su participación sin perjudicar su relación con la institución o individuos afiliados a la investigación, y 5) derecho a interrumpir su participación en cualquier momento. De haber comprendido la información y aclarado todas las dudas, se solicitó su autorización para colaborar con el estudio. En el presente estudio no se incluyeron a pacientes menores de 18 años.
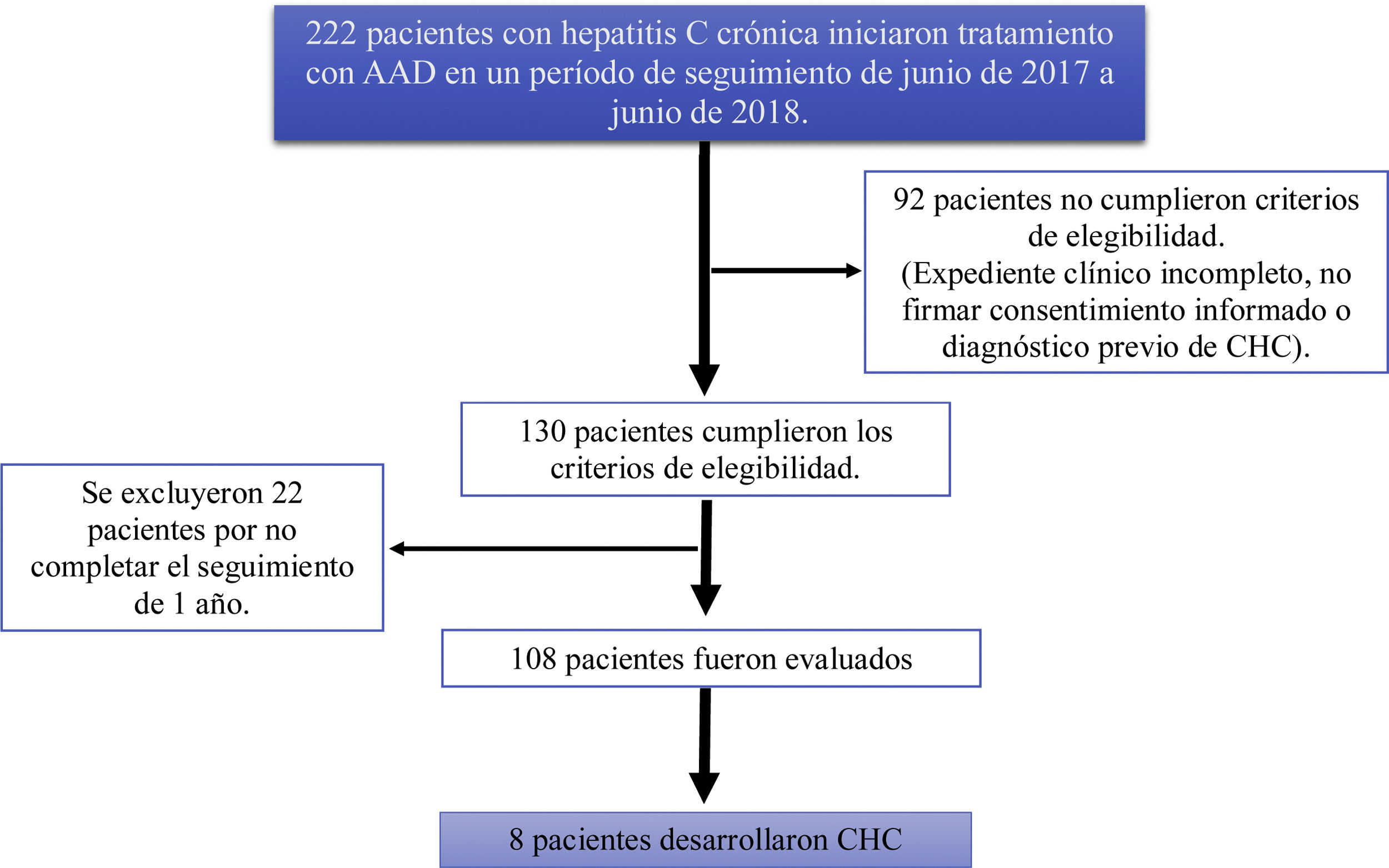
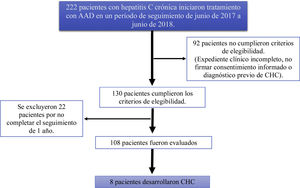
ResultadosSe estudiaron 222 pacientes con infección crónica por virus de hepatitis C que iniciaron tratamiento con AAD en un período de junio de 2017 a junio de 2018, 92 pacientes no cumplieron los criterios de elegibilidad (expediente clínico incompleto, no firmaron la carta de consentimiento informado o presentaban diagnóstico previo de CHC). Ciento treinta pacientes cumplieron criterios de elegibilidad y 22 fueron excluidos por no completar el seguimiento a un año, finalmente se analizaron 108 pacientes (fig. 1).
Las variables estudiadas se agruparon en clínico-demográficas y bioquímicas, analizando de igual forma aspectos terapéuticos.
En la (tabla 1) se muestran las características basales de los pacientes con infección crónica por virus de hepatitis C que fueron tratados con AAD. Se encontró que la media de edad fue de 56.24 años (±10.6), siendo la mayoría de los pacientes del sexo femenino (65.7%). En cuanto al genotipo, el más frecuente fue el 1b 69 (63.9%), contando con una mediana de carga viral de 435428.50UI/ml (RI: 136241.2-1095906.7UI/ml). La comorbilidad más frecuente fue obesidad en 34 pacientes (31.5%), seguida de diabetes mellitus 6 (5.6%). El diagnóstico de cirrosis estaba presente en 58 pacientes lo que representa el 53.7%, los nódulos de regeneración <10mm estaban presentes en el 7.4% (no documentado previa al inicio del estudio), y el 34.0% cursaban con várices esofágicas pequeñas. Predominó la clase funcional Child-Pugh A, 48 pacientes (82.8%), la mediana de MELD registrada fue de 8 (RI 7-11).
Características de los pacientes con infección crónica por VHC tratados con antivirales de acción directa
| Variables | N=108 |
|---|---|
| Edad (años) | 56.24 (±10.6)a |
| Sexo (%) | |
| Masculino | 37 (34.3) |
| Femenino | 71 (65.7) |
| Genotipo (%) | |
| 1a | 39 (36.1) |
| 1b | 69 (63.9) |
| Etilismo (%) | 2 (1.9) |
| Comorbilidad (%) | |
| Diabetes mellitus (%) | 6 (5.6) |
| Obesidad (%) | 34 (31.5) |
| Dislipidemia(%) | 5 (4.6) |
| Coinfectado (hepatitis B crónica) | 1 (0.9) |
| Cirrosis (%) | 58 (53.7) |
| Nódulos de regeneración (%) | |
| Ausentes | 93 (86.1) |
| <10mm | 8 (7.4) |
| >10mm | 7 (6.5) |
| Varices esofágicas (%) n=97 | |
| Ausentes | 55 (56.7) |
| Pequeñas (<5mm) | 33 (34.0) |
| Grandes (>5mm) | 9 (9.3) |
| Child-Pugh N.° (%) n=58 | |
| A | 48 (82.8) |
| B | 9 (15.5) |
| C | 1 (21.7) |
| MELD | 8.00 (7.0-11.0)b |
| AST (U/l) | 49.50 (30.0-79.7)b |
| ALT (U/l) | 49.50 (31.2-71.0)b |
| Albúmina (g/dl) | 4.25 (3.7-4.5)b |
| Plaquetas (células/mm3) | 139000.00 (87000.0-203750.0)b |
| INR | 1.10 (1.0-1.2)b |
| Alfafetoproteína basal (UI/ml) | 6.90 (3.9-13.9)b |
| Carga viral basal (UI/ml) | 435428.50 (136241.2-1095906.7)b |
AFP: alfafetoproteína; ALT: alanino aminotransferasa; AST: aspartato aminotransferasa; INR: International Normalized Ratio; MELD: Model for End-stage Liver Disease; VHC: virus de la hepatitis C.
Con respecto a las características bioquímicas, la mediana de la AST y ALT en ambos casos fue de 49.50U/l (RI: 30.0-79.7 y 31.2-71.0, respectivamente); la mediana de albúmina fue de 4.25g/dl (RI: 3.7-4.5). La mediana de plaquetas fue de 139,000 células/mm3 (RI: 87000.0-203750.0) y de INR: 1.1 (RI: 1.0-1.2). Los valores de alfafetoproteína presentaron una mediana de 6.90UI/ml (RI: 3.9-13.9).
Los esquemas terapéuticos de los AAD que recibieron los pacientes con hepatitis C crónica fueron: ombitasvir, paritaprevir, ritonavir y dasabuvir el cual recibieron 53 pacientes que representa (49.1%), sofosbuvir-ledipasvir 34 pacientes (31.5%) y ledipasvir-sofosbuvir-ribavirina 21 pacientes (9.4%), para el último grupo se documentó un OR: 4; IC 95%: 0.66-18.19 y una p de 0.63.
Para el análisis bivariado utilizamos la prueba exacta de Fisher documentando lo siguiente: el 100% de los pacientes con CHC tenían diagnóstico de cirrosis hepática. Del grupo de pacientes con cirrosis hepática 7 presentaban nódulos de regeneración >10mm (no documentados previo al inicio de tratamiento) con una p<0.05. Se analizaron las variables clínico-demográficas, bioquímicas y su asociación con la presencia de CHC (tabla 2). Se encontró que el mayor riesgo de desarrollar CHC lo tuvieron los pacientes con nódulos de regeneración >10mm OR: 101, IC 95%: 14.3-710.0; p<0.05, seguido de aquellos con várices esofágicas OR: 10, IC 95%: 1.27-91.61; p<0.05, y los pacientes con cirrosis que se encuentran en clase funcional Child-Pugh B y C OR: 7.3, IC 95%: 1.44-37.32; p<0.05. Se categorizó la variable carga viral, tomando como punto de corte el límite inferior del tercer cuartil OR: 0.40, IC 95%: 0.48-3.46; p 0.35.
Análisis bivariado de los pacientes que desarrollaron carcinoma hepatocelular
| Variables | Hepatocarcinoman=8 | Sin hepatocarcinoma | OR | IC 95% | Valor de p |
|---|---|---|---|---|---|
| Edad ≥65 años (n=24) | 4 (16.7%) | 20 (83.3%) | 4 | 0.92-17.39 | 0.71 |
| Sexo | |||||
| Masculino (n=37) | 2 (5.4%) | 35 (94.6%) | 0.61 | 0.11-3.23 | 0.44 |
| Femenino (n=71) | 6 (8.5%) | 65 (91.5%) | |||
| Genotipo | |||||
| 1a (n=39) | 1 (2.6%) | 38 (97.4%) | 0.23 | 0.28-1.96 | 0.14 |
| 1b (n=69) | 7 (10.1%) | 62 (89.9%) | |||
| Diabetes mellitus (n=6) | 1 (16.7%) | 5 (83.3%) | 2.7 | 0.278-26.54 | 0.37 |
| Obesidad (n=34) | 1 (2.9%) | 33 (97.1%) | 0.29 | 0.034-2.45 | 0.21 |
| Dislipidemia (n=5) | 0 | 5 (100%) | 0.67 | ||
| Cirrosis (n=58) | 8 (13.8%) | 50 (86.2%) | 0.86 | 0.778-0.956 | <0.05 |
| Nódulos de regeneración >10mm (n=7) | 7 (100%) | 0 | 101 | 14.3-710.0 | <0.05 |
| Varices esofágicas (n=42) | 7 (16.7%) | 35 (83.3%) | 10 | 1.27-91.61 | <0.05 |
| Child-Pugh | |||||
| B y C (n=10) | 4 (40%) | 6 (60%) | 7.3 | 1.44-37.32 | <0.05 |
| MELD>9 (n=22) | 4 (18.2%) | 43 (18 81.8%) | 1.77 | 0.39-7.97 | 0.35 |
| AST>120U/l (n=9) | 1 (11.1%) | 8 (88.9%) | 1.64 | 0.179-15.07 | 0.51 |
| ALT>120U/l (n=14) | 1 (7.1%) | 13 (92.9%) | 0.95 | 0.109-8.4 | 0.72 |
| Albúmina <3.5g/dl (n=34) | 2 (15.4%) | 11 (84.6%) | 2.69 | 0.484-15.03 | 0.24 |
| Plaquetas <100000 células/mm3 (n=34) | 5 (14.7%) | 29 (85.3%) | 4 | 0.91-18.19 | 0.63 |
| AFP>20UI/ml (n=22) | 3 (13.6%) | 19 (86.4%) | 2.5 | 0.56-11.64 | 0.20 |
| Carga viral<1095906.0UI/ml (n=81) | 7 (8.6%) | 74 (91.4%) | 0.40 | 0.48-3.46 | 0.358 |
| Tipo de tratamiento | |||||
| Ombitasvir-dasabuvir. Paritaprevir y ritonavir (n=53) | 2 (38%) | 51 (96.2%) | 0.32 | 0.62-1.66 | 0.14 |
| Sofosbuvir-ledipasvir (n=21) | 1 (4.8%) | 20 (95.2%) | 0.57 | 0.66-4.9 | 0.51 |
| Sofosbuvir-ledipasvir-ribavirina (n=34) | 5 (14.7%) | 29 (85.3%) | 4 | 0.66-18.19 | 0.63 |
Se utilizó la prueba exacta de Fisher.
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; MELD: Model for End-stage Liver Disease.
Se excluyó de análisis multivariado los nódulos de regeneración por ser una variable inestable al hacer el análisis. Sin embargo, el OR fue de riesgo y la p fue significativa.
De los 108 pacientes analizados, 8 pacientes (7.4%) desarrollaron CHC en los primeros 3 meses de haber concluido el tratamiento.
En el análisis multivariado de regresión logística se incluyeron aquellas variables con significación estadística, se observó que ninguna variable analizada fue independiente como factor de riesgo para desarrollar CHC y el modelo propuesto tiene un R cuadrado de 0.23 lo cual explica el 23% de los casos de CHC (tabla 3).
Modelo de regresión logística para las variables asociadas a carcinoma hepatocelular
| Variables | Análisis multivariado | |||
|---|---|---|---|---|
| OR | IC 95% | Coeficiente B | Valor de p | |
| Edad ≥65 años | 1.44 | 0.840-21.61 | 4.2 | 0.08 |
| AFP>20UI/ml | 0.69 | 0.356-11.33 | 2 | 0.43 |
| Albúmina <3.5g/dl | 0.19 | 0.18-8.22 | 1.21 | 0.84 |
| Varices esofágicas y/o gástricas | −2.2 | 0.11-1.00 | 0.10 | 0.51 |
AFP: alfafetoproteína; IC 95%: intervalo de confianza del 95%; OR: odds ratio.
La infección crónica por virus de hepatitis C es hoy en día; un problema de salud pública a nivel mundial, con un alto impacto en la morbimortalidad, por lo que es prioritario implementar estrategias dirigidas a la promoción en salud y prevención de complicaciones. La llegada del tratamiento a base de AAD, ha logrado modificar la historia natural de la enfermedad y el pronóstico en pacientes con cirrosis hepática, incluyendo la supervivencia global8, ya que son esquemas de tratamiento seguros, con adecuada tolerabilidad y mínimos efectos adversos. Existen pocos diseños de ensayos controlados que permitan evaluar el impacto clínico a largo plazo en todas las etapas de la enfermedad hepática.
La relación de este tratamiento con CHC se ha analizado en diferentes poblaciones, al momento solo se ha visto una asociación en pacientes con tratamiento previo pero no en pacientes con tratamiento de novo9. A partir del año 2016 diversas publicaciones lanzaron un llamado de advertencia por aparición temprana de CHC en pacientes tratados con AAD que lograron RVS10,11. Una de las hipótesis más aceptadas de la relación de CHC y AAD es la distorsión inmune asociada con la rápida disminución de la carga viral posterior al inicio del tratamiento12.
Estos informes iniciaron una revolución en la investigación de este suceso, abriendo la incertidumbre sobre el riesgo incrementado de CHC en pacientes cirróticos tratados con AAD y si los efectos de los nuevos fármacos antivirales influyen en la mortalidad, trayendo consigo revisiones con discrepancia en los resultados, es por ello que a partir de esto se enfatizó la importancia de realizar estudios multicéntricos7,13.
Hasta la fecha 2 estudios recientes multicéntricos llevados a cabo por Kanwal et al. e Innes et al., no demostraron una asociación de CHC en pacientes tratados con AAD14,15.
Fue el estudio CirVir donde se explicaron diversos factores de confusión y se identificaron ciertas características como la edad o etapa avanzada de la cirrosis como factores independientes que aumentan el riesgo de desarrollar CHC16.
Muchas de las limitaciones de los estudios publicados hasta el día de hoy es que presentan sesgos de selección, población de estudio en etapa avanzada de cirrosis, evaluación subóptima previa al inicio de tratamiento y ausencia de detalles con respecto a la aplicación de programas de vigilancia de CHC en estas poblaciones y con esto la omisión del diagnóstico. En el caso de la población que estudiamos se incluyeron pacientes con y sin cirrosis hepática; en el grupo de pacientes cirróticos el diagnóstico se hizo con la presencia de várices esofágicas y/o gástricas o mediante elastografía de transición con un punto de corte >12.5kPa de acuerdo a las recomendaciones de la Asociación Americana de Gastroenterología; los pacientes con cirrosis representaron el (53.7%) de nuestra población. La edad media de estudio fue mayor; 56.24 años (±10.6), respecto a cohortes previas. A diferencia de otros estudios, donde una gran parte de la población presenta comorbilidades, en nuestra cohorte la comorbilidad más frecuente fue la obesidad (31.5%).
El objetivo de este proyecto fue analizar los factores que influyen en la presencia de CHC en pacientes que recibieron tratamiento con AAD, con un tiempo de seguimiento a 12 meses, el 100% de los pacientes contaba con ultrasonido abdominal o tomografía de abdomen en caso de documentar nódulos de regeneración, además determinación de alfafetoproteína previo al inicio de tratamiento con AAD, estos elementos se consideran adecuados para descartar la presencia de CHC previo a recibir tratamiento.
Del total de nuestra población, en el 86.1% no se documentaron nódulos de regeneración durante los 12 meses de seguimiento posterior al término de tratamiento. De los 8 pacientes que desarrollaron CHC (7.4%), 7 de ellos se detectaron en forma temprana (dentro de los 3 meses de haber concluido AAD), una mayor incidencia a lo publicado en guías internacionales12.
Teniendo como característica que estos nódulos fueron únicos, entre 10 y 35mm el de mayor tamaño documentados por ultrasonografía abdominal, que finalmente fue corroborado el diagnóstico CHC con tomografía abdominal trifásica.
La asociación de tiempo entre el inicio de AAD y el desarrollo de CHC, junto con la asociación con la presencia de nódulos no caracterizados en la ecografía basal, sugiere que la terapia antiviral provoca un mecanismo (probablemente relacionado con el sistema inmunológico) que prepara el crecimiento y el reconocimiento clínico del CHC en las primeras etapas del seguimiento17.
El genotipo más común fue el 1b, concordante en lo estipulado respecto a la epidemiología de nuestro país18. La RVS a las 12 semanas fue del 100%, mayor a la reportada en la literatura4.
La cirrosis hepática en clase funcional Child-Pugh B o C sigue siendo la variante más importante para el desarrollo de CHC como lo han reportado Calvaruso et al. y Kanwal et al. en sus trabajos7,14. Otro factor identificado fue la presencia de várices esofágicas y/o gástricas.
Dentro de los marcadores tumorales, el que presenta mayor rentabilidad por «costo-beneficio» es la alfafetoproteína, un marcador oncofetal, que de acuerdo a las guías EASL de CHC12 presenta una sensibilidad >60% y una especificidad >80% dependiente el punto de corte utilizado. Si bien su utilidad en CHC es discutible, en nuestra población estudiada identificamos que previo al inicio del tratamiento se encontró en rangos normales, sin embargo al año de seguimiento; solo 3 de los 8 pacientes que desarrollaron CHC presentaron elevación de este marcador, por lo que de acuerdo a lo propuesto en las guías internacionales tomamos en cuenta un punto de corte de AFP>20UI/ml a un año de seguimiento postratamiento, un punto de corte más elevado a lo propuesto por Ogawa et al. ≥9.0ng/ml19.
Estos datos indican que en la población heterogénea de pacientes cirróticos que logran una RVS después de la terapia con AAD, el riesgo de desarrollar CHC debe evaluarse en relación con la etapa de la enfermedad20. Sin embargo, el tratamiento debe garantizarse a todos los pacientes con cirrosis, en cualquier etapa funcional, considerando el riesgo residual e inevitable de CHC después de la erradicación viral.
La principal fortaleza de esta cohorte es que, en nuestro país, es el primer estudio en evaluar la asociación del CHC y uso de AAD y que la evaluación de los pacientes fue integral con ultrasonido abdominal y laboratorios previo al inicio del tratamiento antiviral, con un seguimiento a 12 meses en todos los pacientes posterior al término de tratamiento.
Una debilidad del trabajo es que la población de estudio fue pequeña a diferencia de otras cohortes, además no se comparó con un grupo de pacientes con cirrosis por otras etiologías o pacientes que no hubieran recibido tratamiento.
A pesar de que nuestros resultados estadísticamente no son factores independientes para desarrollar CHC, el riesgo para esta neoplasia después de la respuesta virológica está latente, sabemos que ninguna de las técnicas bioquímicas y de imagen estándar puede ofrecer una sensibilidad del 100% en la detección de CHC15, es por ello la importancia de tener una adherencia al tamizaje14.
Finalmente, concluimos que los factores de riesgo para desarrollar CHC en este grupo de pacientes es cirrosis hepática, clase funcional Child-Pugh B, varices esofágicas y/o gástricas y genotipo 1b.
El diagnóstico de CHC en pacientes tratados con AAD se presentó de manera temprana en nuestra cohorte; en los primeros 3 meses posterior a concluir tratamiento, derivado de esto proponemos que en los pacientes con cirrosis hepática se realice vigilancia trimestral con ultrasonido abdominal y determinación de alfafetoproteína en pacientes con factores de riesgo mencionados durante el tratamiento y en el primer año de haber concluido el mismo, para permitir identificar CHC en etapas tempranas, aunque claro está que se necesitan más estudios para respaldar la propuesta de nuestro grupo acerca del tamizaje para CHC cada 3 meses e incluirlo en guías de práctica clínica.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.