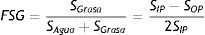La presencia de fibrosis hepática es el denominador común de numerosas enfermedades crónicas del hígado que pueden evolucionar a fibrosis y a hepatocarcinoma. Las más importantes por su frecuencia son las hepatitis virales y el hígado graso no alcohólico, cuya prevalencia aumenta en proporciones epidémicas. La biopsia hepática, aun cuando imperfecta, continúa siendo el estándar de oro que tiende a ser reemplazado en muchas situaciones clínicas por métodos de imagen no invasivos.
ObjetivosDescribir la experiencia obtenida en nuestro departamento de imagen con la técnica de elastografía por resonancia magnética, analizar y comentar los resultados publicados por otros autores en la literatura reciente en gastroenterología, hepatología y radiología, complementada con una búsqueda en PubMed de los últimos 10 años.
Resultados y conclusionesLa elastografía por resonancia magnética es un método no invasivo y eficaz, cuyos resultados tienen concordancia con la biopsia hepática, presenta superioridad sobre los métodos de elastografía por ultrasonido debido a que evalúa un volumen mucho mayor de tejido hepático y muestra la distribución de las lesiones que, a menudo, es heterogénea. La mayor ventaja del protocolo de resonancia magnética descrito estriba en cuantificar en la misma sesión, además de la fibrosis, el contenido de grasa y de hierro, lo cual se realiza en una exploración dirigida específicamente a este fin, en un tiempo de 25 min y a un costo-beneficio favorable para el paciente y la institución.
The presence of liver fibrosis is the common denominator in numerous chronic liver diseases that can progress to fibrosis and hepatocellular carcinoma. Most important, with respect to frequency, are viral hepatitis and non-alcoholic fatty liver disease, the prevalence of which is increasing in epidemic proportions. Liver biopsy, albeit imperfect, continues to be the criterion standard, but in many clinical situations tends to be replaced with noninvasive imaging methods.
ObjectivesThe aim of the present article was to describe our imaging department experience with magnetic resonance elastography and to analyze and discuss recently published results in gastroenterology, hepatology, and radiology from other authors in the literature, complemented with a PubMed search covering the last 10 years.
Results and conclusionsMagnetic resonance elastography is an efficacious, noninvasive method with results that are concordant with liver biopsy. It is superior to ultrasound elastography because it evaluates a much greater volume of hepatic tissue and shows the often heterogeneous lesion distribution. The greatest advantage of the magnetic resonance protocol described is the fact that it quantifies fibrosis, fat content, and iron content in the same 25min examination specifically directed for that purpose, resulting in a favorable cost-benefit ratio for the patient and/or institution.
La fibrosis hepática es la respuesta de cicatrización que ocurre como consecuencia del daño agudo o crónico del hígado por una variedad de causas; es un proceso de reparación, dinámico y potencialmente reversible, que está asociado a regeneración hepatocelular. La activación de las células estelares provoca proliferación de fibroblastos y depósito excesivo de matriz extracelular, lo que produce bandas fibrosas y distorsiona la estructura del hígado formando cicatrices y nódulos de regeneración. Como consecuencia, la función del hígado se altera y se incrementa la resistencia hepática al flujo sanguíneo, que causa enfermedad crónica del hígado (ECH) manifestada por cirrosis y complicaciones como: insuficiencia hepática, hipertensión portal y hepatocarcinoma1,2.
En los países industrializados las causas principales de cirrosis incluyen la infección crónica por virus de las hepatitis C y B, la ingesta inmoderada de alcohol y el hígado graso no alcohólico (HGNA), que puede evolucionar a esteatohepatitis no alcohólica (EHNA) y cirrosis.
La prevalencia de las infecciones virales y el alcoholismo como causa de ECH permaneció estable entre 1998 y 2008. En contraste, la prevalencia de HGNA como causa de ECH ha aumentado del 46.8 al 75.1% en el mismo período3. El HGNA se ha convertido en la causa más frecuente de ECH en los Estados Unidos y Europa, asociado al aumento en la prevalencia de obesidad y el síndrome metabólico. Se estima que el incremento continuo en la prevalencia del HGNA contribuirá sustancialmente al aumento de la ECH y representará una carga epidemiológica en numerosos países, entre los cuales está México4–6.
El diagnóstico de fibrosis ha cobrado mayor importancia en tiempos recientes debido a que varias causas que la producen pueden ser prevenidas o tratadas y a que puede ser potencialmente reversible si se elimina el factor causal2,5. El manejo clínico de estos pacientes requiere conocer el estadio de la fibrosis, el contenido de grasa y, eventualmente, el de hierro, que coexisten con frecuencia, así como su incremento o reducción en el curso del tratamiento.
La biopsia hepática, tradicionalmente considerada «estándar de oro» para el diagnóstico, cuenta con varias limitaciones: es invasiva, costosa, está sujeta a complicaciones, permite examinar solamente una porción muy pequeña del órgano (de aproximadamente 1/50,000 de su volumen), el análisis histológico tiene una gran variabilidad intra- e interobservador, con una baja eficacia en los estadios iniciales de fibrosis (F1 y F2) y no brinda información acerca de la distribución de la fibrosis en el parénquima, la cual puede ser heterogénea7–9.
Algunos métodos de imagen como el ultrasonido (US), la tomografía computada (TC), la resonancia magnética (RM) y la elastografía por ultrasonido (EUS) superan algunas o varias de estas limitantes y han venido utilizándose con frecuencia creciente en los últimos años, brindando una nueva opción de diagnóstico no invasivo.
Una técnica de más reciente adquisición es la elastografía por resonancia magnética (ERM), desarrollada por investigadores de la Clínica Mayo de Rochester para obtener información cuantitativa y cualitativa sobre la fibrosis del hígado10.
Esta técnica ha continuado perfeccionándose y recientemente se ha hecho más atractiva debido a que puede combinarse en forma adicional y durante la misma sesión con otras secuencias de RM que son útiles para cuantificar los infiltrados del parénquima por grasa o hierro, lo cual permite establecer un protocolo de exploración «multiparamétrico».
El objeto de esta comunicación es describir la técnica y las aplicaciones clínicas del protocolo de RM multiparamétrico de hígado que utilizamos en nuestro departamento para el diagnóstico y la cuantificación de fibrosis, esteatosis y hepatosiderosis, durante una exploración específica de 25 min de duración, que resulta clínica y económicamente viable para el paciente y para la institución.
Sustentan esta revisión la experiencia obtenida en los últimos 18 meses en nuestro departamento de imagen y una amplia revisión de la literatura publicada en las revistas de hepatología, gastroenterología y radiología, en idiomas inglés y francés, en la base de datos PubMed entre 2006 y 2016 con las palabras clave: fibrosis, liver fibrosis, elastography, US elastography y MR elastography.
FibrosisElasticidad y durezaEl comportamiento mecánico de los tejidos del cuerpo humano es similar al de los materiales viscoelásticos. La elasticidad del hígado es inversamente proporcional a la dureza del parénquima y a la cantidad de tejido fibroso. A medida que aumenta la fibrosis, se incrementa la dureza del parénquima y disminuye su elasticidad. Este fenómeno físico puede medirse con técnicas llamadas de elastografía.
Principios generales de la elastografíaLa finalidad de la elastografía del hígado es obtener, en vivo y en forma no invasiva, información acerca de las propiedades mecánicas del parénquima después de someterlo a un estrés que lo deforme. La elastografía puede realizarse por medio de ultrasonidos (EUS) o por medio de resonancia magnética (ERM).
Para realizar la ERM del hígado se requieren 3 etapas básicas: a) la excitación, que consiste en transmitir al órgano un estrés por medio de una fuente de movimiento que envía ondas que deforman el parénquima; b) la adquisición de los datos, que consiste en registrar la deformación producida en el tejido como consecuencia del estrés aplicado y c) el análisis y la cuantificación de los datos obtenidos que el equipo presenta en forma de imágenes11,12.
Elastografía por resonancia magnéticaLos principios físicos de la ERM han sido descritos en múltiples publicaciones especializadas, por lo que no son motivo de descripción detallada en este trabajo10,11,13–15. Se basan en la transmisión de ondas longitudinales de baja frecuencia, de aproximadamente 65Hz, por medio de un instrumento colocado sobre la pared costal, frente al hígado. Las ondas longitudinales que penetran en el órgano se transforman en ondas transversales, llamadas de corte, o de cizalladura, que se propagan por el parénquima hepático y son calculadas con el módulo de cizalladura (shear modulus). Las medidas obtenidas se cuantifican en kilopascales (kPa).
EquipamientoEn nuestro departamento la ERM (también llamada fibro-RM) se lleva a cabo en un equipo de RM de 1.5 T (Optima 450 w, General Electric, Milwaukee, Wisconsin, EE. UU.). El resonador cuenta con un hardware adicional destinado a producir las ondas mecánicas que se envían hacia el hígado y con un programa de software específico para analizar la información que se obtiene.
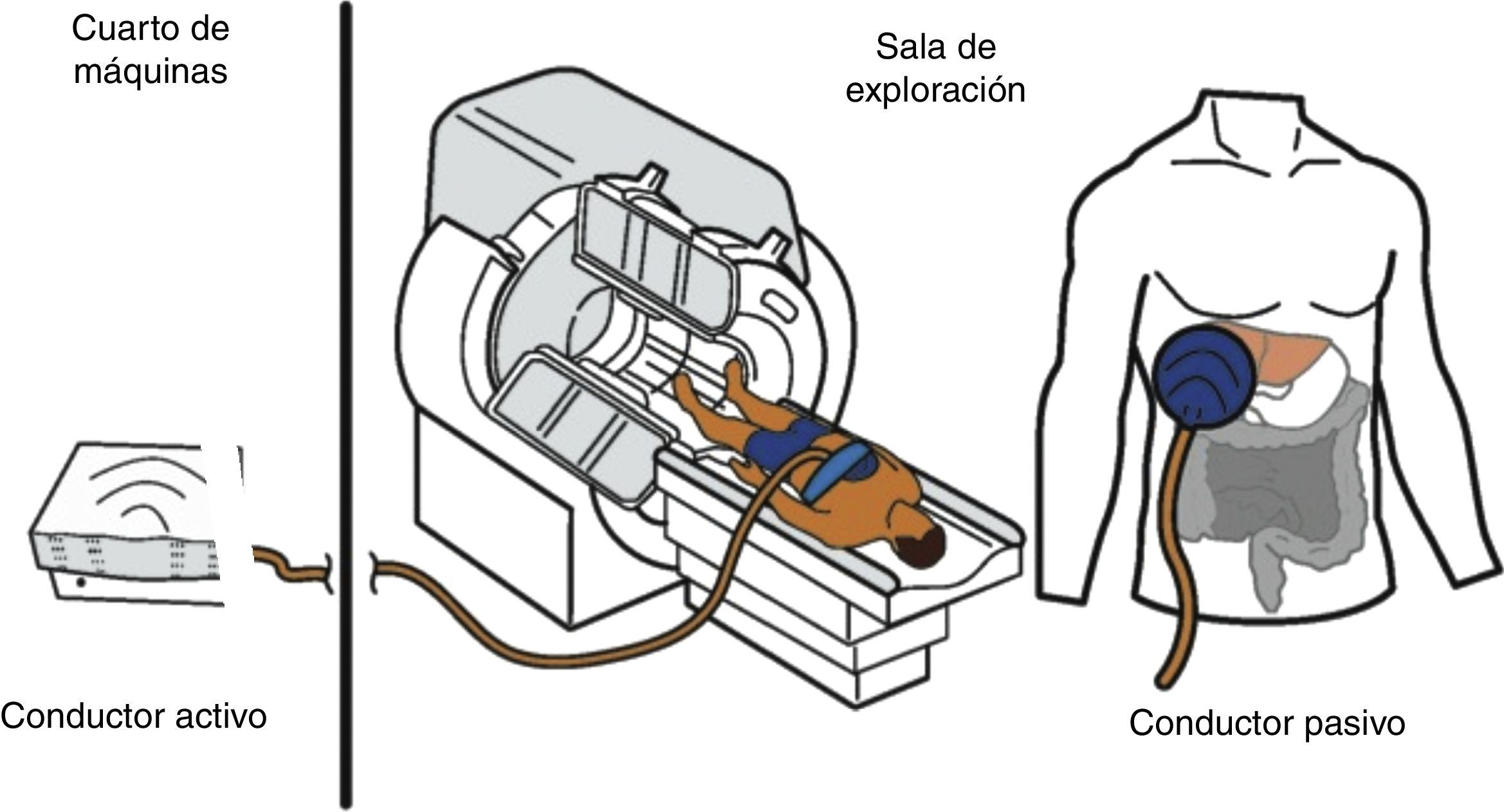
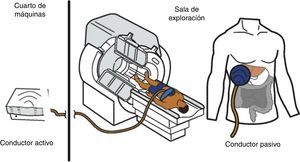
El hardware está compuesto por 4elementos mecánicos (fig. 1): 1) un generador de pulsos o vibraciones que actúa como «generador activo», el cual se localiza en el cuarto de máquinas vecino; 2) un tubo flexible que transmite los pulsos o vibraciones producidos por el generador y que son conducidos hacia 3) una paleta de material plástico de 10cm de diámetro que se coloca sobre la piel de la parrilla costal, frente al hígado del paciente, llamada «conductor pasivo» y 4) hacia una banda elástica con la que se fija dicha paleta al cuerpo del paciente.
Esquema de los componentes del equipo de elastografia por resonancia magnética. En el cuarto de máquinas se encuentra el equipo conductor activo que genera pulsaciones. Estas se transmiten en forma de ondas a través de un tubo de plástico que conecta dicha máquina con la paleta, que es un conductor pasivo de 10cm de diámetro que se coloca frente al hígado y las transmite al órgano. La paleta se fija al cuerpo con una banda elástica.
La información que generan las ondas a su paso por el parénquima es procesada por el software de elastografía, que despliega los datos en la pantalla de una estación de trabajo en forma de imágenes en 4presentaciones diferentes (tabla 1).
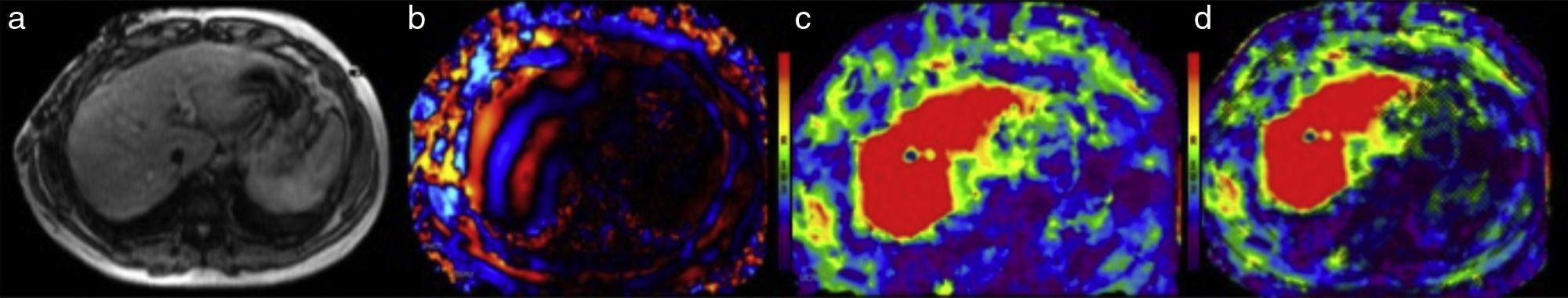
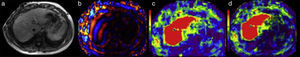
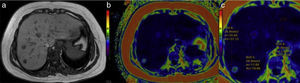
La primera es una imagen llamada de referencia, en escala de grises y con baja resolución, que sirve únicamente para seleccionar las áreas del parénquima hepático que deben medirse, evitando incluir las zonas inadecuadas como los vasos portales, grandes fisuras, vesícula, etc. (fig. 2a).
La segunda imagen corresponde a un mapa de ondas en color y en movimiento que muestra el avance de las ondas en el tejido hepático (fig. 2b).
La tercera imagen, llamada elastograma, es un mapa en color de la dureza del hígado. Adjunto a cada elastograma aparece una escala colorimétrica (fig. 2c).
El software de elastografía genera una cuarta imagen llamada «imagen de confianza» que permite delimitar las zonas del hígado en las cuales se puede realizar una medición confiable (fig. 2d).
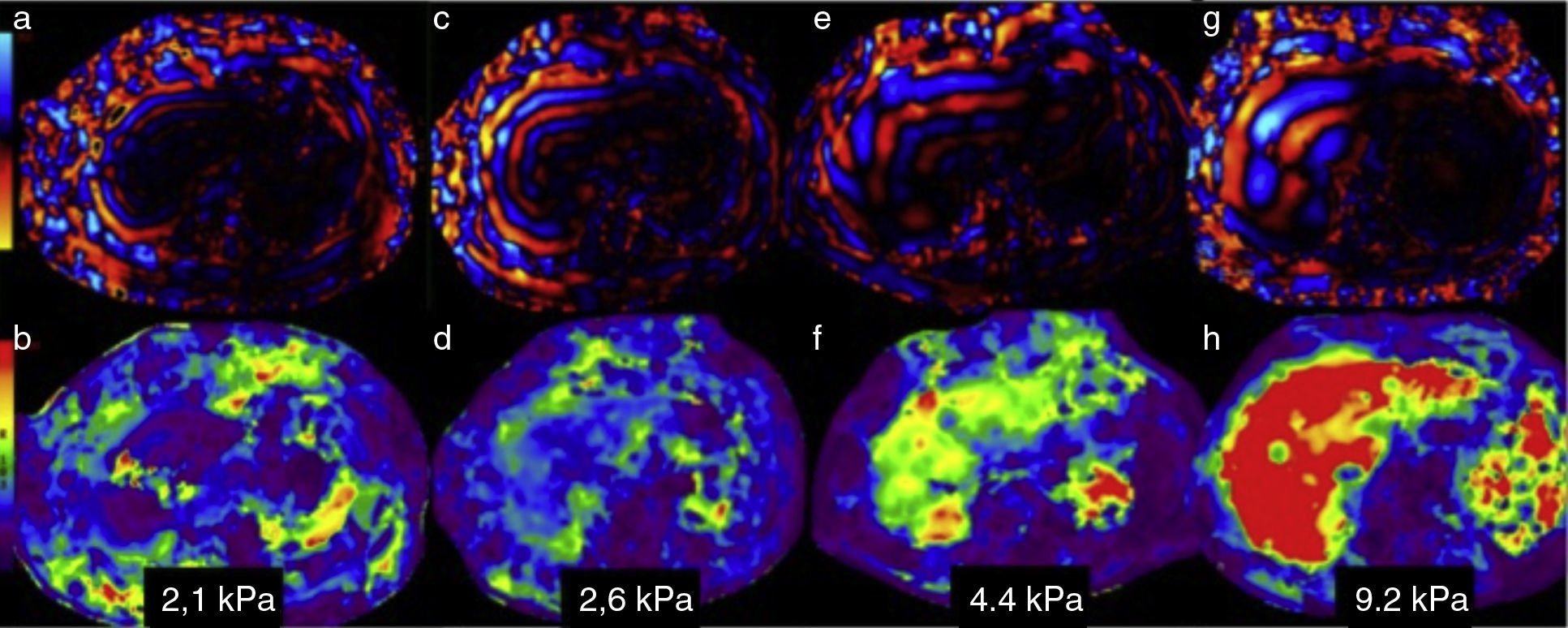
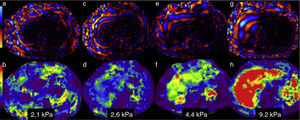
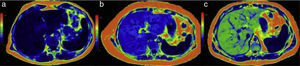
Análisis de las imágenes y medición de la dureza del hígadoMapa de ondasEl análisis de las ondas puede hacerse en forma estática, en una imagen fija, o bien en un video que muestra el movimiento de las ondas. Sirve para verificar que las ondas enviadas por el conductor pasivo penetraron y se distribuyeron adecuadamente en el tejido hepático. En el hígado normal las ondas son delgadas y paralelas (fig. 3a); conforme hay mayor fibrosis, las ondas se tornan más gruesas y rápidas (fig. 3c, e y g).
Análisis de la información. En la fila superior aparece el mapa de ondas en 4pacientes con diferentes grados de dureza. La fila inferior corresponde al elastograma o mapa de color de cada uno de ellos. Las figuras a, c, e y g muestran el aumento en el grosor y la irregularidad de las ondas conforme se incrementan los grados de fibrosis. Los elastogramas muestran los cambios de color del hígado y sus respectivas medidas de dureza: b) colores morados para 2.1kPa=F 1; d) verdes y azules para 2.6kPa=F2; f) verdes y amarillos para 4.4kPa=F3 y h) rojo para 9.2kPa=F4. Compárense los colores del hígado con la barra de colores en el extremo izquierdo.
Este mapa de color permite hacer una valoración visual rápida de la normalidad o anormalidad de la dureza del parénquima hepático. Se realiza comparando los colores del hígado con los de la escala colorimétrica adjunta a cada imagen. Con ello se tiene una primera apreciación del grado de fibrosis ya sea que esté ausente, sea incipiente, moderada, o intensa (fig. 3b, d, f y h).
En nuestro equipo los colores azules y morado están situados en la parte baja de la escala y corresponden a la menor dureza, y el color rojo, en la parte superior, representa la mayor dureza, mientras que aquellos con valores intermedios de dureza tienen colores amarillos y naranja. El mapa de color permite también apreciar en forma visual si la distribución de la fibrosis es homogénea o heterogénea16.
El radiólogo realizará las mediciones de la dureza colocando manualmente los cursores electrónicos sobre la imagen de referencia (cuidando de evitar los vasos portales y la vesícula) o sobre el elastograma en las zonas que delimita la llamada «área de confianza».
Recientemente se están desarrollando programas que permiten hacer la cuantificación en forma automática, sin intervención humana. Dado que el elastograma abarca toda la circunferencia del abdomen, permite también reconocer en la misma imagen si existe aumento en la dureza del bazo (fig. 3h).
Valores normales de dureza hepática en elastografía por resonancia magnéticaEl hígado normal es blando y elástico con una dureza promedio de 2.05 a 2.44kPa y un rango de 1.54 a 2.87kPa15,16. El nivel de corte para detectar fibrosis con ERM oscila entre 2.4 y 2.9kPa con un 98% de sensibilidad y un 99% de especificidad para el valor de 2.93kPa13,16,17.
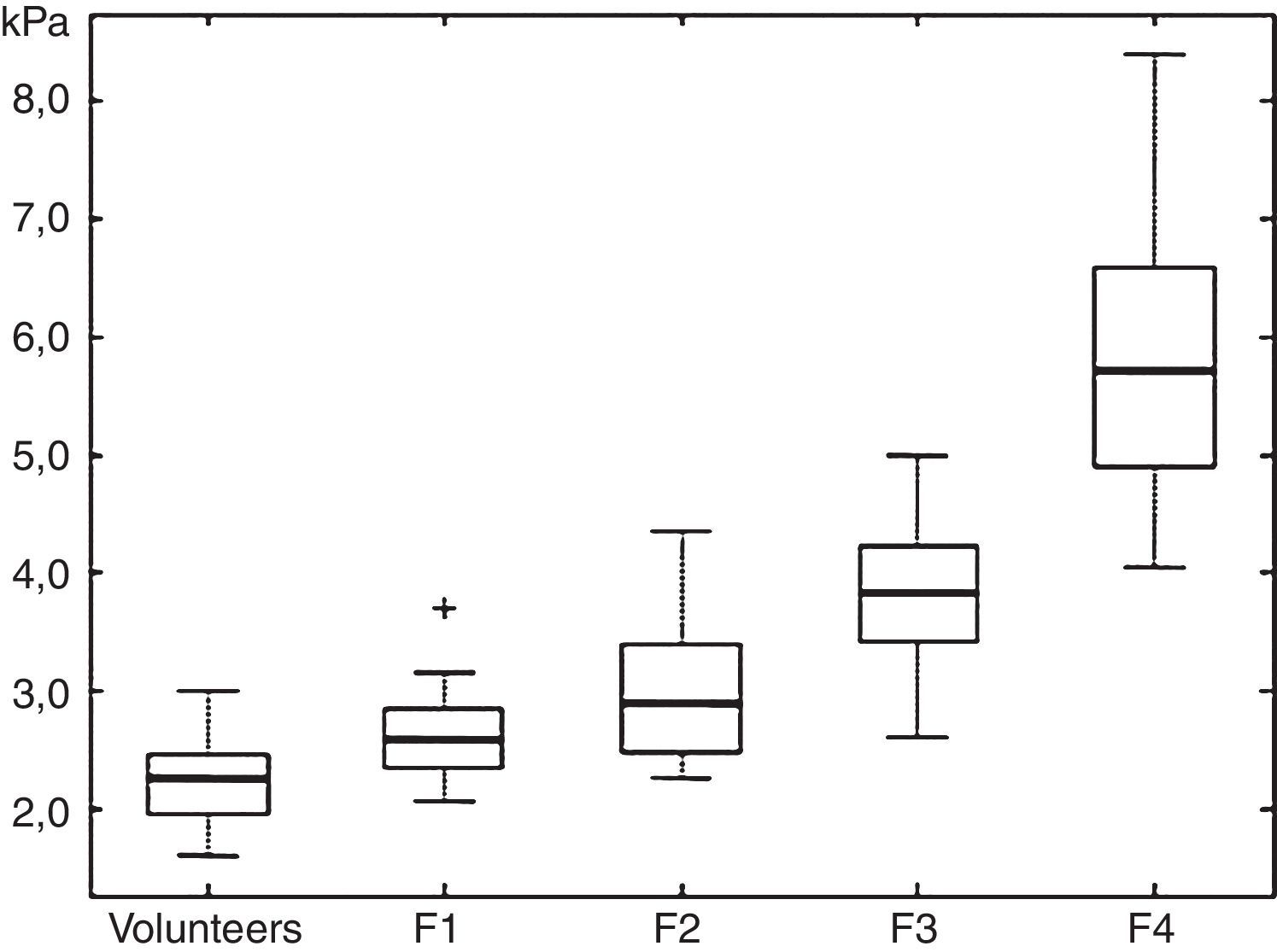
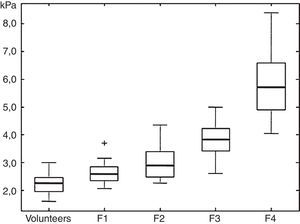
Los valores obtenidos en kPa han sido correlacionados por Huart et al. con la escala METAVIR de F0 a F413, escala que fue modificada por Asbach et al., quienes elaboraron la tabla que utilizamos en nuestra práctica para informar los resultados del estudio (fig. 4)14.
Cuadro que muestra los cuartiles bajo, mediano y alto del módulo de cizalladura (shear modulus) para los estadios F1-F4 de fibrosis en comparación con voluntarios. (Reproducido con autorización).
Es importante saber que la escala de kPa en RM es diferente a la que se usa en US. Esto, debido a que en el US los valores se procesan con el módulo de elasticidad de Young, que valora las ondas longitudinales en una escala que oscila entre 2.5 y 75kPa. La ERM, en cambio, procesa los valores con el módulo de elasticidad transversal o módulo de cizalladura (shear modulus), que mide las ondas transversales que se distribuyen en el parénquima también en kPa, pero en una escala de 0 a 8kPa.
Seguimiento clínico de la fibrosis con elastografía por resonancia magnéticaDiversos estudios han mostrado que la ERM puede detectar las modificaciones de la dureza del hígado en el curso del tiempo. Es un estudio reproducible, repetible y poco operador dependiente, por lo que es un marcador útil para monitorear el incremento o el eventual decremento de la fibrosis del hígado, en forma no invasiva, durante el seguimiento clínico15–17.
Medición de la dureza del bazoLas técnicas de elastografía empleadas para medir la dureza del hígado han sido también utilizadas para explorar el bazo, con la hipótesis de que el aumento en la dureza esplénica puede relacionarse con el desarrollo de hipertensión portal y puede ser útil para clasificar la cirrosis.
Medición con ultrasonidosLa dureza del bazo puede medirse con técnicas de EUS o con ERM en forma similar a la del hígado. Los primeros estudios de EUS fueron realizados con los equipos de elastografía transitoria. Estudios recientes, en cambio, dan cuenta del empleo de equipos que utilizan el impulso de ondas de radiación acústica (ARFI) para generar ondas transversales de cizalladura conocidas en inglés como shear wave images. Esos equipos permiten efectuar la medida del bazo bajo la guía de la imagen del ultrasonido en escala de grises y tiempo real, evitando también medir los vasos del hilio esplénico que pueden ser prominentes cuando hay hipertensión portal. Se obtiene así una medición más precisa18–23.
Medición con resonancia magnéticaUn número creciente de publicaciones informan de la utilidad de la ERM para medir la dureza del bazo con resultados favorables en comparación con los de la EUS24–30.
El estudio del bazo es posible durante la ERM del hígado debido a que el elastograma abarca toda la circunferencia del abdomen, incluyendo ambos órganos.
En el área de estudio, el bazo puede también explorarse colocando la paleta emisora de pulsos directamente sobre el área esplénica.
La dureza normal del bazo medida por ERM varía entre 2.35 y 5.6kPa, con una medida de 3.6kPa en voluntarios normales27. Estudios en curso deberán aportar mayores conocimientos en este tema.
Ventajas de la elastografía por resonancia magnéticaLa ERM obtiene información de los vectores de las ondas que se propagan en 2 o en 3 dimensiones en el parénquima hepático. Se calcula que el volumen de tejido hepático que se analiza en la ERM en 2D es de aproximadamente 250cm3, comparado con el volumen que valoran los métodos ultrasonográficos, que oscila entre 0.5 y 20cm3 (tabla 2). El volumen de tejido analizado en la ERM es, por ello, mucho más representativo de la infiltración del parénquima y reduce errores debidos a la heterogeneidad que pueda tener la fibrosis22. El examen con ERM no está limitado por la presencia de ascitis o espacios intercostales cerrados. El tiempo de ocupación del equipo de RM y el costo del estudio se reducen considerablemente cuando se hace un estudio específico de elastografía.
Volumen de tejido cuantificado por los métodos de EUS y ERM22
| Método de elastografía | Fabricante | Volumen |
|---|---|---|
| 1. Elastografía transitoria (Fibroscan®) | Echosens, FR | 4 cm3 |
| 2. US ARFI pSWE | Siemens, Philips | 0.5-1.0 cm3 |
| 3. US ARFI 2DSWE | Supersonics, Toshiba, General Electric (GE) | 20 cm3 |
| 4. Elastografía por RM | GE, Siemens, Philips | 250 cm3 |
La más importante es la presencia del depósito excesivo de hierro en el parénquima debido a hemosiderosis o hemocromatosis, que puede coexistir con fibrosis en los pacientes con ECH. Cuando existe sobrecarga de hierro, las ondas se transmiten bien por el parénquima, pero la señal emitida por el hígado resulta demasiado baja (especialmente en equipos de 3 T) y la medición puede resultar inexacta. La obesidad excesiva, obstrucción biliar y la claustrofobia y la incapacidad para sostener la apnea son causas que pueden limitar la exploración.
EsteatosisLa RM ofrece varias técnicas para detectar y cuantificar el contenido de grasa en el parénquima hepático (tabla 3). Se basan en las diferentes frecuencias de precesión —resonancia— que tienen los protones de hidrógeno (1H+) existentes en el agua y en la grasa31–33.
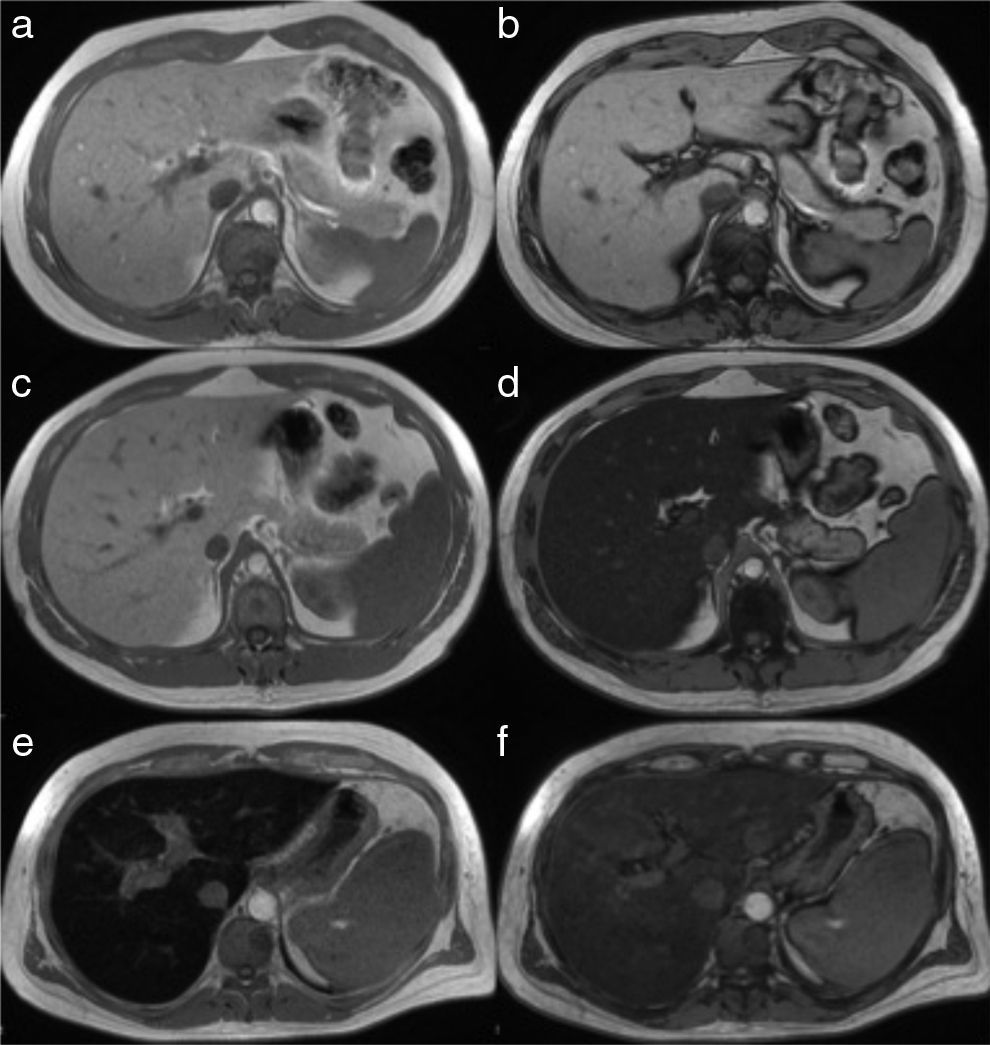
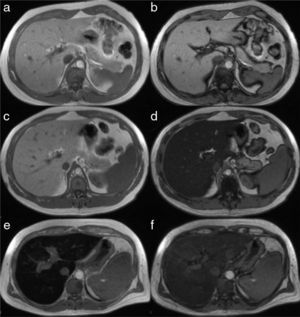
La técnica más sencilla es el análisis visual de la imagen del hígado obtenida en la secuencia ponderada en T1 de doble eco, que forma parte de todos los protocolos de RM del hígado. Proporciona un par de imágenes anatómicas del hígado de buena calidad, «ponderadas a T1» y en 2fases de adquisición diferentes: una «dentro de fase» (IP) y otra «fuera de fase» (OP), que permiten detectar la grasa en forma visual, cualitativa: en el paciente normal, el parénquima hepático tiene una señal igual en ambas imágenes, dentro y fuera de fase (fig. 5 a y b). En los enfermos con esteatosis se produce un decaimiento de la señal en las imágenes «fuera de fase», lo cual hace que la imagen de hígado se torne más oscura, conforme existe mayor cantidad de triglicéridos (fig. 5c y d), lo que permite el cálculo de la fracción grasa como veremos adelante.
Imagen del hígado en secuencia T1 dentro de fase (columna izquierda) y fuera de fase (columna derecha) en 3pacientes diferentes. En un sujeto normal la señal es similar en las secuencias a) dentro de fase y b) fuera de fase. Las imágenes del centro corresponden a un paciente con esteatosis en quien la intensidad de la señal del parénquima es normal en la secuencia «dentro de fase» (c) y decae notoriamente en la secuencia «fuera de fase», en la que adquiere una tonalidad negra por mayor contenido de grasa (d). En el paciente de la línea inferior con hemocromatosis se observa que la señal decae, en cambio, en la secuencia «dentro de fase» (e), por incremento en la saturación de hierro en comparación con la secuencia «fuera de fase» (f).
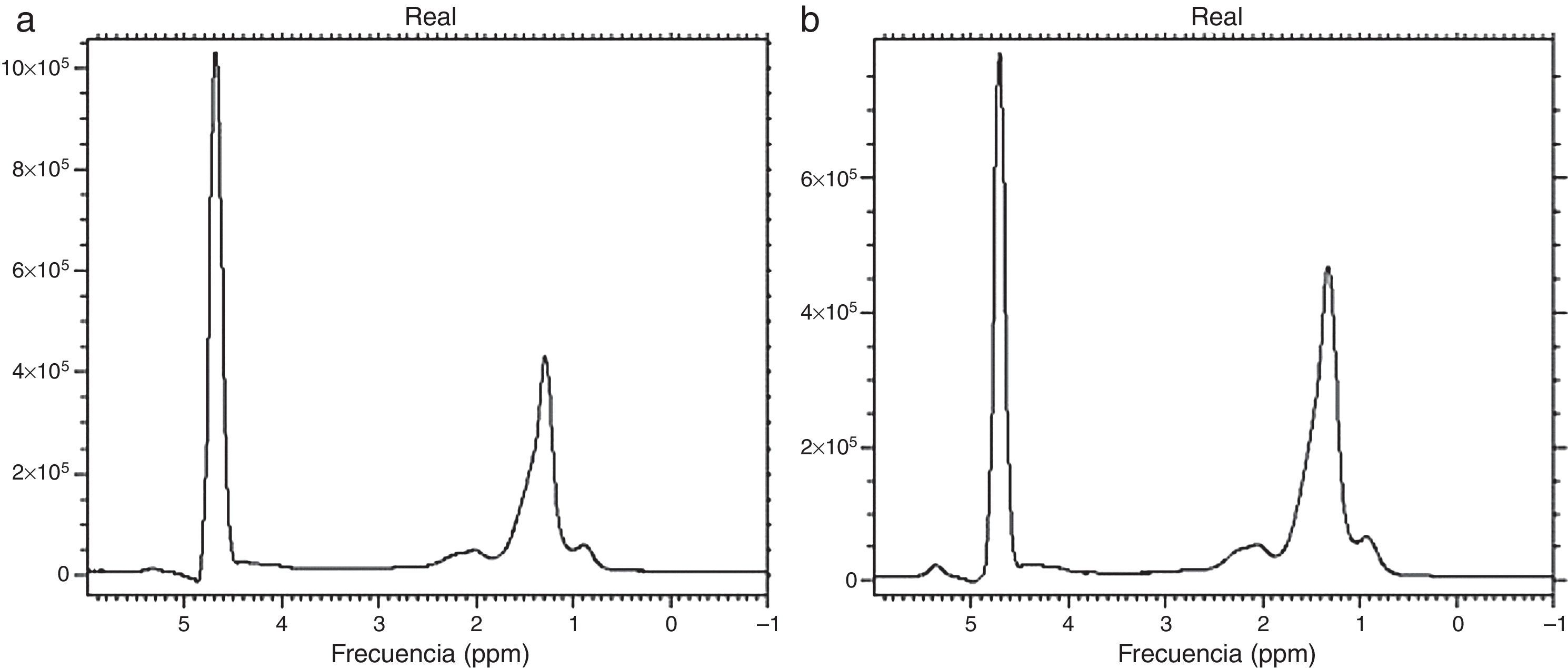
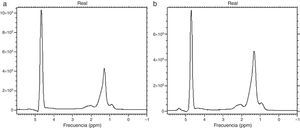
La técnica cuantitativa más exacta que existe en la actualidad para cuantificar la grasa es la espectroscopia por RM (1H-RM). Permite separar el espectro de la curva de agua de aquellos de las curvas de los lípidos y proporciona una cuantificación precisa. En la curva espectral cada metabolito se detecta de acuerdo con su frecuencia de resonancia medida en partes por millón (ppm). Puede distinguirse el pico de agua de varios picos producidos por triglicéridos y eventualmente también de otros metabolitos (fig. 6a y b). La espectroscopia es la técnica no invasiva de referencia para diagnosticar la esteatosis32,34,35. Es, sin embargo, la más compleja, lenta y costosa: requiere software especializado, por lo que hasta ahora se reserva para estudios académicos y de investigación.
Espectroscopia de lípidos. Las gráficas a y b muestran 2picos principales: a la izquierda un pico elevado que corresponde al agua y, a la derecha, uno de menor altura que corresponde a la concentración de triglicéridos. Nótese que este pico es más elevado en la gráfica b en un paciente con mayor concentración de lípidos.
La técnica más utilizada es la descrita por Dixon36, que mide el desplazamiento químico (chemical shift) entre los protones de la grasa y el agua. Utiliza la secuencia ponderada en T1 de doble eco: la secuencia IP contiene la suma de protones del agua y de los lípidos, y la secuencia OP contiene el valor absoluto de la diferencia del agua menos los lípidos (IP-OP).
El contenido graso se calcula con la siguiente ecuación35:
Donde, FSG es la fracción de señal de la grasa; SGrasa es la señal de la grasa; SAgua es la señal del agua; SIP es la señal «en fase» y SOP, la señal «fuera de fase».
En la actualidad se recomienda utilizar técnicas más recientes de la misma familia, como las secuencias 3D multieco en densidad protónica, que permiten el cálculo más preciso de la fracción grasa, la separan del agua y tienen buena correlación histológica. Estas son más precisas, en especial, cuando coexisten esteatosis con depósitos de hierro en el parénquima que pueden falsear la lectura.
Las secuencias multieco permiten eliminar el efecto del hierro y proporcionan una cuantificación de grasa corregida que es más precisa32,34,35,37.
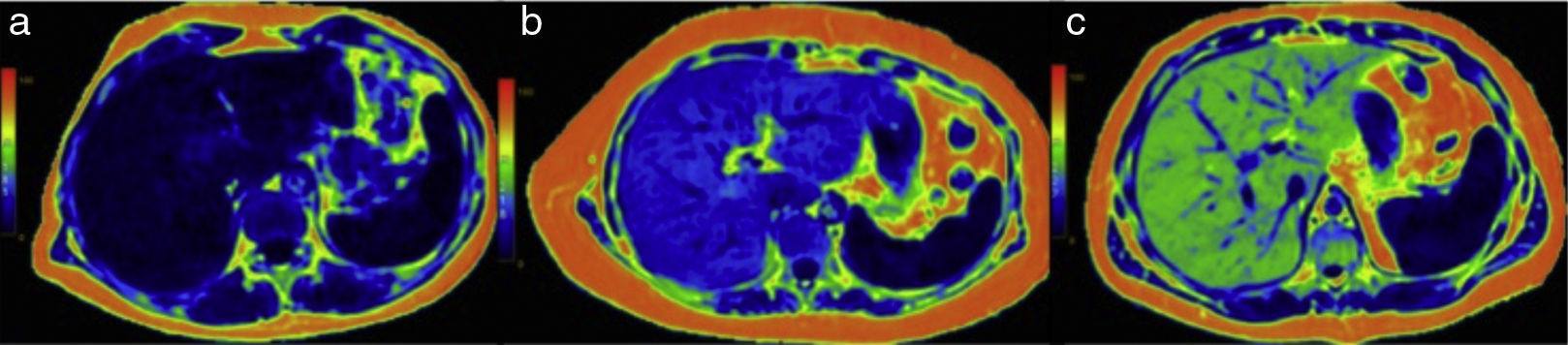
Cuantificación de la esteatosis en la cartografía en colorLa cuantificación de la grasa hepática puede realizarse también por medio de una cartografía o mapa del color, que permite la rápida apreciación visual de la existencia de esteatosis y hacer las medidas directamente sobre la imagen (fig. 7a, b y c).
Mapas de color en 3 pacientes con diferentes grados de esteatosis: a) paciente con contenido normal de grasa: el color azul oscuro del hígado corresponde a la parte baja de la escala colorimétrica y a una cuantificación menor de 6% (normal); b) en este paciente el color azul claro se sitúa más arriba en la escala y el contenido de grasa está aumentado a un promedio de 17%; c) la imagen del tercer paciente asignó al hígado un color verde, indicativo de un alto contenido de grasa, que se cuantificó en 33%.
Los diferentes colores del mapa corresponden a la distribución y la intensidad del infiltrado que puede ser difuso o regional («esteatosis geográfica» o «en parches») e, incluso, estar presente en una lesión focal, como sucede en los lipomas y en algunos adenomas y hepatocarcinomas.
La cartografía facilita el análisis del contenido de grasa al comparar los colores de la barra colorimétrica que se presenta adjunta a la imagen. En nuestro equipo los colores azules oscuros corresponden a la menor concentración de lípidos; según aumenta la cantidad de infiltrado, se obtienen colores azules claros y verdes, y los amarillos y rojos aparecen a las concentraciones más altas. La imagen de la cartografía abarca toda la circunferencia del abdomen, por lo que pondrá en evidencia también con colores rojos la grasa subcutánea y la de los espacios peritoneal y perirrenal.
Para cuantificar el infiltrado hepático, el radiólogo utiliza dispositivos electrónicos que le permiten escoger las regiones en las que desea calcular el porcentaje de grasa existente. La presencia de grasa dentro de una lesión focal del hígado ayuda a caracterizarla (fig. 8).
Adenoma hepático con grasa. a) La secuencia T1 muestra 3pequeñas lesiones focales en los segmentos 7 y 8 del hígado. El mapa de color para cuantificar grasa muestra que 2de ellas tienen tonos azulados en el centro (b) donde la concentración de lípidos fue de 37 y 19%, respectivamente (c). El diagnóstico histológico fue de adenoma HNF1.
Se consideran normales los valores de contenido graso menores de 6%.
La RM puede identificar infiltrados de triglicéridos tan bajos como 6-15%. Las cifras de porcentaje de grasa obtenidas en la imagen paramétrica son reproducibles en el tiempo, lo que les confiere valor para el diagnóstico y para el seguimiento de la evolución de la esteatosis bajo tratamiento.
En 2estudios prospectivos comparativos, los resultados de la RM han sido más precisos que los del US y la TC para el diagnóstico y la cuantificación de la esteatosis38–40.
HepatosiderosisLa RM cuenta también con secuencias especiales para investigar el contenido de hierro en el parénquima hepático y en otros órganos como el páncreas, el bazo y el corazón. Permite detectar y cuantificar la cantidad de hierro depositada en el hígado con precisión y reproducibilidad, por lo que es una herramienta útil para el diagnóstico y para seguir la respuesta al tratamiento. Cuando el acúmulo de hierro en el tejido hepático es muy grande, distorsiona el campo magnético y produce un decaimiento de la señal en las secuencias T1, T2 y T2*.
La secuencia T1 de doble eco permite hacer una apreciación cualitativa rápida del incremento en el contenido de hierro hepático debido a que en esta secuencia el decaimiento se presenta en la imagen IP (fig. 5 e y f), al contrario de lo que ocurre y describimos anteriormente para la esteatosis.
La técnica cuantitativa más conocida en nuestro medio y que utilizamos con mayor frecuencia en nuestro departamento es la de Gandon et al., de la Universidad de Rennes (Francia), publicada en el sitio de la universidad: http://www.radio.univrennes1.fr/Sources/EN/Hemo.htlm. El estudio puede realizarse en resonadores comunes, adaptando el protocolo a la magnitud del campo del magneto disponible ya sea de 0.5, 1.0 o de 1.5 T. El cálculo se realiza «en línea» con una aplicación de Java proporcionada por la propia universidad41.
El método es eficaz para descartar la existencia de pequeñas sobrecargas parenquimatosas de hierro, aun cuando los valores sean menores de 60μmol Fe/g. En cambio, la eficacia de la técnica puede perderse cuando los depósitos son muy intensos, debido a que ocasionan pérdida completa de la señal de resonancia por el efecto que produce el hierro hepático en el campo magnético.
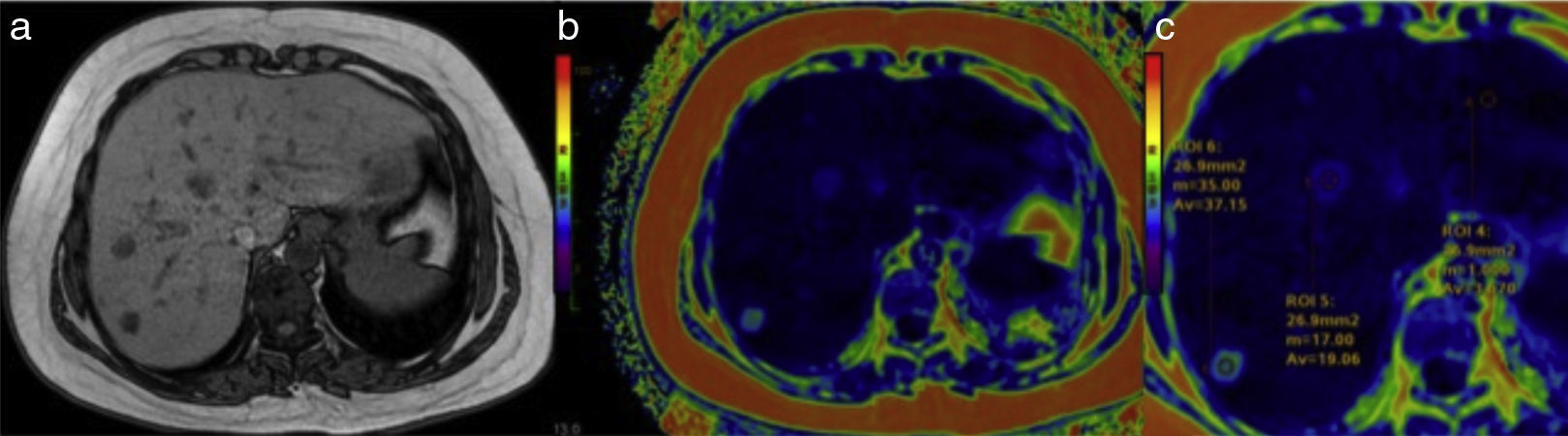
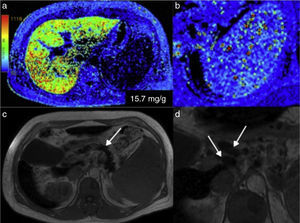
Existen otras técnicas de evaluación del hierro parenquimatoso. Entre ellas, la llamada MRI R2 y R2*, técnica con la que pueden obtenerse también imágenes paramétricas que reflejan el contenido de hierro en el hígado y el bazo (fig. 9). Las comparaciones con biopsia hepática han dado resultados disímbolos, debido a la heterogenidad de los depósitos de hierro. En general resultan similares, pero con obvias ventajas para la RM, que puede utilizarse para seguimiento de los tratamientos y que cuenta también con la preferencia del paciente por no ser invasiva42,43.
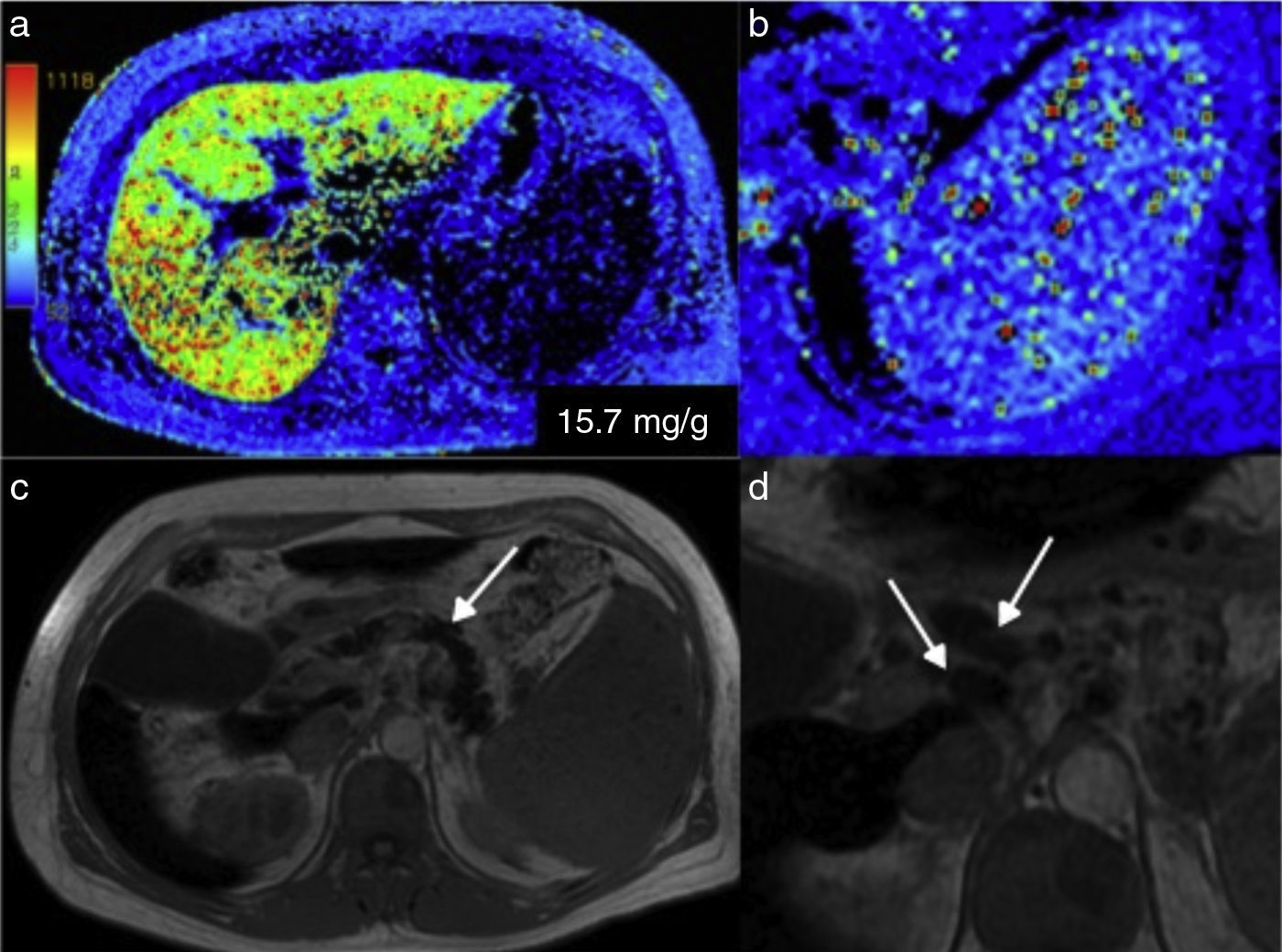
Hemocromatosis. a) En el mapa colorimétrico, los colores rojos corresponden a la parte alta de la escala, que indica la mayor concentración de hierro en el parénquima hepático. b) Nótese también el punteado de color rojo en la imagen amplificada del bazo producido por los cuerpos sideróticos de Gamna-Gandy. c) Adicionalmente, la imagen anatómica en T1 de este paciente mostró decaimiento de la señal del parénquima del páncreas (flecha) y presencia de ganglios peripancreáticos aumentados de tamaño (flechas) en relación con hemocromatosis (d).
Con la técnica descrita por Gandon et al., los valores de 40 a 100μml/ml representan una sobrecarga ligera de hierro en el tejido hepático, en tanto valores de 100 a 200μml/ml corresponden a una sobrecarga moderada y aquellos mayores de 300μml/ml indican una sobrecarga mayor que puede saturar las secuencias y falsear las lecturas41. La técnica MRI R2-R2* mide la concentración parenquimatosa de hierro en mg de Fe/g42,43.
Imagen anatómicaEl protocolo utilizado en nuestro departamento de imagen incluye, adicionalmente, la presentación de 2secuencias anatómicas simples de RM sin contraste que tienen utilidad clínica: la primera es la mencionada secuencia ponderada en T1 con imágenes IP y OP, que sirvieron también para la valoración cualitativa de la grasa y el hierro, a la que añadimos una secuencia T2 axial. Brindan una excelente imagen anatómica del hígado, de los órganos del abdomen superior y del retroperitoneo, incluyendo la vesícula y las vías biliares, el bazo, el intestino, el páncreas, el conducto pancreático, los riñones, las suprarrenales, la aorta y la vena cava. Pueden detectar algunas lesiones focales del hígado benignas o malignas, en cuyo caso debe valorarse la ampliación del estudio con secuencias con contraste intravenoso ya sea con gadolinio o ácido gadoxético (Primovist®).
Discusión y comentariosLa necesidad de contar con métodos no invasivos que sean precisos, reproducibles y además capaces de detectar los diferentes estadios de la ECH deriva de varios hechos, entre los cuales destacan: el incremento de su prevalencia (que en el caso del HGNA ha sido calificado como epidémico), el mejor conocimiento de la enfermedad y las mayores oportunidades terapéuticas (que han hecho también más complejas las decisiones que el clínico está llamado a tomar44,45).
FibrosisSi bien a la fecha existen pocas oportunidades de curación para etapas avanzadas de cirrosis a excepción del trasplante, los estadios tempranos o intermedios de fibrosis están emergiendo como entidades tratables por medio de algunas medidas preventivas y otras posiblemente curativas, que pueden detener la progresión o permitir la regresión de la fibrosis, como puede ser el caso de los nuevos antivirales directos y algunos fármacos en curso experimental46–50.
El diagnóstico de fibrosis como factor central en la patogenia de la ECH adquiere en este contexto un mayor significado. Guías recientes de AASLD-IDSA señalan que la correcta evaluación de la fibrosis es fundamental para valorar la indicación del tratamiento y, en algunos casos, su duración51. En la reunión de consenso celebrada en Denver (Colorado, EE. UU.), en octubre de 2014 sobre el uso de las diversas técnicas de elastografía que incluyó a infectólogos, hepatólogos, radiólogos, patólogos, ingenieros biomédicos y representantes de la FDA, se estableció que la prioridad para dar tratamiento antiviral a pacientes con virus de la hepatitis B y C está actualmente determinada por la presencia o ausencia de fibrosis moderada a intensa (F3 o mayor)22.
La técnica de ERM desarrollada en la Clínica Mayo de Rochester ha venido a enriquecer nuestra capacidad de diagnóstico, ya que proporciona al clínico una amplia y variada información sobre la fibrosis, que no está al alcance de otras tecnologías y entre las cuales se cuentan:
- a)
la muestra de volumen de tejido examinado por la ERM, que es significativamente mayor que la que analizan los métodos por ultrasonidos: Fibroscan® (aproximadamente 4cm3; ARFI pSWE=0.5 a 1cm3 y ARFI 2D SWE=20cm3 comparados con aproximadamente 250cm3 de la ERM22) (tabla 2);
- b)
la obtención simultánea de una imagen cinética que comprueba el paso de las ondas en la amplitud y la profundidad del órgano;
- c)
la presentación de un elastograma en color que permite valorar visualmente el grado de dureza y la distribución homogénea o irregular de la fibrosis para hacer mediciones dirigidas por la imagen a las zonas de interés.
- d)
La ERM y la EUS, ya sea ARFI pSWE o ARFI 2DSWE, proporcionan en el mismo procedimiento la imagen anatómica del hígado y de los órganos del abdomen superior, lo que no existe en la elastografía transitoria por Fibroscan®22.
- e)
A estas ventajas se añade la posibilidad de cuantificar la dureza del bazo. La posibilidad de que esta medida sea un posible predictor de hipertensión portal se comentará más adelante52.
El protocolo de estudio específico de fibrosis puede ampliarse durante la misma sesión de ERM con 2secuencias adicionales para cuantificar la concentración y la distribución del infiltrado de grasa y, si se desea, la medición del contenido de hierro del parénquima, circunstancias que frecuentemente coexisten en los pacientes con ECH.
A diferencia de las técnicas de EUS, cuyos resultados difieren entre los diversos fabricantes de equipo lo que hace imposible comparar su equivalencia entre ellas, los 3fabricantes de ERM actualmente homologados por la FDA (General Electric, Siemens y Phillips) utilizan los mismos métodos de manejo de ondas de cizalladura, algoritmos de procesamiento y despliegue de las imágenes, por lo que los resultados que proporcionan sí son comparables22,53.
Este conjunto de datos paramétricos, obtenidos en forma no invasiva, califican a la RM como el método que brinda mayor información comparado con los demás procedimientos de diagnóstico, incluyendo las pruebas biológicas, los métodos de EUS y la misma biopsia, con la que ha mostrado tener una excelente concordancia12,22,44,54.
La ERM es también el método que garantiza el mayor éxito en su realización: en una serie de 141 pacientes, Huwart et al. obtuvieron estudios exitosos con ERM en 133/141 (94%), comparado con 118/141 (84%) con elastografía transitoria, además de obtener una mayor eficacia en el diagnóstico13. Resultados similares han sido informados en el estudio reciente de Ichikawa et al.55.
La eficacia y la correlación de la ERM con la biopsia hepática han sido motivo de un número creciente de estudios. El metaanálisis temprano realizado por de Wang et al. en 2012 demostró que la eficacia de la ERM para diagnosticar fibrosis proporcionó cifras de 0.95, 0.98, 0.98 y 0.99 bajo la curva AUROC56. Estos autores refirieron también que la dureza del hígado medida con ERM aumenta en paralelo con el grado de fibrosis: a mayor dureza, más fibrosis. Huwarth et al. informaron que en 141 pacientes con ERM en los que se realizó biopsia del hígado, las áreas bajo la curva AUROC fueron: 0.994 para F≥2; 0.985 para F≥3 y 0.998 para F=413.
Un metaanálisis realizado en 2014 por Su et al., que incluyó a 989 pacientes en 13estudios, mostró gran eficacia diagnóstica de la ERM para la detección, cuantificación y estadificación de la fibrosis hepática. Las cifras de sensibilidad y especificidad promedio para: F≥1, F≥2, F≥3 y F≥4 fueron: 0.87, 0.92, 0.87 y 0.9257.
Otro metaanálisis hecho por Sing et al. en 2015, que incluyó a 697 pacientes, 92.1% de los cuales tenían menos de un año de intervalo entre la ERM y la biopsia, mostró que los valores del área promedio bajo la curva AUROC (con 95% de intervalo de confianza) para el diagnóstico de cualquier estadio de fibrosis negativa (≥estadio 1), fibrosis significativa (≥estadio 2), fibrosis avanzada (≥estadio 3) y cirrosis, fueron: 0.84 (0.76–0.92), 0.88 (0.84–0.91), 0.93 (0.90–0.95) y 0.92 (0.90–0.94), respectivamente58. Por otra parte, el porcentaje de fallas del procedimiento en los 697 pacientes colectados en el mismo metaanálisis fue 4.3%, cifra que es muy baja cuando se compara con otras técnicas. Los autores concluyeron que la ERM tiene alta eficacia para el diagnóstico de fibrosis significativa o avanzada y que el resultado es independiente de la masa corporal y de la etiología de la ECH.
La ERM es una herramienta eficaz para el seguimiento de la evolución de los enfermos con ECH, habiéndose comprobado que las mediciones son confiables, repetibles y reproducibles59–61. La posibilidad de que la ERM reemplace a la biopsia hepática para el diagnóstico de fibrosis ha sido expresada en varios estudios, que ponen énfasis en que el volumen de tejido analizado en ERM es sustancialmente mayor que el de la biopsia hepática, que representa apenas el 0.02% del parénquima, sin informar sobre si la distribución de los infiltrados es homogénea o heterogénea13,16,43,44,59.
Hipertensión portalLa exploración del hígado por ERM ha despertado adicionalmente el interés de investigar la viscoelasticidad esplénica y su posible relación con el desarrollo de la hipertensión portal. La correlación entre el aumento de la dureza del bazo y el gradiente de presión de las venas hepáticas (GPVH) ha mostrado resultados promisorios para la detección de hipertensión portal grave y la presencia o ausencia de várices esofágicas.
Los estudios experimentales hechos con RM en animales por Nedredal et al. y por Yin et al.24,25 encontraron que hay una correlación significativa entre la dureza del bazo medida con ERM y el GPVH. Por su parte, Talwalkar et al., en un estudio preliminar en 38 pacientes con ECH, demostraron una correlación significativa entre la dureza del bazo y la del hígado, con aumento de la dureza esplénica en los estadios más avanzados de la fibrosis hepática (fig. 3h). Una dureza media de ≥10.5kPa ha sido referida como marcador de várices esofágicas de alto grado24,25,28.
La mayoría de dichos estudios se han basado en la medición de la dureza o rigidez del hígado y bazo. Recientemente Ronot et al. utilizaron una técnica de ERM en 3 dimensiones (ERM3D) con la que midieron 3parámetros: la dureza y, además, la elasticidad y la viscosidad del bazo. Concluyeron que la ERM3D es útil para: a) estimar en forma no invasiva el aumento en el GPVH, b) detectar várices esofágicas de alto riesgo y c) reconocer la hipertensión portal avanzada29. Asimismo, Shin et al. encontraron una correlación lineal con el grado endoscópico de várices esofágicas utilizando las técnicas de ERM3D30. Los trabajos anteriores constituyen un progreso en el conocimiento de la hipertensión portal y, si bien no reemplazan a la endoscopia ni a la medición del GPVH, representan un avance que puede ser útil para la selección de los pacientes que requieran tratamiento, por lo que debe continuar siendo investigada23.
EsteatosisOtra área de renovado interés en el diagnóstico por imagen paramétrica ha sido el diagnóstico de la esteatosis. El interés en este campo ha sido propiciado por el aumento de la obesidad en la población general, que es la causa más frecuente de infiltrado graso en el hígado, incremento que ha sido calificado como epidémico y que se estima que actualmente afecta a entre el 15 y el 30% de la población mundial. En nuestro país estudios del año 2008 la cifraban en el 14% y referían que la prevalencia puede alcanzar hasta el 45% en la población hispánica radicada en los EE. UU.33.
Se estima también que existirá un fuerte incremento en la prevalencia del HGNA en las próximas décadas, lo que dará lugar a un grave problema de salud pública3.
El diagnóstico de esteatosis por métodos de imagen puede realizarse con US, TC y RM. El más utilizado es el US en tiempo real, debido a que es también el método más accesible. La información de este método es, sin embargo, cualitativa y se informa en «grados» que no son medibles. El US tiene poca reproducibilidad interobservador. Su carácter operador dependiente lo hace poco confiable para el seguimiento cuando los estudios son hechos por diferentes personas, con equipos y transductores diferentes.
La TC simple es más precisa, pues proporciona información cuantitativa en unidades Hounsfield. La esteatosis suele diagnosticarse incidentalmente con este método en el curso de un estudio realizado por otra indicación. La radiación ionizante limita su indicación con el solo propósito de diagnóstico y no es recomendable utilizarla para seguimiento de la esteatosis.
La espectroscopia por RM es hoy la técnica más precisa para cuantificar lípidos en el hígado. Se informa que, con equipos de 3 T, puede tener una exactitud del 100% para un valor de corte de concentración de grasa del 7.48%33,62. Sin embargo, la complejidad de la espectroscopia limita su empleo rutinario.
En la práctica cotidiana se utilizan las técnicas que analizan el fenómeno del desplazamiento químico. Son sólidas, reproductibles y cuantitativas. El resultado se informa numéricamente en porcentaje de infiltración de grasa31,32,58,63,64. El desarrollo de un mapa paramétrico en color facilita observar la cantidad y la distribución de la grasa en el parénquima38. Esta técnica puede incluso identificar grasa en el interior de algunos tumores del hígado.
La RM es también un método preciso para el seguimiento de pacientes con HGNA. La cuantificación de esteatosis puede hacerse en forma rutinaria cuando se está realizando una RM del hígado por otra causa, o puede realizarse como un protocolo multiparamétrico específico como el que hemos descrito.
Es un hecho conocido el que la esteatosis simple puede permanecer estable y no modificarse en el curso del tiempo; sin embargo, del 10 al 20% de los pacientes con esteatosis simple evolucionan a EHNA y del 10 al 15% de estos podrán evolucionar a cirrosis61. El riesgo de desarrollar hepatocarcinoma es también mayor en los pacientes con cirrosis63,64.
Una pregunta importante es si la RM puede diferenciar la esteatosis simple de la EHNA en los pacientes con HGNA. Algunos autores han señalado que la EHNA puede identificarse en sus etapas iniciales si se combina el estudio de cuantificación de grasa con la ERM. Esto es debido a que la esteatosis simple no altera la dureza del hígado; en cambio, el desarrollo de fibrosis que ocurre en la EHNA sí aumenta la dureza y puede identificarse al combinar los estudios paramétricos de grasa y ERM13,16,59,61,65. Se ha informado que incluso la inflamación que ocurre en las etapas iniciales de EHNA puede aumentar la dureza y ayudar a identificar esteatohepatitis aún antes de aparecer la fibrosis66.
Otra indicación para la cuantificación de esteatosis está en el protocolo de selección de donadores para trasplante hepático59: un infiltrado mayor de 20% descarta al hígado donador67.
La principal limitación para el diagnóstico de esteatosis por medio de la técnica de desplazamiento químico es la coexistencia de hierro y grasa en el parénquima hepático, debido a que se reduce la señal y puede falsear los resultados; de ahí la importancia de cuantificar este elemento en el estudio multiparamétrico y utilizar protocolos de corrección: se recomienda el empleo rutinario de la técnica de Dixon multiecos.
HepatosiderosisLa medición de hierro con las diversas técnicas de RM ha mostrado tener resultados por lo menos similares a los de la biopsia hepática, con la ventaja para el paciente de ser no invasiva. La cuantificación de hierro con RM tiene una baja variabilidad interestudio, por lo que es un examen confiable y una herramienta valiosa para la evaluación del resultado de los tratamientos de quelación; es también preferida por los pacientes en substitución de una biopsia periódica para seguimiento68.
Duración del examen, protocolos y costo de la elastografía por resonancia magnéticaEn muchas publicaciones y conferencias se señala que la ERM es un estudio caro.
Esto es cierto cuando la elastografía se añade a un protocolo de RM completa del hígado, simple y con gadolinio que, de por sí, tiene un costo elevado.
En cambio, el costo se reduce considerablemente si se realiza como un estudio específico dirigido a investigar solamente fibrosis, grasa o hierro.
El protocolo multiparamétrico utilizado en nuestro departamento se realiza en un tiempo de 25 min en forma similar a la que que ha sido informada por otros autores en la literatura22,44.
En nuestro servicio existen 3protocolos específicos diferentes que pueden realizarse de acuerdo con la necesidad clínica en cada paciente:
- a)
solo elastografía;
- b)
elastografía y lípidos y
- c)
protocolo multiparamétrico de elastografía, cuantificación de lípidos y hierro.
Dichos protocolos son aplicables no solamente para el diagnóstico, sino también para el seguimiento de los pacientes durante el tratamiento44. La realización de estudios de RM específicos permite reducir significativamente el costo y hacerlos más accesibles para el paciente y para la institución.
ConclusionesLa ERM es un método eficaz que proporciona al gastroenterólogo y al hepatólogo información más amplia y precisa para el diagnóstico de la fibrosis del hígado. Una de sus mayores ventajas es la de poder realizar, en la misma sesión, secuencias de RM para el diagnóstico y la cuantificación de fibrosis, esteatosis y hepatosiderosis, lo cual la convierte en un procedimiento de diagnóstico multiparamétrico que tiene excelente concordancia con la biopsia hepática. La determinación precisa del grado de fibrosis en los enfermos con virus de la hepatitis C y B es hoy un elemento indispensable para seleccionar y dar prioridad a los enfermos que puedan requerir tratamientos antivirales. El incremento epidémico en las enfermedades metabólicas y el HGNA otorga también a la ERM una importante indicación en la práctica clínica. La posibilidad de detectar cambios tempranos de EHNA debe ser investigada con más estudios, pero existen ya informes de que el aumento de dureza del hígado en pacientes con HGNA puede revelar la presencia de fibrosis temprana y aun de estados inflamatorios que la precedan en el desarrollo de la EHNA.
La adición de 2secuencias anatómicas en nuestro protocolo enriquece la información, al permitir detectar alteraciones morfológicas del hígado y los órganos del abdomen superior. La información anatómica y funcional aportada por este estudio es útil para la valoración y el seguimiento de la evolución de las ECH. La mayor innovación del protocolo multiparamétrico descrito es la obtención del diagnóstico y la cuantificación de fibrosis, esteatosis y hepatosiderosis durante el mismo estudio, en un tiempo de 25 min, que resulta clínica y económicamente viable para el paciente y para la institución.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este estudio.
Conflicto de interesesM. Stoopen-Rometti, E.R. Encinas-Escobar, C.R. Ramirez-Carmona, E. Wolpert-Barraza, E. Kimura-Hayama, L.A. Sosa-Lozano, Y. Kimura-Fujikami, J.A. Saavedra-Abril y A. Loaeza-del Castillo declaran no tener ningún conflicto de intereses por la realización de este trabajo.
R. Favila es especialista en aplicaciones avanzadas de RM para GE Healthcare.
A las doctoras Rocío Perez Johnston y Véronique Barois Boullard por la revisión del manuscrito.