Desde la publicación de las guías de dispepsia 2007 de la Asociación Mexicana de Gastroenterología ha habido avances significativos en el conocimiento de esta enfermedad. Se realizó una revisión sistemática de la literatura en PubMed (01/2007 a 06/2016) con el fin de revisar y actualizar las guías 2007 y proporcionar nuevas recomendaciones basadas en evidencia. Se incluyeron todas las publicaciones en español e inglés, de alta calidad. Se redactaron enunciados que fueron votados utilizando el método Delphi. Se estableció la calidad de la evidencia y la fuerza de las recomendaciones según el sistema GRADE para cada enunciado. Treinta y un enunciados fueron redactados, votados y calificados. Se informan nuevos datos sobre definición, clasificación, epidemiología y fisiopatología. La endoscopia debe realizarse en dispepsia no investigada cuando hay datos de alarma o falla al tratamiento. Las biopsias gástricas y duodenales permiten confirmar infección por Helicobacter pylori y excluir enfermedad celiaca, respectivamente. Establecer una fuerte relación médico-paciente, cambios en la dieta y en el estilo de vida son útiles como medidas iniciales. Los bloqueadores H2, inhibidores de la bomba de protones, procinéticos y fármacos antidepresivos son efectivos. La erradicación de H.pylori puede ser eficaz en algunos pacientes. Con excepción de Iberogast y rikkunshito, las terapias complementarias y alternativas carecen de beneficio. No existe evidencia con respecto a la utilidad de prebióticos, probióticos o terapias psicológicas. Los nuevos enunciados proporcionan directrices basadas en la evidencia actualizada. Se presenta la discusión, el grado y la fuerza de la recomendación de cada uno de ellos.
Since the publication of the 2007 dyspepsia guidelines of the Asociación Mexicana de Gastroenterología, there have been significant advances in the knowledge of this disease. A systematic search of the literature in PubMed (01/2007 to 06/2016) was carried out to review and update the 2007 guidelines and to provide new evidence-based recommendations. All high-quality articles in Spanish and English were included. Statements were formulated and voted upon using the Delphi method. The level of evidence and strength of recommendation of each statement were established according to the GRADE system. Thirty-one statements were formulated, voted upon, and graded. New definition, classification, epidemiology, and pathophysiology data were provided and include the following information: Endoscopy should be carried out in cases of uninvestigated dyspepsia when there are alarm symptoms or no response to treatment. Gastric and duodenal biopsies can confirm Helicobacter pylori infection and rule out celiac disease, respectively. Establishing a strong doctor-patient relationship, as well as dietary and lifestyle changes, are useful initial measures. H2-blockers, proton-pump inhibitors, prokinetics, and antidepressants are effective pharmacologic therapies. H.pylori eradication may be effective in a subgroup of patients. There is no evidence that complementary and alternative therapies are beneficial, with the exception of Iberogast and rikkunshito, nor is there evidence on the usefulness of prebiotics, probiotics, or psychologic therapies. The new consensus statements on dyspepsia provide guidelines based on up-to-date evidence. A discussion, level of evidence, and strength of recommendation are presented for each statement.
La dispepsia es un complejo sintomático que se presenta con elevada frecuencia en la población general1. Se define como la presencia de malestares crónicos y recurrentes en el epigastrio, entre los que se incluyen una amplia variedad de síntomas como dolor, ardor, distensión, saciedad temprana, plenitud, eructos, náusea o vómito que pueden ser continuos o intermitentes2. Este síndrome puede ser la manifestación de diversas enfermedades orgánicas, sistémicas o metabólicas (dispepsia orgánica o secundaria) o no tener una causa evidente (dispepsia funcional). Así, la dispepsia abarca un grupo heterogéneo de enfermos cuyas manifestaciones clínicas son comunes pero causadas por mecanismos fisiopatológicos diferentes, por lo que pueden requerir un tratamiento diferenciado. Este padecimiento representa un reto para el médico debido a la frecuente sobreposición con otros síndromes digestivos, la errática respuesta terapéutica y la búsqueda constante de una estrategia de diagnóstico y tratamiento eficiente para cada sujeto.
En el año 2007 la Asociación Mexicana de Gastroenterología reunió a un grupo de gastroenterólogos que elaboraron las guías de diagnóstico y tratamiento de la dispepsia2-5. Desde entonces han surgido nuevos conceptos sobre esta enfermedad en áreas como la epidemiología (en especial en México), la fisiopatogenia, los nuevos criterios de diagnóstico, la correcta identificación de subgrupos que integran la dispepsia, el reconocimiento del traslape con otras enfermedades, el diagnóstico diferencial, los estudios de calidad sobre la efectividad de fármacos y otras alternativas de tratamiento. Todos estos avances justifican la generación de un documento que complemente las guías de diagnóstico y tratamiento de 2007. En marzo de 2016, la Asociación Mexicana de Gastroenterología convocó a los coordinadores de este consenso para que realizaran una revisión sobre los avances en diversos aspectos de la dispepsia, evaluaran la evidencia y elaboraran enunciados sobre el estado actual de este padecimiento.
El objetivo de este documento es presentar una revisión consensuada del estado actual de la dispepsia que permita actualizar las guías de diagnóstico y tratamiento publicadas en 2007, integrando las nuevas evidencias científicas publicadas a nivel mundial, con especial énfasis en los estudios realizados en México.
MétodosEn la elaboración de este consenso se utilizó el método Delphi6. Los coordinadores del consenso realizaron una revisión de la bibliografía utilizando como criterios de búsqueda las palabras «dyspepsia», «functional dyspepsia» y «non-ulcer dyspepsia», combinados con los siguientes términos: «epidemiology», «incidence», «prevalence», «pathophysiology», «inflammation», «microbiota», «diagnosis», «differential diagnosis», «treatment», «therapy», «management», «review», «guidelines» y «meta-analysis» así como los términos equivalentes en español. La búsqueda se realizó en PubMed de enero de 2007 a junio de 2016. Se incluyeron todas las publicaciones en inglés y español. Se dio preferencia a los consensos, guías, revisiones sistemáticas y metaanálisis, pero no se limitó a este tipo de artículos. También se realizaron búsquedas electrónicas y manuales complementarias en los archivos de la REVISTA DE GASTROENTEROLOGÍA DE MÉXICO y en todas las publicaciones que los coordinadores consideraron relevantes hasta junio de 2016.
Luego de realizar la revisión en cada tema, se elaboraron una serie de enunciados que abordaran los principales aspectos de la enfermedad. Estos fueron enviados a todos los miembros del grupo de consenso para una primera votación anónima por vía electrónica cuyo voto se emitió como «de acuerdo» o «en desacuerdo» para cada enunciado. En caso de obtener un acuerdo igual o superior al 75%, se determinó que el enunciado podría quedar sin cambios para la siguiente ronda de votación. Los enunciados con 75% o más de desacuerdo se eliminaron del documento. Los enunciados con menos del 75% de acuerdo o menos del 75% de desacuerdo fueron replanteados por el coordinador de cada tema tomando en cuenta los comentarios emitidos por los participantes. Se realizaron 3 rondas de votación electrónica a distancia y una votación presencial llevada a cabo en Culiacán (Sinaloa, México) en junio de 2016. En la votación final, los votos se emitieron usando una escala de 4 puntos: a) totalmente de acuerdo; b) parcialmente de acuerdo; c) parcialmente en desacuerdo, y d) totalmente en desacuerdo.
Una vez que se contó con los enunciados finales consensuados, los coordinadores se dieron a la tarea de establecer el nivel de la evidencia que sustentaba cada enunciado y otorgar un grado de recomendación en los casos que aplicara, empleando el sistema Grading of recommendations, assessment, development and evaluation (GRADE)7. Este sistema surgió con el fin de superar las limitaciones de los sistemas previos, optimizando la evaluación de la calidad de la evidencia y la graduación de la fuerza de las recomendaciones, y fue utilizado en un consenso recientemente publicado, avalado por la Asociación Mexicana de Gastroenterología8. En el sistema GRADE la calidad de la evidencia no se establece solo por la metodología del estudio analizado, sino que se clasifica con base en el diseño utilizado para responder una pregunta específica que se ha planteado previamente7,9. Sobre estas bases, la calidad de la evidencia se define como «alta» cuando la publicación de nuevos resultados de estudios de investigación no modificará nuestra confianza en la estimación del efecto, «moderada» cuando la publicación de nuevos resultados de estudios de investigación puede modificar nuestra confianza en la estimación del efecto, «baja» cuando muy probablemente la publicación de nuevos resultados de estudios de investigación va a tener un efecto importante en nuestra confianza en la estimación del efecto, y «muy baja» cuando cualquier estimación del efecto es incierta. El sistema GRADE establece adicionalmente la fuerza de las recomendaciones en fuerte o débil, a favor o en contra de la intervención o del enunciado. Existe un código definido para expresar los resultados de este sistema, en el que se usan letras mayúsculas para hablar de la calidad de la evidencia, seguidas de un índice numérico para indicar la fuerza de la recomendación a favor o en contra de la intervención o enunciado7,9. El código del sistema GRADE se muestra en la tabla 1.
Clasificación de la calidad de la evidencia y de la fuerza de las recomendaciones de acuerdo con el sistema GRADE
| Calidad de la evidencia | Código |
|---|---|
| Alta | A |
| Moderada | B |
| Baja | C |
| Muy baja | D |
| Fuerza de la recomendación | Código |
|---|---|
| Fuerte a favor de la intervención | 1 |
| Débil a favor de la intervención | 2 |
| Débil en contra de la intervención | 2 |
| Fuerte en contra de la intervención | 1 |
A continuación se presentan los enunciados finales consensuados.
Definición, fisiopatología y epidemiología de la dispepsia en adultos1. La dispepsia es un síndrome que se define como la presencia de malestar en el epigastrio, crónico y recurrente, que integra diversos síntomas como dolor, ardor, distensión, saciedad temprana, plenitud, eructos o náuseaEl término dispepsia es quizá uno de los que causan mayor confusión en la gastroenterología, ya que frecuentemente se emplea en forma indistinta para referirse a la dispepsia funcional. Cabe recordar que la dispepsia propiamente dicha se refiere a un complejo sintomático y no a un diagnóstico. Aunque este concepto ha sido clarificado desde hace mucho tiempo, sigue siendo muy frecuente su uso inapropiado10,11. El grupo de consenso consideró importante establecer que el término dispepsia se refiere solo a un grupo de síntomas que posiblemente tengan un origen común. Esto podrá ayudar al mejor empleo de la nomenclatura sobre este trastorno. Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
Los síntomas dispépticos no permiten distinguir en forma confiable si su origen es orgánico o funcional. Este grupo de malestares suelen indicar la presencia de patología a nivel gastroduodenal, pero los síntomas por sí solos son una guía insuficiente para determinar la causa de los trastornos subyacentes12. El reto para el médico es estudiar en forma apropiada y sistematizada al enfermo con el fin de discriminar entre la presencia de enfermedades estructurales causantes de síntomas dispépticos de la sola presencia de dispepsia funcional. Al igual que en el enunciado anterior, el grupo de consenso consideró que el empleo correcto de estos términos es necesario para estandarizar la nomenclatura en este trastorno. Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
La dispepsia funcional se define por la presencia de llenura, plenitud, dolor o ardor epigástrico, sin evidencia de enfermedades orgánicas, metabólicas o sistémicas que expliquen su presencia13. En general, las enfermedades orgánicas o estructurales son clasificadas en términos de la morfología de los órganos, mientras que las enfermedades funcionales son clasificadas en relación a los síntomas y a la interpretación que los pacientes hacen de ellos14. Sin embargo, en las últimas dos décadas ha habido un cambio importante en el conocimiento de los mecanismos fisiopatológicos subyacentes que afectan la región gastroduodenal15,16. Se han descrito múltiples mecanismos moleculares, neuronales y celulares que interactúan con el micro y macro-ambiente para modificar la función gástrica e intestinal. Estos mecanismos se observan en muchos de los enfermos afectados por la dispepsia, pero no explican por sí mismos todos los casos. La definición más reciente establece que los trastornos funcionales digestivos son desórdenes de la interacción cerebro-intestino que generan síntomas causados por la combinación de cualquiera de los siguientes factores: motilidad alterada, hipersensibilidad visceral, alteraciones de la mucosa, de la función inmune y de la microbiota intestinal, así como del procesamiento del sistema nervioso central17. Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
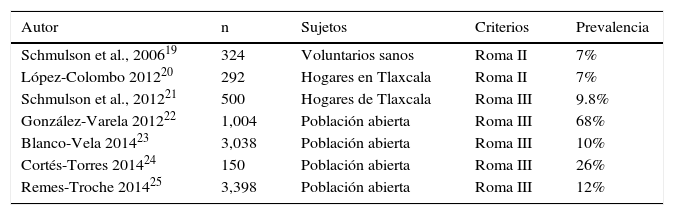
La dispepsia afecta al 25-40% de la población en alguna época de la vida y es el motivo del 3-5% de las consultas de primer contacto en los Estados Unidos de Norteamérica1. Sin embargo, el 50-60% de los sujetos con dispepsia no tienen lesiones estructurales que expliquen sus malestares. La prevalencia de dispepsia no investigada varía ampliamente de acuerdo con la población estudiada y la definición utilizada para establecer su presencia. Un metaanálisis que incluyó más de 300 estudios a nivel mundial estimó la prevalencia de la dispepsia no investigada en el 21%18. En México, la prevalencia de este trastorno se ha informado del 7 al 68%19-25 (tabla 2). El estudio poblacional más grande realizado hasta la fecha en nuestro país, que incluyó más de 3,000 sujetos en población abierta de 8 diferentes regiones de México, informó que la prevalencia de dispepsia no investigada fue del 12%26. Debido a que, por el momento, los criterios diagnósticos requieren la realización de endoscopia para establecer el diagnóstico de dispepsia funcional, no se cuenta con estudios que permitan conocer su prevalencia. Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
Estudios de prevalencia de la dispepsia realizados en población mexicana
| Autor | n | Sujetos | Criterios | Prevalencia |
|---|---|---|---|---|
| Schmulson et al., 200619 | 324 | Voluntarios sanos | Roma II | 7% |
| López-Colombo 201220 | 292 | Hogares en Tlaxcala | Roma II | 7% |
| Schmulson et al., 201221 | 500 | Hogares de Tlaxcala | Roma III | 9.8% |
| González-Varela 201222 | 1,004 | Población abierta | Roma III | 68% |
| Blanco-Vela 201423 | 3,038 | Población abierta | Roma III | 10% |
| Cortés-Torres 201424 | 150 | Población abierta | Roma III | 26% |
| Remes-Troche 201425 | 3,398 | Población abierta | Roma III | 12% |
De forma similar a lo que ocurre en el síndrome de intestino irritable, la dispepsia postinfecciosa se ha descrito como una entidad diferente con base en estudios retrospectivos que demostraron la existencia de un grupo de enfermos que desarrollaban síntomas dispépticos luego de haber presentado cuadros de gastroenteritis aguda. Estudios de cohorte han confirmado que el riesgo de presentar dispepsia se incrementa 5 veces luego de un año de haber tenido gastroenteritis aguda bacteriana27. Diversos gérmenes se han asociado al desarrollo de dispepsia postinfecciosa, pero destacan Salmonella spp., Escherichia coli O157, Campylobacter jejuni, Giardia lamblia y norovirus. Un metaanálisis reciente que incluyó 19 estudios de buena calidad informó que la prevalencia de dispepsia funcional luego de gastroenteritis infecciosa en adultos fue del 9.55% (RM: 2.54, IC95%: 1.76-3.65)28. Algunos factores que aumentan el riesgo de dispepsia postinfecciosa son el sexo femenino, la edad temprana, el tabaquismo y la psicomorbilidad asociada. Esta entidad se ha asociado a la presencia de focos de célulasT agregadas, linfocitos CD4+ disminuidos y cuentas aumentadas de macrófagos en el duodeno que persisten varios meses después de la infección aguda. A pesar de ser concebida como una entidad diferente, no existe tratamiento específico con utilidad confirmada para este trastorno. Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 90%. Parcialmente de acuerdo, 10%.
Desde hace más de dos décadas, los criterios diagnósticos basados en síntomas han intentado establecer el diagnóstico de los diferentes trastornos funcionales en forma positiva y no por exclusión. Sin embargo, en la dispepsia no investigada, la estrategia de diagnóstico aceptada consiste en una cuidadosa historia clínica y la identificación de signos y síntomas de alarma cuya presencia indica la realización de una endoscopia inmediata29. Aunque esta táctica es ampliamente aceptada, el valor de estos signos y síntomas de alarma dista mucho de ser óptimo. Ninguno de estos datos clínicos ha demostrado tener una alta precisión diagnóstica en forma individual30. Un metaanálisis que evaluó la utilidad de la endoscopia inmediata como estrategia de diagnóstico en la dispepsia no investigada en Asia encontró que los signos y síntomas de alarma tienen una utilidad muy limitada para diagnosticar cáncer31. Por otro lado, es posible detectar lesiones orgánicas en uno de cada 4 pacientes que cumplen con criterios de RomaIII para dispepsia funcional, por lo que se acepta que la sensibilidad y la especificidad de estos criterios son insuficientes32. Queda claro que es necesario hacer una cuidadosa valoración de los enfermos para detectar otros posibles factores asociados e indicadores potenciales de la presencia de organicidad. Por lo anterior, el diagnóstico de dispepsia funcional se puede sospechar clínicamente aplicando la nueva versión de los criterios de Roma, pero continúa siendo un diagnóstico de exclusión que requiere la realización de endoscopia29. Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 95%. Parcialmente de acuerdo, 5%.
El consenso RomaIII propuso dos cambios sustanciales en la definición de la dispepsia funcional. Por un lado, describió este trastorno con base en 4 síntomas principales (dolor, ardor, plenitud y saciedad) con el fin de incrementar la especificidad de este complejo sintomático. Por otro lado, estableció la subdivisión de este trastorno en dos subgrupos: el síndrome de dolor epigástrico caracterizado por dolor o ardor, y el síndrome de malestar (distress) posprandial en presencia de saciedad temprana y plenitud. Diversos estudios han sugerido que los factores de riesgo y la fisiopatogenia pueden ser diferentes en ambos subgrupos. Por ejemplo, la infección por Helicobacter pylori (H. pylori), la soltería, los trastornos del sueño y la depresión se asociaron al síndrome de malestar (distress) posprandial33. Otros estudios encontraron una mayor prevalencia de acomodación gástrica alterada e incremento de eosinófilos duodenales en el síndrome de dolor epigástrico34. Los estudios epidemiológicos confirmaron la presencia definida de ambos grupos, pero la separación no siempre fue clara debido a la gran sobreposición entre ellos, inclusive en población mexicana26,35. Estudios más recientes han demostrado que el reconocimiento de la inducción de síntomas por el consumo de alimentos permite reclasificar los subgrupos y reducir el traslape entre ellos36. Los criterios de RomaIV han sido ligeramente modificados, reconociendo que no solo el síndrome de malestar posprandial sino también el dolor y el ardor epigástrico pueden ser inducidos o empeorados por el consumo de alimentos. La identificación de los subtipos de dispepsia funcional ha promovido el reconocimiento de factores fisiopatológicos subyacentes distintos y, por lo tanto, la necesidad de un tratamiento diferenciado37. La evidencia que apoya este concepto se sigue acumulando y por el momento se acepta que el tratamiento inicial puede seleccionarse con base en el subgrupo. Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
La sobreposición de la dispepsia con estos padecimientos es evidente no solo por la frecuente coexistencia de síntomas en un mismo enfermo, sino por fenómenos fisiopatológicos compartidos (v.gr., estados postinfecciosos, inflamación de bajo grado o trastornos motores). En la práctica clínica, excluir síntomas como las pirosis, las regurgitaciones ácidas, el vómito o los malestares que desaparecen al evaluar los criterios clínicos de dispepsia funcional puede no solo ser artificial sino imposible34. Uno de cada 4 pacientes con dispepsia funcional muestra retraso en el vaciamiento gástrico y el 86% de los pacientes con gastroparesia cumplen con criterios clínicos de dispepsia funcional12. La línea que separa la dispepsia funcional de la gastroparesia no está claramente definida debido a la mala correlación entre el retraso en el vaciamiento gástrico y el patrón y la gravedad de los síntomas, así como la falta de estabilidad del retraso en el vaciamiento a lo largo del tiempo38,39. Los criterios de RomaIV reconocen la frecuente coexistencia de estos síntomas en un mismo paciente, pero los excluyen claramente de los criterios clínicos de dispepsia funcional con el fin de incrementar la especificidad de los mismos29. Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 85%. Parcialmente de acuerdo, 15%.
La erradicación del H. pylori ha demostrado en forma consistente que mejora los síntomas dispépticos en algunos pacientes con dispepsia funcional40-42. Múltiples estudios realizados en poblaciones asiáticas, europeas y americanas han evaluado el beneficio potencial de eliminar H.pylori en pacientes con dispepsia funcional y los resultados han sido positivos a favor del tratamiento. Un metaanálisis que incluyó 21 ensayos con más de 3,500 pacientes demostró una ganancia terapéutica consistente a favor de la erradicación al comparar con placebo, con un número necesario a tratar (NNT) de 1440. Un metaanálisis que incluyó 14 estudios clínicos controlados y aleatorizados, que contenían información sobre el efecto de la erradicación en los siguientes 12 meses, demostró mejoría significativa en los pacientes con dispepsia funcional tratados, en comparación con el grupo control (RM: 1.38; IC 95%: 1.18-1.62, p<0.0001)41. Un estudio demostró que el 82% de los pacientes que logran erradicar la bacteria presentan una respuesta completa o satisfactoria en la resolución de sus síntomas, en comparación con el 62.5% de aquellos con una infección persistente42. Sin embargo, los beneficios del tratamiento antimicrobiano deben sopesarse para cada caso en particular tomando en consideración tasas regionales de resistencia, costos y riesgos. Debe tomarse en cuenta que la mejoría de los síntomas al tratamiento de erradicación puede ocurrir hasta después de 6meses y aquellos casos con buena respuesta no deben seguir considerándose como parte de la dispepsia funcional. Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 95%. Parcialmente de acuerdo, 5%.
La endoscopia del aparato digestivo proximal permite reconocer directamente las lesiones causantes de la dispepsia como úlceras, erosiones o neoplasias. Sin embargo, solo una minoría de sujetos con dispepsia no investigada tienen lesiones significativas por endoscopia. Una revisión sistemática y metaanálisis que incluyó 9 estudios y más de 5,300 enfermos demostró que la esofagitis erosiva fue la anormalidad más frecuentemente detectada, seguida de úlcera péptica (prevalencia 13.4 y 8.0%, respectivamente)43. Siendo un procedimiento invasivo, costoso y que conlleva algunos riesgos, la aplicación de criterios de selección que permitan identificar a los sujetos que se beneficiarán más de una endoscopia es una conducta ampliamente aceptada. Como se comentó previamente, la detección de datos de alarma tiene una baja sensibilidad, pero una elevada especificidad para la detección de malignidad en sujetos con dispepsia44. Algunos estudios han demostrado que la endoscopia temprana puede ser una estrategia recomendable en poblaciones como la asiática, en la que los factores como la edad y los datos de alarma son poco confiables para detectar malignidad30. Aunque el rendimiento diagnóstico de la endoscopia en pacientes con síntomas persistentes o refractarios no ha sido establecido en nuestro medio, realizar el estudio de diagnóstico en este contexto es lo más recomendable en el momento actual, principalmente en pacientes no infectados por H.pylori45. Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
Las biopsias pueden establecer el diagnóstico definitivo en algunos pacientes con síntomas dispépticos y proporcionar información complementaria en otros. Considerando que la endoscopia diagnóstica se realiza frecuentemente en pacientes con dispepsia refractaria a tratamiento, obtener la mayor información posible durante el procedimiento debe ser una prioridad del médico. La American Gastroenterological Association (AGA) ha elaborado recomendaciones específicas para la correcta utilización de las biopsias esofágicas, gástricas y duodenales en pacientes sin lesiones identificables en la mucosa46,47, y el grupo de consenso consideró que estas pueden ser una guía útil en nuestro medio. La evidencia disponible hasta ahora indica que las biopsias tomadas del esófago y la unión esofagogástrica de aspecto normal muy probablemente no identifiquen anormalidades significativas ni impacten en el manejo clínico estos enfermos46,47. Ante la evidencia de que al menos un grupo de pacientes con dispepsia se puede beneficiar de la erradicación de la bacteria, tomar biopsias del cuerpo y antro aun cuando su aspecto sea normal puede ser de utilidad si se desconoce la posible infección por H.pylori, y esto cobra relevancia en el paciente que ha fallado a otros tratamientos46,47. La AGA no recomienda la toma de biopsias duodenales en ausencia de lesiones, si no existen otros síntomas o signos que incrementen el riesgo de detectar enfermedad celiaca46,47. Un metaanálisis de 15 estudios que informaron la prevalencia de enfermedad celiaca en pacientes con dispepsia demostró que la prevalencia de serología positiva y la enteropatía confirmada por biopsia fueron más frecuentes entre los sujetos dispépticos en comparación con controles, pero sin alcanzar una diferencia estadística importante48. Una revisión reciente ha reproducido estos hallazgos y detectó al menos un grupo de pacientes dispépticos con mayor riesgo para presentar enfermedad celiaca: mujeres jóvenes entre 20 y 37años de edad49. Más recientemente, algunas poblaciones específicas han mostrado una prevalencia elevada de enfermedad celiaca en sujetos con dispepsia50. Por otro lado, aunque existe poca evidencia en nuestro medio, al menos 3 estudios realizados en México han informado alta prevalencia de atrofia de vellosidades en pacientes con dispepsia estudiados con biopsia endoscópica en forma sistemática51, elevada frecuencia de infiltración linfocitaria en pacientes con dispepsia refractaria52 y dos veces mayor detección de diagnósticos específicos utilizando las biopsias duodenales en sujetos con dispepsia en comparación con controles53. Algunos expertos han sugerido que la toma rutinaria de biopsias duodenales puede ser de utilidad como parte del algoritmo de diagnóstico en estos enfermos50. Considerando la evidencia actual, el grupo de consenso no recomienda el uso rutinario de las biopsias duodenales en pacientes con dispepsia, pero sugiere considerar el uso de esta herramienta de diagnóstico en sujetos que han tenido falla a un tratamiento inicial, individualizando cada caso. Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 75%. Parcialmente de acuerdo, 20%. Totalmente en desacuerdo, 5%
No existe un acuerdo general acerca de qué se puede considerar como normal en el examen endoscópico de un adulto con síntomas dispépticos. Algunos expertos consideran que la gastritis (que es un término histológico que no debe usarse como sinónimo de dispepsia), sin erosiones, úlceras o neoplasias asociadas, forma parte del espectro clínico de la dispepsia funcional54. Lo que sí es muy claro es que la detección de lesiones estructurales (erosiones, úlceras o neoplasias) en cualquier segmento del aparato digestivo proximal por endoscopia tiene impacto en el diagnóstico, el pronóstico y el tratamiento de la enfermedad45. El valor y el impacto del reconocimiento de lesiones mínimas en el manejo integral del paciente con dispepsia son desconocidos. La concordancia interobservador es baja, sin importar la experiencia del endoscopista, para la detección de lesiones cuando solo se basa en el aspecto y coloración de la mucosa55-57. Hasta no contar con sistemas de clasificación claramente definidos y estandarizados, los hallazgos como enrojecimiento, palidez, nodularidad, incremento del patrón vascular y puntilleo eritematoso carecen de un valor claro en el manejo integral del paciente con síntomas dispépticos y no descartan el diagnóstico de dispepsia funcional. Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
Los síntomas dispépticos por sí solos no permiten discernir si existen causas orgánicas o se trata de un trastorno funcional. El reto para el médico es identificar características clínicas y factores de riesgo que permitan sospechar trastornos estructurales u orgánicos subyacentes. A pesar de que el ultrasonido abdominal es un método accesible, es notable la escasa información acerca de su utilidad en el proceso diagnóstico del paciente con dispepsia. Un estudio evaluó la utilidad diagnóstica de la endoscopia y el ultrasonido abdominal en 709 pacientes atendidos en forma consecutiva por diversos trastornos funcionales (RomaIII)58. El diagnóstico de enfermedad funcional se confirmó en el 61%, y el 39% tuvieron alguna enfermedad orgánica. Existen criterios consensuados para establecer la presencia de retraso en el vaciamiento gástrico y gastroparesia, que pueden ser útiles en el diagnóstico diferencial de sujetos con dispepsia59. La principal utilidad de la tomografía radica en la detección de lesiones orgánicas y cambios anatómicos asociados o causantes de los síntomas. Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
Todos estos métodos diagnósticos han demostrado alteraciones sensitivas (menor umbral sensitivo, plenitud temprana, saciedad precoz o dolor epigástrico) y motoras (retraso en el vaciamiento o alteraciones de la acomodación) más frecuentemente en casos con dispepsia en comparación con controles60-62. Sin embargo, algunos de estos métodos no han sido estandarizados, no muestran correlación entre los diversos parámetros funcionales y no han podido establecer asociación con los síntomas ni con la respuesta al tratamiento, por lo que no se recomienda su empleo rutinario en la práctica diaria. Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
Un biomarcador es un indicador biológico objetivo de función normal, de procesos patogénicos o de respuestas farmacológicas ante una intervención terapéutica, y su utilidad práctica potencial ha sido investigada en otros trastornos funcionales8. El objetivo principal de esta investigación es poder establecer el diagnóstico de dispepsia funcional en forma directa, omitiendo el largo y costoso proceso diagnóstico de exclusión. Con referencia a la dispepsia, existen estudios que han evaluado múltiples biomarcadores como pepsinógeno, polimorfismos genéticos, interleucinas, hipersensibilidad visceral, infección por H.pylori, eosinofilia y linfocitosis duodenal, entre otros63-68. Sin embargo, hasta la fecha no existen biomarcadores que permitan establecer el diagnóstico directo de dispepsia funcional. Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
La dispepsia funcional es un padecimiento de curso benigno en el que la mitad de los enfermos muestran mejoría o desaparición de sus síntomas con el paso del tiempo69. La dispepsia funcional no se asocia a un incremento en la mortalidad en la comunidad70. Por lo anterior, los esfuerzos deben encaminarse a lograr un adecuado control de los síntomas y a mejorar la calidad de vida o revertir el deterioro que frecuentemente se observa en estos enfermos26. Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
Asegurarle al paciente que se trata de un padecimiento benigno ha mostrado ser útil en el síndrome de intestino irritable, aunque no hay estudios que confirmen lo mismo en la dispepsia funcional. Se ha sugerido que modificar el estilo de vida puede mejorar los síntomas en la dispepsia funcional71. Un trabajo realizado en Suecia demostró que existía una correlación entre cambios en el estilo de vida y la disminución sintomática con el tiempo, y uno de los factores significativamente asociados a la mejoría fue la suspensión del tabaquismo72. Se ha descrito que una gran proporción de pacientes con trastornos funcionales digestivos, incluyendo la dispepsia funcional, informan que sus síntomas son desencadenados por la ingestión de ciertos alimentos, y aunque las encuestas dietéticas han demostrado que el consumo de alimentos es similar entre pacientes con dispepsia funcional y controles, los pacientes dispépticos ingieren una menor cantidad de grasa73. Esta asociación sugiere que la dieta juega algún papel en el tratamiento de la dispepsia funcional, aunque la relación es difícil de definir. Otro factor involucrado en el desarrollo de los síntomas son las situaciones de estrés, las alteraciones psicológicas y los trastornos psiquiátricos. Los estudios epidemiológicos han mostrado una mayor prevalencia de ansiedad y depresión en la dispepsia funcional al compararla con controles sanos, así como un papel importante de los trazos de personalidad, eventos estresantes previos en la vida y alteraciones del sueño74,75. Una fuerte relación médico-paciente es importante como parte del manejo con el fin de profundizar en eventos personales que pudieran influir en la sintomatología. Nivel de la evidencia y fuerza de la recomendación GRADE: C1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%
Dada la fisiopatología tan compleja de los trastornos funcionales digestivos, incluyendo la dispepsia funcional, la posibilidad de respuesta al placebo es alta. Una revisión sistemática de Cochrane publicada en 2006, en pacientes en los cuales se aplicaba aún el término «dispepsia no ulcerosa», la respuesta sintomática al placebo fue del 30-40%76. Estudios posteriores informaron mejoría en el 19-49% de los casos de dispepsia funcional, y una revisión de Cochrane estimó una respuesta al placebo del 25%, ligeramente inferior a la lograda con inhibidores de la bomba de protones (34%)77. No se han analizado en forma sistemática los factores de respuesta, ni existen estudios controlados de placebo versus no tratamiento. Se cree que existe un aparente efecto terapéutico al realizar endoscopia en la que no se encuentran hallazgos anormales1,12. El grupo de consenso no recomienda administrar placebo en el tratamiento de los enfermos dispépticos, pero es importante saber que algunos pacientes pueden informar mejoría sin recibir medicamentos activos. Esto tiene especial importancia en el diseño de estudios que evalúen opciones terapéuticas en esta enfermedad. Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 85%. Parcialmente de acuerdo, 5%. Parcialmente en desacuerdo 5%. Totalmente en desacuerdo, 5%.
Como se ha descrito previamente, con mucha frecuencia los pacientes con uno o varios trastornos funcionales digestivos informan el inicio o empeoramiento de sus síntomas al consumir algunos alimentos71,73,78, particularmente grasa y condimentos, así como alimentos con epinefrina y norepinefrina79, aunque la relación con cafeína, lactosa, fructosa o trigo no ha sido establecida de forma inequívoca como en el síndrome de intestino irritable. Algunos trabajos han demostrado asociación entre ciertos alimentos y un síntoma en particular, de manera que la sensación de llenura se ha asociado al consumo de frijoles, harinas, chocolate, trigo, comida frita, cítricos y carnes rojas; la distensión se ha relacionado con bebidas carbonatadas, cebollas y algunas frutas como plátano; y el dolor epigástrico con chocolate, cafeína, pimiento y cebolla78. En pacientes con dispepsia, la ingestión oral de grasa aumenta en forma significativa la presencia de náusea y dolor, comparada con la ingestión de glucosa en comparación con sanos, y se ha podido establecer que los síntomas se asocian al aumento en los niveles de colecistocinina80. Un trabajo que evaluó cambios en los síntomas relacionados con una dieta específica, utilizando un cuestionario durante 7días, mostró mejoría tras la reducción en el consumo diario de grasa y con ayuno nocturno más prolongado81. A pesar de esta probable asociación, existe poca evidencia científica de su utilidad82. Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 95%. Parcialmente de acuerdo, 5%.
Existen múltiples medicamentos de acción local, que incluyen diversos tipos de antiácidos solos y en combinación, y otros a base de alginato, bismuto y sucralfato, así como medicamentos que tienen efecto sobre la formación de gas, como la simeticona y el carbón activado. Ninguno de estos ha mostrado ser más efectivo que placebo en el tratamiento de la dispepsia funcional. Los antiácidos y el alginato no cuentan con estudios adecuados1,12. En un metaanálisis de 5 estudios que incluyó 311 pacientes, el bismuto no fue mejor que placebo83. El sucralfato tampoco fue mejor que placebo en el mismo metaanálisis con 2 estudios controlados83, y no hubo diferencia al comparar ambos medicamentos entre sí en 29 pacientes84. Un trabajo que evaluó 276 pacientes con dispepsia funcional (RomaIII) demostró que la combinación de simeticona, carbón activado y óxido de magnesio (llamada Carbosymag en Francia) era superior a placebo, reduciendo la intensidad del dolor epigástrico, la plenitud posprandial y la distensión subjetiva (p<0.05), con un NNT de 7, logrando una reducción global de síntomas dispépticos del 70%85. Sin embargo, no hay estudios similares posteriores que apoyen estos hallazgos, por lo que la evidencia es insuficiente para recomendar su uso. Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
Entre los mecanismos fisiopatológicos de la dispepsia funcional se ha descrito que la hipersensibilidad duodenal al ácido clorhídrico y la depuración alterada del mismo son capaces de ocasionar síntomas, particularmente el síndrome de dolor epigástrico. Los agentes antisecretores como los antagonistas H2 (AH2) y los inhibidores de bomba de protones (IBP) bloquean la secreción normal de ácido gástrico y disminuyen los síntomas asociados. La revisión de Cochrane con 10 estudios y 3,347 pacientes demostró superioridad de ambos grupos de medicamentos en comparación con placebo. Los IBP obtuvieron una respuesta sintomática del 34 vs. el 25% del placebo, con un riesgo relativo (RR) de persistencia de síntomas de 0.87 (IC95%: 0.80-0.96) y un NNT de 10. Los AH2 tuvieron un RR de persistencia sintomática de 0.77 (IC95%: 0.65-0.92) y un NNT de 7. La mayoría de estudios incluidos en el metaanálisis usaron los criterios de RomaII77. Un subanálisis mostró que los IBP mejoraban solo el dolor o síntomas parecidos al reflujo. Un segundo metaanálisis86 informó una reducción del RR del 10.3% y un NNT de 14.6. La eficacia significativa varió de acuerdo al subtipo de la dispepsia, de manera que la entonces llamada «dispepsia tipo úlcera» tuvo una reducción del RR del 12.8%, la llamada «dispepsia tipo reflujo» una reducción del RR del 19.7% y sin beneficio en la «dispepsia tipo dismotilidad» ni en la dispepsia inespecífica87. Un estudio japonés con rabeprazol mostró mejoría independientemente del subtipo de la dispepsia88, y los estudios subsecuentes, un efecto de mejoría promedio con IBP de 32-68%1,12. Existen pocos estudios posteriores con AH2, pero un trabajo más reciente con nizatidina obtuvo una ganancia terapéutica del 60% sobre el placebo, incluyendo efecto benéfico sobre la plenitud posprandial, la saciedad temprana y el vaciamiento gástrico89. Nivel de la evidencia y fuerza de la recomendación GRADE: A1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 95%. Parcialmente de acuerdo, 5%.
Otro mecanismo asociado a los síntomas en la dispepsia funcional es la presencia de anormalidades en el vaciamiento gástrico y una relajación receptiva fúndica anormal después de consumir alimentos. Diversos procinéticos han sido probados en la dispepsia funcional. Un metaanálisis que incluyó 24 estudios y que analizó el efecto de la cisaprida, la domperidona y la itoprida versus placebo encontró una reducción de síntomas del 33% y un NNT de 676. Sin embargo, este trabajo ha sido criticado por incluir primordialmente estudios pequeños, con dispepsia de la variedad dismotilidad. Una revisión posterior de Cochrane que incluyó 19 estudios controlados con un total de 3,178 pacientes mostró una reducción del RR de persistencia de síntomas del 33% (IC95%: 18-45%), pero la mayor parte de los estudios incluidos evaluaba cisaprida, la cual ya había sido retirada del mercado en los Estados Unidos de Norteamérica al momento de la publicación del metaanálisis77. Al analizar cada procinético por separado la efectividad a corto y mediano plazo es buena, pero la efectividad a largo plazo se encuentra limitada por efectos secundarios. La cisaprida, un agonista 5-HT4, mostró ser mejor que placebo, pero fue retirada de la mayor parte de los mercados debido a su efecto sobre el segmento QT del electrocardiograma90. La metoclopramida y la domperidona son antagonistas de receptores D2 de dopamina, que actúan bloqueando a la dopamina en el sistema nervioso entérico con un consecuente aumento del vaciamiento y la motilidad gástricos. Ambas drogas también actúan a nivel central suprimiendo náusea y vómito79. Tanto metoclopramida como domperidona han mostrado ser superiores a placebo en estudios controlados y metaanálisis, con duraciones de tratamiento de entre 4 y 6semanas. Sin embargo, su uso se asocia a efectos secundarios. La metoclopramida puede ocasionar varios síntomas extrapiramidales al inhibir el sistema dopaminérgico central. A corto plazo puede causar temblores o reacciones distónicas agudas, a mediano plazo hiperprolactinemia y galactorrea, y a mediano y largo plazo puede causar efectos potencialmente irreversibles como discinesia tardía. La domperidona requiere un permiso especial para su uso en los Estados Unidos de Norteamérica79, y en forma similar a la metoclopramida, puede ocasionar hiperprolactinemia. A diferencia de metoclopramida, no cruza la barrera hematoencefálica por lo que no ocasiona efectos neurológicos. La levosulpirida es otro antagonista de los receptores D2 de dopamina derivado de benzamidas, con una efectividad similar a cisaprida, que logró una mejoría sintomática de 33% en un estudio aleatorizado que incluyó 140 pacientes91. Posee un efecto antidepresivo leve, por lo que ha sido incluido en el grupo de los antidepresivos tricíclicos en algunos metaanálisis77, y también puede asociarse a hiperprolactinemia en algunos casos. La itoprida es un procinético de segunda generación que mostró mejoría sintomática progresiva en las primeras 4semanas de tratamiento en los estudios faseii, pero con resultados conflictivos en los estudios faseiii92. Un metaanálisis que incluyó 9 ensayos clínicos controlados comparativos con placebo encontró superioridad de la itoprida en lograr mejoría global (RR: 1.11; IC95%: 1.03-1.19; p=0.006), plenitud posprandial (RR: 1.21; IC95%: 1.03-1.44; p=0.02) y saciedad temprana (RR: 1.24; IC95%: 1.01-1.53; p=0.04)93. La mosaprida fue evaluada en un metaanálisis con 13 ensayos clínicos controlados comparativos con placebo, observando resultados inconsistentes, sin mejoría al usar criterios de RomaIII94. La cinitaprida y la cleboprida no han sido evaluadas en estudios controlados comparativos con placebo en la dispepsia funcional y tienen efectos secundarios extrapiramidales importantes, particularmente cleboprida. La eritromicina es un antibiótico macrólido con actividad agonista sobre motilina que es útil en la gastroparesia que, sin embargo, no ha mostrado ser eficaz en la dispepsia funcional95. El tegaserod, un agonista 5-HT4 utilizado particularmente en el estreñimiento crónico, se asoció a mejoría sintomática en mujeres con dispepsia funcional96, pero su perfil de seguridad cardiovascular ha limitado su uso. La acotiamida es un inhibidor de acetilcolinesterasa que acelera el vaciamiento gástrico, ha sido aprobada en Japón para su uso en la dispepsia funcional97 y se encuentra en estudios faseiii en los Estados Unidos de Norteamérica pero aún no ha sido aprobada por la Food & Drug Administration98. Un estudio que evaluó la utilidad de acotiamida en la dispepsia funcional mostró mejoría sintomática en comparación con placebo (52 vs. 35%, respectivamente; p<0.001), eliminación de síntomas relacionados con alimentos luego de 4semanas (15.3 vs 9%, respectivamente; p=0.004), mejoría en el reflejo de acomodación gástrica (21.7 vs 4.4%, respectivamente; p=0.012) y aumento en la tasa de vaciamiento gástrico (35 vs 11%, respectivamente)99. La acotiamida, al igual que otros procinéticos, tiene un mayor efecto en la plenitud posprandial y en la saciedad temprana, pero no en la epigastralgia100. El NNT es de 6 para lograr mejoría sintomática y de 16 para la eliminación de síntomas98. Otra línea de investigación son los análogos de ghrelina, un péptido gastrointestinal relacionado con la motilidad y con la regulación del apetito. Varios análogos de ghrelina han sido evaluados en la dispepsia funcional, incluyendo ulimorelina (TZP-101), TZP-102 y relamorelina (RM-131), pero la evidencia es conflictiva e insuficiente79. Nivel de la evidencia y fuerza de la recomendación GRADE: A1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
Se ha informado que hasta el 5% de los casos de dispepsia en la comunidad son debidos a infección por H.pylori101. Diversas guías clínicas han sugerido que la mejor estrategia en la dispepsia no investigada es «buscar y tratar» la bacteria, particularmente en pacientes jóvenes sin síntomas de alarma, aunque la evidencia proviene de países con prevalencias bajas de esta infección102,103. En nuestro país, donde la prevalencia es mayor al 70%, esta estrategia es controversial, ya que se ha descrito que solo entre el 10 y el 15% de los pacientes infectados con H.pylori desarrollan síntomas. Esta estrategia es igual de efectiva que la endoscopia como medida para reducir la severidad de la dispepsia, pero más costo-efectiva. La endoscopia, por su parte, puede descartar organicidad, pero también puede ejercer un efecto placebo, particularmente en pacientes con ansiedad. En la dispepsia funcional, esta estrategia diagnóstica y terapéutica es controversial. La evidencia sugiere que uno de cada 14 pacientes con dispepsia funcional e infección por H.pylori obtiene beneficio sintomático tras la erradicación. En una revisión sistemática y metaanálisis de 17 estudios que incluyó 3,566 pacientes, el RR de persistencia de síntomas con terapia de erradicación fue 0.90 (IC95%: 0.86-0.94), con un 10% de reducción del riesgo y un NNT de 1577. Un metaanálisis más reciente de 14 estudios confirmó que la erradicación fue superior al placebo y al manejo convencional para obtener mejoría sintomática41. Cuatro estudios evaluaron el efecto de erradicación sobre los síntomas individuales de la dispepsia funcional, y en tres de los cuatro se observó un efecto significativo sobre el dolor y el ardor epigástrico, pero no en la saciedad temprana o en la plenitud posprandial104-107. Solo uno de los tres estudios reportó mejoría tanto en los síntomas de dismotilidad como en dolor106. En los trabajos con respuesta sintomática completa, esta se ha informado como persistente hasta por 12meses después del tratamiento41. Un estudio más reciente que evaluó adultos con dispepsia funcional (RomaIII), el estudio HEROES, comparó la terapia triple versus omeprazol y placebo107. El desenlace principal (>50% de mejoría sintomática a 12meses) fue del 49 vs. el 36.5% a favor de la erradicación. Un porcentaje mayor del grupo de erradicación también obtuvo mejoría sintomática parcial (78 vs 67.5%, respectivamente; p<0.001). Al analizar grupos poblacionales se ha descrito una mayor respuesta sintomática en las poblaciones con alta prevalencia, y aunque las cepas son usualmente diferentes, un metaanálisis reciente demostró una proporción similar de mejoría en Asia, Europa y América41. En resumen, aunque la evidencia demuestra que el tratamiento de erradicación puede ser útil, no se han identificado factores predictores de respuesta que permitan detectar qué subgrupo de pacientes se beneficiarán de esta alternativa de tratamiento. Nivel de la evidencia y fuerza de la recomendación GRADE: A1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 95%. Parcialmente de acuerdo, 5%.
Se ha descrito un papel importante del eje sistema nervioso central-sistema nervioso entérico en el procesamiento anormal central del dolor y en el desarrollo de hipersensibilidad visceral. Los antidepresivos tricíclicos (ATC) y los inhibidores selectivos de la recaptura de serotonina (ISRS) modulan los niveles de serotonina y, por tanto, tienen un efecto sobre la motilidad y la nocicepción visceral108. Por muchos años fueron considerados como terapia de segunda o tercera línea, particularmente en pacientes con ansiedad o depresión asociadas a la dispepsia. En la actualidad se reconoce que el beneficio que ofrecen ocurre independientemente de la presencia o no de comorbilidad psiquiátrica. Una revisión sistemática y metaanálisis de ansiolíticos y antidepresivos en trastornos funcionales digestivos concluyó que los antidepresivos fueron superiores a placebo en la dispepsia funcional en 4 de 13 artículos. Se incluyeron estudios con ATC, levosulpirida, anticolinérgicos y ansiolíticos. El RR de persistencia de síntomas con antidepresivos en general fue 0.55 (IC95%: 0.36-0.85)109. Otro metaanálisis comparó 7 estudios que incluyeron antidepresivos y ansiolíticos con 11 estudios que incluyeron antisecretores y procinéticos. Ambos grupos de medicamentos se asociaron a reducción del dolor, aunque el beneficio fue limítrofe110. Varios trabajos subsecuentes han mostrado beneficio modesto con ATC, resultados conflictivos con ISRS y no existe evidencia ni a favor ni en contra con los inhibidores de recaptura de norepinefrina. Al analizar el efecto de los antidepresivos por separado en la dispepsia funcional, venlafaxina111 y sertralina112 no fueron mejores que placebo. Un solo estudio ha comparado el efecto de un ATC (amitriptilina), un ISRS (escitalopram) y placebo en la dispepsia funcional113. En este estudio, amitriptilina fue superior a escitalopram y a placebo luego de 10semanas, con una respuesta adecuada de 53 vs. 38 vs. 40% (amitriptilina, escitalopram y placebo, respectivamente; p=0.05), una tendencia a la mejoría del dolor epigástrico (67 vs. 27 vs. 39% amitriptilina, escitalopram y placebo, respectivamente; p=0.06), sin efecto significativo sobre la saciedad. Ambos antidepresivos mejoraron la calidad de vida113. La mirtazapina ha mostrado tener un efecto sobre la relajación receptiva del fondo gástrico, con mejoría significativa sobre placebo en la saciedad temprana, la calidad de vida, la tolerancia a nutrientes y la pérdida ponderal tras 8semanas de tratamiento114. Otro estudio con mirtazapina mostró, además de mejoría sintomática, una recuperación de peso y porcentaje de grasa corporal luego de 8semanas de tratamiento115. Un pequeño trabajo publicado recientemente concluyó que mirtazapina fue superior a placebo en lograr mejoría en la intensidad de los síntomas, en el puntaje de depresión, en el puntaje de somatización y en los puntajes de calidad de vida medida a través del cuestionario SCL-90 en pacientes con dispepsia funcional (RomaII)116. Finalmente, los antagonistas 5-HT1A, como la buspirona y la tandospirona, bloquean la respuesta serotoninérgica central, mejorando así la relajación receptiva fúndica y la acomodación gástrica. Ambos fármacos fueron efectivos en estudios fasei yii. La buspirona se asoció a mejoría en la distensión subjetiva, la plenitud posprandial y la relajación fúndica en un estudio faseiii cruzado controlado por 4semanas117. La tandospirona fue superior a placebo tras 4semanas en lograr mejoría del malestar (31.5 vs 12.7%, p=0.002) y del dolor epigástrico (p=0.02), con una mayor proporción de respondedores a la semana3 (p=0.017) y 4 (p=0.016) al ser comparada con el placebo y sin efectos adversos118. Nivel de la evidencia y fuerza de la recomendación GRADE: A1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
No existen estudios controlados con placebo que comparen antisecretores o procinéticos entre sí. Un estudio publicado recientemente evaluó la efectividad de los IBP vs. AH2 combinados con procinéticos119. En este estudio abierto se comparó rabeprazol 10mg una vez al día o la combinación de famotidina 10mg 2 veces al día más mosaprida 5mg 3 veces al día durante 4semanas. El desenlace primario fue el cambio en el puntaje de síntomas, y el secundario, la satisfacción con el tratamiento. Los IBP fueron superiores a la combinación famotidina/mosaprida al día 28 en relación a la mejoría sintomática (22.5±29.2% vs 53.2±58.6%; p<0.0001) y este beneficio fue independiente de la presencia o no de H.pylori. También se observó una mayor satisfacción con el tratamiento en el grupo que recibió IBP (87.7 vs 59.6%; p=0.0012). La terapia con rabeprazol fue el único predictor de respuesta a tratamiento. No existen estudios que comparen combinación de antisecretores o procinéticos con antidepresivos. Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
La prueba terapéutica en la dispepsia no investigada sin síntomas de alarma usualmente es de 3 semanas antes de revalorar cambiar el tratamiento o hacer pruebas diagnósticas. Sin embargo, en la dispepsia funcional la duración apropiada del tratamiento no ha sido evaluada. La mayoría de los estudios con antisecretores y procinéticos muestran cambios sintomáticos a las 4 y 8semanas, mientras que los trabajos con antidepresivos informan mejoría a las 8 y 12semanas. Pero al tratarse de una enfermedad crónica es probable que el tratamiento pueda ser más largo que en algunos casos o puedan requerirse ciclos intermitentes de uno o varios medicamentos. Al momento no existe evidencia que evalúe duración e intervalos entre tratamientos. Nivel de la evidencia y fuerza de la recomendación GRADE: D1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 95%. Parcialmente de acuerdo, 5%
La información que existe acerca de la utilidad de los prebióticos, los probióticos o los simbióticos en la dispepsia funcional se encuentra en población pediátrica y es escasa120,121. Existen en el mercado diferentes marcas de yogures adicionados con cepas de probióticos, y la creencia popular es que el consumo de estos alimentos ejerce algún papel protector en el estómago. La realidad es que no existe información de calidad disponible para establecer una recomendación en la dispepsia funcional. Se requieren estudios específicos en este trastorno funcional digestivo que evalúen la utilidad potencial de estas opciones terapéuticas. Nivel de la evidencia y fuerza de la recomendación GRADE: D1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 100%.
México es uno de los principales países consumidores de chile. La capsaicina se encuentra en diferentes alimentos como el chile y el pimiento rojo. La ingestión de capsaicina es considerada popularmente como causal de síntomas dispépticos. Recientemente ha aparecido evidencia científica con resultados controversiales, específicamente en la dispepsia funcional. Por un lado, se ha reportado que el consumo de capsaicina produce síntomas de forma aguda, asociando la ingestión de esta sustancia con síntomas tipo dismotilidad y ardor epigástrico122,123. Por otro lado, se ha descrito que la administración repetida de capsaicina por un tiempo prolongado reduce los síntomas en pacientes con dispepsia funcional124-126. Este efecto se atribuye a una desensibilización dual de quimiorreceptores y mecanorreceptores por la capsaicina127. Algunos estudios atribuyen un efecto terapéutico específicamente por la desensibilización de los receptores transitorios potenciales vaniloides tipo 1 (TRPV1) con la ingesta de capsaicina por al menos 3-5semanas128. Se desconoce si esta desensibilización es reversible o se mantiene. Por lo tanto, se requieren más estudios antes de recomendar su empleo. Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 85%. Parcialmente de acuerdo, 10%. Totalmente en desacuerdo, 5%.
Estos tratamientos alternativos cada vez ganan más aceptación en el mundo occidental. En la dispepsia funcional se cuenta con ensayos clínicos de buena metodología con resultados estadísticamente significativos a favor de la acupuntura129. Inclusive, existen estudios de neuroimagen en los que se han demostrado las áreas cerebrales estimuladas con esta técnica130. Los efectos adversos de la acupuntura incluyen dolor, fatiga, sangrado y hematomas, y se presentan del 0.671 al 11.4% de los casos tratados131. Estudios que han empleado la estimulación eléctrica interferencial han demostrado mejoría sintomática en pacientes con dispepsia funcional; sin embargo, el tamaño de muestra es pequeño y se desconoce el efecto y la seguridad de la aplicación repetida a largo plazo132. Una revisión de Cochrane analizó los estudios en los que se comparó acupuntura manual, electroacupuntura o electroacupuntura manual versus medicamentos (procinéticos), así como la acupuntura en puntos verdaderos versus acupuntura en puntos falsos. Los autores concluyeron que, aunque los estudios demostraban mejoría clínica con diferencias significativas, la evidencia fue de baja calidad por limitaciones en su diseño (principalmente el cegamiento) y la imprecisión (tamaño de muestra pequeño para generalizar resultados). No les fue posible llegar a una conclusión sobre la eficacia y la seguridad de estas intervenciones en la dispepsia funcional hasta contar con estudios de mejor calidad133. Se ha demostrado la eficacia de la estimulación eléctrica transcutánea en la gastroparesia, pero no se cuenta con evidencia en la dispepsia funcional en adultos. Dos estudios en población pediátrica y adolescentes han demostrado mejoría clínica significativa en la dispepsia funcional, pero se requieren más estudios para establecer la eficacia y la seguridad de estos procedimientos a largo plazo134,135. Nivel de la evidencia y fuerza de la recomendación GRADE: A1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 95%. Parcialmente de acuerdo, 5%.
La medicina alternativa, en especial la herbolaria, es popular en los pacientes con trastornos funcionales digestivos, en parte debido a las limitadas opciones terapéuticas de la medicina convencional para el control de los síntomas136. Lahner et al.137 informaron que la frecuencia de consumo de herbolaria dentro de la medicina alternativa en los trastornos funcionales digestivos es del 36.7%. La mayoría de los compuestos herbolarios no cuentan con evidencia científica de calidad para demostrar su eficacia138. El Iberogast (STW5) y en rikkunshito son los dos compuestos con mayor evidencia científica de calidad y han demostrado utilidad en el alivio sintomático de la dispepsia funcional12. Ambos compuestos cuentan con ensayos clínicos aleatorizados, controlados y comparativos que han demostrado alivio de los síntomas dispépticos139-141. Nivel de la evidencia y fuerza de la recomendación GRADE: A1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 95%. Parcialmente de acuerdo, 5%.
Los estudios realizados hasta ahora en las diferentes terapias psicológicas no son concluyentes para poder establecer una recomendación en la dispepsia funcional. Una revisión de Cochrane de 2005 y actualizada en 2011 concluyó que la información es insuficiente para poder establecer una recomendación para intervenciones psicológicas en la dispepsia no ulcerosa142. Es una patología en la que se requieren estudios con mejores diseños y mayor número de pacientes143-146. En comparación con otros trastornos funcionales digestivos, como el síndrome de intestino irritable, en el que se han establecido recomendaciones para la aplicación de algunas terapias psicológicas8, estas han sido muy poco estudiadas en la dispepsia funcional como una opción terapéutica alternativa147. Nivel de la evidencia y fuerza de la recomendación GRADE: B1 fuerte a favor del enunciado. Nivel de acuerdo: Totalmente de acuerdo, 95%. Parcialmente de acuerdo, 5%.
La dispepsia es un motivo de consulta habitual en la práctica diaria y uno de los padecimientos digestivos más frecuentemente diagnosticado en la práctica diaria, por lo que es de gran importancia dar a conocer los cambios y avances que se han logrado en el conocimiento de esta enfermedad en los últimos años. Presentamos una revisión consensuada que reafirma, renueva y complementa el conocimiento sobre este padecimiento en comparación con la guía publicada por la Asociación Mexicana de Gastroenterología en 2007.
FinanciaciónEste consenso se realizó con el apoyo económico de Laboratorios Takeda México, con el que se costeó parcialmente la reunión de votación presencial (transportación y hospedaje). Los autores recibieron un honorario por su participación.
Conflicto de interesesRamón Carmona-Sánchez es miembro del Consejo Asesor de Mayoly-Spindler, ponente para Mayoly-Spindler y Allergan, y participa en protocolos de investigación patrocinados por Laboratorios Senosian y Asofarma.
Octavio Gómez-Escudero es miembro del Consejo Asesor de Laboratorios Allergan y ponente para Laboratorios Allergan, Alfa-Wassermann, Asofarma, AstraZeneca y Takeda, y participa en un protocolo de investigación patrocinado por Laboratorios Asofarma.
Mónica Zavala-Solares es ponente para Laboratorios Takeda.
María Victoria Bielsa-Fernández es ponente para Alfa-Wassermann. Miembro de Consejo Asesor de Alfa-Wassermann.
Enrique Coss-Adame es ponente de Laboratorios Takeda de México. Ha sido consultante y colabora con Laboratorios Asofarma de México, y participa en un protocolo de investigación patrocinado por Laboratorios Asofarma.
María Eugenia Icaza-Chávez es miembro del Consejo Asesor de Laboratorios Mayoly-Spindler y Carnot, es ponente para Mayoly-Spindler, Alfa-Wassermann y Asofarma, y participa en un protocolo de investigación patrocinado por Laboratorios Asofarma y otro por laboratorios Senosian.
Francisco Huerta-Iga es ponente para Takeda y Asofarma.
Aurelio López-Colombo es ponente de Laboratorios Takeda de México.
Alejandra Noble-Lugo es ponente de Laboratorios Takeda de México, Alfa-Wassermann y AstraZeneca.
Ricardo Raña-Garibay es miembro del Consejo Asesor y ponente de Laboratorios Commonwealth.
José María Remes-Troche es miembro del Consejo Asesor de Takeda Pharmaceuticals y Alfa-Wassermann, es ponente para Takeda, Asofarma, Alfa-Wassermann y AstraZeneca y participa en un protocolo de investigación patrocinado por Laboratorios Asofarma.
José Luis Tamayo es ponente y asesor externo de los laboratorios Alfa-Wassermann, Asofarma, Mayoly-Spindler y Takeda de México, y participa en un protocolo de investigación patrocinado por Laboratorios Asofarma.
Miguel A. Valdovinos es ponente de Laboratorios Takeda de México, Mayoly-Spindler, Carnot, Biocodex, Danone. Es miembro del Consejo Asesor de Mayoly-Spindler, Takeda y Biocodex.
José Antonio Velarde Ruiz Velasco es ponente de Laboratorios Takeda México y Alfa Wassermann, es miembro del Consejo Asesor de laboratorios Carnot y participa en un protocolo de investigación patrocinado por Laboratorios Asofarma.
Todos los demás participantes declaran no tener conflicto de intereses.