Más de 30 millones de personas consumen diariamente antiinflamatorios no esteroideos (AINE) en el mundo y este consumo se ve incrementado año tras año. Aunque los AINE poseen propiedades analgésicas y antiinflamatorias, sus eventos adversos gastrointestinales son bien reconocidos. En nuestro país no existía un consenso respecto al diagnóstico, tratamiento y prevención de la gastropatía y la enteropatía por AINE, por lo que la Asociación Mexicana de Gastroenterología reunió a un grupo de expertos para establecer recomendaciones de utilidad para la comunidad médica. En este consenso se emitieron 33 recomendaciones. El consenso destaca que el riesgo de toxicidad gastrointestinal de los AINE varía según el fármaco empleado y su farmacocinética, lo cual debe ser considerado al momento de su prescripción. Los factores de riesgo de complicación gastroduodenal por AINE son: antecedente de úlcera péptica, edad mayor de 65 años, dosis altas del AINE, infección por Helicobacter pylori y presencia de comorbilidades graves. Los síntomas y el daño gastroduodenal inducido por AINE son variables, ya que puede cursar asintomático o manifestarse como anemia por deficiencia de hierro, hemorragia, estenosis y perforación. La cápsula endoscópica y la enteroscopia son métodos diagnósticos directos en la enteropatía por AINE. Respecto a la prevención, se recomienda prescribir la dosis mínima necesaria de un AINE para obtener el efecto deseado y durante el menor tiempo. Por último, los inhibidores de la bomba de protones representan el estándar de oro para la profilaxis y tratamiento de los efectos gastroduodenales, mas no son útiles en la enteropatía.
More than 30 million persons worldwide take nonsteroidal anti-inflammatory drugs (NSAIDs) on a daily basis, and annual consumption is increasing. In addition to their analgesic and anti-inflammatory properties, NSAIDs also produce well-known gastrointestinal adverse events. There is no consensus in Mexico on the diagnosis, treatment, and prevention of NSAID-induced gastropathy and enteropathy, and so the Asociación Mexicana de Gastroenterología brought together a group of experts to establish useful recommendations for the medical community. Thirty-three recommendations were formulated in the present consensus, highlighting the fact that the risk for NSAID-induced gastrointestinal toxicity varies according to the drug employed and its pharmacokinetics, which should be taken into account at the time of prescription. The risk factors for gastroduodenal complications due to NSAIDs are: a history of peptic ulcer, age above 65 years, high doses of NSAIDs, Helicobacter pylori infection, and the presence of severe comorbidities. The symptoms and gastroduodenal damage induced by NSAIDs vary, ranging from an asymptomatic course to the presentation of iron-deficiency anemia, bleeding, stricture, and perforation. Capsule endoscopy and enteroscopy are direct diagnostic methods in NSAID enteropathy. Regarding prevention, the minimum dose of an NSAID needed to achieve the desired effect, administered for the shortest period of time, is the recommendation. Finally, proton pump inhibitors are the gold standard for the prophylaxis and treatment of gastroduodenal effects, but they are not useful in enteropathy.
Más de 30 millones de personas consumen diariamente antiinflamatorios no esteroideos (AINE) en el mundo1, y este consumo se ve incrementado año tras año debido a la mayor expectativa de vida de la población y a la autoprescripción de aspirina y de algunos AINE. Aunque, los AINE poseen excelentes propiedades analgésicas y antiinflamatorias, sus eventos adversos gastrointestinales, cardiovasculares, renales y hepáticos son bien reconocidos. Entre todos los eventos adversos relacionados con el consumo de AINE, los gastrointestinales son los más frecuentes y los que conllevan mayor morbimortalidad.
En febrero de 2018, la Asociación Mexicana de Gastroenterología se dio a la tarea de integrar un grupo multidisciplinario de profesionales de la salud conformado por gastroenterólogos, endoscopistas y cirujanos, para que elaboraran el Consenso sobre diagnóstico, tratamiento y prevención de la gastropatía y la enteropatía por AINE y establecieran recomendaciones de utilidad para la comunidad médica. De manera específica, el objetivo de este consenso fue preparar un documento actualizado y aplicable en la práctica médica en México. Las recomendaciones incluidas están basadas en una extensa revisión de la literatura y en la opinión consensuada de los especialistas participantes.
MétodosSe utilizó el proceso Delphi para el desarrollo del consenso, tal y como se ha descrito previamente2. Se designaron 3coordinadores (MVBF, JLL, JLT de la C) y se invitó a 20 expertos de las especialidades relacionadas con la gastropatía y la enteropatía por AINE. Los coordinadores realizaron una búsqueda exhaustiva en las siguientes bases de datos: CENTRAL (The Cochrane Central Register of Controlled Trials), MEDLINE (PubMed), EMBASE (Ovid), LILACS, CINAHL, BioMed Central y World Health Organization International Clinical Trials Registry Platform (ICTRP). La búsqueda comprendió el período del 1 de enero de 2008 al 28 de febrero de 2018. Los criterios de búsqueda incluyeron los siguientes términos: «nonsteroidal antiinflamatories» combinado con los siguientes términos: «gastric», «small bowel», «enteropathy», «risk» «incidence», «prevalence», «Mexico», «pathophysiology», «diagnosis», «differential diagnosis», «treatment», «endoscopy», «therapy», «management», «review», «guidelines» y «meta-analysis», y sus equivalentes en español. Toda la bibliografía se puso a disposición de los integrantes del consenso.
Posteriormente, los coordinadores elaboraron enunciados que fueron sometidos a una primera votación anónima por vía electrónica (del 2 al 11 de febrero de 2018) cuya finalidad fue evaluar la redacción y el contenido de los enunciados. Los participantes del consenso emitieron su voto considerando las siguientes respuestas: a) totalmente de acuerdo, b) parcialmente de acuerdo, c) incierto, d) parcialmente en desacuerdo y e) totalmente en desacuerdo.
Terminada la primera votación, los coordinadores introdujeron las modificaciones correspondientes. Los enunciados que alcanzaron un acuerdo total>75% se mantuvieron y los que tuvieron un desacuerdo total>75% se eliminaron. Los enunciados que tuvieron ≤75% de acuerdo total y ≤75% de desacuerdo total se revisaron y reestructuraron. Los enunciados revisados se sometieron a una segunda votación anónima por vía electrónica (del 11 de febrero al 4 de marzo de 2018). En esta votación, además de la redacción y el contenido, cada enunciado fue evaluado de acuerdo con un grado de recomendación y la calidad de la evidencia para sustentar dicha recomendación. Esto se hizo empleando el sistema Grading of Recommendations Assessment, Development, and Evaluation (GRADE)3. En el sistema GRADE, la calidad de la evidencia no se califica solo con base en el diseño o la metodología de la investigación, sino que se juzga en función de una pregunta claramente planteada con relación a una variable de desenlace también formulada con claridad4. Sobre estas bases, la evidencia puede ser alta, moderada, baja o muy baja. El sistema GRADE también establece la fuerza de las recomendaciones en fuerte o débil, a favor o en contra de la intervención o del enunciado. Es importante mencionar que el sistema GRADE se utilizó en el caso de pruebas diagnósticas e intervenciones terapéuticas. Como se muestra en la tabla 1, el sistema GRADE se expresa empleando un código que usa letras mayúsculas para hablar de la calidad de la evidencia, seguidas de un índice numérico para indicar la fuerza de la recomendación a favor o en contra de la intervención o enunciado.
Código del sistema GRADE
| Calidad de la evidencia | Código |
|---|---|
| • Alta | A |
| • Moderada | B |
| • Baja | C |
| • Muy baja | D |
| Fuerza de la recomendación | |
|---|---|
| • Fuerte a favor de la intervención | 1 |
| • Débil a favor de la intervención | 2 |
| • Débil en contra de la intervención | 2 |
| • Fuerte en contra de la intervención | 1 |
Fuente: Adaptado de Guyat et al.3.
Los resultados de la tercera votación se presentaron el día 14 de abril de 2018 en una reunión presencial realizada en la ciudad de Durango (Durango, México). En esta reunión, los enunciados que obtuvieron un acuerdo>75% fueron ratificados. Aquellos enunciados que no alcanzaron un 75% de acuerdo en las votaciones previas se discutieron con la finalidad de tratar de llegar a un consenso o, en caso contrario, eliminarlos, y se volvieron a votar. Una vez establecidos todos los enunciados del consenso, los coordinadores elaboraron el presente manuscrito, el cual fue revisado y aprobado por todos los miembros.
ResultadosDe forma inicial, los coordinadores propusieron 39 enunciados. Después de las rondas de votaciones en línea y al final de la reunión presencial, el consenso final se conformó por 33 recomendaciones. A continuación, se presentan las recomendaciones finales y los resultados de la votación.
Generalidades y factores de riesgo1.- Los AINE (antiinflamatorios no esteroideos) son uno de los medicamentos de venta libre más ampliamente utilizados a nivel mundial.
Acuerdo alcanzado: 90% totalmente de acuerdo, 10% parcialmente de acuerdo.
Los AINE son fármacos que reducen el dolor, la fiebre y la inflamación, y en la actualidad se clasifican en1,5:
- a)
AINE no selectivos (AINE-NS) como el naproxeno, la indometacina, el ibuprofeno, el sulindac, el diclofenaco y el piroxicam.
- b)
Inhibidores selectivos de la isoforma 2 de la ciclooxigenasa (inhibidores COX-2 selectivos), y en este grupo se encuentran los COXIB (como rofecoxib, eterocoxib, celecoxib) y los denominados «preferentemente» selectivos, como la nimesulida y el meloxicam.
Debido a que a nivel mundial la expectativa de vida de la población mundial está aumentando y, por lo tanto, los trastornos reumatológicos, el uso de AINE se ha incrementado sustancialmente en las últimas décadas1. Además de sus efectos antiinflamatorio, analgésico y antipirético, el uso de ácido acetilsalicílico (AAS) a dosis bajas se utiliza para reducir el riesgo de eventos isquémicos cardiacos y cerebrovasculares; esta indicación se ha popularizado y muchas personas lo utilizan sin prescripción ni una indicación absoluta1,5. Al menos en los Estados Unidos de Norteamérica, estos medicamentos son los más utilizados ya sea por prescripción médica o por venta libre6. Además, los AINE encuentran un aumento en la aplicación clínica como fármacos profilácticos contra algunas neoplasias o como parte del tratamiento de la enfermedad de Alzheimer7. Por lo tanto, es probable que la enteropatía inducida por AINE se diagnostique cada vez más.
2.- La gastroduodenopatía inducida por AINE se debe tanto a un efecto sistémico que causa hipoperfusión, disminución de la síntesis de bicarbonato y de la proliferación epitelial secundario a la inhibición de la síntesis de prostaglandinas, como a efectos tópicos directos que provocan disrupción de la barrera citoprotectora de la mucosa.
Acuerdo alcanzado: 80% totalmente de acuerdo, 20% parcialmente de acuerdo.
El efecto nocivo de los AINE sobre la mucosa gastroduodenal es mediado por 2mecanismos; el principal es por efecto sistémico, debido a la inhibición de la actividad de la ciclooxigenasa (COX), lo que ocasiona menor flujo sanguíneo, menor síntesis de bicarbonato y prostaglandinas y disminución de la proliferación epitelial8. Además, pueden causar daño tópico sobre la mucosa y provocar disrupción de la barrera mucosa gástrica, por acción de ácidos débiles no ionizados, al interior de las células, lo que causa alteraciones intracelulares en las mitocondrias por un desacoplamiento de la fosforilación oxidativa mitocondrial, así como el daño a la capa lipídica9,10. Esta citotoxidad directa es independiente de la inhibición de la COX y provoca un aumento de la permeabilidad de la membrana, causa daño epitelial con necrosis adicional y apoptosis de las células gástricas11.
3.- La enteropatía causada por AINE tiene una fisiopatología diferente a la de la gastroduodenopatía.
Acuerdo alcanzado: 70% totalmente de acuerdo, 30% parcialmente de acuerdo.
La patogénesis de las lesiones intestinales inducidas por AINE es menos comprendida9. Típicamente las úlceras se presentan como daño necrótico (o apoptótico) de los enterocitos que pueden afectar capas más profundas de la mucosa, con infiltrado inflamatorio agudo y pérdida de las vellosidades9. A diferencia de la gastroduodenopatía, los síntomas de la enteropatía inducida por AINE no son específicos y su fisiopatología parece ser diferente. Sin embargo, parece ser que el daño inducido por los AINE-NS y los inhibidores COX-2 selectivos son similares en el intestino delgado. Por ejemplo, un estudio mostró que no hubo diferencia en cuanto a las lesiones intestinales inducidas por el uso a largo plazo de AINE-NS o de inhibidores COX-2 selectivos (62 vs. 50%)12. Desde hace varios años, se postula la hipótesis de los 3 golpes: primero el AINE afecta los fosfolípidos de la membrana celular, que provoca lesión mitocondrial, lo que causa el segundo golpe, que es la disminución de la síntesis de energía, lo que provoca liberación de calcio y generación de radicales libres; entonces se rompen las uniones intercelulares y aumenta la permeabilidad de la mucosa, para que por último se produzca el tercer golpe: el contenido intraluminal, como los ácidos biliares, enzimas proteolíticas y las bacterias intestinales y sus toxinas, entran a las células y empieza la inflamación13,14. A la fecha, no hay evidencia de que la supresión de la secreción de ácido gástrico reduzca la incidencia o severidad de la enteropatía por AINE; de hecho, los pocos estudios clínicos que existen indican un beneficio marginal y los estudios realizados en animales señalan que el uso concomitante de inhibidores de la bomba de protones (IBP) y AINE exacerban la enteropatía existente y este daño parece estar relacionado con cambios en el número y tipo de bacterias en el intestino delgado durante la terapia con IBP15.
4.- El daño inducido por AINE a lo largo del tracto gastrointestinal es mayor con el uso concomitante de otros AINE, anticoagulantes, antiagregantes plaquetarios.
Acuerdo alcanzado: 85% totalmente de acuerdo, 15% parcialmente de acuerdo.
Los agentes antiplaquetarios y anticoagulantes per se conllevan riesgo de complicaciones gastrointestinales (ulceración o sangrado) y este riesgo se incrementa con el uso concomitante de AINE y otros medicamentos (enunciados 8 a 12). Así pues, la comunicación entre cardiólogos, gastroenterólogos y médicos de atención primaria es fundamental para evaluar individualmente el riesgo de eventos isquémicos o hemorrágicos del paciente que requiere estos medicamentos16.
5.-El riesgo de toxicidad gastrointestinal de los diferentes AINE varía según el fármaco empleado y su farmacocinética, lo cual debe ser considerado al momento de su prescripción.
Acuerdo alcanzado: 95% totalmente de acuerdo, 5% parcialmente de acuerdo.
Es bien conocido que todos los AINE, en mayor o menor grado, causan toxicidad gastrointestinal. Múltiples ensayos clínicos controlados con placebo demuestran que todos los AINE, incluyendo los inhibidores COX-2 selectivos, se asocian a mayor o menor riesgo de lesiones gastrointestinales y que este riesgo relativo varía entre los diferentes AINE. El riesgo relativo para aceclofenaco, celecoxib e ibuprofeno es bajo (riesgo relativo [RR]<2)17. El diclofenaco, meloxicam y ketoprofeno tienen un riesgo intermedio (RR=2-4) mientras que, para naproxeno, indometacina y diflunisal el riesgo es mayor (RR=4-5). El piroxicam (RR=7.4) y el ketorolaco (RR=11.5) son los fármacos con mayor riesgo de toxicidad gastrointestinal17.
La manera de prevenir las lesiones de la mucosa gastrointestinal inducida por los AINE es evitar su utilización o sustituirlo por un agente menos tóxico para la mucosa gastrointestinal como el acetaminofén. Pero si es necesario utilizarlos, debe ser tratando de minimizar el daño18. Se debe buscar la dosis efectiva más baja, por el menor tiempo posible y, de preferencia, utilizar un solo AINE. También se debe preferir los inhibidores COX-2 selectivos, si no existe mayor riesgo cardiovascular o un AINE-NS más seguro como ibuprofeno, diclofenaco o aceclofenaco, que se han asociado con un menor riesgo relativo de hemorragia gastrointestinal18,19. Los inhibidores COX-2 selectivos tienen una menor toxicidad gastroduodenal en comparación con los AINE-NS. La principal preocupación del uso de estos es su asociación con mayor riesgo de eventos cardiovasculares, pero muchos AINE-NS, particularmente el diclofenaco, también se ha asociado con riesgo cardiovascular17-19. Por otra parte, el riesgo de complicaciones gastrointestinales aumenta si se usan dosis altas de AINE de forma mantenida. Este riesgo es constante, independientemente de la dosis y durante todo el tiempo que se mantiene el tratamiento20. Así pues, diferentes agencias reguladoras de medicamentos recomiendan que todo AINE sea utilizado a la mínima dosis y durante el menor tiempo posible, y de acuerdo con la indicación por la que fue prescrito21,22.
6.- El daño inducido por los AINE-NS y los inhibidores COX-2 selectivos a lo largo del intestino se presenta con la misma frecuencia.
Acuerdo alcanzado: 55% totalmente de acuerdo, 25% parcialmente de acuerdo, 20% incierto.
En comparación con los AINE-NS, los inhibidores COX-2 selectivos se asocian a un riesgo significativamente más bajo de daño gastroduodenal, no así en el tubo digestivo distal (intestino medio y colon), donde el riesgo parece ser similar. Existe cada vez más evidencia que demuestra un incremento notable en lesiones de intestino delgado. Desde hace muchos años, se conocen las lesiones y sus complicaciones que causan los AINE en estómago y duodeno: con el incremento de la disponibilidad de equipos endoscópicos, estas son más reconocidas y fáciles de identificar, pero realmente se desconoce la magnitud real del daño en el tubo digestivo distal23. La enteropatía a menudo es subdiagnosticada o incluso pasa desapercibida en la mayoría de los estudios, porque están más allá del alcance de los exámenes endoscópicos convencionales. Sin embargo, cada vez se reportan más hospitalizaciones por complicaciones en el tubo digestivo distal24. Algunos informes de la literatura reportan que la prevalencia de la enteropatía es mayor que la de la gastroduodenopatía y que las complicaciones graves son semejantes25. Un estudio hecho en material de autopsia detectó ulceraciones en el intestino delgado en el 8.4% de los sujetos que usaron AINE contra el 0.6% de los que nunca lo utilizaron26 y en otro estudio se reportó que entre el 55 y el 75% de los pacientes tratados continuamente con AINE presentan daño en la mucosa intestinal27.
7.- Los factores de riesgo de complicación gastroduodenal por AINE son: a) antecedente de úlcera péptica (complicada o no); b) edad mayor a 65 años; c) dosis altas del AINE; d) uso concomitante de medicamentos; e) infección porHelicobacter pylori (H. pylori)y f) presencia de comorbilidades graves.
Acuerdo alcanzado: 90% totalmente de acuerdo, 10% parcialmente de acuerdo.
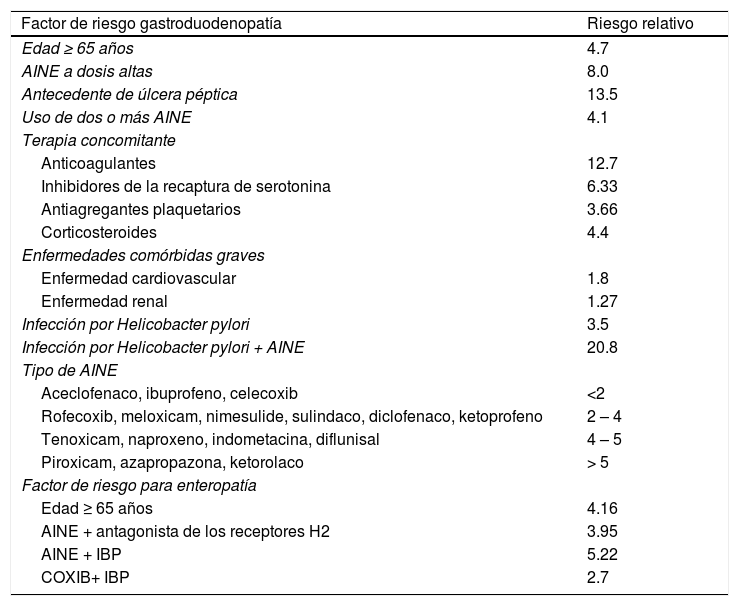
Los factores de riesgo más importantes son la edad y la historia previa de úlcera péptica (tabla 2). A mayor edad, es más frecuente el uso de AINE y los mayores de 70 años tienen un riesgo similar a los que tienen antecedente de úlcera péptica. Conforme avanza la edad, el riesgo aumenta alrededor del 4% anual, probablemente debido a la presencia de otros factores de riesgo asociados19. El papel de la infección por H. pylori y el potencial beneficio de su erradicación en pacientes que toman AINE-NS ha sido controversial9,19. Un metaanálisis de estudios de casos y controles demostró una sinergia para el desarrollo de úlceras complicadas y no complicadas entre la infección por H. pylori y consumo de AINE (enunciado 31)28. Dentro de los medicamentos asociados a un incremento en el riesgo de toxicidad gastrointestinal y consumo de AINE, como se menciona en el enunciado 4, se encuentra el AAS, los esteroides, los antitrombóticos y, más recientemente, el uso de inhibidores selectivos de la recaptura de serotonina (ISRS)29. También la comorbilidad grave (por ejemplo, neoplasias, cardiopatías graves, insuficiencia renal, etc.) se consideran un factor de riesgo30.
Factores de riesgo para complicaciones gastrointestinales asociadas al consumo de AINE
| Factor de riesgo gastroduodenopatía | Riesgo relativo |
| Edad ≥ 65 años | 4.7 |
| AINE a dosis altas | 8.0 |
| Antecedente de úlcera péptica | 13.5 |
| Uso de dos o más AINE | 4.1 |
| Terapia concomitante | |
| Anticoagulantes | 12.7 |
| Inhibidores de la recaptura de serotonina | 6.33 |
| Antiagregantes plaquetarios | 3.66 |
| Corticosteroides | 4.4 |
| Enfermedades comórbidas graves | |
| Enfermedad cardiovascular | 1.8 |
| Enfermedad renal | 1.27 |
| Infección por Helicobacter pylori | 3.5 |
| Infección por Helicobacter pylori + AINE | 20.8 |
| Tipo de AINE | |
| Aceclofenaco, ibuprofeno, celecoxib | <2 |
| Rofecoxib, meloxicam, nimesulide, sulindaco, diclofenaco, ketoprofeno | 2 – 4 |
| Tenoxicam, naproxeno, indometacina, diflunisal | 4 – 5 |
| Piroxicam, azapropazona, ketorolaco | > 5 |
| Factor de riesgo para enteropatía | |
| Edad ≥ 65 años | 4.16 |
| AINE + antagonista de los receptores H2 | 3.95 |
| AINE + IBP | 5.22 |
| COXIB+ IBP | 2.7 |
Fuente: Modificado de Lanza et al.103.
8.- El consumo concomitante de AINE-NS e inhibidores COX-2 selectivos puede predisponer al desarrollo de complicaciones gastrointestinales.
Acuerdo alcanzado: 75% totalmente de acuerdo, 20% parcialmente de acuerdo, 5% incierto.
No se recomienda utilizar 2o más AINE (selectivos o no selectivos) de manera simultánea, ya que esta estrategia no incrementa su eficacia analgésica, antiinflamatoria ni antipirética y, en cambio, sí aumenta el riesgo de toxicidad gastrointestinal y de sus complicaciones20. Existe evidencia obtenida de estudios en animales que demuestran papel citoprotector de los prostanoides del tracto gastrointestinal, derivadas de ambas isoenzimas COX. Los prostanoides derivados de la COX-1 (básicamente prostaglandina-E2) participan como mecanismo de defensa que actúa en condiciones fisiológicas; por el contrario, la prostaglandina endógena E2 derivada de la COX-2 juega un papel importante en la cicatrización de úlceras y reparación de la mucosa gastroduodenal. Así pues, la inhibición de cualquiera de las isoenzimas COX predispone al desarrollo de lesiones en el tracto gastrointestinal31.
9.- El uso concomitante de AAS, aun a dosis bajas, con AINE-NS o de inhibidores COX-2 selectivos aumenta el riesgo de síntomas y complicaciones gastrointestinales.
Acuerdo alcanzado: 90% totalmente de acuerdo, 10% parcialmente de acuerdo.
Muchos pacientes que toman AINE también requieren profilaxis antitrombótica con AAS. El AAS, incluso en dosis bajas, aumenta el riesgo de sangrado gastrointestinal alrededor de 2.5 veces y aumenta el riesgo de complicaciones gastrointestinales superiores cuando se combina con un AINE-NS o inhibidores COX-2 selectivos.
La aspirina sola, a dosis bajas, aumenta el riesgo de hemorragia de tubo digestivo proximal (HTDP) en aproximadamente 2 veces; cuando se combina con AINE-NS, este riesgo aumenta de 2 a 4 veces en comparación con dosis bajas de AAS32. La asociación de AAS a dosis bajas con inhibidores COX-2 selectivos se asocia a una reducción numérica, pero no significativa, de hemorragia en comparación de la asociación con AINE-NS. Por otra parte, las admisiones hospitalarias por HTDP son significativamente menores para los usuarios de AAS que también están tomando un inhibidor COX-2 selectivo, en comparación con los que toman AINE-NS33. Cuando un inhibidor COX-2 selectivo se coadministra con aspirina, la conversión del ácido araquidónico a 15 (r) ácido hidroxiepitetraenoico (y, por lo tanto, la producción de la lipoxina gastroprotectora 15 [r]-EPI-lipoa4) es bloqueada, y da como resultado un daño gástrico más grave que el que se ve con aspirina sola o con el inhibidor COX-2 selectivo14. En la práctica clínica, el uso de los inhibidores COX-2 selectivos reduce, pero no elimina, el riesgo de lesiones gastroduodenales, sin embargo, este potencial beneficio se pierde al utilizarlo conjuntamente con AAS, aun a dosis bajas34.
El uso de inhibidores COX-2 selectivos representa un menor riesgo de HTDP que los AINE-NS; sin embargo, cuando se combinan con dosis bajas de AAS, las diferencias entre los AINE-NS y los inhibidores COX-2 selectivos tienden a desaparecer34,35. El tratamiento con antiplaquetarios (AAS u otros) tiene un riesgo similar de causar HTDP. Un estudio realizado por Lanas et al.35 encontró que el uso de AINE aumenta el riesgo de HTDP (RR=5.3), que el tratamiento con rofecoxib también aumentó el riesgo de HTDP (RR=2.1), pero el uso de celecoxib, paracetamol o el uso concomitante de un IBP con un AINE no presentaron un mayor riesgo. El tratamiento antiplaquetario con clopidogrel o ticlopidina tuvieron un riesgo similar de HTDP (RR=2.8) al del AAS a una dosis cardioprotectora (100mg/día) (RR=2.7) o de los anticoagulantes (RR=2.8). Sin embargo, se encontró una interacción evidente entre el uso de AAS a dosis bajas con AINE, inhibidores COX-2 selectivos o tienopiridinas, con un incremento aún mayor del riesgo de HTDP35.
10.- El riesgo de hemorragia de tubo digestivo proximal (HTDP) aumenta cuando se prescribe clopidogrel con AAS comparado con AAS solo.
Acuerdo alcanzado: 85% totalmente de acuerdo, 5% parcialmente de acuerdo, 10% incierto.
El riesgo de hemorragia gastrointestinal con el uso de AAS se incrementa aún más con la prescripción concomitante de clopidogrel. El clopidogrel se percibe a menudo como relativamente seguro en términos de eventos adversos gastrointestinales, pero los datos muestran que, incluso el clopidogrel como monoterapia se asocia con un alto riesgo de resangrado en pacientes que tienen historia previa de sangrado por úlcera péptica. Cuando el clopidogrel se utiliza en combinación con AAS, el riesgo de sangrado aumenta aún más16.
Tres grandes ensayos clínicos controlados han evaluado la combinación de clopidogrel y AAS en comparación con AAS solo: CURE36, COMMIT37 y CHARISMA38. El primero encontró un riesgo significativamente mayor de hemorragias en un periodo de 12 meses, mientras que el estudio CHARISMA38 reporta un mayor riesgo de sangrado moderado y un aumento, pero no significativo, del riesgo de sangrado intenso en un lapso de más de 28 meses con la combinación en comparación con AAS solo. COMMIT37 no mostró un aumento del riesgo de sangrado mayor con la combinación en comparación con AAS solo; sin embargo, la duración media del tratamiento fue solo 15 días. Así pues, para los pacientes con alto riesgo gastrointestinal, se recomienda evitar la combinación de clopidogrel y AAS.
11.- En usuarios de AINE, la erradicación deH. pyloripreviene la recurrencia de úlcera péptica.
Acuerdo alcanzado: 75% totalmente de acuerdo, 20% parcialmente de acuerdo, 5% parcialmente en desacuerdo.
Es claro el papel que juega la infección por H. pylori para el desarrollo de úlcera péptica y, de acuerdo con el consenso mexicano para el diagnóstico y tratamiento del H. pylori en México y con múltiples metaanálisis, se sabe que la erradicación de esta bacteria reduce significativamente el riesgo de úlceras (enunciado 31)28,39. Sin embargo, varios ensayos clínicos han demostrado que el tratamiento concomitante de AINE con IBP puede ser superior en la prevención (primaria y secundaria) de úlcera péptica que la erradicación preventiva de este microorganismo32. La decisión de prescribir un tratamiento de erradicación dependerá, entonces, de la prevalencia local de la infección, así como de otros factores de riesgo que pueda presentar cada individuo en particular, tal y como se detalla en el consenso mexicano para el diagnóstico y tratamiento de la infección por H. pylori en México39.
12.- El riesgo de hemorragia gastrointestinal proximal aumenta con el uso concomitante de AINE y antidepresivos del tipo inhibidores selectivos de la recaptura de serotonina.
Acuerdo alcanzado: 80% totalmente de acuerdo, 20% parcialmente de acuerdo.
En años recientes empezó a surgir la preocupación sobre la utilización de ISRS, pues se ha publicado que pueden asociarse a un mayor riesgo de HTDP y este riesgo puede aumentar más si se utilizan junto con algún AINE. Se han publicado algunos reportes, con un número relativamente pequeño de estudios, en los que informan un riesgo sustancial de hemorragia digestiva con ISRS; sin embargo, estudios más recientes han producido resultados variables.
En un metaanálisis más reciente, con el fin de obtener una estimación más precisa del riesgo de sangrado gastrointestinal superior con ISRS, con o sin concurrente uso de AINE, los autores analizaron 15 estudios de casos y controles (incluidos 393,268 participantes) y 4estudios de cohorte40. Hubo un mayor riesgo de HTDP con medicamentos ISRS en los 2tipos de estudios con razones de momios (RM) que variaron entre 1.66 y 1.68. El número necesario para dañar (HTDP) con el uso de ISRS en una población de bajo riesgo fue 3.177 y en la población de alto riesgo fue 8.81. El riesgo de hemorragia digestiva superior aumentó aún más con el uso concomitante de ISRS y AINE (RM=4.25, IC 95%: 2.82-6.42). Por lo que estos autores concluyen que los ISRS se asocian con un modesto aumento del riesgo de HTDP, que es menor de lo que se ha estimado anteriormente.
Así pues, los participantes de este consenso consideran que se debe tener precaución cuando se prescriban estos 2tipos de medicamentos juntos.
1.1Manifestaciones clínicas y diagnóstico13.-Los síntomas y el daño gastroduodenal inducido por AINE son amplios y variables.
Acuerdo alcanzado: 85% totalmente de acuerdo, 15% parcialmente de acuerdo.
El daño provocado por los AINE independientemente de su vía de administración (tópica o sistémica) sobre el tracto digestivo es amplio, varía desde la presencia de síntomas tipo dispepsia, pirosis, náuseas hasta la presencia de úlceras pépticas, complicadas o no24,41. Es importante destacar que la presencia e intensidad de estos los síntomas no predicen la presencia de lesión mucosa24. Por ejemplo, el 50% de los consumidores de AINE tiene síntomas sin lesión mucosa y el 50% de los pacientes con úlcera péptica complicada no reportan síntomas previamente30. Por otra parte, en los Estados Unidos de Norteamérica, hasta el 25% de los consumidores de AINE desarrollarán úlcera péptica y el 2-4% presentarán complicaciones como perforación o sangrado42. El desarrollo de estos síntomas no es exclusivo de los AINE-NS, ya que también han sido demostrados durante el consumo de inhibidores COX-2 selectivos, aunque en menor proporción43.
Es importante mencionar que, aparentemente, el periodo de mayor riesgo para desarrollar síntomas o complicaciones es el primer mes de uso (RR=5.7)44. Otros estudios han señalado los primeros 2meses de uso como el periodo con mayor riesgo de complicaciones; sin embargo, el riesgo se mantiene mientras se consumen los fármacos35,45. Se estima que aproximadamente 47/100,000 consumidores de AINE requerirán hospitalización por eventos adversos sobre el tracto digestivo proximal y que la mortalidad asociada a complicaciones gastrointestinales graves es del 5.57%46,47.
14.- La enteropatía por AINE frecuentemente cursa asintomática; puede manifestarse como anemia por deficiencia de hierro, hemorragia, estenosis y perforación.
Acuerdo alcanzado: 100% totalmente de acuerdo.
El reporte de los efectos deletéreos de los AINE sobre el tubo digestivo distal es cada vez mayor y estos conllevan una morbimortalidad significativa48. Estos eventos adversos van desde el incremento en la permeabilidad mucosa, inflamación de la mucosa, pérdida de proteínas, malabsorción, hemorragia o sangre oculta, diarrea, úlceras, hasta estenosis y perforación49. El reconocimiento de los efectos tóxicos de los AINE sobre el tubo digestivo distal ha aumentado con el advenimiento de nuevas tecnologías para evaluar la integridad intestinal, en particular, con la cápsula endoscópica y la enteroscopia50. El daño provocado por los AINE no es transitorio y no disminuye con el tiempo. Por ejemplo, con el uso continuo, a los 3 meses de consumo de AINE el 71% de los consumidores tiene lesión mucosa y hasta el 80% después de un año51,52. Endo et al.53, con la utilización de cápsula endoscópica, demostraron que, incluso con el empleo de dosis bajas de aspirina, es posible provocar inflamación de la mucosa intestinal. En consumidores crónicos de AINE también se demostró mediante cápsula endoscópica y enteroscopia la presencia de erosiones, úlceras y estenosis54.
15.- El consumo de AINE y AAS puede asociarse con complicaciones de la enfermedad diverticular del colon.
Acuerdo alcanzado: 75% totalmente de acuerdo, parcialmente de acuerdo 20%, incierto 5%.
La evidencia, aunque es escasa, indica un incremento en el riesgo de desarrollar complicaciones relacionadas con enfermedad diverticular del colon. En la revisión sistemática realizada por Laine et al.55, donde se analizaron 7 estudios con diferentes diseños metodológicos, 5 de ellos muestran un incremento significativo del riesgo de complicación de la enfermedad diverticular en consumidores crónicos de AINE. En un estudio observacional de casos y controles, Taki et al.56 demostraron que la enfermedad diverticular bilateral (RM=3.00), el uso de AINE no selectivos (RM=3.47), aspirina en dosis bajas (RM=2.23) y de anticoagulantes (RM=3.09) son factores de riesgo independientes para hemorragia diverticular.
16.- El efecto del consumo de AINE sobre la enfermedad inflamatoria intestinal aún es incierto.
Acuerdo alcanzado: 100% totalmente de acuerdo.
Algunos estudios han señalado que el consumo de AINE no selectivos y de inhibidores COX-2 selectivos puede ser un factor de riesgo para la exacerbación de la enfermedad inflamatoria intestinal, específicamente en la enfermedad de Crohn y en la colitis ulcerativa crónica inespecífica57,58. Sin embargo, otros trabajos no han encontrado tal asociación59,60. Recientemente, Moninuola et al.61 publicaron una revisión sistemática y metaanálisis para evaluar el riesgo de exacerbación de la enfermedad inflamatoria intestinal con el consumo de acetaminofén y AINE, en la cual no se demostró asociación consistente entre el uso de acetaminofén, AINE no selectivo o inhibidores COX-2 selectivos, y la exacerbación de la enfermedad.
17.- La cápsula endoscópica y la enteroscopia son métodos diagnósticos que evalúan directamente la enteropatía por AINE.
Acuerdo alcanzado: 90% totalmente de acuerdo, 5% incierto, 5% parcialmente en desacuerdo.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor.
Desde que la cápsula endoscópica y la enteroscopia se encuentran disponibles para la evaluación directa del intestino delgado, la detección de lesiones en este segmento del sistema digestivo ha ido en aumento62,63. Se sabe que hasta el 50-70% de los pacientes consumidores de AINE a largo plazo desarrollará daño en el intestino delgado51.
Actualmente ambos métodos diagnósticos se encuentran disponibles, y aunque la capacidad de detección de lesiones de intestino delgado no es perfecta, la enteroscopia es superior a la cápsula endoscópica en detección de grandes lesiones como pólipos, mientras que la cápsula endoscópica es superior en la detección de lesiones pequeñas como erosiones y manchas rojas62. Aunque no existe una terminología validada para reportar los hallazgos de la enteropatía por AINE, Hayashi et al.64 proponen los siguientes criterios para establecer el diagnóstico de enteropatía por AINE mediante la utilización de enteroscopia de doble balón:
- -
Antecedente de consumo de AINE.
- -
Hallazgos endoscópicos: erosión, úlcera y estenosis tipo diafragma.
- -
Mejoría de los hallazgos clínicos (signos y síntomas) o hallazgos endoscópicos al suspender los AINE, con excepción de las estenosis tipo diafragma.
- -
Exclusión de otras causas (tumor, enfermedad inflamatoria intestinal, enfermedad infecciosa).
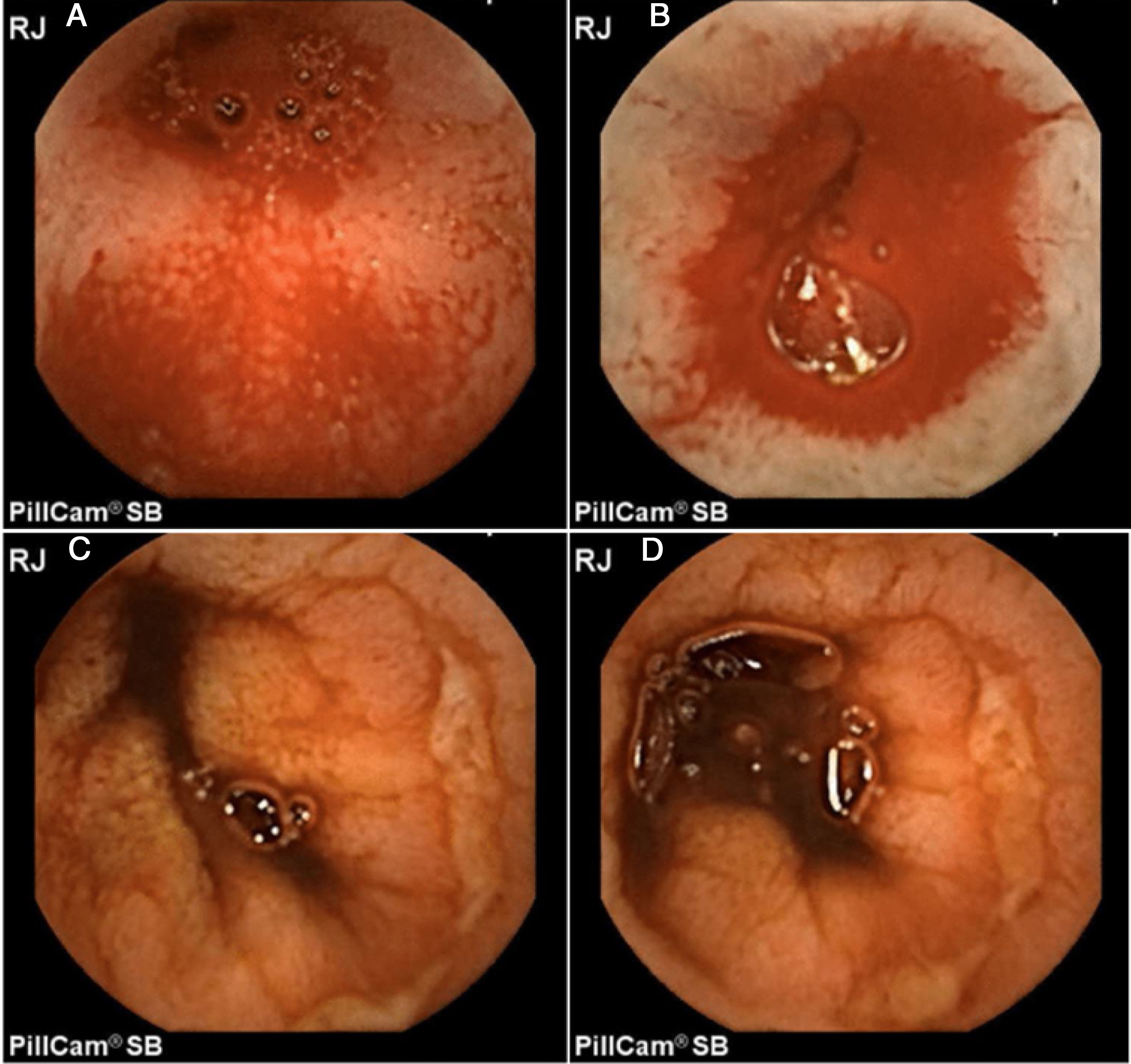
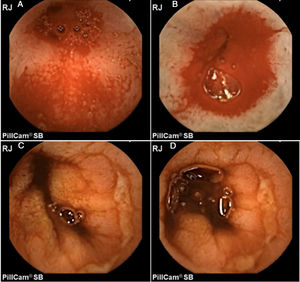
Por otra parte, Maiden et al.65 clasifican los hallazgos endoscópicos de la enteropatía por AINE en 5 categorías (fig. 1) utilizando cápsula endoscópica:
- -
Pliegues eritematosos.
- -
Áreas de mucosa denudada.
- -
Manchas rojas.
- -
Disrupción de la mucosa.
- -
Hemorragia.
Hombre de 52 años consumidor crónico de diclofenaco. A-B) Imagen de cápsula endoscópica que demuestra inicialmente hemorragia activa en yeyuno. C-D) Posteriormente se evidencia la presencia de úlceras cubiertas de fibrina de forma circunferencial.
Imágenes originales: Dr. José María Remes Troche.
El uso de enteroscopia permite tener visión directa y una mejor caracterización de las lesiones, además de que esta puede permitir tomar biopsias para estudio histopatológico adicional42. También tiene ventajas terapéuticas, a diferencia de la cápsula endoscópica, ya que, por ejemplo, en caso de existir estenosis tipo diafragma se pueden realizar dilataciones endoscópicas66.
18.- La realización de gastroduodenoscopia, colonoscopia o ambos estudios en consumidores de AINE se justifica en presencia de factores de riesgo o datos de alarma.
Acuerdo alcanzado: 75% totalmente de acuerdo, 25% parcialmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor.
La presencia de síntomas en consumidores de AINE es común, y el inicio de estos parece variar dependiendo del AINE utilizado, como se menciona en el enunciado 13. Aunque alrededor del 1-2% de los consumidores de AINE desarrollará una complicación grave durante su tratamiento, es muy importante destacar que hasta el 50% de los pacientes que presenta una complicación grave no reportaba síntomas previos, por lo que las medidas de prevención deben ser implementadas con base en la existencia de factores de riesgo24.
El papel de la endoscopia en los estudios clínicos básicamente se reserva para determinar el daño agudo o crónico provocado por la toxicidad de los AINE en el sistema digestivo. Sin embargo, ninguno de los consensos o guías, hasta el momento, recomienda su realización de manera rutinaria. El manejo de los pacientes que van a recibir tratamiento con AINE debe ir precedido siempre y de manera obligatoria de una correcta valoración del riesgo gastrointestinal individual.
Por ejemplo, el consenso mexicano sobre dispepsia propone que la endoscopia debe realizarse en todo paciente con dispepsia no investigada que presente síntomas y signos de alarma o falla a un tratamiento inicial orientado al síntoma predominante67. Por otra parte, la American Society for Gastrointestinal Endoscopy (ASGE) señala que, ante la presencia de datos de alarma (síntomas dispépticos en mayores de 50 años, pérdida de peso, hemorragia gastrointestinal, anemia por deficiencia de hierro, síntomas obstructivos, antecedente familiar de cáncer y estudios de imagen sugestivos de enfermedad orgánica), está justificada una endoscopia68. Los principales factores de riesgo que justifican los estudios endoscópicos en el contexto de la enteropatía asociada a AINE se muestran en la tabla 2.
Incluso, con base en la presencia o ausencia de factores de riesgo, se ha estratificado a los pacientes en 3diferentes grupos que se muestran en la tabla 347. Por ejemplo, en un estudio realizado por el Sistema Nacional de Salud en España reveló una tasa de mortalidad de 15.3 por cada 100,000 consumidores de AINE-AAS; aproximadamente el 50% de los pacientes que murieron en este estudio tenían uno o más de los siguientes factores de riesgo: úlcera péptica (22.6%), hemorragia gastrointestinal (15.3%), dispepsia (13.3%), enfermedad cardiaca (65.1%) e hipertensión (40%)30.
Categorías de riesgo para el desarrollo de gastroduodenopatía por AINE
| Riesgo | Eventos por cada 100 pacientes año | |
| Bajo | Sin factores de riesgo y sin consumo de AAS a bajas dosis | < 1.5 |
| Moderado | Sin antecedente de úlcera péptica, sin anticoagulación + 1-2 factores de riesgo | 1.5 a 10 |
| Alto | Antecedente de úlcera péptica, anticoagulados o >2 factores de riesgo | > 10 |
Fuente: Adaptado de Lanas et al.47.
Es importante destacar que no todos los pacientes que consumen AINE de manera aguda o crónica requieren de gastroprotección, por lo que se requiere evaluar de forma individual a cada paciente y decidir con base en ese riesgo30.
19.- La cápsula endoscópica en consumidores de AINE se reserva para la evaluación de pacientes con anemia o hemorragia gastrointestinal cuando la esofagogastroduodenoscopia y la colonoscopia no identifiquen la causa.
Acuerdo alcanzado: 80% totalmente de acuerdo, 20% parcialmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: B2 débil a favor.
Hasta un 5-10% de todas las hemorragias gastrointestinales se originan en el intestino delgado69,70. Con el advenimiento de la cápsula endoscópica (2001) y de la enteroscopia (2004), en la actualidad es posible detectar hasta el 75% de las causas de hemorragia que se originan en el intestino delgado71. Las guías actuales del American College of Gastroenterology proponen una segunda revisión (second look) utilizando gastroduodenoscopia y colonoscopia en pacientes con hematemesis recurrente, melena o examen endoscópico previo incompleto, en casos de hematoquecia recurrente o sospecha de origen distal. En caso de no encontrar el origen de la hemorragia, se deberá considerar que el sangrado se sitúa en el intestino delgado[0] y, por lo tanto, se recomienda el empleo de la cápsula endoscópica como primera opción para la evaluación de estos pacientes72.
20.- La enteroscopia en consumidores de AINE está indicada para la evaluación, toma de biopsias y dilatación de lesiones de intestino delgado.
Acuerdo alcanzado: 100% totalmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: B2 débil a favor.
La enteroscopia, además de ofrecer la posibilidad de observar directamente la superficie mucosa, caracterizar los hallazgos y tomar biopsias, puede tener fines terapéuticos. Por ejemplo, brinda la opción de tratamiento hemostático y de hacer dilataciones, específicamente cuando existen estenosis tipo «diafragma» (proyecciones concéntricas de fibrosis submucosa que puede causar síntomas inespecíficos u obstructivos), lo cual es un hallazgo poco común pero patognomónico de la enteropatía por AINE63,64. Cuando se encuentra indicada la dilatación endoscópica de estas lesiones el éxito terapéutico es del 80%73. Una revisión sistemática sobre dilatación endoscópica de estenosis de intestino delgado demostró que esta intervención evita la necesidad de cirugía en 4 de cada 5 pacientes, con un índice de complicaciones del 4.8% por paciente y del 2.6% por dilatación74.
21.- Los biomarcadores de daño intestinal pueden ser de utilidad para la evaluación de la enteropatía por AINE.
Acuerdo alcanzado: 80% totalmente de acuerdo, 20% parcialmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: C1 fuerte a favor.
Como se menciona en el enunciado 2, el aumento en la permeabilidad y la inflamación mucosa son mecanismos fisiopatológicos asociados al consumo de AINE. En ese sentido, biomarcadores que evalúan de forma indirecta la permeabilidad intestinal como la calprotectina, la lactoferrina fecal, la excreción urinaria de ácido etilendiaminocético marcado con cromo 51-EDTA (Cr51-EDTA) y la centellografía con leucocitos marcados con indio 111 (In 111) y eritrocitos radiomarcados potencialmente pueden tener aplicabilidad en la práctica clínica23. Las pruebas para medir la permeabilidad intestinal se basan en la detección de compuestos administrados por vía oral que posteriormente son eliminados por la orina: en condiciones normales estos compuestos no pueden ser absorbidos, pero en presencia de daño a la barrera o intestinal son llevados hacia el sistema circulatorio para ser eliminados75. La prueba con ácido etilendiaminocético marcado con Cr51-EDTA es una de las más utilizadas, y a través de esta se ha documentado que el 50-70% de los consumidores de AINE a largo plazo desarrollan un aumento de la permeabilidad intestinal76. Aunque muchas de estas pruebas son promisorias, son necesarios más estudios para determinar el papel de cada una de ellas77.
1.2Prevención y tratamiento22.- La prescripción de AINE debe siempre ser precedida de una evaluación integral de los riesgos gastrointestinales y cardiovasculares.
Acuerdo alcanzado: 100% totalmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor.
Antes de iniciar la terapia con un AINE, se debe evaluar cuidadosamente la necesidad real y calcular los riesgos cardiovasculares y gastrointestinales de cada individuo. Los factores de riesgo son los que se establecen en el enunciado 18 y la tabla 1. De igual manera, como se menciona en ese enunciado 18 (tabla 2), con la presencia o ausencia de estos factores se establecen 3 grupos distintos de riesgo y de la inclusión de cada paciente en uno de ellos dependerá la estrategia de prevención gastrointestinal que debemos adoptar.
23.- En sujetos con factores de riesgo gastrointestinal, la prescripción de AINE debe evitarse o hacerlo junto con un inhibidor de la bomba de protones.
Acuerdo alcanzado: 80% totalmente de acuerdo, 20% parcialmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor.
Si no es posible evitar el uso de AINE, existe evidencia que recomienda la prescripción concomitante con IBP con fines profilácticos. Por ejemplo, Scheiman et al.78 publicaron los resultados de 2 ensayos clínicos idénticos, aleatorizados, controlados con placebo: el estudio VENUS (Estados Unidos de Norteamérica, n=844) y PLUTO (internacional, n=585). Ambos ensayos involucraron a pacientes de alto riesgo sin úlcera activa (≥65 años o antecedentes de enfermedad ulcerosa péptica en los últimos 5 años) que continuaban bajo tratamiento con AINE no selectivo o COX-2 selectivos de manera crónica. Se comparó esomeprazol (20 o 40mg administrados una vez al día) contra placebo en lo referente a la tasa de desarrollo de la úlcera a los 6 meses. Las tasas de remisión al final del periodo de estudio fueron, en el estudio VENUS 79.6% para placebo, 94.7% para 20mg de esomeprazol al día y 95.3% para 40mg al día (ambos con p=0.001, comparado con placebo); en el estudio PLUTO fueron 87.7% para placebo, 94.8% para 20mg de esomeprazol diarios (p=0.018) y 95.6% para 40mg esomeprazol al día (p=0.007). En el análisis agrupado, que incluyó solo a los inhibidores COX-2, las tasas de remisión fueron del 83.5% con placebo, 99.1% con 20mg de esomeprazol al día (p=0.001) y 95.9% con 40mg de esomeprazol al día (p=0.002). Ambos estudios demuestran la efectividad de un IBP en la prevención del daño gastrointestinal en consumidores a largo plazo de AINE no selectivos y COX-2 selectivos en una población de alto riesgo.
24.- Prescribir la dosis mínima necesaria de un AINE para obtener el efecto deseado y durante el menor tiempo posible se asocia con menor riesgo de efectos adversos gastrointestinales.
Acuerdo alcanzado: 90% totalmente de acuerdo, 10% parcialmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: C1 fuerte a favor.
La decisión acerca de prescribir un AINE-NS o un inhibidor COX-2 selectivo debe ser balanceada e influida por los posibles eventos gastrointestinales y cardiovasculares. Sin embargo, la eficacia analgésica y antiinflamatoria comparativa también es importante. La efectividad comparativa se ha demostrado en varios ensayos clínicos controlados (ECA). Por ejemplo, un ECA demostró que el etoricoxib tiene una eficacia similar a la del diclofenaco en pacientes con osteoartritis79. Otro ECA mostró que el celecoxib tenía una eficacia similar al naproxeno80. En el estudio celecoxib versus omeprazol y diclofenaco en pacientes con osteoartritis y artritis reumatoide (CONDOR), no hubo diferencia en la efectividad de celecoxib y diclofenaco en pacientes con osteoartritis81. Un metaanálisis de ECA en pacientes con enfermedades reumatológicas, no mostró un aumento del riesgo cardiovascular asociado con celecoxib en comparación con placebo82, mientras que un análisis de seguridad de 6ECA en pacientes con afecciones distintas a la artritis proporcionó evidencia de riesgo cardiovascular dependiente de la dosis de celecoxib, del régimen y del riesgo cardiovascular inicial83. El riesgo pareció ser no significativo (RR=1.1) para la dosis de 400mg al día, intermedio para la dosis de 200mg 2veces al día (RR=1.8) y alto para la dosis de 400mg 2veces al día (RR=3.1)84. En un metaanálisis de inhibidores COX-2 selectivos y de AINE-NS también se encontró una tendencia hacia un menor riesgo con dosis más bajas de celecoxib84.
Sin embargo, el costo del tratamiento también es un factor importante. Después de publicados los resultados del estudio CONDOR, se actualizó en el 2012 el modelo económico de la guía clínica del National Institute for Care Excellence (NICE) del Reino Unido, para incluir riesgos relativos de eventos adversos relacionados con el tubo digestivo distal85.
25.- Los IBP son fármacos seguros y eficaces en la prevención de complicaciones gastroduodenales asociadas al consumo crónico de AINE.
Acuerdo alcanzado: 90% totalmente de acuerdo, 10% parcialmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor.
Los fármacos IBP como el omeprazol, pantoprazol, lansoprazol, esomeprazol, dexlansoprazol, etc., son fármacos efectivos y bien tolerados que actúan inhibiendo a la H/K-adenosintrifosfatasa gástrica por unión covalente a las cisteínas de la bomba de protones, y reducen así la secreción de ácido gástrico. Con el propósito de evaluar la eficacia y seguridad de los IBP, en una revisión sistemática con metaanálisis de 31 ensayos clínicos que incluyeron a 12,532 participantes, los IBP fueron significativamente más efectivos que el placebo en la reducción de las complicaciones ulcerosas (RR=0.29) y de las úlceras pépticas endoscópicas (RR=0.27)86. Cuando se realizó un análisis por subgrupos, no se encontraron diferencias según la clase de AINE, riesgo de úlcera, antecedentes de enfermedad ulcerosa previa, infección por H. pylori o edad. El número necesario para tratar y prevenir una complicación ulcerosa es de 10 pacientes de alto riesgo y de 268 pacientes de riesgo moderado86. El metaanálisis de red indicó que la efectividad de los diferentes IBP en la reducción de las complicaciones de la úlcera y las úlceras pépticas endoscópicas es similar. Los IBP redujeron significativamente los eventos adversos gastrointestinales y la suspensión del medicamento relacionada, en comparación con el placebo; no hay diferencia en seguridad entre los diferentes IBP86.
26.- Los IBP a dosis estándar son más recomendables que los antagonistas de los receptores H2 (ARH2) y que el misoprostol para reducir el riesgo de úlcera péptica y de sus complicaciones en pacientes que consumen AINE a largo plazo.
Acuerdo alcanzado: 75% totalmente de acuerdo, 25% parcialmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor.
Los IBP se han convertido en la piedra angular para la gastroprotección en comparación con otras terapias que inhiben la secreción de ácido gástrico. Por ejemplo, un estudio «pivote» comparó 20mg de omeprazol al día contra 150mg de ranitidina 2veces al día durante 12 semanas, en 425 pacientes consumidores de AINE para la profilaxis de úlcera gástrica y úlcera duodenal, el omeprazol fue superior a ranitidina en la prevención tanto de la úlcera gástrica (RR=0.32) como de la duodenal (RR=0.11)87. Cuatro estudios que incluyeron a un total de 1,478 pacientes han comparado un IBP contra misoprostol (400-800μg) al día y demostraron que los IBP son superiores a misoprostol para la prevención de úlceras duodenales (RR=0.25), pero no de las úlceras gástricas (RR=1.61, efectos aleatorios) o del total de las úlceras (RR=0.90)88-91.
Dos ensayos que incluyeron a 600 pacientes compararon misoprostol (400 a 800μg) versus 150mg 2veces al día92,93. Misoprostol mostró ser superior a ranitidina a dosis estándar para la prevención de úlceras gástricas inducidas por AINE tradicionales (RR=0.12), pero no para las úlceras duodenales (RR=1.00). En un metaanálisis de pacientes que recibieron misoprostol junto con un AINE versus placebo, la incidencia de las úlceras gástricas disminuyó en un 74% y las úlceras duodenales un 58%94. El principal factor limitante que impide el uso generalizado de misoprostol como un agente de protección es la elevada frecuencia de efectos secundarios como diarrea, calambres abdominales y náuseas en hasta el 20% de aquellos que lo consumen, lo que limita el cumplimiento del paciente.
27.-En pacientes bajo terapia con AINE sin antiagregantes plaquetarios, se recomienda la prescripción de IBP solo cuando existe riesgo de complicaciones gastrointestinales.
Acuerdo alcanzado: 80% totalmente de acuerdo, 15% parcialmente de acuerdo, 5% incierto.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor.
Con el propósito de evaluar la efectividad comparativa de las distintas estrategias clínicas para prevenir la toxicidad gastrointestinal inducida por los AINE, investigadores chinos realizaron un metaanálisis pareado y bayesiano de red, en el cual se incluyeron 82 ECA que comparan el riesgo de eventos adversos gastrointestinales en pacientes consumidores de AINE-NS, inhibidores COX-2 selectivos o no a gastroprotección con IBP, ARH2 o misoprostol95. Para todos los criterios de evaluación de la eficacia, la prescripción concomitante de un inhibidor COX-2 selectivo + IBP se asoció con la menor probabilidad absoluta de evento adverso y el rango de seguridad más alto, seguido por los inhibidores COX-2 selectivos solos y, en tercer lugar, por los AINE-NS más IBP95.
28.- En pacientes con alto riesgo gastroduodenal y bajo riesgo cardiovascular, la mejor estrategia para prevenir daño asociado a AINE es la combinación de inhibidores COX-2 selectivos con inhibidores de la bomba de protones.
Acuerdo alcanzado: 100% totalmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: C1 fuerte a favor.
En lo referente al riesgo gastrointestinal, como se mencionó en los enunciados 8 y 9, el perfil de seguridad de los inhibidores COX-2 selectivos es superior al de los AINE-NS. El estudio CONDOR81 y el más reciente GI-REASONS96 demostraron que celecoxib presenta una mayor seguridad en todo el tracto gastrointestinal comparado contra diclofenaco más omeprazol. Un reciente metaanálisis que incluye 52 ensayos clínicos aleatorizados demostró que, en comparación con los AINE-NS, celecoxib se asoció a un riesgo significativamente más bajo de todos los eventos gastrointestinales clínicamente significativos a lo largo de todo el tracto digestivo97.
29.- En los pacientes con alto riesgo cardiovascular y gastroduodenal, se recomienda la combinación de naproxeno e inhibidores de la bomba de protones.
Acuerdo alcanzado: 85% totalmente de acuerdo, 15% parcialmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor.
El metaanálisis más reciente y extenso de ensayos clínicos con datos individuales de pacientes señala que tanto inhibidores COX-2 selectivos como AINE-NS presentan incremento del riesgo cardiovascular frente a placebo, sin diferencias significativas entre ellos de manera global. De entre los AINE no selectivos, el de mayor riesgo cardiovascular fue el diclofenaco, que presentó un riesgo similar al de los inhibidores COX-2 selectivos. Naproxeno, por su parte, a dosis de 500mg cada 12h, no se asoció a incremento del riesgo cardiovascular, a diferencia de ibuprofeno y diclofenaco, los AINE NS más estudiados95. Un caso particular es el de los pacientes que toman AAS, pues hay que tener en cuenta que los AINE como el naproxeno y, sobre todo, el ibuprofeno, interfieren con la actividad antiagregante del AAS98. Dado el buen perfil de seguridad cardiovascular que presenta el naproxeno, su administración 2h tras la ingesta del AAS debería minimizar este riesgo y lo coloca como una buena opción en este tipo de pacientes20.
30.- Los IBP no son útiles para prevenir la enteropatía por AINE. Incluso pueden ser deletéreos.
Acuerdo alcanzado: 85% totalmente de acuerdo, 10% parcialmente de acuerdo, 5% parcialmente en desacuerdo.
Calidad de la evidencia y fuerza de la recomendación: C2 débil en contra de la intervención.
A diferencia del estómago y del duodeno, no existe evidencia de que el ácido gástrico juegue un papel en la patogénesis de daño gastrointestinal inducido por AINE distal al ligamento de Treitz33. Se ha demostrado que la supresión crónica de la secreción de ácido gástrico (con IBP o ARH2) provoca un crecimiento excesivo de bacterias en el intestino delgado, lo cual podría aumentar la gravedad de la enteropatía por AINE. Estudios en roedores señalan que los IBP, en realidad, exacerban la enteropatía inducida por AINE, en lugar de proporcionar efecto benéfico99. En este estudio, las ratas tratadas con un IBP (omeprazol o lansoprazol) desarrollaron sustancialmente más úlceras y hemorragias intestinales cuando se trataron simultáneamente con un AINE (naproxeno o celecoxib) que el grupo de control tratado con placebo más el AINE. Una serie de estudios realizados con videocápsula endoscópica han demostrado alta incidencia (55-75%) de daño en el intestino delgado en voluntarios sanos que toman AINE más un IBP durante un período de 2 semanas51,100-102. Cabe destacar que esta alta incidencia de daño intestinal fue observada en un grupo considerado de bajo riesgo de daño gastrointestinal por AINE, durante un período corto de tratamiento y con coadministración de un medicamento «gastroprotector» (IBP). En un estudio de corte transversal utilizando videocápsula endoscópica, realizado en pacientes con artritis reumatoide bajo tratamiento con AINE durante más de 3 meses, los pacientes de edad avanzada y usuarios de supresores del ácido (ARH2 e IBP) presentaban más probabilidades de desarrollar una enteropatía grave50.
31.- Antes de iniciar tratamiento a largo plazo con AINE, debe investigarse y tratar la infección porHelicobacter pylori.
Acuerdo alcanzado: 90% totalmente de acuerdo, 10% parcialmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: C1 fuerte a favor de la intervención.
La detección de la infección por H. pylori para la prevención de úlceras en pacientes asintomáticos debe evaluarse de manera individual y no se recomienda de forma rutinaria. Sin embargo, se recomienda investigar y erradicar H. pylori en pacientes con antecedentes de enfermedad ulcerosa péptica antes de iniciar tratamiento con dosis baja de aspirina o un AINE39. La infección por H. pylori es un factor de riesgo independiente de desarrollar úlceras y hemorragia por úlcera en consumidores de AINE103,104. El erradicar la infección por H. pylori antes de iniciar el tratamiento con AINE reduce el riesgo de desarrollar úlceras pépticas y de hemorragia por úlcera105,106. Un metaanálisis de 5ECA señaló que la erradicación de la infección por H. pylori en pacientes que consumen AINE estaba asociada con una reducción del 57% en la incidencia de úlcera péptica (RM=0.43, IC 95%: 0.20-0.93)28. En lo que respecta a consumidores crónicos de AINE, la evidencia señala que la erradicación de H. pyloriper se no reduce la incidencia de úlceras pépticas y que la terapia con un IBP es una estrategia que proporciona un efecto más eficaz de reducción de riesgo de úlcera que el erradicar H. pylori107,108.
32.- Existen otras alternativas de profilaxis y tratamiento para la gastroduodenopatía y enteropatía por AINE, cuya utilidad y disponibilidad son limitadas.
Acuerdo alcanzado: 85% totalmente de acuerdo, 15% parcialmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: C1 fuerte a favor de la intervención.
Se ha propuesto que el misoprostol, el metronidazol y la sulfasalazina pueden ser benéficos en el tratamiento o la prevención de la enteropatía por AINE en humanos. Sin embargo, la mayoría de los estudios tienen limitaciones significativas como, por ejemplo, el ser estudios abiertos, no controlados y con tamaños de muestra pequeños. Las observaciones de estudios en animales de que la enteropatía por AINE se acompañaba de cambios drásticos en el número y tipo de bacterias intestinales condujo a una serie de estudios sobre el valor potencial de los probióticos para el tratamiento o la prevención de la enteropatía por AINE. Se ha reportado que la cepa Shirota de Lactobacillus casei protege contra la lesión del intestino delgado inducida por indometacina en ratas, y que sus efectos probióticos pueden estar mediados por los efectos antiinflamatorios del ácido láctico, sin embargo, no existe evidencia en humanos109. Más recientemente, otros autores demostraron que el tratamiento con una mezcla de probióticos (VSL # 3) que contiene L. casei redujo significativamente las concentraciones de calprotectina fecal en voluntarios sanos que recibían indometacina110. La rebamipida es un agente citoprotector antiulceroso que estimula la producción de prostaglandinas endógenas y ha sido utilizado en varios países asiáticos para el tratamiento de úlceras gástricas y lesiones gástricas, como erosiones y edema asociados con gastritis aguda111-113. Existe buena evidencia de que la rebamipida aumenta los niveles endógenos de prostaglandinas, aumenta el flujo sanguíneo, suprime los aumentos de la permeabilidad, elimina los radicales libres y suprime la inflamación en la mucosa gástrica114-116. A través de estas acciones, la rebamipida también ha demostrado ser útil en la prevención de lesiones gastrointestinales inducidas por aspirina, incluso ha demostrado tener un efecto preventivo contra las erosiones de la mucosa del intestino delgado inducidas por la aspirina en el íleon en comparación con el placebo117. En un ensayo controlado aleatorizado llevado a cabo en pacientes con dosis bajas de aspirina o un AINE durante más de 3 meses, la rebamipida demostró ser eficaz en la curación de las erosiones y las úlceras del intestino delgado118.
33.- En la actualidad no existe un tratamiento útil para la enteropatía por AINE; si es posible, se recomienda suspenderlo.
Acuerdo alcanzado: 100% totalmente de acuerdo.
Calidad de la evidencia y fuerza de la recomendación: C1 fuerte a favor de la intervención.
A la fecha no existen terapias eficaces comprobadas para la enteropatía por AINE y la detección sigue siendo un desafío, particularmente debido a la escasa correlación entre la lesión tisular y los síntomas. Además, estudios recientes indican que los fármacos comúnmente usados para proteger el tracto gastrointestinal superior (es decir, IBP) pueden empeorar significativamente el daño inducido por AINE en el intestino delgado. La evaluación del riesgo para enteropatía se ha visto obstaculizada por la falta de conocimiento de los factores de riesgo correspondientes, los cuales, a la inversa de los relacionados con las complicaciones del tracto gastrointestinal superior, aún son poco conocidos. El análisis de los datos del programa MEDAL (es decir, estudios MEDAL, EDGE-I y EDGE-II) ha demostrado que el riesgo de un evento clínico en el tubo digestivo distal con el uso de AINE parece ser constante a lo largo del tiempo, y los principales factores de riesgo son un evento gastrointestinal inferior previo y la edad avanzada119. En un análisis post hoc del ensayo CONDOR81 se demostró que los niveles basales de proteína C reactiva, el antecedente de gastritis y de intolerancia gastrointestinal, la infección por H. pylori, la edad avanzada y el índice de masa corporal se asociaron con pérdida de sangre clínicamente significativa en pacientes con osteoartritis tratados con AINE.
ConclusionesLa evaluación individualizada del perfil de riesgo gastrointestinal y cardiovascular de cada paciente subsidiario de tratamiento con AINE es obligada para todo médico prescriptor. Una vez determinado el perfil de riesgo hay que buscar la opción terapéutica más indicada para cada caso. En los pacientes con alto riesgo (antecedentes de úlcera péptica complicada o terapia antitrombótica) se debe evitar el tratamiento con AINE. En caso de ser necesario, hay que erradicar H. pylori en pacientes con historia ulcerosa e infectados y prescribir inhibidores COX-2 selectivos más IBP. En los pacientes con riesgo cardiovascular alto, naproxeno es el AINE ideal, más IBP si existe riesgo gastrointestinal asociado. En el caso de la enteropatía por AINE, es importante destacar que es una entidad cada vez más frecuente y que, si bien existe mayor capacidad diagnóstica, la profilaxis y el tratamiento son aún limitados.
FinanciamientoEste consenso se realizó con el apoyo de la Asociación Mexicana de Gastroenterología, que permitió la participación, transportación y hospedaje durante la votación presencial. No se recibieron honorarios.
Conflicto de interesesDra. María Victoria Bielsa-Fernández declara no tener conflictos de interés.
Dr. José Luis Tamayo de la Cuesta ha sido ponente y miembro de consejo asesor de Takeda y Chinoin.
Dr. Jesús Lizárraga López declara no tener conflictos de interés.
Dr. José María Remes-Troche es miembro del consejo asesor de Takeda y Asofarma. Recibió fondos para la investigación por Sanfer y Asofarma. Ha sido ponente para Takeda, Asofarma, Alfa-Wassermann, Carnot, Menarini y Astra-Zeneca.
Dr. Ramón Isaías Carmona-Sánchez es o ha sido ponente para Asofarma, Astra-Zeneca y Chinoin.
Dr. Juan Manuel Aldana Ledesma declara no tener conflictos de interés.
Dr. José Manuel Avendaño Reyes declara no tener conflictos de interés.
Dr. Mario Arturo Ballesteros Amozorrutia declara no tener conflictos de interés.
Dr. Mauricio de Ariño declara no tener conflictos de interés.
Dr. Louis de Giau Troulitz declara no tener conflictos de interés.
Dr. Ricardo Flores Rendón ha sido ponente para Takeda.
Dr. Héctor Huerta Guerrero declara no tener conflictos de interés.
Dr. José Alberto González declara no tener conflictos de interés.
Dra. Angélica Hernández Guerrero declara no tener conflictos de interés.
Dr. Enrique Murcio Pérez declara no tener conflictos de interés.
Dr. Joel Jacquez Quintana declara no tener conflictos de interés.
Dr. Arturo Meixueiro Daza declara no tener conflictos de interés.
Dr. José Ramón Nogueira de Rojas declara no tener conflictos de interés.
Dr. Heriberto Rodríguez Hernández declara no tener conflictos de interés.
Dr. Ricardo Santoyo Valenzuela declara no tener conflictos de interés.
Dra. Sandra Concepción Solorzano Olmos declara no tener conflictos de interés.
Dr. Luis F. Uscanga Domínguez es miembro del consejo asesor de Asofarma.
Dr. Felipe Zamarripa Dorsey declara no tener conflictos de interés.