Diarrea crónica es aquella que ocurre por un período mayor de 4 semanas, y es un problema común que afecta hasta 5% de la población adulta. Existen diferentes mecanismos fisiopatológicos que involucran múltiples causas y que incluyen efecto secundario de medicamentos, alteraciones en la anatomía y fisiología posquirúrgicas, trastornos de la pared intestinal y colónica, inflamatorios o malabsortivos, enfermedades pancreatobiliares, y trastornos funcionales y del eje cerebro-intestinal asociados a disbiosis o a alteraciones de la motilidad gastrointestinal. Debido al diagnóstico diferencial tan amplio es importante categorizarla en cinco grupos principales: efecto secundario de medicamentos o cirugías, postinfecciosa, malabsortiva, inflamatoria y funcional. La presente revisión analiza en forma narrativa el abordaje diagnóstico, enfatizando claves en la historia clínica, la utilidad de biomarcadores (aliento, fecales, urinarios, serológicos), así como pruebas de malabsorción, motilidad, y el papel de los estudios radiológicos, endoscópicos, así como los hallazgos histológicos más comunes, y se propone un algoritmo diagnóstico encaminado a determinar la etiología y personalizar la terapia.
Chronic diarrhea is defined by symptoms lasting longer than 4 weeks. It is a common problem that affects up to 5% of the adult population. Different pathophysiologic mechanisms involve numerous causes, including drug side effects, postoperative anatomic and physiologic alterations, intestinal and colonic wall abnormalities, inflammatory or malabsorption causes, pancreatobiliary diseases, and functional or gut-brain axis disorders associated with dysbiosis or gastrointestinal motility alterations. Due to such a broad differential diagnosis, it is important to categorize chronic diarrhea into five main groups: drug side effect, postoperative, postinfectious, malabsorptive, inflammatory, and functional. The present review is a narrative analysis of the diagnostic approach, emphasizing key aspects of the clinical history, the utility of biomarkers (in breath, stool, urine, and serology) and malabsorption and motility tests, the role of radiologic and endoscopic studies, and the most common histologic findings. A diagnostic algorithm aimed at determining etiology and personalizing therapy is also proposed.
La diarrea crónica (DC) se define como disminución en la consistencia de las heces o aumento en el número de deposiciones durante un período mayor a 4 semanas. Tiene una prevalencia de 3-5% en la población adulta, y es una de las entidades con el diagnóstico diferencial más amplio, ya que puede ser secundaria a causas tan heterogéneas como efecto secundario de medicamentos, enfermedades estructurales del intestino delgado y/o colon, resultado de cirugías gastrointestinales previas, trastornos pancreatobiliares inflamatorios o neoplásicos, o bien como parte de un trastorno funcional intestinal como diarrea funcional o síndrome de intestino irritable con predominio de diarrea (SII-D) o postinfeccioso (SII-Pi)1–9.
En el año 2010, la Asociación Mexicana de Gastroenterología publicó las guías clínicas para el manejo y diagnóstico de la diarrea crónica en México10. Sin embargo, desde entonces se han descrito nuevas entidades clínicas y se han desarrollado nuevas pruebas diagnósticas para el abordaje y tratamiento oportuno de la DC. El objetivo fue realizar una revisión narrativa que permita actualizar los conceptos relacionados con el diagnóstico de la diarrea crónica.
Material y métodosSe realizó una revisión que valoró y analizó los artículos publicados en la bibliografía nacional y mundial acerca del diagnóstico y tratamiento de la DC. Para ello se llevó a cabo una búsqueda cruzada a través de los portales de PubMed e IMBIOMED (desde enero de 2011 hasta diciembre de 2020) de los siguientes términos (en español y sus respectivas traducciones y abreviaturas en inglés): diarrea, diarrea crónica, malabsorción intestinal, sobrecrecimiento bacteriano, enfermedad celíaca, enteritis, malabsorción de sales biliares, enfermedad inflamatoria intestinal, colitis, síndrome de intestino irritable con predominio de diarrea y postinfeccioso, infecciones, efectos secundarios de medicamentos, biomarcadores, pruebas diagnósticas, radiología, endoscopia, colonoscopia, enteroscopia, y hallazgos histológicos. Se identificaron los artículos más relevantes al respecto, y se consideró la información proveniente de revisiones técnicas, revisiones sistemáticas, metaanálisis y guías clínicas sobre DC. También se incluyeron los trabajos previos a la fecha de búsqueda relevantes al respecto. Se ordenó la bibliografía y se realizó la revisión considerando los siguientes apartados: fisiopatología, abordaje y entidades clínicas específicas, pruebas diagnósticas y algoritmos.
De un total de 337 artículos obtenidos en la búsqueda se incluyó la información proveniente de 106 ya que se excluyeron casos clínicos, imágenes de casos, artículos en población pediátrica, artículos repetidos o que no se pudieron accesar por estar en un idioma diferente al inglés o al español.
FisiopatologíaExisten múltiples mecanismos fisiológicos que mantienen un balance entre secreción, absorción, y contenido luminal para evitar que exista diarrea. La cantidad de líquido en la evacuación está determinada por su contenido de solutos, de manera que la barrera intestinal, los mecanismos de permeabilidad y las bombas transportadoras de electrólitos permiten mantener un balance entre el líquido extra- e intraluminal. La DC puede dividirse de acuerdo a su mecanismo fisiopatológico en: osmótica, secretora, inflamatoria, malabsortiva, y secundaria a dismotilidad1,7. Las diarreas osmóticas típicamente son acuosas, abundantes y ceden con el ayuno. En la diarrea secretora, la osmolaridad fecal está dada enteramente por electrólitos, y en la osmótica existe una diferencia entre los electrólitos fecales y la osmolaridad medida, llamada brecha osmótica, ocasionada por moléculas pobremente absorbibles3. El uso crónico de laxantes o antiácidos, así como la malabsorción de hidratos de carbono como lactosa, fructosa o sorbitol caen en la categoría de diarrea osmótica. Dentro de las causas secretoras están las colitis microscópicas –las cuales tienen también un componente inflamatorio como mecanismo primario–11, los medicamentos laxantes no osmóticos, la enteropatía diabética, y la diarrea asociada a tumores neuroendocrinos secretores de hormonas (péptido intestinal vasoactivo, somatostatina y/o gastrina) o de sustancias vasoactivas (tumores carcinoides). Las diarreas malabsortivas incluyen todos aquellos trastornos que afectan la superficie del intestino delgado (enteropatías), sobrepoblación bacteriana de intestino delgado (small intestinal bacterial overgrowth [SIBO por sus siglas en inglés]), algunas infecciones como giardiasis, o bien alguno de los procesos involucrados en el proceso de digestión de nutrientes (malabsorción de ácidos biliares, insuficiencia pancreática exocrina). Las diarreas de origen inflamatorio que implican un daño estructural a la mucosa del colon se denominan enfermedad inflamatoria intestinal (EII), e incluyen a la colitis ulcerativa crónica idiopática (CUCI), la enfermedad de Crohn, las colitis indeterminadas, colitis microscópicas, infección por Clostridioides difficile(C. difficile) o algunas formas de SIBO con colonización colónica, colitis isquémica, y algunos casos de malignidad (adenomas vellosos, carcinoma colorrectal [CCR] con afección extensa, actividad tumoral severa, o asociada a diarrea postobstructiva)1–5. Las diarreas asociadas a ingestión de alimentos pueden ocurrir por deficiencia enzimática (v.gr.: deficiencia de disacaridasa), o ser mediadas por mecanismos inmunes (v.gr.: alergia a proteínas de leche y enfermedad celíaca por intolerancia al gluten). Es probable que en algunos casos de DC estén involucrados mecanismos múltiples que incluyan alteraciones autocrinas, luminales, paracrinas, inmunes, neurales y endocrinas que afecten la función vascular, paracelular, muscular y epitelial, resultando finalmente en alteraciones de la permeabilidad, transporte de iones, microbiota y motilidad3,7.
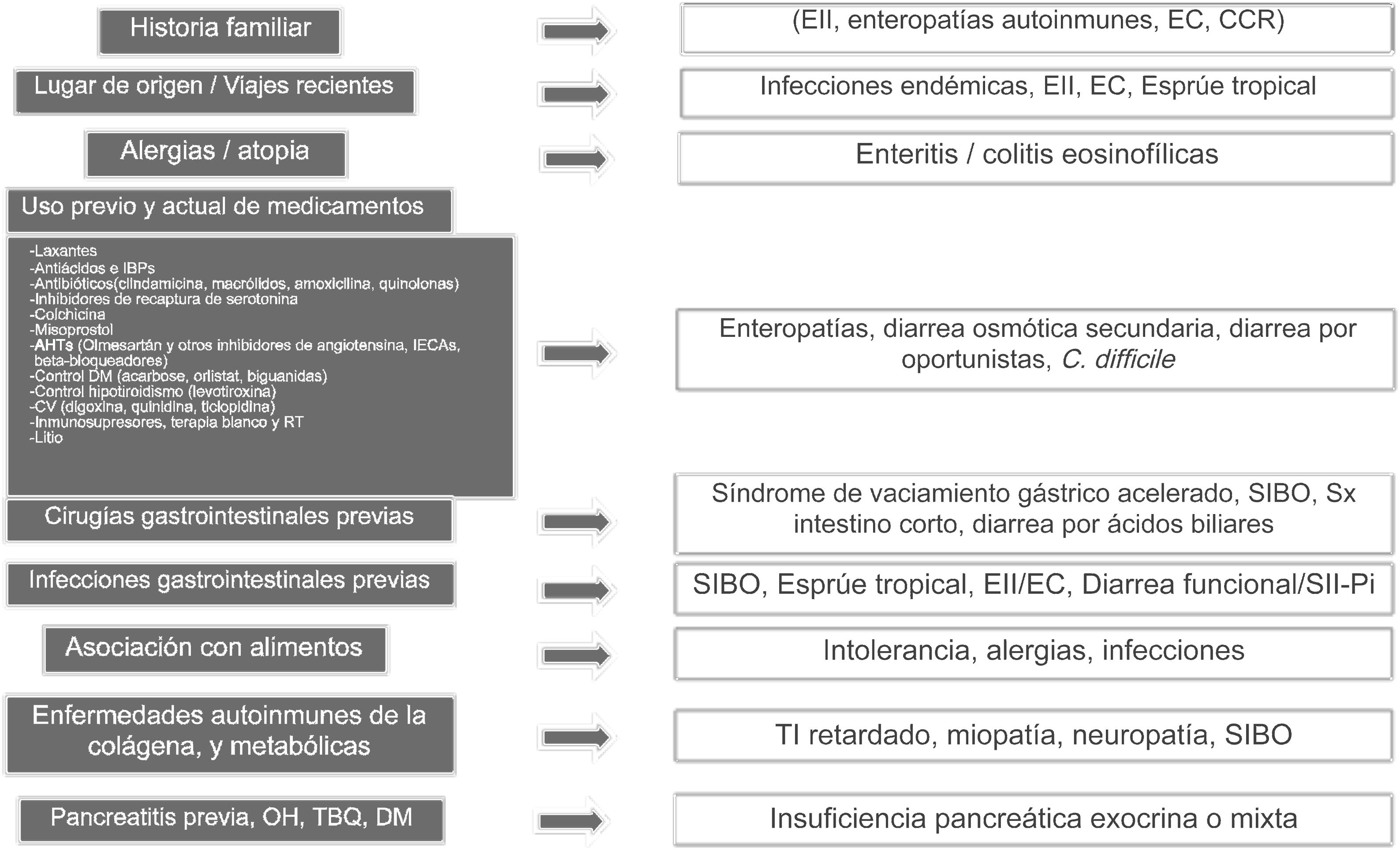
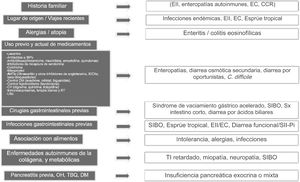
Abordaje clínico y entidades clínicas específicasUna historia clínica detallada es clave dentro de la evaluación de DC, ya que algunos antecedentes o combinaciones de los mismos pueden orientar hacia una o más causas probables (fig. 1)1–3. Es muy importante en primer lugar entender lo que el paciente define como su hábito intestinal normal, que en algunas ocasiones pueden caracterizar como un número aumentado de movimientos defecatorios pero de consistencia normal, término llamado pseudodiarrea, que no debe ser considerado como parte del espectro de diarrea1,4,7,12. Con frecuencia el paciente define diarrea como heces sueltas, frecuencia aumentada de heces de consistencia disminuida, urgencia, o en ocasiones tenesmo. Las características físicas como volumen grande, presencia de lientería, esteatorrea, creatorrea o heces flotantes indican malabsorción o bien problema de intestino delgado o pancreatobiliar. La diarrea acuosa, de volumen pequeño, sin restos alimentarios es característica de los trastornos colónicos. La temporalidad con alimentos puede indicar malabsorción cuando se asocia a distensión, meteorismo, borborigmos o flatulencias, mientras que la urgencia posprandial sugiere tránsito intestinal rápido. Por regla general la diarrea de origen estructural es tanto diurna como nocturna, y la diarrea asociada a dismotilidad o funcional ocurre únicamente de día, particularmente durante el período posprandial. Si existe historia familiar de DC hay que considerar trastornos con una asociación genética como enteropatías autoinmunes, incluyendo enfermedad celíaca, EII, o CCR. El lugar de origen o viajes recientes implican riesgo para ciertas infecciones endémicas que podrían asociarse eventualmente a SIBO. Ciertos grupos con ascendencia nórdica tienen un mayor riesgo de enfermedad celíaca. En sujetos originarios y que viven en un área a nivel del mar una consideración es esprúe tropical. Si existe historia de atopia importante (v.gr.: rinitis alérgica, asma), o historia de alergias alimentarias una fuerte posibilidad son los trastornos gastrointestinales asociados a infiltración por eosinófilos como enteritis o colitis eosinofílicas. Es de vital importancia revisar la lista de uso previo y actual de medicamentos, ya que algunas drogas solas o en combinación pueden aumentar el riesgo de diarrea. Hay que revisar en forma minuciosa por uso previo, reciente o intermitente de laxantes, antiácidos e inhibidores de bomba de protones (IBP), antibióticos (particularmente clindamicina, macrólidos, amoxicilina y quinolonas), colchicina, antihipertensivos (particularmente olmesartán y otros inhibidores del receptor de angiotensina II, inhibidores de enzima convertidora de angiotensina, y beta-bloqueadores), y para otras enfermedades cardiovasculares (digoxina, quinidina, ticlopidina), así como medicamentos para el control de sobrepeso, obesidad y diabetes mellitus, uso de litio, y terapia oncológica, incluyendo inmunosupresores, terapia blanco e inmunoterapia, así como radioterapia previa. Si la DC inició como un cuadro aparentemente infeccioso agudo a partir del cual el paciente notó un cambio en el hábito intestinal, hay que considerar SIBO como primera opción, desarrollo de una EII o enteropatía secundaria a una respuesta cruzada del sistema inmune, o bien diarrea funcional o SII-Pi. En aquellos casos donde el paciente logra identificar una asociación entre los episodios de diarrea y consumo de alimentos hay que considerar varios factores: a) sustancias que en cantidades suficientes ocasionan diarrea en un intestino normal (v.gr.: fructosa), b) alimentos que ocasionan diarrea debido a una condición previa (lácteos en deficiencia de lactasa), c) alteraciones intestinales o hepatobiliares que limitan digestión o absorción (colecistectomía, intestino corto, insuficiencia pancreática), d) intolerancias idiosincráticas y alergias (poco común en adultos: 1-2%), o d) componente infeccioso. Algunos trastornos sistémicos pueden ocasionar diarrea como parte de su cuadro clínico, incluyendo tiroiditis e hipertiroidismo, diabetes descontrolada, enfermedades reumatológicas como esclerosis sistémica, y algunos tumores neuroendocrinos productores de sustancias vasoactivas como histamina o serotonina (v.gr.: carcinoides), prosecretoras como péptido intestinal vasoactivo o somatostatina (v.gr.: VIPomas y somatostatinomas), o sustancias como gastrina que aumentan la secreción ácida, pudiendo manifestarse por enfermedad ácido péptica de difícil control, y diarrea por interferencia en los procesos de digestión de grasas (v.gr.: gastrinoma). Finalmente cuando existe historia de pancreatitis aguda extensa o recidivante, alcoholismo o tabaquismo crónico, o diabetes posterior a un episodio de pancreatitis, una fuerte posibilidad es insuficiencia pancreática exocrina1–4 (fig. 1).
Claves en historia clínica para determinar la causa de diarrea crónica.
AHT: antihipertensivos; CCR: carcinoma colorrectal; CV: cardiovascular; EC: enfermedad celíaca; EII: enfermedad inflamatoria intestinal; IBP: inhibidores de la bomba de protones; IECA: inhibidores de la enzima convertidora de la angiotensina; RT: radioterapia; SIBO: sobrepoblación bacteriana de intestino delgado; SII-Pi: síndrome de intestino postinfeccioso; TI: tránsito intestinal.
Más de 700 medicamentos han sido implicados como causantes de diarrea, que constituye el 7% de todos los efectos secundarios asociados a farmacoterapia13.
- 1.
Antibióticos: destacan en primer lugar los antibióticos, que al inducir disbiosis pueden aumentar el riesgo de infección por C. difficile (ICD). Una revisión sistemática reciente con metaanálisis concluyó que como grupo, los antibióticos tienen una razón de momios de entre 8 y 10 para ocasionar ICD, particularmente clindamicina (OR 46.95), de la cual 1 de cada 10 usuarios la desarrolla. Otros antibióticos tanto parenterales como orales tienen también una asociación mayor: aztreonam OR 29.95, amoxicilina OR 20.05, carbapenem OR 19.16, cefalosporinas OR 15.33, tetraciclinas OR 7.54, macrólidos OR 5.8, e incluso quinolonas, con un OR de 4.9414.
- 2.
Medicamentos asociados a colitis microscópicas: varios grupos de medicamentos aumentan el riesgo de colitis microscópicas, tanto linfocítica como colagenosa. Un trabajo revisó la asociación entre colitis microscópicas y uso previo y actual de tres tipos de drogas: antiinflamatorios no esteroideos (AINE), IBP, y antidepresivos del grupo de los inhibidores selectivos de la recaptura de serotonina (ISRS), y observaron un riesgo aumentado de colitis microscópicas en los 3 grupos: AINE OR 1.86, IBP OR 3.37, e ISRS OR 2.03. El uso reciente de AINE e IBP también se asoció a un riesgo mayor (OR 2.09 y 4.00 respectivamente), así como el uso prolongado (IBP>12 meses OR 4.69, uso AINE>4 meses OR 4.86). Interesantemente la asociación persiste para ambos subtipos de colitis microscópicas: el uso actual de AINE e IBP aumenta el riesgo de colitis colagenosa (OR 2.32 y 5.35 respectivamente), y el de IBP e ISRS el de colitis linfocítica (IBP OR 2.06, ISRS 2.28)15.
- 3.
Inhibidores de angiotensina (IA): una condición recientemente descrita es la enteropatía asociada a IA, un grupo de medicamentos utilizados para control de hipertensión arterial, que pueden inducir cambios intestinales similares a los de enfermedad celíaca, con un cuadro clínico similar16. La mayor asociación se ha descrito con olmesartán (94% de los casos), pero los otros IA pueden también asociarse en forma ocasional (telmisartán 2%, irbesartán 1.6%, valsartán 1.2%, losartán 0.8%, y eprosartán 0.4%)17.
- 4.
Agentes antineoplásicos: un grupo nuevo de medicamentos empleados para tratar distintas formas de cáncer mediante inmunoterapia se denominan inhibidores de los puntos de control (llamados en inglés «check-point inhibitors»). Estos son anticuerpos monoclonales que bloquean al activador de punto de control de inhibición de células T llamado antígeno 4 de linfocitos T citotóxicos (CTLA-4). Dos anticuerpos, pembrolizumab y nivolumab regulan la activación de células T bloqueando la proteína 1 de muerte celular programada (PD-1). El resultado es una actividad antitumoral importante que se ha asociado a regresión tumoral y a sobrevida prolongada en diferentes tumores, como melanoma, cáncer pulmonar de células no pequeñas, mesotelioma, glioblastoma y cáncer renal. El principal efecto secundario deriva de la activación inmune excesiva, y puede afectar distintos órganos, incluyendo el tubo digestivo y el aparato hepatopancreatobiliar. Se han descrito formas severas de toxicidad tanto intestinal como colónica parecidas a las que ocurren en EII, y que pueden manifestarse por erosiones, ulceraciones, atrofia severa y apoptosis, con una variabilidad clínica que va desde diarrea leve a moderada, hasta diarrea refractaria, megacolon y enterocolitis necrosante18–21.
- 5.
Medicamentos usados para control de peso y glucemia: varios medicamentos utilizados para el control de diabetes mellitus y/o sobrepeso y obesidad pueden ocasionar diarrea por diversos mecanismos: acarbosa es un inhibidor de alfa glucosidasa que ocasiona malabsorción de hidratos de carbono, lo cual se asocia a meteorismo y diarrea, orlistat es un inhibidor de lipoproteína lipasa que disminuye la absorción de grasa y ocasiona esteatorrea, y metformina es un inhibidor de gluconeogénesis que mejora la sensibilidad a la insulina, pero puede ocasionar con frecuencia disbiosis y síntomas gastrointestinales como meteorismo, diarrea y dolor abdominal22.
Diversos procedimientos quirúrgicos pueden alterar la anatomía o fisiología gastrointestinal en forma temporal o permanente, ocasionando DC. Las vagotomías tronculares pueden resultar en síndromes de vaciamiento gástrico acelerado (también conocido como dumping), particularmente cuando se acompañan de antrectomía23. Un subgrupo pequeño de pacientes sometidos a funduplicatura puede experimentar diarrea persistente (15%) o distensión abdominal posprandial24. Las resecciones intestinales extensas o que incluyen áreas clave de absorción como íleon terminal o la válvula ileocecal pueden desencadenar diarrea malabsortiva, particularmente cuando el segmento remanente es anormal o corto. Tanto la resección ileal como la colecistectomía pueden asociarse a diarrea por ácidos biliares (DAB)25. Los procedimientos de cirugía bariátrica que incluyen derivaciones (bypass gástrico con Y-Roux, bypass duodeno-ileal y derivación biliopancreática) por sus características intrínsecas ocasionan tránsito intestinal acelerado, malabsorción y diarrea osmótica26. Varios procedimientos pueden aumentar el riesgo de SIBO mediante diversos mecanismos: disminución en acidez gástrica (vagotomía), estasis (estenosis de anastomosis, adherencias), asa ciega (enteroanastomosis laterales), o resección de la válvula ileocecal (reflujo de contenido colónico hacia íleon)27.
EnteropatíasLas enfermedades que afectan la pared intestinal se denominan enteropatías, y pueden asociarse a DC, la cual se presenta clínicamente en este grupo de pacientes como un síndrome de absorción intestinal deficiente (SAID) caracterizado por diarrea explosiva con esteatorrea, creatorrea, lientería, heces flotantes, y en algunos casos por anemia, dolor abdominal y pérdida ponderal. Existen diferentes categorías de acuerdo a la causa, que se pueden dividir en:
- 1.
Causas autoinmunes: incluyen a la enfermedad celíaca, enfermedad de Crohn y otras enteropatías autoinmunes con afección en una o varias áreas intestinales.
- 2.
Medicamentos: de los antihipertensivos, los IA, particularmente olmesartán, se han asociado a desarrollo de enteropatía atrófica similar a la enfermedad celíaca, los AINE pueden ocasionar enteritis ulcerosa, particularmente en duodeno e íleon terminal, los inmunosupresores como azatioprina, metotrexate y micofenolato mofetil, además de los inhibidores de los puntos de control como nivolumab que pueden ocasionar diversos grados de daño mucoso enteral.
- 3.
Radioterapia (RT): hasta el 20% de los pacientes expuestos a RT pueden desarrollar daño intestinal, típicamente entre 1 y 6 años postexposición, y es dependiente de dosis, usualmente cuando excede 5000 cGy (centi-Gray).
- 4.
Causas infecciosas: incluyen al esprúe tropical, sobrepoblación bacteriana de intestino delgado (SIBO), giardiasis, enfermedad de Whipple, infección por virus de inmunodeficiencia humana y gérmenes oportunistas asociados, tuberculosis, enteropatías posvirales, y enteritis linfocítica asociada a infección por Helicobacter pylori.
- 5.
Trastornos infiltrativos y neoplásicos: este grupo incluye a las enteritis eosinofílicas, esprúe colagenoso, amiloidosis, linfoma de células T o B asociado a enteropatías, linfoma intestinal linfoproliferativo, y algunos tumores neuroendocrinos productores de sustancias vasoactivas, particularmente gastrinomas, VIPomas y tumores carcinoides intestinales.
- 6.
Causas misceláneas: incluyen condiciones tan diversas como duodenitis péptica, alergias alimentarias, desnutrición, linfangiectasias, inmunodeficiencia variable común, o esprúe idiopático, que pueden ocasionar también SAID27–32.
La diarrea de origen colónico se manifiesta con síntomas de predominio posprandial, precedidos por cólico o urgencia, las heces son líquidas pero de volumen pequeño, pueden ser acuosas, o bien sanguinolentas y con moco si es la causa es inflamatoria. Desde el punto de vista fisiopatológico pueden ser secundarias a un problema inflamatorio de pared, como en EII o diarrea infecciosa, inflamación de bajo grado que afecta los mecanismos de producción de moco y absorción de líquidos, como en colitis microscópicas, o DAB. En forma similar a las enteropatías, las colonopatías se dividen de acuerdo a su causa, y la clasificación es similar:
- 1.
Causas autoinmunes: CUCI, enfermedad de Crohn, colitis microscópicas (linfocítica o colagenosa).
- 2.
Medicamentos: antibióticos, AINE, inmunosupresores, radioterapia (aguda o crónica, usualmente cuando excede 6000 cGy), e inmunoterapia, particularmente inhibidores de puntos de control.
- 3.
Infecciones crónicas. C. difficile, Campylobacter jejuni (C. jejuni), Yersinia enterocolitica, virus (citomegalovirus, virus del herpes simple), parásitos no oportunistas (Entamoeba histolytica, Cyclospora cayetanensis), y parásitos oportunistas (Cryptosporidium, Isospora belli).
- 4.
Trastornos infiltrativos y neoplásicos: colitis eosinofílica, amiloidosis, tumores neuroendocrinos, adenomas vellosos y CCR (diarrea postobstructiva o asociada a factores de liberación tumoral).
- 5.
Cirugía colónica previa: colitis por derivación, sigmoidectomía, colectomía subtotal y total, y proctocolectomía.
- 6.
Trastornos motores y funcionales: diarrea funcional, SII-D, y SII-Pi3–12,30,33–36.
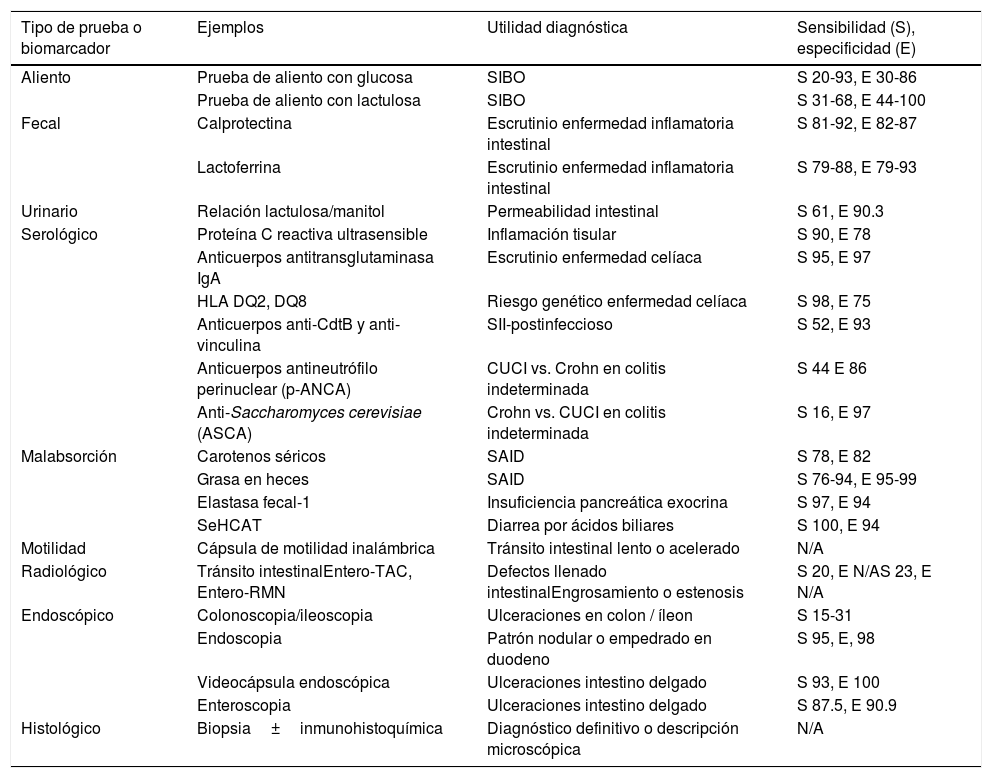
Dado el amplio diagnóstico diferencial y fisiopatológico de DC, existen múltiples pruebas diagnósticas dirigidas al sitio de origen y mecanismo (s) fisiopatológico (s). Existen por lo tanto también, múltiples biomarcadores medibles en aliento, fecales, urinarios, serológicos, pruebas de malabsorción y motilidad, así como hallazgos radiológicos, endoscópicos, e histológicos que nos pueden orientar, y en la mayoría de los casos diagnosticar la causa de la misma (tabla 1).
Utilidad de pruebas diagnósticas en diarrea crónica
| Tipo de prueba o biomarcador | Ejemplos | Utilidad diagnóstica | Sensibilidad (S), especificidad (E) |
|---|---|---|---|
| Aliento | Prueba de aliento con glucosa | SIBO | S 20-93, E 30-86 |
| Prueba de aliento con lactulosa | SIBO | S 31-68, E 44-100 | |
| Fecal | Calprotectina | Escrutinio enfermedad inflamatoria intestinal | S 81-92, E 82-87 |
| Lactoferrina | Escrutinio enfermedad inflamatoria intestinal | S 79-88, E 79-93 | |
| Urinario | Relación lactulosa/manitol | Permeabilidad intestinal | S 61, E 90.3 |
| Serológico | Proteína C reactiva ultrasensible | Inflamación tisular | S 90, E 78 |
| Anticuerpos antitransglutaminasa IgA | Escrutinio enfermedad celíaca | S 95, E 97 | |
| HLA DQ2, DQ8 | Riesgo genético enfermedad celíaca | S 98, E 75 | |
| Anticuerpos anti-CdtB y anti-vinculina | SII-postinfeccioso | S 52, E 93 | |
| Anticuerpos antineutrófilo perinuclear (p-ANCA) | CUCI vs. Crohn en colitis indeterminada | S 44 E 86 | |
| Anti-Saccharomyces cerevisiae (ASCA) | Crohn vs. CUCI en colitis indeterminada | S 16, E 97 | |
| Malabsorción | Carotenos séricos | SAID | S 78, E 82 |
| Grasa en heces | SAID | S 76-94, E 95-99 | |
| Elastasa fecal-1 | Insuficiencia pancreática exocrina | S 97, E 94 | |
| SeHCAT | Diarrea por ácidos biliares | S 100, E 94 | |
| Motilidad | Cápsula de motilidad inalámbrica | Tránsito intestinal lento o acelerado | N/A |
| Radiológico | Tránsito intestinalEntero-TAC, Entero-RMN | Defectos llenado intestinalEngrosamiento o estenosis | S 20, E N/AS 23, E N/A |
| Endoscópico | Colonoscopia/ileoscopia | Ulceraciones en colon / íleon | S 15-31 |
| Endoscopia | Patrón nodular o empedrado en duodeno | S 95, E, 98 | |
| Videocápsula endoscópica | Ulceraciones intestino delgado | S 93, E 100 | |
| Enteroscopia | Ulceraciones intestino delgado | S 87.5, E 90.9 | |
| Histológico | Biopsia±inmunohistoquímica | Diagnóstico definitivo o descripción microscópica | N/A |
CUCI: colitis ulcerativa crónica idiopática; E: especificidad; EII: enfermedad inflamatoria intestinal; N/A: no aplicable; S: sensibilidad; SAID: síndrome de absorción intestinal deficiente; SIBO: sobrepoblación bacteriana de intestino delgado.
Las pruebas de aliento consisten en la determinación en partes por millón de hidrógeno o metano exhalado en el aire espirado durante cierto tiempo tras la administración de un sustrato, como glucosa, lactulosa, lactosa, fructosa o sorbitol. El fundamento teórico se basa en que la producción de hidrógeno en los humanos se debe al metabolismo bacteriano de los hidratos de carbono, de manera que si estos no se absorben, las bacterias colónicas los metabolizan liberando hidrógeno, el cual difunde a través de la pared intestinal, de ahí hacia el torrente sanguíneo, y es excretado por los pulmones, permitiendo ser detectado en el aliento y medido en partes por millón (ppm). Las pruebas realizadas con glucosa y/o lactulosa sirven para establecer si existe fermentación bacteriana intestinal de la misma, lo que sugeriría SIBO. En el caso de los otros hidratos de carbono una prueba positiva significa intolerancia al carbohidrato ingerido. Existen diferentes protocolos y duración para cada prueba: por regla general se considera positiva si existe un aumento de 10-20ppm (>10ppm de metano,>20ppm de hidrógeno) con respecto al soplo basal, 90 min tras la ingestión del sustrato para la prueba de glucosa y/o lactulosa, y hasta 5 h para la prueba de lactosa. La sensibilidad (S) y especificidad (E) dependen del tipo de sustrato y del criterio utilizado, para SIBO, a 90 min la prueba de aliento con glucosa tiene una S de entre 20-93% y una E 30-86%, y la de lactulosa una S 31-68% y una E 44-100%. La utilidad principal de estas pruebas en DC es como escrutinio de SIBO, predecir respuesta a rifaximina, o para descartar intolerancia a hidratos de carbono específicos37–39.
Biomarcadores fecalesDurante un cuadro de diarrea aguda o subaguda la presencia de leucocitos en heces indica que la diarrea es inflamatoria. En DC su utilidad es menor. La determinación de coproparasitoscópicos y coprocultivos tiene baja S y E y no se recomiendan10. Los análisis encaminados a determinar la composición física, química y osmótica de la evacuación, como peso en 24 h, determinación de brecha osmótica, presencia de alimentos o fibra, aunque pudieran orientar al mecanismo implicado, no son útiles desde el punto de vista clínico en DC4–7. Recientemente ha surgido una prueba que determina mediante técnica de reacción de polimerasa en cadena (PCR) la presencia de material genético bacteriano, viral o parasitario en las heces, llamada panel gastrointestinal fecal infeccioso por PCR (FilmArray GI Panel®, BioFire Diagnostics, Salt Lake City, UT, EE. UU.). Esta prueba es de mayor utilidad en diarrea aguda persistente o subaguda, ya que en DC tiene una S de 54.8%, y una tasa alta de falsos positivos, particularmente a distintas cepas de Escherichia coli enteropatógena o enterotoxigénica, pero en casos seleccionados permite determinar la presencia de gérmenes patógenos causantes de DC como Giardia, o C. difficile, siendo de mayor utilidad en el último caso, cuando existe un resultado discrepante entre la determinación de citotoxinas A/B, y glutamato deshidrogenasa fecal40. Existen tres marcadores fecales derivados de leucocitos: la calprotectina, la lactoferrina y la elastasa de polimorfonucleares. Los dos primeros se encuentran disponibles en varios laboratorios y son de utilidad como escrutinio de EII en DC. La S y E dependen del valor de corte utilizado, y las pruebas pueden reportarse en forma cualitativa o cuantitativa. Para la calprotectina fecal un corte de 50 mcg/g tiene S 81-92% y E 82-87%, y si el corte se aumenta a 1000 mcg/g la razón de momios para diagnóstico de EEI es 27.8. En el caso de la lactoferrina, el valor de corte varía entre 4.0 y 7.25 mcg/g, por lo que la S que varía de 79-88%, y la E 79-93% dependiendo del valor41–44. Un resultado positivo indica inflamación de pared intestinal o colónica y la necesidad de realizar colonoscopia e ileoscopia. Otros marcadores detectados en heces son la quimotripsina y elastasa fecales, que son discutidos en la sección de pruebas de malabsorción.
Biomarcadores urinariosLa medición de la relación lactulosa/manitol en orina es una prueba de permeabilidad intestinal (PI) que permite en forma similar a la lactoferrina y calprotectina discernir entre causas inflamatorias y no inflamatorias intestinales. La prueba consiste en ingerir una solución de 50ml con 10g de lactulosa y 5g de manitol después de un ayuno nocturno, y tras recolectar la orina durante 6 h y refrigerarla a -20 grados centígrados, se miden los niveles de los azúcares mediante cromatografía líquida, y la PI se expresa como la relación del porcentaje de la excreción urinaria de lactulosa y manitol (L/M). Se considera anormal cuando es igual o mayor a 0.030. Un estudio reciente comparó el desempeño de la PI medida por este método, contra la lactoferrina fecal, y aunque fue inferior (S 87.8% vs. 61%, E 93.6% vs. 90.3%), la PI permitió identificar mejor causas estructurales originadas en el intestino delgado, por lo que en un futuro podría utilizarse como una prueba complementaria a los biomarcadores fecales de inflamación45. Otros dos biomarcadores medibles en orina, la prueba de D-xilosa y el pancreolauryl, se discuten en el apartado de pruebas de malabsorción.
Biomarcadores serológicosVarios biomarcadores medibles en suero permiten detectar inflamación tisular o la presencia de anticuerpos con S y E variables para la detección de diversos padecimientos asociados a DC.
- a)
Velocidad de sedimentación globular (VSG o velocidad de eritrosedimentación): es uno de los más utilizados, pero los valores considerados normales varían de acuerdo a la edad (por arriba de 30 años es una tercera parte de la edad o menos). Estudios que han comparado los valores de VSG en poblaciones con EII y trastornos funcionales han encontrado múltiple sobreposición entre grupos, por lo que un valor elevado no discrimina SII ni predice EII7,10,44.
- b)
Proteína C reactiva: la proteína C reactiva y la proteína C reactiva ultrasensibles son marcadores con alta S para detectar inflamación tisular, pero tienen baja E, por lo que no discriminan el sitio de inflamación. La proteína C reactiva tiene un nivel de corte de 5-6mg/l, y una S de 73% y E 78% para predecir EII, y la proteína C reactiva ultrasensible, tomando un valor de corte<6mg/l tiene S>90% para detectar inflamación tisular1,2,7,42–44.
- c)
Anticuerpos para la detección de enfermedad celíaca: varios biomarcadores tisulares han sido ensayados para la búsqueda de enfermedad celíaca como causa de DC. Los anticuerpos antigliadina fueron los primeros en ser utilizados, pero tienen una baja S ya que pueden ser positivos en 12% de población sana y hasta en 17% de pacientes con SII. Se ha reportado que los anticuerpos antiendomisio tienen S y E altas, pero los métodos de realización en los laboratorios varían, con lo que la S y E pueden variar también46,47. Los anticuerpos IgG contra gliadina deaminada (DGP) es una herramienta más reciente, cuya positividad depende de la ingestión activa de gluten, y en 80% de los casos negativizan tras una dieta sin gluten mayor a 6 meses, y no se encuentran disponibles aún en la mayor parte de los laboratorios clínicos48. Los anticuerpos antitransglutaminasa tisular IgA (anti-TTG) es la mejor prueba no invasiva en personas mayores de 2 años, con una S de 95% y E de 95-97%, y a mayor titulación, mayor probabilidad de un verdadero positivo. Dado que son anticuerpos IgA, es necesario medir también la concentración de este anticuerpo en sangre, ya que entre 2-3% de la población sana no los produce, lo que puede interpretarse como un verdadero negativo cuando en realidad es un falso negativo. La otra razón que los puede negativizar, o disminuír su titulación, de manera similar a los DGP, es la dieta sin gluten por varias semanas o meses46,47,49. Finalmente el factor de riesgo genético más importante para enfermedad celíaca es la presencia de haplotipos HLA DQ2 y DQ8, los cuales se encuentran positivos en un 98% de sujetos con enfermedad celíaca, pero también en 25-30% de la población sana, y pueden ser positivos en otras enfermedades no relacionadas, como hepatopatías (45%), trastornos funcionales digestivos (53%), y otros padecimientos gastrointestinales (46%). Una revisión reciente concluyó que tienen una S 95% y un valor predictivo negativo (VPN) de 98%50. Las guías nacionales e internacionales recomiendan su búsqueda en situaciones especiales, como discrepancia entre hallazgos histológicos y de anticuerpos, o en aquellos pacientes ya bajo dieta sin gluten y con alta sospecha46,49. Otras enteropatías y colonopatías de origen autoinmune presentan con frecuencia autoanticuerpos positivos, por ejemplo, la enteritis autoinmune que se asocia en 85-90% de los casos a la presencia de anticuerpos antienterocito o anti células caliciformes positivas51.
- d)
Anticuerpos para el diagnóstico de enfermedad inflamatoria intestinal: los pacientes con enfermedades inflamatorias del colon pueden desarrollar autoanticuerpos incluso años antes del inicio de síntomas (CUCI: anticuerpos anti neutrófilo citoplásmico o cANCA, enfermedad de Crohn: anticuerpos anti Saccharomyces cerevisiae o ASCA, y anti flagelina X). La utilidad de estos anticuerpos está limitada a diferenciar entre CUCI y enfermedad de Crohn cuando los hallazgos endoscópicos y/o histológicos son insuficientes, o en casos de colitis indeterminada. Los p-ANCA tienen S 44% y E 86% para CUCI, y los ASCA S 16%, E 97% para enfermedad de Crohn52. Finalmente los pacientes con colitis microscópicas si bien pueden tener anticuerpos antinucleares positivos con mayor frecuencia, se han descrito casos con anticuerpos antigliadina o ASCA positivos, ninguno de los cuales son específicos ni son de utilidad diagnóstica53.
- e)
Anticuerpos anti-CdtB y antivinculina: esta prueba deriva del concepto que una gastroenteritis infecciosa puede afectar la motilidad gastrointestinal, y modelos murinos han demostrado que una toxina bacteriana de C. jejuni, llamada «cytolethal distending toxin B (CdtB)», causa síntomas parecidos al SII, y que los anticuerpos anti-CdtB pueden reaccionar contra vinculina, una proteína citoesquelética requerida para la migración neuronal en las células de Cajal y ganglios mientéricos, y alterar la motilidad gastrointestinal. Esta prueba ha sido comparada entre pacientes con SII, controles sanos, y con EII, y se ha observado que en SII existe una densidad óptica mayor de anti-CdtB, así como una concentración mayor de anticuerpos antivinculina. La primera generación de la prueba tenía una S baja (<40%), y una E cercana a 90%54. Tras corrección de epítopes la segunda generación ha mostrado una E 90-93%, con una S 52%, y su utilidad principal es cuando existe sospecha de SII o diarrea funcional de origen postinfeccioso55. En casos especiales cuando se sospecha diarrea asociada a tumores neuroendocrinos pueden medirse en sangre los niveles séricos de péptido intestinal vasoactivo, gastrina, cromogranina o calcitonina, o bien los niveles urinarios de ácido 5-hidroxi-indolacético, pero dada la baja probabilidad preprueba y la tasa de falsos positivos, estas pruebas no deben formar parte de la evaluación rutinaria de DC3.
Varias pruebas permiten detectar alteraciones en los diferentes mecanismos de digestión y/o absorción intestinal56:
- 1.
Carotenos séricos: los betacarotenos requieren que los mecanismos de absorción de la pared intestinal estén intactos, por lo que un nivel sérico disminuido al azar puede ser indicativo de malabsorción o de desnutrición. En general se considera un valor normal>130 mcg/dl (rango 112-385), no diagnóstico entre 100 y 130, sugestivo de SAID cuando se encuentran <100 mcg/dl, con S 78%, y E 82%, y altamente sugestivos cuando la concentración es <60 mcg en mujeres o <50 mcg en hombres10,56,57. Una carga con carotenos puede diferenciar al paciente con desnutrición de aquel con malabsorción, al normalizar el nivel tras su administración en el primer caso.
- 2.
Grasa fecal: la determinación de grasa en heces, en forma cualitativa o cuantitativa en DC es también sugestiva de SAID. Si se realiza en forma cualitativa se determina mediante una tinción de Sudán III con ácido acético glaciar (anormal>100 glóbulos o glóbulos con diámetro>4μg por campo de alto poder), con S de 76-94% y E 95-99%, y en forma cuantitativa se considera anormal si la concentración es>7g/24 h (dependiendo del porcentaje de grasa de la dieta), y un peso fecal mayor a 1000g/24h indica causas severas de malabsorción como insuficiencia pancreática, trastornos biliares o una causa neuroendocrina. Puede servir también de apoyo cuando la concentración de betacarotenos se encuentra en rango no diagnóstico4,5,56,58,59.
- 3.
Prueba de D-xilosa: la D-xilosa es una pentosa que se absorbe en forma activa y por difusión pasiva y que evalúa la capacidad absortiva intestinal. Desde hace muchos años se ha utilizado para establecer si la malabsorción es secundaria a un defecto de pared intestinal de entre otras causas. La prueba consiste en la administración de 25g de D-xilosa vía oral+500ml de agua, seguido de la recolección de orina de 5h (anormal <4g o 16% de excreción), o concentración sanguínea 1-2h postingestión (anormal <20mg/dl). Ante una prueba de D-xilosa anormal el siguiente paso es descartar problema de pared intestinal, aunque puede haber falsos positivos en caso de deshidratación, insuficiencia renal, ascitis, o si el volumen urinario es menor a 150ml durante las 5h de prueba10,56,60.
- 4.
Pruebas para insuficiencia pancreática: tres pruebas pueden establecer si la DC es secundaria a insuficiencia pancreática exocrina: pancreolauryl, elastasa fecal-1, y la prueba de estimulación con secretina o colecistocinina (CCK). En la prueba de pancreolauryl se administra dilaurato de fluoresceína junto con una porción de carbohidrato y grasa, y tras recolectar la orina durante 8 h, se determina el porcentaje de excreción de fluoresceína urinario, considerándose normal si es mayor a 30%, dudoso entre 20 y 30%, y anormal cuando se encuentra debajo de 30%. También se puede utilizar un corte de 4.5 mcg/ml, el cual tiene una S de 82%, y E 91%56,61. La determinación de elastasa fecal-1 es una prueba más reciente, que permite discernir si la DC es secundaria a insuficiencia pancreática exocrina, y con un valor de corte <200 mcg/g, la S varía entre 77-96%, y la E 88%, con un valor de corte menor (100 mcg/G) la S es 97%, E 84%; valor predictivo positivo 66% y VPN 100%62,63. Las pruebas de estimulación con secretina o con CCK, se realizan recolectando las secreciones provenientes del ámpula de Vater vía endoscopia tras la estimulación vía endovenosa, pero dada su naturaleza invasiva y con pruebas alternativas con S y E razonables como el pancreolauryl o la elastasa fecal-1 cada vez se realizan menos10.
- 5.
Malabsorción de ácidos biliares: los ácidos biliares son sustancias metabólicamente activas, que al exceder una concentración en colon>3 mmol/l modifican la fisiología. Las bacterias colónicas tienen la capacidad de convertir ácidos biliares primarios prosecretores en secundarios secretores, los cuales disminuyen la absorción de sodio y aumentan la secreción de cloro, ocasionando diarrea33. Una causa cada vez más reconocible de DC es la DAB. Se ha descrito que hasta un 22.5% de los pacientes con diarrea funcional o SII tienen DAB64. Varias pruebas pueden detectar malabsorción de ácidos biliares, como la medición sérica de niveles de 7-alfa-hidroxi-4-colesten-3-ona o factor de crecimiento de fibroblastos tipo 19, la medición de ácidos biliares fecales durante 48 h, o el gammagrama con ácido homotaurocólico con selenio radiomarcado (prueba de SeHCAT). Un valor de retención corporal <15% al día 7 tiene una S de 100% y E 94%, pero la prueba se encuentra poco disponible. En forma más práctica, la respuesta clínica positiva a agentes secuestradores de ácidos biliares como colestiramina o colestipol puede también utilizarse como prueba terapéutica de DAB1,3,4,7,10,32,64.
La cápsula de motilidad inalámbrica es un dispositivo ingerible con sensores de pH y presión, que permite medir el tiempo por segmentos intestinales en base a cambios en el pH, presión, y temperatura, lo cual ha permitido establecer valores normales para cada segmento gastrointestinal65. En DC su utilidad se limita a medir el tiempo de tránsito de intestino delgado (TI), ya que un tránsito lento puede predisponer a SIBO66, y un TI acelerado a vaciamiento prematuro del contenido intestinal hacia el colon, permitiendo el paso de sustancias no digeridas que son osmóticamente activas. La mediana de TI medido por cápsula de motilidad es 4.6h, se considera TI rápido si es <2.5h, normal entre 2.5-6h, y lento cuando es mayor a 6h65.
Estudios radiológicosExisten diferentes estudios de imagen que pueden indicar en forma indirecta si existe alguna anormalidad anatómica estructural como estenosis, fístulas o divertículos intestinales, identificar calcificaciones en el área del páncreas, delinear grado y extensión de EII, detectar tumores potencialmente secretores, particularmente neuroendocrinos, o alteraciones de motilidad asociadas a TI acelerado. Algunos estudios sencillos como una placa simple de abdomen pueden ser útiles al mostrar calcificaciones en el área del páncreas que sugieran pancreatitis crónica. Un estudio de tránsito intestinal con contraste oral permite medir el tiempo de llenado de la válvula ileocecal o bien observar la presencia de defectos de llenado o áreas de floculación sugestivas de malabsorción en una o varias áreas del intestino delgado. Esta prueba sin embargo tiene un rendimiento diagnóstico bajo en DC (20%). La tomografía abdominal computada (TAC) y la resonancia magnética nuclear (RMN), además de permitir identificar tumoraciones, particularmente al realizarse junto con una tomografía con emisión de positrones (PET-scan), tienen variaciones al protocolo que permiten una mejor visualización intestinal (entero-TAC y entero-RMN), y ayudan a identificar engrosamiento focal o por segmentos, que pueden sugerir la presencia de enfermedad de Crohn u otras causas inflamatorias intestinales o colónicas. Aunque su rendimiento diagnóstico aumenta cuando hay dolor y diarrea, este es de 23% cuando el único síntoma es DC67,68.
Estudios endoscópicosLos estudios endoscópicos apoyan el diagnóstico de la causa de DC en dos formas: al confirmar lesiones macroscópicas que sean diagnósticas de una enfermedad, y al permitir la toma de biopsias para el diagnóstico histológico final.
- 1.
Colonoscopia: el papel de la colonoscopia e ileoscopia en DC consiste en identificar hallazgos macroscópicos que sugieran daño mucoso sugestivo de EII, y en aquellos casos cuando la apariencia intestinal o colónica es normal, para la toma de biopsias que permitan determinar si existe enteritis o colitis microscópicas u otras condiciones inflamatorias. La colonoscopia tiene un rendimiento diagnóstico global en DC que varía entre 15-31% (2-15% si es DC acuosa), pero es superior a la sigmoidoscopia, ya que permite la toma de biopsias en cada segmento colónico, aumentando la posibilidad de diagnosticar colitis microscópicas, así como daño microscópico en íleon terminal. 69–72. Dos estudios mexicanos concluyeron que la colonoscopia con toma de biopsias permite establecer el diagnóstico histológico específico entre 28%71 y 36%72 de los casos de DC. El rendimiento diagnóstico de las biopsias de íleon varía de acuerdo a la indicación (promedio 10% en DC), y aumenta en casos con anormalidades detectadas mediante estudios de imagen o al observar erosiones, ulceraciones, o bien alteraciones macroscópicas al utilizar endoscopios de alta definición con cromoendoscopia virtual73,74.
- 2.
Esofagogastroduodenoscopia: ciertas enfermedades tienen una predilección por alguna área particular del intestino, por ejemplo, enfermedad celíaca es más fácilmente detectable en duodeno, donde puede observarse un patrón nodular o reticular con los endoscopios de luz blanca, o reducción macroscópica de vellosidades con los de magnificación. La endoscopia superior permite además la toma de biopsias duodenales, y en algunos casos seleccionados, aspirados para cultivo y antibiograma. Aunque se ha reportado que los hallazgos endoscópicos duodenales como nodularidad o un aspecto reticular pueden ser inespecíficos, un estudio evaluó el rendimiento diagnóstico de los hallazgos endoscópicos duodenales típicos, y reportó que la presencia de cualquiera de ellos tenía una S de 95% y una E de 98.4% comparado con el estándar de oro (hallazgos histopatológicos). De estos, la reducción del grosor de los pliegues circulares tuvo la menor precisión diagnóstica, mientras que el patrón en mosaico, reticular o con fisuras se asoció a una E 98-99%, con razones de momios superiores a 1275.
- 3.
Enteroscopia y videocápsula endoscópica: los estudios que evalúan el intestino medio, como la videocápsula endoscópica (VCE) o la enteroscopia con uno o doble balón tienen un rendimiento diagnóstico de 42-77% en DC, el cual depende de la identificación de erosiones, úlceras aftoides o serpiginosas, eritema, edema o estenosis luminal76,77. Un estudio reciente reportó que la VCE puede cambiar el diagnóstico en 1 de cada 3 casos77, mientras otro trabajo concluyó que aunque el rendimiento diagnóstico es 44%, este disminuye en forma considerable en DC si los marcadores de inflamación como la calprotectina son negativos78. Específicamente en enfermedad celíaca, la VCE mostró una S 87.5% y E 90.9% en un estudio multicéntrico usando histología como el estándar de oro, y tras comparar con hallazgos sugestivos como apariencia en mosaico o nodular, fisuras o mucosa plana79. La enteroscopia, en cualquiera de sus modalidades (balón, doble balón o espiral, anterógrada, retrógrada) permite la toma de biopsias guiada por segmento, y de ese modo confirmar el diagnóstico histológico hasta en 86% de enteropatías, y 78% de los casos de enfermedad de Crohn intestinal80. Su rendimiento diagnóstico en DC es menor (55%) cuando no hay lesiones macroscópicas sugestivas de EII81,82.
El análisis histopatológico permite definir el tipo de inflamación asociado a daño intestinal o colónico que puede ser en muchos casos, específico de alguna entidad, o bien orientar al mecanismo fisiopatológico involucrado o diagnósticos diferenciales cuando los hallazgos no son definitivos. Un patólogo experto en trastornos gastrointestinales es capaz de distinguir entre hallazgos normales o anormales en cada sitio:
- 1.
Presencia de atrofia: altura de las vellosidades y su relación con la profundidad de las criptas, aplanamiento o grado y distribución de atrofia (clasificaciones de Marsh y Marsh-Oberhuber).
- 2.
Tipo de infiltrado inflamatorio: presencia de agregados linfoides con o sin hiperplasia, patrón y número de células inflamatorias por campo de alto poder (eosinófilos, linfocitos, células plasmáticas, neutrófilos), así como su distribución (intraepiteliales, lámina propria), presencia de erosiones, úlceras, abscesos, criptitis o microabscesos de criptas, fisuras e inflamación de tipo granulomatosa.
- 3.
Tinciones específicas: algunas tinciones permiten la detección de hallazgos más específicos (hematoxilina y eosina: contraste de componentes intracelulares, ácido peryódico de Schiff o PAS: diferenciación de glucógeno de otros elementos, macrófagos, parásitos, Masson: colágena, inmunohistoquímica: subtipos de linfocitos, rojo Congo: amiloidosis, PCR para Tropheryma whipplei o Giardia lamblia)83.
- 4.
Patrón de distribución del daño intestinal: tanto en patología malabsortiva intestinal como inflamatoria colónica hay que resaltar que la mayoría de las enfermedades (con excepción de pocas como CUCI) desarrollan un patrón en parches, a lo largo tanto de duodeno, yeyuno e íleon, como en colon. Debido a esto es importante tomar biopsias intestinales y colónicas –incluyendo cada segmento colónico–, y en casos específicos poner énfasis en un área en particular, por ejemplo, bulbo duodenal en enfermedad celíaca. Se ha descrito que el tomar al menos 2 biopsias de bulbo (en posición 9 y 12) y al menos 4 del duodeno posbulbar incrementa la posibilidad de diagnosticar enfermedad celíaca al menos 5% con una S de 96%84. Un estudio que evaluó el rendimiento diagnóstico de las biopsias de duodeno en 28,210 pacientes encontró que los predictores de toma de biopsia y hallazgos anormales fueron sospecha de esprúe, anemia, diarrea y pérdida de peso, y en aquellos con DC, 8.6% tuvo algún hallazgo significativo relacionado con enfermedad celíaca, y entre aquellos con sospecha de esprúe, 8.9% tuvo linfocitosis intraepitelial, 11.2% atrofia de vellosidades, y 12% datos concluyentes de esprúe85.
- 5.
Criterios diagnósticos, diferenciales y hallazgos inespecíficos de enteropatías asociadas a DC: de los trastornos duodenales asociados a DC, algunos tienen criterios histológicos bien definidos, como enfermedad celíaca, en la cual es típico observar atrofia de vellosidades y linfocitosis intraepitelial, con un conteo de linfocitos intraepiteliales (LIE)>40 por campo de alto poder, criterios definidos por las clasificaciones de Marsh y Oberhuber, o la clasificación simplificada de Corazza86–88. Sin embargo el diagnóstico diferencial de atrofia de vellosidades es muy amplio, y diversas condiciones pueden presentar atrofia en diferentes grados, como esprúe tropical, SIBO, enteritis autoinmune, enteropatía asociada a medicamentos, enfermedad de Whipple, esprúe colagenoso, enteritis eosinofílica, enfermedad de Crohn, linfoma intestinal, TB intestinal, enteritis infecciosa por Giardia, enteropatía asociada a VIH, y desnutrición severa, mientras que el diagnóstico diferencial de linfocitosis intraepitelial (valor normal <25/HPF) comprende, además de enfermedad celíaca, esprúe tropical, SIBO, enteropatía autoinmune, enteropatía asociada a medicamentos, e incluso algunos trastornos funcionales89–93. En ciertos casos, y a pesar de los hallazgos histológicos –que pueden mostrar hallazgos limítrofes– puede ser difícil establecer un diagnóstico final, por lo que es importante tomar en consideración el contexto general del paciente, como lugar de origen, historia familiar de padecimientos similares, infecciones gastrointestinales previas recientes, y estudios adicionales como biomarcadores serológicos o fecales, particularmente para diferenciar algunas formas de enfermedad celíaca de esprúe tropical, SIBO o diarrea funcional postinfecciosa27,92–94.
- 6.
Criterios histológicos diagnósticos de colonopatías asociadas a DC: de entre las colonopatías asociadas a DC, las EII presentan hallazgos histológicos específicos como microabscesos y distorsión de criptas en CUCI95, o inflamación granulomatosa, fisuras y afección transmural en enfermedad de Crohn96,97. Las colitis microscópicas como su nombre lo indica se presentan con hallazgos inflamatorios en las biopsias, en ausencia de daño endoscópico. El hallazgo característico en colitis linfocítica es linfocitosis intraepitelial, definida como>20 LIE por 100 células epiteliales, y un infiltrado agudo y crónico mixto en lámina propia. En colitis colagenosa pueden verse hallazgos similares, con menor grado de linfocitosis intraepitelial, pero con una banda de colágena subepitelial de>7 um (normal <5 um)98. Las colitis eosinofílicas requieren presentar eosinofilia tisular, que puede variar dependiendo del área, en promedio se requiere al menos 65 eosinófilos por campo de alto poder, pero al observarse eosinofilia tisular en otras entidades incluyendo EII, un panel de expertos ha recomendado un conteo>50 eosinófilos por campo de alto poder en colon derecho,>35 en transverso, y>25 en colon izquierdo, con o sin eosinofilia periférica, y con o sin afección en intestino delgado, particularmente íleon terminal, para cumplir con criterios de colitis eosinofílica99,100.
- 7.
Hallazgos histológicos sugestivos de daño por medicamentos: otras entidades que pueden ocasionar daño colónico y DC incluyen infecciones, particularmente ICD, y medicamentos. Ya se ha comentado que algunas drogas pueden incrementar el riesgo de colitis microscópicas (IBP, AINE, ISRS, antibióticos), mientras otras pueden ocasionar ulceraciones (AINE, quimioterapia, inmunoterapia y terapia blanco para cáncer, RT). Se han descrito diferentes patrones histológicos en daño por medicamentos, que incluyen colitis focal activa, colitis pseudomembranosa, colitis hemorrágica, colitis isquémica, y colitis erosiva101,102. El diagnóstico histológico de daño por inmunoterapia e inhibidores de los puntos de control es similar al de EII, con infiltrados mixtos por linfocitos y neutrófilos, criptitis, y en formas severas, apoptosis19,20.
Se define diarrea funcional como aquella diarrea crónica que no es ocasionada por enfermedad orgánica o estructural6,8,39. Su diagnóstico se basa en los criterios clínicos de Roma IV, caracterizados por evacuaciones diarreicas que ocurren más del 25% del tiempo, por al menos 3 meses previos y con 6 antes del diagnóstico, y se distingue del SII-D por la ausencia de dolor como síntoma predominante12.
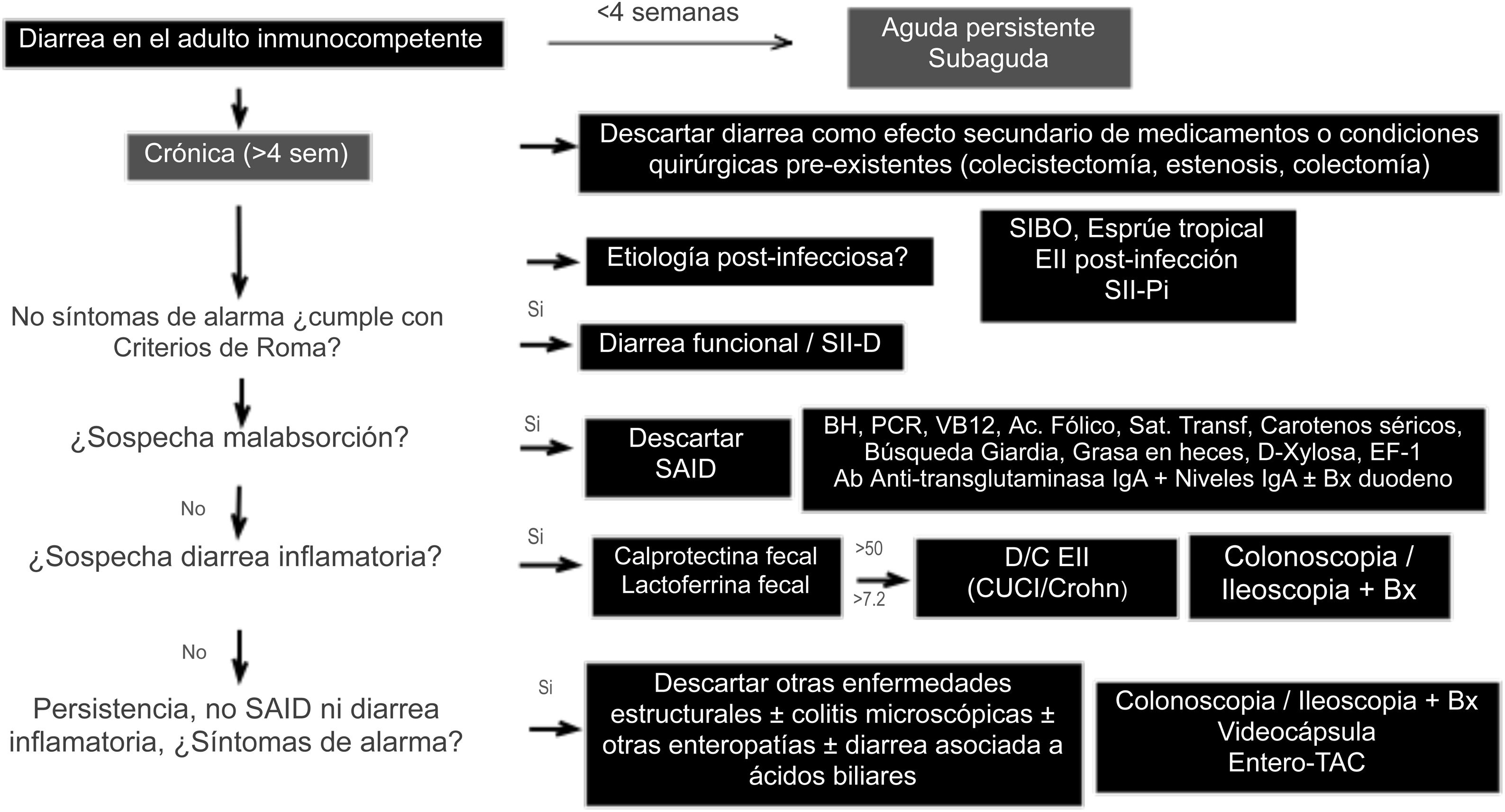
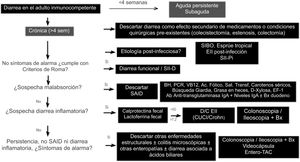
Algoritmo diagnósticoExisten varias guías de abordaje con recomendaciones generales, y se han descrito diferentes algoritmos para el diagnóstico de DC, siempre con el sesgo de prevalencia de ciertas entidades del país donde se realiza la publicación1,7,10. Las guías americanas de diarrea funcional recomiendan un escrutinio básico con calprotectina fecal, serología celíaca, búsqueda de Giardia y de DAB en la mayoría de los pacientes como recomendaciones condicionales y calidad de evidencia variable6,39. Recientemente se publicó una revisión latinoamericana con énfasis en la fisiopatología de la DC, y con un algoritmo que incluye prueba de grasa en heces y brecha aniónica como criterios mayores de subclasificación103. Debido al amplio diagnóstico diferencial, para realizar un algoritmo que sea sencillo es importante considerar antecedentes familiares, enfermedades sistémicas, forma de inicio de la diarrea, periodicidad o patrón de evacuación, frecuencia y apariencia, cirugías abdominales previas, uso previo de medicamentos, síntomas de alarma (sangrado rectal, melena, pérdida de peso, síntomas nocturnos, historia familiar de EII, pólipos o cáncer de colon), signos de alarma en el examen físico abdominal (masas, adenomegalias), y síntomas extraintestinales asociados, con el fin de determinar si es probable que sea malabsortiva, inflamatoria o funcional, y reducir la necesidad de pruebas o encaminarlas hacia el subtipo probable. Nosotros proponemos un algoritmo diagnóstico sencillo para establecer la causa de DC (fig. 2), en el cual se excluyen en forma inicial causas secundarias a medicamentos, o a alteraciones anatómicas o funcionales posteriores a cirugía gastrointestinal, como colecistectomía o colectomía. A continuación, si existe el antecedente de un episodio potencialmente infeccioso, con cambio en el hábito posterior al mismo, considerar SIBO, EII secundaria, o bien diarrea funcional o SII-Pi. En base a las características clínicas y macroscópicas de la diarrea, y a la presencia o no de síntomas de alarma, el algoritmo divide a la DC en 3 grupos: funcional, malabsortiva o inflamatoria. Si hay síntomas sugestivos de malabsorción se sugiere descartar SAID mediante estudios básicos de malabsorción (BH, proteína C reactiva ultrasensible, carotenos séricos, serología celíaca, niveles séricos de vitamina B12, ácido fólico y cinética de hierro). Si no hay datos sugestivos de SAID se debe investigar diarrea inflamatoria mediante la determinación de calprotectina y/o lactoferrina fecales. En base a los resultados se norma la conducta a seguir, por ejemplo, si la serología celíaca es débilmente positiva el siguiente paso sería hacer una endoscopia para toma de biopsias duodenales, y si la calprotectina o lactoferrina son positivas, entonces se debe hacer una colonoscopia para descartar EII. En aquellos casos sin evidencia de malabsorción o inflamación colónica en los parámetros bioquímicos, pero en los que existen síntomas de alarma como pérdida de peso o síntomas nocturnos, hay que realizar una colonoscopia e ileoscopia con toma de biopsias de ambos sitios, para descartar enteropatías o colitis microscópicas. Cuando existen antecedentes en la historia clínica que sugieran DAB, se puede dar un tratamiento de prueba con un agente secuestrador de sales biliares. En aquellos pacientes sin síntomas o signos de alarma y que cumplen con los criterios de Roma, o bien cuando la evaluación diagnóstica es negativa, se puede establecer el diagnóstico de diarrea funcional, o si existe el antecedente de infección y no hay evidencia de EII o SIBO, se puede confirmar el diagnóstico de SII o diarrea funcional postinfecciosas1–11. El diagnóstico de una entidad causante de DC no descarta la posibilidad de un segundo problema sobreagregado o simultáneo. Se han descrito casos de SII postinflamatorio tras EII, o de enfermedad celíaca y SII concomitantes104–106.
Algoritmo diagnóstico de diarrea crónica.
BH: biometría hemática; Bx: biopsias; D/C: descartar; EF-1: elastasa fecal-1; EII: enfermedad inflamatoria intestinal; PCR: proteína C reactiva ultrasensible;
SAID: síndrome de absorción intestinal deficiente; SIBO: sobrepoblación bacteriana del intestino delgado; SII-Pi: síndrome de intestino irritable postinfeccioso; TAC: tomografía axial computarizada.
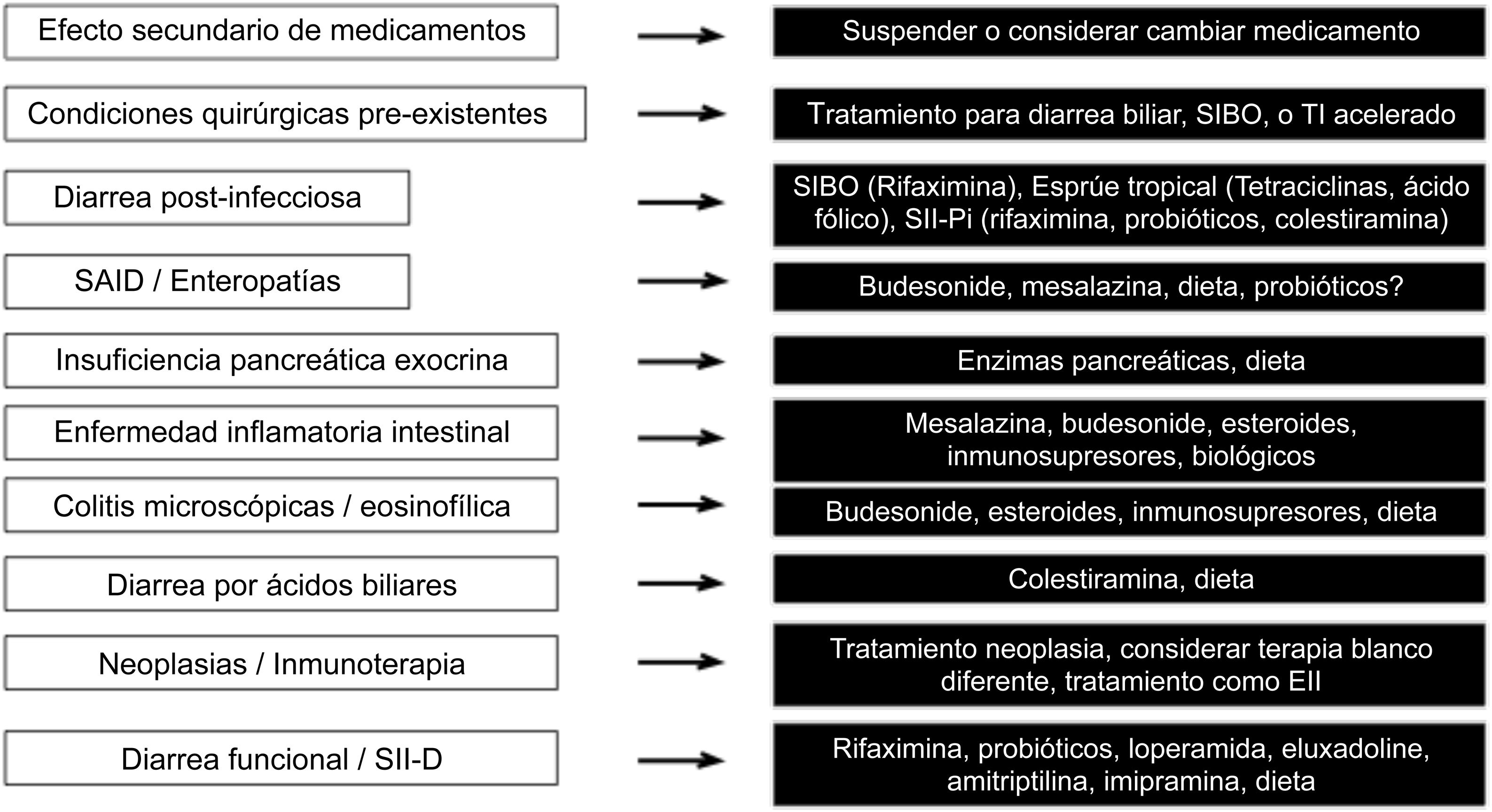
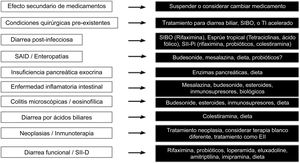
Finalmente, en la figura 3 se describen las opciones terapéuticas de acuerdo a la causa de la diarrea.
ConclusionesDebido a la complejidad en los mecanismos y a las múltiples causas de DC, la presente revisión analiza el abordaje diagnóstico enfatizando claves en los antecedentes clínicos que puedan orientar a determinar la causa o en su defecto categorizarla en un subgrupo, el papel de los diferentes biomarcadores y pruebas diagnósticas en cada subtipo de diarrea. Se detalló un abordaje clínico el cual apoyado de forma racional con pruebas diagnósticas será de utilidad en la práctica diaria para determinar la etiología de este problema tan común pero tan complejo, y así poder guiar la terapia de manera oportuna y específica.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.