El secado y almacenamiento adecuados de los endoscopios flexibles son esenciales para mantener la calidad en su reprocesamiento. El objetivo del presente estudio fue evaluar las etapas de secado y almacenamiento, así como las condiciones de los canales de los endoscopios por medio de la inspección con boroscopio.
Materiales y métodosSe entrevistó al personal responsable de reprocesar los endoscopios. También se inspeccionaron las condiciones de almacenamiento en 10 centros endoscópicos y se realizó un examen interno de los canales y puertos del equipo resguardado utilizando un boroscopio. Se evaluó un total de 74 canales de endoscopios.
ResultadosÚnicamente 10% de los centros inspeccionados emplearon cajas transportadoras para almacenamiento y solo 10% tenían cuartos para ese uso exclusivo. Un total de 60% de los centros no realizó ningún control de vida de anaquel. Todos los canales evaluados presentaron raspaduras y se encontró líquido en 69% de ellos.
ConclusionesEl reprocesamiento del endoscopio puede mejorarse por medio de la implementación de controles del secado y almacenamiento, así como mediante herramientas de validación, al igual que por medio de la utilización de boroscopios y auditorías clínicas periódicas.
Adequate drying and proper storage of flexible endoscopes are essential for maintaining quality in their reprocessing. The aim of the present study was to evaluate the drying stages, storage, and channel conditions of endoscopes through borescope inspection.
Material and methodsThe personnel responsible for endoscope reprocessing were interviewed. Storage conditions at 10 endoscopy facilities were inspected and an internal examination of the channels and ports of the stored equipment was carried out, utilizing a borescope. A total of 74 stored endoscope channels were evaluated.
ResultsOnly 10% of the facilities inspected utilized transport cases for storage and only 10% had rooms exclusively used for storage. Sixty percent of the facilities did not perform any shelf-life control. All the channels evaluated were scratched and fluids were present on 69% of them.
ConclusionsEndoscope reprocessing can be improved through the implementation of drying and storage control and validation tools, as well as the use of borescopes and periodic clinical audits.
Los endoscopios gastrointestinales son dispositivos médicos reutilizables y complejos. Sus lúmenes son múltiples, largos, obscuros y angulados. Para asegurar una reutilización segura, estos aparatos requieren un proceso de limpieza de varios pasos, los cuales, de no realizarse adecuadamente, puede llevar a la contaminación del dispositivo1. Las etapas de reprocesamiento incluyen: prelimpieza, prueba de fugas, limpieza, secado, desinfección de alto nivel, secado final y almacenamiento. La limpieza es el paso más vulnerable a fallos, lo cual puede suscitar brotes infecciosos y problemas de salud2,3. Sin embargo, los pasos finales también se han descrito como puntos vulnerables que pueden facilitar la proliferación de microorganismos debido a la recontaminación y a la formación de biopelícula, lo cual ha sucedido en casos infecciosos reportados en varios estudios4–8. El secado y el almacenamiento son fases cruciales para mantener la efectividad de un reprocesamiento realizado de manera adecuada; sin embargo, las recomendaciones y los fabricantes no proporcionan información detallada sobre los pasos específicos para generar diferencias en los procesos y las fallas en la ejecución7,9. A la vez, la simeticona, la cual es una substancia silicona no soluble al agua, es empleada por los endoscopistas para mejorar las imágenes al retirar burbujas de las superficies mucosas y puede permanecer adherida al canal después del reprocesamiento, lo cual evita un secado adecuado y facilita el crecimiento microbiológico10.
La permanencia de líquido en los canales, frecuentemente asociada a raspaduras y residuos, facilita la formación de biopelícula, debido a que los microorganismos tienen tropismo por áreas dañadas y utilizan residuos y líquidos como sustratos para adherirse y proliferar11. Las biopelículas son difíciles o imposibles de retirar, son resistentes a la acción de soluciones desinfectantes y su presencia puede resultar en fallas de reprocesamiento11–13. Por otro lado, el enjuague final con agua no esterilizada puede permitir que bacterias residuales permanezcan en los canales y cuando no se hace un secado adecuado, favorece el crecimiento microbiológico, lo cual resalta la importancia de una ejecución correcta, al igual que las potenciales consecuencias de no hacerlo13,14. En la práctica clínica, se ha recomendado el monitoreo y validación del reprocesamiento para mejorar el proceso. Sin embargo, existe poca verificación de las condiciones internas de los canales del endoscopio, especialmente respecto a la presencia de humedad9.
Para validar el secado de los endoscopios, se pueden utilizar estrategias como el uso de papel azul de cobalto, aunque este es limitado por su imprecisión para verificar la humedad, debido a su sensibilidad15. Otra posibilidad es el empleo de un boroscopio, el cual es un instrumento óptico diseñado para visualizar los canales del endoscopio16,17. Este dispositivo puede inspeccionar, grabar y analizar hallazgos, relacionándolos a posibles fallas en los pasos del reprocesamiento, especialmente en el secado9. Respecto a los beneficios del boroscopio, el uso de esta tecnología ha sido recomendado en algunos lineamientos de centros endoscópicos18,19. En estudios previos se ha reportado la identificación de humedad en los canales endoscópicos por medio de este instrumento, lo cual señala importantes fallos en el proceso de secado17,20,21. El objetivo de nuestra investigación fue evaluar la relación entre los hallazgos realizados con el boroscopio en los canales de endoscopios almacenados y la calidad y seguridad del secado y almacenamiento de dichos dispositivos. La complejidad de la estructura de los endoscopios gastrointestinales, el riesgo de infección implicado en los fallos en el reprocesamiento y la dificultad para validar los pasos del mismo en la práctica clínica requieren de un conocimiento más profundo para mejorar las etapas del reprocesamiento.
En vista de los riesgos involucrados en la permanencia de líquido en los canales de los endoscopios y la capacidad de que el almacenamiento inadecuado facilite la recontaminación de aquellos preparados para ser usados, empleamos un boroscopio para evaluar el secado, el almacenamiento y las condiciones de los canales de endoscopios en centros endoscópicos.
Materiales y métodosSe realizó un estudio transversal en centros endoscópicos de la ciudad de Belo Horizonte, Minas Gerais, Brasil. Por medio de una investigación, se determinó que existían 82 centros endoscópicos anotados en el Registro de Establecimientos de Salud (CNES DATA SUS). Después de excluir los duplicados y los que no efectuaban endoscopias gastrointestinales, se contactó a 51. Se realizaron cinco intentos de contacto por medio de correo electrónico y teléfono y, en caso de no recibir respuesta, se consideró al centro no elegible. Finalmente, 10 de ellos aceptaron participar en el estudio, en los cuales se analizaron 71 endoscopios, haciendo la revisión de un total de 74 canales de 98 dispositivos. Algunos canales no fueron examinados, ya que no cumplieron con los criterios de elegibilidad.
Los criterios de inclusión consistieron en centros que realizaran endoscopias gastrointestinales, colonoscopias, colangiopancreatografía endoscópica retrógrada (CPRE) y/o endoscopia en pacientes adultos, y que tuvieran endoscopios con canales >2.4mm de diámetro. Se excluyó a los dispositivos que estaban en uso al momento de la visita, al igual que aquellos en espera de reparación o mantenimiento.
El estudio se llevó a cabo en tres momentos concurrentes, comenzando con la aplicación de un cuestionario semiestructurado basado en estándares aplicables18,22,23, seguido de la evaluación de los canales de los endoscopios empleando variables asociadas con las etapas del reprocesamiento.
ResultadosSe visitaron un total de 10 servicios, todos ellos situados dentro de edificios hospitalarios; sin embargo, 30% (3/10) estaban gestionados por clínicas externalizadas y 70% restante (7/10) por la propia institución. Se observó una variabilidad en los procedimientos por mes (100-775), con una media de 264 procedimientos realizados al mes por servicio. En cuanto a la cantidad de equipos, se observó un promedio de endoscopios por servicio (rango: 2-26). La tabla 1 resume la ocurrencia de las variables analizadas.
Frecuencia de adherencia a los pasos del reprocesamiento en los centros endoscópicos (n=10)
| Código de centro | Frecuencia | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pasos de reprocesamiento | Variables | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | % (n=10) |
| Limpieza | Manual | 90 (9) | ||||||||||
| Manual + automatizada | 10 (1) | |||||||||||
| Simeticona | Utilizada | 80 (8) | ||||||||||
| No utilizada | 20 (2) | |||||||||||
| Enjuague | Agua potable | 80 (8) | ||||||||||
| Ósmosis inversa | 10 (1) | |||||||||||
| Agua filtrada | 10 (1) | |||||||||||
| Secado | Pistola de aire comprimido | 90 (9) | ||||||||||
| Lavadora automática | 10 (1) | |||||||||||
| Tiempo de secado | 5 minutos | 10 (1) | ||||||||||
| No determinado | 90 (9) | |||||||||||
| Enjuague de alcohol | Utilizado | 60 (6) | ||||||||||
| No utilizado | 40 (4) | |||||||||||
| Hora de enjuague de alcohol | Fin del día | * | * | * | * | 40 (4) | ||||||
| Entre procesamiento | * | * | * | * | 20 (2) | |||||||
| Almacenamiento | Gabinetes con ventilación natural | 60 (6) | ||||||||||
| Cajas de transporte | 10 (1) | |||||||||||
| Ganchos en habitación | 10 (1) | |||||||||||
| Gabinetes sin ventilación | 10 (1) | |||||||||||
| Gabinetes con filtración | 10 (1) | |||||||||||
| Materiales de gabinete de almacenamiento | Esponja | 10 (1) | ||||||||||
| Hierro pintado | 10 (1) | |||||||||||
| Acrílico | 10 (1) | |||||||||||
| Madera cubierta de formica | * | 60 (6) | ||||||||||
| Ubicación del gabinete | Cuarto de examinación | 40 (4) | ||||||||||
| Pasillo de recepción | 10 (1) | |||||||||||
| Cuarto no dedicado | 20 (2) | |||||||||||
| Cuarto de reprocesamiento limpio | 10 (1) | |||||||||||
| Cuarto de almacenamiento dedicado | 20 (2) | |||||||||||
| Periodo de almacenamiento | Sin patrón | 60 (6) | ||||||||||
| 7 días | 20 (2) | |||||||||||
| Desinfección antes de uso | 20 (2) | |||||||||||
| Posición de almacenamiento del endoscopio | Vertical sin válvulas | 70 (7) | ||||||||||
| Vertical con válvulas | 20 (2) | |||||||||||
| Horizontal sin válvulas | 10 (1) | |||||||||||
Durante la preparación del paciente, 80% (8/10) de los centros usaron simeticona; 25% (2/8) de ellos inyectaron esta sustancia en los canales durante la ejecución del procedimiento. Durante el secado, se controló la presión del aire en un solo centro (a 1.5 atm). Se observó la utilización de protectores de las puntas en 50% (5/10) de los centros y en 30% (3/10) de ellos se colocó esponja o algún material que no permitió una ventilación y limpieza adecuados en dichos protectores. En todos los cuartos de almacenamiento inspeccionados se observaron incumplimientos a los estándares de almacenamiento (fig. 1).
Ubicación de almacenamiento de los endoscopios en los centros endoscópicos sin adherencia a las sugerencias.
1) Presencia de superficie de apoyo rugosa y almacenamiento de otros objetos junto a los endoscopios. 2) Presencia de un protector de punta sin ventilación en el endoscopio y una caja de cartón en el gabinete junto al dispositivo. 3) Dispositivo en contacto con la pared del gabinete de almacenamiento. 4) Presencia de objetos y cajas de cartón en el espacio de almacenamiento del endoscopio. 5) Espacio dedicado al almacenamiento con agujeros en las paredes y sellado incompleto. 6) Soporte de almacenamiento de madera. 7) Presencia de objetos almacenados junto al endoscopio, telas de retención de humedad y altura insuficiente del gabinete de almacenamiento. 8) Almacenamiento horizontal en una caja de transporte sin ventilación. 9) Altura insuficiente del gabinete, dispositivos tocando el piso del gabinete. 10) Uso de protectores de puntas de esponja y área sin ventilación.
Respecto a la evaluación de los endoscopios, se inspeccionaron 71 piezas. Los instrumentos fueron almacenados por un promedio de 113h (rango: 16-720h) y solo 1.5% (1/71) estuvieron en posición horizontal, mientras que 98.5% (79/71) fueron almacenados colgando verticalmente. También, 91.5% (65/71) de los aparatos examinados no tenían válvulas colocadas en el dispositivo, mientras que 8.5% (6/71) tenía al menos una válvula en los canales.
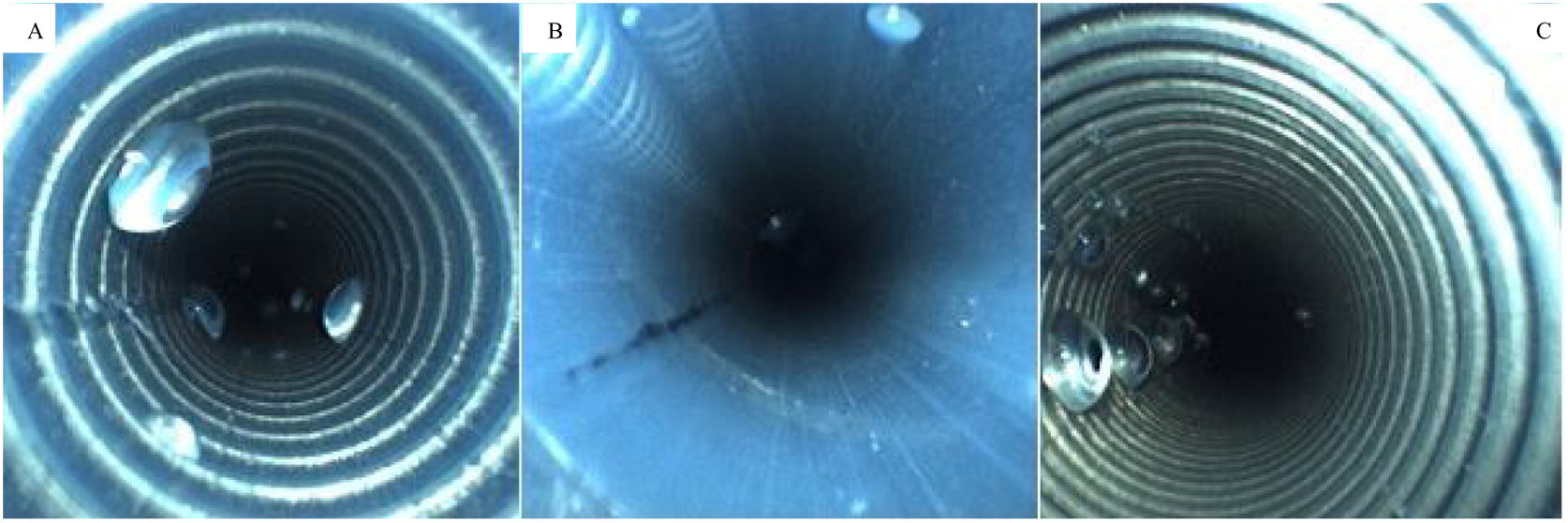
A continuación, se utilizó el boroscopio para inspeccionar el canal del puerto de succión y se detectó líquido en 3% (3/71) de los endoscopios almacenados con válvulas colocadas. También se identificó líquido en el canal del puerto de aire y agua en 6% (4/71) y de estos, 75% (3/4) estaban almacenados con las válvulas colocadas. En la figura 2 se muestra la presencia de líquido.
Se analizó un total de 74 canales de biopsia con el boroscopio, debido a la presencia de equipo con canales dobles. De los canales inspeccionados, 31% (23/74) no mostraron señas de humedad, 69% (51/74) presentaron líquidos y 41% (21/51) exceso de humedad, como se observa en la figura 3.
Todos los centros tuvieron al menos un dispositivo con líquido/humedad en los canales. Se encontró líquido en 69% (51/74) de ellos, distribuidos de la siguiente manera: 45.9% (25/51) en gastroscopios, 32.4% (19/51) en colonoscopios, 12.2% (4/51) en duodenoscopios y 9.5% (7/51) en otros endoscopios (p=0.049). No se observaron relaciones significativas entre las otras variables analizadas.
Discusión y conclusionesNuestros resultados destacan una serie de fallas en los centros endoscópicos relacionadas con las etapas finales del reprocesamiento. La ejecución del secado y el almacenamiento ha sido una preocupación de varias asociaciones y sociedades, como el Emergency Care Research Institute (ECRI), el cual ha señalado al reprocesamiento de los endoscopios como uno de los 10 mayores riesgos respecto al uso de tecnologías de la salud7,24.
El líquido en los canales endoscópicos facilita la multiplicación y mantenimiento de microorganismos y, en consecuencia, la formación de biopelícula7. Además, los líquidos tienen el potencial de fijar residuos no solubles al agua, tales como la simeticona, una sustancia aceitosa compuesta de otros elementos (p. ej., azúcares y colorantes), cuya remoción por medio de los procesos de limpieza usuales en centros endoscópicos es un desafío10,22,25. Como resultado de esto, los fabricantes han contraindicado la simeticona en este proceso, pero se le recomienda a las clínicas que consideran el uso de esta sustancia beneficioso para visualizar imágenes, que lo suministren directamente a los canales de biopsia, ya que estos pueden cepillarse, lo cual facilita su remoción26. El empleo de la simeticona en otros canales o en bombas de agua incrementa la probabilidad de obstrucción por cristalización del fármaco, al igual que el riesgo de contaminación microbiológica10,21,25,26. La calidad del agua utilizada para enjuagar los residuos de desinfectante es otro factor importante, dado que esta puede llevar microorganismos patógenos desde los conductos y reservorios, como Pseudomonas sp., permitiendo la recontaminación de dispositivos desinfectados adecuadamente y aumenta el riesgo de infección, especialmente en pacientes inmunodeprimidos27,28. Por lo tanto, las recomendaciones indican optar por un sistema de agua purificada o esterilizada, monitoreado y controlado de manera adecuada, para evitar la presencia de microorganismos, especialmente considerando las dificultades para garantizar los efectos del secado de todos los canales en la práctica clínica2,18,29.
Cuando sucede una falla en el secado, los microorganismos residuales encuentran un ambiente ideal para la proliferación, lo cual hace que este proceso sea crítico7,14,30. Debido a que las recomendaciones y lineamientos por parte de los fabricantes son insuficientes respecto a los pasos detallados, y que la validación y monitoreo de la fase de secado es compleja, a menudo, este se efectúa de manera inadecuada en la práctica clínica, lo cual fue evidente en el presente análisis, como lo ha sido en otros estudios9,20,30,31. Los métodos automatizados de secado favorecen la reproducción de este paso y reducen el riesgo de omisiones por error humano. De hecho, Barakat20 obtuvo mejores resultados con procesadores automatizados que con las técnicas manuales, haciendo un secado de 10 minutos. Sin embargo, un estudio realizado por Nerandzic et al.9 sugirió que 10 minutos por canal era un tiempo insuficiente para el secado y demostró la importancia de controlar otros factores de influencia de la efectividad de este, como la presión del flujo de aire, el uso de alcohol y el diámetro del canal, además de reforzar la necesidad de validar el proceso en cada estructura disponible.
El uso del alcohol como facilitador del secado es controvertido entre las sociedades de gastroenterología y usualmente está contraindicado por las asociaciones europeas, principalmente por sus propiedades fijadoras de proteínas y el riesgo de contaminación por proteína priónica29. Por otro lado, las asociaciones estadounidenses consideran las capacidades microbicidas y evaporadoras de soluciones de alcohol y recomiendan su uso2,18. Sin embargo, existen estudios que han mostrado que el empleo de este no tiene influencia en la reducción microbiológica o en el tiempo de secado, lo cual refuerza la importancia de que este sea efectivo9,14,32. Por lo tanto, la implementación de herramientas para la verificación del secado, como el boroscopio, es esencial para garantizar una ejecución adecuada del proceso16,31.
De las herramientas utilizadas para asegurar un secado adecuado de los canales endoscópicos, el boroscopio destaca porque permite una visualización interna de los canales, con visualización directa de líquidos. Sin embargo, su uso es aún limitado a canales endoscópicos de diámetros mayores a los del boroscopio16,31. Independientemente de esto, se ha demostrado que estos dispositivos son importantes para detectar fallas y para monitorear y verificar el secado, lo cual es fundamental para la mejoría del proceso10,16,31.
Un almacenamiento inadecuado también puede favorecer la recontaminación de endoscopios preparados para ser utilizados24. Como resultado de esto, se han realizado recomendaciones claras orientadas a guiar a los profesionales en el mantenimiento de la calidad del reprocesamiento2,18,29. Sin embargo, en el presente estudio se observaron errores en el almacenamiento adecuado del endoscopio, como guardarlo en posición horizontal con válvulas puestas o en gabinetes sin ventilación, corroborando la evidencia anterior de pasos de reprocesamiento inadecuados. Bajolet et al.5 mostraron que el almacenamiento inadecuado está ligado a una potencial causalidad de transmisión de microrganismos, lo cual indica la necesidad de una cuidadosa observación de esta fase.
Observamos el uso de protectores de puntas en algunos de los endoscopios evaluados. Su propósito es evitar el daño mecánico en las puntas distales de estos aparatos, pero los protectores estaban hechos de materiales adaptados, como esponjas, lo cual evita una limpieza adecuada y sella las puntas y promueve potencialmente la retención de humedad o el incremento de microorganismos residuales y riesgos de contaminación18,33. Las recomendaciones sugieren el uso de protectores desechables que fomentan la aireación de la punta, que no retengan humedad y que tengan un diámetro adecuado para cada endoscopio18.
Se recomienda utilizar gabinetes que permitan el flujo de aire en los canales, ya que se ha observado que dan mejores resultados para mantener la calidad del secado de los endoscopios almacenados después del procesamiento15,17. En algunos países, la sugerencia para determinar el tiempo de almacenamiento seguro debe ser validado por los fabricantes de dichos gabinetes29. Otras recomendaciones solicitan la obtención de evidencia por parte de un equipo multiprofesional para definir de manera segura la duración de la vida de anaquel2,21. En el presente estudio, ninguno de los centros endoscópicos inspeccionados tenía criterios rigurosos para definir la de sus aparatos, ni realizaron algún tipo de validación por medio de monitoreo microbiológico. Por lo tanto, la determinación empírica del tiempo máximo de almacenamiento podría resultar en fallas de reprocesamiento y en riesgo para los pacientes sometidos a procedimientos empleando estos dispositivos8.
Otro punto para destacar es la frecuencia del hallazgo de líquido dentro de los canales de biopsia y los puertos del endoscopio durante la inspección con un boroscopio, lo cual indica la fragilidad de los pasos como el secado4. Por lo tanto, el uso del mismo puede señalar fallas en la práctica clínica y promover la mejora en la ejecución del proceso del secado, dado que la identificación de líquido está directamente relacionada con la formación de biopelícula16,31.
El presente estudio tiene ciertas limitaciones que requieren comentarse. Primero, no fue posible realizar un análisis de diferenciación de los tipos de líquido encontrados. Segundo, no efectuamos un análisis microbiológico del equipo evaluado, lo cual nos habría permitido medir la seguridad del uso clínico de los endoscopios. Finalmente, el tamaño de la muestra fue relativamente pequeño, debido a la baja participación de los centros endoscópicos en el proyecto, ya fuera por una falta de conocimiento del boroscopio o por restricciones en las visitas, como resultado de medidas de control implementadas durante la pandemia de COVID-19.
La capacitación, la educación y la evaluación continua de la ejecución de los pasos del reprocesamiento son recomendaciones para fomentar la seguridad de los pacientes que se someten a procedimientos endoscópicos. La capacitación debería considerar actualizaciones de las recomendaciones, evidencia científica y la implementación de nuevas tecnologías para validar la práctica de los pasos. Nuestros hallazgos destacan debilidades en la adherencia a las fases de reprocesamiento, especialmente las etapas finales, haciendo evidentes los riesgos de recontaminación de los endoscopios preparados para ser usados. Estos resultados no solo destacan los problemas a ser abordados en la capacitación de los equipos encargados del mantenimiento de los endoscopios, sino también las mejorías que deben realizarse en términos de recursos básicos, y la importancia de utilizar el boroscopio en la práctica, para mejorar el secado, el almacenamiento y las condiciones de los endoscopios.
En futuras investigaciones se debe buscar mejorar las herramientas de validación del reprocesamiento de los endoscopios, enfocándose en un bajo costo, la facilidad de implementación y las mejoras en la práctica para la seguridad de los pacientes.
Los fallos en los pasos finales del reprocesamiento incrementan el riesgo de transmisión microbiana y deben ser eliminados para garantizar la seguridad de los pacientes. El uso de herramientas de validación y monitoreo, como la implementación del boroscopio y las auditorías de seguimiento, pueden generar oportunidades para la capacitación del personal y la creación de ciclos de mejora continua, promoviendo el uso seguro y las condiciones internas adecuadas de los canales de los endoscopios gastrointestinales (tabla 1).
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.