El cáncer de colon es frecuente en los países desarrollados, con una mortalidad específica del 33%. Diversos biomarcadores son asociados a la sobrevida global de los pacientes o predicen el efecto del tratamiento monoclonal. La presencia de mutaciones en el oncogén K-ras afecta la respuesta a terapia blanco con cetuximab, y podría mostrar valor pronóstico de manera independiente.
ObjetivosAnalizar la diferencia en la supervivencia de pacientes K-ras mutados y en estado nativo.
MétodosSe analizaron retrospectivamente 31 expedientes clínicos de pacientes con cáncer de colon con secuenciación de K-ras utilizando reacción en cadena de polimerasa en tiempo real realizados desde el año 2009 y hasta 2012 en el Hospital de Alta Especialidad de Veracruz del Instituto para la Salud y Seguridad Social de los Trabajadores del Estado (HAEV-ISSSTE). Se analizó la supervivencia entre los pacientes con mutación y aquellos que no la tienen usando el método de Kaplan-Meier; las covariables se contrastaron usando transformación logarítmica.
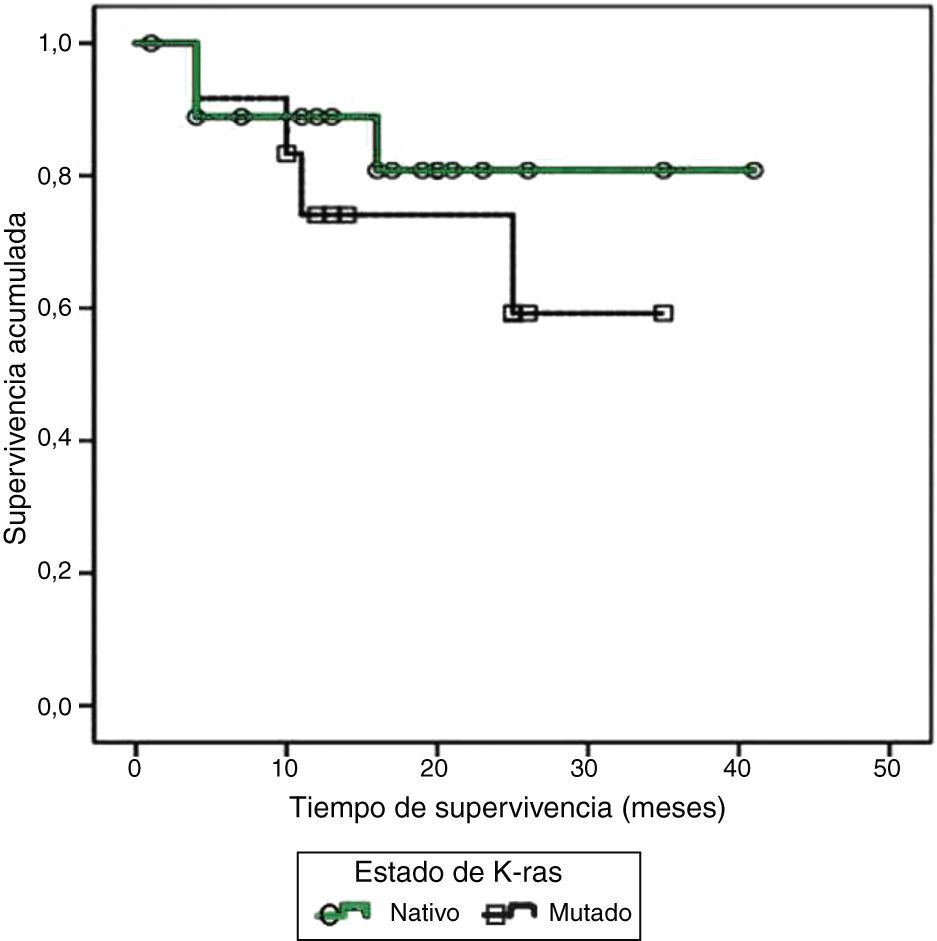
ResultadosNo se halló una diferencia significativa en la sobrevida de los pacientes en los que se encontró K-ras mutado versus K-ras nativo (p=0.416). Al analizar covariables y supervivencia de los pacientes K-ras mutados, tampoco se obtuvieron diferencias significativas: escala ECOG (p=0.221); edad ( <menor a=""> o <igual o="" mayor="" a=""> 65 </igual> </menor>años, p=0.441); estadio clínico según AJCC (p=0.057); sitio de lesión primaria, p=0.614.
ConclusionesNo se encontró relación entre la mutación del oncogén K-ras y disminución en la sobrevida, a diferencia de lo establecido en la literatura. Es importante realizar estudios con un mayor número de pacientes y que se incluya el tratamiento monoclonal, que, en el presente, fueron solo 5 y su análisis es inverosímil.
Colorectal cancer is frequent in the developed countries, with a cancer-specific mortality rate of 33%. Different biomarkers are associated with overall survival and the prediction of monoclonal treatment effectiveness. The presence of mutations in the K-ras oncogene alters the response to target therapy with cetuximab and could be an independent prognostic factor.
AimsTo analyze the difference in survival between patients with mutated K-ras and those with K-ras wild-type status.
MethodsThirty-one clinical records were retrospectively analyzed of patients presenting with colorectal cancer that underwent K-ras sequencing through real-time polymerase chain reaction within the time frame of 2009 to 2012 at the Hospital de Alta Especialidad de Veracruz of the Instituto para la Salud y Seguridad Social de los Trabajadores del Estado (HAEV-ISSSTE). Survival analysis for patients with and without K-ras mutation was performed using the Kaplan Meier method. Contrast of covariates was performed using logarithmic transformations.
ResultsNo statistically significant difference was found in relation to survival in the patients with mutated K-ras vs. those with K-ras wild-type (P=.416), nor were significant differences found when analyzing the covariants and survival in the patients with mutated K-ras: ECOG scale (P=.221); age (less than, equal to or greater than 65years, P=.441); clinical stage according to the AJCC (P=.057), and primary lesion site (P=.614).
ConclusionsNo relation was found between the K-ras oncogene mutation and reduced survival, in contrast to what has been established in the international medical literature. Further studies that include both a larger number of patients and those receiving monoclonal treatment, need to be conducted. There were only 5 patients in the present study that received cetuximab, resulting in a misleading analysis.
Alrededor del mundo se ha descrito que un millón de personas desarrollan cáncer de colon cada año, y la mortalidad específica por esta razón se acerca al 33% en el mundo desarrollado, solo después de la mortalidad por cáncer pulmonar, que en nuestro país es del 13%. En 2002 se reportaron 108,064 nuevos casos en México, con un incremento del 50% en la incidencia en un periodo de 25años1-3. La etiología de esta neoplasia es compleja, e incluye una relación entre factores ambientales y genéticos. El oncogén K-ras (Kirsten Rat Sarcoma Viral Homologue u oncogén homólogo a virus de sarcoma de rata) codifica para una proteína de unión a GTP (guanidiltrifosfatasa) que puede mutar en estadios muy tempranos del desarrollo tumoral; se ha descrito que del 35 al 42% de los adenomas poseen una mutación en K-ras, que promueve el crecimiento hiperplásico del epitelio colónico, morfología aberrante en focos de criptas, crecimiento tumoral, progresión, invasión local y formación de metástasis4,5. Para la detección de estas mutaciones existen varias técnicas descritas, siendo la secuenciación directa de un producto de PCR la de elección. Como resultado se obtiene la mutación (que se denomina K-ras mutado) y el codón mutado; si no la hay, se denomina K-ras en estado silvestre, término introducido del inglés wild type, aunque en el presente estudio lo llamaremos K-ras nativo6-11.
En cuanto al tratamiento del cáncer de colon, inicialmente debe ser quirúrgico de intención curativa. El papel de la terapia adyuvante es limitado por el modesto incremento de supervivencia, considerándose en pacientes con factores clínicos, histológicos y moleculares de alto riesgo de recurrencia12. Existe un auge por la adición de terapia biológica por sus beneficios sobre la terapia citotóxica convencional; sin embargo, por su elevado costo se reserva a un grupo específico de pacientes. Una revisión amplia del tema13 concluye que el estado de K-ras es factor pronóstico independiente, ya que los pacientes K-ras nativo viven más y se benefician más del tratamiento monoclonal. Ensayos clínicos, como CRYSTAL14 y OPUS15, encontraron en estos pacientes respuesta a tratamiento, supervivencia libre de progresión y supervivencia global superiores a las de pacientes K-ras mutados en grupos con quimioterapia convencional y quimioterapia más terapia monoclonal. En estudios recientes, la evidencia con respecto al estado mutacional, estadio tumoral y supervivencia de pacientes bajo diversos esquemas de tratamiento señala que las mutaciones detectadas (sobre todo en el codón12) confieren un peor pronóstico, así como metástasis hepáticas prontas y agresivas. El fármaco cetuximab es un anticuerpo monoclonal inhibidor del receptor del factor de crecimiento epidérmico/epitelial (EGFR), y actualmente es la terapia biológica de elección para el cáncer de colon. Su uso se reserva únicamente para pacientes con K-ras nativo, asociado a otros fármacos como capecitabina y oxaliplatino (conocido como esquema XELOX) o ácido folínico y oxaliplatino (esquema FOLFOX)16,17. Resulta importante conocer las diferencias clínicas entre los grupos mutado y no mutado en población local, ya que su estudio en nuestra población ha sido muy limitado y su relevancia en la decisión clínica ha sido notable y publicada en otros países. El objetivo principal del presente estudio es confirmar si existe diferencia en la supervivencia relacionada con el hallazgo de mutaciones, y si esta es modificada por otras variables, tal y como lo describen la literatura europea y estadounidense, ya mencionadas.
MétodosSe realizó un estudio retrospectivo, comparativo y analítico de bajo riesgo respetando la declaración de Helsinki de 2008 y el Reglamento de la Ley General de Salud en Materia de Investigación para la Salud. Para ello se accedió a los expedientes de nuestros pacientes bajo autorización de la dirección general del Hospital de Alta Especialidad de Veracruz, perteneciente al Instituto para la Salud y Seguridad Social de los Trabajadores del Estado (HAEV-ISSSTE), así como con el visto bueno del comité de bioética de la Universidad Veracruzana. No se requirió consentimiento signado bajo información ya que no hubo daño o intervención a pacientes, y se laboró a través de claves numéricas para salvaguardar la identidad de cada paciente. Analizamos datos de los expedientes clínicos de pacientes adultos activos en el sistema de salud del HAEV-ISSSTE con los siguientes criterios de inclusión: diagnóstico histopatológico de cáncer de colon, secuenciación de K-ras por PCR (K-ras mutado o nativo), tiempo de sobrevida en meses, aceptación de tratamiento médico y quirúrgico en la modalidad coadyuvante, sin sospecha clínica de cáncer de colon familiar y que el expediente clínico mencionara la edad (
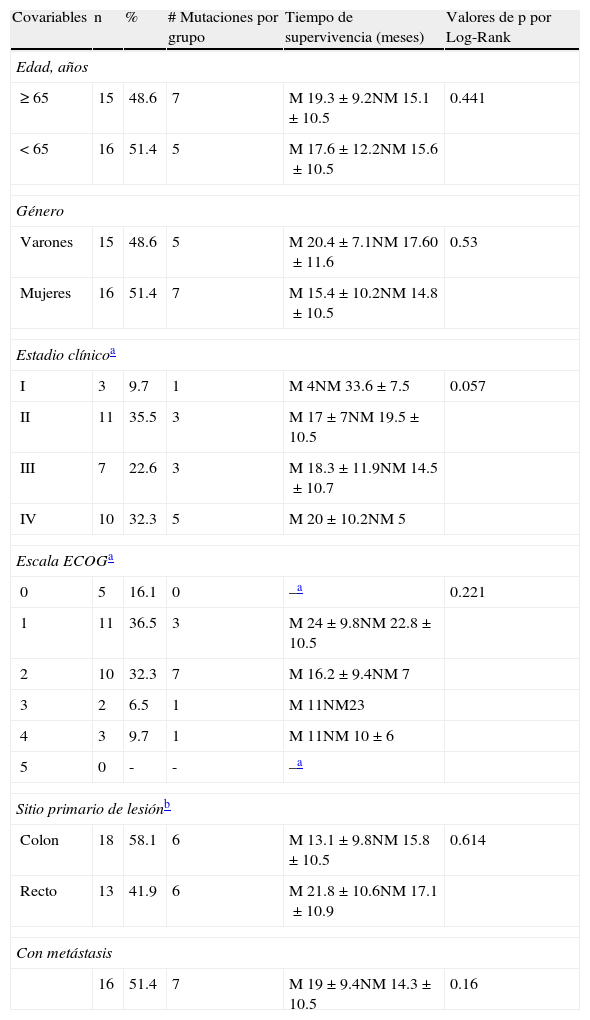
En el HAEV-ISSSTE, durante el periodo de estudio mencionado se realizaron 63 secuenciaciones de K-ras mediante la técnica de PCR en tiempo real. Se tomó en cuenta una baja casuística de 31 casos, y el resto se rechazó por no contar con expedientes completos. El 61.3% (n=19) recibió esquema inicial con XELOX y el 38.7% (n=12) con FOLFOX. Un 38.7% recibió además radioterapia. Solo 5 pacientes del total recibieron cetuximab como terapia adyuvante. La distribución por estadios clínicos, así como la valoración funcional ECOG, se resumen en la tabla 1.
Distribución de características de la población, número de mutaciones y su comparación en supervivencia
| Covariables | n | % | # Mutaciones por grupo | Tiempo de supervivencia (meses) | Valores de p por Log-Rank |
| Edad, años | |||||
| ≥65 | 15 | 48.6 | 7 | M 19.3±9.2NM 15.1±10.5 | 0.441 |
| <65 | 16 | 51.4 | 5 | M 17.6±12.2NM 15.6±10.5 | |
| Género | |||||
| Varones | 15 | 48.6 | 5 | M 20.4±7.1NM 17.60±11.6 | 0.53 |
| Mujeres | 16 | 51.4 | 7 | M 15.4±10.2NM 14.8±10.5 | |
| Estadio clínicoa | |||||
| I | 3 | 9.7 | 1 | M 4NM 33.6±7.5 | 0.057 |
| II | 11 | 35.5 | 3 | M 17±7NM 19.5±10.5 | |
| III | 7 | 22.6 | 3 | M 18.3±11.9NM 14.5±10.7 | |
| IV | 10 | 32.3 | 5 | M 20±10.2NM 5 | |
| Escala ECOGa | |||||
| 0 | 5 | 16.1 | 0 | –a | 0.221 |
| 1 | 11 | 36.5 | 3 | M 24±9.8NM 22.8±10.5 | |
| 2 | 10 | 32.3 | 7 | M 16.2±9.4NM 7 | |
| 3 | 2 | 6.5 | 1 | M 11NM23 | |
| 4 | 3 | 9.7 | 1 | M 11NM 10±6 | |
| 5 | 0 | - | - | –a | |
| Sitio primario de lesiónb | |||||
| Colon | 18 | 58.1 | 6 | M 13.1±9.8NM 15.8±10.5 | 0.614 |
| Recto | 13 | 41.9 | 6 | M 21.8±10.6NM 17.1±10.9 | |
| Con metástasis | |||||
| 16 | 51.4 | 7 | M 19±9.4NM 14.3±10.5 | 0.16 | |
M: K-ras mutado; NM: K-ras nativo.
El número de pacientes que presentaron una o varias mutaciones en la secuenciación del oncogén K-ras fue de 12 (38.7%), en su totalidad localizados en el codón 12 y 4 con mutaciones adicionales en el codón 13. Se documentó metástasis en 7 (58.3%), y 4 (33.3%) fallecieron. Por otro lado, 19 pacientes (61.3%) poseían K-ras en estado nativo, 9 (42.1%) progresaron a enfermedad metastásica y 3 (15.7%) de ellos fallecieron. Los resultados de un análisis inicial entre las mutaciones de K-ras con la presencia de metástasis (p=0.82) o con de decesos (p=0.48) no fueron significativos. El tiempo de sobrevida en general tuvo un valor medio de 16.77±9.90meses. La sobrevida en los pacientes con K-ras en estado nativo fue de 16.31±10.50meses; en contraste, en los pacientes con mutación, el tiempo de sobrevida tuvo una media de 17.5±9.27meses. Al realizar el análisis comparativo entre el tiempo de sobrevida y el estado de K-ras no se encontró diferencia estadísticamente significativa por el método de Kaplan-Meier (p=0.416) (fig. 1). Se contrastaron covariables con el método de Log-Rank. Los resultados numéricos se resumen en la tabla 1, ninguno de ellos fue significativo. Los pacientes en tratamiento con cetuximab fueron solo 5, todos ellos sin mutaciones en K-ras, los cuales tuvieron una supervivencia promedio de 10±3meses. El tiempo libre de recurrencia fue de 16.6±10.2meses. De manera anecdótica, se reporta a un paciente quien, a pesar de tener K-ras mutado, recibió tratamiento con cetuximab, teniendo una de las sobrevidas más largas de este reporte, con 26meses.
DiscusiónEn el presente estudio, las características de la población en cuanto a hallazgo mutacional y características de distribución por edad, género y sitio de lesión primaria fueron porcentualmente muy similares a lo que señala la literatura. El estudio más amplio sobre el tema, denominado RASCALII18, y otros estudios recientes más pequeños, concluyen que la presencia de mutaciones en K-ras se asocia a una menor supervivencia en comparación con los pacientes K-ras nativos, y sus razones de riesgo con mayor peso estadístico se reportaron en estadios clínicos más avanzados (DukesC); adicionalmente también reportan que las mutaciones en el codón12 conferían una biología agresiva19. Sin embargo, estudios con una metodología similar pero con un notable menor número de pacientes11,20, en los cuales la secuenciación de K-ras se realizó con el método de elección y en población local, no se encontró diferencia alguna en la sobrevida entre los grupos mutado y nativo, y tampoco fue influido por las covariables. La importancia de realizar la secuenciación a todos los pacientes con cáncer de colon recae en dirigir el tratamiento; se ha demostrado consistentemente que las mutaciones en el exón1 de este oncogén hacen que un tratamiento con cetuximab sea menos efectivo y modifica la sobrevida21. En el presente trabajo, el número de pacientes tratados con cetuximab no fue lo suficientemente grande para realizar una prueba estadística útil. Baste decir que su sobrevida fue muy pobre (10±3meses), y de manera anecdótica un caso, en el que de hecho se corroboró mutación en K-ras en una segunda secuenciación, tuvo una sobrevida por arriba de la media (26meses). Lo anterior representa un problema para los investigadores en países emergentes, en los cuales, aun en centros de referencia, no se realizan de manera rutinaria las secuenciaciones de K-ras o no se incluye para tratamiento monoclonal a todos los pacientes con K-ras en estado nativo, por el amplio costo que ambos procedimientos implican.
ConclusionesNo se encontró en el presente estudio piloto una relación entre la presencia de K-ras mutado y progresión a metástasis o asociación a una mayor proporción de decesos, como lo señala la literatura. Es importante realizar estudios con un mayor número de pacientes en tratamiento monoclonal para extrapolar lo publicado a población mexicana.
FinanciamientoNo se recibió patrocinio alguno por la realización del presente estudio.
Conflicto de interesesLos autores declaran no tener conflictos de intereses de ninguna índole.
Agradecemos la colaboración del personal directivo del HAEV-ISSSTE por las facilidades brindadas para el desarrollo del presente trabajo, así como las críticas del mismo al Dr. José María Remes Troche, Dr. Federico Roesch Dietlen y la Dra. Sara Aquino Pérez.