Paciente femenino de 54 años de edad, trasplantada de hígado por cirrosis biliar primaria Child-Pugh-Turcotte C10 MELD 16. Se realizó trasplante hepático ortotópico el 27 de enero del 2012 piggy back (con preservación de la vena cava), con anastomosis arterial termino-terminal (T-T), portal T-T, con colocación de endoprótesis biliar transoperatoria (retirada por colangiopancreatografía retrógrada endoscópica al día 45 postrasplante [post-THO]). Se realizó inducción con basiliximab y una terapia inmunosupresora de mantenimiento con prednisona, mofetil micofenolato y tacrolimús. El seguimiento fue semanal durante los primeros 3 meses y posteriormente cada 2 semanas. En el seguimiento la paciente estaba con adecuados niveles sanguíneos de tacrolimús con una marca de genérico (7.4-10.7ng/ml), se manejaron dosis de mofetil micofenolato de 1,000-1,500mg cada 12h, según tolerancia y efectos secundarios; la reducción de prednisona se realizó de manera progresiva 2.5mg por mes y manteniendo una dosis de 10mg al día.
Al cuarto mes post-THO, la paciente (sin previa notificación al equipo médico) cambió de marca genérica de tacrolimús. En la siguiente consulta, se presentó con ictericia conjuntival, citólisis y colestasis (tabla 1), niveles sanguíneos residuales de tacrolimús de 2.7ng/ml (previos 7.4ng/ml) con la misma dosificación; se descartaron otras causas de disminución de niveles de tacrolimús (como la forma de administración, la ingesta de otros medicamentos, las alteraciones gastrointestinales o los problemas de absorción, etc.); la paciente fue hospitalizada. Los medicamentos utilizados al ingreso: micofenolato 1,000mg cada 12 h, prednisona 10mg al día, tacrolimús 3mg cada 12 h (la dosis se duplicó al ingreso), amlodipino 5mg al día, aspirina 100mg cada 24h, metformina 500mg cada 8h. Siendo las principales causas de disfunción del injerto infecciosas, complicaciones vasculares y rechazo, se realizaron los estudios necesarios para el abordaje. El US Doppler mostró: flujo arterial normal con un índice de resistencia postanastomótico de la arteria hepática de 0.61, flujo venoso porta y suprahepática normales y vías biliares sin dilatación. La antigenemia pp65, para descartar una infección por CMV fue negativa. Se realizó una biopsia percutánea, donde se documentaron cambios compatibles con rechazo agudo celular (RAC) (fig. 1). Al ingreso, se administran 3 bolos de 1 g de metilprednisolona, con mejoría progresiva de las pruebas de función hepática (PFH), que al egreso fueron ALT 79 U/l, AST 42 U/l, fosfatasa alcalina 292 U/l, GGT 1,283 U/l, bilirrubina total 2.3mg/dl, albúmina 3.8g/dl; fue egresada con tratamiento inmunosupresor: Prograf 10mg cada 12h, con niveles sanguíneos residuales de 22ng/ml, mofetil micofenolato 1,500mg cada 12h y prednisona 20mg al día; duración de hospitalización: una semana.
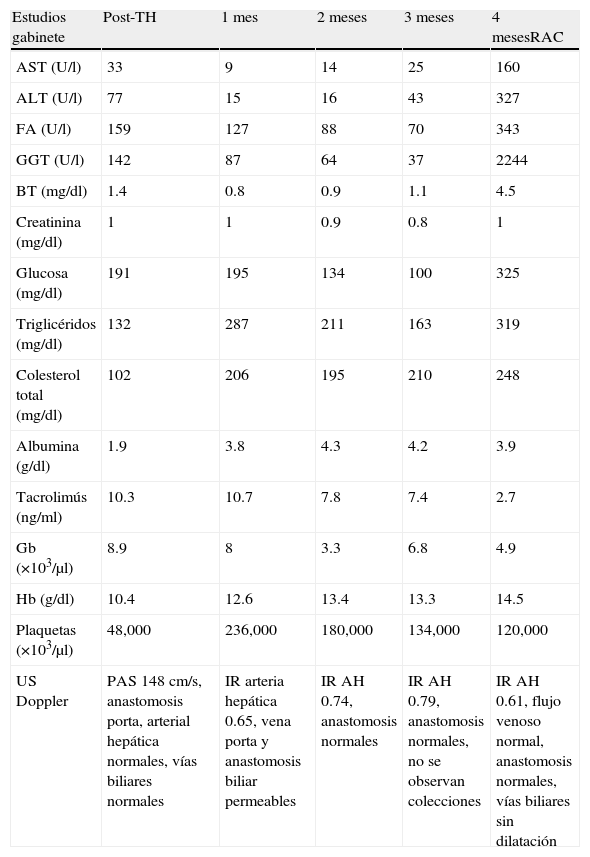
Evolución de pruebas laboratorio y de imagen
| Estudios gabinete | Post-TH | 1 mes | 2 meses | 3 meses | 4 mesesRAC |
| AST (U/l) | 33 | 9 | 14 | 25 | 160 |
| ALT (U/l) | 77 | 15 | 16 | 43 | 327 |
| FA (U/l) | 159 | 127 | 88 | 70 | 343 |
| GGT (U/l) | 142 | 87 | 64 | 37 | 2244 |
| BT (mg/dl) | 1.4 | 0.8 | 0.9 | 1.1 | 4.5 |
| Creatinina (mg/dl) | 1 | 1 | 0.9 | 0.8 | 1 |
| Glucosa (mg/dl) | 191 | 195 | 134 | 100 | 325 |
| Triglicéridos (mg/dl) | 132 | 287 | 211 | 163 | 319 |
| Colesterol total (mg/dl) | 102 | 206 | 195 | 210 | 248 |
| Albumina (g/dl) | 1.9 | 3.8 | 4.3 | 4.2 | 3.9 |
| Tacrolimús (ng/ml) | 10.3 | 10.7 | 7.8 | 7.4 | 2.7 |
| Gb (×103/μl) | 8.9 | 8 | 3.3 | 6.8 | 4.9 |
| Hb (g/dl) | 10.4 | 12.6 | 13.4 | 13.3 | 14.5 |
| Plaquetas (×103/μl) | 48,000 | 236,000 | 180,000 | 134,000 | 120,000 |
| US Doppler | PAS 148cm/s, anastomosis porta, arterial hepática normales, vías biliares normales | IR arteria hepática 0.65, vena porta y anastomosis biliar permeables | IR AH 0.74, anastomosis normales | IR AH 0.79, anastomosis normales, no se observan colecciones | IR AH 0.61, flujo venoso normal, anastomosis normales, vías biliares sin dilatación |
AH: arteria hepática; ALT: alanino aminotransferasa; AST: aspartato aminotransferasa; BT: bilirrubina total; FA: fosfatasa alcalina; GGT: gamaglutamil transferasa; IR: índice de resistencia; PAS: presión arterial sistólica; US: ultrasonido.
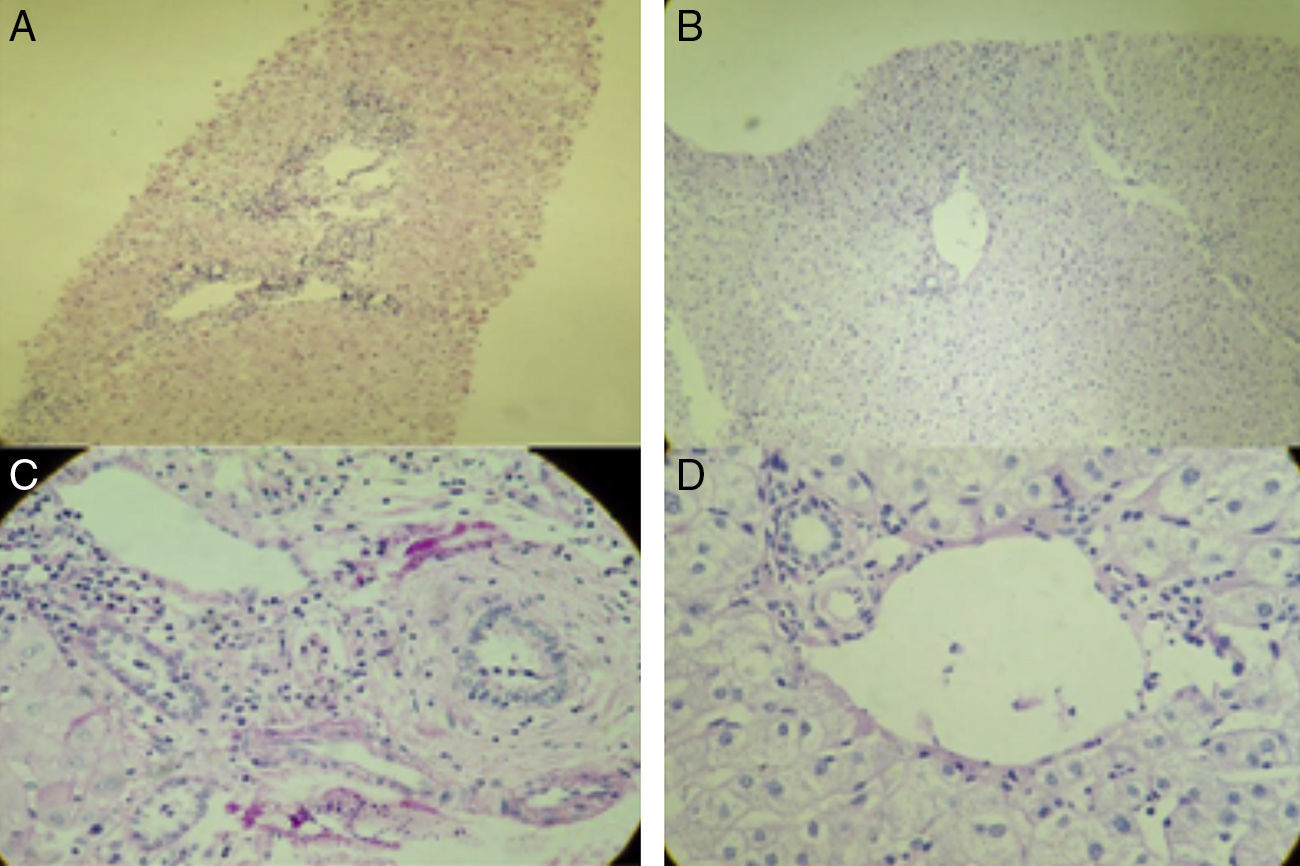
A) Tinción con hematoxilina y eosina de biopsia hepática percutánea de la paciente mostrando un rechazo agudo celular sin ductopenia. La muestra analizada cuenta con 6 espacios porta, todos ellos con infiltrado inflamatorio, compuesto por linfocitos, células plasmáticas, eosinófilos e histiocitos. No se observa ductopenia. Endotelitis. En las venas centrolobulillares hay 2 de ellas con inflamación de la íntima y luminal, y necrosis perivenular. Score de Banff 7 (rechazo moderado). B) Tinción de PAS de paciente trasplantado hepático, control anual. Se observan hepatocitos de características normales; los espacios porta no presentan lesión ni vasculitis, no hay disminución de colangiolos, sin datos de rechazo. La biopsia se encuentra dentro de los límites sin alteraciones. C) Tinción PAS: paciente con RAC. D) Tinción PAS: parénquima hepático normal (biopsia hepática de control anual de paciente trasplantado hepático).
Cuatro meses posterior al primer episodio de RAC, la paciente presenta citólisis y colestasis (AST 152 U/l, ALT 223 U/l, fosfatasa alcalina 186 U/l, GGT 494 U/l), la paciente no aceptó la realización de una nueva biopsia hepática; se realizó un ultrasonido Doppler que fue normal; se solicitaron anticuerpos antinucleares (ANA), IgG y anticuerpos antimúsculo liso; los ANA resultaron positivos 1:320 homogéneo y la IgG 1.5N (estos estudios eran normales pre-THO), por lo cual se decidió tratar como una hepatitis autoinmune de novo; actualmente, con PFH normales.
La introducción de medicamentos inmunosupresores genéricos (IS) fue aprobada por la Food and Drug Administration (FDA) en agosto del 20091,2. En el siglo xxi, el tacrolimús es considerado el inmunosupresor de elección. El nombre de patente del tacrolimús (Prograf, Astellas Pharma) perdió la protección de la patente en abril del 2008, y el 10 de agosto del 2009 la FDA aprobó el primer tacrolimús genérico2. Para ser bioequivalente, el medicamento genérico debe de contener la misma cantidad de sustancia activa, vía de administración y misma dosis; la tasa (concentración máxima) y la concentración del área bajo la curva no deben de diferir de forma significativa de las de referencia. Los medicamentos genéricos deben tener un 90% de intervalo de confianza y la bioequivalencia debe de encontrarse entre un 80 al 125%3. En México, la NOM-177-SSA1-1998 establece los criterios y los requisitos que deben cumplirse en la realización de pruebas para demostrar la intercambiabilidad de los medicamentos genéricos4, y actualmente (aprobados por la COFEPRIS) existen 4 marcas de tacrolimús genérico oral5.
Factores como la edad, la raza, el género, la dieta y las alteraciones del metabolismo y del transporte entérico, así como los polimorfismos de las enzimas que catabolizan los IS, pueden generar variabilidad interindividual6. Existen diferentes guías de recomendación para el uso de medicamentos genéricos en trasplante7; sin embargo, sigue siendo controversial la bioequivalencia de algunos de estos2,8,9. En un estudio realizado en México sobre 3 marcas diferentes de tacrolimús genérico comparado con la sustancia innovadora (Prograf) se encontró que estos no son bioequivalentes al Prograf9; sin embargo, aunque no presenten la misma bioequivalencia, algunos de ellos han demostrado en otros estudios su eficacia y seguridad para su utilización10.
Los medicamentos genéricos pueden ser una opción útil y eficaz para el tratamiento de los pacientes trasplantados; sin embargo, no todas las presentaciones de medicamentos genéricos han mostrado su bioequivalencia y biodisponibilidad; además, entre las diversas marcas de IS genéricos estas pueden diferir de forma importante. El ajuste individual de las dosis cuando se utilizan IS genéricos es crítico, no solo para prevenir el rechazo agudo, sino también para prolongar la sobrevida del paciente y del injerto.
FinanciaciónNo hubo financiamiento para la realización de este estudio.
Conflicto de interesesLos autores no tienen conflicto de interés en relación con el artículo que se remite para publicación.
A Navarro Reynoso Francisco Pascual, M.D., García-Covarrubias Luis M.D., Luque Hernández Alejandro, M.D., Cicero-Lebrija Alejandra M.D., Hinojosa Heredia Héctor, M.D., Fernández Ángel Diana, M.D., Silva de Navarro Carolina, y Espinosa Escobar Carolina, T.S.