¿ Introducción
Desde el diseño del primer prototipo de ecoendoscopio en 1980,1 el ultrasonido endoscópico (USE) ha experimentado un espectacular desarrollo. Ideado inicialmente como una técnica estrictamente diagnóstica, ha ido incorporando nuevas indicaciones terapéuticas hasta convertirse en una alternativa menos invasiva a procedimientos quirúrgicos.2
El desarrollo de los ecoendoscopios lineales a principios de la década de 1990, permitió obtener muestras de tejido y fue el punto de partida para el desarrollo de nuevos accesorios3 e indicaciones.
Los nuevos ecoendosocopios terapéuticos de visión frontal4,5 y la evolución constante de la cirugía mínimamente invasiva6,7 parecen asegurar la continua expansión de la técnica.
1. Ablación del plexo celíaco
La ablación del plexo celíaco con etanol fue la primera aplicación terapéutica de la inyección con aguja fina guiada por ecoendosocopia.8
Wiersema y colaboradores8 publicaron los resultados obtenidos en 30 pacientes con dolor refractario a la analgesia convencional, 25 de ellos con cáncer de páncreas y cinco con metástasis intraabdominales. Tras la inyección de una mezcla de etanol al 98% y bupivacaína por medio de una aguja de 22G, 79% a 88% refirieron mejoría persistente del dolor luego de dos a 12 semanas.
Dos meta-análisis recientes9,10 analizaron la eficacia de este procedimiento en pacientes con diagnóstico de cáncer de páncreas y pancreatitis crónica. Se observó mejoría del dolor en el 72% a 80% de los pacientes con diagnóstico de neoplasia; la eficacia en los casos de dolor abdominal secundario a pancreatitis crónica desciende de 51% a 59%. En este subgrupo de pacientes se hace necesaria la investigación de nuevas técnicas y sustancias.
Ambos trabajos revelan una menor tasa de complicaciones en comparación con los métodos guiados por TAC; es destacable la ausencia de complicaciones neurológicas al evitarse el acceso posterior.
La principal limitación es la progresiva disminución del efecto analgésico. Un trabajo reciente con modelos animales,11 comparó la inyección convencional con la administración conjunta de un polímero que se gelifica a temperatura corporal y que demostró permanecer en el sitio exacto de inyección, lo que potencialmente ayudaría a incrementar la eficacia y duración del tratamiento.
Es necesario determinar cuál es el momento óptimo en el curso de la enfermedad para su administración. En un estudio aleatorizado, controlado y doble ciego, que incluye a 98 pacientes diagnosticados de cáncer de páncreas no subsidiario de tratamiento quirúrgico, Wyse y colaboradores12 muestran que con la neurolisis del plexo celíaco guiada por USE en el momento del diagnostico se logra un mejor control del dolor y es menor la necesidad de analgésicos que con la pauta analgésica convencional.
2. Drenaje de colecciones
El drenaje quirúrgico de colecciones y abscesos intraabdominales se acompaña de elevadas tasas de morbilidad y mortalidad; como alternativa se ha empleado el acceso percutáneo bajo control radiológico o ecográfico, con menos complicaciones pero en ocasiones con dificultades para acceder a la lesión. Frente a ellas, la ecoendoscopia se ha convertido en una alternativa eficaz, con menor morbimortalidad, menor estancia hospitalaria y menor coste.13
El ecoendoscopio se sitúa adyacente a la lesión, lo que evita la punción de la pared abdominal impidiendo la formación de fístulas cutáneas y disminuyendo el riesgo de lesión de órganos vecinos y de infección del trayecto.14,15
Las áreas anatómicas de la cavidad abdominal accesibles al ecoendoscopio son el espacio subfrénico, el lóbulo hepático izquierdo y los segmentos centrales del hígado, la región peripancreática, y el área perirrectal.14
2a. Pseudoquistes pancreáticos.
El drenaje de pseudoquistes pancreáticos guiado por ecoendoscopia está ampliamente documentado desde que Grimm y colaboradores publicarán el primer caso en 1992.16 Presenta cifras de éxito superiores al 90% y logra la resolución de la lesión y de la sintomatología en más del 80% de los casos. Comparado con la alternativa quirúrgica, tiene menor tasa de complicaciones, más bajo coste y requiere una estancia hospitalaria más breve.15,17-21
Tras localizar la lesión con el ecoendoscopio lineal y descartar la presencia de estructuras vasculares, se accede al pseudoquiste por vía transgástrica o transdudoenal con una aguja de 19G o 22G. Bajo control radiológico se introduce una guía de 0.035 cm en el interior de la cavidad y se dilata el trayecto empleando un balón neumático de 6-8 mm. Para asegurar el drenaje se emplean prótesis plásticas de 8.5-10 Fr, usualmente de doble pigtail, y opcionalmente un catéter nasoquístico.14,15
Es recomendable utilizar ecoendoscopios con un canal de trabajo de 3.7 mm o 3.8 mm de diámetro, que permiten la colocación de prótesis de hasta 10 Fr y la progresión sin dificultad de prótesis con doble pigtail.14
El empleo del nuevo prototipo de ecoendoscopio terapéutico de visión frontal podría facilitar el drenaje de pseudoquistes de determinada localización; se requieren ensayos aleatorizados para definir sus indicaciones.14
No está establecido el mejor momento para la retirada de las prótesis de drenaje; un estudio aleatorizado22 encontró una menor tasa de recurrencia en pacientes en quienes se mantuvieron durante el seguimiento, comparados con aquellos en quienes fueron retiradas dos semanas después de confirmar la resolución de la colección en pruebas de imagen. Cabe destacar que la recurrencia se produjo principalmente en pacientes con disrupción completa del conducto pancreático principal.
Para aclarar el riesgo de oclusión de las prótesis y establecer si su mantenimiento a largo plazo se asocia a mayor riesgo de infección se requieren estudios que incluyan un mayor número de pacientes. En casos de ruptura del conducto pancreático o comunicación del pseudoquiste con la vía pancreática parece indicado su mantenimiento.22
Hasta la fecha se han publicado dos estudios prospectivos aleatorizados que comparan el drenaje endoscópico convencional con el guiado por USE.23,24 No se encontraron diferencias en términos de eficacia (definida como la desaparición del pseudoquiste o la disminución a un tamaño ≤ 2 cm en TAC sumada a la resolución de los signos y síntomas a las seis semanas de tratamiento), complicaciones ni estancia hospitalaria media, aunque ambos muestran diferencias estadísticamente significativas en el porcentaje de éxito inicial a favor del drenaje guiado por USE (94% a 100% vs. 33% a 72% [p < 0.001-0.039]). Cabe destacar que los pacientes en los que fracasó el drenaje endoscópico convencional fueron sometidos a un intento de drenaje guiado por USE con un porcentaje de éxito del 100%.
En un tercer estudio prospectivo no aleatorizado comparando ambos métodos25 se obtuvieron resultados similares, pero los pacientes fueron asignados a una de las dos técnicas en función de las características del pseudoquiste y de la presencia o no de compresión de la pared gástrica o duodenal visible endoscópicamente.
El drenaje endoscópico de pseudoquistes pancreáticos presenta elevadas tasas de eficacia y escasa morbimortalidad, además de reducir los costes y la estancia hospitalaria media en comparación con la alternativa quirúrgica y debe ser considerado como el tratamiento de primera elección.
El USE ayuda al diagnóstico diferencial entre pseudoquistes simples y tumoraciones quísticas del páncreas, puede determinar la naturaleza de la colección, estableciendo si se trata de un quiste, un absceso simple o si existen restos necróticos, disminuye el riesgo de sangrado al identificar la presencia de vasos sanguíneos, establece la distancia entre la lesión y la pared intestinal, lo que podría disminuir el riesgo de perforación, y permite el drenaje de colecciones líquidas que no protruyen en la luz intestinal.14,26 Todo esto junto al mayor porcentaje de éxito inicial asociado al drenaje guiado por USE, hace que ésta deba ser la técnica de elección siempre que esté disponible y fundamentalmente en casos en los que no exista protrusión de la pared gástrica o duodenal visible endoscópicamente.26
2b. Colecciones pélvicas.
Por la localización de las colecciones y abscesos pélvicos, el accesopara su drenaje es a menudo complejo. El método de elección suele ser el abordaje percutáneo guiado por TC con acceso transglúteo o transabdominal, que se asocia a complicaciones graves como la lesión del nervio ciático o de la arteria glútea inferior. La ecografía endorrectal o endovaginal no consigue el acceso a colecciones profundas y no permite la colocación concomitante de prótesis para asegurar el drenaje.27
La particular anatomía de la pelvis, rodeada de estructuras óseas y con importantes vasos, nervios y numerosos órganos, hace técnicamente complejo acceder a ella, por lo que el desarrollo del drenaje guiado por USE es una alternativa atractiva.27
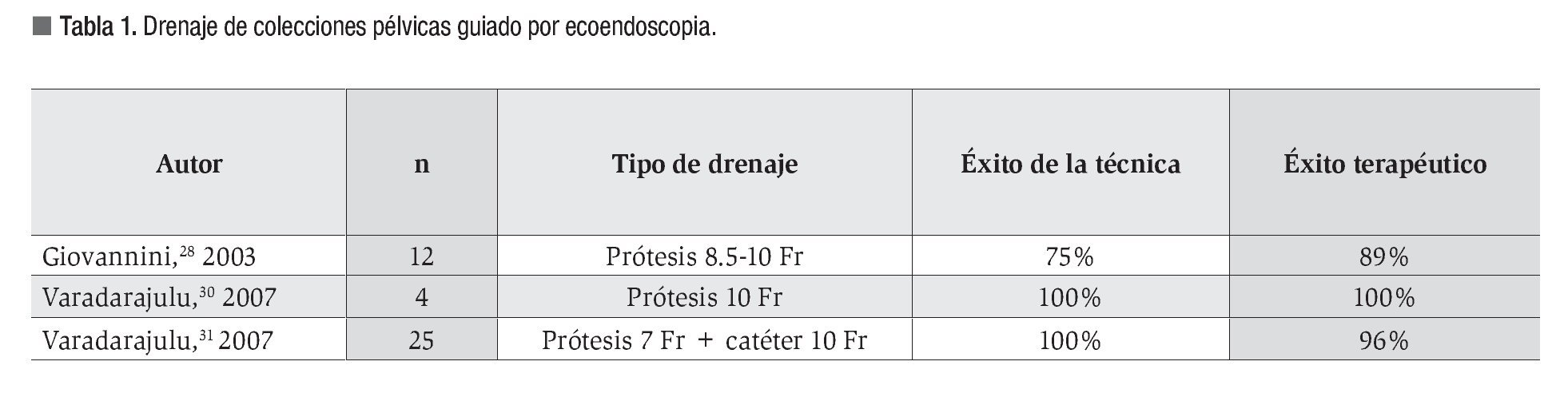
La técnica habitual2,27-31 consiste en la localización del absceso empleando un ecoendoscopio lineal con Doppler color para confirmar la ausencia de vasos y asegurar que la lesión se encuentra en contacto con la pared del tracto digestivo o a una distancia menor de 1-2 cm. Tras la punción con una aguja de 19G y realizar lavados con suero fisiológico, se introduce una guía convencional bajo control radiológico con posterior dilatación del trayecto para facilitar la colocación del número de prótesis que se considere indicado, habitualmente de 7, 8.5 o 10 Fr y doble o simple pigtail. En los trabajos publicados, se logra la resolución del absceso con la retirada precoz de las prótesis, tras comprobar en pruebas de imagen su desaparición o disminución en al menos el 80%.29-31
La colocación conjunta de catéteres de drenaje puede ayudar a una más rápida resolución;29 su empleo se recomienda en abscesos mayores de 8 cm.27
En la Tabla 1 se resumen los resultados y características de los estudios prospectivos publicados; se trata de series de casos con fracaso previo del drenaje guiado por ecografía endorrectal/endovaginal o TC. Todos presentan elevadas tasas de éxito y de resolución o disminución significativa del absceso con práctica ausencia de complicaciones.
El abordaje guiado por USE no permite drenar colecciones multiloculadas ni aquellas que no estén localizadas alrededor del recto o en contacto con el colon izquierdo; se espera que el desarrollo de nuevos ecoendoscopios de visión frontal con una mayor maniobrabilidad permita el acceso a colecciones y abscesos localizados en el colon proximal.27
Sus indicaciones actuales se limitan a casos con fracaso del abordaje convencional; se precisan ensayos multicéntricos comparativos con mayor número de pacientes para establecer la eficacia y seguridad de la técnica y sus ventajas sobre las actualmente aceptadas.27
2c. Otras colecciones.
Varios trabajos muestran la posibilidad del drenaje guiado por USE de colecciones de diversa localización, siempre que se encuentren en contacto con el tubo digestivo.2, 32-39 Aunque todos informan tasas de resolución por encima del 90% y escasas complicaciones, se trata de series de casos con un número muy limitado de pacientes.La eficacia y seguridad de este procedimiento, en comparación con las técnicas actualmente disponibles, no han sido establecidas.2
La técnica es superponible a la ya descrita previamente y se encuentran en la literatura ejemplos de drenaje por vía transgástrica de abscesos subfrénicos,32,33 abscesos esplénicos,32,34 bilomas35 y abscesos hepáticos36-38 así como ejemplos de drenaje transesofágico de pseudoquistes pancreáticos32 y quistes pericárdicos.39
3. Terapéutica de la vía biliar y pancreática
3a. Drenaje de la vía biliar.
La colangiopancreatografía retrógrada endoscópica (CPRE) es el método terapéutico de elección en casos de ictericia obstructiva o estenosis de la vía pancreática (VP) y en manos de endoscopistas expertos las cifras de éxito alcanzan 90% a 95%. Cuando ésta no es posible, se emplean métodos de drenaje quirúrgicos y percutáneos con aceptables cifras de éxito.
Wiersema y colaboradores40 publican en 1996 el primer acceso a la vía biliar (VB) guiado por USE, que se plantea como una alternativa menos invasiva y con mejor perfil de seguridad.41-44 El riesgo de hemorragia es inferior gracias al empleo del Doppler, la visualización en tiempo real del árbol biliopancreático es posible y se evita la necesidad de un catéter externo de drenaje, lo que disminuye el riesgo de infecciones y ofrece mayor comodidad al paciente.
Este abordaje está especialmente indicado en casos de inaccesibilidad a la papila por patología obstructiva gástrica o duodenal, divertículos duodenales o cirugía gastroduodenal previa (Billroth II, Y de Roux, Whipple).44
El procedimiento se asocia a más riesgos que una CPRE convencional y debe ser realizado por un endoscopista experto en USE y CPRE, o por dos endoscopistas expertos en cada una de las técnicas, y en centros de tercer nivel con disponibilidad de equipos de cirugía biliopancreática y radiología intervencionista.42,43
Se describen dos modos de abordaje de la VB: El acceso a la VB intrahepática a través del estómago y a la VB extrahepática desde el duodeno. Siempre que exista dilatación ≥ 2 mm de la vía intrahepática se prefiere el acceso transgástrico, que permite la colocación de prótesis biliares por vía anterógrada con mayor facilidad y sin necesidad de una CPRE posterior.42
¿ Hepatogastrostomía
Se emplean ecoendoscopios lineales con canal terapéutico de al menos 3 mm, idealmente 3.8 mm, para permitir el empleo de una mayor variedad de accesorios y la colocación de prótesis de hasta 10 Fr. Con el ecoendoscopio en el estomago proximal identificando la VB intrahepática izquierda, que debe encontrarse dilatada, se realiza la punción de la VB con agujas de 25, 22 o 19G, aunque es preferible la utilización de agujas de 19G que permiten el empleo de guías de 0.035 cm. El uso de guías de mayor calibre y rigidez puede ayudar a superar estenosis aunque su inserción en la VB puede resultar más complicada.43,44 Tras la inyección de contraste para delimitar el árbol biliar, se pasa la guía bajo control radiológico hasta que el extremo distal alcance el duodeno a través de la papila y se procede a la dilatación de la fístula bilioentérica empleando catéteres de dilatación de 6-7 Fr o balones inflables de 4-6 mm.
El procedimiento concluye con la colocación de una prótesis biliar por vía anterógrada hasta que su extremo distal emerja a la luz duodenal. Otra opción es realizar una CPRE convencional tras retirar el ecoendoscopio (rendezvous).
En los casos en los que no sea posible superar la estenosis, se coloca una prótesis en el interior del árbol biliar abocada a la luz del estómago para asegurar el drenaje.
¿ Coledocoduodenostomía
El acceso transduodenal fue descrito por Giovannini y colaboradores en 2001;45 se accede a la VB extrahepática desde el duodeno o el antro gástrico, siendo el procedimiento posterior superponible al descrito con anterioridad.46
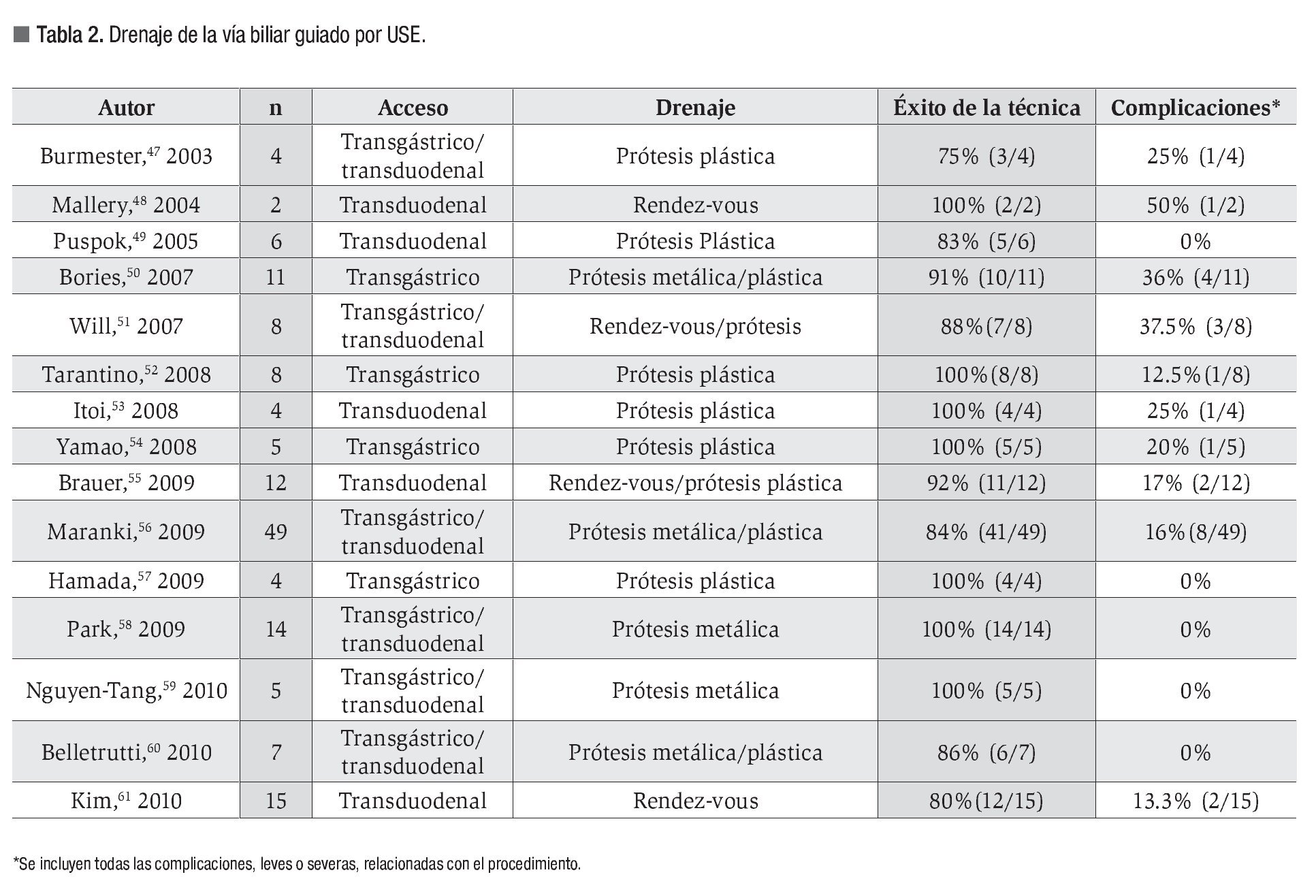
Para asegurar el drenaje por cualquiera de los dos abordajes descritos, se han empleado con éxito prótesis biliares plásticas49,50,52-54,56-58 y prótesis metálicas totalmente recubiertas.50,56,58-60
En la Tabla 2 se resumen los trabajos más relevantes publicados hasta la fecha. El porcentaje de éxito global es del 89% (75% a 100%) y la tasa de complicaciones del 15%, siendo las más importantes neumoperitoneo, hemorragia, sangrado, perforación y fuga biliar.47-61
Pese a lo prometedor de los resultados, la escasez de estudios y la heterogeneidad de los mismos, tanto en el diseño como en las técnicas de drenaje empleadas, disminuye la potencia de las conclusiones. Dado que la evidencia disponible no es suficiente, se hace necesario realizar estudios prospectivos y aleatorizados para la comparación de esta técnica, en términos de eficacia y seguridad, con las de drenaje percutáneo y quirúrgico consideradas de elección en la práctica clínica.
3b. Drenaje de la vía pancreática.
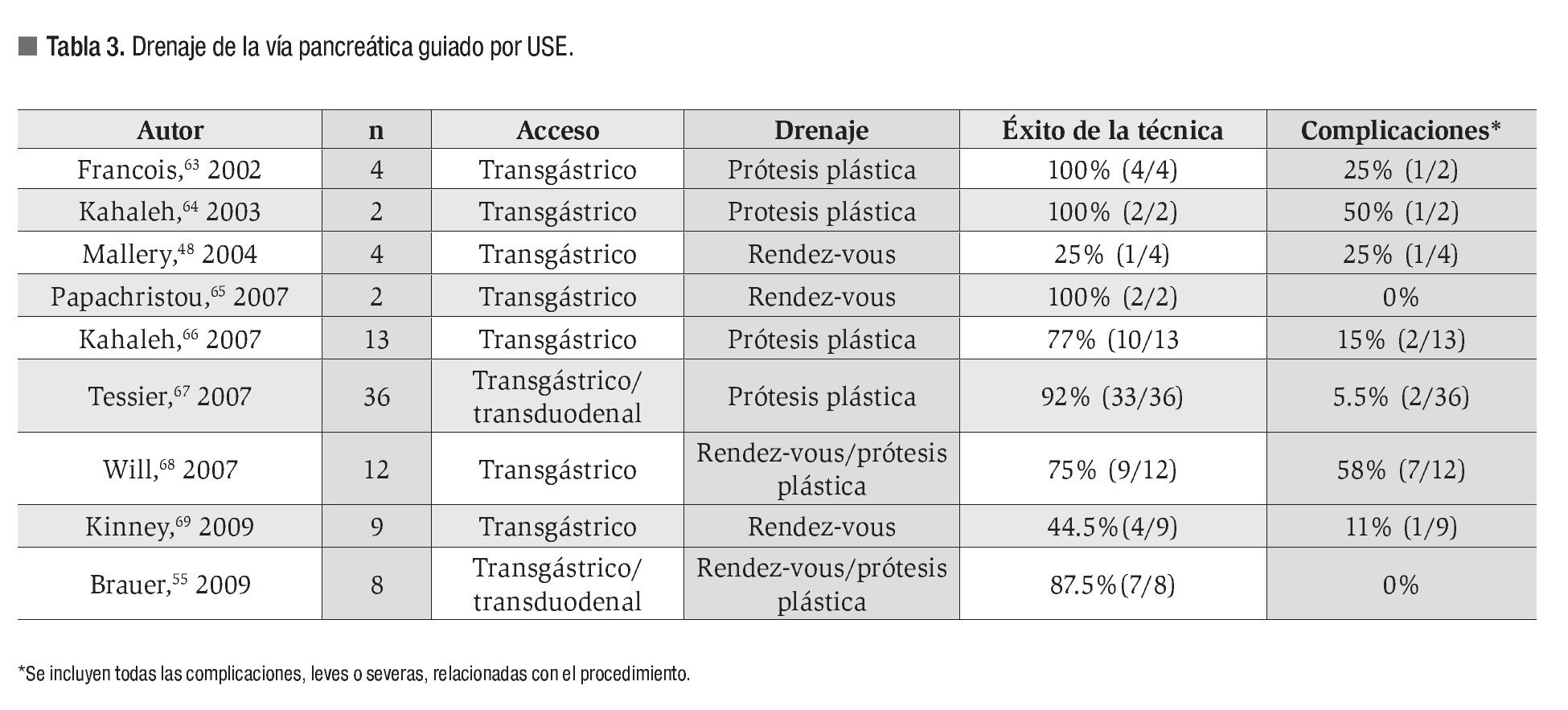
Descrita en 1995 por Harada y colaboradores,62 la técnica sigue los mismos pasos explicados para el acceso a la VB. Puede entrañar más complejidad, entre otros motivos por la tendencia de la guía a pasar a pequeñas ramificaciones de los conductos pancreáticos.
El pronóstico a largo plazo, la necesidad de reintervención y el momento de recambio de las prótesis no están debidamente establecidos.
En la Tabla 3 se resumen los resultados y complicaciones de los trabajos publicados hasta la fecha.48,55,63-69
3c. Drenaje de vesícula biliar. Utilidad en colecistitis aguda.
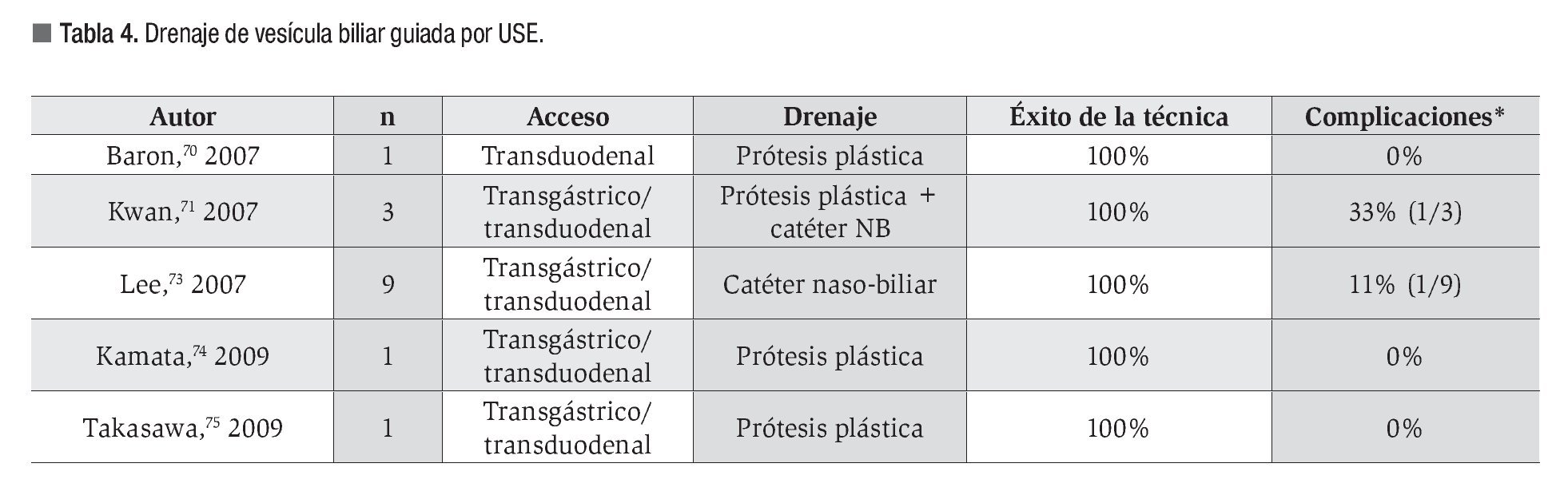
El drenaje de la vesícula biliar guiado por USE en pacientes con contraindicación para el tratamiento quirúrgico o en situaciones de sepsis, fue descrito por primera vez en 200770,71 como alternativa al drenaje percutáneo, considerado el tratamiento de elección en estos pacientes.
La técnica empleada es similar a la ya descrita para el drenaje de las vías biliar y pancreática. Tras identificar a la vesícula empleando un ecoendoscopio lineal, se realiza una punción desde al antro gástrico o el duodeno, y bajo control radiológico se procede a la colocación de un sistema de drenaje sobre una guía.70-75
El escaso número de pacientes incluidos en los trabajos publicados impide que exista una estandarización de la técnica.72 Se han empleado diferentes métodos de punción, agujas de 19G70,73,74 y esfinterótomos de aguja,71,75 y distintos métodos de drenaje, prótesis plásticas,70,74,75 catéteres de drenaje nasobiliar 73 o ambos de forma conjunta.71 En la Tabla 4 se resumen los estudios disponibles.
A pesar del elevado porcentaje de éxito, la falta de estandarización ya referida y la ausencia de materiales específicos, impiden que pueda recomendarse como una técnica de rutina en la práctica clínica.72
3d. Ablación de quistes pancreáticos.
La inyección intralesional de etanol a diferentes concentraciones (80% a 99%) por medio de aguja guiada por USE, ha mostrado resultados prometedores en el tratamiento de lesiones quísticas del páncreas, con cifras de resolución radiológica que alcanzan 79% a los 12 meses y escasos efectos adversos.76-80 Aún se considera un abordaje terapéutico experimental y es necesario establecer su eficacia a largo plazo y la comparación en términos de eficacia y seguridad con otros métodos de tratamiento, como la ablación por radiofrecuencia o la terapia fotodinámica.2
4. Terapia antineoplásica
Se han publicado numerosos trabajos empleando diversas modalidades de tratamiento anticancerígeno que utilizan el USE como modo de acceder a la lesión. La mayor parte aún se encuentra en fase experimental y su papel en el algoritmo terapéutico del cáncer no está bien establecido.2,81-84
4a. Inyección de sustancias antitumorales
La inyección intratumoral de sustancias antineoplásicas guiada por USE se plantea como una modalidad de tratamiento en casos de enfermedad tumoral localmente avanzada.
Se logra acceso a la lesión por medio de la punción selectiva con una aguja de 22G. La inyección de la sustancia se realiza mientras se retira la aguja; antes de extraerla por completo de la lesión se introduce de nuevo con un ángulo diferente y se vuelve a inyectar en retirada. La intención es inyectar la sustancia en forma de abanico para tratar la mayor parte del tumor.81
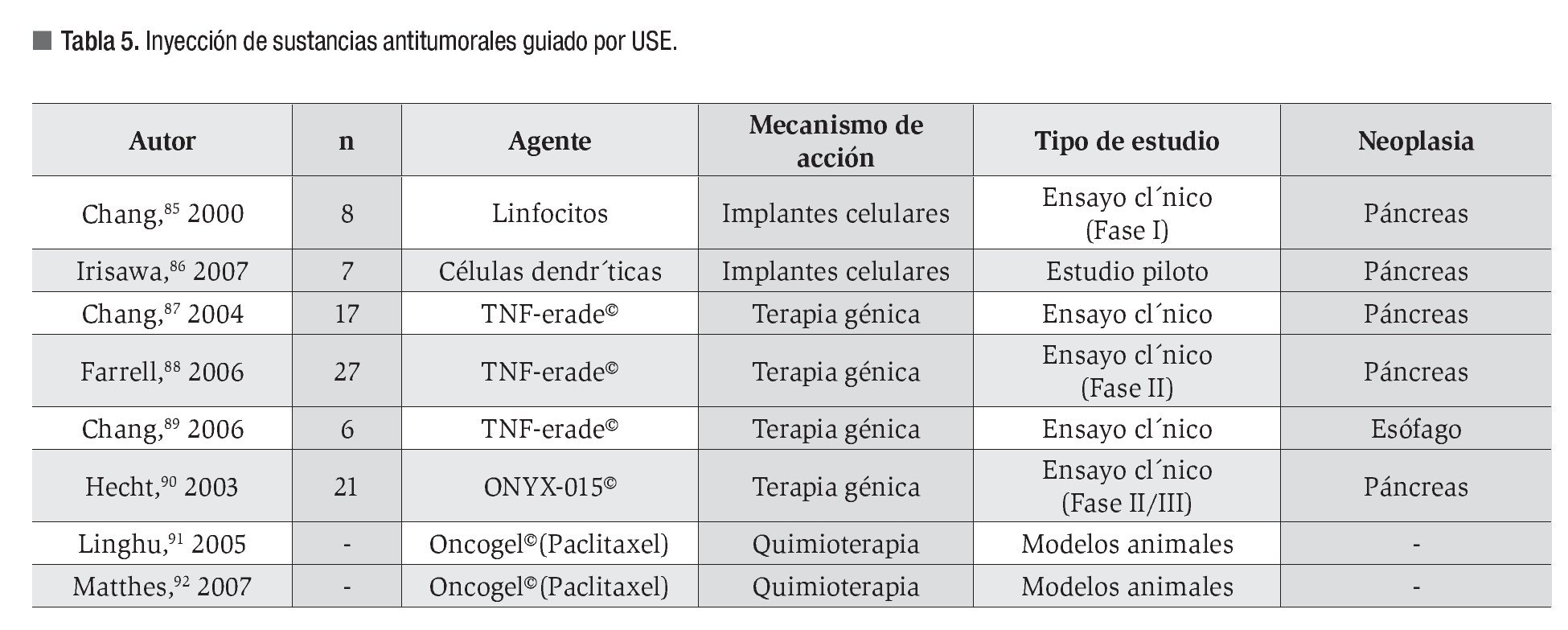
Varios trabajos publicados, resumidos en la Tabla 5, demuestran la viabilidad de la técnica y evalúan la respuesta al tratamiento con diversas sustancias.85-92
Aunque existe riesgo potencial de siembra tumoral a través del trayecto de punción, se ha demostrado que éste es claramente inferior al asociado al acceso percutáneo.93
No existe consenso con respecto a sus indicaciones ni a su lugar denle el algoritmo terapéutico del cáncer; sin embargo, podría tener un papel en el tratamiento de neoplasias localmente avanzadas.81
Se requieren estudios comparativos para identificar las ventajas de este tipo de abordaje; el desarrollo de agujas específicas contribuiría a la evolución de la técnica.81 Actualmente se lleva a cabo un ensayo clínico multicéntrico, aleatorizado y controlado, que se encuentra en fase II/III, y evalúa la respuesta al tratamiento combinado con TNFerade y quimioterapia en cáncer de páncreas localmente avanzado.81
4b. Radioterapia guiada por USE
4b1. Braquiterapia.
La braquiterapia se ha venido empleando con éxito en el tratamiento de diversos tumores de órganos sólidos como próstata, mama o sistema nerviosos central. Mediante el implante percutáneo o quirúrgico de semillas radiactivas (Yodo-125 o Paladio-103) directamente en el tumor, y la exposición posterior a radiación gamma, se logra la destrucción de la lesión con menor toxicidad sobre el tejido sano y los órganos adyacentes que la radioterapia convencional.
Un trabajo publicado en 2005 mostró la posibilidad de implantar semillas de I-125 en tejido pancreático, empleando una aguja de 18G modificada guiada por USE, sin que ocurrieran complicaciones relacionadas con el procedimiento.94 Posteriormente Lah y colaboradores95 emplearon este modo de abordaje en un paciente con adenocarcinoma de esófago, implantando con éxito semillas de I-125 en dos adenopatías subdiafragmáticas.
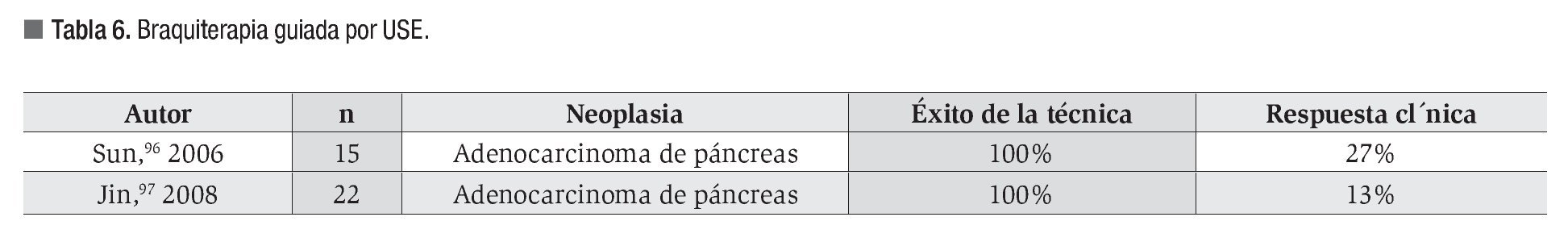
Hasta la fecha se han publicado dos ensayos clínicos prospectivos96,97 que incluyen a un total de 37 pacientes con diagnóstico de adenocarcinoma de páncreas; los resultados se resumen en la Tabla 6.
No se ha demostrado un incremento en la supervivencia aunque sí un mejor control del dolor en estos pacientes. Esta modalidad terapéutica requiere ser evaluada en el marco de ensayos clínicos.
4b2. Radioterapia estereotáxica.
La radioterapia estereotáxica emplea radiomarcadores implantados en el tejido tumoral para dirigir de forma precisa altas dosis de radiación y minimizar el daño sobre el tejido sano circundante.
Los marcadores son implantados a través de cirugía o de forma percutánea guiados por TC.
El USE ofrece la posibilidad teórica de implantar radiomarcadores en tumores del tubo digestivo u órganos vecinos. Varios trabajos, que incluyen globalmente a un total de 170 pacientes, demostraron su utilidad logrando el implante en el 85% a 100% de los casos.98-103
Dos de estos trabajos emplearon una aguja de 22G100,102 en lugar de agujas de 19G; su mayor flexibilidad permite la progresión a través del canal de trabajo sin resistencia, incluso con angulaciones marcadas del endoscopio, inconveniente mencionado en estudios previos con agujas de mayor calibre.
El único estudio prospectivo que evalúa la eficacia del tratamiento tras la colocación de implantes guiados por USE,104 obtuvo respuesta clínica en cuatro de los nueve pacientes incluidos (45%); tres de ellos presentaban márgenes quirúrgicos positivos y se mantuvieron en remisión completa y en el cuarto se logró la disminución del tamaño tumoral.
Por su excelente visualización, la implantación de radiomarcadores guiada por USE podría ser más precisa y más segura que con el uso de TAC o ultrasonido (US) como métodos de imagen. En lesiones pequeñas, difíciles de localizar por TAC/US o de difícil acceso por la interposición de estructuras vasculares, la implantación guiada por USE podría ser el único método mínimamente invasivo eficaz.105
5. Técnicas de acceso vascular guiadas por ecoendoscopia
La mayor parte de los grandes vasos toracoabdominales es fácilmente identificable a través de un USE convencional y su abordaje con una aguja de aspiración introducida por el canal de trabajo del ecoendosocopio lineal es relativamente sencillo, por lo que se plantea la utilidad del USE como técnica de intervención vascular con fines diagnósticos y terapéuticos.106
Inicialmente el USE se evaluó como adyuvante en el tratamiento endoscópico de varices gástricas y esofágicas,107-111 mostrando que la punción directa de grandes vasos guiada por USE puede llevarse a cabo de forma efectiva y segura.
En un estudio en modelos animales, Magno y colaboradores112 realizaron una angiografía selectiva con constraste yodado tras acceder a la aorta torácica y abdominal, el tronco celíaco, las arterias esplénica y mesentérica superior y las venas porta, esplénica y hepática, mediante punción directa guiada por USE. La visualización de los vasos de menor calibre (tronco celíaco, arteria esplénica y venas hepáticas) fue adecuada, no así la de los grandes vasos, debido a su elevado flujo sanguíneo que provoca un rápido lavado del contraste. El estudio postmortem demostró ausencia de daño vascular con las agujas de menor calibre (22 y 25G).
En un trabajo posterior, el mismo grupo113 empleó CO2 como medio de constraste tras la punción transhepática de la porta con agujas de 25G, consiguiendo una visualización completa del árbol portal. El examen postmortem reveló ausencia de daño hepático o vascular. El acceso transhepático parece ofrecer menor riesgo de sangrado por la compresión del parénquima hepático sobre el sitio de punción.114
El acceso guiado a la porta ofrece la posibilidad de realizar intervenciones sobre el árbol portal como la medición directa de presiones portales114-117 o la embolización portal.118
Otra de las potenciales aplicaciones es la implantación de shunts portosistémicos (TIPS) bajo control ecoendoscópico. Un trabajo reciente119 con modelos animales in vivo, ha logrado su realización con éxito y sin complicaciones, empleando una prótesis biliar metálica recubierta para la comunicación entre la porta y una de las venas hepáticas.
El desarrollo de éstas y otras posibles aplicaciones del acceso vascular guiado por USE, dependerá de la seguridad que muestre la técnica en futuros ensayos clínicos118 y de la resolución de algunos de los interrogantes planteados, como el asegurar el acceso en un medio estéril, definir la relevancia clínica del aparente daño observado en la pared de los vasos de mayor calibre y establecer las ventajas que el USE ofrece con respecto a las técnicas percutáneas no invasivas empleadas actualmente en la práctica clínica.120
6. Técnicas de ablación guiada por USE
La ablación focal de lesiones neoplásicas mediante sondas que liberan energía de forma controlada, ha sido empleada en el tratamiento de tumores cerebrales y hepáticos, utilizando para el acceso a la lesión diversas técnicas de imagen, como TAC, resonancia magnética (RM) o US.
El USE permitiría el acceso a lesiones inaccesibles con los métodos mencionados, aunque su empleo en tumores sólidos se encuentra en fase de investigación y los trabajos disponibles se han llevado a cabo únicamente en modelos animales.121
¿ Radiofrecuencia
La radiofrecuencia (RFA) libera energía térmica (50-100°C) que conduce a deshidratación celular y a coagulación proteica con la consiguiente necrosis del tejido.121,122 Para su aplicación guiada por USE se emplea una aguja convencional modificada con una sonda en su extremo distal.122,123 Se han publicado estudios en modelos animales sobre tejido pancreático124 y más recientemente sobre hígado sano con una nueva aguja retráctil en forma de paraguas que logra el tratamiento de mayor superficie de tejido y minimiza los efectos secundarios.125 En otros dos trabajos en tejido de bazo, hígado y páncreas, se han empleado sondas que combinan radiofrecuencia y crioterapia,126,127 lo que potencialmente incrementa su eficacia disminuyendo los efectos adversos.
¿ Tearapia fotodinámica
Ésta es una modalidad terapéutica prometedora. Se basa en la administración endovenosa de un fármaco fotosensibilizador, habitualmente porfímero de sodio o verteporfin, que se acumula de forma selectiva en las células tumorales. Por medio de una sonda luminosa colocada en la lesión a través de una aguja convencional guiada por USE,123 se induce necrosis tumoral. En modelos animales128,129 ha demostrado su eficacia en lesiones de hasta 3 cm.
¿ Láser
La ablación con láser por medio de una fuente de Nd:YAG (neodimio:itrio-aluminio) se ha empleado en el tratamiento de tumores de tiroides, metástasis hepáticas y carcinoma hepatocelular; su ventaja sobre otros métodos ablativos es la precisión con la que induce la necrosis en el tejido diana. Sólo puede emplearse en lesiones pequeñas ya que la necrosis se limita a unos 15 mm.121 Un estudio en modelos animales demuestra la posibilidad de colocar una sonda láser guiada por USE en tejido pancreático.130
7. Procedimientos quirúrgicos guiados por USE
El desarrollo de la cirugía por orificios naturales (NOTES) ha venido acompañado por el diseño de nuevos instrumentos que han permitido el desarrollo de técnicas de endocirugía guiadas por USE.6,7
Se han publicado trabajos en modelos animales que muestran la posibilidad de realizar técnicas de sutura,131,132 anastomosis y trasposición de tejidos,133,134 cirugía antirreflujo135 y linfadenectomía136 guiadas por USE.
¿ Conclusiones
El USE ha experimentado un importante crecimiento en las últimas tres décadas; el número de endoscopistas formados es cada vez mayor y la técnica se ha hecho indispensable en los servicios de gastroenterología.
Se han desarrollado nuevos ecoendoscopios y accesorios, lo que ha favorecido el creciente número de indicaciones hasta convertirse en una herramienta eminentemente terapéutica que cuenta con gran número de estudios experimentales en curso.137
Pese a ello, la ausencia de estudios comparativos y la heterogeneidad de los disponibles, hacen que no exista la suficiente evidencia científica que apoye su eficacia y seguridad en las nuevas indicaciones.137 Tras haberse publicado numerosas series de casos que evidencian su aplicabilidad en diferentes indicaciones, se hace necesario el diseño de estudios controlados y aleatorizados que demuestren sus ventajas sobre las técnicas consideradas de elección.
Correspondencia: 5758 S. Maryland Avenue, MC 9028 Chicago, IL 60637