Introducción
La enfermedad celíaca (EC) es una entidad de diagnóstico elusivo.1 Aunque la prevalencia de la enfermedad se estima entre 0.5% - 1.0% según estudios serológicos, el número de pacientes con EC identificados es muy reducido.2 Una fracción nada despreciable de sujetos con EC se diagnostica en la adultez, en ocasión de estudios de salud prenupciales o laborales, donaciones de sangre, ingresos hospitalarios, durante la conducción de procesos de diagnóstico diferencial de otras entidades clínicas o incluso después de intervenciones quirúrgicas.3-9
La forma de presentación de la EC ha cambiado drásticamente en los últimos años. Se ha informado un incremento de las formas oligo-sintomáticas e incluso de las presentaciones atípicas de esta enfermedad.10-12 También se ha reconocido la estrecha relación entre la EC y las enfermedades autoinmunes y endocrinas.13-15
Debido a que la EC es una entidad cuyo tratamiento se basa en la retirada del gluten de la dieta regular del enfermo, se ha avanzado en la búsqueda activa de nuevos casos entre los distintos reservorios de la enfermedad.16-18 Los trastornos nutricionales pueden afectar a la mitad de los pacientes con EC.19 La frecuencia de desnutrición puede variar según la etapa de progresión clínica de la enfermedad.19-21 Sería natural suponer que la desnutrición asociada a trastornos gastrointestinales de etiología no aclarada exhaustivamente, pudiera ser otro reservorio de la EC. Si esta hipótesis resultara ser cierta, no sólo se podría alcanzar un diagnóstico integral sino, además, la curación del enfermo mediante la intervención dietético-nutricional oportuna.
El objetivo de este trabajo es presentar el proceso de diagnóstico implementado en dos instituciones de nivel terciario de la ciudad de La Habana, Cuba. Este proceso utiliza un sistema de puntaje que integra y pondera los resultados de los diferentes procedimientos diagnósticos conducidos en los sujetos con probable EC.
Material y métodos
Proceso de atención al paciente
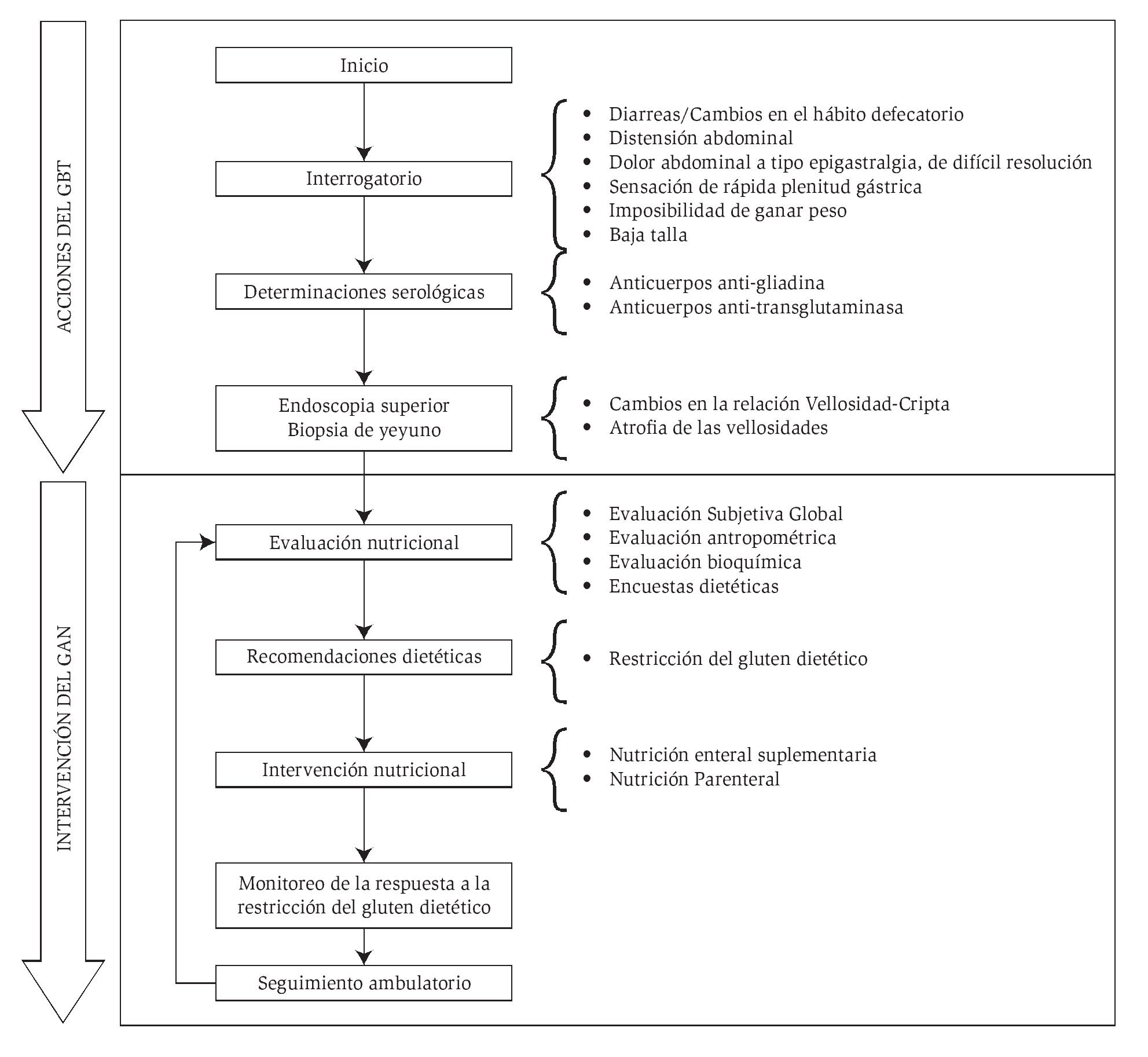
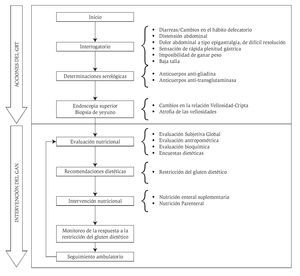
El proceso comprende acciones diagnósticas e integra los esfuerzos del Grupo Básico de Trabajo (GBT) que recibe al enfermo y se ocupa del seguimiento ambulatorio con la de otros servicios encargados de la conducción de los procedimientos de diagnóstico. También comprende las acciones del Grupo de Apoyo Nutricional (GAN) que se ocupa de la evaluación nutricional, la intervención dietoterapéutica, la implementación de otras formas de repleción nutrimental y el monitoreo de la respuesta del enfermo como se ha expuesto previamente.22-23 La Figura 1 presenta el proceso descrito en este artículo.
Figura 1. Algoritmo empleado en el diagnóstico y monitoreo de los pacientes celíacos22-31
El proceso se aplicó a sujetos en los que el deterioro nutricional concurría con diarreas, distensión abdominal dolorosa, digestiones lentas u otro trastorno gastrointestinal refractario al tratamiento prescrito, a aquellos con imposibilidad para ganar peso y con "síndrome de mala absorción intestinal". Se han hecho provisiones en el proceso para la identificación de manifestaciones atípicas de la EC, como la anemia refractaria al tratamiento convencional y enfermedades autoinmunes especificadas.10-12
La intervención micronutrimental contempló la prescripción de ácido fólico (30 mg/día), sulfato de zinc (1 mg/día) o cuplementos de complejo B (1-2 tabletas diarias de Polivit®, IMEFA -Industria Médico-Farmacéutica de Cuba-). La composición de la tableta de Polivit® incluye tiamina 2.5 mg, riboflavina 1.6 mg, nicotinamida 20 mg, ácido fólico 250 mg, cianocobalamina 6 mg, piridoxina 2 mg y vitamina A 2 500 UI.
En los esquemas de nutrición enteral se emplearon indistintamente dietas poliméricas genéricas sin fibra (Nutrial®, Instituto de Investigaciones de la Industria Alimentaria, La Habana, Cuba), dietas poliméricas hiperproteicas sin fibra (ADN HN®, B|BRAUN, Santiago de Chile, Chile) o dietas semi-digeridas sin fibra (Peptamen®, Laboratorios Abbott, EUA).
Para los esquemas de nutrición parenteral se utilizaron las soluciones de dextrosa al 10% (IMEFA Industria Médico-Farmacéutica de Cuba) para aportar entre 680-1 700 Kcal/día, soluciones de aminoácidos (Aminoplasmal® 10%, B|BRAUN, Alemania) y soluciones de lípidos (Lipofundin® 10%, B|BRAUN, Alemania).
La ganancia de peso se monitoreó a corto (entre 30-45 días de instaladas las medidas de repleción nutricional) y mediano plazo (entre 6-12 meses).
El proceso se implementó simultáneamente en el Hospital Clínico Quirúrgico "Hermanos Ameijeiras" y el Instituto de Gastroenterología, pertenecientes al Sistema Nacional de Salud del Ministerio de Salud Pública.
Registro, documentación y análisis de los datos
Los datos recolectados se almacenaron en un único contenedor digital creado en Access 7.0 de Office sobre Windows XP de Microsoft (Redmond, Virginia; Estados Unidos), como se ha descrito previamente.24,25
Sistema para el diagnóstico de la enfermedad celíaca
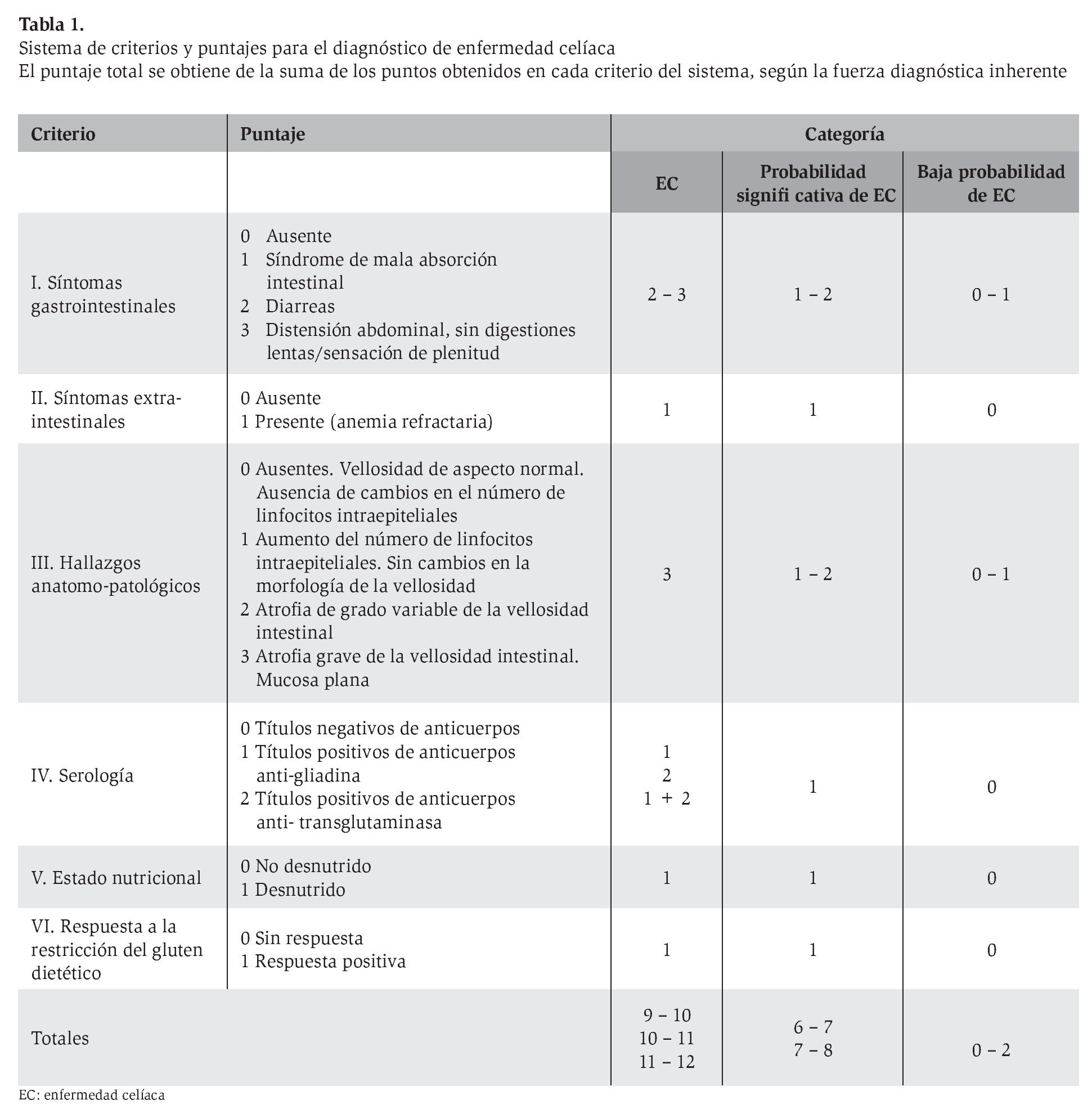
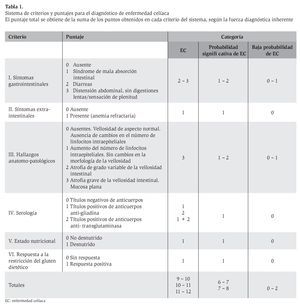
Los resultados del proceso descrito se integraron en un sistema de puntaje creado ad hoc (Tabla 1). El sistema comprende 17 posibles niveles de respuesta del paciente distribuidos entre 6 criterios diagnósticos. El criterio puede ser binario (ausente/presente) o categórico. Se le asignaron puntos a cada nivel según la fuerza diagnóstica inherente y en correspondencia con la literatura consultada. Los títulos positivos de anticuerpos anti-transglutaminasa recibieron un puntaje superior en el punto IV26,27 La atrofia de vellosidades también recibió un puntaje máximo en el punto III.11,28
De acuerdo a este sistema, el paciente puede ser asignado a cualquiera de los 3 diagnósticos posibles: EC (puntajes entre 9 a 12), probabilidad significativa de EC (puntajes de 6 a 8) y baja probabilidad de EC (puntajes entre 0 a 2 ) (Tabla 1).
Análisis estadístico
Los datos se agregaron según la característica de interés y se describieron mediante estadígrafos de localización (media/mediana), dispersión (porcentajes). Cuando fuera de interés del equipo investigador, se evaluó la existencia de diferencias significativas entre subgrupos de pacientes mediante pruebas estadísticas apropiadas.29 En estos casos, se utilizó un nivel de significación del 5%.29
Resultados
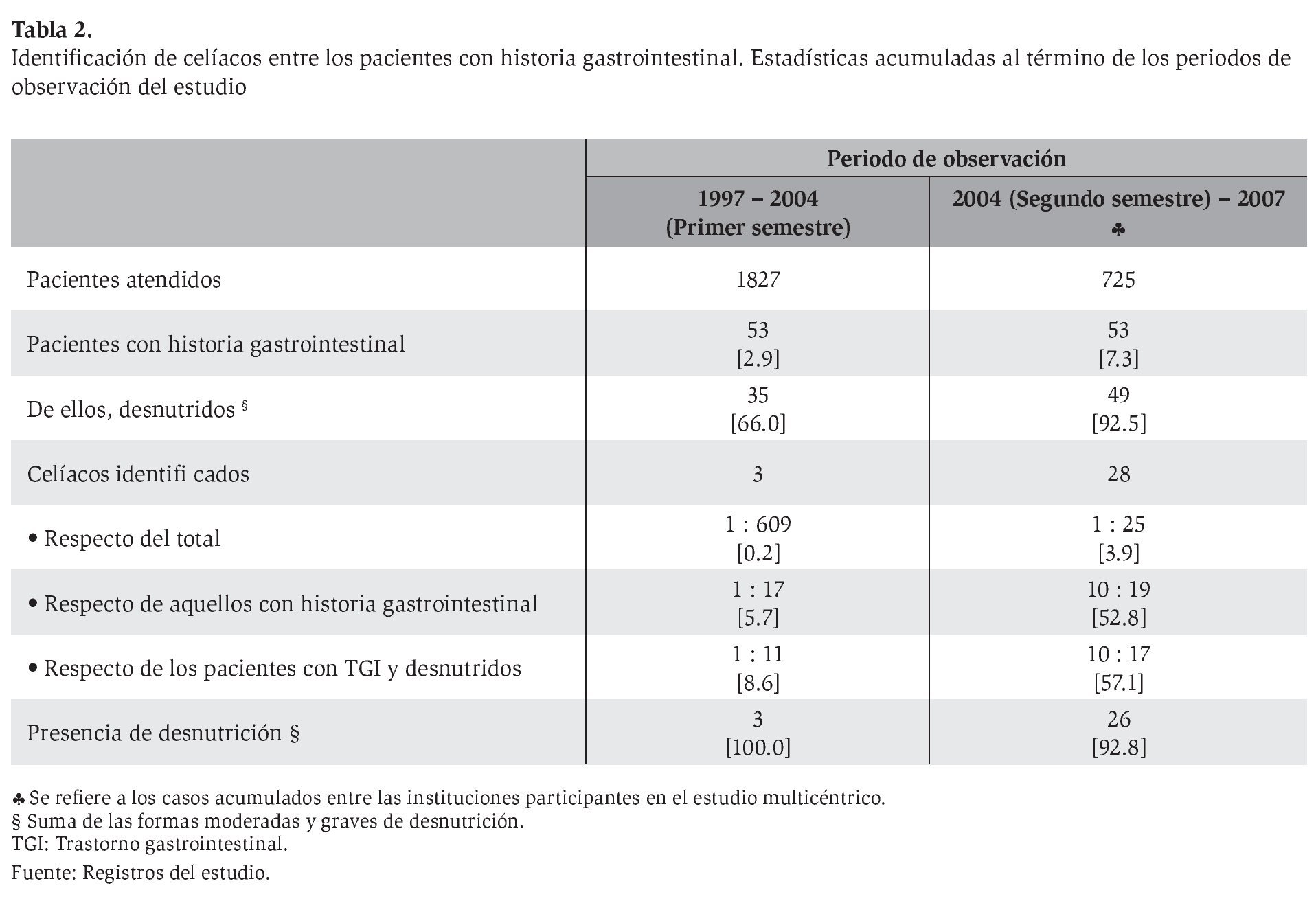
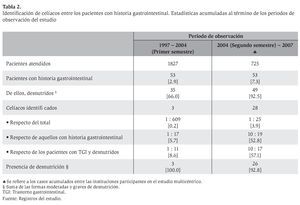
Se identifi caron 28 pacientes con EC de entre los 728 enfermos atendidos durante el estudio (Tabla 2). El 92.8% de los pacientes identificados con EC estaban desnutridos al momento del diagnóstico. Las mujeres constituyeron el 75.0% de la serie. Los blancos representaron el 82.1%. La edad promedio fue de 38.9 ± 13.7 años y 96.4% de los pacientes tenía menos de 60 años de edad.
Como síntoma predominante, 60.7% de los enfermos refirió diarrea. Distensión abdominal, dispepsias, dolor en epigastrio y otras formas de dolor abdominal fueron referidos por la tercera parte de los enfermos. La cuarta parte de los pacientes manifestó imposibilidad de ganar de peso. La anemia estaba presente en la décima parte de los sujetos. Uno de los pacientes se presentó con osteoporosis grave. La artritis reumatoide, la tiroiditis de Hashimoto, la colitis ulcerosa y la epilepsia se contaron entre los diagnósticos concurrentes entre los pacientes con EC. En una paciente concurrieron los diagnósticos de EC, tiroiditis de Hashimoto y artritis reumatoide.
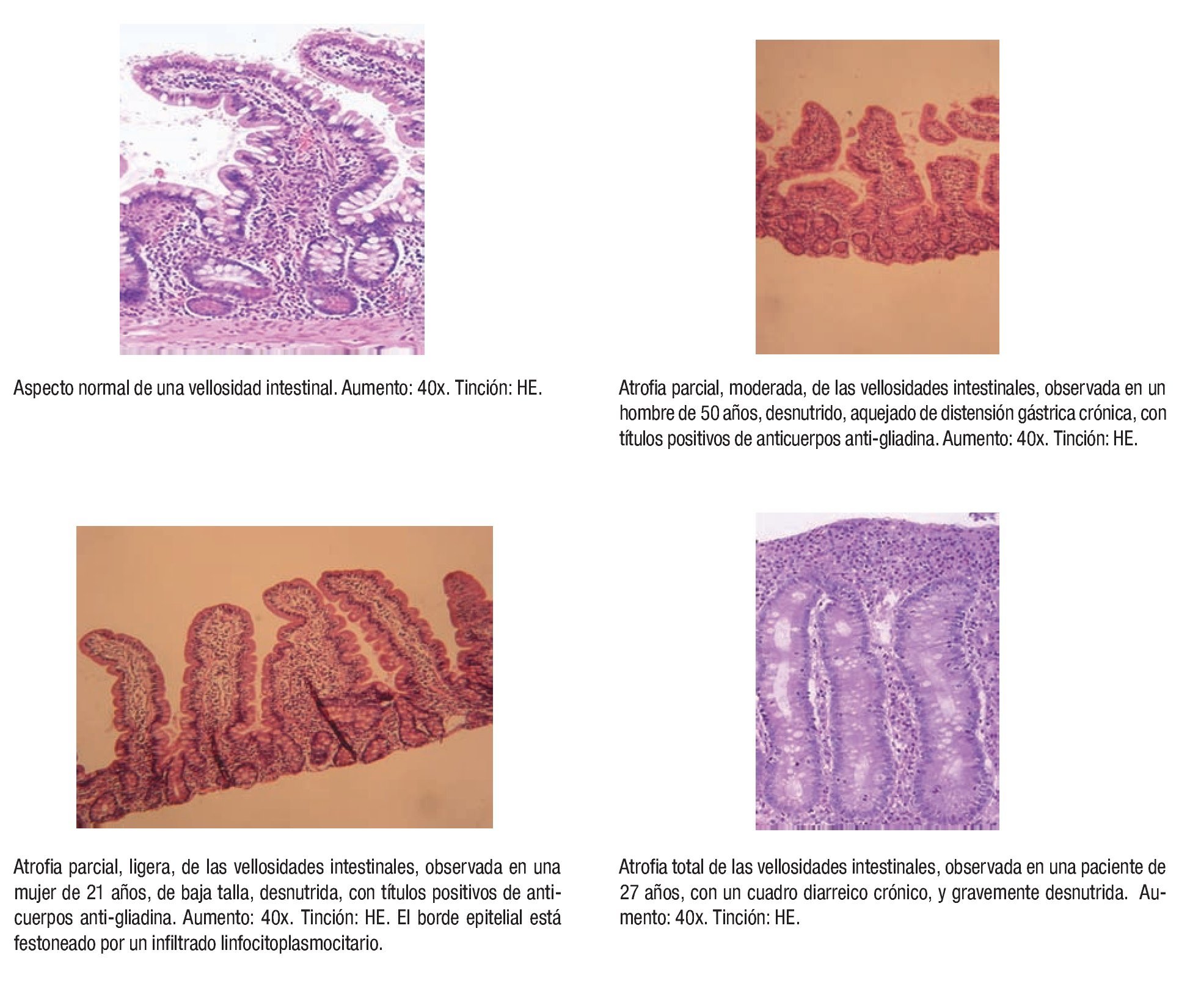
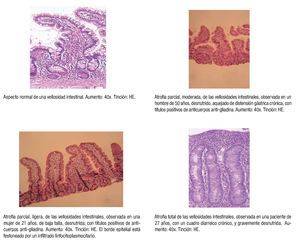
Se realizó biopsia yeyunal al 100% de los pacientes atendidos. La distribución de los cambios en la mucosa yeyunal fue irregular: No se observaron cambios en la morfología vellositaria en 7.1%, se observó atrofia vellositaria entre leve y moderada en 64.3% y, atrofia total en 28.6% (Figura 2).
Figura 2. Cambios histopatológicos observados en la mucosa de pacientes seleccionados de la presente serie de estudio.
Se determinaron anticuerpos anti-gliadina al 89.3% de los pacientes atendidos y los anticuerpos anti-transglutaminasa a 39.3%. Entre los sujetos con EC los anticuerpos antigliadina fueron positivos en 72.0% y los anti-transglutaminasa en 54.5%. Los resultados de ambos anticuerpos concordaron en un 54.5% (X2 = 0.020; p > 0.05). La positividad de los títulos de ambos anticuerpos fue independiente de la morfología vellositaria.
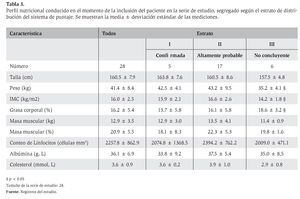
El puntaje global obtenido mediante el sistema presentado en este artículo fue de 6.6 ± 1.7. La distribución de los pacientes según los estratos del sistema de puntaje fue como sigue: EC confirmada 5 (17.9%) con puntaje: 9.2 ± 0.4; EC probable 17 (60.7%) con puntaje: 6.6 ± 1.1; y no concluyente 6 (32.1%) con puntaje: 4.7 ± 0.5.
No se observaron diferencias en el índice de masa corporal (IMC) de acuerdo al género (hombres: 16.2 ± 2.5 Kg/m2vs. mujeres: 15.7 ± 2.3 Kg/m2; p > 0.05). El 82.1% de los enfermos tenía valores del IMC menores de 18.5 Kg/m2.
El compartimiento graso corporal representó, en promedio el 16.2 ± 5.4% del peso de los enfermos y dependió del sexo del paciente (p < 0.05; prueba de comparación de medias independientes). El compartimiento muscular esquelético significó el 20.9 ± 5.5% del peso corporal de los enfermos No se comprobaron diferencias respecto del sexo (datos no mostrados).
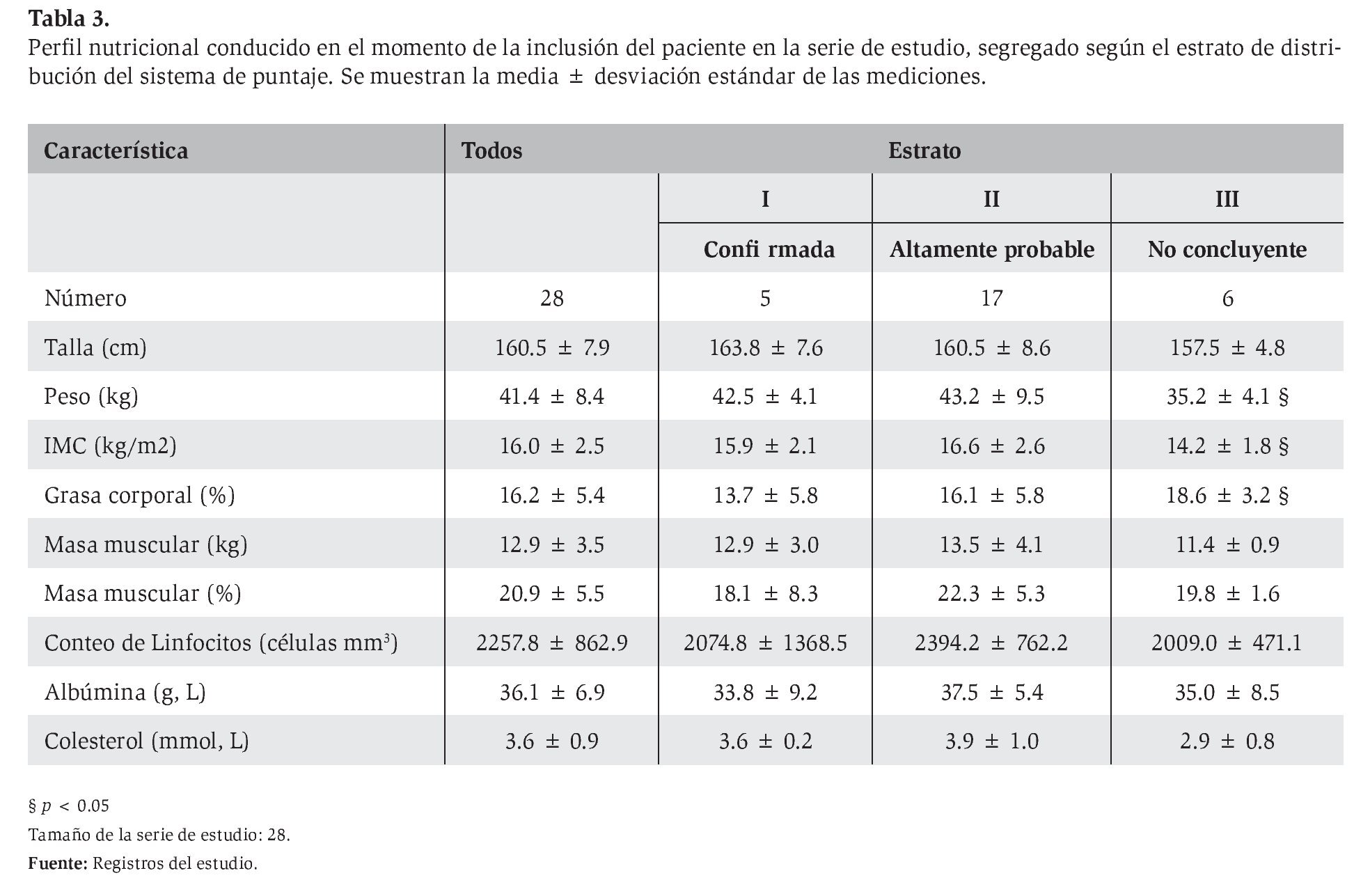
Los valores promedio de las variables bioquímicas de interés nutricional no difirieron con respecto a los puntos de corte establecidos: albúmina sérica 3.6 ± 0.7 vs. MG D, p > 0.05); colesterol sérico 139.2 ± vs. 135.0 (p > 0.05); y, cuenta total de linfocitos 2,257.8 ± 863.0 vs. 1,800.0 células/mm3 (p > 0.05; prueba de comparación para una media poblacional conocida). No se comprobaron diferencias en los valores promedio de las variables bioquímicas respecto del sexo (datos no mostrados). La proporción de valores anómalos de las variables bioquímicas nutricionales fue como sigue: albúmina sérica < 3.5 mg/dL en 25.0%, colesterol sérico < 135.0 mg/dL en 43.5% y cuenta total de linfocitos < 1,800 células/mm3 en 26.1%. El peso, el IMC y la grasa corporal fueron los únicos indicadores dentro del perfil nutricional que se asociaron con el estrato del sistema de puntuación (Tabla 3).
Se condujeron 84 intervenciones, a razón de 3 acciones por cada paciente. Las intervenciones se distribuyeron como sigue: dietoterapia en 33.0%, vitaminoterapia oral en 44.0%, vitaminoterapia parenteral en 2.4%, nutrición enteral suplementaria en 20.2% y nutrición parenteral en 7.1%.
La restricción del gluten dietético se instaló tan pronto el paciente se identificó como celíaco, y se acompañó de aportes independientes de ácido fólico (30 mg/24 horas distribuidos equitativamente entre las 3 comidas principales del día) en el 92.3% de los enfermos incluidos en la presente serie. En el 39.3% de los pacientes se prescribieron también suplementos adicionales de complejo B, a razón de 1-2 tabletas diarias de Polivit®. Fue necesaria la repleción vitamínica parenteral en el 7.1% de los enfermos, ante la gravedad de los hallazgos histopatológicos en la mucosa yeyunal, y/o la presencia de signos clínicos de carencias micronutrimentales como polineuropatía periférica.
En el 57.1% de los enfermos se instaló un esquema de nutrición enteral suplementaria, con dietas poliméricas hiperprotéicas sin fibra, a fin de paliar el deterioro nutricional presente.
En el 21.4% de los pacientes se implementó un esquema de nutrición parenteral con el propósito de sostener un estado nutricional gravemente afectado. Estos esquemas se administraron tanto por vía central (33.3%) como periférica (66.7%). La duración promedio de los esquemas de nutrición parenteral fue de 13.0 ± 6.7 días. En 4 pacientes (66.7%) de este subgrupo de enfermos se administraron soluciones de lípidos en días alternos a razón de 500 mL diarios.
De 27 pacientes elegibles, se pudieron registrar los cambios a corto plazo en el peso en 21 (77.8%). El tiempo de seguimiento de estos pacientes fue de 33.7 ± 32.6 días (rango: 7 a 69). La ganancia de peso fue de 0.4 ± 0.1 Kg con un cambio estadísticamente significativo (p < 0.05; prueba de comparación para una media poblacional conocida). Los cambios a largo plazo en el peso sólo pudieron ser anotados en 13 [61.9%] y en ellos la ganancia de peso fue de 0.7 ± 0.9 Kg (valor estadísticamente significativo, p < 0.05; prueba de comparación para una media poblacional conocida). La ganancia de peso se observó en 321 ± 314 días de seguimiento (rango: 39-795).
Discusión
El proceso de atención descrito en este artículo ha servido para identificar a 28 pacientes con enfermedad celíaca de entre aquellos enfermos atendidos por trastornos gastrointestinales de presentación clínica similar. El diagnóstico de EC se confirmó en 5 de éstos y fue altamente probable en otros 17. Estos resultados demuestran las ventajas del análisis integral y de la información recaudada mediante diferentes procedimientos diagnósticos, superando estereotipos que han retrasado (e incluso obscurecido) el diagnóstico y el tratamiento de esta entidad [30]. Si bien la EC debería incluirse dentro del diagnóstico diferencial de un enfermo con diarreas crónicas,10-12 el médico de asistencia
debe estar alerta también ante la distensión abdominal, acompañada muchas veces de sensación de rápida plenitud y dolor que puede afectar a la tercera parte de los pacientes.
Apenas la tercera parte de los pacientes del presente estudio mostró atrofia total de las vellosidades. En contraste, muchos enfermos pueden ser ignorados como celíacos por presentar cambios en la relación vellosidad-cripta sin llegar a la atrofia total.11,28,31 Los cambios en la mucosa intestinal representan en realidad un continuum, desde las formas leves de daño a la mucosa como el infiltrado linfoplasmocitario del borde epitelial y la lámina propia, junto con aparente conservación de la forma y tamaño de la vellosidad, hasta la atrofia que sería la forma más grave y última de deterioro.28
Los anticuerpos anti-gliadina han sido criticados por la aparente insensibilidad en el diagnóstico de la EC.31-33 El 72.0% de positividad observada en la presente serie de estudio coincide con los informes previos.34 La falla de la sensibilidad de la titulación de los anticuerpos anti-gliadina pudiera deberse a deficiencia de Ig A26 o infección parasitaria concomitante.35 La frecuencia de giardiasis en la serie de estudio fue del 7.1%.
La concordancia entre las determinaciones de anticuerpos anti-gliadina y anti-transglutaminasa fue baja. La positividad de los anticuerpos anti-transglutaminasa fue apenas superior a la mitad más uno. Es probable que el desempeño de esta determinación se haya afectado por la retirada del gluten dietético, como pudo ocurrir en aquellos pacientes en los que no se demostraron títulos de tales anticuerpos. La exposición del sujeto a un reto con gluten dietético, seguido de la re-titulación de los anticuerpos, serviría para mejorar las características operacionales de tan importante determinación.
La relativa preservación de los valores séricos de albúmina y colesterol observada en este estudio, fue similar a lo anotado previamente por otros investigadores.36 Se han informado cifras disminuidas de albúmina sérica entre enfermos celíacos conocidos, pero este hallazgo podría reflejar otros epifenómenos y no exactamente el deterioro nutricional causado por la enfermedad o una incontrolada restricción dietética.37
Se debe insistir que el tratamiento de la EC es eminentemente dietético, como forma de asegurar la remisión de los síntomas de la enfermedad, la recuperación de la estructura y función intestinales y la restauración del bienestar nutricional.38 La intervención dietética debe ir acompañada de la administración de suplementos vitamínicos orientada a corregir las carencias, reponer los depósitos corporales y favorecer la rehabilitación de la mucosa intestinal agredida. El consumo oral de ácido fólico y vitaminas del complejo B, junto con suplementos de zinc, constituye una práctica terapéutica establecida de la actuación de los autores del presente trabajo.
El deterioro nutricional observado en estos pacientes puede obligar a intervenciones nutricionales drásticas mediante esquemas de nutrición artificial (enteral/parental), para satisfacer necesidades nutrimentales del paciente en los periodos iniciales de la intervención nutricional, mientras se reacomoda la indicación dietética; ante el riesgo de que la dieta prescrita no sea capaz de cubrir las necesidades del celíaco; y la persistencia de la sintomatología propia de la enfermedad, que impediría satisfacer las necesidades nutrimentales por vía oral. La administración de regímenes de nutrición artificial no está exenta de riesgos. El síndrome de realimentación debe anticiparse como una complicación potencialmente letal de los esquemas de repleción nutricional en el paciente con EC con signos extremos de desnutrición.39
Los equipos básicos de trabajo deberían documentar la respuesta del paciente a la retirada temporal del gluten dietético. La remisión de los síntomas digestivos (unida a la recuperación del estado nutricional) tan pronto se proscribe el consumo de trigo, centeno, cebada y avena, y el regreso de los mismos una vez que se reta al enfermo con pequeñas cantidades de estos cereales, sirve para establecer definitivamente el diagnóstico de la enfermedad.40
En el presente trabajo llamó la atención que los cambios a largo plazo en el peso corporal (tenido como indicador de mejoría clínica y respuesta a la restricción del gluten dietético), sólo pudieron registrarse en menos de la mitad de los celíacos identificados. La ganancia de peso observada al cabo de casi un año de observación de este subgrupo de enfermos fue de 700 g, a todas luces insuficiente. La recuperación del peso, y la mejoría sintomática, exigen del celíaco y sus familiares una adherencia férrea a la prescripción dietética, y la atención sistemática por el equipo básico de trabajo. Lamentablemente, muchos investigadores se quejan de las bajas tasas de obediencia de la restricción del gluten dietético y del poco impacto de las medidas dietéticas sobre los indicadores de respuesta al tratamiento.41 Debe hacerse notar también que la falla de un paciente con EC en responder a los tratamientos dietéticos y de repleción nutricional instalados pueden apuntar hacia formas graves de la celiaquía, cuya resolución demandaría esfuerzos diagnósticos y terapéuticos adicionales.42-45 Se abre así una segunda etapa en el proceso de implementación del sistema de diagnóstico de la celiaquía expuesto en este trabajo.
El presente artículo continúa y expande otro precedente sobre el estado nutricional y antropométrico de adolescentes celíacos.46 Sin embargo, el trabajo presente se distingue de aquel en que pretende llamar la atención a los involucrados en la práctica nutricional sobre la frecuente asociación entre desnutrición y EC en los adultos atendidos por trastornos gastrointestinales no bien caracterizados. Los grupos de trabajo deberían documentar la remisión de los síntomas ante la retirada del gluten dietético y la respuesta del enfermo a la reintroducción del mismo, como forma de establecer definitivamente el diagnóstico de EC si los exámenes complementarios son ambiguos o no conclusivos. Por extensión, los grupos de trabajo deberían motivar a los celíacos identificados a mantener una adherencia a la prescripción dietética, y asistir regularmente a los encuentros concertados para evaluar la respuesta a largo plazo al tratamiento instalado.
Conclusión
El sistema de puntaje presentado en este estudio pudiera ser útil en el diagnóstico y tratamiento de la EC como parte del proceso de atención al enfermo. Otros puntos se pueden incorporar en versiones futuras como la determinación de los HLA-haplotipos DQ2/DQ8.47
Agradecimientos
Dr. Pedro Velbes Marquetti. Servicio de Gastroenterologia. Hospital Clínico quirúrgico "Hermanos Ameijeiras".
Dr. Jesús Barreto Penié, Lic. Carmen Martínez González, Lic. Alicia Espinosa Borrás. Grupo de Apoyo Nutricional. Hospital Clínico quirúrgico "Hermanos Ameijeiras".
Dr. Carlos Domínguez Alvarez. Departamento de Anatomía Patológica. Hospital Clínico quirúrgico "Hermanos Ameijeiras".
Téc. Norma Turcas. Laboratorio del Departamento de Inmunología. Instituto de Gastroenterología.
Dr. Héctor Vega Sánchez. Jefe del Departamento de Inmunología. Instituto de Gastroenterología.
Dr. José Armando Galván. CIB Centro de Investigaciones Biológicas. La Habana.
Dra. Adelaida Rodríguez de Miranda. Departamento de Nutrición. Instituto de Gastroenterología.
Dr. Bienvenido Grá Oramas, Téc. Luisa Tamayo García. Departamento de Anatomía Patológica. Instituto de Gastroenterología.
Dr. Juan Carlos Gómez. Unidad de Soporte Nutricional y Enfermedades Malabsortivas. Hospital General Interzonal de Adultos "General José de San Martín". La Plata, República Argentina.
* Presentado en parte como Tema en Cartel en el Programa científico del I Simposio Latinoamericano de Enfermedad Celíaca, celebrado en la ciudad de Buenos Aires, República Argentina, entre los días 28 - 30 de Junio del 2007
Correspondencia: Dr. Sergio Santana Porbén.
Correo electrónico:ssergito@infomed.sld.cu
Fecha recibido: 3 noviembre 2008 Fecha aprobado: 21 junio 2009