Existen pocos estudios comparativos entre polietilenglicol (PEG) 3350 e hidróxido de magnesio (HM) para tratar el estreñimiento funcional (EF) a largo plazo en niños, y no incluyen lactantes desde 6meses. El objetivo fue determinar la eficacia, la seguridad y la aceptabilidad de PEG vs HM en el EF a largo plazo en pacientes pediátricos.
MétodosEnsayo clínico controlado, paralelo, abierto, en pacientes de 6meses a 18años con diagnóstico de EF asignados aleatoriamente a PEG3350 o HM durante 12meses. Se definió éxito: ≥3 evacuaciones/semana, sin incontinencia fecal, impactación fecal, dolor abdominal o necesidad de otro laxante. Se compararon eventos adversos, así como la aceptabilidad, medida como dosis rechazadas del laxante durante el estudio en cada grupo y subgrupo.
ResultadosSe incluyeron 83 pacientes con EF, sin que presentaran diferencias en éxito entre ambos grupos (40/41PEG vs 40/42HM, p=0.616). No hubo diferencias en aceptabilidad entre ambos grupos, pero un número significativamente mayor de pacientes rechazó la leche de magnesia en los subgrupos de >4 a 12años y de >12 a 18años (p=0.037 y p=0.020, respectivamente). No hubo diferencias de eventos adversos entre ambos grupos y no se registraron eventos adversos clínicos ni bioquímicos graves.
ConclusionesAmbos laxantes fueron igualmente efectivos y seguros para tratar el EF en niños de 0.5 a 18años. El PEG3350 fue mejor aceptado que el HM por los pacientes mayores de 4años. El HM puede ser considerado como tratamiento de primera línea para EF en niños menores de 4años.
There are few studies that compare polyethylene glycol (PEG) 3350 and magnesium hydroxide (MH), as long-term treatment of functional constipation (FC) in children, and they do not include infants as young as 6months of age. Our aim was to determine the efficacy, safety, and acceptability of PEG vs MH in FC, in the long term, in pediatric patients.
MethodsAn open-label, parallel, controlled clinical trial was conducted on patients from 6months to 18years of age, diagnosed with FC, that were randomly assigned to receive PEG3350 or MH for 12months. Success was defined as: ≥3 bowel movements/week, with no fecal incontinence, fecal impaction, abdominal pain, or the need for another laxative. We compared adverse events and acceptability, measured as rejected doses of the laxative during the study, in each group and subgroup.
ResultsEighty-three patients with FC were included. There were no differences in success between groups (40/41PEG vs 40/42MH, p=0.616). There were no differences in acceptability between groups, but a statistically significant higher number of patients rejected MH in the subgroups >4 to 12years and >12 to 18years of age (P=.037 and P=.020, respectively). There were no differences regarding adverse events between the two groups and no severe clinical or biochemical adverse events were registered.
ConclusionsThe two laxatives were equally effective and safe for treating FC in children from 0.5 to 18years of age. Acceptance was better for PEG3350 than for MH in patients above 4years of age. MH can be considered first-line treatment for FC in children under 4years of age.
El estreñimiento es un problema común en la población pediátrica. Se estima que representa el 3% de la consulta del pediatra y el 25% de la consulta del gastroenterólogo pediatra1,2. Los niños pueden presentarlo desde etapas tempranas de la vida, con una prevalencia del 2.9% en el primer año de vida y del 10.1% en el segundo año3. Existen muchos desórdenes que pueden causar estreñimiento en los niños; sin embargo, el estreñimiento funcional (EF) representa el 97% de los casos3. Con mucho menor frecuencia es el resultado de afecciones sistémicas o de alteraciones anatómicas, que pueden ser excluidas mediante una evaluación clínica completa y minuciosa. Si bien el 25% de los casos de EF mejoran con medidas simples como educación familiar y cambios en los hábitos dietéticos, al combinar la dieta con los laxantes se obtiene una respuesta favorable en el 95% de los pacientes3. Los laxantes osmóticos son los recomendados, como primera línea, para tratar el EF en niños4.
El hidróxido de magnesio (HM), mejor conocido como leche de magnesia, es un laxante osmótico, muy utilizado en nuestro medio por ser accesible y económico, que disminuye el tiempo de tránsito colónico y aumenta la osmolaridad. Sus efectos secundarios cobran gran importancia en pacientes con insuficiencia renal, ya que incrementan el riesgo de hipermagnesemia, hipofosfatemia o hipocalcemia; otros de sus efectos colaterales son deshidratación, incontinencia y cólicos abdominales. Su pobre palatabilidad hace que muchos niños rehúsen tomarla por periodos prolongados5,6.
El polietilenglicol (PEG) es un polímero químicamente inerte en forma de polvo. Es insípido, inodoro e incoloro y puede mezclarse en jugo, agua sola o con saborizantes artificiales e incluso fórmulas lácteas7. No es degradado por las bacterias y su absorción en el tracto gastrointestinal es mínima, por lo que actúa como un excelente agente osmótico aumentando el contenido de agua de las heces8,9. El PEG sin electrolitos ha mostrado ser útil para tratar el estreñimiento en pacientes pediátricos7,10–21, así como ser seguro y más eficaz que el placebo para el tratamiento de niños con EF a corto plazo22. Sin embargo, pocos estudios comparan la efectividad, la seguridad y la aceptación del PEG con HM19,20.
La última guía de manejo sugerida por las sociedades norteamericana y europea de gastroenterología, hepatología y nutrición (NASPGHAN y ESPGHAN, respectivamente) coloca al PEG como medicamento de primera línea para la terapia de mantenimiento del EF, seguido de la lactulosa, en caso de no disponerse de PEG; el HM, el aceite mineral y los laxantes estimulantes están considerados como tratamiento agregado o de segunda línea4.
Hasta el momento solo existe un estudio aleatorizado que compara la efectividad, la seguridad y la aceptabilidad durante 12meses de tratamiento de PEG3350 sin electrolitos con HM en niños, y es en pacientes ≥4años con EF y encopresis19. Los estudios comparativos de otros laxantes, que han incluido pacientes menores20,21, han reportado seguimiento máximo de 6meses, y solo uno evaluó la seguridad20. Dado que el EF representa también un problema para los niños menores3, los cuales pueden requerir tratamientos más prolongados, consideramos de utilidad comparar la eficacia, la seguridad y la aceptabilidad del PEG3350 sin electrolitos y del HM para el tratamiento de EF, con o sin encopresis, a largo plazo (12meses) de niños de 6meses a 18años de edad. El objetivo fue determinar la eficacia, la seguridad y la aceptabilidad de PEG vs HM en el EF a largo plazo en pacientes pediátricos.
Material y métodosDiseño del estudioSe realizó un ensayo clínico controlado, de asignación aleatoria, de grupos paralelos, de etiqueta abierta, entre julio de 2007 y julio de 2015, en la consulta externa de Gastroenterología del Hospital Infantil de México Federico Gómez.
Población de estudioSe incluyeron pacientes externos atendidos en un hospital de tercer nivel de México. Después de que los padres otorgaran el consentimiento informado y que los pacientes mayores de 7años firmaran el asentimiento informado, se enrolaron pacientes de 6meses a 18años de edad que llevaban al menos un mes sin recibir ninguno de los dos medicamentos del estudio y que cumplieron con los criterios diagnósticos de EF acorde con los criterios de RomaIII23–24:
- a)
De lactante hasta 4años de edad: presencia, al menos durante un mes, de dos o más de las siguientes manifestaciones:
- 1)
≤2 evacuaciones por semana.
- 2)
≥1 episodio por semana de encopresis luego de alcanzar el control esfinteriano.
- 3)
Historia de retención fecal excesiva.
- 4)
Historia de evacuaciones dolorosas o duras.
- 5)
Presencia de una masa fecal grande en recto.
- 6)
Historia de evacuaciones de diámetro aumentado que obstruyen el inodoro.
- b)
Niños con edad ≥4 años: presencia al menos una vez por semana, durante ≥2meses antes del diagnóstico, de dos o más de las siguientes manifestaciones:
- 1)
≤2 evacuaciones en el baño por semana.
- 2)
≥1 episodio por semana de encopresis luego de alcanzar el control esfinteriano.
- 3)
Historia de postura retentiva o de retención fecal voluntaria excesiva.
- 4)
Historia de evacuaciones dolorosas o duras.
- 5)
Presencia de una masa fecal grande en recto.
- 6)
Historia de evacuaciones de diámetro aumentado que obstruyen el inodoro.
Los criterios de exclusión fueron: pacientes con diagnóstico de síndrome de intestino irritable, estreñimiento secundario, cirugía abdominal, anormalidad anatómica del tracto gastrointestinal o alguna comorbilidad que pudiera afectar el resultado del tratamiento. Estos criterios se mantuvieron a lo largo de toda la ejecución del estudio, sin sufrir modificaciones.
Tamaño de la muestraEstimación del tamaño de la muestra para la comparación de dos proporciones con paquete STATA 9.2, College Station, Texas 77845 EE.UU. Tomando en cuenta una α de 0.05 (prueba de dos colas), un poder del 90%, con una p1=0.05, p2=0.35 y N2/N1=1.00, salió un número de 42 pacientes por grupo de tratamiento, y estimando un 10% de pérdidas, quedó un total de 46 por grupo.
AleatorizaciónEn la visita de inicio se corroboró que el paciente calificaba para ser enrolado en el estudio. En caso detectarse impactación fecal, se procedió a efectuar la desimpactación rectal mediante la colocación de enemas con solución jabonosa. Posteriormente se realizó la asignación a grupo de tratamiento mediante un método de asignación por bloques aleatorios para conseguir grupos balanceados en tres subgrupos etarios diferentes (6meses a 4años; >4años a 12años, y >12años a 18años), para lo cual se utilizó una tabla de números aleatorios generada con el programa Excel por un tercero que no participó en el enrolamiento de los pacientes. La maniobra de intervención no se pudo hacer cegada debido a la diferencia en las características físicas y de presentación de ambas intervenciones. El análisis de los datos se hizo por un investigador independiente que no participó en la atención directa de los pacientes.
Subgrupos etariosSe eligieron los diferentes subgrupos de edad a efectos de evaluar si la edad de los pacientes influiría en la eficacia, la seguridad y la aceptación de cada uno de los laxantes, sobre todo del HM, debido a su pobre palatabilidad. Tomando en cuenta que la dosis fue ponderal, los pacientes mayores deberían ingerir un mayor volumen de HM, lo que podría hacer más difícil su aceptación. Por dichas razones se establecieron tres subgrupos: el primero se corresponde con el grupo de lactantes hasta 4años de la clasificación de EF de los criterios de RomaIII; el segundo subgrupo, de 4 a 12años, y el tercer grupo incluyó solo adolescentes, quienes son generalmente más difíciles de tratar debido a su baja adherencia a los tratamientos, sobre todo si son prolongados; además, por su peso, son los que requieren dosis mayores de laxante.
IntervencionesGrupo 1. PEG 3350 (Contumax®, Asofarma de México, S.A. de C.V., México), 0.7g/kg/día23 disueltos en agua natural, agua de sabor, jugo o leche, en una a tres dosis diarias. La dosis fue incrementada, cada tres días, en 5g de polvo disueltos en dos onzas de líquido, hasta lograr de una a tres evacuaciones diarias de consistencia semejante a puré; o bien disminuida en la misma proporción, en caso de presentarse evacuaciones líquidas o más de tres veces al día. Se indicó mantener la dosis una vez logrado el objetivo.
Grupo 2. HM (Normex®, Química y Farmacia S.A. de C.V., México), 2ml/kg/día sola o disuelta en jugo, licuados de leche o bien con agregado de saborizantes de chocolate u otros gustos, en una a tres dosis diarias. La dosis fue incrementada 5ml cada tres días, hasta lograr de una a tres evacuaciones diarias de consistencia semejante a puré; o bien disminuida en la misma proporción en caso de presentarse evacuaciones líquidas o más de tres veces al día. Se indicó mantener la dosis una vez logrado el objetivo.
Instrucciones para el tratamientoSe explicó verbalmente a los familiares el objetivo del tratamiento, que consistía en lograr de una a tres evacuaciones diarias con consistencia semejante a puré, sin dolor abdominal ni incontinencia fecal (IF), y cómo aumentar o disminuir la dosis de los medicamentos para llegar al objetivo. Se les entregó un instructivo con dichas explicaciones por escrito. En todos los casos con control de esfínteres, se indicó sentarse en el baño luego de cada comida.
SeguimientoLuego de la visita inicial, se realizaron controles clínicos a 1, 3, 6, 9 y 12meses de tratamiento, en los que se evaluó: distensión abdominal, masas palpables en abdomen, dolor a la palpación abdominal, impactación fecal (materia fecal dura en el recto o en el abdomen inferior), materia fecal en la región perianal y/o en la ropa interior. Se tomaron muestras de sangre de aproximadamente 5ml para realizar estudios de laboratorio basales y a los 3, 6, 9 y 12meses de tratamiento: biometría hemática, nitrógeno ureico, creatinina, aspartato-aminotransferasa, alanino-aminotransferasa, fosfatasa alcalina, bilirrubinas y electrólitos séricos (Na, K, Cl, Ca, P y Mg).
Recolección de datosLos padres fueron instruidos para llevar, durante todo el estudio, un registro diario de:
- 1)
Dosis diaria utilizada de PEG (g/día) o de leche de magnesia (ml/día) según el laxante utilizado.
- 2)
Número de dosis rechazadas del medicamento/día: número de dosis del laxante que el paciente se negó a tomar en 24h.
- 3)
Utilización de otro laxante/día (sí/no): uso agregado de cualquier otro laxante en las 24h.
- 4)
Número de dosis de otro laxante/día: número de dosis del laxante agregado en las 24h.
- 5)
Enemas/día (sí/no): uso de lavados rectales en 24h.
- 6)
Número de enemas/día: número de lavados rectales realizados en las 24h.
- 7)
Número de movimientos intestinales/día: número de evacuaciones en el baño o en el pañal que el paciente presentó en 24h.
- 8)
Consistencia de las heces:
- a)
Formada dura (FD), cuando tenían cualquier forma con consistencia pétrea, muy difícil de evacuar e imposible de aplanar.
- b)
Formada suave (FS), cuando tenían cualquier forma y eran blandas, fáciles de evacuar y se aplanaban con facilidad.
- c)
Como puré (P), cuando no tenían forma y semejaban un puré.
- d)
Líquidas (L), cuando tenían abundante contenido líquido con residuos sólidos.
- 9)
Número de episodios de IF retencionista/día: número de eventos de evacuaciones en la ropa durante las 24h con evacuaciones duras en el baño o en ausencia de ellas.
- 10)
Número de episodios de dolor abdominal/día: número de veces que el paciente se quejó de dolor en el abdomen durante 24h.
- 11)
Eventos adversos/día (sí/no): cólicos, gases, dolor abdominal, diarrea, IF no retencionista (presencia de heces en la ropa y evacuaciones líquidas en el baño), vómitos, deshidratación y otros, con especificación de los mismos.
Los médicos a cargo del estudio llevaron un registro de datos clínicos basales y de los meses 1, 3, 6, 9 y 12 de tratamiento, que incluyeron evidencia de impactación fecal y manifestaciones del espectro autista. Los datos obtenidos de los registros diarios de los pacientes, los obtenidos de la consulta y los de laboratorio fueron anotados en una hoja de Excel con la finalidad de hacer los análisis.
EficaciaAl finalizar los 12 meses de tratamiento se consideró:
- 1)
Éxito: ≥3 evacuaciones/semana en el baño para el que ya tenía control de esfínteres o en el pañal para el que no tenía control de esfínteres, sin episodios de IF, de impactación fecal ni dolor abdominal, sin necesidad de otro laxante.
- 2)
Mejoría parcial: ≥3 evacuaciones/semana en el baño para el que ya tenía control de esfínteres o en el pañal para el que no tenía control de esfínteres, ≤2 episodios de IF al mes, sin impactación fecal ni dolor abdominal, sin necesidad de otro laxante.
- 3)
Fracaso: en caso de presentar ≤2 evacuaciones/semana en el baño para el que ya tenía control de esfínteres o en el pañal para el que no tenía control de esfínteres con >2 episodios de IF/mes y/o ≥1 evento de impactación fecal o necesidad de otro laxante.
Primarios. Los principales puntos de corte del estudio fueron: proporción de pacientes que presentaron éxito, número de dosis rechazadas del laxante y eventos adversos en cada grupo de tratamiento en forma global y por subgrupos etarios a 1, 3, 6, 9 y 12meses de tratamiento.
Secundarios. Los puntos de corte secundarios fueron: dosis de laxante (HM: ml/kg/día; PEG: g/kg/día) necesaria para lograr el objetivo del tratamiento; duración del tratamiento necesaria para alcanzar criterios de éxito (tiempo en meses necesario para reunir los criterios de éxito) y número de evacuaciones, de episodios de impactación fecal y de episodios de IF por semana a 1, 3, 6, 9 y 12meses de tratamiento.
Análisis estadísticoFue realizado por un investigador cegado a la asignación del tratamiento. Se llevaron a cabo pruebas de hipótesis para evaluar normalidad en la distribución de las variables a comparar. Se utilizó el enfoque analítico de intención a tratar. La significancia de las diferencias entre los grupos se determinó para los puntos primarios y secundarios mediante la prueba χ2 o prueba de Fisher para las variables cualitativas y mediante la prueba t de Student o U de Mann-Whitney para las variables cuantitativas. Todos los procedimientos se realizaron con el programa SPSS versión 13.0. Para todas las comparaciones se consideró un valor de p de 0.05 como estadísticamente significativo, de forma bidireccional.
Consideraciones éticasEl protocolo de estudio fue aprobado por el Comité Local de Investigación y Ética del HIMFG (HIM/2007/032/SSA-759 y 1062), y su registro consta en archivos de dicho comité. No hubo modificaciones del protocolo posteriores al registro e inicio del mismo. Todos los padres de los pacientes enrolados otorgaron el consentimiento informado y los pacientes mayores de 7años firmaron el asentimiento informado. Los autores declaran que este artículo no contiene información personal que permita identificar a los pacientes.
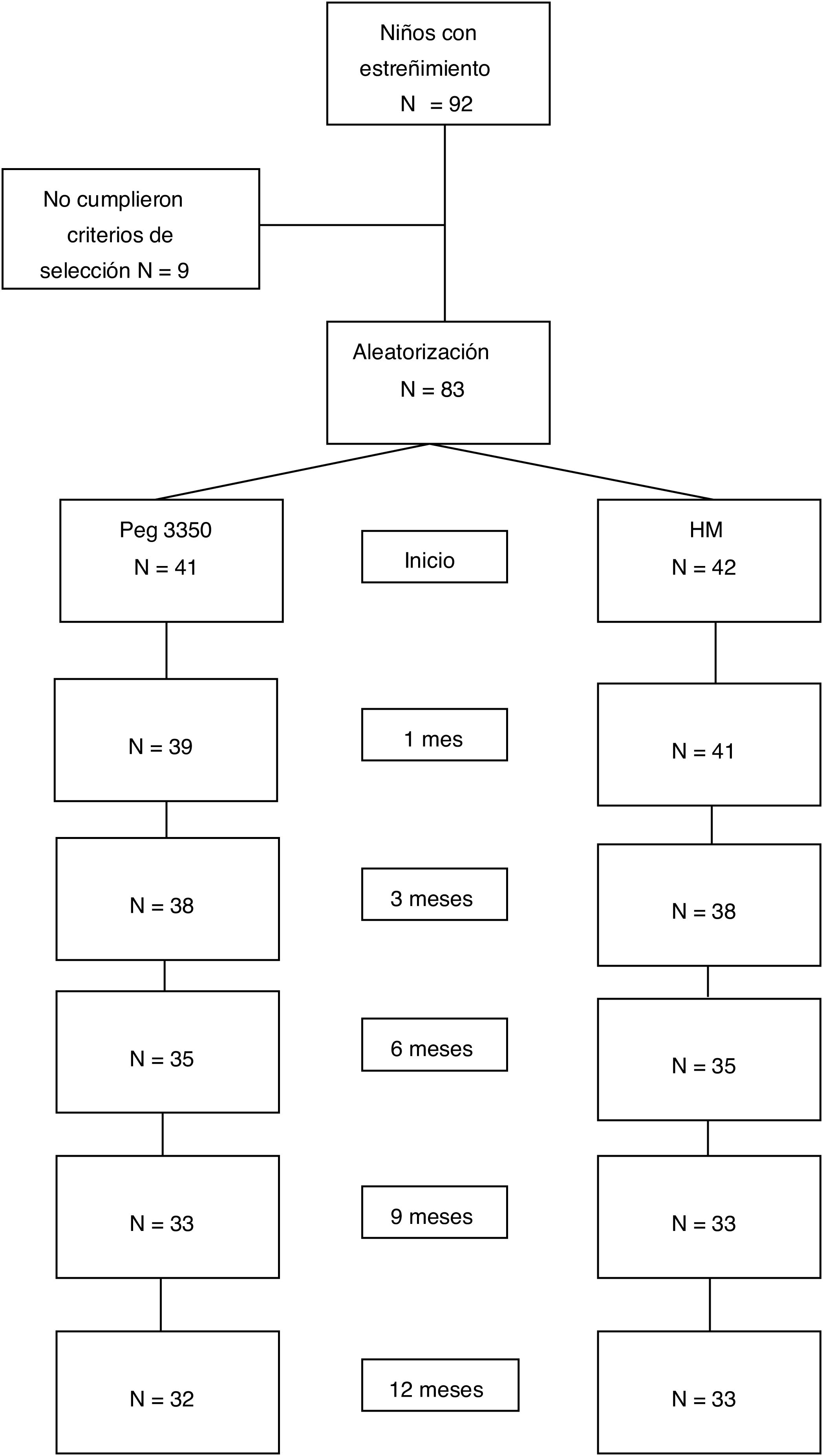
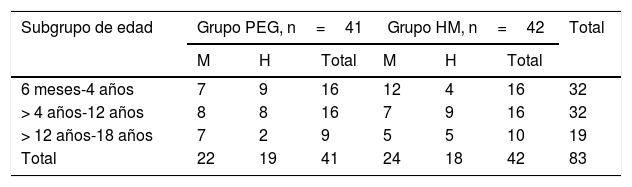
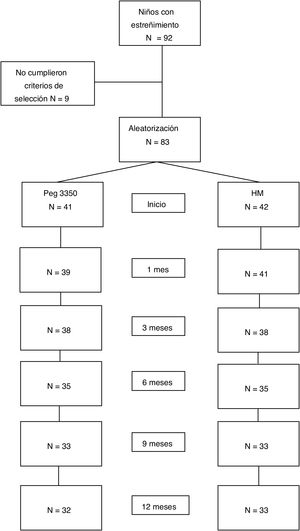
ResultadosPoblación estudiadaSe incluyeron 83 pacientes, en el período entre julio de 2007 y julio de 2015: 41 en el grupo de PEG y 42 en el grupo de HM. El 53% del total fueron mujeres. No existieron diferencias en el número de pacientes asignados a cada subgrupo etario entre ambas opciones de tratamiento. Las características demográficas basales se muestran en la tabla 1. Completaron el estudio a 12meses 65 pacientes (78%). Dieciocho pacientes (9 de cada grupo) suspendieron el tratamiento antes de los 12meses por diferentes motivos: 4 por problemas familiares, 2 por rechazo del medicamento, 2 por enfermedades intercurrentes, uno por problemas psicológicos, uno por impactación fecal, uno por diarrea y 7 sin causa conocida (fig. 1).
Distribución demográfica basal
| Subgrupo de edad | Grupo PEG, n=41 | Grupo HM, n=42 | Total | ||||
|---|---|---|---|---|---|---|---|
| M | H | Total | M | H | Total | ||
| 6 meses-4 años | 7 | 9 | 16 | 12 | 4 | 16 | 32 |
| > 4 años-12 años | 8 | 8 | 16 | 7 | 9 | 16 | 32 |
| > 12 años-18 años | 7 | 2 | 9 | 5 | 5 | 10 | 19 |
| Total | 22 | 19 | 41 | 24 | 18 | 42 | 83 |
H: hombres; HM: hidróxido de magnesio o leche de magnesia; M: mujeres; PEG: polietilenglicol.
De los 83 pacientes, 66 (79.5%) reunieron criterios de éxito desde el primer mes de tratamiento; 12 (14.5%), a los 3meses; 2 (2.4%), a los 6meses, y uno, a los 9meses. Fueron eliminados del estudio 2 pacientes (2.4%) (uno de cada grupo). No se encontraron diferencias significativas en la población general al comparar los resultados de las pruebas bioquímicas basales con las posteriores a la intervención. Se registraron eventos adversos no graves. Los más frecuentes fueron gases, cólico, IF y diarrea. Veintinueve pacientes (34.9%) rechazaron alguna dosis del medicamento.
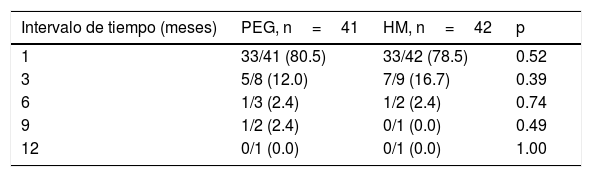
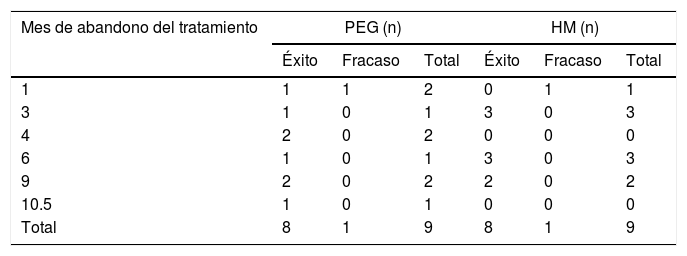
Respuesta al tratamientoEficacia. Presentaron éxito 40/41 pacientes en el grupo de PEG (97.56%) y 40/42 pacientes en el grupo de HM (95.24%), p=0.616. No se encontraron diferencias significativas entre grupos respecto al tiempo de tratamiento necesario para reunir criterios de éxito (tabla 2). Solo un paciente presentó mejoría parcial en el grupo con HM y ninguno en el grupo con PEG. Dos pacientes presentaron falla al tratamiento, uno en cada grupo de estudio. No se encontraron diferencias entre grupos de tratamiento respecto al número de pacientes que suspendieron el tratamiento antes de los 12meses, así como tampoco en el número de pacientes que reunieron criterios de éxito y de falla al momento de suspender el tratamiento (tabla 3). Tampoco existieron diferencias en la duración del tratamiento necesaria para reunir criterios de éxito (tiempo en meses necesario para alcanzar los criterios de éxito) en forma global y ni por subgrupos etarios a 1, 3, 6, 9 y 12meses de tratamiento.
Tasa de éxito comparativa entre grupos de tratamiento en cada intervalo de tiempo
| Intervalo de tiempo (meses) | PEG, n=41 | HM, n=42 | p |
|---|---|---|---|
| 1 | 33/41 (80.5) | 33/42 (78.5) | 0.52 |
| 3 | 5/8 (12.0) | 7/9 (16.7) | 0.39 |
| 6 | 1/3 (2.4) | 1/2 (2.4) | 0.74 |
| 9 | 1/2 (2.4) | 0/1 (0.0) | 0.49 |
| 12 | 0/1 (0.0) | 0/1 (0.0) | 1.00 |
HM: hidróxido de magnesio o leche de magnesia; PEG: polietilenglicol.
Número de pacientes que abandonaron el tratamiento por intervalos de tiempo, grupo de intervención y evolución
| Mes de abandono del tratamiento | PEG (n) | HM (n) | ||||
|---|---|---|---|---|---|---|
| Éxito | Fracaso | Total | Éxito | Fracaso | Total | |
| 1 | 1 | 1 | 2 | 0 | 1 | 1 |
| 3 | 1 | 0 | 1 | 3 | 0 | 3 |
| 4 | 2 | 0 | 2 | 0 | 0 | 0 |
| 6 | 1 | 0 | 1 | 3 | 0 | 3 |
| 9 | 2 | 0 | 2 | 2 | 0 | 2 |
| 10.5 | 1 | 0 | 1 | 0 | 0 | 0 |
| Total | 8 | 1 | 9 | 8 | 1 | 9 |
PEG: polietilenglicol, HM: hidróxido de magnesio o leche de magnesia.
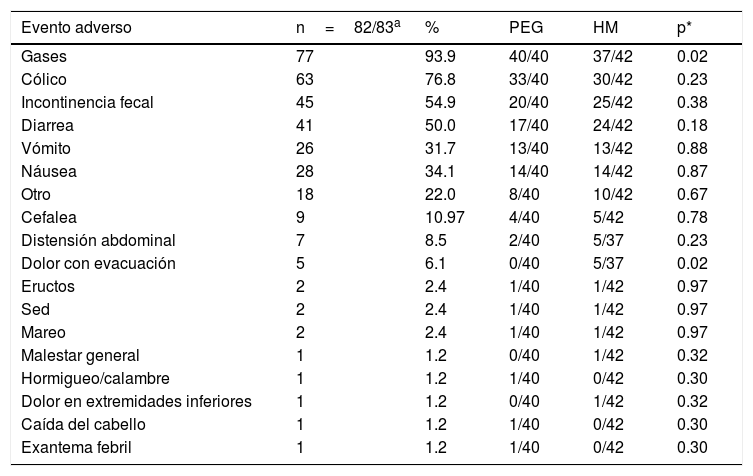
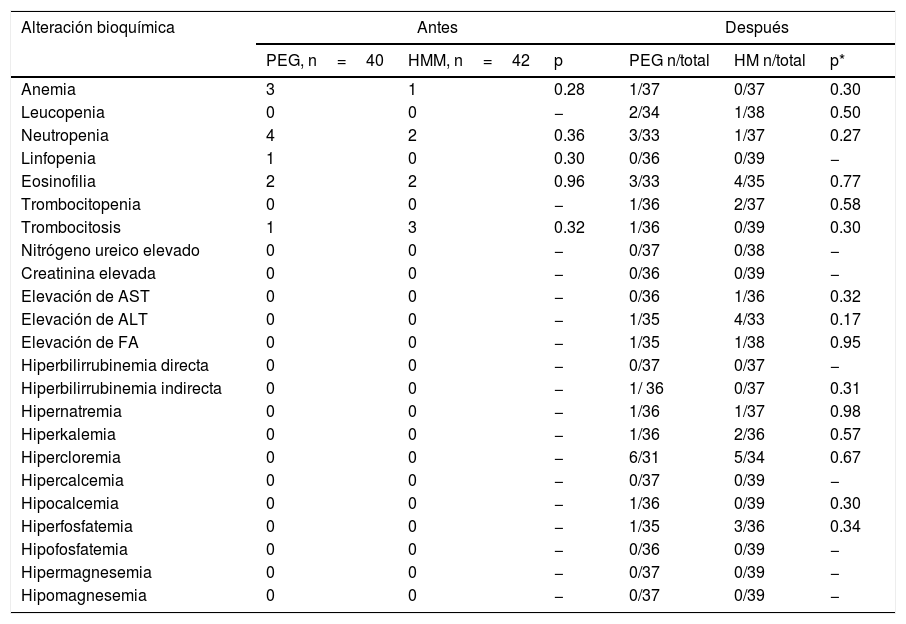
Seguridad. No se presentaron eventos adversos de gravedad con ninguno de los dos regímenes de tratamiento en ningún subgrupo etario. Un número significativamente mayor de pacientes presentaron gases en el grupo con PEG (p=0.024) y dolor al evacuar en el grupo con HM (p=0.02) (tabla 4). No se encontraron diferencias significativas por subgrupos etarios. No se encontraron diferencias significativas entre grupos respecto a las pruebas bioquímicas basales ni al final del tratamiento (tabla 5).
Eventos adversos clínicos. Comparación entre grupos de tratamiento
| Evento adverso | n=82/83a | % | PEG | HM | p* |
|---|---|---|---|---|---|
| Gases | 77 | 93.9 | 40/40 | 37/42 | 0.02 |
| Cólico | 63 | 76.8 | 33/40 | 30/42 | 0.23 |
| Incontinencia fecal | 45 | 54.9 | 20/40 | 25/42 | 0.38 |
| Diarrea | 41 | 50.0 | 17/40 | 24/42 | 0.18 |
| Vómito | 26 | 31.7 | 13/40 | 13/42 | 0.88 |
| Náusea | 28 | 34.1 | 14/40 | 14/42 | 0.87 |
| Otro | 18 | 22.0 | 8/40 | 10/42 | 0.67 |
| Cefalea | 9 | 10.97 | 4/40 | 5/42 | 0.78 |
| Distensión abdominal | 7 | 8.5 | 2/40 | 5/37 | 0.23 |
| Dolor con evacuación | 5 | 6.1 | 0/40 | 5/37 | 0.02 |
| Eructos | 2 | 2.4 | 1/40 | 1/42 | 0.97 |
| Sed | 2 | 2.4 | 1/40 | 1/42 | 0.97 |
| Mareo | 2 | 2.4 | 1/40 | 1/42 | 0.97 |
| Malestar general | 1 | 1.2 | 0/40 | 1/42 | 0.32 |
| Hormigueo/calambre | 1 | 1.2 | 1/40 | 0/42 | 0.30 |
| Dolor en extremidades inferiores | 1 | 1.2 | 0/40 | 1/42 | 0.32 |
| Caída del cabello | 1 | 1.2 | 1/40 | 0/42 | 0.30 |
| Exantema febril | 1 | 1.2 | 1/40 | 0/42 | 0.30 |
HM: hidróxido de magnesio o leche de magnesia; PEG: polietilenglicol.
Alteración de las pruebas bioquímicas entre grupo de tratamiento
| Alteración bioquímica | Antes | Después | ||||
|---|---|---|---|---|---|---|
| PEG, n=40 | HMM, n=42 | p | PEG n/total | HM n/total | p* | |
| Anemia | 3 | 1 | 0.28 | 1/37 | 0/37 | 0.30 |
| Leucopenia | 0 | 0 | − | 2/34 | 1/38 | 0.50 |
| Neutropenia | 4 | 2 | 0.36 | 3/33 | 1/37 | 0.27 |
| Linfopenia | 1 | 0 | 0.30 | 0/36 | 0/39 | − |
| Eosinofilia | 2 | 2 | 0.96 | 3/33 | 4/35 | 0.77 |
| Trombocitopenia | 0 | 0 | − | 1/36 | 2/37 | 0.58 |
| Trombocitosis | 1 | 3 | 0.32 | 1/36 | 0/39 | 0.30 |
| Nitrógeno ureico elevado | 0 | 0 | − | 0/37 | 0/38 | − |
| Creatinina elevada | 0 | 0 | − | 0/36 | 0/39 | − |
| Elevación de AST | 0 | 0 | − | 0/36 | 1/36 | 0.32 |
| Elevación de ALT | 0 | 0 | − | 1/35 | 4/33 | 0.17 |
| Elevación de FA | 0 | 0 | − | 1/35 | 1/38 | 0.95 |
| Hiperbilirrubinemia directa | 0 | 0 | − | 0/37 | 0/37 | − |
| Hiperbilirrubinemia indirecta | 0 | 0 | − | 1/ 36 | 0/37 | 0.31 |
| Hipernatremia | 0 | 0 | − | 1/36 | 1/37 | 0.98 |
| Hiperkalemia | 0 | 0 | − | 1/36 | 2/36 | 0.57 |
| Hipercloremia | 0 | 0 | − | 6/31 | 5/34 | 0.67 |
| Hipercalcemia | 0 | 0 | − | 0/37 | 0/39 | − |
| Hipocalcemia | 0 | 0 | − | 1/36 | 0/39 | 0.30 |
| Hiperfosfatemia | 0 | 0 | − | 1/35 | 3/36 | 0.34 |
| Hipofosfatemia | 0 | 0 | − | 0/36 | 0/39 | − |
| Hipermagnesemia | 0 | 0 | − | 0/37 | 0/39 | − |
| Hipomagnesemia | 0 | 0 | − | 0/37 | 0/39 | − |
HM: hidróxido de magnesio o leche de magnesia; PEG: polietilenglicol.
Aceptabilidad. Al analizar ambos grupos de intervención de manera global no se encontraron diferencias significativas entre grupos respecto al número de dosis rechazadas del laxante, así como tampoco en el número de pacientes que rechazaron el medicamento a 1, 3, 6, 9 y 12meses de intervención.
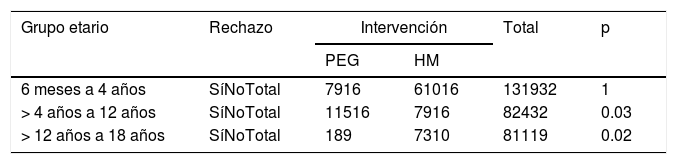
Al analizarlos por subgrupos de acuerdo con la edad, se encontró un número significativamente mayor de pacientes que rechazaron el HM en los subgrupos de >4años a 12años y de >12años a 18años (p=0.037 y p=0.020, respectivamente) (tabla 6).
Número de pacientes que rechazaron el medicamento por grupo de intervención y subgrupo etario
| Grupo etario | Rechazo | Intervención | Total | p | |
|---|---|---|---|---|---|
| PEG | HM | ||||
| 6 meses a 4 años | SíNoTotal | 7916 | 61016 | 131932 | 1 |
| > 4 años a 12 años | SíNoTotal | 11516 | 7916 | 82432 | 0.03 |
| > 12 años a 18 años | SíNoTotal | 189 | 7310 | 81119 | 0.02 |
HM: hidróxido de magnesio o leche de magnesia; PEG: polietilenglicol.
No se encontraron diferencias en el número de evacuaciones ni de eventos de IF semanales por grupo a 1, 3, 6, 9 ni 12 meses de seguimiento. Solo un paciente presentó impactación fecal luego de una semana del inicio del tratamiento con PEG, motivo por el cual fue retirado del estudio de inmediato. Ningún paciente requirió laxantes extras ni enemas. La dosis requerida de mantenimiento para lograr el objetivo del tratamiento (1 a 3 evacuaciones diairas, de consistencia semejante a puré, sin dolor abdominal ni IF) fue de 0.91±0.37g/kg/día de PEG y 1.83±0.39ml/kg/día de HM.
DiscusiónEste estudio es el primero en el que se comparan dos laxantes osmóticos, muy utilizados en la población pediátrica general (PEG vs HM), para tratar el EF durante 12meses, en niños de diferentes grupos etarios, con lactantes desde los 6meses de edad. Evalúa comparativamente la efectividad, la seguridad y la aceptabilidad, con la finalidad de ofrecer una alternativa adecuada a la edad y condición clínica del paciente. El EF crónico es una condición muy frecuente en pediatría. Su manejo requiere intervenciones dirigidas a mejorar la dieta, así como los hábitos para ir al baño. No obstante, es bien conocida la importancia que tiene el uso de laxantes por períodos prolongados, tanto para limpiar el colon como para mantenerlo limpio, con lo cual no solo se logra mejorar la calidad de vida del paciente, sino que se favorece también la recuperación del tamaño del colon y de su motilidad. Si bien existen numerosos tipos de laxantes, la literatura ha demostrado que los laxantes osmóticos son los preferidos universalmente para tratar a los pacientes en edad pediátrica, ya que, además de ser efectivos, son más seguros, aunque su aceptabilidad puede no ser buena a largo plazo5,6. Las soluciones de PEG con electrólitos han sido utilizadas para desimpactar a pacientes con estreñimiento crónico25–29, para limpiar el tracto gastrointestinal previo a realizar procedimientos diagnósticos y quirúrgicos30,31, y para tratar el estreñimiento crónico en adultos32,33 y niños34. A partir del año 1990, ante los problemas relacionados con la absorción de electrólitos9, se probó el PEG3350 sin electrólitos como laxante en adultos35,36. Desde entonces se han publicado varios estudios pediátricos de PEG sin electrólitos para tratar el EF. La mayoría de los estudios han comparado el PEG con la lactulosa, demostrando que el PEG sin electrólitos es significativamente más efectivo que la lactulosa15–18. Dada la pobre evidencia de estudios comparativos entre PEG e HM, los expertos de NASPGHAN y ESPGHAN, en sus últimas guías, han recomendado el PEG y, en su defecto, la lactulosa, como terapia de primera línea para tratar el EF, y como segunda línea, o como tratamiento agregado, el HM y los laxantes estimulantes4.
La leche de magnesia, nombre comúnmente utilizado para referirse al HM, es un laxante osmótico ampliamente disponible en nuestro medio. Además, comparativamente con el PEG, su costo es mucho menor. Se estima que un mes de tratamiento para un paciente de 20kg con PEG3350 (Contumax polvo frasco de 255g) representa un costo de $540.00 mexicanos contra $172.00 mexicanos por un mes de tratamiento con HM (Leche de Magnesia Normex, frasco con 360ml). Tomando en cuenta la importante diferencia en sus costos, la amplia disponibilidad del HM y el menor número de estudios que comparan el PEG con el HM, sobre todo por un periodo prolongado (12meses), y que el existente19 no incluye lactantes desde los 6meses de edad, consideramos importante realizar un estudio comparativo entre PEG e HM en población pediátrica desde los 6meses hasta los 18años y dividirlos en subgrupos etarios a efectos de evaluar posibles diferencias en la eficacia, la seguridad y la aceptación de los laxantes entre subgrupos.
Nuestro estudio demostró que ambos laxantes son igualmente efectivos en todos los grupos etarios, similar a lo reportado por Loening-Baucke et al.19 en su estudio aleatorizado, en el que compararon PEG3350 sin electrolitos e HM durante 12meses. Otros autores han comparado el PEG con HM en pacientes desde los 12meses de edad, aunque no incluyeron lactantes menores y la duración del tratamiento alcanzó un periodo máximo de 6meses20,21. Sus resultados son discordantes, ya que mientras el estudio de Ratanamongkola et al.20 reportó que el PEG fue más efectivo que el HM, Gomes et al.21, al igual que nosotros, encontraron que el PEG y el HM fueron igualmente efectivos. Nuestras evidencias, aunadas a las aportadas por otros autores20,22, dan fuerza al concepto de igualdad de eficacia del PEG y el HM. En nuestro estudio, el PEG y el HM mostraron ser igualmente seguros para su uso durante 12meses en niños desde los 6meses de edad, tanto desde el punto de vista clínico como bioquímico. Los principales eventos adversos detectados fueron gases, cólico, IF y diarrea, que mejoraron al disminuir la dosis de laxante y que coinciden con los reportados por otros autores11,19–21. Sin embargo, es importante considerar que en ninguno de los estudios publicados previamente se incluyeron lactantes menores de un año de edad que hayan recibido tratamiento durante 12meses. Al igual que el presente estudio, los estudios comparativos entre PEG e HM publicados hasta el momento reportan que ambos laxantes son seguros; sin embargo, solo el estudio de Loening-Baucke et al.19 evaluó la seguridad de ambos laxantes, tanto desde el punto de vista clínico como bioquímico. Ratanamongkola et al.20 solo analizaron los eventos adversos clínicos y Gomes et al.21 no evaluaron la seguridad. Nuestro estudio aporta conocimiento acerca de la seguridad que ofrecen tanto el PEG como el HM para tratar el EF aun en lactantes menores, a partir de los 6meses de edad, por un periodo de tratamiento de 12meses. No obstante, dado el pequeño número de lactantes de esta edad incluidos en cada grupo de tratamiento, se requieren estudios con un mayor número de pacientes menores de un año para fortalecer esta evidencia. Cinco pacientes tratados con HM reportaron dolor al evacuar a pesar de presentar evacuaciones blandas. Desconocemos la razón de este síntoma, que fue considerado como leve y no relacionado con la presencia de evacuaciones traumáticas. No fue un síntoma constante y no afectó la continuidad del tratamiento.
Hemos visto que la aceptación de PEG y HM de manera global fue similar; sin embargo, al hacer un análisis por subgrupos etarios encontramos que un número significativamente mayor de pacientes rechazó el HM en los subgrupos de >4-12años y de >12-18años (p=0.037 y p=0.020, respectivamente) (tabla 6). Estos hallazgos concuerdan con los del grupo de Loening-Baucke et al.19, quienes incluyeron pacientes a partir de los 4años de edad. Esto tal vez tenga que ver con la palatabilidad poco agradable del HM y con la mayor cantidad de laxante requerida por estos grupos de pacientes, hecho que sugerimos tomar en cuenta a la hora de elegir su tratamiento. Los estudios realizados en pacientes de 1 a 5años por periodos de 6meses mostraron mayor aceptación del PEG que del HM. Sin embargo, no especifican cómo se evaluó dicha aceptación y no muestran un análisis comparativo21,22.
Limitaciones del estudioDebido a las diferentes formas de presentación y texturas del PEG (polvo) y de la leche de magnesia o HM (líquido), no fue posible llevar a cabo un estudio ciego. Otra limitación fue que 9 pacientes en cada grupo de tratamiento lo abandonaron antes de finalizar. Sin embargo, es importante considerar que también, en cada grupo de tratamiento, 8 de los 9 pacientes que abandonaron el estudio antes de su finalización reunían criterios de éxito al momento de abandonarlo, por lo que no pueden ser considerados como fallas al tratamiento.
ConclusiónTanto el PEG como el HM son igualmente efectivos en el manejo del EF en pacientes pediátricos desde los 6meses de edad. El PEG es mejor aceptado que el HM por los pacientes mayores de 4años y mejor aún por los mayores de 12años de edad, por lo que se sugiere considerar, además de los costos, la edad del paciente antes de prescribir alguno de los dos laxantes. Ambos laxantes son seguros para tratar a lactantes menores de 12meses de edad por un periodo de 12meses; aun así, se requieren más estudios comparativos en este grupo etario que incluyan un mayor número de pacientes, a efectos de fortalecer este concepto. Con base en nuestros hallazgos, el HM puede ser recomendado también como primera línea de tratamiento para el EF en niños menores de 4años de edad y para los casos en los cuales el PEG no esté disponible o bien no sea económicamente accesible.
FinanciaciónEste trabajo contó con el apoyo de Fondos Federales para la investigación, tal y como está asentado en los archivos del Comité Local de Investigación y Ética del HIMFG (HIM/2007/032/SSA-759 y 1062).
Conflicto de interesesNinguno de los autores presenta conflicto de intereses.