La enfermedad inflamatoria intestinal es considerada como una entidad inmunomediada que compromete especialmente el tracto digestivo, pero con frecuencia se presentan manifestaciones extradigestivas. La enfermedad de Crohn suele presentar un compromiso profundo transmural y puede afectar cualquier parte del tubo digestivo, desde la cavidad oral hasta el ano. Al momento del diagnóstico, la mayoría de estos pacientes presentan enfermedad predominantemente inflamatoria. El compromiso esofagogastroduodenal es infrecuente, con una baja incidencia estimada entre el 0.5 y el 4% de los casos de enfermedad de Crohn1, por lo cual se considera un reto diagnóstico. El diagnóstico se basa en la sumatoria de hallazgos clínicos, endoscópicos, histológicos y radiológicos, donde se debe excluir, primero, una larga lista de diagnósticos diferenciales que incluyen el linfoma, el adenocarcinoma y la tuberculosis2.
Presentamos una paciente de 24 años, proveniente de área rural, previamente sana, quien consultó a su sitio de atención primaria por un cuadro clínico de 6 meses de evolución de dolor abdominal tipo cólico, con frecuencia diaria, con incremento pospandrial, de moderada intensidad, asociado a náuseas y vómitos pospandriales frecuentes. También refirió que 3 meses previos a la consulta presentó diarrea acuosa en promedio de 4-6 veces al día, de consistencia entre 6 y 7 en la clasificación de Bristol; mencionó que tenía episodios recurrentes de melena y una pérdida de 17kg. Al examen físico, estaba en regular estado general, caquéctica, con una talla de 154cm, peso corporal 32 kg (con un peso usual de 49kg) para un IMC de 13.5kg/m2, con dolor abdominal de tipo cólico, de intensidad moderada, sin irritación peritoneal.
Se le realizaron estudios endoscópicos iniciales en los que se describió: pobre distensión de las paredes gástricas, presencia de abundantes líquidos y restos alimentarios de retención. Además, lesión ulcerada infiltrante que afectaba casi la totalidad del cuerpo y antro gástrico, con estenosis pilórica, por lo cual le hicieron un diagnóstico probable de cáncer gástrico. En dicho procedimiento tomaron biopsias, que mostraron severos cambios inflamatorios dados por infiltrado linfoplasmocitario y representación de material ulcerado. Por la sospecha endoscópica inicial de cáncer gástrico se le realizó estadificación con tomografía axial computarizada de abdomen en la que se identificó severo engrosamiento parietal que envolvía toda la pared gástrica, con mayor compromiso corporoantral y múltiples adenopatías, que se interpretaron como adenopatías perigástricas de presunto origen neoplásico. Las primeras biopsias no mostraron malignidad, por lo cual se solicitó nueva endoscopia, en la que se describió el mismo patrón endoscópico y, ante la alta sospecha de neoplasia, le volvieron a tomar múltiples biopsias, incluso con técnica de biopsia sobre biopsia. Los resultados fueron similares a las primeras biopsias descritas. Por esta razón, solicitaron una endosonografía gástrica para evaluar las paredes gástricas y eventual punción/aspiración con aguja fina transmural y de las adenopatías perigástricas. La punción/aspiración con aguja fina gástrica y los ganglios tuvieron una muestra insuficiente y descrita como negativa para malignidad.
Fue evaluada por cirugía general, que recomendó realizarle diagnóstico y estadificación del supuesto cáncer gástrico con biopsias tomadas por laparoscopia del peritoneo y de los ganglios perigástricos (resultados que también fueron negativos). En este escenario, se remitió a nuestra institución para completar su diagnóstico y con fines de ofrecer manejo paliativo.
Al ingreso, se identificó una paciente en malas condiciones generales, con palidez cutaneomucosa marcada y sensación de masa en epigastrio. En los laboratorios de ingreso fue llamativa la alteración en reactantes de fase aguda: PCR 18.51mg/dl (VR hasta 1mg/dl); velocidad de sedimentación globular de 83mm/h; un hemograma con leucocitosis de 12,700mm3; neutrofilia del 81.6% (absolutos 10,400mm3); hemoglobina de 7.8 g/dl; hematocrito de 23.7%, con trombocitosis de 747,000mm3, hipoalbuminemia severa en 2.3mg/dl y ELISA para VIH no reactiva.
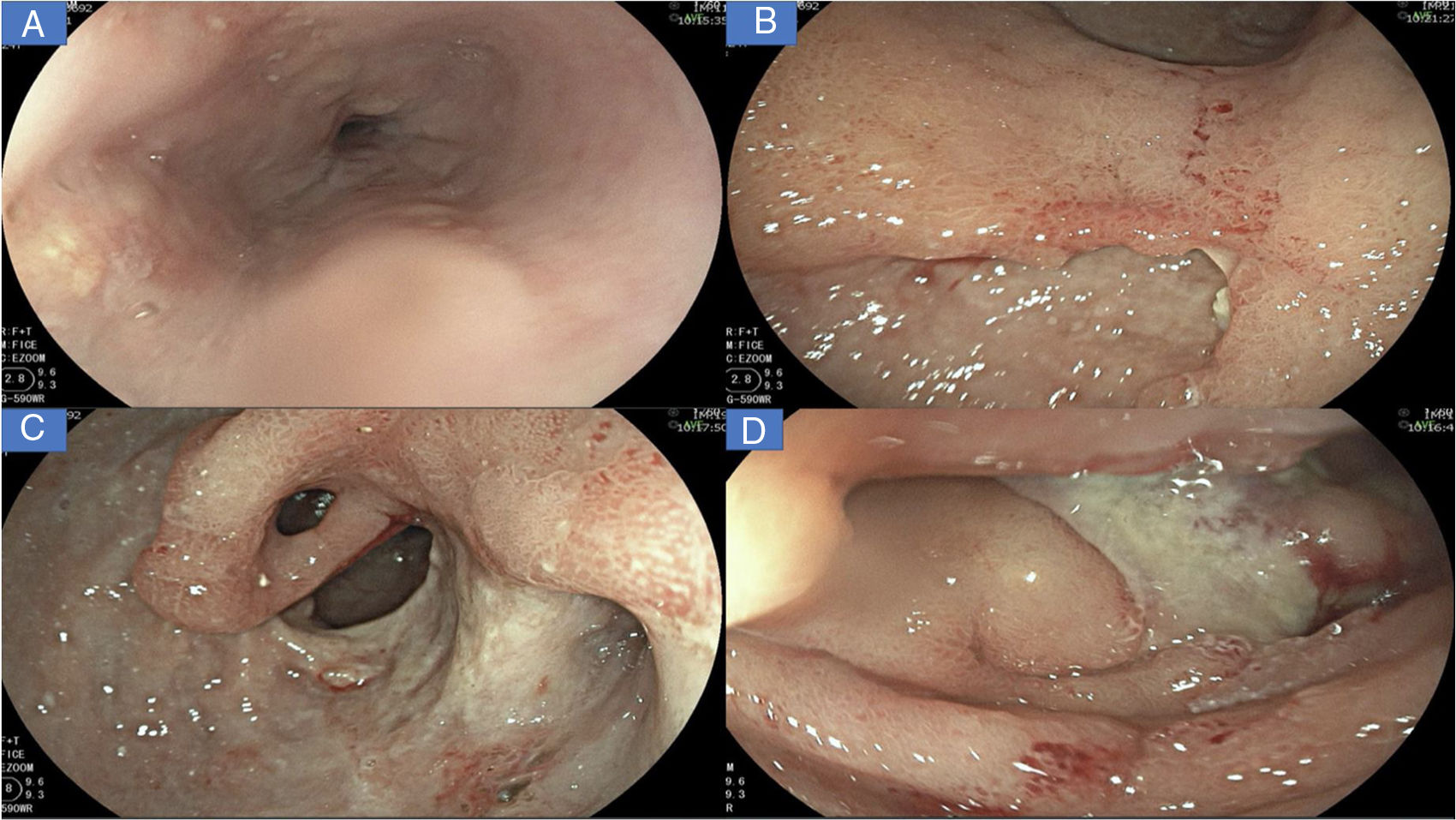
Se le realizó una nueva endoscopia digestiva, la cual mostró en el esófago muescas de Kerckring (fig. 1A); en el estómago, múltiples úlceras profundas de bordes irregulares, segmentarias, con un compromiso extenso en antro y cuerpo (fig. 1B-C); en el duodeno tenía severos cambios inflamatorios segmentarios, con un mayor compromiso en la segunda porción duodenal (fig. 1D), por lo cual de inmediato sospechamos de una enfermedad inflamatoria.
A) Úlceras lineales, erosiones aftoides y muescas de Kerckring en esófago. B) Severos cambios inflamatorios que afectan la mucosa del cuerpo, con evidencia de eritema, edema, nodularidad, con úlceras profundas y segmentarias. C) Visión del antro gástrico, evidencia de úlcera profunda que afecta más del 70% de la circunferencia, con áreas en sacabocados, deformidad pilórica y puente mucoso (flecha negra). D) Severos cambios inflamatorios en duodeno, con evidencia de úlceras serpiginosas y una úlcera dominante en DII recubierta de fibrina.
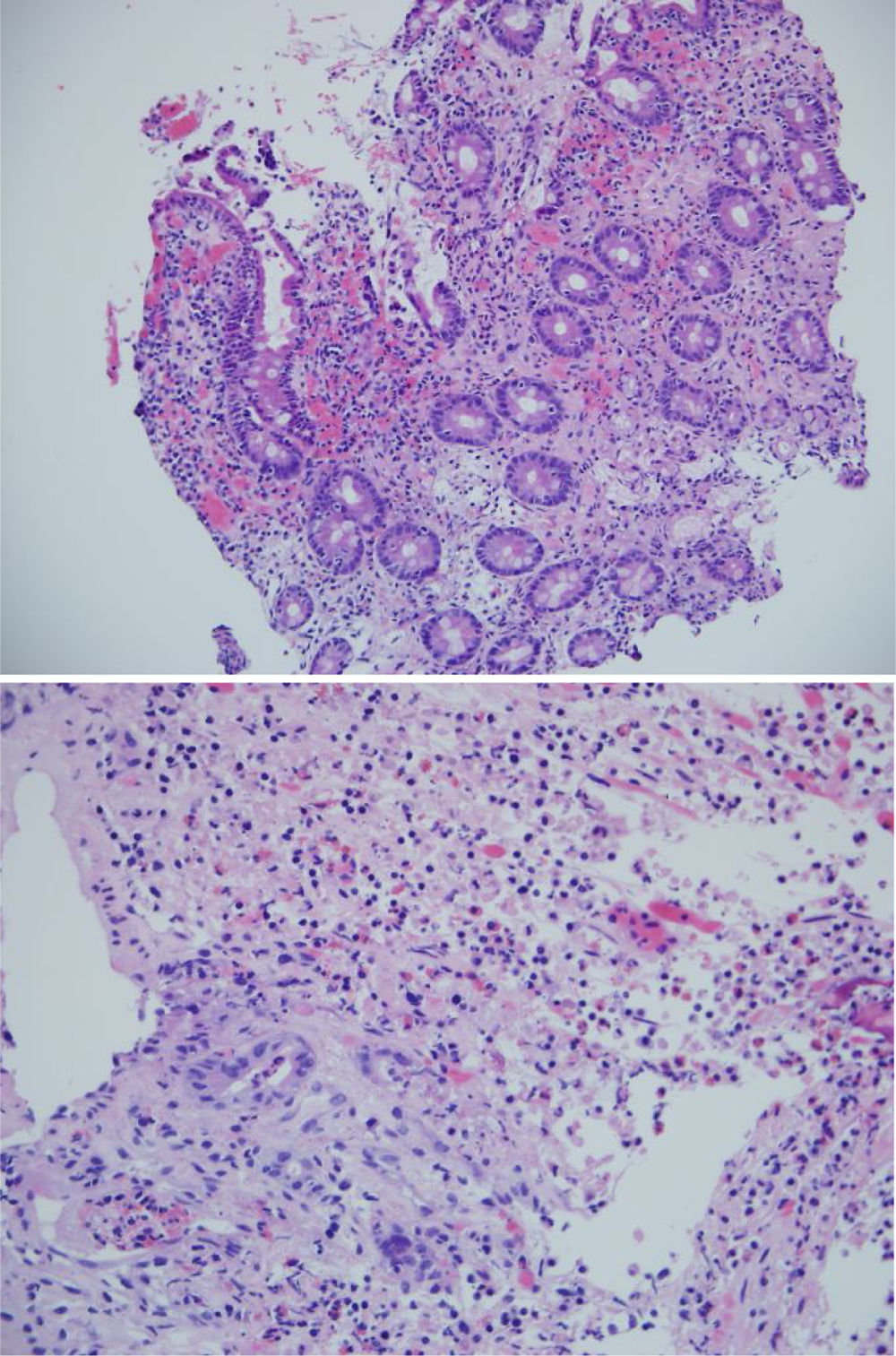
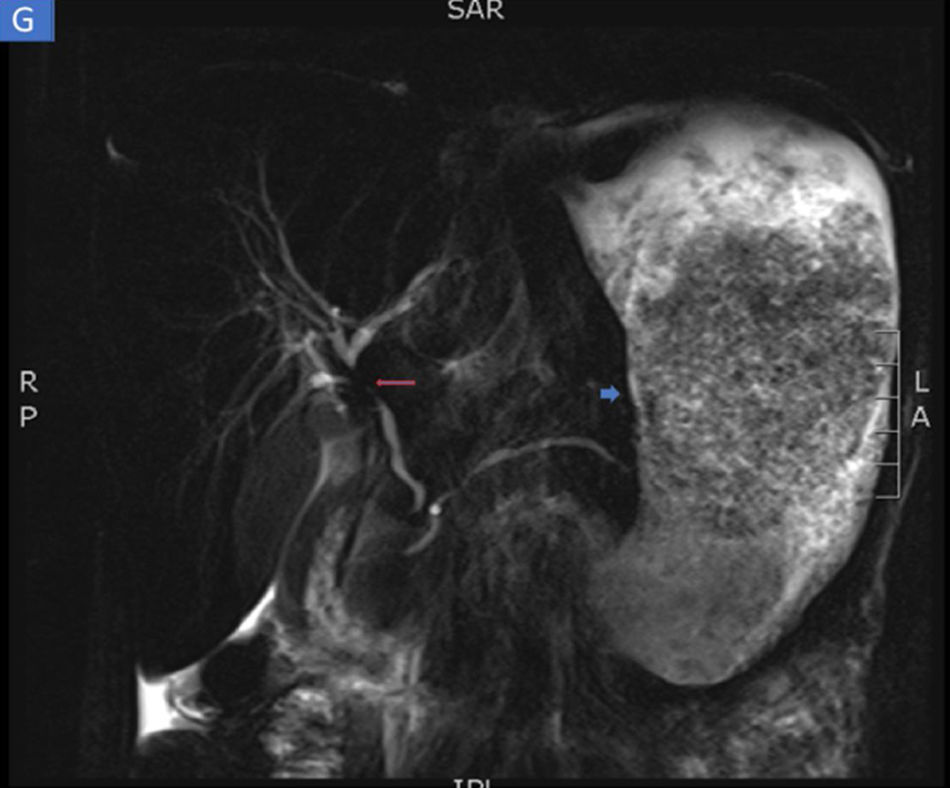
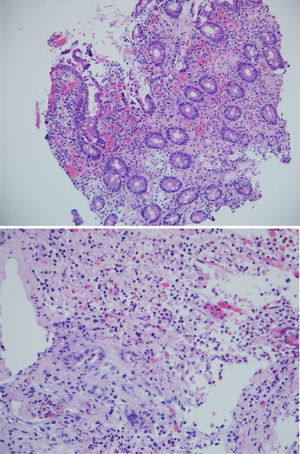
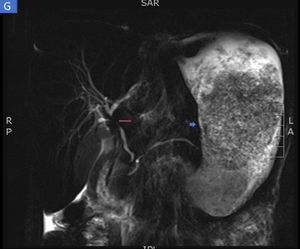
Las biopsias tomadas en la endoscopia superior mostraron severos cambios inflamatorios crónicos, infiltrado linfoplasmocitario, con áreas ulceradas de forma extensa y profunda en esófago, estómago y duodeno, sin evidencia de displasia ni malignidad. El estudio de inmunohistoquímica descartaba proceso neoplásico de tipo adenocarcinoma y linfoma y las coloraciones especiales de Ziehl-Neelsen y plata metenamina eran negativas para infección por tuberculosis y hongos, respectivamente (fig. 2). Por la alta sospecha de enfermedad de Crohn, solicitamos una enterorresonancia para evaluar la extensión de la enfermedad, en la cual se descartó compromiso del resto del intestino delgado y del tracto digestivo inferior. En la enterorresonancia fue llamativa la extensión y la profundidad de las lesiones gástricas, además de la presencia de una estenosis de aspecto inflamatorio en el confluente de los hepáticos y colédoco proximal (fig. 3).
Enterorresonancia en la que se identifican severos cambios inflamatorios y engrosamiento del estómago (flecha corta). Además, de forma incidental se identifica una estenosis severa de aspecto inflamatorio en la confluencia de los hepáticos y colédoco proximal compatible con colangitis esclerosante primaria (flecha larga).
Con los hallazgos clínicos, endoscópicos, radiológicos y la negatividad de las biopsias para malignidad y sin infecciones profundas, se concluyó finalmente compromiso esofagogastroduodenal por enfermedad de Crohn. Con un score calculado de CDAI de 449 del ingreso, sumado a la presencia de una estenosis biliar dominante, consideramos una alta probabilidad de colangitis esclerosante primaria como manifestación extradigestiva. Se complementaron estudios inmunológicos, en los que destacaron anticuerpos antinucleares (negativos), anticuerpos antimúsculo liso negativo, P ANCA negativo, con anticuerpos anti-Saccharomyces IgA e IgG positivos.
Con el reporte de enfermedad que descartó malignidad e infecciones profundas, se inició tratamiento con esteroides sistémicos (hidrocortisona: 100mg cada 8h por vía intravenosa) y terapia con anticuerpo contra factor de necrosis tumoral α(infliximab a 5mg/kg en dosis de inducción en semana 0-2-6). La respuesta inicial fue satisfactoria debido a la mejoría temprana del dolor abdominal y a la reducción de las náuseas; a la semana no volvió a presentar episodios de vómitos, ni diarrea. Posteriormente se dejó con prednisolona a 40mg al día por 2 semanas, con reducción gradual hasta que la suspendió pasados 2 meses; se dejó también esomeprazol a 40mg cada 12 h por 2 meses; luego se redujo la dosis a 40mg día. Recibió también 2 viales de hierro parenteral carboximaltosa por la anemia severa.
Por los hallazgos biliares en la enterorresonancia se le realizaron pruebas hepáticas en las que se evidenció una elevación de bilirrubina total a 2.45mg/dl, con predominio de la directa (1.9mg/dl), fosfatasa alcalina de 802mg/dl, con transaminasas TGP 37 U/I y TGO 50U/I (VR hasta 34). Se decidió realizar una colangiografía retrógrada endoscópica para complementar estudio, además de derivar la vía biliar. En la colangiografía retrógrada endoscópica se confirmó una estenosis de aspecto inflamatorio en colédoco proximal, no se encontraron otras áreas estenóticas, ni arrosaramiento en las vías biliares intrahepáticas; se derivó la vía biliar mediante la colocación de un stent plástico de 10 cm×10 Fr. Se dejó ácido ursodesoxicólico a 10mg/kg al día por la alta sospecha de colangitis esclerosante primaria.
Estuvo hospitalizada durante 58 días en salas generales. Por su pésimo estado nutricional, el grupo de soporte nutricional le dejó tratamiento con dieta hipercalórica, astringente, adicionalmente con nutrición parenteral total intrahospitalaria para aportar 1,737kcal/día y 1.44 g/kg de proteínas. Tuvo una recuperación nutricional aceptable; en el momento del egreso su peso corporal era de 43kg y presentaba mejoría en sus parámetros nutricionales con hemoglobina de 10.1 g/dl, hematocrito de 31% y albúmina de 3.4mg/dl.
En el seguimiento ambulatorio, a los 2 meses del egreso hospitalario la paciente se sentía mejor, con buena tolerancia oral, sin más episodios eméticos y sin nuevos episodios de diarrea. Había aumentado 2kg de peso. Con cálculo de CDAI de 135. Se le dejó tratamiento de mantenimiento con el infliximab a 5mg/kg cada 2 meses y ácido ursodesoxicólico. Se le dio orden de retiro del stent biliar plástico.
ComentarioLa localización de la enfermedad de Crohn esofagogastroduodenal es rara. Algunos autores han descrito que estos pacientes podrían tener un peor pronóstico3,4. Los estudios endoscópicos han demostrado que el antro y el duodeno son las áreas más afectadas en la enfermedad de Crohn proximal5. Los hallazgos endoscópicos son variables, desde eritema parcheado, engrosamiento nodular y manchas eritematosas focales hasta varios grados de úlceras superficiales o profundas; en el duodeno es común encontrar engrosamiento irregular, apariencia de adoquín, lesiones polipoides y ulceraciones focales6. Las muescas de Kerckring pueden ser el único signo patognomónico del compromiso superior en la enfermedad de Crohn7.
Cuando el compromiso del tracto digestivo es proximal, el diagnóstico diferencial es amplio. Si las lesiones se encuentran en el esófago, se debe diferenciar con la estenosis secundaria a reflujo gastroesofágico, tumor, fístula, absceso mediastinal y tuberculosis. En el estómago, con gastritis por Helicobacter pylori (H. pylori), gastritis granulomatosa, granulomatosis con poliangeítis y otros tipos de vasculitis. Se debe siempre descartar adenocarcinoma, linitis plástica, linfoma y otras malignidades que comprometen el tracto digestivo superior7. Respecto a la histología, lo más frecuente es encontrar una gastritis linfocítica focal o difusa, sin la presencia de H. pylori. La detección de granulomas, que es el dato anatomopatológico más específico, se encuentra solo en el 30% de los casos. En el duodeno, se debe descartar la presencia de infecciones como tuberculosis, sífilis, enfermedad de Whipple y neoplasias, como adenocarcinoma y linfoma MALT como principales diagnósticos diferenciales8.
En el caso mencionado, la sospecha inicial por los hallazgos endoscópicos fue neoplasia gástrica localmente avanzada versus linfoma; sin embargo, la evolución clínica sumada a la evaluación endoscópica detallada, los hallazgos radiológicos y la exclusión de diagnósticos diferenciales permitieron el diagnóstico final de una enfermedad de Crohn con compromiso esofagogastroduodenal.
En este caso, también hubo compromiso de la vía biliar extrahepática proximal, por lo cual se sospechó de colangitis esclerosante primaria (dado el contexto clínico de enfermedad de Crohn sumado a colestasis y a la presencia de estenosis inflamatoria en las imágenes). En este sentido, se debe hacer un seguimiento estricto a futuro, ya que la colangitis esclerosante primaria se considera una manifestación extradigestiva poco común en Crohn.
Responsabilidades éticasLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que se ha preservado en todo momento su anonimato.
El consentimiento informado no se solicitó para la publicación de este caso, porque en el presente artículo no se publican datos personales que permitan identificar al paciente.
FinanciaciónEl manuscrito no fue patrocinado.