Dolor torácico no cardíaco (DTNC) se define como un síndrome clínico caracterizado por dolor retroesternal semejante a la angina de pecho, pero de origen no cardiaco y generado por enfermedades esofágicas, osteomusculares, pulmonares o psiquiátricas.
ObjetivoPresentar una revisión consensuada basada en evidencias sobre definición, epidemiología, fisiopatología, diagnóstico y opciones terapéuticas para pacientes con DTNC.
MétodosTres coordinadores generales realizaron una revisión bibliográfica de todas las publicaciones en inglés y español sobre el tema y elaboraron 38 enunciados iniciales divididos en tres categorías principales: 1)definiciones, epidemiología y fisiopatología; 2)diagnóstico, y 3)tratamiento. Los enunciados fueron votados (3rondas) utilizando el sistema Delphi, y los que alcanzaron un acuerdo >75% fueron considerados y calificados de acuerdo con el sistema GRADE.
Resultados y conclusionesEl consenso final incluyó 29 enunciados Todo paciente que debuta con dolor torácico debe ser inicialmente evaluado por un cardiólogo. La causa más común de DTNC es la enfermedad por reflujo gastroesofágico (ERGE). Como abordaje inicial, si no existen síntomas de alarma, se puede dar una prueba terapéutica con inhibidor de bomba de protones (IBP) por 2-4semanas. Si hay disfagia o síntomas de alarma, se recomienda hacer una endoscopia. La manometría de alta resolución es el mejor método para descartar trastornos motores espásticos y acalasia. La pHmetría ayuda a demostrar exposición esofágica anormal al ácido. El tratamiento debe ser dirigido al mecanismo fisiopatológico, y puede incluir IBP, neuromoduladores y/o relajantes de músculo liso, intervención psicológica y/o terapia cognitiva, y ocasionalmente cirugía o terapia endoscópica.
Non-cardiac chest pain is defined as a clinical syndrome characterized by retrosternal pain similar to that of angina pectoris, but of non-cardiac origin and produced by esophageal, musculoskeletal, pulmonary, or psychiatric diseases.
AimTo present a consensus review based on evidence regarding the definition, epidemiology, pathophysiology, and diagnosis of non-cardiac chest pain, as well as the therapeutic options for those patients.
MethodsThree general coordinators carried out a literature review of all articles published in English and Spanish on the theme and formulated 38 initial statements, dividing them into 3 main categories: (i)definitions, epidemiology, and pathophysiology; (ii)diagnosis, and (iii)treatment. The statements underwent 3rounds of voting, utilizing the Delphi system. The final statements were those that reached >75% agreement, and they were rated utilizing the GRADE system.
Results and conclusionsThe final consensus included 29 statements. All patients presenting with chest pain should initially be evaluated by a cardiologist. The most common cause of non-cardiac chest pain is gastroesophageal reflux disease. If there are no alarm symptoms, the initial approach should be a therapeutic trial with a proton pump inhibitor for 2-4weeks. If dysphagia or alarm symptoms are present, endoscopy is recommended. High-resolution manometry is the best method for ruling out spastic motor disorders and achalasia and pH monitoring aids in demonstrating abnormal esophageal acid exposure. Treatment should be directed at the pathophysiologic mechanism. It can include proton pump inhibitors, neuromodulators and/or smooth muscle relaxants, psychologic intervention and/or cognitive therapy, and occasionally surgery or endoscopic therapy.
El dolor torácico no cardíaco (DTNC) es una condición manifestada por un cuadro clínico indistinguible del ocasionado por enfermedad isquémica coronaria. Aunque no se traduce en una mortalidad aumentada, se asocia a una mayor utilización de los servicios médicos y a menor calidad de vida1. Existe múltiple evidencia, guías y consensos sobre dolor torácico de origen cardiovascular2-4, pero no hay consensos previos sobre el DTNC. Varias guías clínicas mencionan el tema como parte de la evaluación de otros tópicos como trastornos motores del esófago (TME), enfermedad por reflujo gastroesofágico (ERGE) y manometría esofágica. Sin embargo, la mayor parte de la información general proviene de artículos de revisión, y la evidencia de utilidad de métodos diagnósticos y tratamientos es indirecta o ha sido extrapolada a las causas de DTNC (p.ej.: ERGE, TME). Paulatinamente ha empezado a surgir evidencia sobre la utilidad de cada prueba diagnóstica y tratamientos en esta entidad. La Asociación Mexicana de Gastroenterología (AMG) convocó a un grupo de expertos sobre el tema con el propósito de establecer recomendaciones basadas en una extensa revisión de la bibliografía y producir un documento sobre definiciones, epidemiología, fisiopatología, diagnóstico y tratamiento del DTNC de utilidad para la comunidad médica.
MétodosPara el desarrollo del presente consenso se utilizó el proceso Delphi5. Los pasos principales de este proceso fueron los siguientes: a)selección del grupo de consenso; b)identificación de áreas de importancia clínica; c)revisión sistemática de la literatura para identificar la evidencia de apoyo a los enunciados; d)elaboración de enunciados, y e)rondas de votación anónima por vía electrónica con discusión y análisis de resultados, corrección y modificación de enunciados.
Se designaron tres coordinadores generales del consenso (MAB, ECA y OGE) y se invitó a 17gastroenterólogos especialistas en motilidad gastrointestinal y/o neurogastroenterología, así como especialistas afines al tema en cuestión (cardiólogos), quienes aceptaron participar en el consenso y en la elaboración de este documento. Los coordinadores generales realizaron una búsqueda exhaustiva en las siguientes bases de datos: CENTRAL (the Cochrane Central Register of Controlled Trials), MEDLINE (PubMed), EMBASE (Ovid), LILACS, CINAHL, Bioma Central y World Health Organización International Clinical Trials Registry Platform (ICTRP). La búsqueda comprendió el período del 1 de enero de 2000 al 31 de marzo de 2018. En PubMed la búsqueda se amplió 20años atrás, hasta 1980. Los criterios de búsqueda incluyeron los siguientes términos: «dolor torácico» (chest pain, thoracic pain), «dolor torácico no cardíaco» (non-cardiac chest pain, noncardiac chest pain), «dolor torácico de origen esofágico» (chest pain of esophageal origin o presumed esophageal origin), combinados con los siguientes términos: «epidemiology», «incidence», «prevalence», «pathophysiology», «pathogenesis», «evaluation», «diagnostic tests», «endoscopy», «biopsies», «pH monitoring», «impedance», «esophageal manometry», «high-resolution esophageal manometry», «differential diagnosis», «treatment», «therapy», «management», «surgery», «review», «guidelines», «consensus», «systematic», «meta-analysis», así como los términos equivalentes en español. Se incluyeron artículos en inglés y en español. Toda la bibliografía se puso a disposición de los miembros del consenso en línea mediante un acceso con palabra clave a Google Drive para que se pudiera revisar en cualquier momento a lo largo del proceso.
Posteriormente, los coordinadores generales elaboraron 38 enunciados, los cuales se sometieron a una primera votación anónima vía electrónica (15 al 22 de mayo de 2018), cuya finalidad fue evaluar la redacción y el contenido. Los participantes del consenso emitieron su voto considerando las siguientes respuestas y criterios: a)totalmente de acuerdo (se refiere a que usted acepta por completo la redacción, el contenido y el concepto del enunciado); b)parcialmente de acuerdo (se refiere a que usted acepta el enunciado, pero propone cambios en la redacción y/o el contenido, aunque está de acuerdo con el concepto general); c)incierto (el contenido del enunciado no es suficiente para que usted lo acepte o no); d)parcialmente en desacuerdo (se refiere a que usted no acepta el enunciado debido principalmente a discrepancias con la redacción y/o el contenido, y realizando las modificaciones usted acepta el enunciado), y e)totalmente en desacuerdo (se refiere a que de ninguna manera acepta el concepto, el contenido ni la redacción del enunciado).
Terminada la primera votación, los coordinadores realizaron las modificaciones correspondientes a cada enunciado de acuerdo con los resultados y comentarios de los participantes. Los enunciados que alcanzaron un acuerdo total >75% se mantuvieron y los que tuvieron un desacuerdo total >75% se eliminaron. Los enunciados que tuvieron <75% de acuerdo total y <75% de desacuerdo total se revisaron y reestructuraron considerando los comentarios de los participantes. Además, a cada uno de los nuevos enunciados se les estableció un grado de recomendación y se evalúo la calidad de la evidencia para sustentar dicha recomendación empleando el sistema Grading of Recommendations Assessment, Development and Evaluation (GRADE) 6-8. En el sistema GRADE, la calidad de la evidencia no se califica únicamente con base en el diseño o la metodología de la investigación, sino que se juzga en función de una pregunta claramente planteada con relación a una variable de desenlace también claramente formulada. Sobre estas bases, la evidencia puede ser alta, moderada, baja o muy baja. Para el propósito de la escala GRADE se denomina calidad «alta» cuando mayor investigación es poco probable que cambie el efecto estimado, «moderada» cuando mayor investigación probablemente cambie el efecto estimado, «baja» cuando mayor investigación muy probablemente cambie el efecto estimado, y «muy baja» cuando el efecto estimado es incierto. Además, el sistema GRADE establece la fuerza de las recomendaciones en «fuerte» o «débil», «a favor» o «en contra» de la intervención o del enunciado. La fuerza de recomendación puede ser «fuerte» (cuando aplica a la mayoría de los pacientes la mayoría del tiempo) o «débil» (cuando aplica solo a un subgrupo de pacientes). La denominación «a favor/ en contra del enunciado» se aplicó para definiciones, fisiopatología y descripción de técnicas, y «a favor/ en contra de la intervención» se aplicó para pruebas diagnósticas y tratamiento. El sistema GRADE se expresa empleando un código que usa letras mayúsculas para hablar de la calidad de la evidencia, seguidas de un índice numérico para indicar la fuerza de la recomendación a favor o en contra de la intervención o enunciado. El sistema GRADE se muestra en la tabla 1.
Clasificación de la evidencia y fuerza de la recomendación según el sistema GRADE
| Calidad de la evidencia | |
| Alta | Mayor investigación es poco probable que cambie el efecto estimado (código A) |
| Moderada | Mayor investigación es probable que cambie el efecto estimado (código B) |
| Baja | Mayor investigación es muy probable que cambie el efecto estimado (código C) |
| Muy baja | El efecto estimado es incierto (código D) |
| Fuerza de recomendación | |
| Fuerte | Aplica a la mayoría de los pacientes la mayoría del tiempo (código 1) |
| Débil | Aplica solo a algunos pacientes (código 2) |
| A favor / en contra del enunciado | |
| Definiciones, epidemiología, fisiopatología, descripción técnica | |
| A favor / en contra de la intervención | |
| Pruebas diagnósticas, tratamiento | |
Los enunciados revisados y calificados de acuerdo con el sistema GRADE se sometieron a una segunda votación anónima por vía electrónica (15 al 22 de junio de 2018) y los resultados se presentaron el día 29 de agosto de 2018 en una reunión presencial realizada en las oficinas de la AMG en la ciudad de México. En esta reunión, los enunciados que obtuvieron un acuerdo >75% fueron ratificados. Los enunciados que no hubiesen alcanzado un 75% de acuerdo en las votaciones previas se discutieron con la finalidad de tratar de llegar a un acuerdo o, en caso contrario, eliminarlos, y se volvieron a votar (tercera votación).
Una vez acordados todos los enunciados que formarían parte del consenso, los coordinadores elaboraron el presente manuscrito final, el cual fue revisado y aprobado por todos los miembros del consenso. Se invitó como revisor técnico del documento a un experto mundial sobre el tema (SRA) para la revisión final del manuscrito.
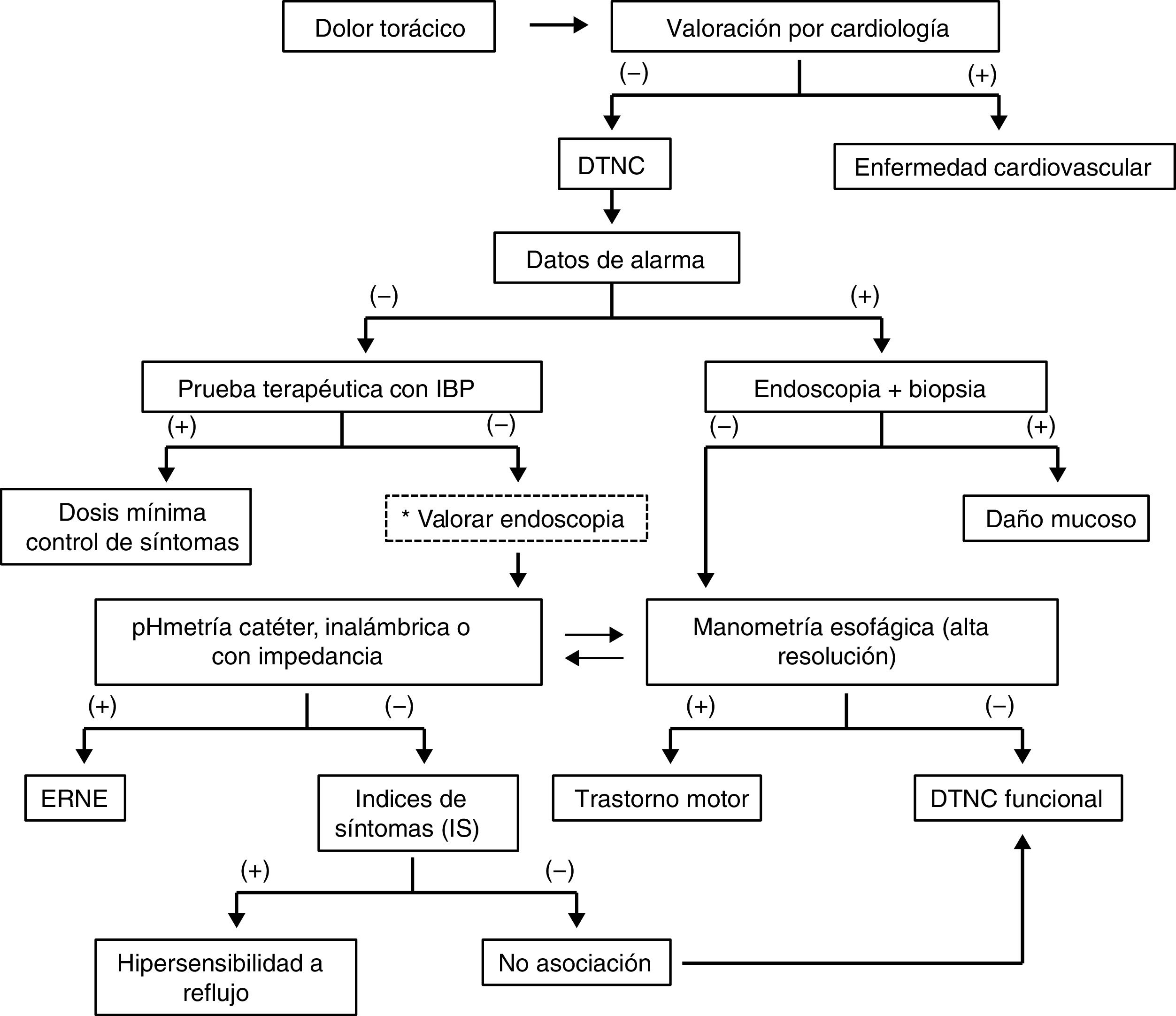
ResultadosEn un principio los coordinadores elaboraron 38 enunciados. En la primera votación electrónica se eliminaron4 por no alcanzar consenso o por sugerencia de fusionar dos enunciados en uno solo. Para la segunda votación electrónica se incluyeron 34 enunciados, mismos que fueron ratificados para la votación presencial. A la votación presencial final asistieron 19 de los 20 miembros del consenso (95%), y de los 34 enunciados finales presentados durante la votación, 2 se eliminaron y 3 se fusionaron, de tal forma que el consenso final consta de 29 enunciados. A continuación se presentan los enunciados finales y los resultados de dicha votación. En la tabla 2 se resumen los resultados generales del consenso junto con las recomendaciones derivadas de cada enunciado. Durante la votación presencial se diseñó y consensuó también un algoritmo diagnóstico, el cual se presenta en la figura 1.
Resumen de las recomendaciones sobre diagnóstico y tratamiento
| Tópico | Enunciado | Porcentaje total de acuerdo | Recomendación |
|---|---|---|---|
| Diagnóstico | 10. Las características clínicas del dolor torácico cardíaco o no cardíaco son muy similares, por lo que es difícil diferenciar desde el punto de vista clínico su etiología, y deben ser evaluadas en primera instancia por un cardiólogo | 90.91% | Se recomienda evaluación inicial por el cardiólogo en todo paciente que debuta con dolor torácico (B1 fuerte a favor de la intervención) |
| 11. Una vez descartada una causa cardiovascular, se deben investigar otras, tales como alteraciones musculoesqueléticas, pulmonares, gastrointestinales —incluyendo trastornos esofágicos— y psiquiátricas | 90.91% | Una vez descartado el problema cardiovascular, proceder al abordaje diagnóstico diferencial, empezando por las causas más comunes (esofágicas) (C1 fuerte a favor de la intervención) | |
| 12. El esofagograma con bario tiene un rendimiento diagnóstico pobre en la evaluación del DTNC. Puede usarse en casos asociados a disfagia | 81.82% | Considerar para valoración estructural si existe disfagia; no usar para diagnóstico de ERGE o trastornos motores (C1 fuerte a favor de la intervención) | |
| 13. Las pruebas provocadoras de dolor, dismotilidad o hipersensibilidad esofágica se encuentran poco disponibles y están limitadas a estudios de investigación | 90.91% | Utilidad en escenarios clínicos seleccionados, no recomendadas para uso general (C2 débil en contra de la intervención) | |
| 14. La prueba terapéutica con inhibidor de bomba de protones a dosis doble es útil para identificar pacientes con DTNC secundario a ERGE | 90.91% | Recomendada como prueba inicial en todo paciente sin síntomas de alarma (A1 fuerte a favor de la intervención) | |
| 15. La endoscopia tiene un rendimiento diagnóstico bajo en el DTNC, por lo que debe realizarse en pacientes con signos o síntomas de alarma | 86.36% | Recomendada cuando hay falla a tratamiento o hay síntomas de alarma (A1 fuerte a favor de la intervención) | |
| 16. Las biopsias esofágicas en el DTNC son de utilidad para establecer el diagnóstico diferencial con otras entidades como esofagitis eosinofílica, infecciones y ante la sospecha de esófago de Barrett | 90.91% | Solo tomar biopsias para confirmar diagnóstico histológico diferencial, no para confirmar ERGE (B1 fuerte a favor de la intervención) | |
| 17. La pHmetría de 24 h con catéter o cápsula inalámbrica y la pHmetría con impedancia son las pruebas más útiles para detectar ERGE como causa de DTNC | 86.36% | Recomendadas para confirmar exposición esofágica al ácido o, en el caso de impedancia, a reflujo no ácido o refractario (A1 fuerte a favor de la intervención) | |
| 18. Los índices de asociación sintomática evaluados durante pHmetría ambulatoria incrementan el rendimiento diagnóstico de la prueba en la detección de DTNC secundario a ERGE | 81.82% | Requieren al menos tres episodios de cada síntoma, solo síntomas relacionados a ERGE, único parámetro para diferenciar hipersensibilidad a reflujo de dolor funcional (C1 fuerte a favor de la intervención) | |
| 19. La manometría esofágica es la prueba más útil para detectar trastornos motores como causa de DTNC | 77.27% | Se recomienda para descartar trastornos motores esofágicos espásticos asociados a dolor y a ERGE (B1 fuerte a favor de la intervención) | |
| 20. Se recomienda la evaluación psiquiátrica en los pacientes con DTNC con pruebas negativas y que no responden a una intervención terapéutica | 90.91% | Se recomienda referir a un psicólogo o psiquiatra en casos de sospecha de trastorno psiquiátrico o cuando evaluación es normal (B1 fuerte a favor de la intervención) | |
| Tratamiento | 21. En forma ideal, el tratamiento del DTNC debe ser dirigido al mecanismo fisiopatológico subyacente (p.ej.: reflujo gastroesofágico, dismotilidad esofágica, hipersensibilidad, comorbilidad psiquiátrica) | 94.45% | Establecer un plan de manejo en base al mecanismo involucrado (B1 fuerte a favor de la intervención) |
| 22. El tratamiento con IBP está indicado cuando se ha documentado ERGE como causa del DTNC | 90.91% | Independientemente de la prueba terapéutica, se recomienda el uso de IBP como tratamiento del DTNC cuando se documente ERGE mediante endoscopia o pHmetría (A1 fuerte a favor de la intervención) | |
| 23. Se recomienda tratamiento a doble dosis de IBP durante al menos 2 meses para el DTNC relacionado con ERGE | 95.45% | Se recomienda IBP 40 mg dos veces al día o equivalente por al menos 8 semanas, con las mismas consideraciones de horario de ERGE típico (B1 fuerte a favor de la intervención) | |
| 24. Los relajantes de músculo liso, como los donantes de óxido nítrico, los antagonistas del calcio y los anticolinérgicos se utilizan en el DTNC asociado a trastornos motores espásticos, pero su eficacia es limitada y se asocian a efectos adversos | 81.82% | Útiles a corto plazo para DTNC asociado a trastornos motores espásticos no candidatos a otros tratamientos, o como puente antes de la terapia definitiva; ajustar dosis en base a la respuesta y a los efectos adversos (C2 débil a favor de la intervención) | |
| 25. La inyección transendoscópica de toxina botulínica es una alternativa para el tratamiento del DTNC asociado a trastornos espásticos del esófago en pacientes que no son candidatos a miotomía o dilatación neumática | 95.45% | Mismas indicaciones que con relajantes de músculo liso: como medida temporal antes de terapia definitiva o en casos cuya terapia más invasiva está contraindicada. Evitar múltiples administraciones si se considera efectuar terapia definitiva posterior (B2 fuerte a favor de la intervención) | |
| 26. La miotomía peroral endoscópica es una opción terapéutica en el DTNC para pacientes seleccionados con trastornos espásticos del esófago | 90.91% | Se recomienda como medida definitiva en trastornos motores espásticos y solo en centros con experiencia y por personal calificado (B1 fuerte a favor de la intervención) | |
| 27. Los neuromoduladores del dolor visceral son útiles en el DTNC funcional cuando no hay respuesta satisfactoria con otros tratamientos | 95.45% | Se recomienda el uso de imipramina, amitriptilina, paroxetina o sertralina a dosis baja como neuromodulador en dolor funcional (B1 fuerte a favor de la intervención) | |
| 28. La terapia cognitivo conductual, la hipnoterapia, la biorretroalimentación y la terapia Johrei son alternativas en casos refractarios o complementarias a otras modalidades de tratamiento del DTNC | 95.45% | Terapia cognitivo conductual (B1 fuerte), hipnoterapia (B2 débil) y biorretroalimentación (C2 débil) deben ser administradas por personal calificado. Medicina alternativa (Terapia Johrei: C2 débil) | |
| 29. La cirugía como tratamiento del DTNC se basa en la miotomía del segmento esofágico afectado y se limita a trastornos espásticos del esófago. Debe ser realizada por un cirujano experto y en casos altamente seleccionados | 90% | Se recomienda miotomía longitudinal extendida previa documentación de la extensión del área de espasticidad por manometría de alta resolución, en casos sin respuesta, y practicada por un cirujano calificado (C2 débil a favor de la intervención) |
- 1.
El dolor torácico de origen no cardíaco se define como la presencia de dolor recurrente retroesternal en el que la etiología cardiovascular ha sido descartada de manera objetiva por un cardiólogo.
Calidad de la evidencia y fuerza de la recomendación: C1 fuerte a favor del enunciado.
Acuerdo: Totalmente de acuerdo 82%, parcialmente de acuerdo 14%, incierto 4%.
El dolor torácico de origen no cardiaco (DTNC) se caracteriza por la presencia de dolor localizado al área retroesternal. Su presentación clínica es indistinguible del dolor de origen cardiaco, lo cual puede derivar en numerosos estudios, en parte debido a que algunos pacientes tienden a amplificar sus síntomas y utilizan palabras más sensoriales y afectivas que los pacientes con enfermedad cardiaca, lo que alerta al clínico en la valoración inicial1,8. Todos los pacientes que presentan por primera ocasión dolor retroesternal —aunque no sea necesariamente precordial— requieren una valoración cardiológica debido a la necesidad de descartar enfermedad coronaria, que tiene una morbimortalidad importante en comparación de la condicionada por la patología esofágica9. Los síntomas del DTNC pueden ser similares a los de angina, con dolor opresivo en el tórax que irradia a espalda, cuello, brazos y mandíbula, por lo que esta irradiación no ayuda a diferenciar la causa del origen del dolor10. Los síntomas típicos de dolor torácico de origen cardiaco están caracterizados por dolor o malestar retroesternal, percibidos como opresión o pesadez con una duración de 5-15min y tradicionalmente son inducidos por la actividad física, el estrés, la ingestión abundante de alimentos, la exposición al frío y mejoran con el reposo o con el uso de nitroglicerina. Una vez que se descarta enfermedad coronaria aguda, la siguiente valoración es descartar enfermedad cardíaca crónica, lo cual incluye un electrocardiograma y prueba de esfuerzo, y puede requerir angiografía coronaria, angio-TAC o estudios complementarios, y la decisión de los mismos debe ser decidida por el cardiólogo tratante4. Hay que tener en consideración que enfermedad coronaria y esofágica pueden coexistir, por lo que algunos expertos en el pasado sugirieron utilizar el término «dolor torácico inexplicable» para referirse al DTNC11. En algunos casos la génesis del dolor puede no llegar a ser elucidada con la tecnología actual o por no contar en todos los niveles de atención con los estudios necesarios para diagnosticar la patología de base, pero estos pacientes deben ser evaluados siempre en primera instancia por un cardiólogo para la realización de los estudios que considere pertinentes para excluir enfermedad cardíaca.
Punto clave: El dolor retroesternal solo se puede considerar como de origen no cardíaco una vez que la etiología cardiovascular ha sido descartada objetivamente por un cardiólogo.
- 2.
El DTNC de probable origen esofágico puede dividirse en tres grupos: asociado a ERGE, asociado a trastornos motores y relacionado con hipersensibilidad esofágica.
Calidad de la evidencia y fuerza de la recomendación: C1 fuerte a favor del enunciado.
Acuerdo: Totalmente de acuerdo 91%, parcialmente de acuerdo 9%.
Los mecanismos principales del DTNC incluyen la ERGE, los trastornos de la motilidad esofágica (TME) y la hipersensibilidad esofágica. La ERGE es la causa más común de DTNC, las alteraciones en la motilidad afectan a una minoría de pacientes y la hipersensibilidad esofágica puede estar presente en pacientes con o sin ERGE o TME12-14. Cerca del 50% de los pacientes con DTNC tienen exposición esofágica al ácido (EEA) anormal medida por pHmetría de 24h15, y entre el 15 y el 30% tienen alteraciones en la manometría esofágica16,17.
La hipersensibilidad visceral es un fenómeno en el cual la percepción generada por un estímulo se encuentra incrementada independientemente de la intensidad del mismo18. Varios estudios han demostrado la presencia de hipersensibilidad esofágica en pacientes con DTNC, independientemente de si existe ERGE o un TME. Nasr et al.19 evaluaron 332 pacientes con DTNC sin evidencia de patología esofágica estructural, llevando a cabo una prueba de distensión con balón esofágico durante la cual el 37% manifestaron hipersensibilidad y el 75% reprodujeron su dolor torácico, por lo que los autores concluyeron que uno de cada tres sujetos con DTNC tienen hipersensibilidad visceral. Este mecanismo del DTNC es importante porque existen neuromoduladores que pueden aumentar los umbrales perceptivos y mejorar la hipersensibilidad.
Punto clave: Las tres principales causas de dolor retroesternal de origen esofágico, que es la principal etiología del DTNC, son la ERGE, los trastornos motores y la hipersensibilidad visceral, los cuales pueden coexistir.
- 3.
La causa más común de DTNC de origen esofágico es la ERGE.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado.
Acuerdo: Totalmente de acuerdo 100%.
El término DTNC se aplica cuando la etiología cardiaca se ha excluido. Dentro de las causas no cardíacas de dolor retroesternal, las esofágicas ocupan el primer lugar, con el 80.5% de las causas, y de estas, la más común es la ERGE1,10,11. Algunas revisiones mencionan el término «dolor torácico de probable origen esofágico» para denotar esta fuerte asociación, y la mayor parte de la literatura sobre el tema sugiere que ERGE es la primera etiología que se debe buscar una vez que se ha descartado patología cardíaca14,15. Locke et al.20 demostraron que el 37% de los pacientes que tienen pirosis ≥1 vez por semana reportan dolor retroesternal como un síntoma secundario, al igual que el 30% de aquellos con <1episodio de pirosis por semana, comparado con solo el 8% de aquellos sin pirosis. Otros trabajos han reportado una asociación desde el 60 hasta el 90% de síntomas típicos de ERGE en pacientes con DTNC21,22. No solo se ha establecido una asociación entre síntomas de ERGE y DTNC, sino que los estudios objetivos de medición ácida como pHmetría de 24h han documentado también una prevalencia mayor de ERGE en pacientes con DTNC, la cual varía del 48 al 70%23,24. En la actualidad la ERGE es el mecanismo fisiopatológico principal que contribuye al DTNC, considerándose al dolor retroesternal como una manifestación atípica de la enfermedad25.
Punto clave: Al menos la mitad de los casos de DTNC están asociados a ERGE. El DTNC puede manifestarse con o sin síntomas clásicos de ERGE, como pirosis o regurgitación.
- 4.
El dolor torácico funcional se define como dolor retroesternal recurrente de probable origen esofágico que no se asocia a ERGE, a problemas motores esofágicos ni a afecciones de la mucosa.
Calidad de la evidencia y fuerza de la recomendación: C1 fuerte a favor del enunciado.
Acuerdo: Totalmente de acuerdo 91%, parcialmente de acuerdo 9%.
El dolor torácico funcional entra dentro del contexto de los trastornos funcionales esofágicos catalogados por el consenso de RomaIV, el cual lo define como la presencia de dolor retroesternal recurrente, no explicado dentro de las bases de la ERGE, trastornos motores o enfermedades de la mucosa esofágica, y donde no existe alguna etiología orgánica que lo condicione26. Por tanto, estos pacientes requieren tener evaluación cardíaca negativa, así como endoscopia, pruebas para reflujo (pHmetría o pHmetría-impedancia) y manometría esofágica normales. A este grupo pertenecen también la pirosis funcional, la hipersensibilidad al reflujo, el globus esofágico y la disfagia funcional26, que son otros padecimientos con pruebas estructurales y fisiológicas negativas27. La prevalencia de dolor torácico funcional no se conoce completamente; algunos estudios la estiman entre el 19 y el 33% de las causas de DTNC, aunque en varios de estos trabajos se incluyeron otras causas de dolor torácico, como ERGE, TME y esofagitis eosinofílica, por lo que la prevalencia real parece ser menor28.
Punto clave: El dolor funcional esofágico requiere que se excluyan causas estructurales, mucosas, reflujo y trastornos motores.
- 5.
La prevalencia de DTNC a nivel mundial es del 13 al 30%. En México fluctúa entre el 1.9 y el 8%, y se desconoce la incidencia.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado.
Acuerdo: Totalmente de acuerdo 90%, parcialmente de acuerdo 5%, totalmente en desacuerdo 5%.
- 6.
El DTNC es más común en personas jóvenes. En México es discretamente más frecuente en mujeres.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado.
Acuerdo: Totalmente de acuerdo 76%, parcialmente de acuerdo 14%, incierto 10%.
La epidemiología del DTNC no ha sido completamente estudiada. Estudios provenientes de Estados Unidos estiman que el 23% de las personas llegan a presentar este síntoma alguna vez en su vida29, y en Australia existen reportes de prevalencias que alcanzan hasta el 39%30, con igual distribución de género en aquellos países. En México, estudios epidemiológicos utilizando los criterios de RomaII han encontrado una prevalencia del 8.3% (IC95%: 5.7-11.9) en población sana de la Ciudad de México31, y del 3% (IC95%: 1.7-4.9) en el estado de Tlaxcala32. Recientemente, utilizando los criterios de RomaIII se encontró una prevalencia del 1.83% en población abierta (IC95%: 1.5-2.42), con una edad promedio de presentación de 41.1±11.9 y con una predominancia en el género femenino (61%). A nivel mundial, como se mencionó previamente, no se han encontrado diferencias significativas en cuanto al género, pero se debe tener en consideración que las mujeres buscan atención médica con mayor frecuencia, lo cual podría explicar estas diferencias. Estudios epidemiológicos han reportado una disminución en la presentación con el incremento en la edad, con tasas más altas en mujeres <25años de edad y entre los 45 y 55años30. Rao et al.33 evaluaron los efectos de la edad y del género en las propiedades biomecánicas y en la sensibilidad esofágica y no encontraron cambios asociados al género en diámetro, distensibilidad muscular y umbrales sensoriales. En contraste, los sujetos de mayor edad presentan cambios en el diámetro, mayor rigidez de la pared y mayores umbrales al dolor (p<0.05), por lo que el envejecimiento, pero no el género, parece influir en la función esofágica. Finalmente, se ha descrito una menor calidad de vida en los pacientes con DTNC30.
Punto clave: La prevalencia del DTNC es variable; no existe diferencia de acuerdo con el género, aunque en México parece ser más común en mujeres.
- 7.
Los pacientes con DTNC tienen niveles más altos de ansiedad y depresión, lo cual genera un mayor deterioro en la calidad de vida.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado.
Acuerdo: Totalmente de acuerdo 95%, parcialmente de acuerdo 5%.
Entre el 17 y el 75% de los pacientes con DTNC padecen algún trastorno psiquiátrico, más comúnmente ansiedad y depresión34. Este grupo utiliza un nivel desproporcionadamente alto de recursos de salud, acude con mayor frecuencia al servicio de urgencias, requiere múltiples consultas médicas a diferentes especialidades y utiliza un mayor número de medicamentos, incluyendo aquellos para enfermedades cardíacas a pesar de no tener evidencia y/o diagnóstico de esta35. La mayoría de los pacientes con DTNC reportan falta de satisfacción con el tratamiento médico, lo que ocasiona búsqueda frecuente de atención médica y opciones alternativas de tratamiento al no sentir seguridad acerca de su diagnóstico36. Varios estudios han demostrado que las causas de muerte en pacientes con DTNC no están relacionadas con sus síntomas. Wielgosz et al.37 siguieron a 821 pacientes con DTNC durante el lapso de un año, de los cuales el 0.3% falleció, pero ninguna de las causas fue de origen cardiaco, a pesar de que el 67% reportó persistir con dolor torácico durante el período hasta su fallecimiento. En un estudio similar, Potts y Bass38 también siguieron a 46 pacientes durante 11años, y de estos solo el 4.3% murieron de causa cardiovascular, aunque igualmente el 74% reportaron continuar con dolor a lo largo de todo el seguimiento. La comorbilidad psiquiátrica como estrés, ansiedad y depresión son más prevalentes en los pacientes con ERGE, y aproximadamente el 60% reportan empeoramiento de sus síntomas durante episodios de estrés, lo cual se relaciona con aumento en la percepción de los mismos39. Se ha documentado que las comorbilidades psicológicas llevan al paciente a un estado de hipervigilancia de las sensaciones, lo que puede llevar a una respuesta incrementada a un estímulo, o a un aumento o empeoramiento en la intensidad del dolor40,41. Los trastornos psiquiátricos, así como el estrés y el miedo al dolor, se han asociado de manera independiente con una disminución en la calidad de vida. De estos trastornos, la depresión y la ansiedad son los más comunes, con una prevalencia en pacientes con ERGE entre el 30 y el 34%42. Si los síntomas físicos tienen una influencia negativa en el estado mental, la presencia de un síntoma de alarma como dolor torácico, el cual puede asociarse a una condición que puede llegar a ser fatal, contribuye a mayores niveles de estrés, y se ha acuñado el término «cardiofobia» para referirse a esta condición43, la cual se ha reportado hasta en el 50% de los pacientes con DTNC y se asocia también con menor calidad de vida. Zhang et al.44 evaluaron pacientes con ERGE y DTNC, y ERGE y dolor torácico de origen cardíaco, encontrando que los niveles de ansiedad y depresión son los que más se relacionan con una baja calidad de vida en ambos grupos de pacientes, pero particularmente en aquellos con ERGE y DTNC. En México, la encuesta Síntomas Gastrointestinales en México (SIGAME), realizada en diferentes estados en población mexicana, encontró disminución significativa en los puntajes del cuestionario de síntomas gastrointestinales altos Patient Assessment of Gastrointestinal Disorders Symptom Severity Index (PAGI-SYM) en sujetos con dolor retroesternal, con una puntuación global de 76±27, con mayor impacto en vestido (63±23), dieta (77±21) y afección psicológica (68.13±20) (p<0.05), lo cual parece confirmar esta asociación también en nuestra población45.
Punto clave: Independientemente de la causa del DTNC, los pacientes con esta condición presentan más frecuentemente comorbilidad psiquiátrica, la cual, al estar presente, afecta a la calidad de vida en forma importante, aumenta la utilización de recursos de salud y la insatisfacción con el tratamiento.
- 8.
La fisiopatología del DTNC es compleja y puede incluir una serie de factores como exposición esofágica anormal a sustancias ácidas y no ácidas, retardo en el vaciamiento esofágico, hipersensibilidad, trastornos de la motilidad y anormalidades de la circulación esofágica.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado.
Acuerdo: Totalmente de acuerdo 100%.
El DTNC puede ser condicionado por causas gastrointestinales, incluyendo esofágicas, o no relacionadas con el tracto digestivo, como reumatológicas, osteomusculares y pulmonares46-48. Previamente se ha comentado que la causa más común de DTNC de origen esofágico es la ERGE1,10,14,15,21-24. En una revisión, Fass y Dickman49 estiman que en cohortes de DTNC el 50-60% tienen ERGE, el 15-18% dismotilidad esofágica, y entre el 32 y el 35% dolor torácico funcional. Aunque múltiples estudios han demostrado una asociación entre exposición esofágica a sustancias ácidas y no ácidas, el mecanismo de dolor no es claro, pero parece involucrar estimulación de quimiorreceptores y mecanorreceptores. Esto precipita sensibilización esofágica secundaria, sensibilización de aferentes sensoriales que generan respuestas aumentadas a estímulos fisiológicos y patológicos, alodinia secundaria y modulación de la función neural aferente a nivel de la raíz dorsal neural del sistema nervioso central50-52. Estudios con pHmetría e impedancia han reportado que los episodios de reflujo de volumen grande y por mayores períodos de tiempo son más frecuentemente percibidos como dolor que como pirosis53. La relación entre DTNC y trastornos de la motilidad también es compleja, y aunque algunos trastornos, como aperistalsis y motilidad inefectiva, pueden asociarse a retardo en el vaciamiento esofágico y una depuración ácida alterada, los trastornos espásticos pueden involucrar alteración de mecanorreceptores o de la microcirculación esofágica54. De forma similar al ácido, el espasmo y los estímulos mecánicos repetidos pueden sensibilizar nervios aferentes periféricos y disminuir el umbral al dolor55.
Existe una relación compleja entre el esófago y el corazón, ya que ambos órganos comparten inervación sensorial56. La acidificación esofágica genera descenso en el flujo coronario en pacientes con el llamado «síndrome X», un padecimiento caracterizado por síntomas típicos de angina, con prueba de esfuerzo positiva (descenso típico del segmento ST) pero con arterias coronarias angiográficamente normales y sin causas extracardíacas57. La reducción en el flujo sanguíneo coronario precipita dolor típico de angina, sugiriendo la presencia de un reflejo esofagocardíaco mediado por fibras vagales. Así mismo, se ha propuesto que la isquemia esofágica inducida por el espasmo esofágico o la contracción anormal del esófago es una de las causas de dolor58. Los mecanismos fisiopatológicos en dolor torácico funcional son todavía más complejos e involucran una combinación de hipersensibilidad esofágica, sensibilización central y periférica, procesamiento central alterado de estímulos esofágicos, alteraciones en las propiedades mecanofísicas del esófago, desregulación autonómica y comorbilidades psicológicas59.
Punto clave: Diversos mecanismos fisiopatológicos pueden coexistir en el paciente con DTNC, ocasionando sensibilización esofágica originada por estímulos centrales y periféricos.
- 9.
La hipersensibilidad esofágica al reflujo se caracteriza por dolor retroesternal o pirosis, con endoscopia normal, sin esofagitis eosinofílica, sin trastornos motores y con evidencia de síntomas asociados a eventos de reflujo pero con pHmetría (exposición total al ácido) y/o pHmetría con impedancia normales.
Calidad de la evidencia y fuerza de la recomendación: C1 fuerte a favor del enunciado.
Acuerdo: Totalmente de acuerdo 82%, parcialmente de acuerdo 13%, incierto 5%.
La hipersensibilidad al reflujo identifica a pacientes con síntomas esofágicos como pirosis o dolor retroesternal, sin evidencia endoscópica o por pHmetría de reflujo anormal pero con síntomas desencadenados por reflujo fisiológico. Como pruebas adicionales el paciente no debe tener otras enfermedades inflamatorias del esófago, incluyendo esofagitis eosinofílica (EEo), ni un TME. Aunque el mecanismo fisiopatológico principal es hipersensibilidad visceral, en ocasiones es difícil distinguir este grupo de los pacientes con ERGE no erosiva (ERNE) verdaderos, debido a la variabilidad diaria de exposición ácida y de síntomas, y a que puede existir superposición entre ERNE y pirosis funcional27,28. Se ha reportado que <10% de los estudios de pHmetría son consistentes con diagnóstico de hipersensibilidad al reflujo, proporción que aumenta al 36% si la pHmetría se realiza con impedancia60,61. Hasta el 80% de los pacientes con trastornos funcionales esofágicos tienen otra patología funcional asociada a hipersensibilidad visceral, particularmente síndrome de intestino irritable (27%) y distensión abdominal funcional (22%)62.
Punto clave: La hipersensibilidad al reflujo es una condición, antes llamada esófago hipersensible, que forma parte del espectro de la enfermedad por reflujo no erosiva, en la cual la exposición esofágica al ácido es normal pero la asociación sintomática con reflujo fisiológico es positiva.
Diagnóstico- 10.
Las características clínicas del dolor torácico cardíaco o no cardíaco son muy similares, por lo que es difícil diferenciar desde el punto de vista clínico su etiología, y deben ser evaluadas en primera instancia por un cardiólogo.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 91%, parcialmente de acuerdo 9%.
Todo paciente que presente por primera vez dolor torácico debe ser evaluado por un cardiólogo para excluir causas cardíacas10,63-65. La descripción del dolor de pecho o torácico obtenida durante la historia clínica puede ser categorizada como de origen cardíaco o no cardíaco (DTNC)13. Los cardiólogos lo subclasifican en tres subgrupos de acuerdo con la posibilidad de presencia de enfermedad coronaria: angina típica (80-90% probabilidad de enfermedad coronaria obstructiva), angina atípica (40-80% de probabilidad de enfermedad coronaria) y dolor no cardíaco (20-70% de probabilidad de enfermedad coronaria)65. El cuadro de angina típica se caracteriza por sensación de presión o pesantez, duración de 5 a 15min, inducido por estrés o esfuerzo, comida abundante o exposición al frío, y mejora con reposo o tras la administración de nitratos. En la angina atípica se observan al menos dos de los criterios de angina típica, y en el DTNC uno o ningún criterio de angina típica65. Desde el punto de vista fisiológico existe una relación única entre el corazón y el esófago, ya que tienen el mismo origen embrionario, comparten la misma inervación sensitiva y la acidificación del esófago distal puede alterar el flujo coronario y provocar dolor66. Además, la enfermedad coronaria puede coexistir con otros trastornos esofágicos, como ERGE y/o trastornos motores espásticos, que a su vez pueden asociarse con espasmo coronario67,68. El papel del cardiólogo es determinar si el dolor se debe a enfermedad coronaria, y solo después de que el cardiólogo ha confirmado que los síntomas no son asociados a enfermedad isquémica u otra patología cardiovascular, entonces se debe proceder a hacer la evaluación para descartar patología esofágica65.
Punto clave y recomendación: No es posible distinguir en base a la semiología del dolor la causa del mismo, por lo que se recomienda evaluación inicial por el cardiólogo en todo paciente que debuta con dolor torácico.
- 11.
Una vez descartada una causa cardiovascular, se deben investigar otras tales como alteraciones musculoesqueléticas, pulmonares, gastrointestinales —incluyendo trastornos esofágicos— y psiquiátricas.
Calidad de la evidencia y fuerza de la recomendación: C1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 91%, parcialmente de acuerdo 9%.
El diagnóstico diferencial de DTNC es extenso e incluye padecimientos torácicos, vasculares, gastrointestinales, musculoesqueléticos y psiquiátricos69-72. Entre las enfermedades gastrointestinales, ciertamente los padecimientos esofágicos como ERGE y los trastornos motores del esófago, particularmente espásticos, son las causas más comunes. Así mismo deben considerarse otros padecimientos digestivos, como dolor biliar, colecistitis, síndrome de flexura colónica, enfermedad ácido-péptica y pancreatitis. Las causas torácicas incluyen neumonía, pleuresía, embolia pulmonar, neumoperitoneo, mediastinitis y pericarditis. Los padecimientos vasculares no cardíacos, como la disección de la aorta torácica y el síndrome de vena cava superior, son raros. Diversos padecimientos musculoesqueléticos, como costocondritis, fibrositis, enfermedad cervical o torácica, enfermedad de Mondor, síndromes de músculos pectorales, enfermedades esternoclaviculares, síndrome de salida torácica y fibromialgia, pueden ocasionar DTNC, así como padecimientos de tejidos blandos (herpes zóster, enfermedad mamaria) y psiquiátricas (depresión, ansiedad, hipocondriasis)46,69-72. Una revisión y metaanálisis que incluyó 11 estudios y 6,500 pacientes encontró que, tomando en consideración todos los pacientes que llegan con dolor de pecho a médicos de atención primaria, las causas más comunes fueron: síndrome de pared torácica (24.5-49.8%), enfermedades cardiovasculares (13.8-16.1%), enfermedad coronaria estable (6.6-11.2%), síndrome coronario agudo (1.5-3.6%), enfermedades respiratorias (10.3-18.2%), trastornos psicógenos (9.5-18.2%), enfermedades gastrointestinales (5.6-9.7%) y enfermedades esofágicas (6.0-7.1%)69. Una vez excluida la enfermedad cardiovascular, la proporción cambia: un trabajo que evaluó 123 pacientes con DTNC recurrente concluyó que el 80.5% tenían un diagnóstico de probable o posible dolor de origen esofágico, siendo la causa más común ERGE (44.7%), seguido de ERGE con trastorno motor secundario (26.8%)48. El DTNC secundario a causas musculoesqueléticas varía de acuerdo con las series entre el 11 y el 28%, y el hallazgo de estas causas no excluye la coexistencia de otras causas, incluyendo las esofágicas o las pulmonares, por lo que puede requerirse una evaluación multidisciplinaria que incluya al gastroenterólogo, al neumólogo, al reumatólogo, al ortopedista o incluso al neurólogo35,71. Finalmente, cuando la evaluación es negativa, cuando no hay una respuesta a tratamiento o bien existe un trasfondo psicológico, se debe también descartar comorbilidad psiquiátrica72.
Punto clave y recomendación: Dado que el diagnóstico diferencial es extenso, una vez que se ha descartado un problema cardiovascular se debe proceder al abordaje diagnóstico empezando por las causas más comunes (esofágicas), y de estas, la ERGE como primera opción. En algunos casos puede requerirse un abordaje multidisciplinario.
- 12.
El esofagograma con bario tiene un rendimiento diagnóstico pobre en la evaluación de DTNC. Puede usarse en casos asociados a disfagia.
Calidad de la evidencia y fuerza de la recomendación: C1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 82%, parcialmente de acuerdo 13%, parcialmente en desacuerdo 5%.
Los estudios radiológicos contrastados son útiles para la evaluación morfológica del aparato digestivo73. El esofagograma con bario es una prueba para visualizar el esófago y detectar anormalidades macroscópicas o compresiones extrínsecas74. Sin embargo, tiene una baja sensibilidad para detectar inflamación mucosa en el DTNC asociado a ERGE, y hasta el 20% de sujetos sanos pueden tener «reflujo anormal» detectado durante el esofagograma75,76. Un estudio reciente comparó el rendimiento diagnóstico del esofagograma con el estándar de oro, la pHmetría con impedancia, y la sensibilidad, la especificidad y el valor predictivo positivo (VPP) y negativo (VPN) del esofagograma fueron del 46, del 44, del 50 y del 40%, respectivamente; por lo tanto, no se puede establecer un diagnóstico de ERGE mediante esofagograma, independientemente de si el paciente presenta síntomas típicos o DTNC77. Tanto la guía del American College of Gastroenterology78 como la de la AMG79 no recomiendan su uso como prueba diagnóstica de ERGE. Es de mayor utilidad cuando además de dolor el paciente tiene disfagia, ya que puede detectar estrechamiento de la columna de bario a nivel distal, divertículos epifrénicos u otras anormalidades estructurales como membranas, hernias o anillos, pero aun así la endoscopia tiene un rendimiento diagnóstico mayor, y en caso de sospecha de acalasia o de un trastorno motor mayor, el diagnóstico debe ser confirmado mediante manometría esofágica76.
Punto clave y recomendación: Se debe considerar el esofagograma para valoración estructural si existe disfagia. No se recomienda para el diagnóstico de ERGE o de trastornos motores, excepto cuando se sospecha acalasia.
- 13.
Las pruebas provocadoras de dolor, dismotilidad o hipersensibilidad esofágica se encuentran poco disponibles y están limitadas a estudios de investigación.
Calidad de la evidencia y fuerza de la recomendación: C2 débil en contra de la intervención.
Acuerdo: Totalmente de acuerdo 91%, parcialmente de acuerdo 9%.
Existen varias pruebas de estimulación farmacológica de dolor retroesternal, como la prueba de Bernstein (perfusión esofágica de HCl) y edrofonio (estimulación colinérgica), las cuales históricamente han reportado una sensibilidad muy variable, del 6-60% y del 0-55%, respectivamente80. Más recientemente, la prueba de distensión esofágica mediante un balón especialmente diseñado fue evaluada en DTNC en 128pacientes con DTNC sin esofagitis erosiva, TME o ERGE, y demostró hipersensibilidad esofágica en el 37% y dolor reproducible en el 75%19. En los últimos años la planimetría de impedancia, una prueba que evalúa las propiedades sensoriales y biomecánicas (distensibilidad) del esófago, ha sido evaluada en diversos escenarios clínicos, incluyendo trastornos motores del esófago, pero su utilidad real se encuentra aún en investigación81. En resumen, aunque son pruebas que pudieran ser útiles en escenarios clínicos muy seleccionados, se encuentran disponibles en pocos centros, y al presente momento son solo utilizadas con fines de investigación.
Punto clave y recomendación: La baja sensibilidad o disponibilidad de estas pruebas no permite usarlas de manera general, aunque pueden ser útiles en escenarios clínicos seleccionados.
- 14.
La prueba terapéutica con inhibidor de bomba de protones a dosis doble es útil para identificar pacientes con DTNC secundario a ERGE.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 91%, parcialmente de acuerdo 9%.
La llamada «prueba terapéutica con inhibidor de bomba de protones (IBP)» consiste en la administración a corto plazo (7-28días) de un IBP a «dosis alta» (doble dosis, dos veces al día) para identificar pacientes con DTNC secundario a ERGE, previo a una evaluación diagnóstica formal64,76,82. Esta prueba fue descrita originalmente para 7días83,84, aunque estudios posteriores han evaluado la respuesta a 2semanas, o hasta 28días, ya que su utilidad depende de la frecuencia de los síntomas, los cuales, en el caso de dolor torácico, pueden no ser tan frecuentes como pirosis o dispepsia, las otras indicaciones de la prueba con IBP85-89. Existen dos abordajes: la «prueba corta», de 1-28días, y la terapia empírica de 2-3meses, esta última utilizada como tratamiento formal de la ERGE. La prueba corta se considera positiva cuando existe mejoría de al menos el 50% en la intensidad y frecuencia del dolor retroesternal, y ha sido evaluada con casi todos los IBP disponibles en el mercado49,63,64,76,82-92. Dependiendo de la duración de la prueba, la sensibilidad (S) varía del 69 al 95% y la especificidad (E) del 67 al 86%64. Por ejemplo, una prueba de 7días con omeprazol 40mg por la mañana y 20mg por la noche tuvo una S del 78.3%, una E del 85.7% y un valor predictivo positivo (VPP) del 90%85. Un estudio reportó que omeprazol a esta dosis tiene una alta S para predecir exposición esofágica al ácido (S 80, p<0.03)86. La prueba realizada con rabeprazol 20mg dos veces al día durante 7días obtuvo una tasa de mejoría de 75% en pacientes con DTNC secundario a ERGE, comparado con solo el 11% de mejoría en DTNC sin ERGE, versus el 19% del placebo, con una S del 75% y una E del 90%21. Los diversos IBP (rabeprazol, esomeprazol, pantoprazol, lansoprazol) han sido estudiados en su potencial diagnóstico del DTNC. Varios estudios con diseños y muestras variables han evaluado en diferentes poblaciones la S y la E diagnósticas, así como el valor predictivo de estos compuestos. La mayoría de los estudios usaron una dosis doble durante un período de 2-4semanas. La S diagnóstica varía del 78 al 92% y la E, del 62 al 80%, con VPP de 58 y un valor predictivo negativo (VPN) de 9487-89. Esta prueba terapéutica también ha sido evaluada en pacientes con enfermedad coronaria demostrada y persistencia de angina, con mejoría sintomática modesta pero disminución significativa de las visitas a urgencias y hospitalizaciones por dolor agudo90-92. Dos metaanálisis subsecuentes y una revisión sistemática han confirmado estos hallazgos: Cremonini et al.93 incluyeron los resultados de 8estudios paralelos y cruzados, y reportaron un riesgo de persistir con dolor menor con IBP (0.54; IC95%: 0.41-0.71), con un OR diagnóstico de 13.83 (IC95%: 5.48-34.91) al ser comparado contra pHmetría, con un número necesario a tratar (NNT) de 3, una S del 80% y una E del 73%. En otro metaanálisis, Wang et al.94 evaluaron 6trabajos, y el OR diagnóstico fue de 19.35 (IC95%: 8.54-43.84) vs 0.61 (IC95%: 0.20-1.86) de placebo, con una S del 80% y una E del 74%. Una revisión sistemática con 6estudios comparó la respuesta a IBP de acuerdo con la presencia o ausencia de evidencia objetiva de ERGE medida por endoscopia y/o pHmetría de 24h, y se definió respuesta como una ganancia terapéutica >50% sobre placebo. El riesgo de encontrar esta ganancia terapéutica fue de 4.3 (IC95%: 2.8-6.7, p<0.0001) para pacientes con ERGE, y de 0.4 (IC95%: 0.3-0.7, p=0.0004) para pacientes sin ERGE95. La evidencia de todos estos estudios apoya el uso de la prueba terapéutica como un abordaje inicial para identificar a los pacientes con DTNC secundario a ERGE96. La prueba ha sido validada tanto en adultos mayores como en adultos menores de 40años, sin diferencias entre resultados97. Un análisis de costo-efectividad reportó que, debido a sus altas S y E, utilizar la prueba terapéutica como el estudio inicial de un paciente con DTNC puede representar un ahorro efectivo de $573USD en promedio por paciente en evaluación adicional, y se asocia a una reducción del 81% en endoscopias y del 79% en pHmetrías84.
Punto clave y recomendación: Al ser la ERGE la causa más común de DTNC y la prueba terapéutica muy sensible, no invasiva y fácilmente disponible, se recomienda como prueba inicial en todo paciente con DTNC sin síntomas de alarma.
- 15.
La endoscopia tiene un rendimiento diagnóstico bajo en DTNC, por lo que debe realizarse en pacientes con signos o síntomas de alarma.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 86%, parcialmente de acuerdo 9%, parcialmente en desacuerdo 5%.
La endoscopia, en cualquiera de sus modalidades (convencional de luz blanca, o de magnificación con cromoendoscopia convencional o electrónica) es útil para descartar enfermedad orgánica, valorar los fenotipos endoscópicos de ERGE, descartar la presencia de esofagitis eosinofílica (EEo) y otras lesiones mucosas causantes de dolor, incluyendo infecciones o producidas por medicamentos, o incluso lesiones mucosas gástricas proximales causantes de dolor torácico63,76,98,99. En 1990 la American Gastroenterological Association publicó las primeras guías para «dolor torácico de origen esofágico» y recomendó realizar endoscopia en forma rutinaria100. Sin embargo, la evidencia posterior demostró que el rendimiento diagnóstico puede ser variable, y su sensibilidad en el DTNC es baja. Hsia et al.101 evaluaron 100 pacientes con DTNC y encontraron un 24% de estudios con esofagitis erosiva, y en el 38% de los pacientes el estudio fue completamente normal. Un trabajo mexicano publicado por García-Compeán et al.102 evaluó un grupo de pacientes referidos por médicos de otras especialidades al gastroenterólogo por sospecha de ERGE, incluyendo otorrinolaringólogos, neumólogos y cardiólogos, y solo el 10% de los estudios endoscópicos mostraron esofagitis erosiva. Un estudio transnacional que evaluó los resultados de una base de datos de 3,668 pacientes sometidos a endoscopia por DTNC, publicado por Dickman et al.103, encontró una prevalencia de esofagitis erosiva del 19%. Otros hallazgos fueron hernia hiatal (29%), estenosis esofágica (4%) y esófago de Barrett (4.4%), y el 44% de los estudios fueron normales. Estudios similares provenientes de Dinamarca y China han mostrado tasas de esofagitis muy variables (31 y 11%, respectivamente)104,105. En los últimos 15-20años han surgido nuevas tecnologías de aumento de imagen que involucran un mayor número de píxeles, filtros para bloqueos selectivos de longitudes de onda de color (narrow band imaging [NBI] o imagen de banda estrecha, i-SCAN y Fujinon Intelligent Chromo Endoscopy [FICE] o cromoendoscopia inteligente de Fuji), excitación de luz o con potencial de evaluación histológica en tiempo real106-109. Varias de estas tecnologías han demostrado una mayor sensibilidad que la endoscopia convencional para detectar microerosiones (magnificación: S 62%, E 74%; FICE: S 76.9%, E 51.6%; Confocal: S 68-86%, E 72-91%) y metaplasia intestinal (cromoendoscopia con azul de metileno y ácido acético: S 100%, E 66%; NBI: S 100%, E 66%; Confocal: S 98%, E 94%, VPN 98%)106,108,110,111. Sin embargo, los consensos más recientes de ERGE, como el de Porto y Lyon, concluyen que hasta el 15% de la población general puede tener esofagitis gradoA, y que la variabilidad interobservador con esofagitis gradoB es alta, por lo que concluyen que solo la presencia de esofagitis gradoC y/oD debe considerarse diagnóstica de ERGE112,113, por lo que la ganancia en rendimiento diagnóstico con los endoscopios de alta definición puede incluir pacientes con microerosiones que no sean necesariamente la causa de los síntomas del paciente114. Además, el hecho de encontrar erosiones o lesiones ácido-pépticas en la endoscopia no cambia el manejo terapéutico inicial. Esto obedece a que estos enfermos pueden ser tratados empíricamente con un curso de IBP. En resumen, la prevalencia de esofagitis erosiva en el DTNC es muy variable, entre el 10 y el 70% de acuerdo con el tipo de población estudiada y por sesgos de referencia, por lo que en pacientes con DTNC debe realizarse en los que además tengan síntomas de alarma como disfagia, odinofagia persistente, anemia o pérdida de peso, o bien cuando hay falla a una prueba terapéutica con IBP a doble dosis, por un periodo no mayor a 6-8semanas.
Punto clave y recomendación: Es una prueba invasiva y con bajo rendimiento diagnóstico en el DTNC sin otros síntomas. Se recomienda cuando hay síntomas de alarma o falla a prueba terapéutica con IBP.
- 16.
Las biopsias esofágicas en el DTNC son de utilidad para establecer el diagnóstico diferencial con otras entidades, como esofagitis eosinofílica, infecciones y ante la sospecha de esófago de Barrett.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 91%, parcialmente de acuerdo 9%.
La toma de biopsias esofágicas durante una endoscopia debe realizarse cuando existan alteraciones en la mucosa sugestivas de patología infecciosa (p.ej.: Candida albicans, herpes virus), causas inflamatorias (enfermedad de Crohn, radioterapia), lesiones preneoplásicas (metaplasia intestinal, displasia) o neoplasia, y ante la sospecha de esofagitis eosinofílica (EEo)110,115-118. Hasta el 7% de las endoscopias de pacientes con EEo tienen un aspecto normal sin las lesiones características como surcos longitudinales, felinización, traquealización o impactación alimentaria118, por lo que si la sospecha es alta se deben tomar biopsias para valorar el número de eosinófilos por campo de alto poder. En un grupo de pacientes con DTNC consecutivos, no seleccionados, referidos a evaluación por endoscopia, se identificó una infiltración anormal de eosinófilos (6-15 eosinófilos/alto poder) en el 14%, y en el 6% se diagnosticó EEo (>15 eosinófilos/campo de alto poder)119. No debe tomarse biopsia para confirmar el diagnóstico de ERGE, ya que los hallazgos histopatológicos descritos como característicos (p.ej.: espongiosis e hiperplasia de capa basal) pueden observarse en población sana110,117. Varios grupos de investigadores han descrito infiltración por mastocitos en biopsias de esófago de pacientes con DTNC secundario a ERGE, trastornos motores y DTNC funcional, y han propuesto que esta infiltración puede formar parte de los mecanismos fisiopatológicos asociados con hipercontractilidad esofágica distal en el DTNC. Sin embargo, se considera aún una línea en investigación120,121.
Punto clave y recomendación: Las alteraciones histológicas asociadas a ERGE pueden verse en población sana. Se recomienda solo tomar biopsias para confirmar el diagnóstico histológico diferencial, pero no para confirmar ERGE.
- 17.
La pHmetría de 24h con catéter o cápsula inalámbrica y la pHmetría con impedancia son las pruebas más útiles para detectar ERGE como causa de DTNC.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 86%, parcialmente de acuerdo 14%.
Se ha demostrado que la ERGE es la causa más común de DTNC, independientemente de la presencia de síntomas clásicos como pirosis y/o regurgitación, y entre el 50 y el 60% de los pacientes con DTNC tienen exposición esofágica al ácido (EEA) anormal al ser medida mediante pHmetría ambulatoria9,15,49,63,64. No queda claro si existe asociación o causalidad entre ERGE (erosivo o no) y presencia de dolor122. La sensibilidad de la pHmetría con catéter varía entre el 79 y el 96%, con una especificidad del 85-100%, aunque algunos estudios han reportado una sensibilidad menor (60-78%) y una correlación sintomática variable (12-50%)48,123,124. Sin embargo, al realizar la pHmetría como prueba confirmatoria de ERNE se ha demostrado un 75% de respuesta a IBP y un 80% de mejoría tras funduplicatura cuando se documenta EEA anormal125. Algunos estudios que han comparado la prueba terapéutica corta con la pHmetría han encontrado sensibilidades similares, por lo que la pHmetría parece ser de mayor valor cuando se requiere evidencia objetiva de EEA o cuando la prueba con IBP es equívoca49,64. Al ser un estudio que puede modificar la dieta del paciente durante la prueba, debido a efectos relacionados con la presencia de la sonda transnasal, se ha propuesto como alternativa la pHmetría inalámbrica, mediante la colocación vía endoscópica de una cápsula de medición de pH en el tercio inferior del esófago, a 6cm proximales a la unión escamo-columnar. Este método tiene dos ventajas principales: la primera es la ausencia de una sonda transnasal durante el estudio, y la segunda es que la medición puede extenderse hasta por 96h, por lo que se puede hacer una medición inicial de 48h sin tratamiento médico para demostrar EEA, y una medición subsecuente durante las segundas 48h para valorar la respuesta al tratamiento126. En un estudio que evaluó esta estrategia en el DTNC, Prakash et al.127 reportaron que la medición extendida aumenta el rendimiento diagnóstico solo en forma modesta: 10% para EEA, 7.3% para mayor reporte de síntomas y 21% en mayor detección de episodios de dolor de pecho. El método tiene también varias desventajas: se ha reportado que la cápsula de pHmetría inalámbrica puede ocasionar por sí misma dolor torácico en el 16% de los casos, y en el 5% lo suficientemente intenso para requerir su retiro. Cuando se evalúa el grupo de pacientes con DTNC que fueron estudiados con este método, hasta el 62.5% de los pacientes a los que se les extrajo la cápsula por dolor, la indicación del estudio era DTNC128. Dos puntos adicionales a considerar son su mayor costo al compararlo con la pHmetría convencional con catéter, y un riesgo potencial del 12% de desprendimiento prematuro de la cápsula durante el período de evaluación129. Varios autores han propuesto que la pHmetría combinada con impedancia intraluminal multicanal (IIM-pH) puede ser más sensible que la pHmetría convencional en pacientes con manifestaciones clínicas atípicas de ERGE y en los pacientes que no responden a dosis dobles de IBP112,113,130-137. El diseño de la sonda de impedancia permite detectar reflujos de acuerdo con características químicas (ácido, no ácido, ácido menor) y físicas (líquido, gaseoso, mixto), además de poder medir distintas variables no disponibles con la sonda de pHmetría convencional, como extensión proximal de cada reflujo, impedancia basal nocturna, índices de deglución posreflujo y tiempo de exposición al bolo. El valor real de estas nuevas variables se encuentra aún en investigación. La IIM-pH puede realizarse con o sin IBP de acuerdo con la indicación (documentar EEA anormal en pacientes sin diagnóstico previo de ERGE, o evaluación de ERGE refractario o falla a tratamiento, respectivamente)112,113,130-132. La evidencia del papel del reflujo no ácido como causa de DTNC es menor133,134. Un estudio comparativo con 48 pacientes con DTNC y 50 con síntomas típicos de ERGE observó que en el grupo con DTNC la mayoría de los episodios de reflujo eran ácidos y mixtos, y tenían un mayor tiempo de exposición al bolo con depuración alterada de este133. Su mayor utilidad, sin embargo, parece ser en el DTNC sin respuesta a IBP134. En resumen, la medición ambulatoria del pH intraesofágico es la mejor prueba para detectar EEA, pero en el DTNC su utilidad principal es cuando se requiere evidencia objetiva de ERGE (medición EEA sin IBP), o cuando hay falla a tratamiento o síntomas refractarios (medición EEA, no ácida y mixta con IBP).
Punto clave y recomendación: La pHmetría es considerada como la prueba estándar de oro para diagnosticar ERGE, pero es invasiva. Se recomienda la medición del pH intraesofágico en cualquiera de sus variedades cuando se requiere confirmar exposición esofágica al ácido, o con impedancia, para evaluación de reflujo no ácido, mixto o refractario.
- 18.
Los índices de asociación sintomática evaluados durante pHmetría ambulatoria incrementan el rendimiento diagnóstico de la prueba en la detección de DTNC secundario a ERGE.
Calidad de la evidencia y fuerza de la recomendación: C1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 82%, parcialmente de acuerdo 14%, incierto 4%.
Los eventos sintomáticos reportados durante un estudio de pHmetría permiten establecer la presencia o ausencia de una relación temporal entre un episodio de reflujo y un síntoma en particular. Sin embargo, solo los síntomas que pueden relacionarse directamente con reflujo (pirosis, dolor retroesternal, regurgitación, tos) deben ser considerados para el análisis de asociación sintomática112,113. Existen tres índices de asociación sintomática: el índice de síntomas (IS), el índice de sensibilidad de síntomas (ISS) y la probabilidad de asociación de síntomas (PAS). De estos, el IS y el PAS han demostrado tener valor predictivo para efecto de terapia médica o quirúrgica. El IS se define como el porcentaje de eventos sintomáticos relacionados con eventos de reflujo, y el PAS es un parámetro estadístico que utiliza una prueba exacta de Fisher para medir la fuerza de la relación entre los eventos sintomáticos y de reflujo135-137. Sin embargo, tienen varias limitaciones para su correcta interpretación: existe variabilidad sintomática entre días, requieren que el paciente marque el botón de síntomas en el momento de inicio de los mismos, y su validez requiere la presencia de al menos tres episodios sintomáticos durante el período de estudio, de manera que a mayor número de síntomas, mayor probabilidad de establecer una asociación. La evidencia actual muestra que la mayoría de los pacientes con DTNC tienen una relación inconsistente entre eventos de reflujo y dolor, con correlación que varía entre el 12 y el 50%59. Prakash et al. evaluaron el valor de dos índices sintomáticos: el IS y el estimado de probabilidad de Ghillebert, y encontraron una variabilidad del 8% entre días con el IS y de 21% con el segundo127. Dos estudios de literatura quirúrgica reportaron buena correlación entre el IS y el desenlace clínico en el DTNC: en el primero, DeMeester et al.138 concluyeron que el IS es altamente predictivo de mejoría sintomática postquirúrgica, y en el segundo, Patti et al.139 documentaron un 96% de mejoría si el IS era positivo, versus solo el 65% si este era negativo. Un estudio evaluó la utilidad de la pHmetría y la manometría realizadas durante una prueba de esfuerzo en 111 pacientes con dolor torácico tipo angina sin mejoría con IBP; aquellos con un IS>50% se catalogaron como dolor asociado a ERGE, y encontraron una asociación entre acidificación esofágica durante la prueba y presencia de dolor, particularmente cuando los episodios de reflujo duraban más de 10segundos, con una sensibilidad baja pero con una especificidad del 83%140. Aunque la evidencia es escasa, el grupo de RomaIV introdujo recientemente el término «hipersensibilidad por reflujo» para referirse a pacientes con síntomas esofágicos —incluyendo dolor retroesternal— sin evidencia de esofagitis por endoscopia y sin reflujo patológico por pHmetría, pero con un IS positivo, y es un grupo de pacientes que puede tener superposición con otras formas de ERNE26,28. Aunque existe controversia en el valor real de la asociación entre síntomas y reflujo, en este momento, en un paciente con dolor y parámetros fisiológicos de reflujo, el IS es de utilidad para diferenciar entre hipersensibilidad al reflujo y dolor de tipo funcional.
Punto clave y recomendación: Se requieren al menos tres episodios de cada síntoma para que la prueba sea válida, y solo deben evaluarse síntomas asociados a ERGE. Es la única prueba para diferenciar hipersensibilidad al reflujo de dolor de tipo funcional.
- 19.
La manometría esofágica es la prueba más útil para detectar trastornos motores como causa de DTNC.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 77%, parcialmente de acuerdo 18%, incierto 5%.
La manometría esofágica es la mejor prueba para detectar trastornos motores del esófago (TME), los cuales se manifiestan habitualmente por dolor retroesternal y/o disfagia. Varios estudios y revisiones de evaluación del DTNC con manometría convencional han encontrado anormalidades esofágicas de la motilidad en una proporción muy variable (6-70%, promedio 30%, y solo 2% de casos de acalasia)63,64. Dekel et al.141 evaluaron un total de 587 pacientes consecutivos a los que se les realizaron estudios de motilidad entre 1998 y 2001, y de los cuales en el 24% el dolor torácico fue el síntoma principal, y encontraron que el 70% de los estudios fueron normales, y solo el 10% tuvieron esófago en cascanueces. Un estudio brasileño que evaluó 240 pacientes con DTNC reportó manometría normal en el 63%, trastornos inespecíficos en el 25%, hipotensión del esfínter esofágico inferior (EEI) en el 16%, cascanueces en el 6%, acalasia en el 2.5% y espasmo esofágico difuso en el 1.6%142. Un ensayo chileno observó un 36% de cascanueces, un 28% de trastornos inespecíficos, un 9% de espasmo difuso, un 28% de hipotensión del EEI hipotenso, y solo el 2% tenían aperistalsis17. Un trabajo mexicano con 33 sujetos documentó como causas de DTNC: ERGE en el 48%, acalasia en el 34% y dolor funcional en el 18%143. La relación entre las anormalidades motoras encontradas mediante manometría convencional y DTNC no es muy clara en la mayoría de los casos, y al igual que con la ERGE, podría ser causa o bien un epifenómeno, y dado que algunos trastornos motores pueden estar asociados a ERGE, la mayoría de los expertos sugieren descartar reflujo primero. La realización de manometría durante un período extendido a 24h tiene un bajo rendimiento diagnóstico adicional cuando se compara con la manometría convencional corta (6.8% de diagnósticos adicionales)123,144. En los últimos 20años han surgido avances tanto en el desarrollo de catéteres de manometría con un mayor número de sensores así como mejoras en los softwares de procesamiento de imágenes, los cuales permiten presentar los datos de presión en forma de trazos espaciotemporales a color145. La manometría de alta resolución (MAR) con topografía de presión esofágica que aplica estos conceptos ha permitido un mejor entendimiento y una mejor evaluación de la función motora del esófago146,147, además de una interpretación más sencilla de los estudios, y con menor variabilidad interobservador148. Esta tecnología ha introducido nuevas variables, con lo que los criterios diagnósticos de los TME han cambiado, integrándose en la Clasificación de Chicago, en su tercer versión actualmente, y que ha redefinido varios trastornos motores (p.ej.: esófago en «Jackhammer» en lugar de «Cascanueces») o bien reclasificado (p.ej.: espasmo esofágico distal [EED] y sus variedades, en lugar de espasmo esofágico difuso), y se han acuñado términos como «trastornos espásticos», que incluyen trastornos complejos como la acalasia tipoiii149. La evidencia de utilidad de la MAR ha quedado bien demostrada en la evaluación de disfagia: en un estudio que comparó 245 trazos de manometría (122 convencional, 123 MAR) de 247 pacientes con disfagia, el diagnóstico inicial fue confirmado tras una revisión por expertos con mayor frecuencia en el grupo de MAR, incluyendo trazos que habían sido interpretados como normales mediante manometría convencional (52% vs 28%, p<0.05)150. En los últimos años ha empezado a surgir información con esta nueva prueba en el DTNC. Un ensayo europeo que describió el comportamiento de 34 casos de esófago en «Jackhammer» (EJ) observó que el 47% tenían DTNC151, y un trabajo mexicano reportó asociación entre DTNC y la presencia conjunta de EEo y EJ152. En un estudio retrospectivo realizado con MAR, Gómez-Cifuentes et al.153 evaluaron 177 pacientes con DTNC y encontraron ERGE en el 35% y TME en el 31% (motilidad esofágica inefectiva 14.1%, EJ 6.8%, EED 5.1%, acalasia 2.3%), y los factores de riesgo para el desarrollo de un TME fueron la edad (el OR se incrementó 1.2 por cada 5años [IC95%: 1.0-1.3]) y la disfagia como síntoma acompañante (OR 3.8 [IC95%: 1.9-9.75]). Aunque no se ha descrito una asociación directa entre alguna variable de MAR con DTNC154, se ha reportado aumento en amplitud de contracción en el segmento3 en pacientes con hipersensibilidad al ácido y DTNC, y un estudio reportó una sensibilidad del 75% y una especificidad del 98% para la MAR con topografía esofágica para el diagnóstico de espasmo esofágico155. La guía italiana de indicaciones de manometría156 sugiere que «idealmente la MAR debería ser realizada en todos los pacientes con DTNC con instrumentos uniformes y parámetros de referencia», pero desde el punto de vista de costo-efectividad se debe hacer tomando en cuenta varias consideraciones: 1)si se sospecha ERGE, la manometría es obligatoria para establecer posición del electrodo de pH/IIM-pH; 2)si el DTNC se acompaña de disfagia, está fuertemente indicada para descartar trastornos espásticos y obstrucción (trastornos mayores de la motilidad), 3)si el DTNC es aislado y no hay mejoría con IBP, y 4)si se acompaña de enfermedades sistémicas con potencial afección esofágica, para descartar esta. El grupo de Roma en sus «Algoritmos para diagnósticos de síntomas gastrointestinales comunes» recomienda realizar manometría como parte de la evaluación del DTNC156. Recientemente un grupo internacional de expertos publicó el primero de una serie de consensos sobre indicaciones de estudios de motilidad, función y sensibilidad gastrointestinal en diferentes padecimientos gastrointestinales incluyendo DTNC, y recomiendan como primera investigación la MAR, incluyendo pruebas provocadoras (secuencia de degluciones rápidas múltiples y prueba de degluciones rápidas con 200ml) en combinación con pHmetría con o sin IIM, y como segunda prueba recomiendan monitoreo prolongado inalámbrico de pH en los casos con duda diagnóstica157. El consenso también menciona que el diagnóstico de ERGE puede establecerse en los casos con EEA en área gris (4-6%), en presencia de una unión esofagogástrica inestable (tipoIII) o bien de motilidad esofágica inefectiva157.
Punto clave y recomendación: La manometría es una prueba invasiva que requiere personal experto para su realización e interpretación. Aunque tiene múltiples indicaciones, para los fines de este consenso se recomienda para descartar trastornos motores esofágicos espásticos y acalasia asociados a dolor y a ERGE.
- 20.
Se recomienda la evaluación psiquiátrica en los pacientes con DTNC con pruebas negativas y que no responden a una intervención terapéutica.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 91%, parcialmente de acuerdo 9%.
Se ha estimado que entre el 17 y el 75% de los pacientes con DTNC sufren de alguna anormalidad psicológica158, y hasta el 60% de los pacientes con «enfermedad coronaria no significativa» pueden coexistir con trastornos psiquiátricos159. Estas comorbilidades pueden modular la percepción del dolor o inducir percepción de estímulos no dolorosos como dolorosos, asociarse a hipervigilancia o a hiperventilación, la cual puede provocar anormalidades manométricas esofágicas reversibles. Los trastornos psiquiátricos más asociados a DTNC son: trastornos de pánico, ansiedad, depresión, hipocondriasis y neuroticismo160. Las comorbilidades psiquiátricas pueden a su vez coexistir con otras causas de DTNC: en un estudio, el 80% de los pacientes con TME tenían un trastorno psiquiátrico adyacente versus solo el 30% de aquellos con motilidad esofágica normal161. Debido a estas asociaciones, los pacientes que no responden a una intervención terapéutica, que tienen pruebas negativas para reflujo o dismotilidad esofágica, o en los que se sospecha comorbilidad psicológica, deben ser referidos a un psicólogo o a un psiquiatra para evaluación adicional y/o manejo162.
Punto clave y recomendación: Se recomienda referir a un psicólogo o psiquiatra cuando la evaluación diagnóstica es normal, no hay respuesta al tratamiento, o bien cuando se sospecha un trastorno psiquiátrico, el cual puede coexistir con otras causas de DTNC.
Tratamiento- 21.
De forma ideal, el tratamiento del DTNC debe ser dirigido al mecanismo fisiopatológico subyacente (p.ej.: reflujo gastroesofágico, dismotilidad esofágica, hipersensibilidad, comorbilidad psiquiátrica).
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 95%, parcialmente de acuerdo 5%.
La fisiopatología del DTNC es compleja y heterogénea, y no existe un marcador único que pueda explicar el proceso del dolor en todos los casos, por lo que se han propuesto factores asociados como la ERGE, la dismotilidad esofágica y diversos mecanismos asociados a hipersensibilidad visceral14. Los criterios de Roma establecen el diagnóstico genérico de DTNC, pero debido a los múltiples mecanismos fisiopatológicos involucrados resulta muy difícil establecer un plan de manejo con base solo en criterios clínicos, ya que ninguno de los apartados en la semiología del dolor tiene sensibilidad y especificidad para el diagnóstico. De hecho, los criterios de RomaIV establecen el diagnóstico de dolor torácico funcional cuando se han descartado causas cardiovasculares y esofágicas de manera adecuada26. Debido a ello, una vez realizada una evaluación diagnóstica, y concluyendo cuál es el(los) mecanismo(s) involucrado(s) en la generación del DTNC en cada caso en particular, se debe establecer el tratamiento correspondiente163.
Punto clave y recomendación: Debido a las múltiples causas y mecanismos involucrados en el DTNC, preferentemente se debe establecer un plan de manejo en base al(a los) mecanismo(s) involucrado(s).
- 22.
El tratamiento con IBP está indicado cuando se ha documentado ERGE como causa del DTNC.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 90%, parcialmente de acuerdo 5%, parcialmente en desacuerdo 5%.
Ya se ha discutido que una prueba terapéutica con IBP positiva puede establecer diagnóstico de ERGE en pacientes con DTNC82,93-95. En los pacientes que requieren evaluación adicional se ha establecido que la ERGE está vinculada a dolor torácico en el 30 al 60% de los casos basádose en estudios de pHmetría con o sin asociación sintomática15,84,137,164. Recientemente, con el uso de IIM-pH se ha determinado que los eventos de reflujo no ácido también se asocian a episodios de dolor134, y que el dolor torácico puede no mejorar en todos los casos bajo terapia con IBP cuando el reflujo no ácido es el promotor principal131,132. El diagnóstico categórico mediante endoscopia es menor debido al bajo rendimiento diagnóstico de la prueba (sensibilidad 30%) y a la mayor prevalencia de ERNE103, así como al reciente cambio en los criterios diagnósticos que indican que solo la esofagitis gradoC oD constituye un diagnóstico categórico de ERGE112,113. Por esta razón, una vez documentada la ERGE como causante del DTNC, ya sea mediante endoscopia o pHmetría, se puede establecer un plan de tratamiento inicial con doble dosis de IBP, seguido de reducción de la misma de acuerdo con el mantenimiento de la respuesta clínica49,96.
Punto clave y recomendación: Independientemente de la prueba terapéutica, se recomienda el uso de IBP como tratamiento del DTNC cuando se documente ERGE mediante endoscopia (esofagitis gradoC oD Los Ángeles) o pHmetría (exposición esofágica al ácido anormal >6%).
- 23.
Se recomienda tratamiento a doble dosis de IBP durante al menos 2meses para el DTNC relacionado con ERGE.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 95%, parcialmente de acuerdo 5%.
Los IBP son el mejor tratamiento médico para el DTNC cuando se asocia a ERGE. Se han utilizado tanto como prueba terapéutica como para tratamiento formal prolongado, con resultados satisfactorios con los diferentes tipos de IBP49,82-95,165, incluyendo omeprazol 20mg dos veces al día o 40mga.m. y 20mgp.m.83-86, rabeprazol 20mg dos veces al día21,87, lansoprazol 30mg dos veces al día22,88 y, más recientemente, esomeprazol 40mg dos veces al día89. Varios metaanálisis han mostrado la superioridad de los IBP sobre placebo en el DTNC, y la dosis evaluada en la mayoría de ellos es doble, dos veces al día93,94,166. En el metaanálisis más reciente, en pacientes con ERGE confirmada mediante endoscopia de tubo digestivo superior o por pHmetría, la razón de momios (OR) para respuesta es de 11.7 (IC95%: 7.5-25), mientras que en pacientes con DTNC no investigado la OR es menor (4.2; IC95%: 2.7-6.7), y en aquellos en que se investigan pero resultan negativos la posibilidad de éxito con la terapia a base de IBP es de apenas 0.8 (IC95%: 0.2-2.8)166. En los metaanálisis de Cremonini y de Wang, la OR para mejoría con IBP fue de 13.83 y 19.35, respectivamente93,94. La mayoría de los estudios muestran mejorías no mayores al 50% durante las primeras 2semanas, por lo que, al igual que otros síntomas atípicos de la ERGE, se recomienda tratamiento a dosis doble por al menos 2meses con IBP para evaluar resultados, aunque a veces puede ser necesario un período mayor49,59,167. El tratamiento a largo plazo parece ser eficaz para mantener la remisión de los síntomas a pacientes con DTNC asociado a ERGE, y como en otras indicaciones de uso de IBP como mantenimiento se sugiere dejar la dosis menor que sea eficaz para cada paciente167,168. No existe ningún estudio que haya comparado un IBP contra otro para determinar cuál es mejor; por lo tanto, la opción para escoger el tipo de IBP inicial es abierta. Las recomendaciones de horario de administración son similares que en la ERGE con síntomas típicos78,79. Los antagonistas H2 han sido también evaluados en estudios abiertos y con muestras pequeñas, y aunque se ha demostrado mejoría subjetiva a altas dosis, no se ha establecido correlación entre IS positivos y respuesta a ranitidina167.
Punto clave y recomendación: Los estudios han demostrado que una dosis convencional de IBP es insuficiente para lograr mejoría clínica en el DTNC. Se recomienda IBP (omeprazol 20mg dos veces al día o su equivalente) por al menos 8semanas, con las mismas consideraciones de horario y mantenimiento que en ERGE con síntomas típicos.
- 24.
Los relajantes de músculo liso, como los donantes de óxido nítrico, los antagonistas del calcio y los anticolinérgicos, se utilizan en el DTNC asociado a trastornos motores espásticos, pero su eficacia es limitada y se asocian a efectos adversos.
Calidad de la evidencia y fuerza de la recomendación: C2 débil a favor de la intervención.
Acuerdo: Totalmente de acuerdo 82%, parcialmente de acuerdo 13%, parcialmente en desacuerdo 5%.
Un mecanismo importante en el DTNC es el espasmo del músculo liso esofágico, el cual puede estar asociado a trastornos motores espásticos16,17,168,169. Por ello se han utilizado relajantes de músculo liso para el tratamiento del subgrupo de pacientes en que se detecta espasmo esofágico distal (EED), esófago hipercontráctil y acalasia tipoIII. Sin embargo, la mayor parte de la evidencia proviene de estudios antiguos, con deficiencias metodológicas o con criterios manométricos antiguos170,171. Los relajantes de músculo liso evaluados en el DTNC han sido antagonistas del calcio (nifedipino, diltiazem), nitratos y los inhibidores de 5fosfodiesterasa como sildenafilo172-177. El nifedipino a dosis de 10-30mg tres veces al día ha mostrado disminuir la amplitud de contracción en pacientes con esófago en cascanueces pero sin correlación clínica172, aunque en otro estudio su uso se asoció a mejoría en puntajes de intensidad de dolor tras 16meses en comparación con placebo, pero sin cambios en la frecuencia o la duración del mismo173. Una limitación importante son los efectos adversos, incluyendo flushing facial, cefalea, mareo y ansiedad167. Tres estudios aleatorizados que incluyeron una muestra modesta de enfermos evaluaron el diltiazem a dosis entre 60 y 150mg. El primero no demostró superioridad ante placebo en el tratamiento del DTNC en pacientes con espasmo esofágico174, mientras que los otros dos demostraron disminución de los puntajes de dolor en pacientes con esófago en cascanueces175,176. Los efectos adversos, al igual que con nifedipino, son su principal limitación de uso. La evidencia con nitratos en TME proviene solo de estudios abiertos y de muestra limitada167. Finalmente, sildenafilo ha sido evaluado en series pequeñas, con resultados inconsistentes, y por períodos cortos de tiempo debido a los efectos secundarios177. En algunos casos bien seleccionados los relajantes de músculo liso pueden ser utilizados mientras se define una terapia definitiva del trastorno motor espástico. Antes de considerar el uso de estos agentes, es imperativo descartar reflujo gastroesofágico, dado que estos medicamentos inducen relajación del EEI y, por consiguiente, tienen el potencial de agravar el reflujo.
Punto clave y recomendación: Los relajantes de músculo liso son medicamentos útiles para su uso a corto plazo en el DTNC asociado a trastornos motores espásticos no candidatos a otros tratamientos, o como puente antes de la terapia definitiva. Se debe ajustar la dosis en base a la respuesta y a los efectos adversos. Dados sus efectos sobre el EEI, antes de prescribirlos hay que cerciorarse de que el paciente no tiene reflujo gastroesofágico.
- 25.
La inyección transendoscópica de toxina botulínica es una alternativa para el tratamiento del DTNC asociado a trastornos espásticos del esófago en pacientes que no son candidatos a miotomía o dilatación neumática.
Calidad de la evidencia y fuerza de la recomendación: B2 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 95%, parcialmente de acuerdo 5%.
Debido a sus propiedades para inducir bloqueo selectivo de la acetilcolina en la placa presináptica neuromuscular, se ha postulado la toxina botulínica para el tratamiento de trastornos espásticos del esófago. En un estudio abierto que incluyó 29 pacientes con alteraciones misceláneas de la motilidad, la inyección en la unión esofagogástrica en 4cuadrantes indujo al menos el 50% en la reducción de dolor torácico en el 72%, con una duración media del efecto de 7.3±4.1meses178. Una serie pequeña de 9pacientes con espasmo esofágico utilizó 100UI de toxina botulínica inyectados cada 1 a 1.5cm por arriba de la unión esofagogástrica, observando mejoría en 8/9 pacientes con una duración media de 6meses y requiriendo reinyecciones en algunos casos179. En un estudio más reciente, abierto, se aplicó toxina botulínica en 45 pacientes con TME diagnosticados de acuerdo con los criterios actuales en un solo centro en Francia: 22 con acalasia tipoIII, 8 con esófago hipercontractil, 7 con EED, 5 con obstrucción funcional del tracto de salida de la unión esofagogástrica, y el resto misceláneos. La localización de la inyección fue heterogénea: en algunos casos solo en la unión esofagogástrica, y en otros incluyó el cuerpo esofágico. El 71% de los pacientes mejoraron tras 2meses de tratamiento, y el 57% se mantuvieron con respuesta tras 6meses de seguimiento. Entre las complicaciones descritas, hubo una muerte relacionada con mediastinitis 3meses después de la inyección, y en 13 casos presentaron dolor torácico con una duración de no más de 7días. Los autores refieren que no hubo diferencia en la respuesta con base al diagnóstico, pero los pacientes con acalasia tuvieron el peor pronóstico180. En la actualidad la inyección de toxina botulínica es una alternativa para el control del dolor en pacientes con trastornos espásticos; debe utilizarse cuando la expectativa de vida o el riesgo quirúrgico o endoscópico son altos, y debe ser aplicada por personal experto. Debido a la baja calidad de la evidencia, no se recomienda su uso rutinario. Otras modalidades de tratamiento endoscópico, como dilatación con bujías (no hidráulica), han sido poco evaluadas y parecen asociarse a una importante respuesta placebo, pero se requieren más estudios aleatorizados para determinar la eficacia de esta modalidad de tratamiento167. A su vez, no existen estudios comparativos de otras formas de dilatación esofágica en pacientes con DTNC secundaria a TME.
Punto clave y recomendación: La inyección endoscópica de toxina botulínica en el DTNC tiene las mismas indicaciones que los relajantes de músculo liso, es decir, como medida temporal antes de la terapia definitiva o en casos cuya terapia más invasiva esté contraindicada. Se deben evitar múltiples administraciones si se considera efectuar terapia definitiva posterior, como miotomía peroral endoscópica o miotomía quirúrgica.
- 26.
La miotomía peroral endoscópica es una opción terapéutica en el DTNC para pacientes seleccionados con trastornos espásticos del esófago.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 90%, parcialmente de acuerdo 5%, parcialmente en desacuerdo 5%.
Los principales trastornos espásticos del esófago según la clasificación de Chicago (EED, Jackhammer y acalasia tipoIII) se pueden asociar no solo a disfagia sino también al DTNC149. Para este subgrupo de TME, la miotomía peroral endoscópica (peroral endoscopic myotomy [POEM]) se ha posicionado como una opción terapéutica debido a su capacidad de seccionar el músculo afectado a lo largo del cuerpo esofágico y del EEI181,182. Un metaanálisis que incluyó 8estudios observacionales con 179pacientes concluyó que en forma global la POEM induce una respuesta del 87% (IC95%: 78-93%), teniendo el mejor pronóstico la acalasia tipoIII, con una respuesta promedio del 92% (IC95%: 84-96). En el análisis para EED la respuesta promedio fue del 88% (IC95%: 61-97) en 4estudios, y para esófago hipercontráctil (EJ) la respuesta en 5estudios analizados fue del 72% (IC95%: 55-83)183. En enfermos con acalasia tipoIII, un estudio multicéntrico comparó de forma retrospectiva la efectividad de la POEM vs miotomía de Heller laparoscópica (MHL). La POEM resultó ser más efectiva (98% vs 80.8%, p=0.01), además de requerir menor tiempo operatorio (102min vs 264min; p<0.01), obtener mayor longitud de la miotomía (16cm vs 8cm, p<0.01) y asociarse con una menor incidencia de efectos adversos (6% vs 27%, p<0.01)184. Es necesario comentar que no se ha realizado un ensayo prospectivo bien diseñado para comparar la eficacia y la seguridad de ambos procedimientos en los trastornos espásticos del esófago. Por último, la POEM, como todos los procedimientos invasivos, requiere una curva de aprendizaje, y varios estudios han explorado el número necesario para desarrollar esta curva185-187. Un estudio en una sola institución en Estados Unidos concluyó que se requieren un mínimo de 13 procedimientos para obtener meseta para realizar POEM185. Sin embargo, dos publicaciones más recientes, ambas provenientes de China, mencionan que el número promedio de POEM para mejorar la implementación de este procedimiento es de 25186, y se requiere realizar al menos 100 para disminuir efectos adversos y riesgo de falla terapéutica187. En nuestro país la POEM ya se está implementando en algunos centros, por lo que la recomendación es que sea realizado solo por personal experto y en centros de excelencia.
Punto clave y recomendación: La POEM es un procedimiento poco disponible en nuestro país o bien aún en curva de aprendizaje, pero la evidencia mundial de efectividad en trastornos espásticos del esófago es muy prometedora. Se recomienda como medida definitiva en trastornos motores espásticos (espasmo distal y Jackhammer) y solo en centros con experiencia y por personal calificado.
- 27.
Los neuromoduladores del dolor visceral son útiles en el DTNC funcional cuando no hay respuesta satisfactoria con otros tratamientos.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor de la intervención.
Acuerdo: Totalmente de acuerdo 95%, parcialmente de acuerdo 5%.
La hipersensibilidad visceral esofágica es un mecanismo importante en el DTNC, particularmente en el subtipo funcional. Se ha demostrado que hasta el 50% de pacientes con DTNC tienen umbrales sensitivos menores comparados con controles sanos188, además de mayor reactividad y menor distensibilidad esofágica19. Los neuromoduladores del dolor visceral son medicamentos de diferentes clases que actúan sobre vías sensitivas periféricas, centrales o ambas para modificar el umbral sensitivo. Se han utilizado antidepresivos tricíclicos, inhibidores selectivos de la recaptura de serotonina (ISRS) e inhibidores selectivos de la recaptura de noradrenalina (ISRN) de manera principal, aunque algunos agentes con efecto sobre los receptores de serotonina, como el tegaserod, y los agonistas de adenosina como la teofilina, han sido evaluados también en estudios pequeños189-199. El único antidepresivo tricíclico estudiado en un trabajo doble ciego controlado con placebo en el DTNC ha sido la imipramina. A un grupo de 60pacientes se les administró imipramina 50mg cada 24h, clonidina 0.1mg o placebo por 4semanas. Aunque los tres grupos de estudio tuvieron una reducción en la frecuencia del dolor, solo el grupo de imipramina tuvo una disminución significativa en la frecuencia del mismo (52%, p<0.03) y la respuesta fue independiente de la presencia o no de comorbilidad psiquiátrica189. Un estudio abierto comparó el efecto de agregar amitriptilina a dosis baja (10mg por la noche) a una dosis convencional de rabeprazol (20mg/día) versus doble dosis en un grupo de pacientes con DTNC con respuesta subóptima a dosis convencional de IBP y pHmetría normal. El 71% (vs. 26%, p=0.008) tuvo mejoría global mayor del 50% y mayor sensación de bienestar190. La paroxetina y la sertralina han sido dos ISRS evaluados en el DTNC. La paroxetina fue evaluada en un estudio aleatorizado, doble ciego con 43 pacientes e indujo mejoría en la percepción clínica pero no en la puntuación específica de la percepción del dolor torácico tras 8semanas de tratamiento a una dosis media de 30mg/día191. En otro estudio aleatorizado y doble ciego que comparó la paroxetina frente a la terapia cognitiva conductual o placebo en 69 pacientes con DTNC no hubo diferencias significativas entre grupos192. La sertralina fue evaluada en un estudio aleatorizado doble ciego titulada hasta 200mg/día de acuerdo con la respuesta, y mostró una disminución significativa (p<0.02) de la percepción del dolor y mejoría con respecto a basal en los subpuntajes de bienestar del cuestionario SF36193. Otro estudio de igual diseño que comparó terapia psicológica más sertralina, sertralina sola o placebo concluyó que la combinación de terapia psicológica más sertralina fue más eficaz en el control del DTNC194. La trazodona es un ISRS del grupo de las fenilpiperazinas que tiene además efecto ansiolítico e hipnótico. Fue evaluada en un estudio controlado con 29 pacientes con DTNC con anormalidades manométricas y una prueba de Bernstein negativa, a dosis entre 100 y 150mg durante 6semanas, observando mejoría global en forma significativa (48% vs 11%, p=0.02) pero sin efecto sobre la intensidad del dolor ni sobre las anormalidades manométricas195. La venlafaxina es un ISRS y también inhibidor selectivo de recaptura de noradrenalina (ISRN). Solo se ha explorado su utilidad en un estudio aleatorizado, cruzado y controlado con placebo utilizando 75mg por 4semanas en 43 pacientes, y que mostró una respuesta (diminución del DTNC) en el 52% versus solo al 4% con placebo en el análisis de intención a tratar (OR26.0, IC95%: 5.7-118.8, p<0.001)196. El tegaserod es un agonista 5-HT4 que fue evaluado en pacientes con pirosis funcional, y entre los hallazgos demostró aumentar el umbral doloroso a la prueba de distensión con balón197. Estos hallazgos no han sido reproducidos en el DTNC. La teofilina, un agonista de la adenosina, fue evaluada en dos estudios del grupo de Rao et al.198,199. En el primero de ellos la administración abierta intravenosa se asoció a aumento en el umbral doloroso medido mediante planimetría de impedancia, y la ingestión oral a disminución en frecuencia e intensidad de dolor198. En un estudio controlado posterior se confirmaron los efectos sobre distensibilidad y relajación esofágica de la teofilina, además de un 58% en reducción sintomática (vs 6% placebo, p<0.02)199. Aunque los resultados sugieren un potencial uso de la teofilina en el DTNC, su margen terapéutico a efectos indeseables es estrecho. Esto limita su uso actual en el DTNC. Pero el hallazgo de que la teofilina mejora el DTNC abre una oportunidad a explorar nuevos analgésicos viscerales en el DTNC no evaluados previamente200. A pesar de que la evidencia proviene de estudios pequeños o no controlados, los neuromoduladores parecen eficaces en el DTNC secundario a dismotilidad o de origen funcional. Su uso se debe individualizar, explicando al paciente que el objetivo es modular las vías nociceptivas y los centros de integración del dolor, y no dirigidos directamente a la comorbilidad psiquiátrica. Se debe iniciar con dosis bajas (p.ej., el equivalente a nortriptilina/imipramina 10mg o amitriptilina 12.5mg antes de dormir y gradualmente incrementar semanalmente hasta obtener respuesta, tratando de usar la dosis más baja posible que mejore el dolor; rara vez se requieren más de 50mg) y explicar los potenciales efectos adversos para favorecer el apego e inducir la respuesta deseada.
Punto clave y recomendación: Existen diferentes neuromoduladores orientados a disminuir la hipersensibilidad visceral en el dolor de tipo funcional, en su mayoría antidepresivos a dosis bajas y con máximo efecto después de 8-12semanas. La mayor evidencia proviene de los estudios con imipramina, amitriptilina y venlafaxina, y en menor grado con paroxetina o sertralina.
- 28.
La terapia cognitivo conductual, la hipnoterapia, la biorretroalimentación y la terapia Johrei son alternativas en casos refractarios o complementarias a otras modalidades de tratamiento del DTNC.
Terapia Cognitivo Conductual
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor de la intervención.
Hipnoterapia
Calidad de la evidencia y fuerza de la recomendación: B2 débil a favor de la intervención.
Biorretroalimentación
Calidad de la evidencia y fuerza de la recomendación: C2 débil a favor de la intervención.
Terapia Johrei
Calidad de la evidencia y fuerza de la recomendación: C2 débil a favor de la intervención.
Acuerdo: Totalmente de acuerdo 95%, parcialmente de acuerdo 5%.
Existen diversas modalidades de tratamiento no farmacológico que han sido investigadas en pacientes con DTNC. La terapia cognitivo conductual (TCC) tiene como fundamento más importante el de favorecer el desarrollo de mejores estrategias para manejar los problemas, en este caso, de salud. De esta manera, los pacientes con DTNC pueden disminuir su sintomatología, con o sin comorbilidad psiquiátrica acompañante. En un estudio controlado pequeño (17pacientes) que comparó la TCC contra terapia convencional demostró que después de 12semanas de tratamiento el 31% de los sujetos estaban libres de síntomas y el 34% presentaron respuesta parcial201. Otro estudio comparó la TCC en un grupo de pacientes con DTNC y en un grupo control. Después de 3meses de intervención, el grupo con TCC presentó una reducción significativa del número de días y gravedad del dolor en comparación con el control. A los 6meses se encontró mejoría del rol social y físico de los pacientes en TCC202. Un ensayo clínico controlado demostró que los pacientes que recibieron TCC mejoraron en esferas de calidad de vida en general, y refirieron menor temor por percibir sensaciones dolorosas corporales203. Por último, un estudio abierto en 60pacientes que recibieron TCC obtuvieron una disminución significativa en la reducción de eventos de dolor de 6.5 a 2.5 por semana, junto con una disminución de escalas de ansiedad y depresión204.
La hipnoterapia también se ha utilizado en pacientes con DTNC. En un ensayo simple ciego que aleatorizó 28 pacientes para recibir hipnoterapia o placebo (entrevista sin hipnoterapia) mostró que los pacientes en hipnoterapia presentaron una mayor disminución de la intensidad pero no de la frecuencia del dolor205. La biorretroalimentación consiste en una serie de ejercicios respiratorios para inducir contracción diafragmática, y su utilidad fue evaluada en un estudio muy pequeño mostrando disminución de dolor torácico pero no de la pirosis en un grupo de 6pacientes con síntomas esofágicos funcionales206. Es importante remarcar que tanto la TCC como la hipnoterapia y la biorretroalimentación deben ser administradas por personal experto para obtener mejores resultados. La terapia Johrei (sanación con energía espiritual), considerada como medicina alternativa de mecanismo de acción desconocido, fue estudiada en 39pacientes con DTNC durante 6semanas, y los que recibieron la intervención mostraron una disminución significativa de la puntuación del dolor en comparación a la basal207. Al ser el único estudio en DTNC, se necesita mayor evidencia para confirmar su beneficio.
En resumen, la TCC ha sido extensamente estudiada en el dolor funcional con buenos resultados. Otras terapias psicológicas son menos conocidas y han sido poco evaluadas, pero parecen ser efectivas en un número limitado de pacientes. Desafortunadamente, existen insuficientes terapistas entrenados y familiarizados con estas técnicas alternativas, mismas que aun requieren evaluación crítica en el manejo del DTNC.
Punto clave y recomendación: La TCC parece ser útil en el DTNC, pero debe ser administrada por personal calificado. La evidencia actual publicada con otras formas de terapia psicológica, como hipnoterapia y biorretroalimentación, o con la terapia Johrei, una forma de medicina alternativa, requiere estudio adicional.
- 29.
La cirugía como tratamiento del DTNC se basa en la miotomía del segmento esofágico afectado y se limita a trastornos espásticos del esófago. Debe ser realizada por un cirujano experto y en casos altamente seleccionados.
Calidad de la evidencia y fuerza de la recomendación: C2 débil a favor de la intervención.
Acuerdo: Totalmente de acuerdo 90%, parcialmente de acuerdo 5%, incierto 5%.
La cirugía puede ser de beneficio en el DTNC bajo dos premisas: como tratamiento antirreflujo en casos de DTNC asociado a ERGE, y para miotomía de un segmento esofágico espástico. No hay estudios controlados que evalúen la funduplicatura en el DTNC. La evidencia de estudios abiertos reporta una mejoría entre el 81 y el 96% en pacientes con confirmación de ERGE mediante pHmetría138. Respecto a cirugía como tratamiento de DTNC asociado a trastornos espásticos, la mayoría de la evidencia proviene de estudios antiguos o retrospectivos y con criterios manométricos previos, aunque las tasas de mejoría reportadas alcanzan el 80% en algunas series en las cuales se combinó miotomía longitudinal y un procedimiento antirreflujo parcial208,209. Aunque la miotomía tipo Heller laparoscópica (MHL) ha sido utilizada de manera exitosa durante muchos años en la acalasia, los estudios en acalasia tipoIII (en la que hay mayor incidencia de dolor torácico secundario) han demostrado que es menos efectiva, ya que la miotomía no abarca el cuerpo esofágico. Un estudio comparó las tasas de éxito de la MHL de acuerdo con el subtipo manométrico de acalasia y encontró que el subtipoIII se asoció a tasas de éxito menores (70-85%) comparado con el subtipoII (95-100%)210. La evidencia de éxito con otros trastornos espásticos ha sido menos evaluada. En una serie de 20casos tratados con miotomía extendida (14cm de esófago y 2cm debajo de la unión esofagogástrica), Leconte et al.211 reportaron mejoría de la disfagia y dolor torácico en pacientes con EED. Otro estudio que comparó el abordaje entre miotomía a través de toracoscopia o laparoscopia en pacientes con espasmo esofágico y con esófago en cascanueces no encontró diferencias entre ambas técnicas para el control del dolor, aunque ambas fueron más efectivas en el espasmo esofágico en comparación con el esófago en cascanueces212. Tomando en cuenta los nuevos criterios manométricos de la clasificación de Chicago v3.0, no hay estudios controlados de MHL en trastornos espásticos diferentes a la acalasia tipoIII, solo reportes o series de casos, por lo que no existe evidencia para recomendar o no su uso, el cual, en caso de realizarse, debe ser en un grupo altamente seleccionado de pacientes, con documentación manométrica de la extensión del área de espasticidad e implementado por un cirujano experto en la realización de estos procedimientos.
Punto clave y recomendación: La evidencia de efectividad de la funduplicatura en el DTNC asociado a ERGE proviene de estudios abiertos no controlados. Se puede considerar la miotomía longitudinal extendida previa documentación de la extensión del área de espasticidad medida por manometría de alta resolución en casos sin respuesta a otras medidas y practicada por un cirujano calificado en este tipo de procedimiento. Sin embargo, carecemos de estudios aleatorios que comparen la eficacia de la cirugía frente a otras medidas terapéuticas. Así mismo, los potenciales efectos indeseables de la cirugía deben ser tomados en cuenta al decidir esta alternativa.
ConclusionesEl DTNC es un síndrome clínico caracterizado por dolor retroesternal semejante a la angina pectoris, en el que se han excluido causas cardiovasculares. El mismo puede ser ocasionado por padecimientos esofágicos, osteomusculares, pulmonares o psiquiátricos. Dentro de los esofágicos, el más común es la ERGE. Otros padecimientos incluyen los trastornos motores espásticos y el dolor de tipo funcional asociado a hipersensibilidad visceral. Todo paciente que debuta con dolor torácico debe ser evaluado en forma inicial por un cardiólogo con el fin de descartar enfermedad coronaria. Dado que la causa más común es la ERGE, si no existen síntomas de alarma (como disfagia/pérdida de peso, anemia no explicada) se puede iniciar el manejo con una prueba terapéutica con IBP por 2-4semanas. Si hay disfagia o manifestaciones de alarma, se debe hacer una endoscopia y valorar las biopsias cuando se sospechen enfermedades de la mucosa diferentes a reflujo. La manometría —particularmente de alta resolución— es el mejor método para descartar trastornos motores, y la pHmetría, con o sin catéter, ayuda a demostrar exposición esofágica anormal al ácido, y con impedancia, reflujo no ácido o ácido refractario. Si la evaluación es negativa, se debe considerar descartar comorbilidad psiquiátrica. El tratamiento preferentemente debe ser dirigido al mecanismo fisiopatológico, y puede incluir IBP, neuromoduladores y/o relajantes de músculo liso. En casos seleccionados la terapia endoscópica (toxina de botulismo o Botox) o la psicológica (terapia cognitiva conductual), y ocasionalmente la quirúrgica, pueden ser de utilidad.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesDr. Octavio Gómez-Escudero es miembro del consejo asesor de Sanofi y Takeda. Conferencista para Laboratorios Menarini, Sanofi y Takeda, y participa en protocolos de investigación patrocinados por Laboratorios Asofarma.
Dr. Enrique Coss-Adame es miembro del consejo asesor de Takeda Pharmaceuticals, Allergan, Carnot Laboratorios y Menarini. Conferencista para Laboratorios Asofarma, Alfa-Wassermann, Allergan, Carnot y Takeda, y participa en protocolos de investigación patrocinados por Laboratorios Asofarma.
Dra. Mercedes Amieva-Balmori es conferencista para Laboratorios Sanfer y Takeda.
Dr. Ramón Carmona-Sánchez es miembro del Consejo Asesor de Mayoly-Spindler, conferencista para Mayoly-Spindler y Grünenthal, y participa en protocolos de investigación patrocinados por Laboratorios Senosian y Asofarma.
Dr. José María Remes-Troche es miembro del consejo asesor de Takeda Pharmaceuticals, Alfa-Wassermann y Menarini. Recibió fondos para la investigación por Sanfer. Ponente para Takeda, Asofarma, Alfa-Wassermann, Carnot, Menarini, Almirall y Astra-Zeneca, y participa en protocolos de investigación patrocinados por Laboratorios Asofarma.
Dra. Ana Teresa Abreu y Abreu es miembro del consejo asesor de Laboratorios Biocodex, Sanofi y Takeda. Ponente para Laboratorios Biocodex, Carnot, Mayoly-Spindler, Signafarma y Takeda.
Dr. Eduardo Cerda Contreras es miembro del Consejo Asesor y ponente para Laboratorios Carnot.
Dr. Paulo César Gómez Castaños es conferencista para Laboratorios Sanofi y Takeda.
Dra. Marina Alejandra González Martínez es ponente para Grünenthal.
Dr. Francisco M. Huerta Iga es miembro del Consejo Asesor y conferencista para Laboratorios Asofarma y Takeda.
Dra. María Eugenia Icaza Chávez es conferencista para Laboratorios Asofarma y Takeda.
Dr. Miguel Morales Arámbula es conferencista para Laboratorios Takeda y Asofarma.
Dr. Genaro Vázquez Elizondo es conferencista y asesor externo de los laboratorios Alfa-Wassermann y Asofarma, y participa en protocolos de investigación patrocinados por Laboratorios Asofarma.
Dr. Miguel A. Valdovinos es miembro del consejo asesor y conferencista de Takeda, Menarini, y Mayoly-Spindler.
Dra. Alicia Sofía Villar Chávez es ponente para laboratorios Asofarma y Carnot.
Dr. Jorge Ibarra Palomino, Dr. Manlio F. Márquez Murillo, Dr. Luis Raúl Valdovinos, Dra. Mónica Zavala Solares y Dr. Sami Rene Achem no tienen conflicto de intereses para los propósitos del presente consenso.