La angiodisplasia gastrointestinal (ADGI) es la anomalía vascular más común en el tracto gastrointestinal, sin embargo, poco se sabe de los factores que favorecen su sangrado. El objetivo de nuestro estudio fue determinar las características de los pacientes con lesiones de ADGI en una población tunecina e identificar los factores de riesgo de sangrado.
Pacientes y métodosSe realizó un estudio retrospectivo de enero del 2010 a febrero del 2020 en un centro médico de tercer nivel de Túnez. Los datos clínicos y endoscópicos fueron obtenidos de los reportes médicos de cada uno de los pacientes. Dividimos a los pacientes en 2grupos: el grupo A fue conformado con pacientes con ADGI sintomática y el grupo B con pacientes con lesiones incidentales. El grupo A fue dividido a su vez en 2subgrupos, según la presencia o ausencia de sangrado recurrente. Los grupos fueron comparados por características clínicas, de laboratorio y endoscópicas.
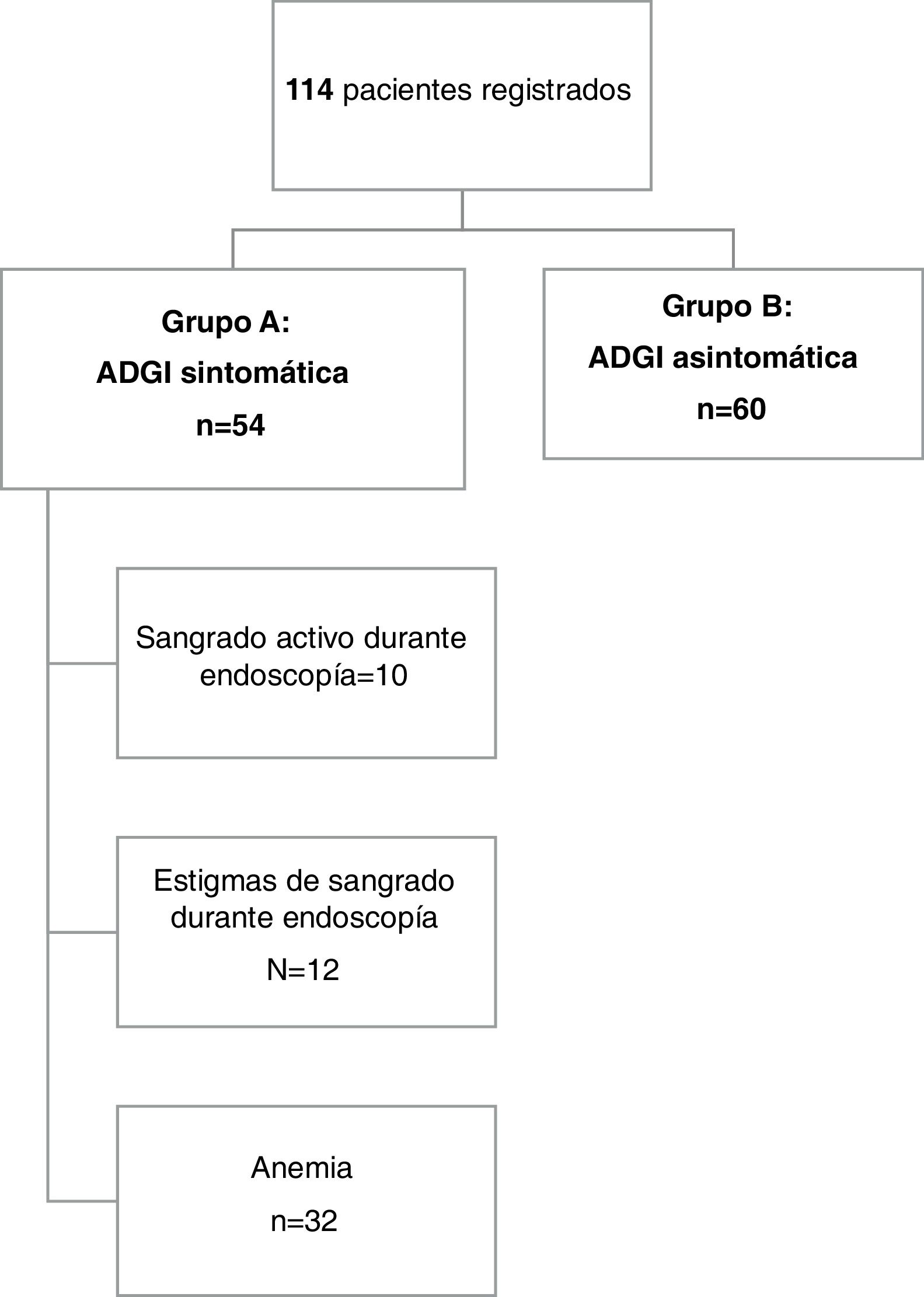
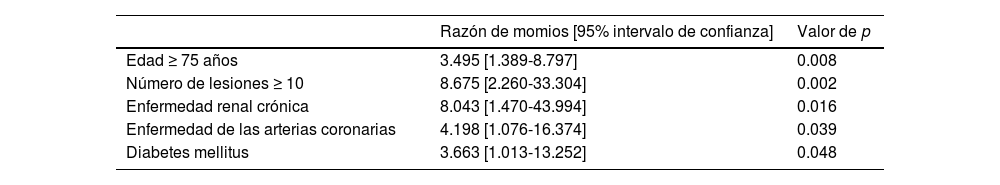
ResultadosSe diagnosticó ADGI en 114 pacientes, con una edad promedio de 70± 13.3 años. Las lesiones de ADGI se localizaron principalmente en el colon (n=72, 63%). Presentaron sangrado asociado a ADGI 54pacientes (47%). El diagnóstico de sangrado se realizó durante los procedimientos endoscópicos al visualizar sangrado activo y estigmas de hemorragia reciente en 10 (18.5%) y 12 (22%.2%) casos, respectivamente. La mayoría de los pacientes fueron tratados con coagulación con plasma de argón (93%). Los factores predictores de sangrado fueron la edad> 75 años, el número de lesiones> 10, enfermedad renal crónica, diabetes mellitus y enfermedad de las arterias coronarias (p: 0.008, 0.002, 0.016, 0.048 y 0.039, respectivamente).
ConclusiónConocer los factores de riesgo de sangrado ayuda a los endoscopistas en el proceso de toma de decisiones en casos de angiodisplasia.
Gastrointestinal angiodysplasia (GIAD) is the most common vascular anomaly in the gastrointestinal tract, yet little is known about the factors favoring their bleeding. Our study aim was to determine the characteristics of patients with GIAD lesions in a Tunisian population and identify the risk factors of bleeding.
Patients and methodsA retrospective study was carried out from January 2010 to February 2020 at a tertiary care medical center in Tunisia. Clinical and endoscopic data were collected from each patient's medical reports. We divided the patients into 2groups: group A, patients with symptomatic GIAD; and group B, patients with incidental lesions. Group A was subsequently divided into 2subgroups, according to the presence or absence of recurrent bleeding. The groups were compared by clinical, laboratory, and endoscopic features.
ResultsGIAD was diagnosed in 114 patients, with a mean age of 70±13.3 years. GIAD lesions were mainly located in the colon (n=72, 63%). Fifty-four patients (47%) presented with GIAD-related bleeding. The bleeding diagnosis was made during endoscopic procedures by visualizing active bleeding and the stigmata of recent hemorrhage in 10 (18.5%) and 12 (22.2%) cases, respectively. Most of the patients were treated by argon plasma coagulation (93%). Predictive factors of bleeding were age>75 years, number of lesions>10, chronic kidney disease, diabetes mellitus, and coronary artery disease (P: 0.008, 0.002, 0.016, 0.048; and 0.039, respectively).
ConclusionKnowledge of the predictive factors of bleeding aids endoscopists in the decision-making process in cases of angiodysplasia.
La angiodisplasia gastrointestinal (ADGI) es la anormalidad vascular más común en el tracto gastrointestinal (GI). Se define como comunicaciones patológicamente dilatadas entre venas y capilares1. Desde el punto de vista histológico, consiste en una acumulación de venas, vénulas y capilares de paredes delgadas, a lo largo del endotelio en la mucosa y submucosa. Estos vasos carecen de una capa muscular lisa, lo cual los hace propensos a sangrar1.
En una endoscopia, las lesiones de ADGI son planas o ligeramente elevadas, de color rojo brillante y bien delimitadas o en forma de helecho en estrella y miden de 2 a 10mm de diámetro1. Pueden ocurrir en múltiples sitios dentro del tracto GI, incluido el colon y el estómago, donde pueden ser diagnosticadas fácilmente. Las lesiones de angiodisplasia del intestino delgado aún son un desafío de diagnóstico y tratamiento, a pesar de los avances tecnológicos de las últimas 2décadas en el campo de la exploración del intestino delgado. La distribución de las lesiones en el tracto GI no es bien conocida, ya que la mayoría de los estudios no incluyen la evaluación endoscópica del intestino delgado2. Las lesiones de ADGI suman hasta el 5% de todas las causas de sangrado GI. En pacientes con sangrado GI de origen incierto, el cual se define como sangrado de una fuente que no puede ser identificada por medio de endoscopia superior o inferior, se encuentra la angiodisplasia del intestino delgado en aproximadamente el 40% de las exploraciones3. Además de la edad avanzada, se han reportado morbilidades tales como estenosis aórtica, insuficiencia renal, cirrosis, enfermedad de von Willebrand, cirrosis hepática y enfermedad pulmonar, como factores de predisposición para la ADGI4. En la actualidad, se conoce poco sobre los factores de riesgo para el sangrado de lesiones de ADGI. Sin embargo, la identificación de dichos factores puede ayudar a predecir y prevenir tanto la ocurrencia como la recurrencia del sangrado asociado con ADGI. De hecho, los pacientes con un perfil de alto riesgo se beneficiarían de un tratamiento endoscópico preventivo, monitoreo cercano y, posiblemente, de la prescripción temprana de terapia médica profiláctica. De tal manera que el objetivo de nuestro estudio fue describir las características clínicas de pacientes con lesiones de ADGI en una población tunecina y determinar los factores de riesgo que promueven su sangrado.
MétodosPacientesEl estudio fue diseñado como una revisión de expedientes médicos en un solo centro. Los reportes de todos los procedimientos endoscópicos superiores, inferiores y de intestino delgado realizados entre enero del 2010 y febrero del 2020 en la Unidad de Endoscopia del Hospital Universitario Taher Maamouri (Nabeul, Túnez) fueron revisados. Incluimos a pacientes con ADGI identificada, con o sin signos de sangrado. No incluimos a pacientes con otras malformaciones vasculares, como ectasia vascular antral, a pacientes con procedimientos endoscópicos incompletos ni a pacientes con preparación intestinal deficiente. Tampoco incluimos a pacientes con sangrado GI que pudiera ser explicado por otras lesiones (como sangrado varicoso, úlceras pépticas o esofagitis), a menos que existiera sangrado activo o estigmas de hemorragia alrededor de la lesión de ADGI durante la endoscopia.
Recolección de datosRecolectamos los datos clínicos de los expedientes médicos y los reportes endoscópicos de cada uno de los pacientes. En los casos de reportes o expedientes incompletos contactamos a los pacientes o familiares para obtener las variables requeridas. Las siguientes fueron las principales características obtenidas: edad, sexo, tabaquismo, consumo de alcohol (en gramos por día), historia médica (hipertensión arterial, enfermedad de arterias coronarias, cardiopatía valvular, estenosis aórtica, fibrilación auricular, diabetes mellitus de tipo 2, dislipidemia, enfermedad renal crónica [ERC] definida como una tasa de filtración glomerular menor a 60ml/min/1.73 m2, y enfermedad renal en etapa terminal) y antecedentes de medicamentos (medicamentos antiinflamatorios no esteroideos [AINE], terapia de antiagregantes plaquetarios y anticoagulantes). También determinamos la indicación para el procedimiento endoscópico y la necesidad de hospitalización debida a sangrado GI. Además, determinamos las siguientes características biológicas en pacientes con anemia o sangrado GI: nivel de creatinina, conteo de plaquetas, tiempo de protrombina y nivel de hemoglobina. La anemia fue definida como un nivel de hemoglobina menor a 13g/dl en hombres y 12g/dl en mujeres.
Las siguientes características endoscópicas fueron determinadas en todos los pacientes: ubicación, número y tamaño de las lesiones de ADGI. En casos de múltiples lesiones de ADGI, se utilizó el tamaño de la lesión de mayor tamaño para cada segmento del tracto GI. También determinamos la existencia de sangrado activo o de estigmas de hemorragia reciente alrededor de las lesiones de ADGI, definidas por coágulos o puntos pigmentados adherentes. Todos los tratamientos que recibieron nuestros pacientes fueron determinados (médicos, endoscópicos y quirúrgicos). El manejo conservador consistió en transfusiones sanguíneas, en caso de ser necesarias; la suspensión de antiplaquetas, anticoagulantes o AINE y la corrección de anormalidades hemostáticas. El tratamiento médico consistió en la prescripción de octreótido. La dosis de octreótido y su ruta de administración, al igual que sus efectos secundarios, fueron determinados.
El manejo endoscópico de lesiones de ADGI en nuestra unidad se basa en coagulación con plasma de argón (CPA). Todas las sesiones de CPA se practicaron con gastroscopios, colonoscopios y duodenoscopios estándar (Olympus Corporation, Tokio, Japón) con un canal de trabajo de al menos 2.8mm. La CPA fue aplicada hasta que todas las lesiones de ADGI visibles estuvieron completamente coaguladas. El número de sesiones de CPA y el intervalo de tiempo entre ellas fue determinado, al igual que cualquier efecto secundario o complicación.
Diseño y definicionesLos pacientes fueron divididos en 2grupos: el grupo A y el grupo B. El grupo A consistió en pacientes con lesiones de ADGI sintomáticas. Se realizó el diagnóstico de sangrado de lesiones de ADGI en caso de visualizar sangrado activo o estigmas de hemorragias durante la endoscopia, o si el paciente presentaba sangrado GI o anemia sin encontrar causas potenciales del sangrado. El grupo B consistió en pacientes con lesiones de ADGI asintomáticas (pacientes sin sangrado o anemia). Para determinar los factores de riesgo de sangrado de ADGI, comparamos las características clínicas, endoscópicas y de laboratorio de los pacientes de los grupos A y B.
Análisis estadísticoLas variables continuas con distribución normal fueron expresadas como media±desviación estándar y las que no presentaron distribución normal fueron expresadas como mediana y rango intercuartil. Se utilizó la prueba de Kolmogórov-Smirnov para verificar la normalidad de las variables continuas. Las variables cualitativas se expresaron como números y porcentajes y fueron comparadas por medio de la prueba de chi cuadrada o la prueba exacta de Fisher. Al desarrollar el modelo final, investigamos todas las posibles combinaciones de las variables candidatas cuyos valores de p fueran<0.2 en el análisis univariado. Se aplicaron pruebas estadísticas de 2colas y se consideró un valor de p<0.05 como estadísticamente significativo. El análisis se realizó utilizando el programa estadístico SPSS versión 22 para Windows.
Consideraciones éticasNo se solicitó el consentimiento informado para la publicación del presente artículo, dado que el estudio fue retrospectivo y no se incluyeron datos personales de los pacientes que permitieran su identificación. El estudio fue aprobado por el Comité de Ética de la Facultad de Medicina de Monastir. Los principios de la Declaración de Helsinki fueron respetados en la totalidad del estudio.
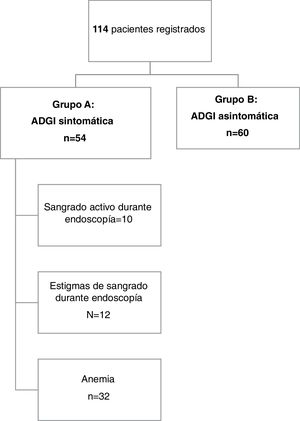
ResultadosEstudio descriptivoLa figura 1 muestra un resumen de los pacientes estudiados. Se incluyó a un total de 114 pacientes en el estudio. La edad media de los pacientes fue de 70.1±13.3 años, con un rango de 25 a 95 años. El 41% de los pacientes (n=47) tenían 75 años o más y el 62.3% de ellos eran hombres (71 pacientes). Se reportó consumo crónico de alcohol en 5 pacientes (4.4%) y el 19.3% de nuestra población era fumadora.
Tenían enfermedades preexistentes 78pacientes (68.4%; solo 36 presentaron enfermedades crónicas. Tenían ERC 17 pacientes (14.9%), de los cuales 10 (8.8%) se realizaban hemodiálisis. Se encontraron enfermedades cardiovasculares en 78 pacientes (68.4%). Enfermedad de arterias coronarias, hipertensión arterial y estenosis aórtica fueron identificadas en 19 (16.7%), 47 (41.3%) y 3 (2.6%) pacientes, respectivamente. Ninguno de los pacientes con estenosis aórtica tenía reemplazo de válvulas. En 12 pacientes se identificó cirrosis y estuvo relacionada con hepatitis B en 9 pacientes (8%) y con hepatitis C en 3 casos (2.6%). Otros 7 pacientes (6.1%) presentaron enfermedad pulmonar obstructiva crónica. A un paciente se le había dado seguimiento desde la infancia por enfermedad de von Willebrand y 18 pacientes (15.8%) estaban tomando medicamentos que podían interferir con la hemodiálisis primaria o secundaria; 9 pacientes (7.9%) estaban tomando acenocumarol, en todos ellos los valores del coeficiente internacional normalizado estuvieron dentro del rango terapéutico.
Se identificaron lesiones sintomáticas de ADGI (grupo A) en 54 pacientes (47.4%) del total de la población estudiada. Presentaron anemia 23 pacientes (42.6%) y los 31 pacientes restantes (57.4%) presentaron sangrado evidente. La melena fue la forma predominante de sangrado GI en el grupo A (n=25, 46.3%), seguida de hematemesis (n=4, 7.4%) y hematoquecia (n=2, 3.7%).
El diagnóstico de sangrado fue realizado durante los procedimientos endoscópicos al visualizar sangrado activo o estigmas de hemorragia reciente en 10 (18.5%) y 12 (22.2%) casos, respectivamente,
En el resto de los 32 casos, los pacientes presentaron anemia microcítica hipocrómica o sangrado evidente, sin una lesión, además de la de ADGI, ni en el tracto GI superior ni en el inferior que pudiera causar el sangrado GI. El nivel de hemoglobina medio en el grupo A fue de 6.4g/dl (± 2.3), con un rango de 1.8 a 15g/dl. El tiempo de protrombina en 6 pacientes fue de menos del 50%, de los cuales 2eran cirróticos. Los 4 pacientes restantes estaban tomando acenocumarol, pero no se documentó anticoagulación excesiva.
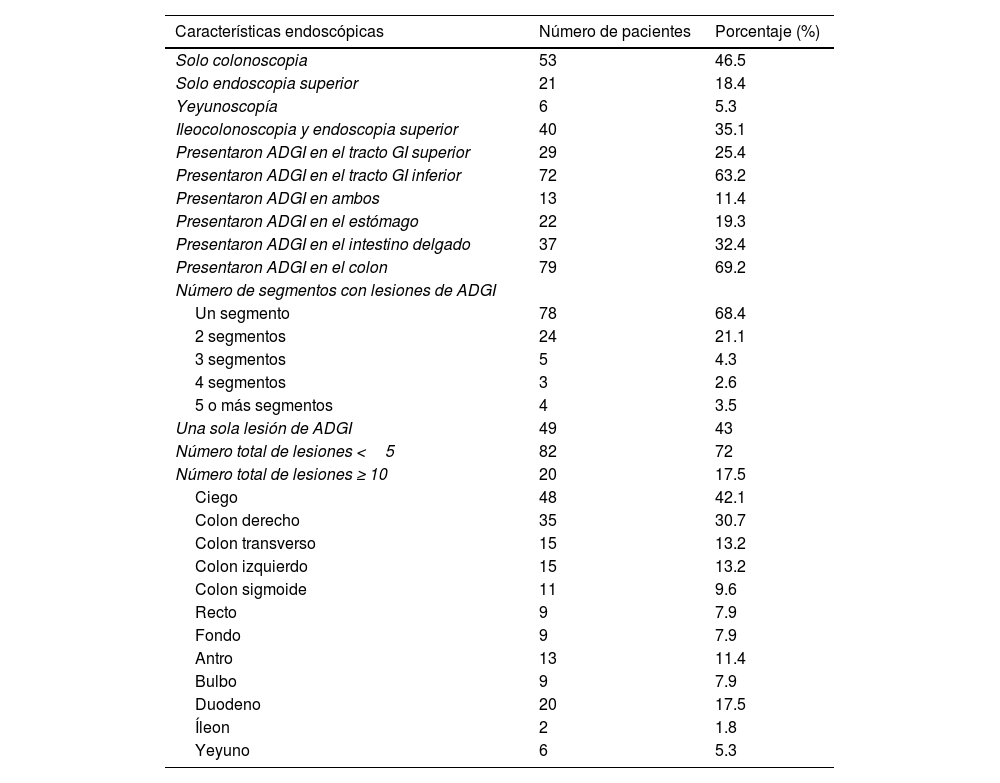
Respecto a los procedimientos endoscópicos, a 53 pacientes (46.5%) se les hizo colonoscopia y a 21 (18.4%) solamente endoscopia GI superior. En todos los reportes colonoscópicos incluidos en el estudio se exploró el ciego y la preparación intestinal fue juzgada como buena o excelente por el endoscopista. En 6 pacientes con sangrado de origen incierto se realizó yeyunoscopia. La distribución de las lesiones de ADGI involucró los siguientes sitios: el estómago (fondo y antro) en 22 casos (19.3%), el intestino delgado (bulbo, duodeno, yeyuno e íleon) en 37 casos (32.4%) y el colon en 79 casos (69.2%). Los siguientes segmentos GI estuvieron afectados: fondo, antro, bulbo, duodeno, yeyuno, íleon, colon y recto. Los hallazgos endoscópicos se muestran en la tabla 1. Respecto al número de lesiones, las ADGI fueron únicas en 49 pacientes (43%) y fueron 10 o más en 20 casos (17.5%). El tamaño de la lesión fue estimado en 98 reportes endoscópicos y su rango fue de 1 a 20mm.
Características endoscópicas de pacientes con lesiones de ADGI
| Características endoscópicas | Número de pacientes | Porcentaje (%) |
|---|---|---|
| Solo colonoscopia | 53 | 46.5 |
| Solo endoscopia superior | 21 | 18.4 |
| Yeyunoscopía | 6 | 5.3 |
| Ileocolonoscopia y endoscopia superior | 40 | 35.1 |
| Presentaron ADGI en el tracto GI superior | 29 | 25.4 |
| Presentaron ADGI en el tracto GI inferior | 72 | 63.2 |
| Presentaron ADGI en ambos | 13 | 11.4 |
| Presentaron ADGI en el estómago | 22 | 19.3 |
| Presentaron ADGI en el intestino delgado | 37 | 32.4 |
| Presentaron ADGI en el colon | 79 | 69.2 |
| Número de segmentos con lesiones de ADGI | ||
| Un segmento | 78 | 68.4 |
| 2 segmentos | 24 | 21.1 |
| 3 segmentos | 5 | 4.3 |
| 4 segmentos | 3 | 2.6 |
| 5 o más segmentos | 4 | 3.5 |
| Una sola lesión de ADGI | 49 | 43 |
| Número total de lesiones <5 | 82 | 72 |
| Número total de lesiones ≥ 10 | 20 | 17.5 |
| Ciego | 48 | 42.1 |
| Colon derecho | 35 | 30.7 |
| Colon transverso | 15 | 13.2 |
| Colon izquierdo | 15 | 13.2 |
| Colon sigmoide | 11 | 9.6 |
| Recto | 9 | 7.9 |
| Fondo | 9 | 7.9 |
| Antro | 13 | 11.4 |
| Bulbo | 9 | 7.9 |
| Duodeno | 20 | 17.5 |
| Íleon | 2 | 1.8 |
| Yeyuno | 6 | 5.3 |
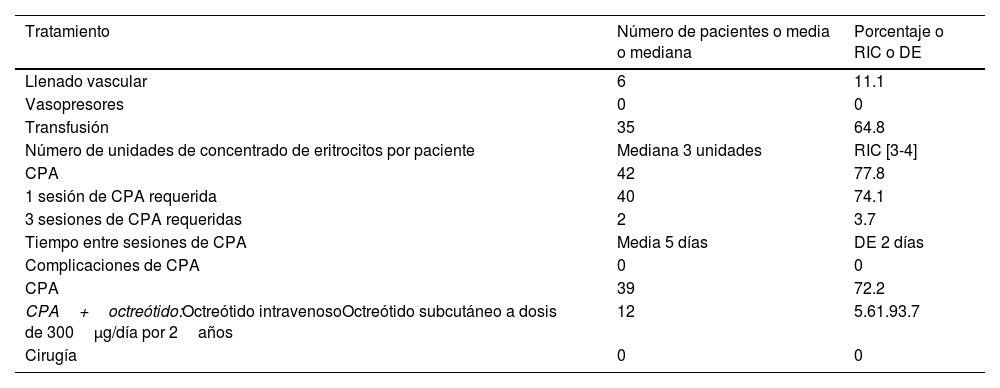
De los 54 pacientes del grupo A, 46 (85.2%) requirieron hospitalización, 6(11%) de los cuales presentaron inestabilidad hemodinámica inicial. En todos esos casos, no fue necesario el uso de fármacos vasopresores, dado que los pacientes respondieron rápidamente al llenado vascular. De los 54 pacientes, 35 (64.8%) requirieron transfusión sanguínea.
En la tabla 2 se muestra el manejo de los pacientes del grupo A. De los 60 pacientes cuyas lesiones de ADGI fueron encontradas de forma incidental, 14 fueron tratados con CPA durante el mismo procedimiento. No fueron planeadas sesiones adicionales.
Tratamientos recibidos por pacientes con sangrado asociado a ADGI
| Tratamiento | Número de pacientes o media o mediana | Porcentaje o RIC o DE |
|---|---|---|
| Llenado vascular | 6 | 11.1 |
| Vasopresores | 0 | 0 |
| Transfusión | 35 | 64.8 |
| Número de unidades de concentrado de eritrocitos por paciente | Mediana 3 unidades | RIC [3-4] |
| CPA | 42 | 77.8 |
| 1 sesión de CPA requerida | 40 | 74.1 |
| 3 sesiones de CPA requeridas | 2 | 3.7 |
| Tiempo entre sesiones de CPA | Media 5 días | DE 2 días |
| Complicaciones de CPA | 0 | 0 |
| CPA | 39 | 72.2 |
| CPA+octreótido:Octreótido intravenosoOctreótido subcutáneo a dosis de 300μg/día por 2años | 12 | 5.61.93.7 |
| Cirugía | 0 | 0 |
CPA: coagulación con plasma de argón; DE: desviación estándar; RIC: rango intercuartil.
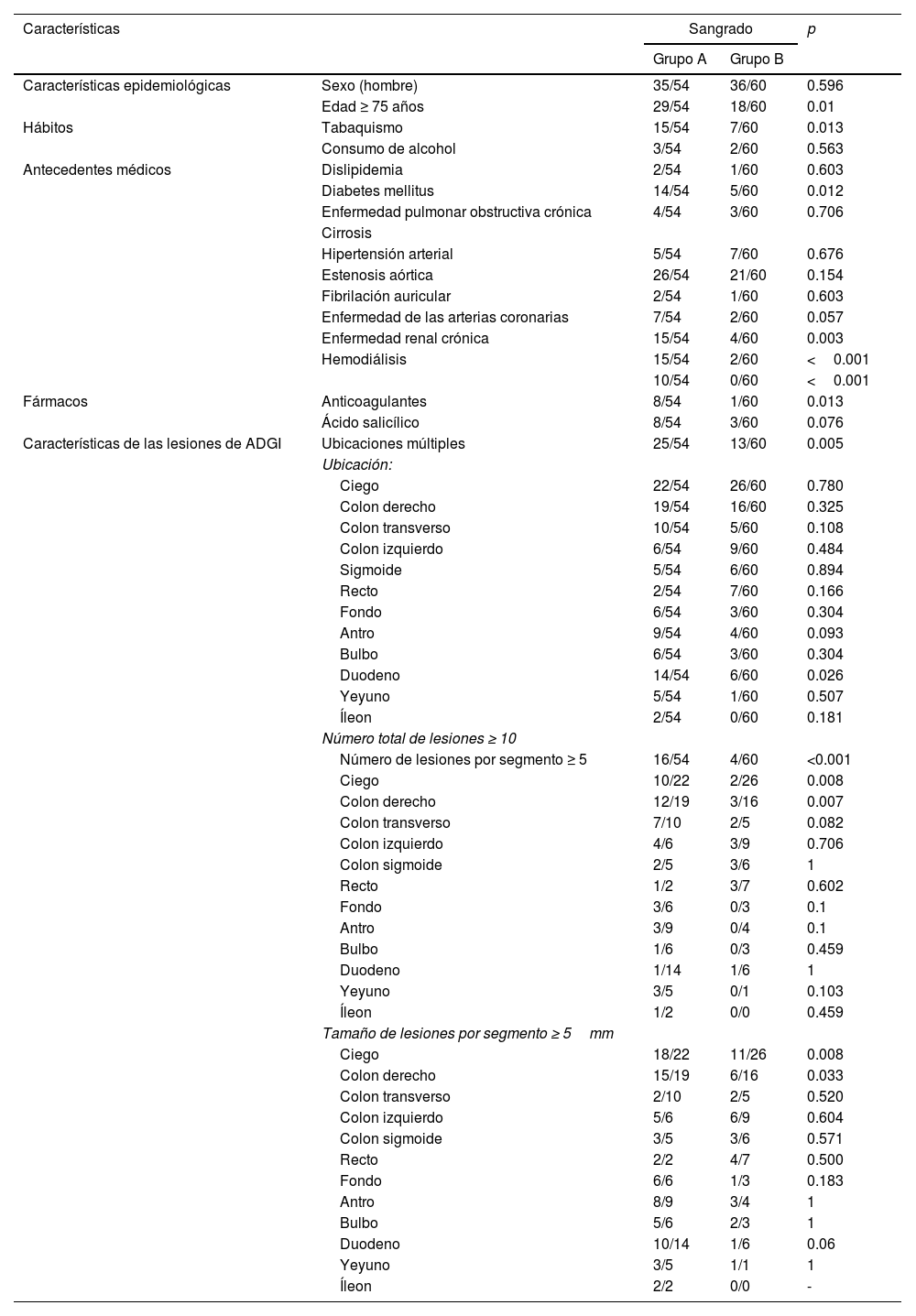
La tabla 3 resume el estudio univariado de los factores de riesgo potenciales para sangrado ADGI. Los pacientes del grupo A y del grupo B presentaron la misma distribución de sexo (p=0.596). No existieron diferencias significativas en la distribución de las lesiones de ADGI a lo largo del tracto GI, excepto en el duodeno. En el análisis multivariado, los factores de riesgo independientes para el sangrado asociado con ADGI fueron la edad ≥75 años, un total de≥10 lesiones, ERC, diabetes mellitus y enfermedad de las arterias coronarias (tabla 4).
Factores de riesgo de sangrado en ADGI: estudio univariado
| Características | Sangrado | p | ||
|---|---|---|---|---|
| Grupo A | Grupo B | |||
| Características epidemiológicas | Sexo (hombre) | 35/54 | 36/60 | 0.596 |
| Edad ≥ 75 años | 29/54 | 18/60 | 0.01 | |
| Hábitos | Tabaquismo | 15/54 | 7/60 | 0.013 |
| Consumo de alcohol | 3/54 | 2/60 | 0.563 | |
| Antecedentes médicos | Dislipidemia | 2/54 | 1/60 | 0.603 |
| Diabetes mellitus | 14/54 | 5/60 | 0.012 | |
| Enfermedad pulmonar obstructiva crónica | 4/54 | 3/60 | 0.706 | |
| Cirrosis | ||||
| Hipertensión arterial | 5/54 | 7/60 | 0.676 | |
| Estenosis aórtica | 26/54 | 21/60 | 0.154 | |
| Fibrilación auricular | 2/54 | 1/60 | 0.603 | |
| Enfermedad de las arterias coronarias | 7/54 | 2/60 | 0.057 | |
| Enfermedad renal crónica | 15/54 | 4/60 | 0.003 | |
| Hemodiálisis | 15/54 | 2/60 | <0.001 | |
| 10/54 | 0/60 | <0.001 | ||
| Fármacos | Anticoagulantes | 8/54 | 1/60 | 0.013 |
| Ácido salicílico | 8/54 | 3/60 | 0.076 | |
| Características de las lesiones de ADGI | Ubicaciones múltiples | 25/54 | 13/60 | 0.005 |
| Ubicación: | ||||
| Ciego | 22/54 | 26/60 | 0.780 | |
| Colon derecho | 19/54 | 16/60 | 0.325 | |
| Colon transverso | 10/54 | 5/60 | 0.108 | |
| Colon izquierdo | 6/54 | 9/60 | 0.484 | |
| Sigmoide | 5/54 | 6/60 | 0.894 | |
| Recto | 2/54 | 7/60 | 0.166 | |
| Fondo | 6/54 | 3/60 | 0.304 | |
| Antro | 9/54 | 4/60 | 0.093 | |
| Bulbo | 6/54 | 3/60 | 0.304 | |
| Duodeno | 14/54 | 6/60 | 0.026 | |
| Yeyuno | 5/54 | 1/60 | 0.507 | |
| Íleon | 2/54 | 0/60 | 0.181 | |
| Número total de lesiones ≥ 10 | ||||
| Número de lesiones por segmento ≥ 5 | 16/54 | 4/60 | <0.001 | |
| Ciego | 10/22 | 2/26 | 0.008 | |
| Colon derecho | 12/19 | 3/16 | 0.007 | |
| Colon transverso | 7/10 | 2/5 | 0.082 | |
| Colon izquierdo | 4/6 | 3/9 | 0.706 | |
| Colon sigmoide | 2/5 | 3/6 | 1 | |
| Recto | 1/2 | 3/7 | 0.602 | |
| Fondo | 3/6 | 0/3 | 0.1 | |
| Antro | 3/9 | 0/4 | 0.1 | |
| Bulbo | 1/6 | 0/3 | 0.459 | |
| Duodeno | 1/14 | 1/6 | 1 | |
| Yeyuno | 3/5 | 0/1 | 0.103 | |
| Íleon | 1/2 | 0/0 | 0.459 | |
| Tamaño de lesiones por segmento ≥ 5mm | ||||
| Ciego | 18/22 | 11/26 | 0.008 | |
| Colon derecho | 15/19 | 6/16 | 0.033 | |
| Colon transverso | 2/10 | 2/5 | 0.520 | |
| Colon izquierdo | 5/6 | 6/9 | 0.604 | |
| Colon sigmoide | 3/5 | 3/6 | 0.571 | |
| Recto | 2/2 | 4/7 | 0.500 | |
| Fondo | 6/6 | 1/3 | 0.183 | |
| Antro | 8/9 | 3/4 | 1 | |
| Bulbo | 5/6 | 2/3 | 1 | |
| Duodeno | 10/14 | 1/6 | 0.06 | |
| Yeyuno | 3/5 | 1/1 | 1 | |
| Íleon | 2/2 | 0/0 | - | |
Factores de riesgo de sangrado en ADGI: estudio multivariado
| Razón de momios [95% intervalo de confianza] | Valor de p | |
|---|---|---|
| Edad ≥ 75 años | 3.495 [1.389-8.797] | 0.008 |
| Número de lesiones ≥ 10 | 8.675 [2.260-33.304] | 0.002 |
| Enfermedad renal crónica | 8.043 [1.470-43.994] | 0.016 |
| Enfermedad de las arterias coronarias | 4.198 [1.076-16.374] | 0.039 |
| Diabetes mellitus | 3.663 [1.013-13.252] | 0.048 |
En el presente estudio evaluamos las características clínicas de la ADGI en una población tunecina e identificamos las siguientes características como factores de riesgo independientes promotores de sangrado: edad avanzada, ERC, enfermedad de arterias coronarias, diabetes mellitus ytener ≥10 lesiones. La historia natural de la ADGI no se entiende del todo. Sin embargo, el hecho de que todas las lesiones tengan el potencial de sangrado y de que el sangrado en las lesiones incidentales sea menos probable es aceptado universalmente2. Respecto a las lesiones de ADGI sintomáticas, la presentación clínica varía de sangrado oculto a sangrado visible (melena, hematemesis, hematoquecia con o sin inestabilidad hemodinámica). En nuestro estudio, alrededor de la mitad de los pacientes (52.6%) presentaron lesiones de ADGI incidentales. En el resto de los casos, la melena fue el síntoma más común, seguido de anemia hipocrómica, hematemesis y hematoquecia. Estos resultados corroboran la epidemiología conocida de las lesiones de ADGI4-6.
En nuestro estudio, la mayoría de las lesiones ADGI se localizaron en el colon (69.2%), en el intestino delgado (32.5%) y en el estómago (19.3%%). Dicha distribución era considerada la más frecuente antes de la era de la enteroscopia de intestino delgado y la cápsula endoscópica de intestino delgado. De hecho, se creía que las lesiones de ADGI estaban localizadas principalmente en el ciego y el colon derecho y, en menor medida, en el estómago e intestino delgado. Sin embargo, en estudios recientes se ha observado que el verdadero es el orden opuesto. Neu et al. encontraron en su estudio con pacientes con ADGI con examen endoscópico de la totalidad del tracto GI que el intestino delgado era el sitio más comúnmente afectado7. El mismo patrón de distribución fue descrito por DeBedet et al. y por Bollinger et al.8,9. Cabe notar que incluso la distribución de la angiodisplasia en el colon es controvertida. Se reporta que el colon derecho es la ubicación colónica más común en estudios realizados en occidente, mientras que en estudios japoneses y taiwaneses se ha reportado que la angiodisplasia colónica se ubica sobre todo en el colon izquierdo5. En nuestro estudio, la ubicación más frecuente en el colon fue el ciego (56%), seguida del colon derecho (25.3%), el colon izquierdo (8%), el colon transverso (5.3%) y, por último, el recto (1.3%).
En la actualidad, no existen recomendaciones de tratamiento para las lesiones de ADGI, lo cual explica la amplia variabilidad en su manejo. Este problema fue destacado en un estudio holandés de 2015, en el cual se aplicó una encuesta a nivel nacional para evaluar el abordaje de tratamiento para ADGI de los gastroenterólogos10. En la práctica actual, los clínicos tienden a posponer el tratamiento de ADGI sintomática cuando no se encuentran estigmas o hemorragias y la mayoría de los autores están de acuerdo en no tratar las lesiones incidentales. Por lo tanto, la identificación de los factores de riesgo de sangrado de la ADGI es de la mayor importancia para comprender mejor los mecanismos y factores que causan que una lesión de ADGI sangre y, en consecuencia, auxiliar a los endoscopistas a identificar los grupos de alto riesgo en quienes sea posible anticipar, predecir y considerar el sangrado, incluso en la ausencia de estigmas o hemorragia.
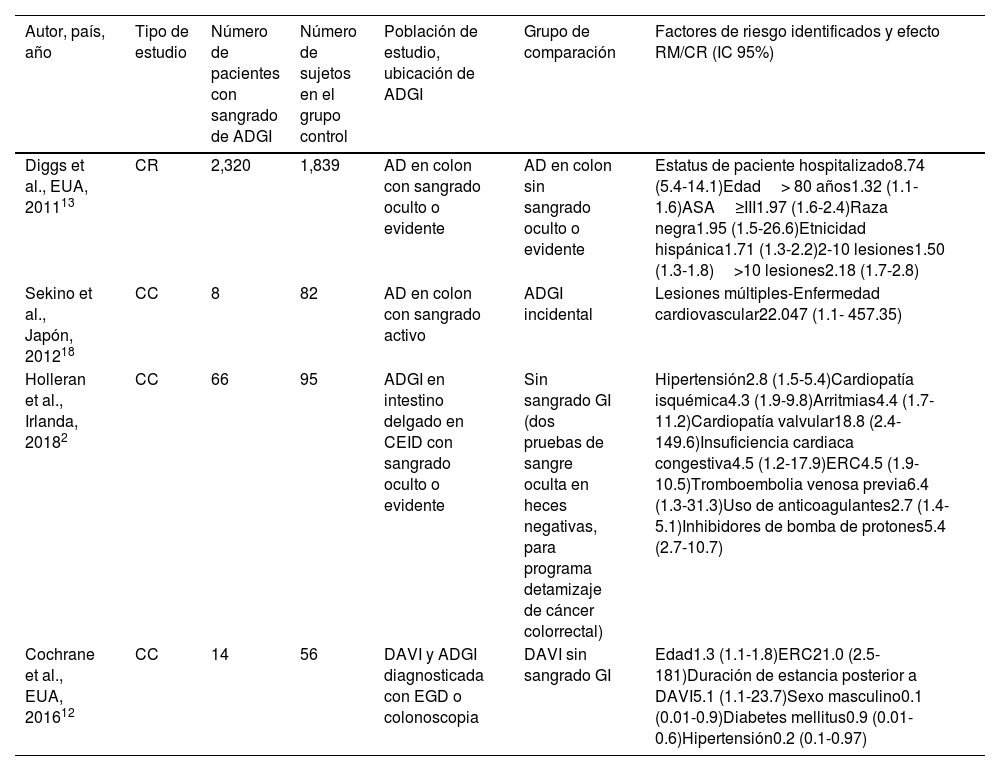
Apenas hace 2años, en lo que es aún un área de investigación nueva, se destacó la diferencia de los factores de riesgo entre angiodisplasia incidental y sintomática en un estudio de caso-control, utilizando una muestra aleatoria de la población general como grupo control11. Los resultados del estudio antes mencionado llevaron a los autores a concluir que las lesiones de ADGI incidentales y sintomáticas podrían ser diferentes estados de enfermedad. Los estudios sobre estos factores de riesgo de sangrado disponibles actualmente se resumen en la tabla 5. Sin embargo, estos estudios son muy heterogéneos, ya que algunos incluyen solo una ubicación y se utilizaron diferentes grupos control. Desafortunadamente, los estudios cuyos grupos control no son de pacientes con lesiones de ADGI incidentales no nos permiten distinguir los factores específicos que podrían ser utilizados para diferenciar de manera adecuada las lesiones de ADGI incidentales de las sintomáticas durante la endoscopia.
Estudios que evalúan los factores de riesgo para sangrado asociado con angiodisplasia
| Autor, país, año | Tipo de estudio | Número de pacientes con sangrado de ADGI | Número de sujetos en el grupo control | Población de estudio, ubicación de ADGI | Grupo de comparación | Factores de riesgo identificados y efecto RM/CR (IC 95%) |
|---|---|---|---|---|---|---|
| Diggs et al., EUA, 201113 | CR | 2,320 | 1,839 | AD en colon con sangrado oculto o evidente | AD en colon sin sangrado oculto o evidente | Estatus de paciente hospitalizado8.74 (5.4-14.1)Edad> 80 años1.32 (1.1-1.6)ASA≥III1.97 (1.6-2.4)Raza negra1.95 (1.5-26.6)Etnicidad hispánica1.71 (1.3-2.2)2-10 lesiones1.50 (1.3-1.8)>10 lesiones2.18 (1.7-2.8) |
| Sekino et al., Japón, 201218 | CC | 8 | 82 | AD en colon con sangrado activo | ADGI incidental | Lesiones múltiples-Enfermedad cardiovascular22.047 (1.1- 457.35) |
| Holleran et al., Irlanda, 20182 | CC | 66 | 95 | ADGI en intestino delgado en CEID con sangrado oculto o evidente | Sin sangrado GI (dos pruebas de sangre oculta en heces negativas, para programa detamizaje de cáncer colorrectal) | Hipertensión2.8 (1.5-5.4)Cardiopatía isquémica4.3 (1.9-9.8)Arritmias4.4 (1.7-11.2)Cardiopatía valvular18.8 (2.4- 149.6)Insuficiencia cardiaca congestiva4.5 (1.2-17.9)ERC4.5 (1.9-10.5)Tromboembolia venosa previa6.4 (1.3-31.3)Uso de anticoagulantes2.7 (1.4-5.1)Inhibidores de bomba de protones5.4 (2.7-10.7) |
| Cochrane et al., EUA, 201612 | CC | 14 | 56 | DAVI y ADGI diagnosticada con EGD o colonoscopia | DAVI sin sangrado GI | Edad1.3 (1.1-1.8)ERC21.0 (2.5-181)Duración de estancia posterior a DAVI5.1 (1.1-23.7)Sexo masculino0.1 (0.01-0.9)Diabetes mellitus0.9 (0.01-0.6)Hipertensión0.2 (0.1-0.97) |
| Kim et al., Corea, 201615 | RC | 35 | 58 | SGIS debido a ADGI, diagnosticado con EGD, ECID o colonoscopia | ADGI incidental | Tamaño AD ≥ 1 cm(1.04-15.9)Sitio: estómago(1.2-12.5) |
| Nishimura et al., Japón, 201614 | RC | 29 | 406 | Colon, sangrado activo durante colonoscopia | ADGI sin sangrado activo durante endoscopia | Edad> 80 años5.15 (1.61-16.5)Cardiopatía6.88 (1.04-45.5)Uso de anticoagulantes4.22 (1.21-14.7)Lesiones múltiples6.67 (1.77-25.2)Lesiones de AD ≤ 5 mm17.7 (4.90-64.0) |
| Yi-Yen Tsai et al., Taiwán, 20185 | RC | 28 | 56 | Colon, ADGI con sangrado activo o estigmas de hemorragia | ADGI colónico incidental | Edad≥ 65 años4.035 (1.2-13.56)Cardiopatía hipertensiva1.564 (0.53-4.62)Fibrilación auricular4.788 (0.49-46.89) |
| Grooteman et al., Países Bajos, 201911 | CC | 176 | 94 | ADGI sintomático (sangrado evidente, anemia, prueba positiva inmunohistoquímica de sangre oculta en heces) | ADGI incidental | Edad avanzada1.7 (1.3-2.5)Cardiopatía valvular10.4 (1.6-69.2)Diabetes mellitus2.6 (1.03-6.7)Hiperlipidemia3.7 (1.1-12.1)Al menos 2lesiones de AD4.3 (1.3-14.4)Ubicación en ID8.7 (1.9-39.5)Ubicación en estómago3.3 (1.04-10.2)ADGI en grupos4.4 (1.2-16.4) |
| Bruno Neu et al., Alemania, 20207 | CC | 58 | 22 | Pacientes con AD (todas las ubicaciones)+antecedente positivo de sangrado GI o anemia+prueba positiva de sangre oculta en heces | ADGI incidental | Número total de lesiones de AD1.4 (1.1-1.7)Tiempo de cierre de prueba PFA/colágeno-epinefrina1.0 (1.0-1.0) |
AD: angiodisplasia; CC: estudio de caso-control; CEID: cápsula endoscópica del intestino delgado; CR: coeficiente de riesgo; CR: cohorte retrospectiva; DAVI: dispositivo de asistencia ventricular izquierda; EGD: esofagogastroduodenoscopía; ERC: enfermedad renal crónica; IC: intervalo de confianza; ID: intestino delgado; RM: razón de momios; SGIS: sangrado gastrointestinal superior.
En nuestro estudio, la edad mayor de 75 años fue identificada como un factor de riesgo independiente para el sangrado de ADGI. La edad avanzada es uno de los factores de riesgo de sangrado más comúnmente identificados5,11,12, aunque no se sabe aún por qué esto es así. En 2020, Neu et al. plantearon que la edad podría ser un factor generador de confusión, respecto al número de lesiones y otras comorbilidades7, pero establecieron una dependencia exponencial de la edad avanzada sobre un mayor número de lesiones de ADGI. Por lo tanto, nos aseguramos de buscar una asociación entre la presencia de múltiples lesiones y la edad avanzada (p=0.92) y ajustar para la edad en el análisis multivariado. Otro de estos factores de riesgo comúnmente aceptado es el número total de lesiones. En nuestro estudio, identificamos un número ≥ 10 lesiones como un factor de riesgo independiente para el sangrado de ADGI. Estos resultados concuerdan con la literatura actual. De hecho, Nishimura et al. y Diggs et al. identificaron las lesiones múltiples como un factor de riesgo para el sangrado activo en el colon13,14. Además, Neu et al. identificaron el número total de lesiones en todo el tracto GI como un factor independiente para el sangrado de ADGI7. Con base en estos hallazgos, varios autores han propuesto explorar la totalidad del tracto GI cuando se diagnostica una lesión de angiodisplasia, incluso si fue encontrada de forma incidental.
En nuestro estudio, no encontramos asociación entre ninguna de las ubicaciones GI y la ocurrencia de sangrado asociado con ADGI. De hecho, es aceptado que todas las lesiones de ADGI pueden sangrar en algún momento, independientemente de su ubicación. Sin embargo, si existe asociación entre ciertas ubicaciones y un mayor riesgo de sangrado, es aún desconocido. Un estudio que analizó los factores de riesgo de angiodisplasia con sangrado GI superior encontró que las ubicaciones no antrales (cuerpo gástrico/fondo) estaban asociadas con sangrado GI15. Estos hallazgos están en contraste con una teoría clásica que sostiene que el antro tiene mayor predisposición a la obstrucción venosa y ectasia vascular que otros segmentos del estómago debido al vigor de la contracción muscular en el antro. Aún se desconoce si la misma teoría podría ser propuesta para la angiodisplasia gástrica; incluso si pudiera ser así, esto solo explicaría un mayor número de lesiones en el antro y no la predisposición al sangrado16.
Respecto a la distribución en el colon, Nishimura et al. encontraron que las lesiones de angiodisplasia con sangrado activo estaban localizadas principalmente en el colon derecho14, pero sin significación estadística en el análisis multivariado. La ubicación en el lado derecho también fue identificada por Diggs et al. como un factor predictor independiente de necesidad de terapia endoscópica13. Sin embargo, estas asociaciones no han sido encontradas en estudios más recientes5,7. Creemos que no es posible sacar conclusiones de la literatura actual respecto al posible papel del tamaño y ubicación de las lesiones de ADGI en la ocurrencia de sangrado. En nuestro estudio, identificamos la ERC, la enfermedad de arterias coronarias y la diabetes mellitus como factores de riesgo de sangrado de ADGI independientes. Estos resultados coinciden con la literatura publicada.
Varios estudios han mostrado que los pacientes con ERC, con hemodiálisis o sin ella, tienen tendencia al sangrado GI, con independencia de la causa subyacente. Esto puede ser explicado por la acumulación de toxinas urémicas, lo cual afecta a la agregación y adherencia de plaquetas17. A diferencia de nuestros hallazgos, en los cuales no identificamos a la hemodiálisis como un factor de riesgo de sangrado de ADGI en el análisis multivariado, parece ser que el riesgo de sangrado en pacientes con ERC es aún mayor en los que cursan con hemodiálisis. Un estudio reciente de cobertura nacional de cohorte poblacional realizado en Taiwán, que investigó el impacto de la ERC sobre la incidencia del sagrado GI inferior, encontró que había una mayor incidencia del sangrado relacionado con angiodisplasia en pacientes con diálisis por ERC, en comparación con pacientes sin diálisis y sujetos control17.
La enfermedad de arterias coronarias estuvo asociada con el sangrado de ADGI en varios estudios13,14,18. El mecanismo subyacente es aún desconocido. Una posible explicación podría ser el amplio uso de antiagregantes en dicha población. En un estudio prospectivo de caso-control, Neu et al. demostraron que las alteraciones en la hemostasia primaria que se observan típicamente en pacientes con ácido salicílico están asociadas con un mayor riesgo de sangrado relacionado con ADGI7. De hecho, los antiagregantes pueden incrementar el riesgo de sangrado de ADGI al inhibir las plaquetas de manera irreversible. Esto puede ocurrir en el tracto GI superior, al reducir la síntesis de la prostaglandina, lo cual puede, a su vez, exponer a la mucosa gástrica a un nivel más elevado de acidez. Por otro lado, en un estudio retrospectivo de cohorte realizado por Cochrane et al., cuyo objetivo principal fue comparar la tasa de sangrado de ADGI en pacientes con dispositivos de asistencia ventricular izquierda de flujo continuo (DAVI) con otras causas de sangrado, encontraron que los pacientes con tratamiento con bomba inhibidora de protones tenían una probabilidad 14 veces mayor de tener sangrado GI, independientemente de la causa de sangrado subyacente12. Estos hallazgos contradicen la teoría de los antiagregantes y acidez. Sin embargo, los pacientes con DAVI forman un grupo muy específico, en el cual los mecanismos isquémicos están más amplificados y es probable que den cuenta de la ocurrencia de hemorragia de ADGI. Por lo tanto, consideramos que se requiere de mayor evaluación del papel de los antiagregantes en una población más grande y menos específica.
Fortalezas y limitacionesA pesar de la vastedad de la información que obtuvimos de una base de datos de 11 años, se deben reconocer algunas limitaciones. Primero, nuestro estudio es retrospectivo de un solo centro y refleja la práctica clínica actual y, por lo tanto, no es posible garantizar un manejo estándar para todos los pacientes. Segundo, de nuestros pacientes, el 64.9% fue tratado con endoscopia inferior o superior y ninguno de los pacientes con sangrado GI de origen incierto tuvo una evaluación GI endoscópica completa debido a que la cápsula endoscópica de intestino delgado no está disponible en los hospitales públicos de Túnez, ni está cubierta por el Fondo Nacional de Seguridad para la Salud. Finalmente, no determinamos los factores de riesgo para las lesiones de ADGI, dado que no tuvimos un grupo control.
A pesar de estas limitaciones, creemos que nuestro estudio tiene varias fortalezas. Primero, la identificación de diferentes factores de riesgo estuvo basada en un criterio de reclutamiento relativamente homogéneo y un análisis completo de una base de datos grande, lo cual nos permitió separar y comparar las lesiones de ADGI basándonos en su distribución, número, tamaño y desenlaces clínicos. Segundo, nuestro estudio arroja luz sobre la importancia de establecer una estratificación de riesgos basada en el manejo de las lesiones de ADGI y contribuye de manera activa a la evaluación y comprensión del papel sustancial de los factores de riesgo individuales en el panorama clínico.
ConclusiónEn el presente estudio identificamos como factores predictores independientes para el sangrado de ADGI la edad avanzada, un mayor número de lesiones, además de las comorbilidades de ERC, diabetes mellitus y enfermedad de las arterias coronarias. Con base en estos resultados y en nuestra revisión de la literatura actual, creemos firmemente que los pacientes con lesiones de ADGI incidentales y con factores de riesgo de sangrado de ADGI múltiples deben ser tratados y se beneficiarán de un tamizaje más, completo para más lesiones, en la totalidad del tracto GI. Sin embargo, se requiere de más estudios que analicen los diferentes perfiles de riesgo y la eficacia de los diferentes tratamientos.
FinanciaciónNo se recibió financiación alguna con relación al presente artículo.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.
Contribuciones de los autoresDr. Nasr y Dr. Khsiba: concepto y diseño.
Dr. Mahmoudi y Dr. Hamzaoui: análisis e interpretación de datos.
Dr. Ben Mohamed y Dr. Yaakoubi: borrador del artículo.
Dr. Medhioub: revisión crítica del artículo por contenido intelectual importante.
Dr. Azouz: aprobación final del artículo.