La biopsia hepática percutánea con análisis histopatológico es una herramienta valiosa para el diagnóstico, pronóstico y evaluación del tratamiento en las enfermedades hepáticas. Su realización guiada por ecografía es útil, pues permite realizar el procedimiento de manera más segura, disminuyendo el riesgo de complicaciones y la estancia hospitalaria. El objetivo es describir las indicaciones, el reporte histopatológico y las complicaciones asociadas a la realización de biopsia hepática percutánea guiada por ultrasonido en pacientes pediátricos.
Material y métodosSe incluyeron 102 procedimientos en pacientes <16 años a los cuales se les realizó biopsia hepática percutánea guiada por ultrasonido de enero 2014 a diciembre 2019. La información se obtuvo del archivo electrónico y reporte histopatológico. Los datos se analizaron mediante estadística descriptiva.
ResultadosSe realizaron 102 procedimientos en 99 pacientes, el 58.8% correspondiente al sexo femenino, con una mediana de edad de 72 meses. La hepatitis autoinmune (23.5%), transaminasemia (21.5%) y hepatopatía crónica (20.5%), representaron más del 65% de las indicaciones para la toma de biopsia hepática. Cuatro pacientes presentaron complicaciones inmediatas (3.9%), 3 de ellas fueron mayores (2.9%), lo que concuerda con lo reportado en la literatura internacional.
ConclusionesNuestro estudio corrobora la importancia de la biopsia hepática percutánea guiada por ecografía en el diagnóstico y el seguimiento en la población pediátrica, además de demostrar que es un procedimiento con baja tasa de complicaciones, observándose únicamente en el 3.9% de los pacientes.
Percutaneous liver biopsy with histopathologic analysis is a valuable tool for the diagnosis, prognosis, and treatment evaluation of liver diseases. Its ultrasound-guided performance is useful, making the procedure safer and reducing the risk for complications and hospital stay. Our aim was to describe the indications, histopathologic study, and complications associated with the performance of ultrasound-guided percutaneous liver biopsy in pediatric patients.
Material and methodsThe study included 102 ultrasound-guided percutaneous liver biopsies performed on patients <16 years of age, within the time frame of January 2014 and December 2019. The information was obtained from electronic files and histopathologic studies and the data were analyzed through descriptive statistics.
ResultsA total of 102 procedures were carried out on 99 patients. Mean patient age was 72 months and 58.8% of the patients were female. Over 65% of the indications for liver biopsy included autoimmune hepatitis (23.5%), elevated liver enzymes (21.5%), and chronic liver disease (20.5%). Four patients presented with immediate complications (3.9%), three of which were major (2.9%), concurring with that reported in the international literature.
ConclusionsOur study corroborates the importance of ultrasound-guided liver biopsy in the diagnosis and follow-up of pediatric patients. The procedure also had a low complication rate of only 3.9%.
La biopsia hepática percutánea (BHP) guiada por ultrasonido en pediatría, ha cobrado gran relevancia a lo largo del tiempo como método seguro de obtención de muestra para el análisis histopatológico en pacientes con hepatopatías agudas y crónicas, lo cual proporciona información para el diagnóstico, el pronóstico y la evaluación del tratamiento1–3.
Durante los últimos años, distintas asociaciones como la Asociación Americana para el Estudio de Enfermedades del Hígado (AASLD, por sus siglas en inglés)4 y la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN, por sus siglas en inglés)5 han publicado recomendaciones para la toma de biopsia hepática en población adulta y pediátrica, incluyendo indicaciones, cuidados previos al procedimiento, técnica sugerida y cuidados de la muestra para su correcto análisis. El apoyo mediante ecografía permite ejecutar el procedimiento de manera más segura3,5, y disminuye el riesgo de complicaciones, realizándose en tiempo real o mediante un marcaje prequirúrgico del sitio5.
La ESPGHAN considera dividir las complicaciones relacionadas a la biopsia hepática en 2 grupos. Las complicaciones menores se pueden agrupar como: todas aquellas que no requieren transfusión, hospitalización prolongada, manejo quirúrgico u hospitalización en terapia intensiva, siendo las complicaciones mayores las que presentan las características mencionadas anteriormente y/o la presencia de hemotórax, neumotórax y muerte5.
Por el momento se cuenta con pocos estudios que evalúen la experiencia de la toma de la BHP en pacientes pediátricos en nuestro país y Latinoamérica. El objetivo de este estudio es describir las principales indicaciones, el reporte histopatológico y las complicaciones asociadas a la realización de la BHP guiada por ultrasonido en pacientes pediátricos en nuestro centro hospitalario.
Material y métodosSe trata de un estudio transversal, descriptivo y retrospectivo. Se revisaron expedientes electrónicos de pacientes pediátricos menores de 16 años atendidos en el Servicio de Gastroenterología y Nutrición Pediátrica del Hospital de Pediatría Centro Médico Nacional de Occidente (CMNO), a los cuales se les realizó la BHP guiada por ultrasonido bajo sedación en un periodo comprendido de enero 2014 a diciembre 2019.
El protocolo realizado en nuestro hospital para la toma de la BHP incluye lo siguiente: previa firma de consentimiento informado por el padre o tutor, toma de exámenes prequirúrgicos que incluyen citometría hemática completa, tiempo parcial de tromboplastina (TTp), tiempo de protrombina (TP), índice internacional normalizado (INR), aspartato aminotransferasa (AST), alanina aminotransferasa (ALT), albúmina y bilirrubinas totales, 24h previas al procedimiento. En caso de presentarse INR≥1.5 o recuento de plaquetas ≤60×109/l se administra plasma fresco congelado (10ml/kg) o concentrado plaquetario (un concentrado/10kg de peso) previo a la punción, con la finalidad de evitar el sangrado. La toma de la BHP se llevó a cabo en el área del servicio de radiología con ayuno de 6 a 8h dependiendo de la edad, por parte de un médico radiólogo intervencionista, con apoyo de un anestesiólogo. Se ejecutó rastreo ultrasonográfico inicial para identificar el sitio de punción, se realiza asepsia, se administra anestesia local con lidocaína al 1%, se procede a la toma de biopsia mediante abordaje intercostal o subcostal con aguja de corte con rastreo ecográfico en tiempo real, con compresión en el sitio de punción por 5min con posterior rastreo ultrasonográfico como protocolo para búsqueda intencionada de sangrado.
A todos los pacientes se les administró analgesia mediante anti-inflamatorios no esteroideos de manera rutinaria. Se realizó nuevo control ultrasonográfico a las 24h posteriores de BHP. Las muestras obtenidas se analizaron por médicos patólogos con experiencia en enfermedades gastrointestinales y hepáticas.
Se realizó un muestreo no probabilístico por conveniencia de casos consecutivos, se incluyeron a todos los pacientes que cumplieron con los criterios de inclusión. Los criterios de inclusión fueron expedientes de pacientes pediátricos a los cuales se les realizó la BHP en el periodo de estudio. El criterio de exclusión fueron aquellos expedientes con información incompleta.
Se recabaron datos demográficos (edad, sexo, comorbilidades asociadas), indicaciones de toma de biopsia, laboratorios previos al procedimiento (hemoglobina, hematocrito, recuento plaquetario, TP, TTp e INR), presencia de complicaciones mayores y menores (dolor en sitio de punción u hombro derecho, infección, sangrado, neumotórax, hemotórax y muerte) y reporte histopatológico. Las variables se procesaron en una base de datos estructurada para dicha finalidad.
Análisis estadísticoSe realizó un análisis descriptivo de la población, de manera inicial se utilizó la prueba de bondad de ajuste de Kolmogorov-Smirnov para analizar la curva de distribución de los datos, posteriormente se reportaron mediante frecuencias y proporciones las variables cualitativas, y con medidas de tendencia central las variables cuantitativas. Se aplicaron pruebas paramétricas (media y desviación estándar) y medidas no paramétricas en caso de no presentar una distribución normal (mediana y rango). El análisis estadístico de la información recolectada se analizó en el software estadístico NCSS® versión 10.
Consideraciones éticasTodos los procedimientos se realizaron previa firma de consentimiento informado del padre o tutor responsable del menor. El presente estudio se trata de una revisión de expedientes, los autores confirman que se ha preservado totalmente la confidencialidad de los pacientes, ya que no brinda información alguna que pudiera identificar a los mismos. Basados en la pauta 10 de las pautas éticas internacionales para la investigación relacionada con la salud con seres humanos elaboradas por el Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS, por sus siglas en inglés) en colaboración con la Organización Mundial de la Salud (OMS), no requiere consentimiento informado.
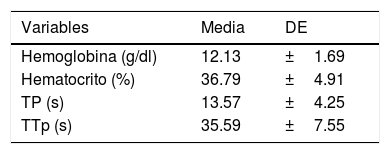
ResultadosSe realizaron un total de 104BHP, se excluyeron 2 por no contar con los datos en el expediente para su análisis, incluyéndose un total de 102BHP guiadas por ecografía en 99 pacientes siguiendo las recomendaciones generales de la ESPGHAN, las cuales se describen en la tabla 1. Se encontró predominio del sexo femenino en el 58.8%. La edad comprendida abarcó desde los 3 meses a 15 años, con una mediana de edad de 72 meses (±51 meses). El procedimiento fue realizado en hígado nativo en 97 procedimientos (95.1%) y en injerto trasplantado en 5 (4.9%). En 3 casos se realizó una segunda BHP durante el periodo de estudio. Los datos bioquímicos se reportan en la tabla 2.
Recomendaciones generales para la realización de BHP
| 1. Identificación de factores de riesgo |
| • Población especial: pacientes con ERC, síndrome de Alagille, lactantes <3 meses y peso bajo para la edad gestacional, pacientes con padecimientos hemato-oncológicos. En el caso de presentar ascitis es importante evitar BHP |
| 2. Preoperatorio |
| • Realizar determinación de citometría hemática completa, función hepática completa (que incluya TP, TTP, INR y fibrinógeno). Realizar determinación de TP, TTP, INR y plaquetas al menos <24h al procedimiento |
| • Suspender antiagregantes plaquetarios 7-10 días y reiniciar 48-72h posterior a la toma |
| • Suspender warfarina 5 días previos y reiniciar 24h posterior a la BHP |
| • Firma de consentimiento informado |
| 3. Durante el procedimiento |
| • Ayuno mínimo de 4h |
| • Asepsia en sitio de punción con solución alcoholada |
| • Uso de agujas de corte preferentemente (se propone uso estándar de 16G) |
| • Realizar máximo 2 pases por BHP |
| • Uso de anestesia general o sedación + anestesia local de larga acción en sitio de punción |
| • Fijación de la muestra con formol y valorar dividir la muestra inmediatamente en caso de requerirse estudios especiales |
| 4. Monitorización posterior |
| • Compresión inmediata del sitio de toma de biopsia para lograr correcta hemostasia |
| • Ayuno mínimo de 2h posteriores |
| • Monitorización de signos vitales, signos y síntomas estrechamente por al menos 6h |
| • Determinación de Hb y Hto deben realizarse si están justificadas clínicamente |
| • En caso de sospecharse sangrado puede solicitarse nueva citometría hemática y realizarse USG |
| • Evitar deportes de contacto al menos durante una semana |
BHP: biopsia hepática percutánea; ERC: enfermedad renal crónica; Hb: hemoglobina; Hto: hematocrito; INR: índice internacional normalizado; TP: tiempo de protrombina; TTp: tiempo parcial de tromboplastina; USG: ultrasonido.
Fuente: Modificado de Dezsőfi A et al.5.
Datos de laboratorio de los pacientes sometidos a biopsia hepática percutánea tomados 24h previas al procedimiento
| Variables | Media | DE |
|---|---|---|
| Hemoglobina (g/dl) | 12.13 | ±1.69 |
| Hematocrito (%) | 36.79 | ±4.91 |
| TP (s) | 13.57 | ±4.25 |
| TTp (s) | 35.59 | ±7.55 |
| Mediana | RIC | |
|---|---|---|
| INR | 1.08 | 0.22 |
| Plaquetas (recuento ×109/l) | 212.5 | 217 |
INR: índice internacional normalizado; RIC: rango intercuartílico; TP: tiempo de protrombina; TTp: tiempo parcial de tromboplastina.
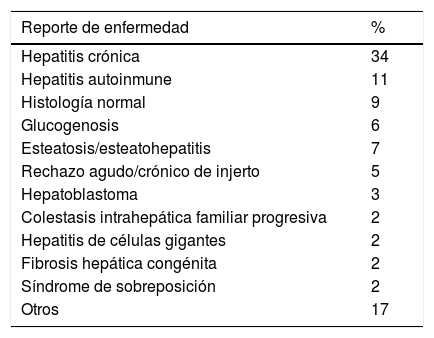
Las indicaciones más frecuentes para realización de las BHP fueron: como herramienta diagnóstica en hepatopatía crónica de etiología indeterminada, transaminasemia y hepatitis autoinmune en más del 65% de los casos, el resto se enlistan en la tabla 3. Los principales diagnósticos histológicos reportados fueron hepatitis crónica (34%), hepatitis autoinmune (11%), histología normal (9%), esteatosis/esteatohepatitis (7%) y glucogenosis (6%). El total de resultados de histopatología se mencionan en la tabla 4.
Indicaciones de biopsia hepática percutánea
| Indicación del procedimiento | N.° procedimientos | % |
|---|---|---|
| Hepatitis autoinmune (diagnóstico y seguimiento) | 24 | 23.5 |
| Transaminasemia | 22 | 21.5 |
| Hepatopatía crónica | 21 | 20.5 |
| Hepatoesplenomegalia | 13 | 12.7 |
| Tumores y lesiones focales | 8 | 7.8 |
| Hepatitis viral crónica | 6 | 5.8 |
| Rechazo de injerto | 5 | 4.9 |
| Colestasis | 3 | 2.9 |
Reporte histopatológico de 102 biopsias hepáticas
| Reporte de enfermedad | % |
|---|---|
| Hepatitis crónica | 34 |
| Hepatitis autoinmune | 11 |
| Histología normal | 9 |
| Glucogenosis | 6 |
| Esteatosis/esteatohepatitis | 7 |
| Rechazo agudo/crónico de injerto | 5 |
| Hepatoblastoma | 3 |
| Colestasis intrahepática familiar progresiva | 2 |
| Hepatitis de células gigantes | 2 |
| Fibrosis hepática congénita | 2 |
| Síndrome de sobreposición | 2 |
| Otros | 17 |
Dentro de los factores de riesgo identificados en nuestro grupo destacan, la presencia de 4 pacientes con enfermedades hemato-oncológicas y un paciente con enfermedad renal crónica. Se observó recuento plaquetario menor a 60×109/l en 10 pacientes, ameritando transfusión de concentrado plaquetario previo a la ejecución del procedimiento. El resto de exámenes de coagulación como TP, TTp e INR no presentaron alteraciones. No se identificó ascitis en los pacientes sometidos a BHP y ninguno de ellos ingería anticoagulantes.
Las comorbilidades asociadas en los pacientes fueron las siguientes: sobrepeso u obesidad (5.8%), enfermedades hematológicas como leucemia aguda, aplasia medular y linfoma de Hodgkin (3.9%), colitis ulcerativa crónica inespecífica (3.9%), lupus eritematoso sistémico (3.9%), hipotiroidismo (2.9%), síndrome de Turner (1.9%), enfermedad renal crónica (1%) y síndrome poliglandular (1%).
Del total de biopsias realizadas, 4 procedimientos presentaron complicaciones inmediatas (3.9%); 2 pacientes con presencia de sangrado en el sitio de punción con descenso de hemoglobina mayor a 2g/dl, uno de ellos ameritando hemotransfusión y el otro con estancia hospitalaria prolongada. Un paciente presentó hematoma subcapsular y posterior formación de absceso que ameritó drenaje percutáneo. Finalmente, el último paciente desarrolló una colección semilíquida hepática que se manejó conservadoramente.
Por lo anterior, se concluye que se presentaron complicaciones mayores en un 2.9% del total de BHP realizadas. Dentro de estos 4 procedimientos, se identificó como factor de riesgo en un paciente recuento plaquetario menor a 60×109/l, en los otros 3 no se evidenció ninguno.
Discusión y conclusionesLa BHP es un procedimiento confiable, seguro y mínimamente invasivo para la evaluación de pacientes pediátricos con enfermedad hepática2,3,5. En nuestra institución se realiza de manera rutinaria mediante guía ecográfica, lo cual ayuda a disminuir la tasa de complicaciones asociadas y mejora la obtención de la muestra.
En nuestro estudio, la indicación más frecuente fue hepatitis autoinmune tanto en diagnóstico como en seguimiento, en contraste con lo publicado por otros centros hospitalarios, donde la colestasis neonatal constituye una de las principales indicaciones para la toma de BHP6–10, lo anterior debido a que el abordaje diagnóstico de colestasis neonatal en nuestro hospital se realiza con biopsia hepática abierta en donde se incluye exploración de la vía biliar, y así descartar la enfermedad anatómica neonatal más frecuente que es la atresia de vías biliares.
Algunos de los estudios referidos informan de la obtención de tejido suficiente para la evaluación histológica tras la BHP del 80-100%5,11–15, con pocos casos ameritando una nueva BHP. En este sentido, el estudio realizado por Short et al. reportaron que el 19.2% de sus biopsias eran insuficientes para el análisis histopatológico, por lo cual se ejecutó una segunda BHP en el 37% de estos pacientes con muestra escasa, y el 8% de estos pacientes ameritó biopsia hepática abierta16. En nuestra población se decidió toma de una segunda BHP en 3 pacientes por muestra insuficiente.
No se reportó dolor en el sitio de punción en nuestros pacientes, ya que recibieron una dosis de analgesia con antiinflamatorios no esteroideos de manera rutinaria, dentro de las primeras 24h de realizada la BHP. Otros estudios, como lo referido por Almeida et al., comentan que el dolor se presentó en el 59% de sus pacientes, el cual cedió con acetaminofén en la mayoría de los casos6.
La complicación más temida es el sangrado, ya que es la principal causa de mortalidad17. De acuerdo con la revisión realizada en 2019 por Midia et al. en población adulta y pediátrica se produjo hemorragia hasta en el 10.9% de las BHP guiadas por imagen, limitándose los eventos de sangrado mayor entre el 0.1-4.6%18, que es equiparable con nuestros resultados, al presentarse un evento de sangrado en el 3.9% de las BHP guiadas por ecografía, con un 2.9% de sangrado mayor (caída de 2g/dl en la hemoglobina, necesidad de transfusión, aumento de estancia intrahospitalaria y necesidad de manejo quirúrgico).
En los pacientes que presentaron complicaciones, no presentaron factores de riesgo descritos por las guías ESPGHAN, ninguno tenía edad <2 años o INR>1.5, los cuales son considerados como factores de riesgo referidos por estas guías para sangrado5; sin embargo, uno de ellos contaba con cifra plaquetaria <60,000 previo al procedimiento, la cual fue corregida con transfusión de concentrado plaquetario.
Generalmente las complicaciones se presentan en las primeras 2-4h de realizado el procedimiento4,5,18, de manera similar a lo detectado en nuestra población, ya que se identificaron durante la ecografía inmediata a la toma de BHP; con lo cual confirmamos lo reportado por Almeida et al.6, quienes describen que se permite la realización de la BHP de forma ambulatoria en pacientes sin comorbilidades y sin factores de riesgo de manera segura, lo cual se efectúa en algunos centros hospitalarios19,20.
La principal limitación de nuestro estudio es su carácter retrospectivo, lo que aporta información restringida acerca de los procedimientos realizados.
En conclusión, la biopsia hepática continúa siendo un recurso fundamental en el estudio de las enfermedades hepáticas en la población pediátrica. El presente estudio busca informar acerca del protocolo de la BHP guiada por ecografía en nuestro centro hospitalario y confirma que la BHP es un procedimiento útil, reproducible y de bajo grado de complicaciones.
En el futuro se debe explorar la posibilidad de ejecutar la toma de BHP de forma ambulatoria en nuestro país, en pacientes pediátricos selectos, con monitorización de 2-4h, lo cual ayudaría a disminuir la estancia hospitalaria y los costos generados de la misma.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales y que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo/estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.