Los criterios de Milán (MC) han sido discutidos debido a su carácter restrictivo. Se ha propuesto su ampliación y el empleo de terapias locorregionales que infraestadifiquen y aumenten los candidatos a trasplante. Nuestro estudio analiza los resultados de los pacientes trasplantados por carcinoma hepatocelular (CHC) que cumplían MC y aquellos que los excedían.
Materiales y métodosEstudio observacional, retrospectivo y unicéntrico sobre trasplantados hepáticos por CHC entre el 2010-2021. Se analizaron variables demográficas, clínicas y supervivencia global y libre de enfermedad. Se aplicó la prueba t de Student o la de U de Mann-Whitney para variables cuantitativas; para categóricas el test exacto de Fisher. Se estimó la función de supervivencia mediante el método de Kaplan-Meier y se aplicó el log rank para comparar entre grupos.
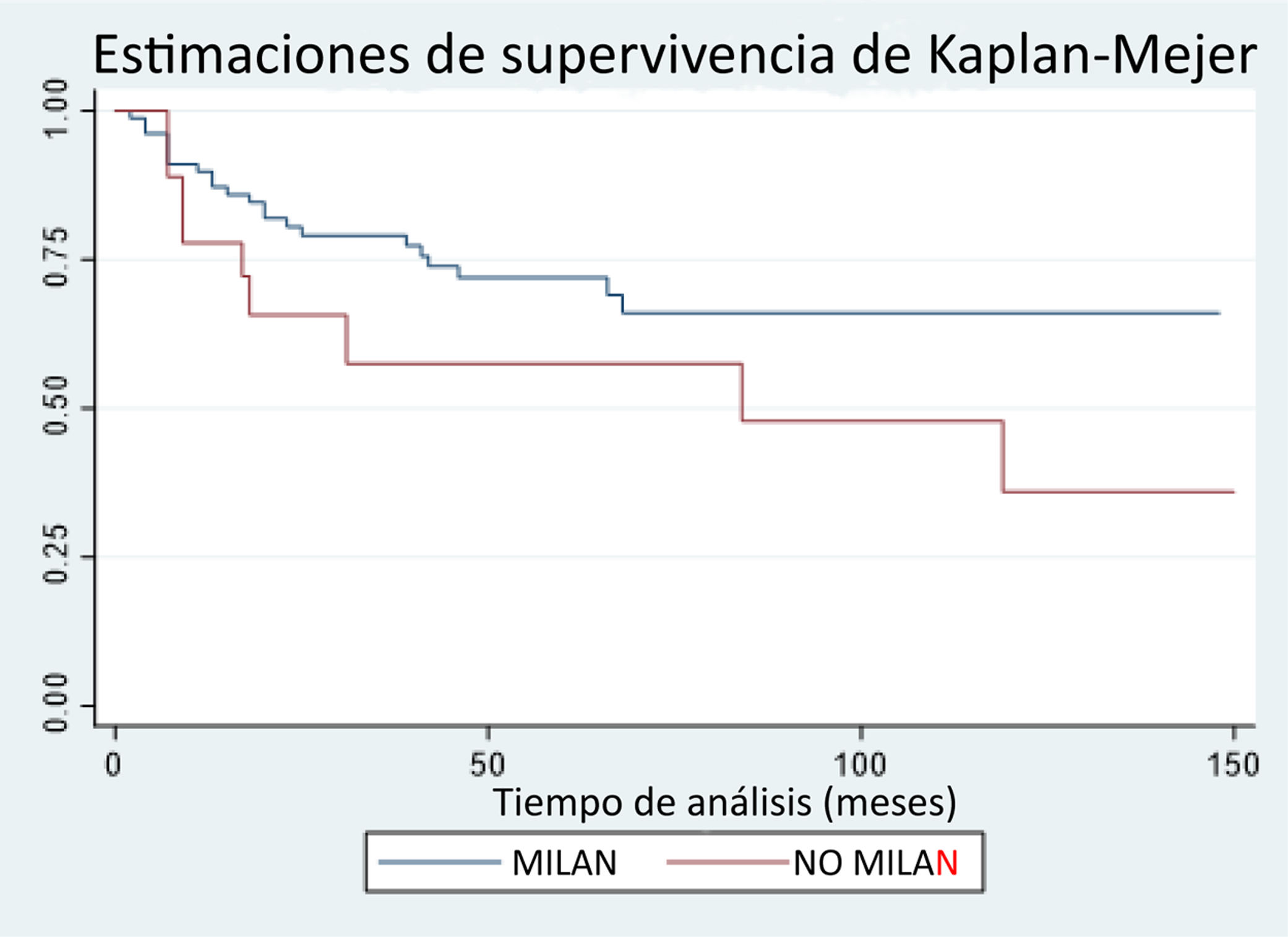
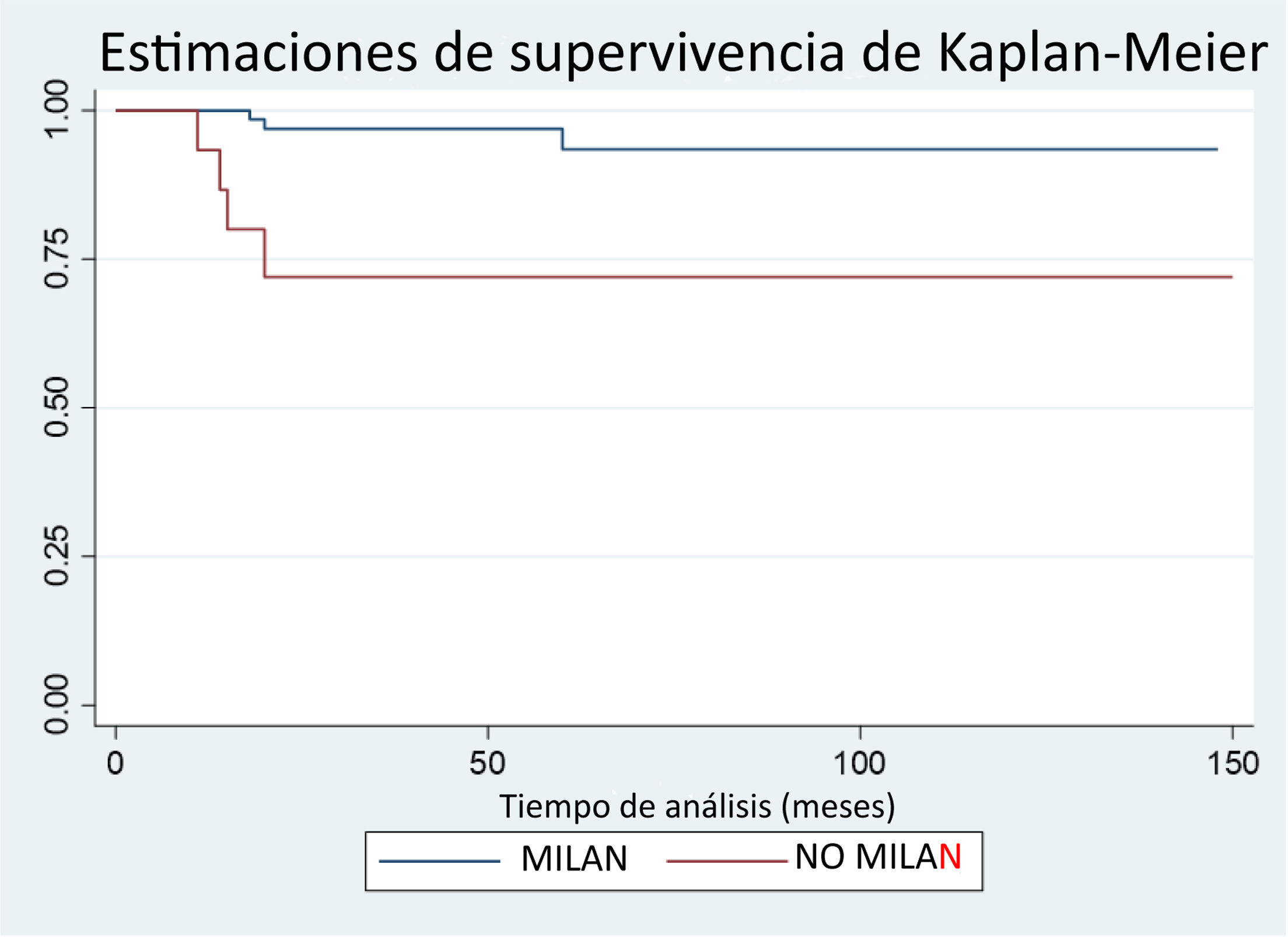
ResultadosDe los pacientes 96 trasplantados, 78 cumplían MC y 18 los excedían. Los pacientes que no cumplían los MC presentaban mayor número de nódulos (1,6 vs. 3,5 nódulos [p=0.000]), mayor tamaño de las lesiones principales (24,38 vs. 38,55mm, p=0.000) y mayor tasa de CHC bilobular (21.79% vs. 72.22%, p=0.000), así como mayor carga tumoral. No hubo diferencias significativas en cuanto a la supervivencia global, aunque sí en cuanto a la supervivencia libre de enfermedad, siendo menor en el grupo que excedía los criterios.
ConclusiónLos pacientes infraestadiados con terapias locorregionales presentan tasas de supervivencia libre de enfermedad menores a los pacientes que cumplen los MC, sin diferencias significativas en cuanto a la supervivencia global.
The Milan criteria have been the subject of discussion in recent years due to their restrictive nature. Expansion of the criteria and the use of locoregional therapies to downstage patients and increase the number of transplant candidates have been proposed. Our study analyzed the results of patients that underwent transplant due to hepatocellular carcinoma, comparing those that met the Milan criteria and those that exceeded them.
Materials and methodsA retrospective, observational, single-center study was conducted on liver transplantations due to hepatocellular carcinoma, within the time frame of 2010-2021. Demographic and clinical variables, overall survival, and disease-free survival were analyzed. The Student's t test or Mann-Whitney U test were applied for the quantitative variables and the Fisher's exact test for the categorical variables. The survival function was estimated through the Kaplan-Meier method and the log-rank test was applied for comparing the groups.
ResultsOf the 96 transplanted patients, 78 met the Milan criteria and 18 exceeded them. Patients that did not meet the Milan criteria had a higher number of nodules (1.6 vs 3.5 nodules; p=0.000), larger main lesions (24.38 vs 38.55mm; p=0.000), a higher bilobar hepatocellular carcinoma rate (21.79% vs 72.22%, p=0.000), and higher tumor burden. There were no significant differences regarding overall survival, but there was a lower rate of disease-free survival in the group exceeding the criteria.
ConclusiónDownstaged patients that received locoregional therapies had lower disease-free survival rates than patients that met the Milan criteria, but there were no significant differences regarding overall survival.
Los tumores hepáticos primarios constituyen la tercera causa de mortalidad por cáncer a nivel mundial, con una incidencia global en 2020 superior a los 900,000 casos y una mortalidad total de 830,000 defunciones, siendo el más frecuente el carcinoma hepatocelular (CHC)1.
Existen varias modalidades de tratamiento para el CHC, desde la resección hepática, terapias locorregionales o el trasplante hepático. La decisión de una u otra alternativas radica en una evaluación global exhaustiva de la carga tumoral, la función hepática, el futuro remanente, las comorbilidades y el estado funcional del paciente2.
El trasplante hepático se ha considerado el tratamiento de elección con intención curativa para pacientes seleccionados, con unas tasas de supervivencia a los cinco años sobre el 70%3–6. No obstante, a pesar de los criterios de selección de los pacientes candidatos a trasplante para el tratamiento del CHC, las tasas de recurrencia del CHC oscilan entre el 8 y el 20%7,8.
En 1996, Mazzaferro et al. publicaron la primera serie exitosa de pacientes cirróticos sometidos a trasplante hepático por CHC irresecable, estableciendo unos criterios de selección mundialmente aceptados, conocidos como criterios de Milán (MC)9, considerados el estándar de referencia para la selección de pacientes con CHC candidatos a trasplante10, con unas tasas de supervivencia global y libre de enfermedad a los cuatro años cercanas al 75% y al 92%, respectivamente9. A pesar del éxito, han sido discutidos en los últimos años, debido a su carácter restrictivo para la indicación de trasplante.
Por ello, diferentes grupos han valorado ampliar estos criterios, desarrollando nuevos modelos más flexibles que permitan a un mayor número de pacientes optar al trasplante como tratamiento. Entre estos se encuentran los criterios de la Universidad de California San Francisco, promovidos por el estudio de Yao et al., con unas tasas de supervivencia al año y a los cinco años similares a los pacientes que cumplían los MC11; los criterios de Kioto o los nuevos criterios expandidos desarrollados por el grupo de trabajo de Milán, los conocidos Up to Seven, con unas supervivencias entre el 70-80% a los cinco años6,12.
En esta dirección y con el objetivo de incrementar los pacientes con CHC candidatos a trasplante, se han desarrollado tratamientos locorregionales como terapia puente previo al trasplante, con dos objetivos: evitar la progresión tumoral de pacientes en lista de espera para el trasplante hepático13,14 y reducir la carga tumoral de pacientes que no cumplen criterios de trasplante (downstaging)13,15. Las terapias locorregionales más utilizadas como terapia puente son la radiofrecuencia (RF) y la quimioembolización transarterial (TACE)15–18.
El objetivo de este trabajo fue realizar un análisis global de las características demográficas, clínicas y biológicas de los pacientes trasplantados por CHC, evaluar su supervivencia y recurrencia tumoral y comparar estas variables entre los pacientes que cumplían los MC frente a los que los excedían.
Materiales y métodosEstudio observacional, retrospectivo (estudio de cohortes) y unicéntrico sobre pacientes sometidos a trasplante por CHC en el Hospital Universitario Virgen de las Nieves, Granada, entre el 1 de enero de 2010 y el 31 de diciembre de 2021. El estudio fue aprobado por el comité ético del hospital.
Como criterio de inclusión se estableció la indicación de trasplante hepático por CHC. Los criterios de exclusión fueron historias duplicadas, diagnóstico de otro tipo tumoral en el informe anatomopatológico, y fallecimiento intraoperatorio o en el posoperatorio inmediato.
El diagnóstico de confirmación de CHC se realizó mediante tomografía axial computarizada (TAC) y/o resonancia magnética. Tanto los pacientes que excedían los MC como los que los cumplían, pero con previsión de tiempo prolongado en lista de espera fueron sometidos a terapias puente. Los tratamientos empleados fueron la TACE y la RF, indicando esta última como tratamiento para nódulos menores de 15mm y únicos, repitiendo las sesiones en aquellos pacientes con sospecha de tumor viable en las pruebas de control, ya sea mediante ecografía, resonancia magnética o TAC. Se usaron los criterios Liver Imaging Reporting and Data System (LI-RADS) en pacientes con CHC tratado (LR-TR) para valorar la respuesta radiológica, estableciéndose tres categorías: LR-TR no viable LR-TR viable y LR-TR equívoco.
El periodo de seguimiento mínimo postrasplante se estableció en 18 meses.
Para el análisis por grupos, se definió el grupo de MC como aquellos pacientes que en las pruebas de imagen pretrasplante presentaban un CHC único menor de 5cm o 2 o 3 lesiones menores de 3cm. El grupo No Criterios de Milán (NMC) fueron pacientes con CHC que excedía los MC pero que no superaban los criterios Up to Seven.
Las variables analizadas incluyeron: datos demográficos, clínicos, bioquímicos, patológicas y evolución seguida. Se recogió la carga tumoral total (TBS) de los pacientes, calculado mediante la ecuación propuesta por Sasaki et al. y dividiendo por categorías de riesgo16
Análisis estadísticoRealizamos un análisis estadístico descriptivo donde las variables cuantitativas se expresaron como media y desviaciones estándar o mediana y rango intercuartílico, según la distribución. Se realizó la prueba de Shapiro-Wilk para valorar la normalidad de las variables continuas. Las variables categóricas se expresaron mediante tablas de frecuencias y porcentajes.
Para contrastar los resultados entre el grupo de pacientes MC/NMC con respecto a las variables cuantitativas, se usó la prueba t de Student o U de Mann-Whitney, según correspondiera. Las variables categóricas se compararon con la prueba de X2 o el test exacto de Fisher. Por otro lado, se estimó la función de supervivencia global y libre de enfermedad mediante el método de Kaplan-Meier tanto de manera global como estratificado por los criterios de inclusión MC/NMC. Por último, se aplicó la prueba de log rank para comparar entre grupo MC/NMC.
Los cálculos se realizaron con el programa estadístico STATA vs14.
Consideraciones éticasEn el siguiente estudio se han seguido los protocolos del centro sobre la publicación de datos de los pacientes que intervienen en el mismo, preservándose en el anonimato los datos de los mismos. El consentimiento informado no se solicitó para la publicación, porque en el presente artículo no se publican datos personales que permita identificar al paciente. El trabajo cumple con la normativa vigente en investigación bioética y fue aprobado por el comité ético del hospital correspondiente, Hospital Universitario Virgen de las Nieves.
ResultadosDel total de trasplantes realizados (397), 104 casos fueron por CHC. De ellos, ocho pacientes fueron excluidos del estudio: uno por historia duplicada, otro por corresponder a un colangiocarcinoma en el explante, un tercero por exitus intraoperatorio por fallo hemodinámico y cinco por fallecimiento en el posoperatorio inmediato (dos casos de no función primaria del injerto, dos por trombosis aguda de la arteria hepática, y uno por sepsis abdominal). Finalmente 96 pacientes fueron analizados, 78 de ellos (81.2%) cumplían MC para trasplante hepático, frente a los 18 pacientes (18.8%) que excedían estos criterios (NMC).
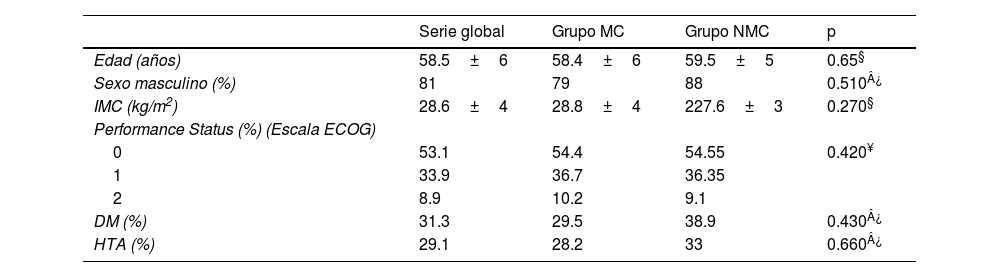
En la tabla 1 se describen las características y variables demográficas analizadas, tanto a nivel global, como por grupos. El sexo predominante fue el masculino (81%), con una edad media de 58.5±6 años.
Características demográficas de los pacientes trasplantados por carcinoma hepatocelular
| Serie global | Grupo MC | Grupo NMC | p | |
|---|---|---|---|---|
| Edad (años) | 58.5±6 | 58.4±6 | 59.5±5 | 0.65§ |
| Sexo masculino (%) | 81 | 79 | 88 | 0.510¿ |
| IMC (kg/m2) | 28.6±4 | 28.8±4 | 227.6±3 | 0.270§ |
| Performance Status (%) (Escala ECOG) | ||||
| 0 | 53.1 | 54.4 | 54.55 | 0.420¥ |
| 1 | 33.9 | 36.7 | 36.35 | |
| 2 | 8.9 | 10.2 | 9.1 | |
| DM (%) | 31.3 | 29.5 | 38.9 | 0.430¿ |
| HTA (%) | 29.1 | 28.2 | 33 | 0.660¿ |
MC: Milan criteria; NMC: no Milan criteria; IMC: índice de masa corporal; ECOG: Eastern Cooperative Oncology Group; DM: diabetes mellitus; HTA: hipertensión arterial.
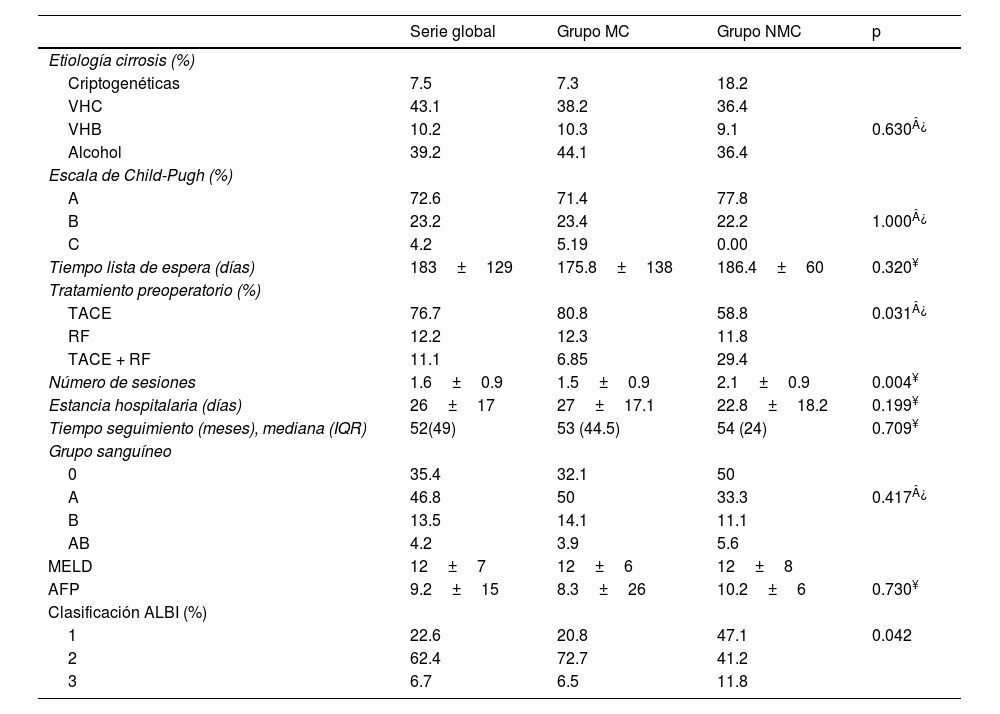
El análisis de las variables clínicas y bioquímicas se resume en la tabla 2. Las terapias puente se ofrecieron al 100% de los pacientes que excedían los MC, con sesiones que fueron repetidas hasta conseguir la infraestadificación frente al 92.4% de los que cumplían los criterios de inicio. El tratamiento más frecuente fue la TACE, realizado en el 87.5%. El número de sesiones medio fue de 1.6 en la muestra global, aunque el grupo NMC precisó de mayor número de sesiones que aquellos que cumplían los MC (2.1 vs. 1.5, p=0.0045).
Características clínicas y bioquímicas
| Serie global | Grupo MC | Grupo NMC | p | |
|---|---|---|---|---|
| Etiología cirrosis (%) | ||||
| Criptogenéticas | 7.5 | 7.3 | 18.2 | |
| VHC | 43.1 | 38.2 | 36.4 | |
| VHB | 10.2 | 10.3 | 9.1 | 0.630¿ |
| Alcohol | 39.2 | 44.1 | 36.4 | |
| Escala de Child-Pugh (%) | ||||
| A | 72.6 | 71.4 | 77.8 | |
| B | 23.2 | 23.4 | 22.2 | 1.000¿ |
| C | 4.2 | 5.19 | 0.00 | |
| Tiempo lista de espera (días) | 183±129 | 175.8±138 | 186.4±60 | 0.320¥ |
| Tratamiento preoperatorio (%) | ||||
| TACE | 76.7 | 80.8 | 58.8 | 0.031¿ |
| RF | 12.2 | 12.3 | 11.8 | |
| TACE + RF | 11.1 | 6.85 | 29.4 | |
| Número de sesiones | 1.6±0.9 | 1.5±0.9 | 2.1±0.9 | 0.004¥ |
| Estancia hospitalaria (días) | 26±17 | 27±17.1 | 22.8±18.2 | 0.199¥ |
| Tiempo seguimiento (meses), mediana (IQR) | 52(49) | 53 (44.5) | 54 (24) | 0.709¥ |
| Grupo sanguíneo | ||||
| 0 | 35.4 | 32.1 | 50 | |
| A | 46.8 | 50 | 33.3 | 0.417¿ |
| B | 13.5 | 14.1 | 11.1 | |
| AB | 4.2 | 3.9 | 5.6 | |
| MELD | 12±7 | 12±6 | 12±8 | |
| AFP | 9.2±15 | 8.3±26 | 10.2±6 | 0.730¥ |
| Clasificación ALBI (%) | ||||
| 1 | 22.6 | 20.8 | 47.1 | 0.042 |
| 2 | 62.4 | 72.7 | 41.2 | |
| 3 | 6.7 | 6.5 | 11.8 |
MC: Milan criteria; NMC: no Milan criteria; VHC: virus de la Hepatitis C; VHB: virus de la Hepatitis B; MELD: Model for End-Stage Liver Disease; AFP: alfafetoproteína; ALBI: albúmina-bilirrubina; RF: radiofrecuencia; TACE: quimioembolización transarterial; IQR: rango intercuartílico.
De los 78 pacientes que recibieron tratamiento locorregional como puente al trasplante, se realizó pruebas de imagen de reevaluación a 71 pacientes (90.5%): 8 (8.2%) mediante ecografía, 68 (70.1%) resonancia magnética, y 12 (12.4%) TAC. De estos 71 pacientes reevaluados, el 59% se catalogaron como LR-TR no viable, el 32.5% como LR-TR viable y el resto (8.5%) LR-TR equívoco.
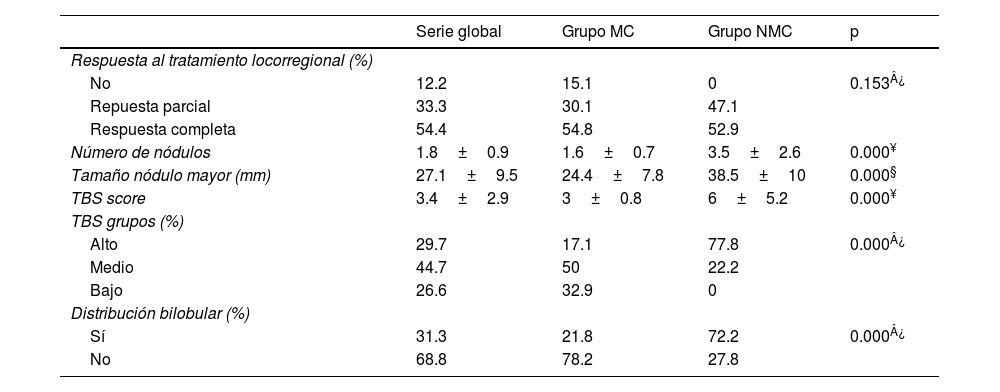
En cuanto al análisis de las variables clínico-patológicas (tabla 3), sobre los 78 pacientes tratados mediante TACE o RF previo al trasplante hepático, se constató en un 87.73% la presencia de necrosis tumoral en el análisis histopatológico del explante hepático. Esta fue completa en un 54.44% de casos y parcial en un 33.33% de los nódulos tratados, sin haber diferencias significativas entre los grupos analizados (p=0.153).
Características patológicas
| Serie global | Grupo MC | Grupo NMC | p | |
|---|---|---|---|---|
| Respuesta al tratamiento locorregional (%) | ||||
| No | 12.2 | 15.1 | 0 | 0.153¿ |
| Repuesta parcial | 33.3 | 30.1 | 47.1 | |
| Respuesta completa | 54.4 | 54.8 | 52.9 | |
| Número de nódulos | 1.8±0.9 | 1.6±0.7 | 3.5±2.6 | 0.000¥ |
| Tamaño nódulo mayor (mm) | 27.1±9.5 | 24.4±7.8 | 38.5±10 | 0.000§ |
| TBS score | 3.4±2.9 | 3±0.8 | 6±5.2 | 0.000¥ |
| TBS grupos (%) | ||||
| Alto | 29.7 | 17.1 | 77.8 | 0.000¿ |
| Medio | 44.7 | 50 | 22.2 | |
| Bajo | 26.6 | 32.9 | 0 | |
| Distribución bilobular (%) | ||||
| Sí | 31.3 | 21.8 | 72.2 | 0.000¿ |
| No | 68.8 | 78.2 | 27.8 |
MC: Milan criteria; NMC: no Milan criteria; TBS: Tumor Burden Score.
Respecto a la correlación del grado de necrosis tumoral y la categoría LR-TR postratamiento, el 37.1% de los pacientes que se evaluaron como LR-TR viable habían presentado «respuesta total» vs. 62.9% «no respuesta total». En cuanto a los evaluados como LR-TR no viable, el 59.2% habían presentado una «respuesta total» vs. el 40.8% una «no respuesta total». Y finalmente, el 62.5% de los pacientes evaluados como LR-TR equívoco tenían una «respuesta completa» en comparación con el 37.5% con «no respuesta completa», siendo estas diferencias no significativas (p=0.123). No se observaron diferencias estadísticamente significativas en la supervivencia global y libre de enfermedad entre los grupos de LR-TR viable, no viable y equívoco (p=0.3484 y p=0.4152, respectivamente).
El tiempo medio en lista de espera para trasplante fue de 183±129 días.
En cuanto a las variables bioquímicas analizadas, se constató que los pacientes clasificados como grados 1 y 2 de albúmina-bilirrubina (ALBI) fueron los más frecuentes, siendo el 47% de los pacientes NMC clasificados como grado 1 frente al 20.78% de los pacientes MC (p=0.042). La media global de alfafetoproteína (AFP) preoperatoria fue de 9.2±15 ng/mL, siendo en el grupo MC 8.3±26 ng/mL frente a 10.2±6 ng/mL en el grupo de pacientes NMC, siendo estas diferencias no significativas (p=0.730).
Por otro lado, se demostró que los pacientes que inicialmente estaban fuera de los MC presentaban mayor número de nódulos (1.6 vs. 3.5 nódulos p=0.000), mayor tamaño de las lesiones principales (24.38 vs. 38.55mm, p=0.000) y mayor tasa de CHC bilobular (21.79 vs. 72.22%, p=0.000), así como mayor carga tumoral tanto en valores absolutos (3.02±0.8 vs. 6±5.2, p=0.00) como por estratificación por grupos de riesgo; así, el 77.8% de los pacientes NMC se catalogaría como grupo de alto TBS frente al 17.1% de los pacientes MC (p=0.000).
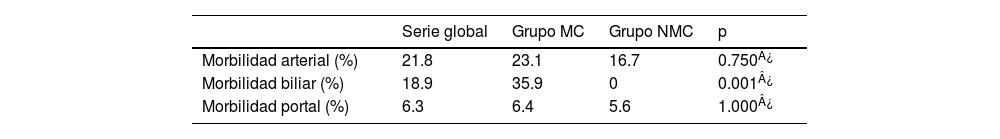
En cuanto a las complicaciones posoperatorias, se registró mayor porcentaje de complicaciones de la vía biliar (en forma de colangiopatía isquémica) en pacientes del grupo MC frente a los del grupo NMC (18.9% vs. 0%, p=0.001) (tabla 4).
Durante el periodo de seguimiento, fallecieron 31 pacientes (32.3%), 22 del grupo MC y nueve del grupo NMC. El 52.1% fueron exitus en los 12 primeros meses postrasplante, en ningún caso por recidiva por CHC.
Las tasas de supervivencia global a los tres, seis, 12, 24 y 48 meses fue del 98%, 96%, 87%, 77% y 69%, respectivamente. Cuando analizamos la supervivencia global por grupos, se apreció una mayor supervivencia a los 12, 24 y 48 meses en el grupo de pacientes MC frente a los pacientes NMC (89.7%, 804% y 71,9% vs. 77,7.%, 65.6% y 57.4%, respectivamente), siendo estas diferencias no significativas (p=0.09) (fig. 1).
Siete (7.3%) pacientes presentaron recidiva del CHC, tres de ellos dentro del grupo MC y cuatro del grupo NMC, presentando una supervivencia libre de enfermedad a los 12, 24 y 48 meses de 100%, 96.9% y 96.9% en el grupo MC vs. 93.3%, 72% y 72% en el grupo NMC, siendo estas diferencias estadísticamente significativas (p=0.0027). El 80% de las recidivas ocurrieron en los primeros 18 meses postrasplante (fig. 2). Todos los pacientes que recidivaron presentaron una enfermedad extrahepática, siendo la localización más frecuente las metástasis óseas y peritoneales.
DiscusiónEn nuestro análisis, obtuvimos una tasa de recurrencia global del 7.3%, dato ligeramente inferior a las tasas de otros trabajos publicados, que oscilan entre el 8-20%7,8,13,15,19 Los resultados de este estudio revelan que existen diferencias en cuanto a la supervivencia libre de enfermedad postrasplante hepático entre los pacientes trasplantados hepáticos dentro de los MC frente a los que los excedían, sin existir diferencia significativa en cuanto a la supervivencia global entre ambos grupos. Kardashian et al. realizaron una revisión del Registro norteamericano, con una amplia casuística (3,570 pacientes con tumores dentro de los MC, 789 excedían los MC, de los cuales 465 pudieron ser sometidos a downstaging). Determinaron que la supervivencia postrasplante global y libre de enfermedad resultaron significativamente inferiores en estos tumores fuera de criterios: con MC el porcentaje de recurrencia fue del 11%; este porcentaje ascendió en el grupo sometido al downstaging al 16%, y en pacientes en los que no se pudo hacer el downstaging llegó al 32%20. Esos datos se corresponden con los obtenidos en nuestra serie, con menores tasas de recurrencia en nuestro caso.
En nuestro centro, se han empleado los tratamientos locorregionales en los pacientes con CHC dentro de Milán como tratamiento puente hasta el trasplante en la mayoría de los casos, ya que el tiempo medio en lista de espera supera los seis meses. Esto concuerda con la recomendación emitida en 2015 por la United Network for Organ Sharing, la European Association for the Study of the Liver y la European Organisation for Research and Treatment of Cancer, sugiriendo el uso de estas terapias locorregionales ante listas mayores a seis meses, por el riesgo de progresión y dropout21,22. El objetivo principal de estas terapias es ralentizar la progresión tumoral hasta que se disponga de un órgano adecuado para el paciente. De esta forma se minimizaría la posibilidad de exclusión para trasplante por progresión del CHC, con tasas que pueden llegar hasta el 10-20%19–21. Además, parecen existir beneficios de estos tratamientos a nivel oncológico. En varios de los estudios publicados, los pacientes que presentaron mayor respuesta tumoral tras el tratamiento locorregional tuvieron mejores resultados después del trasplante22–24. En unidades de trasplante con tiempos de lista de espera más cortos, el papel de las terapias locorregionales en pacientes dentro de MC no está claramente definido25. A pesar del voluminoso número de trabajos y estudios publicados sobre la expansión de criterios para indicar trasplante hepático en el CHC y el uso cada vez más extendido de las terapias para infraestadiar los pacientes, no se ha establecido aún ningún protocolo de manejo, y hay poca definición en cuanto a los resultados tras el downstaging. Además, las tasas de éxito de los tratamientos locorregionales utilizados para el downstaging son extremadamente variables (24-90%), debido principalmente, a los diseños retrospectivos de los estudios publicados; y por no haber una definición clara en cuanto a la modalidad de tratamiento, volumen tumoral a tratar y definición de respuesta al tratamiento. En 2015 se publicó una revisión sistemática que concluyó que existía una importante heterogeneidad en los trabajos en cuanto a la definición de la carga tumoral, tiempo en lista de espera, los protocolos utilizados para infraestadiar, y la evaluación de respuesta al tratamiento17.
Cada vez existen menos dudas de que los criterios morfológicos centrados únicamente en el tamaño y el número del tumor son insuficientes en la selección de pacientes para el trasplante hepático, por lo que deben combinarse con marcadores biológicos, inflamatorios, radiológicos, patológicos y genéticos que predigan el comportamiento biológico del tumor. Son varios los estudios publicados que han demostrado que los niveles de AFP por encima de 400 ng/mL preoperatorios, los grados de diferenciación del tumor desfavorables (3 y 4), la positividad en la tomografía por emisión de positrones, los tumores multilobulares o la presencia de invasión vascular tanto micro como macroscópica predicen la posibilidad de recidiva de forma más precisa que los MC de forma aislada26–29. Liang et al. analizaron los pacientes trasplantados por CHC con criterios expandidos que presentaron recurrencia de la enfermedad. Se evidenció que aquellos que recidivaban tenían un mayor tamaño tumoral total y del nódulo tumoral principal que aquellos que no recidivaron, lo que les permitió establecer unas nuevas indicaciones más amplias. De esta forma, con tumores con un tamaño máximo de hasta 6cm y una sumatoria tumoral total de hasta 10 cm, obtenían unas tasas de supervivencia tanto global y libre de enfermedad a los cinco años del 77.7% y 20.5%, respectivamente, datos comparables a los obtenidos cumpliendo MC. Así se beneficiarían hasta en un 35% más los posibles candidatos a trasplante30. Estos resultados van en el mismo sentido que nuestro caso, aunque dada la escasa muestra y el escaso número de recidivas, no hemos podido establecer qué variables se asocian a la recidiva.
Este estudio presenta una serie de limitaciones. En primer lugar, es una serie retrospectiva con un diseño no aleatorizado. Por otra parte, el tamaño de la serie es reducido para poder realizar un análisis multivariante que identifique parámetros predictores de recurrencia de la enfermedad de forma independiente y así obtener conclusiones sólidas. En tercer lugar, no se han valorado marcadores génicos o moleculares que pueden condicionar la mayor o menor agresividad tumoral y su tendencia a la recidiva.
Como conclusión, según nuestro estudio, la infraestadificación o downstaging de los pacientes candidatos a trasplante que presentan CHC más allá de los MC es una opción segura permitiéndoles optar al trasplante, con tasas de supervivencia libre de enfermedad menores que los pacientes trasplantados que cumplen estos criterios, aunque sin diferencias significativas en cuanto a la supervivencia global.
Son necesarios estudios prospectivos con mayor tamaño muestral que confirmen estos resultados, analizar las variables asociadas a la recidiva y estandarizar las estrategias de infraestadiaje, el tipo de tratamiento locorregional, la evaluación más adecuada de la respuesta, así como el seguimiento posterior para mejorar los resultados.
FinanciaciónNo se recibió ningún tipo de financiación para la elaboración de este trabajo.
Conflicto de interesesNo existe conflicto de intereses con relación al artículo que se remite para publicación.