¿ Introducción
La enfermedad por reflujo gastroesofágico (ERGE), se define como una condición que se desarrolla cuando el reflujo del contenido gástrico causa síntomas que afectan considerablemente el bienestar y la calidad de vida de los individuos y es un problema muy frecuente. De acuerdo con la clasificación de Montreal,1 los síndromes esofágicos de la ERGE se caracterizan por la presencia de síntomas típicos (pirosis y regurgitación, e incluso dolor torácico) o asociados a lesiones esofágicas (erosiones, estenosis, Barrett y adenocarcinoma). Se estima que cerca de 20% de la población en los Estados Unidos de Norteamérica tienen estos síntomas típicos de ERGE (pirosis o regurgitación) al menos una vez por semana y en poblaciones especiales se estima que la prevalencia anual puede ser tan alta como de 50%.2,3
El evento primario en la patogénesis de la ERGE es el movimiento del contenido gástrico desde el estómago hacia el esófago, a pesar de la continencia natural que provee la barrera anti-reflujo a nivel de la unión esófago-gástrica. Los tres mecanismos más importantes que condicionan la incompetencia de la barrera anti-reflujo son: 1) las relajaciones transitorias del esfínter esofágico inferior (tLESRs), 2) la hipotensión del esfínter esofágico inferior, y 3) la alteración anatómica de la unión condicionada por la presencia de hernia hiatal.4
De manera independiente al mecanismo predominante para la falla de la barrera anti-reflujo, tradicionalmente se ha considerado que el reflujo ácido juega un papel determinante en la fisiopatología de los síntomas relacionados.5-7 Este axioma se basa en múltiples estudios en animales y en humanos que han demostrado que la supresión ácida con agentes como los inhibidores de la bomba de protones (IBP), mejoran significativamente los síntomas y el daño al epitelio esofágico relacionado con la ERGE.7,8
Existen tendencias que han favorecido que durante el manejo médico de la ERGE y otros síntomas digestivos (dispepsia, dolor abdominal refractario, entre otros), se utilicen indiscriminadamente medicamentos inhibidores de la secreción ácida (bloqueadores H2 e IBP). Esto ha condicionado que la cifra de sujetos con síntomas persistentes o refractarios a los anti-secretores se incremente considerablemente. Por ejemplo, se estima que entre 25% a 40% de los pacientes que actualmente toman una dosis estándar de IBP no responden, ya sea parcial o completamente.9
¿ Mecanismos fisiopatológicos relacionados con la percepción de pirosis
Los factores que determinan la percepción de estímulos a nivel esofágico, como el ácido son complejos. Si bien la percepción de pirosis como síntoma relacionada con el ácido puede estar influenciada por la cantidad, la duración o la concentración de hidrogeniones en la mucosa esofágica, algunos autores han propuesto que otros factores interactúan; por ejemplo la ansiedad, la depresión o el estrés, de tal manera que estímulos mínimos en el esófago desencadenen dolor.10-12 Otros factores como la ingesta de alimentos irritantes y grasas también pueden intensificar la percepción del ácido.13 A continuación se analizan cinco de los mecanismos fisiopatológicos más importantes relacionados con la pirosis no asociada al ácido.
1. Percepción de descensos mínimos en el pH esofágico: Se estima que 70% de los pacientes que presentan síntomas típicos de ERGE tienen una mucosa esofágica normal en el estudio endoscópico.14-16 Aunque tradicionalmente se consideraba a la ERGE no-erosiva (ERNE) como una forma leve de ERGE, actualmente se sabe que estos pacientes son los que tienen una menor respuesta al tratamiento con inhibidores de la bomba de protones y cirugía.17
Menos de 40% de los pacientes con ERNE tienen exposición anormal al ácido cuando se realiza una pH-metría esofágica de 24 horas (porcentaje de tiempo de pH menor de cuatro, mayor de 4.2%). Se considera que estos casos tienen enfermedad por reflujo, cuyo epitelio es más resistente, pero con alteraciones microscópicas mínimas, como la dilatación de espacios intercelulares del epitelio esofágico.18 Con base en los criterios de Roma III, el resto de sujetos con pirosis y con una pH-metría esofágica normal, son los que se consideran que tienen "pirosis funcional".19 Sin embargo, la determinación del porcentaje de síntomas que se relacionan a los episodios de reflujo ácido (índice de síntomas, IS) ha permitido sub-clasificar a estos pacientes en dos grupos: los que tienen pH normal e IS positivo (llamado esófago hipersensible) y los que tienen pH normal e IS negativo (considerados como los verdaderos casos de pirosis funcional).
Convencionalmente, se considera que un episodio de reflujo se asocia al síntoma de pirosis cuando el pH esofágico cae por debajo de cuatro, y que además el síntoma se presente durante esta caída de pH o en los dos minutos posteriores. Sin embargo, estudios recientes han demostrado que los descensos en el pH de una o dos unidades (no necesariamente por debajo de cuatro, por ejemplo una caída de seis a cinco) puede producir pirosis. En un estudio en el que evaluamos 120 pacientes con ERGE (69% con ERNE), evidenciamos que 68% de los casos con pirosis funcional, tenían síntomas relacionados con caídas mínimas del pH (pH cinco a seis).20 Esto sugiere que los pacientes con pirosis y pH-metría normal tienen una quimio sensibilización o hipersensibilidad mayor al ácido, por lo que los descensos en tan solo una o dos unidades de pH son suficientes para causar síntomas.
2. Reflujo No Ácido. Hasta hace poco, la medición de la frecuencia del reflujo gastroesofágico, estuvo basada únicamente en la detección del reflujo ácido a través del monitoreo del pH en esófago distal.21 Recientemente, el uso de la impedancia intraluminal multicanal combinada con la pH-metría (pH-MII) representa un avance importante en las pruebas de reflujo gastroesofágico, ya que permite la detección de las características del reflujo en todos los niveles de pH (ácido y no ácido), una característica potencialmente útil en la evaluación de los síntomas persistentes a pesar de la supresión de ácido.
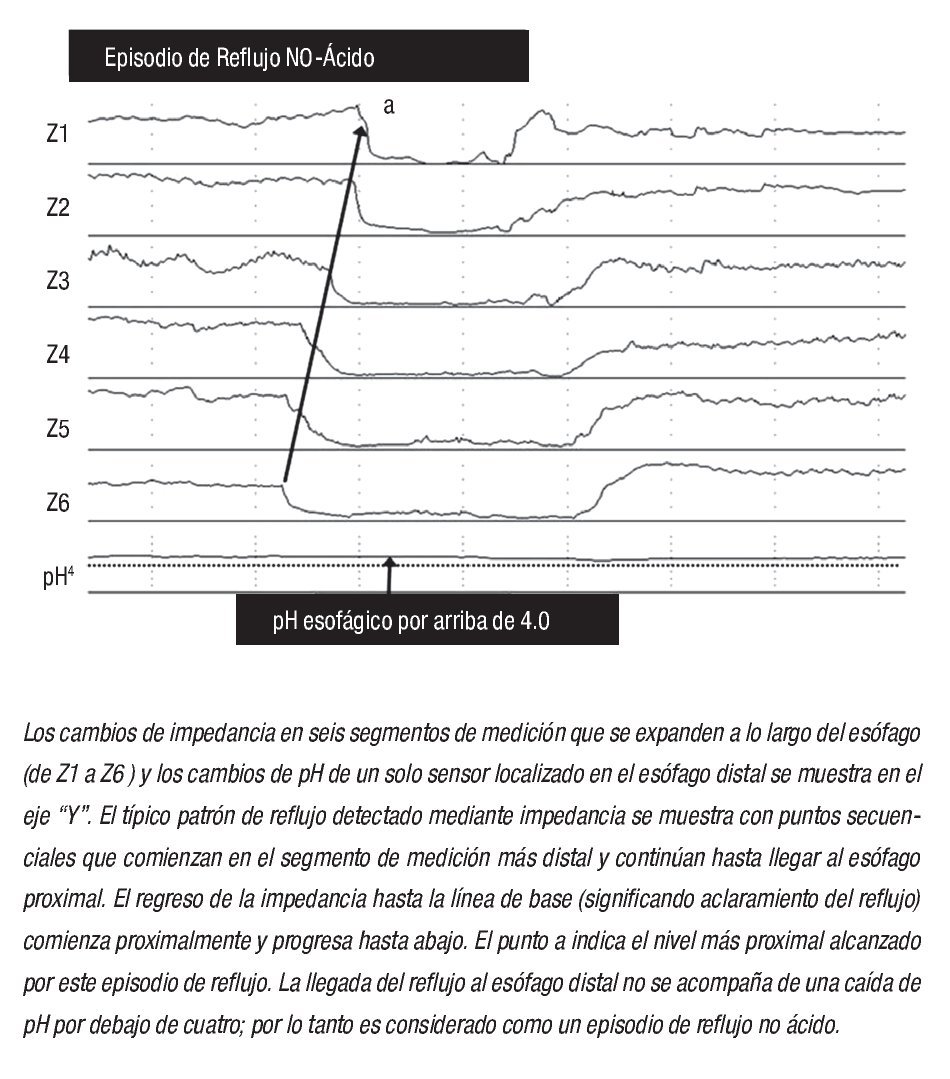
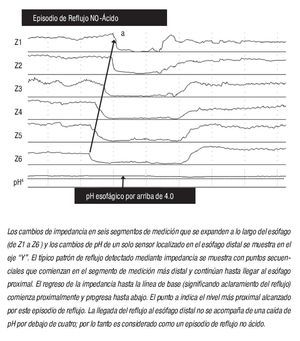
La impedancia intraesofágica, determinada por la medición de la conductividad eléctrica a través de un par de electrodos muy próximos entre sí dentro de la luz esofágica, depende de la conductividad del material a través del cual la corriente debe viajar. Al colocar una serie de electrodos de conductancia en un catéter que se extiende a lo largo del esófago, (de ahí el término "impedancia intraluminal multicanal"), los cambios en la impedancia se pueden grabar en respuesta al movimiento de material intraluminal tanto en dirección anterógrada como retrógrada. Así pues, la impedancia se usa para detectar el movimiento retrógrado del bolo, mientras que la medición del pH establece la acidez (ácido o no ácido) del episodio de reflujo. Ejemplos del reflujo ácido y no ácido se muestran en la Figura 1.
¿ Figura 1. Reflujo no ácido detectado mediante impedancia intraluminal multicanal y pH-monitoreo (pH-MII).
Antes de discutir el papel del reflujo no ácido como causa de pirosis, es importante revisar los estudios iniciales que describen que la existencia del mismo ocurre predominantemente en el posprandio o durante la supresión farmacológica del ácido.22 En un estudio piloto con 12 pacientes con ERGE, utilizando monitoreo de pH-metría-Impedencia (pH-MII) durante condiciones reflugénicas (decúbito lateral izquierdo después de la ingesta de alimentos), Vela y colaboradores23 demostraron que posterior a la administración de omeprazol, el porcentaje de episodios de reflujo ácido disminuyó de 45% a 3%, mientras que el porcentaje de reflujo no ácido se incrementó de 55% a 97%. Es importante destacar que en este estudio la pirosis y el sabor "ácido" en la boca, se relacionaron más comúnmente a reflujo ácido, pero también a reflujo no ácido. La regurgitación no se modificó con la ingesta del IBP y se asoció frecuentemente a reflujo no ácido. Este estudio, fue el primero en demostrar que la presencia de reflujo no ácido es una causa potencial de síntomas a pesar del tratamiento con IBP. En un estudio subsecuente, los mismos investigadores evaluaron el papel de la inhibición farmacológica de las tLESR (utilizando baclofen) sobre el reflujo ácido y no ácido.24 En este estudio, 18 sujetos (nueve pacientes y nueve voluntarios) recibieron de forma aleatoria baclofen o placebo. El baclofen, disminuyó significativamente el número de reflujos ácidos y no ácidos, pero además disminuyó el número de síntomas asociados a reflujo (ácido y no ácido) en los pacientes.
En un estudio multicéntrico con 144 pacientes con síntomas diversos (pirosis, regurgitación, dolor retro-esternal, tos, aclaramiento de garganta, ronquera) a pesar de estar bajo tratamiento diario con IBP dos veces al día, demostró que durante el tratamiento, 11% de los pacientes tuvieron un IS positivo para reflujo ácido, mientras que en 37% lo fue para reflujo no ácido.25 De los pacientes con síntomas típicos (pirosis, regurgitación y dolor retro esternal) 55% tuvieron un IS positivo (45% para reflujo no ácido, 10% para reflujo ácido), mientras que sólo 25% de los casos con síntomas atípicos tuvieron un IS positivo (23% para reflujo no ácido, 2% para reflujo ácido).
Patogénesis del reflujo no ácido como causa de pirosis. Ya establecido el hecho que el reflujo no ácido es un fenómeno real y medible con exactitud, la siguiente cuestión a resolver es por qué el reflujo no ácido causa síntomas típicos de reflujo. Aunque los estudios enfocados en el abordaje de la patogénesis de la pirosis causada por el reflujo no ácido son escasos, se han propuesto múltiples mecanismos.
Cuando hay presencia de esofagitis erosiva, se piensa que el reflujo ácido proveniente del estómago, penetra las rupturas visibles de la mucosa y alcanza nociceptores, que una vez activados, causan los síntomas de la pirosis. En los sujetos con ERNE, al menos tres mecanismos acerca de la patogénesis de la pirosis han sido postulados: 1) sensibilidad de los mecano-receptores a la estimulación (hipersensibilidad visceral del esófago), 2) contracciones mantenidas de los músculos longitudinales del esófago y, 3) función anormal de la barrera epitelial.26
Desde una perspectiva teórica, el mismo proceso puede llevarse a cabo en la patogénesis de la pirosis por reflujo no ácido. Dado que los pacientes con pirosis crónica, endoscopia negativa y monitoreo del pH normal parecen ser hipersensibles a la estimulación mecánica mediante la dilatación intra-esofágica con balón,27 es concebible que el reflujo, sin importar su acidez, puede producir pirosis al estimular a los mecano-receptores. Otra explicación podría ser que ésta se deba a las contracciones prolongadas de los músculos lisos longitudinales del esófago, detectables mediante ecografía de alta frecuencia. En un estudio, doce sujetos con pirosis se sometieron a pH simultáneo y ultrasonido intraesofágico de alta frecuencia,28 identificándose que las contracciones prolongadas de los músculos lisos longitudinales del esófago estuvieron asociados a 13 de 20 episodios de reflujo ácido, así como a 15 de 20 episodios de pirosis sin reflujo ácido concomitante.
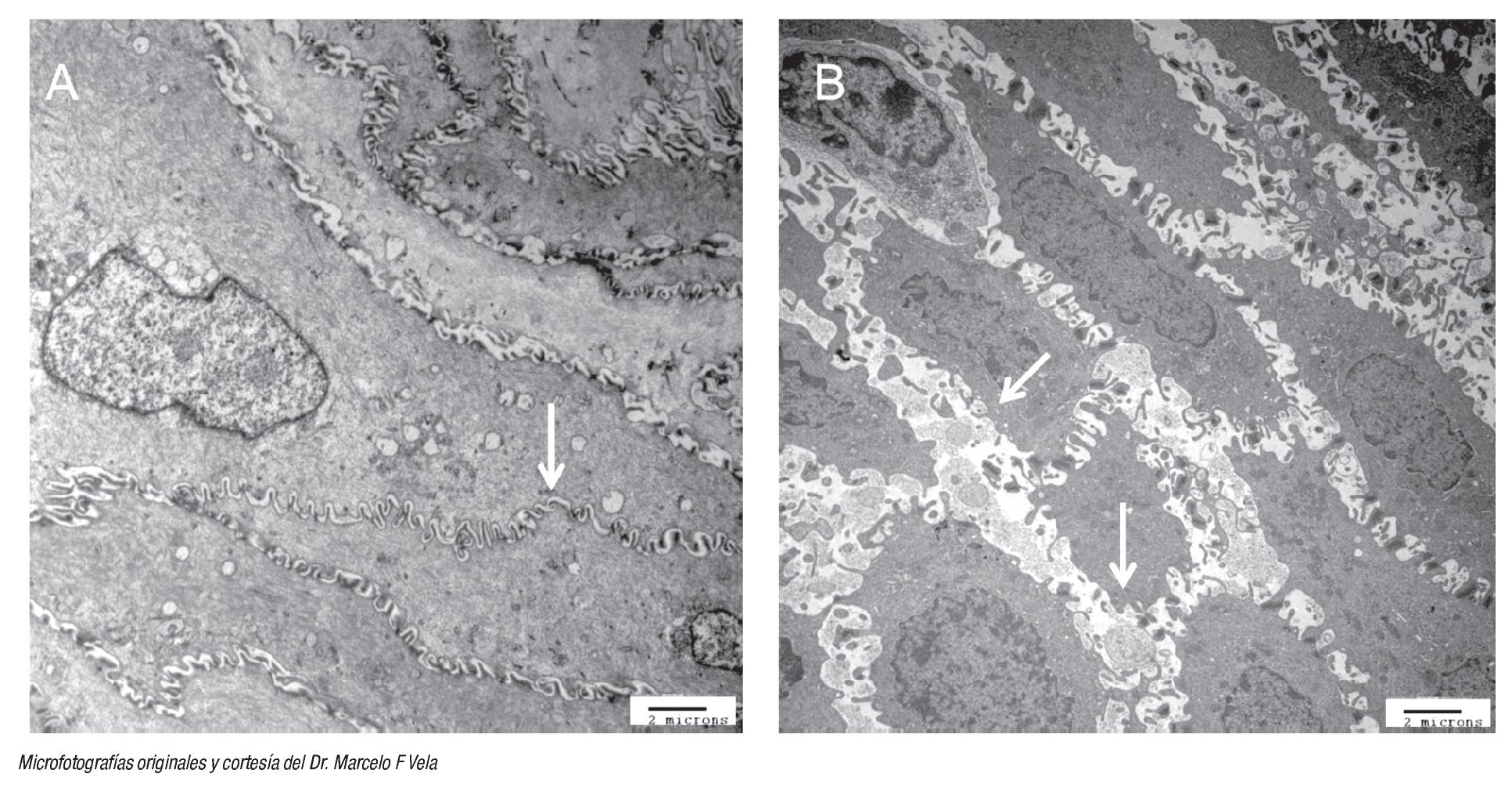
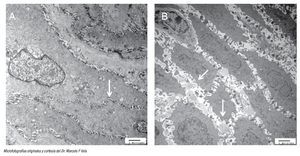
Por último, hay evidencia que muestra que el funcionamiento anormal de la barrera epitelial, provocado por dilatación entre los espacios intercelulares (DIE) del epitelio esofágico medido mediante microscopia electrónica, es un marcador morfológico temprano de daño tisular en pacientes con ERGE (Figura 2).29 Un estudio demostró que en los pacientes sintomáticos con exposición ácida anormal, con o sin esofagitis erosiva, la distancia entre los espacios intercelulares se encuentra aumentada en comparación con los controles.30 Vela y colaboradores,31 mediante el uso de pH-MII y microscopía electrónica en pacientes con pirosis refractaria encontró que, en comparación con el grupo control, los pacientes con pirosis refractaria y asociación de síntomas positivos, los espacios intercelulares se encontraban aumentados, independientemente si la pirosis se debía al reflujo ácido o al no ácido.31 Al parecer ante la presencia de DIE, el reflujo no ácido puede causar teóricamente pirosis al estimular quimiorreceptores, esto debido a la hiperosmolaridad y no así, a la acidez del reflujo; sin embargo, también podría causar estimulación de los mecano-receptores independientemente de las propiedades químicas del reflujo.
¿ Figura 2. Fotomicrografías con técnica de microscopía electrónica de biopsias de mucosa esofágica de un sujeto sano (A) en la que se muestra la presencia de uniones estrechas e espacios intracelulares intactos (flecha blanca); y de un sujeto con ERGE no erosivo (B) donde se aprecian evidentes dilataciones de los espacios intercelulares.
3. Hipersensibilidad esofágica. Ha sido postulada como un marcador biológico y un mecanismo fisiopatológico en el dolor torácico no cardiaco (DTNC) o funcional.32-34 El concepto de hipersensibilidad esofágica fue primeramente reportado por Ritcher y colaboradores35 en un estudio donde realizaron distensión esofágica con balón para evaluar el umbral sensitivo del dolor en pacientes con DTNC usando un balón de látex adjunto a un catéter de manometría. En este estudio se encontró que un alto porcentaje de pacientes reportó dolor torácico en comparación con el grupo control sano (60% vs. 20%). Estudios realizados por otro grupo de investigadores han revelado hipersensibilidad esofágica en más de 83% de los individuos con dolor torácico mediante la prueba de dilatación con balón y estimulación eléctrica.10,32-34,36,37 La mayoría de los pacientes con pirosis funcional presentan hipersensibilidad a la distensión esofágica con balón y a la perfusión de ácidos biliares. Esta observación sugiere que entre los pacientes con ERGE refractaria algunos tienen una sensibilidad aumentada ante la perfusión ácida esofágica (pacientes con ERNE ácido-sensitivos) y otros tienen una mayor sensibilidad a la sales biliares mecánicas y posiblemente a la estimulación eléctrica (pirosis funcional).
Sin embargo, determinar qué cantidad de pacientes tiene hipersensibilidad esofágica, desde un punto de vista clínico, es altamente subjetivo.
¿Sensibilización central o periférica? Las bases neurofisiológicas de la hipersensibilidad esofágica no son claras y los mecanismos propuestos incluyen una mayor respuesta periférica a los impulsos sensitivos normales y el procesamiento cognitivo (central) anormal de estos impulsos.32
Sensibilización periférica: La evidencia que sugiere que la hipersensibilidad esofágica es debida a un fenómeno de sensibilización periférica, está basada en estudios que demuestran que los pacientes con DNTC y pirosis funcional tienen umbrales sensoriales más bajos después de la estimulación esofágica con múltiples estímulos.38-40 Por ejemplo, Timble y colaboradores10 estudiaron a pacientes con ERNE y pHmetría normal y encontraron que estos pacientes fueron más sensibles a la dilatación esofágica con balón, mientras que los pacientes con reflujo patológico tuvieron un nivel de sensibilidad similar al de los sujetos sanos del grupo control. Drewes y colaboradores41 señalaron que los pacientes con pirosis funcional son hipersensibles a los estímulos de calor en el esófago e hiposensibles a la estimulación mecánica. Estos datos indican que las vías periféricas de sensibilidad al calor pueden estar relacionadas con la activación de un receptor específico.
Por otra parte, el incremento en la expresión de receptores sensitivos localizados en la mucosa del esófago como el receptor vaniloide TRPV1 y de canales ionotrópicos purinoreceptores son más sugestivos de hipersensibilidad periférica inducida por el ácido.42 El TRPV1 es un canal catiónico expresado por las neuronas sensitivas y su activación mediante calor, pH ácido o etanol, puede desencadenar el dolor urente o quemante a nivel esofágico.43 En un estudio en el que se compararon las biopsias de la mucosa esofágica de un grupo control de siete individuos sanos con las de siete pacientes con esofagitis, Matthews y colaboradores43 encontraron un aumento en la expresión del TRPV1 en las fibras nerviosas sensoriales del grupo de pacientes con esofagitis sintomática comparados con los niveles expresados en las fibras nerviosas sensoriales de los pacientes del grupo control. Además existen estudios que muestran que la instalación esofágica del receptor agonista capsaicina TRPV1 induce síntomas de ardor retro esternal y epigástrico en forma dosis-dependiente. Estos hallazgos sugieren que la expresión incrementada del TPRV1 desempeña un papel potente (periférico) en la mediación de la pirosis en los pacientes con ERGE.
Recientemente, nuestro grupo demostró que la adenosina puede inducir hiperalgesia esofágica en personas sanas por lo que puede ser un neuromediador clave en la patogénesis de los trastornos funcionales del esófago.44
Sensibilización central: Con el advenimiento de las nuevas técnicas de neuroimagen ha sido posible explorar las vías y mecanismos centrales relacionados con el dolor esofágico de tipo funcional. Por ejemplo, al monitorear el flujo sanguíneo cortical como marcador de la actividad cerebral durante la realización de distensión esofágica con balón, Aziz y colaboradores45 identificaron que se activaban estructuras límbicas y paralímbicas como la corteza insular, cingular anterior y la corteza prefrontal. Shaker y colaboradores46 compararon los cambios corticales mediante resonancia magnética funcional (RMF) inducidos durante la infusión de ácido o solución salina con los generados mediante prueba de distensión esofágica con balón en 10 voluntarios sanos. Estos autores describieron patrones de activación cortical similares que se concentraron en los lóbulos mesial, parietooccipital y frontal, y al lado o dentro de la circunvolución del cíngulo. La respuesta de la RMF cerebral tras la perfusión ácida mostró un periodo de latencia más largo en comparación con la dilatación esofágica, lo que -además de llamar la atención- sugiere un posible retraso en el procesamiento o interpretación de la señal aferente.37 La estimulación eléctrica del esófago proximal y distal, antes y después de la exposición ácida en siete pacientes con DTNC y 19 voluntarios sanos, mostró que el grupo con DTNC tuvo umbrales de dolor esofágico más bajos, los que disminuyeron aún más y se prolongaban durante más tiempo al ser expuestos a la instilación de ácido. Esto sugiere un aumento central de percepción sensorial.37 Además, estudios de potenciales evocados corticales sugieren que en algunos pacientes con dolor torácico e hipersensibilidad visceral los estímulos aferentes del esófago se han sensibilizado, mientras que otros están excesivamente alertas a las sensaciones del esófago (hipervigilantes), lo que sugiere una perturbación central de la regulación del dolor.47 La teoría de la sensibilización central se ve apoyada por un estudio que indujo acidificación duodenal y que paradójicamente produjo también hipersensibilidad esofágica. Debido a que los aferentes viscerales de numerosos órganos del tracto gastrointestinal convergen en las neuronas del asta dorsal de la columna vertebral, la activación de los aferentes viscerales en el duodeno dan lugar a una hipersensibilidad del esófago tras la infusión de ácido, más no de solución salina.48 Así, hay evidencia sustancial de que la exposición de ácido en el esófago y otras partes del tracto digestivo, puede resultar en cambios centrales neuroplásticos a nivel espinal y supraespinal.
4. Alteraciones motoras de la pared esofágica. La dismotilidad esofágica también se ha visto involucrada en el desarrollo de hipersensibilidad esofágica. Mediante el uso de planimetría por impedancia, Rao y colaboradores49 mostraron que los pacientes con DTNC tienen umbrales sensoriales 50% más bajos junto con un esófago hiperreactivo y poco distensible en comparación con sujetos control. A fin de determinar si la hipersensibilidad o la función motora desempeña un papel determinante, el mismo autor realizó dilatación con balón antes y después de administrar atropina intravenosa (para relajar la pared del esófago y disminuir el componente motor) en 16 pacientes y cinco voluntarios sanos.36 La dilatación con balón reprodujo dolor en el pecho en 81% de los pacientes comparado con el dolor inducido en 20% de los controles al inicio del estudio, los umbrales sensitivos no cambiaron después de la relajación de la pared esofágica, lo que sugiere que la disfunción de las capas motoras del esófago pudieran ser un fenómeno permanente o más difícil de revertir.36
En un estudio clásico, Balaban y colaboradores50 evaluaron a 10 pacientes con dolor torácico funcional usando ultrasonografía endoluminal, una técnica novedosa para evaluar la sincronía de las capas musculares del esófago, y demostraron que algunos de estos pacientes tenían contracciones esofágicas sostenidas (CES), asincrónicas y de larga duración durante los episodios de dolor torácico espontáneo. Esta actividad muscular aberrante se produjo en un subgrupo de pacientes y sólo durante algunos episodios de dolor. En un estudio posterior, los mismos investigadores encontraron que las CES estuvieron correlacionadas con episodios de pirosis y reflujo ácido.28 Por lo tanto, las CES pueden ser un marcador fisiopatológico del dolor torácico de origen muscular, pero es todavía difícil establecer una relación causal.
5. Comorbilidad psicológica. Los factores psicológicos pueden influir en la percepción de los síntomas en los pacientes con trastornos funcionales del esófago, tal como sucede en otros trastornos gastrointestinales funcionales. Aún más, los síntomas fisiopatológicos de la ansiedad y el neuroticismo son más comunes en pacientes con DTNC y hasta 60% de los pacientes cumplen con los criterios para diagnósticos psiquiátricos, siendo los más comunes los trastornos de ansiedad, depresión y somatización.32 Existe evidencia que sugiere que la pirosis puede estar asociada con hipersensibilidad esofágica ante los estímulos psicológicos o algunas características psiquiátricas como ansiedad o depresión.19,51,52 Por ejemplo, Johnston y colaboradores53 informaron que los pacientes con pirosis sin correlación con eventos de reflujo ácido, tuvieron puntajes de ansiedad y depresión más altos que aquellos en quienes los episodios de reflujo si se correlacionaron con eventos de reflujo ácido. En 1983 Clouse y Lustman52 realizaron evaluaciones psiquiátricas y manométricas en 50 pacientes, encontrando que 25 (50%) tenían una manometría esofágica anormal no específica; entre estos 21 (84%) tuvieron un diagnóstico psiquiátrico. En contraste sólo ocho sujetos (31%) con manometría normal tuvieron un diagnóstico psiquiátrico.
En un estudio reciente, Rubenstein y colaboradores54 compararon la sensibilidad esofágica en sujetos con pirosis con y sin respuesta a los IBP (21 con respuesta a los IBP y nueve sin respuesta) y correlacionaron la sensibilidad esofágica (perfusión de ácido y prueba de dilatación esofágica) con características psiquiátricas. Se encontró que los desórdenes psiquiátricos (obsesivo-compulsivo, hostilidad, ideación paranoide) estuvieron asociados a un incremento en la intensidad de las molestias inducidas por el ácido. La somatización estuvo asociada con el incremento en las molestias provocadas por la dilatación con balón. Por lo tanto, la hipersensibilidad esofágica podría explicar en parte la etiología de los síntomas de la pirosis que son refractarios a los IBP.
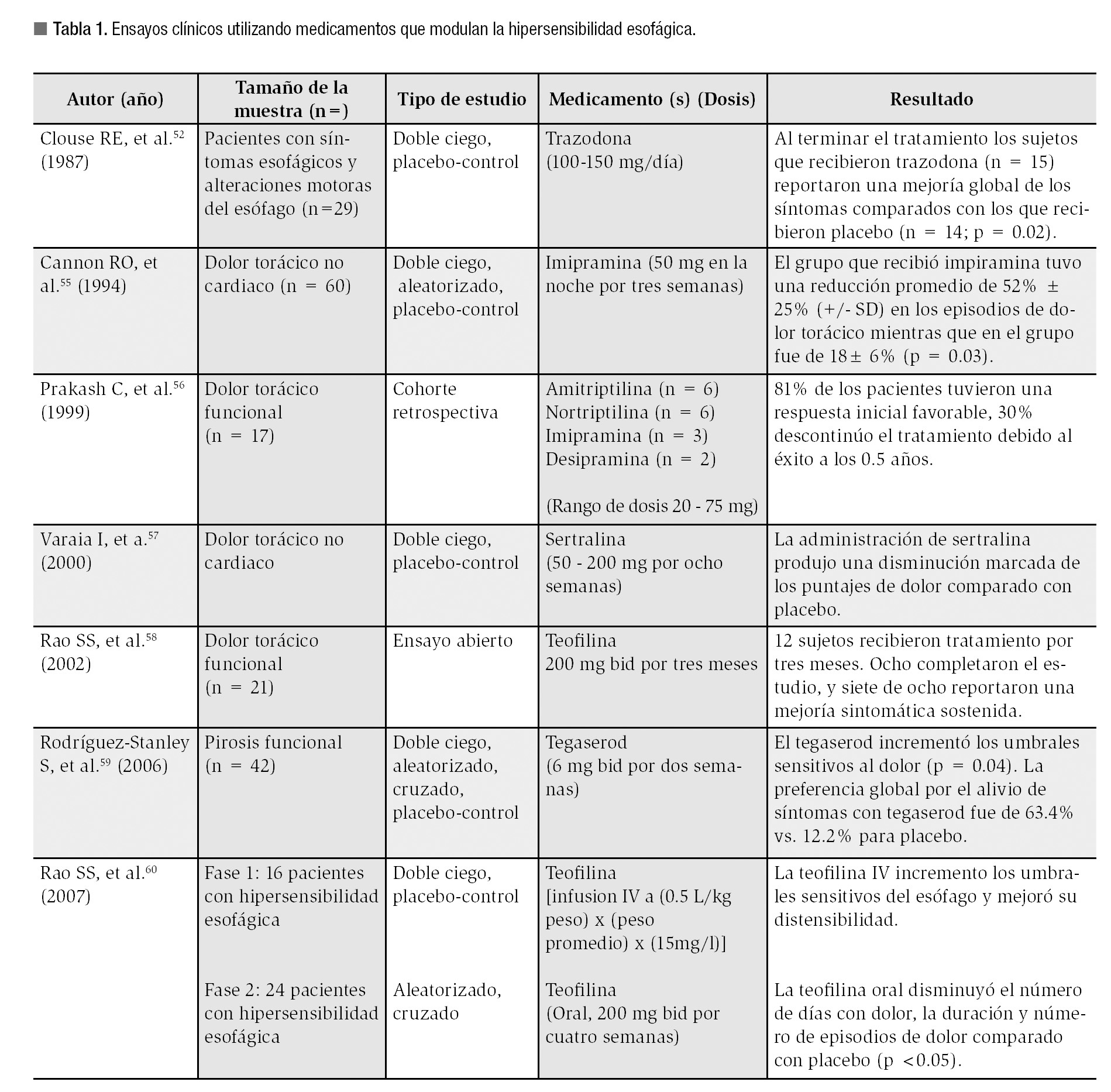
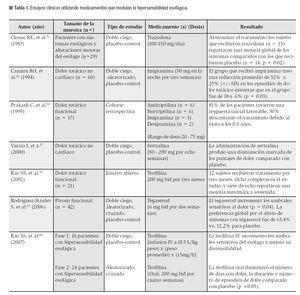
Es interesante como en esta población de pacientes, el uso de medicamentos psicotrópicos puede mejorar la sensibilidad y los síntomas esofágicos. Por ejemplo, la trazodona, administrada a dosis bajas mejora el dolor torácico en los pacientes que tienen un diagnóstico psiquiátrico.51 Otro estudio realizado por Cannon55 demostró que 38 de 60 pacientes (63%) con DTNC tenían uno o más desórdenes psiquiátricos y que posterior a la administración de imipramina a dosis bajas hubo una disminución significativa del dolor torácico. En la Tabla 1, se resumen los efectos de algunos de los fármacos psicotrópicos utilizados en la modulación de la sensibilidad esofágica.
¿ Conclusiones
Aunque la percepción de pirosis como síntoma relacionada con el ácido puede estar influenciada por la cantidad, la duración o la concentración de hidrogeniones en la mucosa esofágica, en la actualidad se consideran que existen otros factores que pueden jugar un papel determinante en el desarrollo de este síntoma como la presencia de relujo no ácido, trastornos de la motilidad, alteraciones psiquiátricas e hipersensibilidad visceral. Una hipótesis unificadora es que un estímulo nocivo, como el reflujo de ácido o bilis, no sólo puede provocar dolor a través de la activación de quimiorreceptores periféricos sino que también causan fenómenos de sensibilización central y alteraciones musculares en el esófago que a su vez provoca dolor, generando así alteraciones psicológicas como ansiedad y depresión.
Correspondencia: Marcelo F. Vela MD.
Baylor College of Medicine & Michael E. DeBakey VA Medical Center Houston, Texas.
Correo electrónico: mvela@bcm.edu.
Recibido el 1 de marzo de 2011;
aceptado el 15 de marzo de 2011.