La atrofia y metaplasia intestinal son marcadores fenotípicos tempranos en la carcinogénesis gástrica. La endoscopia con luz blanca no permite la biopsia directa de metaplasia intestinal debido a la falta de contraste de la mucosa. Se sabe que la imagen de banda estrecha aumenta la visibilidad de metaplasia intestinal, reduce el error de muestreo e incrementa el rendimiento diagnóstico endoscópico para metaplasia intestinal en pacientes asiáticos. El objetivo de nuestro estudio fue validar la utilidad de la endoscopia con imagen de banda estrecha para el diagnóstico de metaplasia intestinal en pacientes mexicanos utilizando un endoscopio con zoom electrónico de 1.5× (sin gran aumento).
Materiales y métodosSe realizó un estudio de cohorte retrospectivo en pacientes consecutivos con síntomas dispépticos en un centro endoscópico privado dentro del periodo de tiempo comprendido entre enero de 2015 a diciembre de 2016.
ResultadosUn total de 338 pacientes (63±8.4 años, 40% mujeres) fueron inscritos. La prevalencia de infección por H. pylori fue de 10.9% y la incidencia de metaplasia intestinal en el antro y cuerpo gástrico fue de 23.9% y 5.9%, respectivamente. Entre los pacientes con metaplasia intestinal el 65.3% presentó tipo incompleto, 42.7% enfermedad multifocal y un tercio presentó extensión hacia el cuerpo gástrico. Dos pacientes tuvieron displasia de bajo grado. La sensibilidad de la endoscopia con luz blanca fue de 71.2%, con una tasa de falsos negativos de 9.9%. La sensibilidad, especificidad, el valor predictivo positivo, el valor predictivo negativo y la precisión de la imagen de banda estrecha (con crestas azules claras positivas) fue de 85%, 98%, 86.8%, 97.7% y 87.2%, respectivamente.
ConclusiónLa prevalencia de infección por H. pylori y de metaplasia intestinal en pacientes mexicanos dispépticos no fue alta. A través de la valoración de la estructura de la microsuperficie y de signos de crestas azules claras, la imagen de banda estrecha sin zoom óptico tuvo valores predictivos altos para la detección de metaplasia intestinal en pacientes de marco general occidental.
Atrophy and intestinal metaplasia are early phenotypic markers in gastric carcinogenesis. White light endoscopy does not allow direct biopsy of intestinal metaplasia due to a lack of contrast of the mucosa. Narrow-band imaging is known to enhance the visibility of intestinal metaplasia, to reduce sampling error, and to increase the diagnostic yield of endoscopy for intestinal metaplasia in Asian patients. The aim of our study was to validate the diagnostic performance of narrow-band imaging using 1.5× electronic zoom endoscopy (with no high magnification) to diagnose intestinal metaplasia in Mexican patients.
Materials and methodsA retrospective cohort study was conducted on consecutive patients with dyspeptic symptoms at a private endoscopy center within the time frame of January 2015 to December 2016.
ResultsA total of 338 patients (63±8.4 years of age, 40% women) were enrolled. The prevalence of H. pylori infection was 10.9% and the incidence of intestinal metaplasia in the gastric antrum and corpus was 23.9 and 5.9%, respectively. Among the patients with intestinal metaplasia, 65.3% had the incomplete type, 42.7% had multifocal disease, and one third had extension to the gastric corpus. Two patients had low-grade dysplasia. The sensitivity of white light endoscopy was 71.2%, with a false negative rate of 9.9%. The sensitivity, specificity, positive predictive value, negative predictive value, and accuracy of narrow-band imaging (with a positive light blue crest) were 85, 98, 86.8, 97.7, and 87.2%, respectively.
ConclusionThe prevalence of H. pylori infection and intestinal metaplasia in dyspeptic Mexican patients was not high. Through the assessment of the microsurface structure and light blue crest sign, non-optical zoom narrow-band imaging had high predictive values for detecting intestinal metaplasia in patients from a general Western setting.
El cáncer gástrico (CG) es la tercera causa principal de muerte por cáncer a nivel mundial. En la mayoría de los casos es detectado en una etapa clínica avanzada y tiene una supervivencia general pobre a los 5 años. En el 2012 hubo 952,000 casos nuevos y 723,000 muertes reportadas a escala mundial1,2.
La infección por Helicobacter pylori (H. pylori) en la mucosa gástrica causa la inflamación crónica persistente involucrando neutrófilos o linfocitos, y la secuencia carcinogénica incluye escalones múltiples subsecuentes, desde la gastritis atrófica crónica (GAC), la metaplasia intestinal (MI) y la displasia, hasta el cáncer3.
La gastritis atrófica crónica y la MI son los marcadores fenotípicos más tempranos en la secuencia carcinogénica gástrica, y la monitorización dependerá de la confirmación histológica de aquellas lesiones. El sitio, la cantidad y el tamaño de las biopsias son factores asociados con el error de muestreo. La endoscopia con luz blanca (WLE, por sus siglas en inglés) no visualiza claramente tales cambios en la mucosa, y por lo tanto las biopsias son tomadas aleatoriamente. La presencia de MI y su extensión incrementa la probabilidad de desarrollar CG4. La monitorización intensiva y la valoración sistemática en dichos pacientes puede incrementar la detección temprana de lesiones y disminuir el riesgo de CG de intervalo5–7.
La técnica óptica de imagen por banda estrecha (NBI, por sus siglas en inglés), caracteriza los vasos sanguíneos y los patrones de la superficie de la mucosa al iluminar 2 luces de longitud de onda corta específicas (azul: 415nm y verde: 550nm) a través del filtro de banda estrecha. La combinación de la endoscopia magnificada con la NBI (NBI-ME por sus siglas en inglés) permite la identificación detallada de los patrones microvasculares y de los patrones de la microsuperficie de la mucosa gástrica superficial que corresponde a la histología8–10. Se reporta que el signo endoscópico de cresta azul clara (LBC, por sus siglas en inglés) presenta un valor predictivo positivo (VPP) alto para el diagnóstico histológico de MI11. La sensibilidad, la especificidad y la eficacia diagnóstica reportada de NBI-ME para la MI es de 89%, 93% y 91%, respectivamente12,13. La utilidad de la LBC en la NBI-ME para el diagnóstico de MI se validó en varios ensayos controlados aleatorizados en Asia14,15. A pesar del avance tecnológico de la NBI, en la mayoría de los países alrededor del mundo la endoscopia con zoom electrónico de 1.5×, la cual posee una capacidad de magnificación menor a la de la ME óptica, sigue utilizándose de manera común en la práctica diaria. Por lo tanto, el objetivo de nuestro estudio fue valorar la eficacia de diagnóstico de la NBI sin zoom óptico para identificar la MI en pacientes mexicanos con síntomas dispépticos.
Materiales y métodosDiseño de estudio y participantesSe realizó un estudio de cohorte retrospectivo en un centro endoscópico privado en la Ciudad de México. Se obtuvieron de expedientes médicos y reportes endoscópicos los datos de pacientes consecutivos que se presentaron con síntomas persistentes o recurrentes de dispepsia entre enero de 2015 y diciembre de 2016. Se excluyeron los datos de los pacientes con las siguientes condiciones: sangrado gastrointestinal, perforación, obstrucción intestinal, cáncer gástrico avanzado, estenosis, resección gástrica, hipertensión portal y alergia a la dimeticona. Se documentaron los datos clínicos y demográficos de todos los pacientes, como historial de tabaquismo, alcoholismo, historial familiar de cáncer gástrico e índice de masa corporal (kg/m2).
Procedimiento endoscópico y definición de los hallazgosLos pacientes ayunaron >8horas antes de la gastroscopia. Con infusión por goteo continua de 0.9% de solución salina fisiológica y administración de oxígeno por cánula nasal a una tasa de 3l/min, un anestesiólogo administró sedación con propofol, de acuerdo con los requisitos básicos. Los signos vitales (presión arterial, ritmo cardiaco, ritmo respiratorio, temperatura corporal y saturación de oxígeno) se monitorizaron y registraron continuamente.
Un solo endoscopista (SSC) examinó la mucosa gástrica, utilizando un sistema EVIS EXERA II y un gastroscopio H-180 (Olympus Medical Systems, Tokio, Japón). Se tomaron imágenes del antro y cuerpo gástrico para evaluar el rendimiento de la endoscopia para el diagnóstico de metaplasia intestinal.
Primero se observó la mucosa gástrica a través de la endoscopia convencional con luz blanca y se emplearon los siguientes hallazgos endoscópicos como indicadores para el diagnóstico de MI: mucosa blanquecina, una superficie mucosa áspera y desigual, una apariencia vellosa, vénulas colectoras atípicas y enrojecimiento irregular15.
Después se observó la mucosa por medio de la NBI. Se diagnosticaron los patrones de la microsuperficie bajo la magnificación electrónica 1.5× como regular, irregular y ausente, de acuerdo con el patrón del epitelio críptico12 o la sustancia blanca y opaca (WOS, por sus siglas en inglés)16.
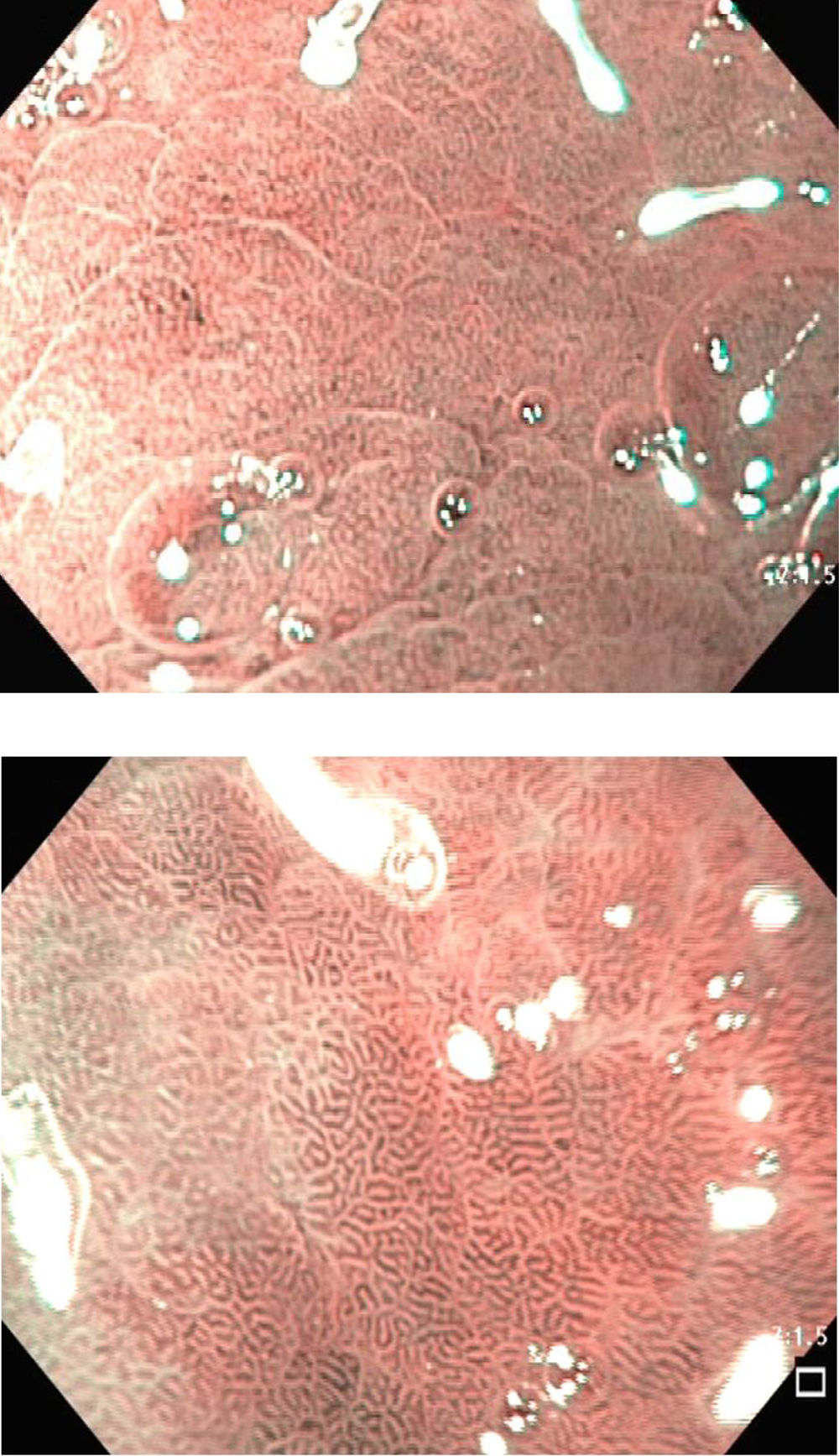
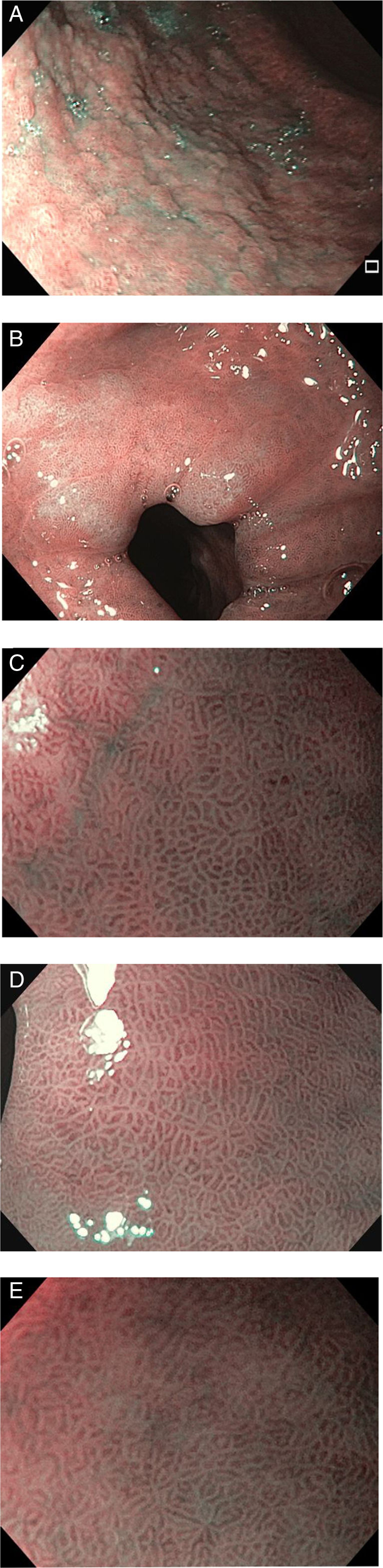
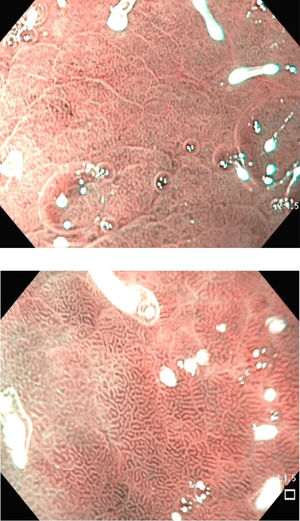
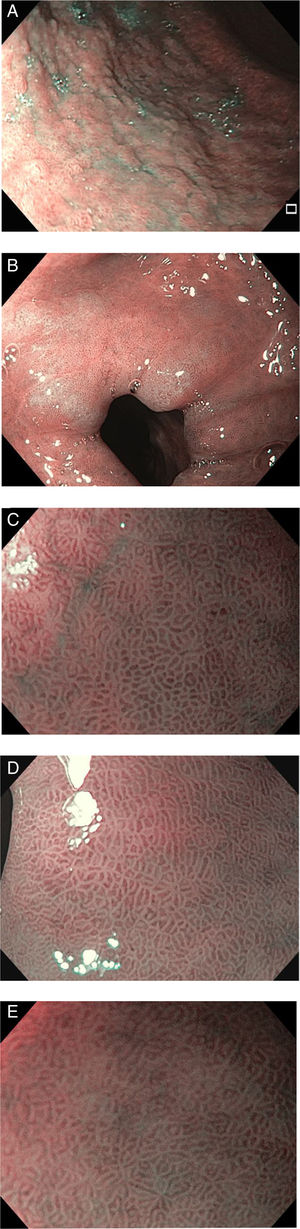
Los criterios de diagnóstico en la NBI fueron12: 1) ausencia de MI: criptas regulares ovaladas o circulares rodeadas por vasos con una distribución regular (fig. 1); y 2) MI: mucosa en la cresta/tubulovellosa regular y vasos sanguíneos regulares con LBC (fig. 2). El signo endoscópico conocido como LBC es un área irregular blanquiazul que puede ser observada en la superficie del epitelio gástrico por medio de la NBI-ME (endoscopia magnificada). Tras el hallazgo endoscópico de MI se tomaron biopsias dirigidas con fórceps de biopsia estándares. En ausencia de lesiones las biopsias se realizaron aleatoriamente (2 del antro y una del cuerpo). Se colocaron las biopsias del antro en un frasco (338) con 10% formaldehído y se etiquetaron de manera separada a aquellas del cuerpo (338 biopsias).
Se llevó a cabo la tinción con hematoxilina y eosina. Los especímenes también fueron evaluados para infección por H. pylori utilizando tinción de Giemsa al 2% modificado. Un patólogo experto (Márquez, ML), formado en patología gastrointestinal, procesó todos los especímenes de la mucosa. El patólogo no fue cegado a la información clínica ni a los hallazgos endoscópicos.
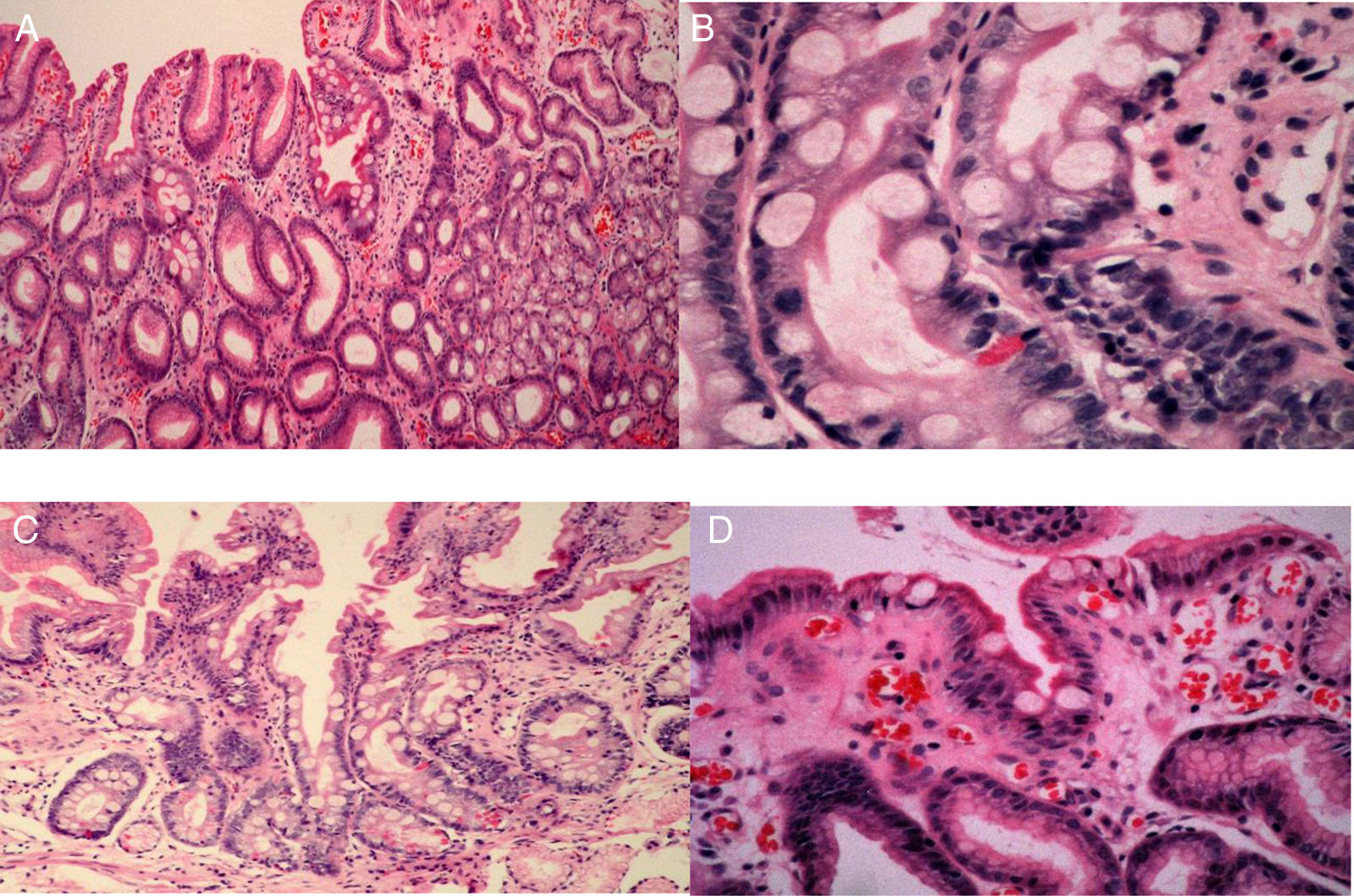
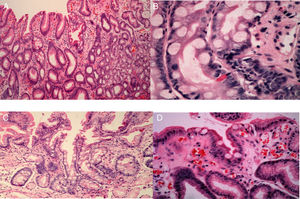
Los grados de infiltración neutrofílica (actividad), infiltración de células mononucleares (inflamación), atrofia y MI se calificaron de acuerdo con el sistema actualizado de Sydney (normal, leve, moderado o severo)17,18. La atrofia se definió como la pérdida de glándulas con o sin metaplasia. La presencia de cualquier grado de MI en la biopsia sirvió como el estándar de referencia para el diagnóstico endoscópico de MI. La MI se subclasificó en tipos completos o incompletos, así como en tipos focales o multifocales19 (fig. 3).
Imágenes histológicas de metaplasia intestinal gástrica. A. Metaplasia intestinal focal incompleta: célula caliciforme (flecha negrita), enterocitos de borde cepillado (flecha delgada) y epitelio foveolar normal (cruz). B. Metaplasia intestinal completa: célula caliciforme (flecha delgada), enterocito (flecha negrita), célula de Paneth (flecha corta). C. Metaplasia intestinal completa: célula caliciforme (flecha delgada), enterocito (flecha larga) y célula de Paneth (flecha ancha). D. Metaplasia intestinal incompleta: enterocitos (flecha delgada), célula caliciforme (flecha negrita) y epitelio foveolar (cruz).
La MI completa (tipo i) se caracterizó por células caliciformes esparcidas entre las células columnares absortivas e intercaladas entre las células columnares secretoras que se asemejan hasta cierto punto a las células foveolares gástricas o a las células colorrectales. El tipo incompleto se definió por gotitas múltiples de mucina intracitoplasmática de tamaños y formas variantes, y la ausencia de un borde cepillado18. La focal se definió como la presencia de MI en el antro o cuerpo, y la MI multifocal se definió como la presencia de MI en ambas áreas20.
Análisis estadísticoSe emplearon estadísticas descriptivas para calcular frecuencias y proporciones. La prueba Chi cuadrado se utilizó para las variables categóricas con un nivel 0.05 de significación. Se calculó el índice de detección de lesiones premalignas. Se estimó el rendimiento diagnóstico de LBC para el diagnóstico de MI. Se llevó a cabo una prueba de diagnóstico, calculando la sensibilidad, especificidad, el VPP, valor predictivo negativo (VPN), cociente de probabilidad (CP), precisión de diagnóstico y prevalencia de enfermedad. Se utilizó el programa de estadísticas SPSS 19.0 para calcular los valores de las variables.
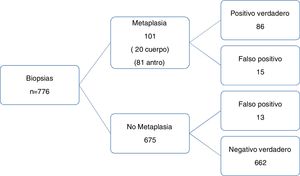
ResultadosUn total de 338 pacientes consecutivos (776 biopsias) fueron incluidos en el estudio. Se listan los datos demográficos en la tabla 1. Todos los pacientes presentaban síntomas de dispepsia (edad 63.9±8.4 años, 203 hombres y 135 mujeres, y un promedio de IMC de 26.2±3.2). Solo 8 sujetos (2.36%) tenían un historial familiar de cáncer gástrico en un pariente de primer grado.
Demográficos de los participantes del estudio
| Pacientes | 338 |
| Edad promedio | 63.9±8.4 años |
| Sexo (hombre/mujer) | 203 (60%)/135 (40%) |
| Índice de masa corporal | 26.2±3.2kg/cm2 |
| Tabaquismo (>20/día), | 10 (2.95%) |
| Alcoholismo | 0 |
| Ingesta regular de AINE | 30 (8.87%) |
| Ingesta regular de IBP | 267 (79%) |
| Historial familiar de CG en parientes de primer grado | 8 (2.36%) |
| Infección por H. pylori | |
| Presente | 37 (10.9%) |
| Ausente | 301 (89.1%) |
La prevalencia de infección por H. pylori en la muestra de la biopsia fue de 10.9% (37/338 pacientes). La prevalencia de MI en el antro y cuerpo gástrico fue de 23.9% y 5.9%, respectivamente (tabla 2). La MI fue incompleta en 65.3% de los pacientes y multifocal en 42.6% (fig. 1). Hubo 2 casos de displasia de grado bajo. En 20/81 (24.6%) la metaplasia se extendió completamente hasta el cuerpo gástrico. No se observó cáncer gástrico temprano durante las evaluaciones del presente estudio.
Cambios histológicos en casos consecutivos de pacientes con síntomas persistentes o recurrentes de dispepsia
| Hallazgos histológicos en la mucosa gástrica | (%) |
|---|---|
| Prevalencia de MI en el antro | 81/338 (23.9) |
| Prevalencia de MI en el cuerpo | 20/338 (5.9) |
| Subtipo de MI en 101 casos | |
| MI completa | 35 (34.6) |
| MI incompleta | 66 (65.3) |
| Distribución de MI en 101 casos | |
| Focal | 58 (57.4) |
| Multifocal | 43 (42.6) |
La sensibilidad de la endoscopia con luz blanca para la MI fue de 71.2% (72/101 casos), pero la tasa de falsos negativos fue de 9.9% (66/665 biopsias no metaplásicas).
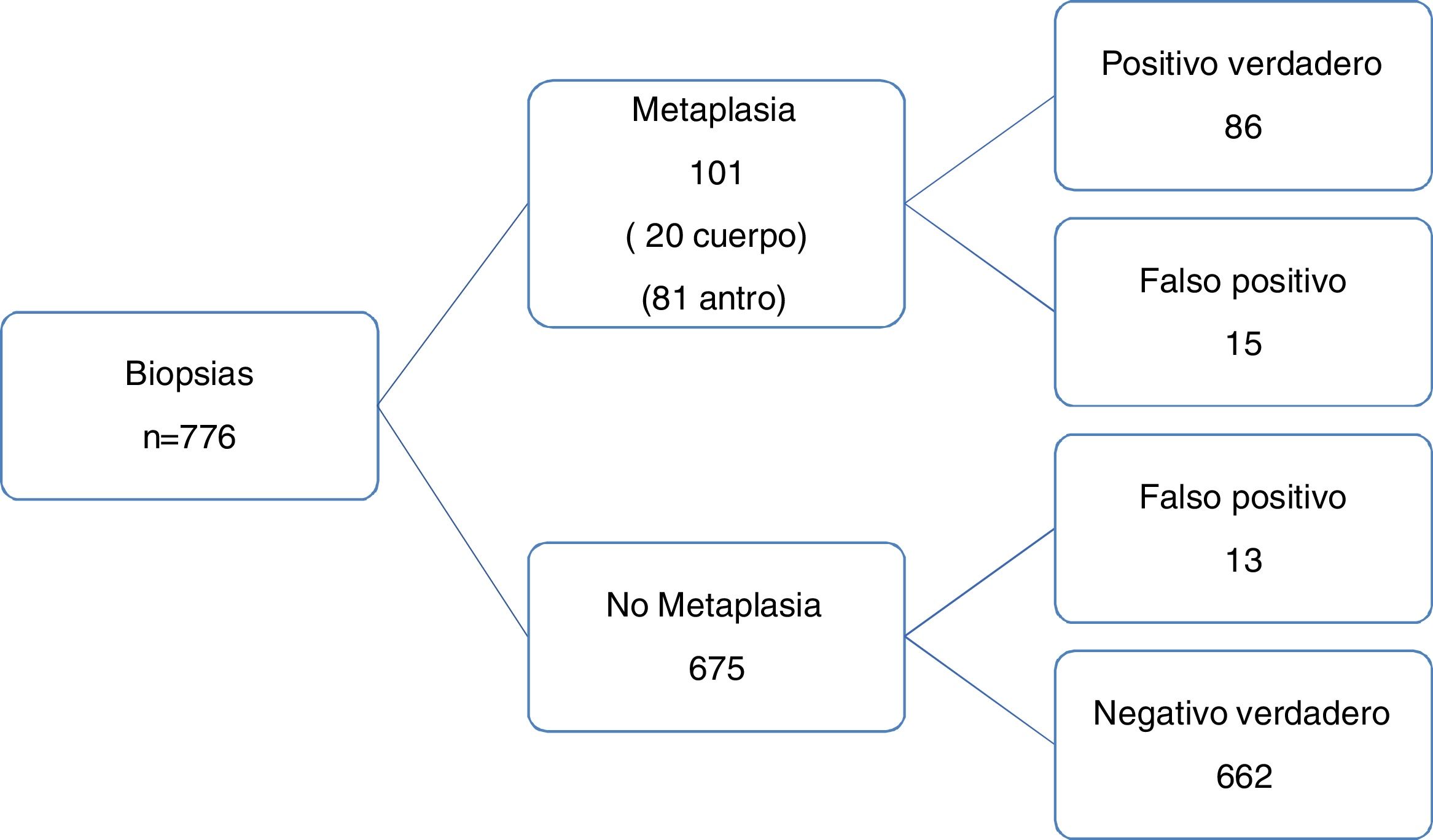
La sensibilidad y especificidad y el VPP y VPN para la detección de MI por medio de la NBI fueron 85% (IC 95%: 76.69-91.44), 98% (IC 95%: 96.73-98.9), 86.8% (IC 95%: 79.3-91.9) y 97.7% (IC 95%: 96.5-98.60), respectivamente, y la precisión de diagnóstico fue 87.2%, con una tasa de prevalencia de 13% (fig. 4). El cociente de probabilidad positivo (CP+) fue 44 (IC 95%: 26-76) y la probabilidad subsecuente fue 87% (IC 95%: 80-92). La probabilidad de que un paciente con prueba positiva presentara la enfermedad fue ∼1 de 1.2. El cociente de probabilidad negativo (CP–) fue 0.15 (IC 95%: 0.09-0.24) y la probabilidad subsecuente fue 2% (IC 95%: 1-3). La probabilidad de que un paciente con prueba negativa estuviese sano fue 1 de 1.0.
Discusión y conclusiónLa prevalencia de infección por H. pylori y MI en pacientes mexicanos dispépticos no fue alta. El signo endoscópico de LBC mostró tener valores predictivos altos para el diagnóstico de MI, con cocientes de probabilidad altos.
La infección prolongada por H. pylori causa gastritis crónica y es el factor principal causante que lleva a la MI21. Consiste en la transformación metaplásica del epitelio gástrico normal a MI, como resultado de una alteración genética y biomolecular de las células epiteliales22. Existe un riesgo incrementado de MI de 4.5 a 9 veces mayor en pacientes con infección por H. pylori. Esta condición premaligna puede detectarse en uno de 4 sujetos sometidos a endoscopia23. Su prevalencia en la población occidental varía entre el 10% y 20%24.
Entre los casos de MI detectada, 69.1% eran de tipo incompleto y 40.7% eran multifocal. La progresión de MI gástrica a adenocarcinoma está altamente asociada con el tipo incompleto23,25. Un estudio colombiano que investigó la distribución de MI y el riesgo de cáncer gástrico indicó que los pacientes con MI extendida hacia la curvatura menor tenían un riesgo incrementado de 5.7 veces mayor (IC 95%: 1.3-26) y que los pacientes con patrón difuso (MI en ambos el antro y el cuerpo) tenían un riesgo incrementado de 12.2 veces mayor (IC 95%: 2.0-72.9), comparado con pacientes con MI limitada al antro19. Esos resultados sugieren que, aunque la prevalencia de infección por H. pylori y MI en pacientes mexicanos con síntomas dispépticos no es alta, una cierta fracción de los pacientes en nuestra población tiene un riesgo sustancial para el desarrollo de cáncer gástrico (24.6% con MI extendida). El objetivo principal para la reducción de la mortalidad por cáncer gástrico es la detección en etapa temprana y el tratamiento de neoplasias. Por lo tanto, es de máxima importancia para los endoscopistas identificar la MI y tomar una biopsia, y para los patólogos reportar ambos el tipo de MI (completa/incompleta) y su extensión26.
En una serie de casos consecutiva en Japón la MI era más frecuente entre los sujetos con infección por H. pylori que en los sujetos no infectados (37% versus 2%)27,28. La tasa de infección bacteriana entre nuestros casos era muy baja (11.8%), aún más baja que la prevalencia de MI. Esto es probablemente debido al uso crónico de IBP, el uso de un solo método de diagnóstico (histología) y la falta de evaluación de la bacteria en los segmentos proximales del estómago. Se reporta que los pacientes que fuman >20 cigarros/día tienen un riesgo incrementado para desarrollar MI (4.75, IC 95%: 1.33-1.99)22, y lo mismo se mantiene para los pacientes con las cepas cagA28. En nuestra serie de casos únicamente el 1.95% de los pacientes reportó tabaquismo crónico empedernido y solo 2 presentaron MI focal del antro. En nuestro estudio no se evaluó la presencia de cepas virulentas. Por lo tanto, una prueba para la detección de infección por H. pylori por sí sola puede no ser un método útil para la identificación de pacientes con MI, la cual es una condición premaligna para el cáncer gástrico en México.
Existe un riesgo incrementado para desarrollar MI (un incremento 2.6 a 3.5 veces mayor; 8% riesgo atribuible calculado) en los individuos que tienen un pariente de primer grado con cáncer gástrico29. La tasa de prevalencia de MI es más alta en aquella población que en los controles. Las razones de momios reportadas en un metaanálisis fue 1.98 (IC 95%: 1.363-2.881)23. En nuestra muestra del estudio la prevalencia de sujetos con un pariente de primer grado con CG era muy baja, lo cual podría ser una explicación para la baja prevalencia de MI en los sujetos de nuestro estudio. Sin embargo, es posible que una infección por H. pylori sea la causa única de MI en un individuo sin historial familiar de cáncer gástrico.
La importancia de la monitorización en pacientes con una condición de la mucosa de alto riesgo, como atrofia y/o MI, ha sido un tema de controversia. La regresión de MI por medio de la erradicación de H. pylori no ha mostrado suficientes resultados convincentes. Un metaanálisis de 7 estudios no reportó una regresión significante de MI del antro (RM: 0.795; IC 95%: 0.587-1.078; p=0-14) ni de MI en el cuerpo (RM: 0.891; IC 95%: 0.633-1.253; p=0.56) después de la erradicación bacteriana30. Shichijo et al.31 indicaron que la MI era el predictor del desarrollo de cáncer gástrico después de la terapia de erradicación. Se piensa que hay un punto de ruptura, o un punto de no retorno dentro de la secuencia carcinogénica, en el cual la reversión no es posible. La MI probablemente representa este punto de ruptura, o de no retorno, en la carcinogénesis gástrica32. Por lo tanto, el diagnóstico de la MI y la recomendación de monitorización endoscópica es importante en aquellos pacientes, aún sin la detección de H. pylori o con su erradicación.
El hallazgo endoscópico de la MI fue descrita por primera vez en 1966 por Takemoto como lesiones grisáceas elevadas esparcidas sobre la mucosa del antro pilórico y el ángulo gástrico35. En 2002 Kaminishi et al34. investigaron la precisión diagnóstica de ese hallazgo. Sin embargo, aunque la presencia de elevaciones grisáceas era altamente específica (98-99%) tenía una sensibilidad muy baja (6-12), y concluyeron que el diagnóstico de la MI debía basarse en la histología y que la endoscopia estándar no era adecuada para el diagnóstico de la MI.
Recientemente, Fukuda et al35. incluyeron otros hallazgos endoscópicos de MI por medio de endoscopia con luz blanca y utilizaron un videoendoscopio de alta resolución, demostrando un mejor rendimiento diagnóstico endoscópico para MI. En el presente estudio utilizamos los mismos hallazgos endoscópicos para diagnosticar MI por medio de la endoscopia con luz blanca, detectando la MI con una sensibilidad de 76.5%. Empleando la NBI (el signo LBC) detectamos MI con una sensibilidad de 85.1%, resultando en un incremento de 8.5% en el rendimiento diagnóstico. Además, la tasa de falsos positivos disminuyó significativamente de 24.5% a 3.9%. La NBI contrasta la arquitectura microvascular y la apariencia de la estructura de la mucosa superficial, y con la magnificación nos permite observar los detalles de las características morfológicas del epitelio33. En 2012 se validó una clasificación reproducible de NBI, con tasas de precisión de 85% y 90% para el diagnóstico de MI y displasia, respectivamente36. La sensibilidad reportada fue 87% (83-91), la especificidad fue 97% (95-98), el CP+ fue 27.8 (19-41) y el CP- fue 0.13 (0.1-0.17) para MI. La NBI incrementó el rendimiento diagnóstico más del 10% y logró una tasa de eficacia diagnóstica del 94%37. En nuestra serie de casos tuvo un mayor efecto sobre la tasa de falsos positivos, y la tasa de falsos negativos no fue estadísticamente significativa cuando se comparó con la endoscopia con luz blanca. Se reportó la sensibilidad acumulativa en 0.86 (IC 95%: 0.83-0.89), con una especificidad de 0.88 (IC 95%: 0.84-0.91), un CP+ de 7.131 (IC 95%: 4.39-11.59), un CP– de 0.15 (IC 95%: 0.08-0.30) y un área bajo la curva ROC de 0.948235. Obtuvimos una sensibilidad del 85%, una especificidad del 98%, un VPP del 86.8% y un VPN del 97.7% para la detección de MI con la LBC. Los cocientes de probabilidad fueron apropiados. Capturando imágenes de acuerdo con el protocolo de detección sistemática para el estómago asegura una valoración objetiva del hallazgo endoscópico de MI, y su uso nos permitiría relacionar los hallazgos endoscópicos con los resultados clínicos relevantes26.
La ausencia de un patrón de la mucosa tubulovelloso (patrón B) o la LBC puede excluir la presencia de MI. Por lo tanto, es importante el diagnóstico de MI por medio de hallazgo endoscópico, no solo para la identificación de pacientes de alto riesgo, sino también para la exclusión de los pacientes de bajo riesgo del cribado y monitorización intensiva. La LBC se origina de la reflexión de luz sobre la estructura ciliada en la superficie de la MI (borde cepillado). El epitelio de la MI parece turbia, comparada con la mucosa no metaplásica9,38. Así, el diagnóstico de características de la mucosa por medio de la NBI-ME correspondería directamente a los cambios histológicos del epitelio gástrico. La endoscopia con magnificación por zoom óptico no es ampliamente utilizada en países occidentales, pero nuestros resultados apoyan a la viabilidad de utilizar la NBI con zoom electrónico no óptico para el diagnóstico de MI, detectando el signo endoscópico de LBC para estratificar el riesgo en el paciente mexicano.
Nuestro estudio tiene varias limitaciones. Primero, debido a su diseño retrospectivo, los resultados deben ser confirmados en un análisis prospectivo. Segundo, 2 biopsias del antro fueron colocadas juntas en una ampolla, pero se evaluaron separadamente de las muestras del cuerpo. Tercero, el criterio de exclusión no incluyó el uso de IBP (dentro de los últimos 30 días) para la detección de bacteria. Cuarto, la información clínica no fue cegada para el patólogo y pudo haber afectado la validez externa del estudio. Y por último, la falta de un cap en la punta del endoscopio para fijar la posición y obtener imágenes de mayor calidad hizo difícil la observación de los capilares.
En conclusión, la prevalencia de la MI en el antro y el cuerpo gástrico en pacientes con síntomas persistentes de dispepsia fue de 23.9% y 5.9%, respectivamente. En México la infección por H. pylori se detectó en solo 10.9%. Por medio de la evaluación de la estructura de la microsuperficie y la LBC, la NBI con zoom no óptico mostró valores predictivos altos para el diagnóstico de MI del antro, con cocientes de probabilidad altos, dentro de un marco occidental.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo/estudio.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.