Coordinador general: Dr. Aldo Torre Delgadillo
Coordinador: Dr. Francisco Javier Bosques Padilla
Participantes: Dr. Carlos Alejandro Cortez Hernández, Dr. Juan Francisco J. Rivera Ramos, Dr. Misael Uribe Esquivel
¿Cuáles son los elementos más relevantes en la fisiopatología de la encefalopatía hepática (EH)?
La falla hepática, los cortocircuitos portosistémicos y las 6 deficiencias enzimáticas del ciclo de la urea, resultan en un aumento en la concentración sanguínea de sustancias que son potencialmente neurotóxicas, siendo de particular interés el amonio que tiene un papel central.
El amonio es un intermediario clave en el metabolismo de proteínas y nitrógeno, su manejo dinámico en humanos está bien definido, siendo el aparato gastrointestinal el sitio primario de su producción. Los componentes de nitrógeno en el intestino, en el cual incluyen ingesta de proteínas y secreción de urea, son degradados por bacterias y liberan amonio, que es entonces absorbido en la circulación portal en donde las concentraciones son 5 a 10 veces mayores que en la sangre venosa mixta. El hígado representa un sitio muy importante, como también lo son los riñones y el músculo, para la extracción de amonio resultando en una depuración del sistema portal y prevención de su entrada en la circulación sistémica. En los hepatocitos preferentemente centrales, el amonio es convertido por una serie de reacciones enzimáticas en glutamina "no tóxica" y en reacciones separadas éste es sintetizado en urea para ser excretado por los riñones.
La evidencia de una asociación entre EH y amonio datan desde hace un siglo con los trabajos de Eck, el cual descubrió los efectos de la anastomosis portocava en perros.1 La alimentación con carne en perros con fístula de Eck resultó en pérdida de la coordinación, estupor y coma, lo que llevó a sugerir que los productos nitrogenados fueron el factor causal en la así llamada intoxicación por carne en esos animales. Las concentraciones de amonio en sangre arterial están frecuentemente elevadas en pacientes con todas las formas de EH. Estudios recientes usando tomografía con emisión de positrones y/o resonancia magnética nuclear y amonio, revelaron acumulación de niveles tóxicos de amonio en humanos con EH.2,3 Existe una correlación lineal entre la elevación de amonio en sangre periférica y el parénquima cerebral. Estos estudios demuestran un aumento en la tasa en la cual el amonio es capturado y metabolizado por el cerebro y un aumento de la permeabilidad de la barrera hematoencefálica, sugiriendo que, en la falla hepática aguda y crónica, la barrera llega a aumentar su permeabilidad al amonio, lo cual resulta en una hipersensibilidad del paciente hepatópata a condiciones amoniogénicas, tales como ingesta de dietas abundantes en proteínas o hemorragia gastrointestinal y una imperfecta correlación entre el grado de disfunción neurológica y la concentración de amonio sanguíneo. La difusión del amonio en el parénquima cerebral no es homogénea, más bien es regional, teniendo diversas áreas específicas de distribución, de ahí que existan alteraciones que se manifiestan con variantes tan disímbolas, como el extrapiramidalismo o como un fenómeno difuso como es el estado de coma.
Mecanismos de la fisiopatología de la toxicidad del amonio
El papel central del amonio en el mecanismo de la EH está fuera de debate. La EH, tanto en su forma aguda como crónica, se considera un problema osmótico, ya que es dominada por la presencia de diversos grados de edema cerebral. El amonio es considerado un osmolito, que se elimina vía la formación de glutamina favorecido por la enzima glutamil sintetasa. De no metabolizarse por esta vía, existirá elevación de amonio y glutamina en el astrocito. El edema de los astrocitos, aunque sea leve, por representar el mayor porcentaje de la masa celular intracraneana y por producir edema regional, favorece la hipertensión endocraneana, y en hepatitis fulminante la hiperamonemia explica el enclavamiento de la amígdala cerebelosa y del tallo cerebral.
Otros factores que se han implicado en la génesis de la encefalopatía hepática son:
Oligoelementos (zinc, manganeso).
Aminoácidos aromáticos y de cadena ramificada.
Mercaptanos.
Ácido gamma-amino-butírico (GABA), benzodiazepinas endógenas.
Neurotransmisores falsos, clínicas, alteraciones de ligandinas por neuroesteroides como pregnenolona alterada.
Todos estos factores se han explorado en modelos experimentales y sus implicaciones en el ser humano están asociadas con un efecto sinérgico asociado al amonio.
Nivel de evidencia IV
¿Cuáles son los datos clínicos para diagnosticar la encefalopatía hepática? ¿Hay otra forma de diagnosticar encefalopatía hepática?
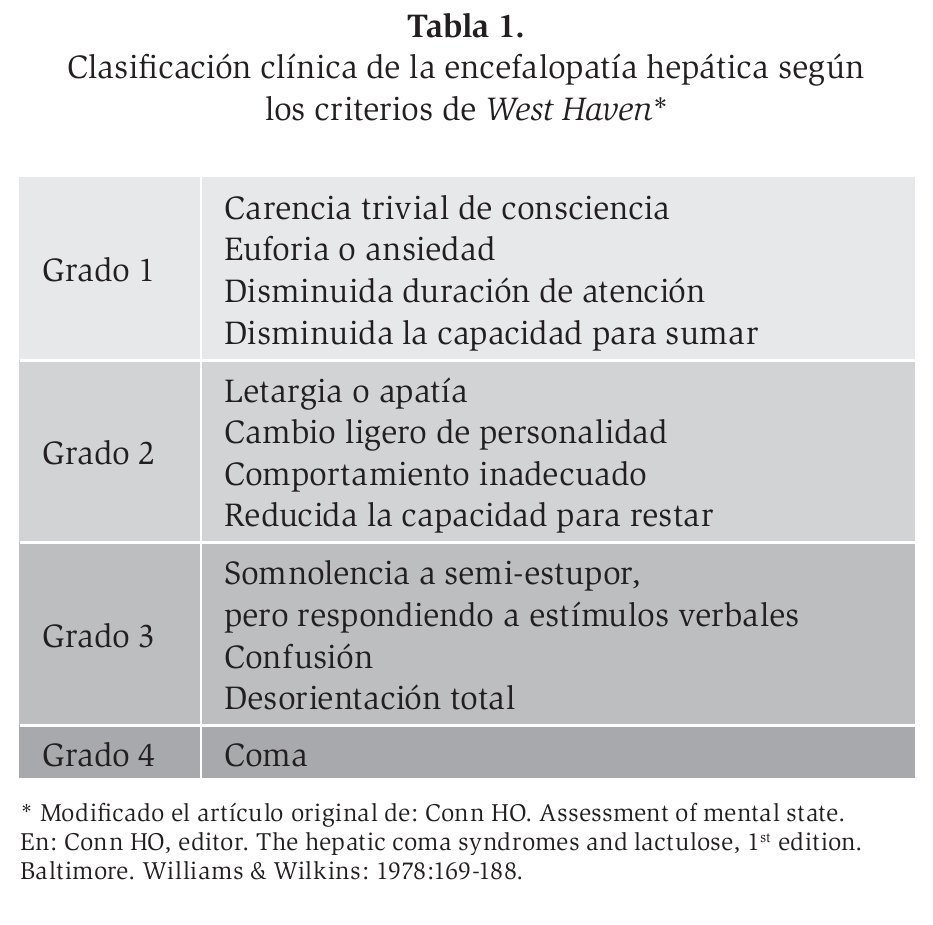
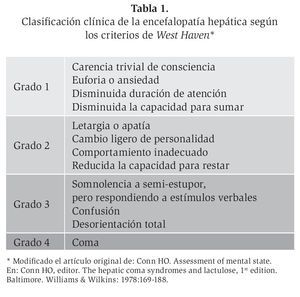
Existen clínicamente dos grandes grupos o tipos de EH, la encefalopatía hepática manifiesta y la encefalopatía mínima. La manifiesta no es de difícil diagnóstico, por sus grandes expresiones clínicas que evidencian bradipsiquia asociada a hepatopatía crónica, que se hace evidente en todas las pruebas psíquicas y clínico-neurológicas, y que puede ir desde la confusión, somnolencia, estupor y coma. Para la detección de la EH se dispone de herramientas diagnósticas clínicas (los criterios West Haven), bioquímicas (el amonio), neuropsicológicas (la prueba de conexión numérica) y neurofisiológicas (el electroencefalograma, los potenciales evocados).
Diagnóstico bioquímico
El diagnóstico de la EH es de exclusión, ya que se debe descartar la presencia de otras encefalopatías metabólicas (deficiencia de vitamina B1, hipoglucemia, hipotiroidismo, etc.). Un nivel normal de amonio en la sangre arterial excluye EH, pero no una encefalopatía metabólica que puede coexistir con una enfermedad hepática. Igualmente se deben investigar otras causas orgánicas neurológicas como hematomas subdurales o intracerebrales, sobre todo si no mejora la encefalopatía al reducir el nivel del amonio.
Diagnóstico clínico
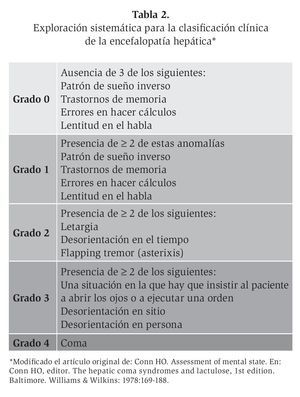
Para el diagnóstico clínico de la EH se pueden utilizar los criterios West Haven,6 que organizan la EH en diversos grados que oscilan entre normal, trastornos mentales leves y coma (Tabla 1). El diagnóstico clínico de la EH conlleva una variabilidad inter e intraobservador, sobre todo en la distinción entre los grados 0 y 1. En la práctica clínica, probablemente no se diagnostica un gran número de pacientes con una EH de grado 1 si se utilizan sólo los criterios de West Haven. Por eso se debe examinar la presencia de la EH de una manera sistemática, como se describe en la Tabla 2. La memoria se evalúa a corto plazo (¿puede el paciente repetir un número de 6 cifras?), a mediano y largo plazo (¿puede el paciente repetir una frase o 3 objetos después de 10 minutos?), y a largo plazo (¿está el paciente al corriente de situaciones que afectan a todo el mundo, como nombres de presidentes, guerras, eventos deportivos, etc.?). Para evaluar la atención se pide al paciente hacer un sencillo cálculo (la prueba de los 7 seriales): de la cifra 100 hay que restar 7, de la cifra que se obtiene otra vez restar 7, y seguir así hasta haber restado 5 veces 7 (al paciente encefalópata se le olvida cuál era exactamente el ejercicio cuando llega a la cifra 93 u 86). Aun utilizando esta exploración sistemática, no se diagnostican todos los pacientes con una EH de grado 1, por lo que se requieren otras herramientas diagnósticas.
Diagnóstico neuropsicológico
La prueba de conexión numérica (Number Connection Test) es una de las pruebas psicométricas más utilizadas, sencilla y de menor costo para el diagnóstico de la EH.4 En esta prueba los pacientes deben conectar lo más rápidamente posible los números impresos en el papel, sucesivamente del 1 al 25. La puntuación de la prueba es el tiempo que necesita el paciente para realizarla, incluyendo el tiempo necesario para corregir todos los errores. Una puntuación baja significa una buena ejecución. Sin embargo, la interpretación de este resultado no es tan fácil como parece. Un punto de corte de 30 segundos, como se sugiere en el índice de encefalopatía portosistémica,5 pudiera no ser adecuado, ya que el resultado de la prueba depende también de la edad del paciente y su nivel de educación.6 De ahí la necesidad de corrección de los valores de normalidad según la edad. Aun así, 44% de pacientes con una EH de grado 1 obtiene un resultado normal en la prueba de la conexión numérica.6
Diagnóstico electrofisiológico
El electroencefalograma (EEG) es el método diagnóstico más objetivo para la detección de la EH. Se organiza en 5 grados expresados con letras donde A es normal y E es coma, igual que la clasificación clínica.7 Aunque en menor grado que en la clasificación clínica, en la electrofisiológica también existe una variabilidad inter e intraobservador. Un método electrofisiológico más objetivo para la detección y clasificación de la EH es el análisis espectral del EEG. Es un método computarizado que analiza la distribución de las frecuencias presentes en el EEG del paciente. En un EEG normal predominan las frecuencias alfa (de 8.0 a 13.0 hertzios). El diagnóstico de la EH se establece con la presencia de más de 35% de frecuencia theta (lentificación progresiva fronto-parieto-occipital) en el EEG.8
Técnicas de imagen
La utilización de un estudio de tomografía computada (TC) con medio de contraste se emplea frecuentemente al inicio de la evaluación del paciente hepatópata y tiene como propósito poder descartar en el diagnóstico diferencial condiciones como presencia de hemorragia o un absceso cerebral. Las técnicas de imagen no han sido establecidas como pruebas de rutina en el diagnóstico de la EH, excepto para hacer diagnóstico diferencial.9 La tomografía por emisión de positrones (PET-scan) es una técnica cuantitativa que genera imágenes de procesos biológicos y fisiológicos. Los estudios con tomografía por emisión de positrones soportan la hipótesis de los cambios en los neurotransmisores y en la función anormal de los astrocitos observada en la EH.
Algunos estudios han evaluado el metabolismo de la glucosa cerebral con fluorodeoxiglucosa en pacientes con cirrosis hepática y han mostrado una reducción en la captación de fluorodeoxiglucosa en la región frontal, parietal y en áreas corticales interhemisféricas y un incremento en la captación en áreas temporales inferomediales, del cerebelo y tálamo posterior. Este hipometabolismo frontal está asociado con alteraciones para realizar las pruebas neuropsicológicas.10 La resonancia magnética nuclear (RMN), puede ser usada para detectar la presencia de atrofia cerebral. En imágenes de T1 se demuestran áreas hiperintensas en los ganglios basales, mientras que en otros estudios se demuestran imágenes hiperintensas en el globus pallidus.11
Nivel de evidencia II, recomendación grado B
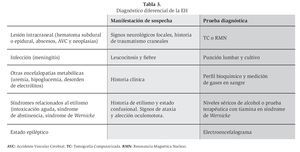
Diagnóstico diferencial de la encefalopatía hepática crónica
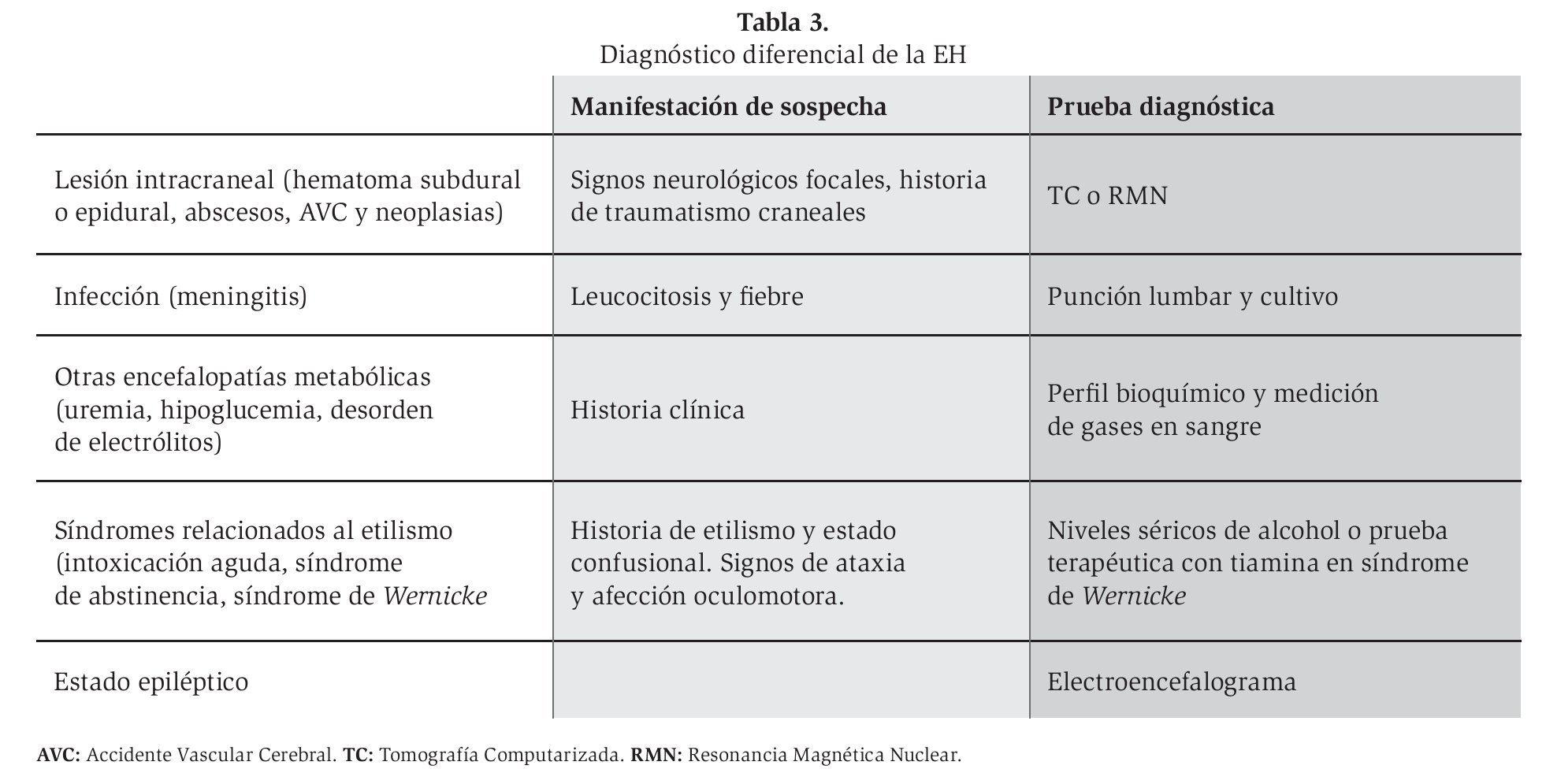
El diagnóstico diferencial debe realizarse con otra serie de procesos que cursan con un cuadro clínico similar como la intoxicación alcohólica aguda, el delirium tremens, el síndrome de Wernicke-Korsakoff, trastornos hidroelectrolíticos, el hematoma subdural, lesiones ocupantes de espacio intracraneales.12 Las principales enfermedades que se deben considerar en el diagnóstico diferencial de la EH crónica se muestran en la Tabla 3.
Nivel de evidencia II, recomendación grado B
¿Qué importancia tiene diagnosticar la encefalopatía hepática mínima (EHM)?
La EHM se caracteriza por alteraciones neurocognitivas relativamente leves y ocurre en una proporción sustancial de pacientes hepatópatas. Ésta se asocia con un compromiso importante en la calidad de vida, predice el inicio de encefalopatía hepática manifiesta y se asocia con un mal pronóstico.13,14 La identificación temprana y su tratamiento puede mejorar la calidad de vida y prevenir el inicio de una forma manifiesta de EH, pero a la fecha, hay poco acuerdo con respecto al método óptimo de su detección.15
Nivel de evidencia III, recomendación grado B
¿Cómo se hace el diagnóstico de la encefalopatía hepática mínima (EHM)?
El panel de Viena,16 recomendó el uso de al menos dos de los siguientes instrumentos para el diagnóstico de EHM:
Prueba de conexión numérica A o B,
Prueba de diseño de bloques o de símbolos y dígitos.
Los cambios en el EEG no son específicos de la EH, por lo que el panel sugirió que el EEG pudiera ser útil como un suplemento de las pruebas psicométricas. Existe la necesidad de desarrollar métodos de evaluación sensibles y específicos que midan esta variedad de EH y es un área de investigación activa en la encefalopatía hepática. Se han propuesto pruebas que miden la integridad funcional de vías neurológicas como la llamada frecuencia crítica de centelleo (critical flicker frequency).17 La principal dificultad en la validación de las pruebas neuropsicológicas o neurofisiológicas o ambas, ha sido la falta de una definición precisa de lo que constituye la prueba patrón para la EH mínima. En su ausencia, la sensibilidad y especificidad de estas pruebas no puede ser determinada. Recientemente la InternationalSociety on Hepatic Encephalopathy and Nitrogen Metabolism convocó a un grupo de expertos con el propósito de revisar la información disponible y hacer recomendaciones para el abordaje estandarizado de la evaluación neuropsicológica de los pacientes hepatópatas en riesgo de tener EHM.18
En esta reunión se definió la característica de las pruebas para poder considerarlas como una prueba patrón (o "estándar de oro"). Se consideró como altamente deseable que tuviera lo siguiente:
Una batería de pruebas debe ser identificada de manera específica para este propósito y servir como un referente, contra el cual se compara un método o abordaje experimental nuevo.
Esta prueba debe medir múltiples dominios de la capacidad cognitiva de un individuo.
Esta prueba debe ser fácilmente traducida y poderse aplicar en diferentes culturas.
La prueba propuesta debe tener un ajuste o norma de acuerdo a la edad.
Las únicas pruebas recomendadas fueron la denominada PSE-Syndrom-Test19 y la Repeatable Battery for the Assessment of Neuropsychological StatusTM (RBANS).20 Esta área del conocimiento está cambiando rápidamente y deberemos esperar que se establezca un referente para adaptarlo en nuestra práctica diaria.
Nivel de evidencia II, recomendación grado C
¿Cuál es la utilidad de la determinación de amonio arterial o venoso en los pacientes con encefalopatía hepática crónica?
El amonio es producto del metabolismo de las proteínas y se depura primariamente a través de la síntesis de urea en el hígado. En la enfermedad hepática, el aumento de NH3 es un signo típico de lesión hepática. La determinación del amonio es más útil en pacientes con insuficiencia hepática aguda, fundamentalmente en la insuficiencia hepática fulminante, no así en la insuficiencia hepática crónica excepto en estudios de investigación. Pueden observarse concentraciones altas en los casos de deficiencias de enzimas del ciclo de la urea,21 síndrome de Reye,22 en la encefalopatía hepática aguda o crónica23,24 y degeneración aguda grasa del embarazo25 Los incrementos plasmáticos leves de NH3 se observan en pacientes con hepatitis crónica y tienen relación con la extensión de la enfermedad.26 Es controvertido el uso de NH4 para monitoreo de los pacientes con EH; algunos estudios han mostrado una buena correlación entre las concentraciones de amonio y el grado de encefalopatía,22,24 mientras que otros lo han negado.27
Nivel de evidencia II, recomendación grado B