Los pacientes con falla intestinal son incapaces de mantener una adecuada nutrición e hidratación debido a una reducción en el área intestinal funcional. La implementación de diferentes estrategias tiene el potencial de beneficiar a estos pacientes en términos de favorecer la autonomía intestinal, aumentar la calidad de vida y elevar la supervivencia.
ObjetivosDescribir las características clínicas de niños con falla intestinal, así como la evolución en términos de autonomía intestinal y supervivencia.
Materiales y métodosEstudio retrospectivo en el que se evaluó a 33 pacientes pediátricos con falla intestinal, hospitalizados entre diciembre del 2005 y diciembre del 2013 en una institución de alta especialidad. Se describieron las características de los pacientes al ingreso hospitalario, se estimó la probabilidad de lograr la autonomía intestinal y se calculó la tasa de supervivencia.
ResultadosLa mediana de edad al momento de ingresar al hospital fue 2 meses (rango intercuartílico [RIC]: 1-4 meses) y el 54.5% de los pacientes fueron de sexo masculino. El 69.7% de los casos lograron la autonomía intestinal con una mediana de tiempo de 148 días (RIC: 63-431 días), la cual disminuyó a 63 días cuando los pacientes tenían presencia de válvula ileocecal. La supervivencia fue del 91% durante una mediana se seguimiento de 281días (RIC: 161-772 días).
ConclusionesEl manejo médico de los pacientes con falla intestinal es complejo. El soporte nutricional y la monitorización continua son de vital importancia y la morbimortalidad a largo plazo depende del reconocimiento y manejo precoz de las complicaciones asociadas.
Patients with intestinal failure are unable to maintain adequate nutrition and hydration due to a reduction in the functional area of the intestine. Different strategies have the potential to benefit these patients by promoting intestinal autonomy, enhancing quality of life, and increasing survival.
AimsTo describe the clinical characteristics of children with intestinal failure and disease progression in terms of intestinal autonomy and survival.
Materials and methodsA retrospective study was conducted, evaluating 33 pediatric patients with intestinal failure that were hospitalized within the time frame of December 2005 and December 2013 at a tertiary care referral center. Patient characteristics were described upon hospital admission, estimating the probability of achieving intestinal autonomy and calculating the survival rate.
ResultsPatient median age upon hospital admission was 2 months (interquartile range [IQR]: 1-4 months) and 54.5% of the patients were boys. Intestinal autonomy was achieved in 69.7% of the cases with a median time of 148 days (IQR: 63 - 431 days), which decreased to 63 days in patients with a spared ileocecal valve. Survival was 91% during a median follow-up of 281 days (IQR: 161 - 772 days).
ConclusionsMedical management of patients with intestinal failure is complex. Nutritional support and continuous monitoring are of the utmost importance and long-term morbidity and mortality depends on the early recognition and management of the associated complications.
La falla intestinal en pediatría se puede definir como la reducción de la masa intestinal por debajo de las necesidades mínimas para mantener una adecuada digestión y absorción de nutrientes y fluidos requeridos para el crecimiento1,2.
Un número de enfermedades se reconocen como responsables de esta entidad, siendo la más común el síndrome de intestino corto (SIC) pero también se describen anormalidades estructurales del enterocito, alteraciones inflamatorias, alergias alimentarias graves, enteropatías autoinmunes y desórdenes severos de la motilidad intestinal3.
Para lograr una adecuada absorción de nutrientes y crecimiento se debe llevar a cabo un proceso de adaptación intestinal, el cual dependerá de la extensión, la funcionalidad y la motilidad del intestino remanente. El curso clínico de estos pacientes para lograr la adaptación intestinal es largo y complejo, el tiempo máximo de adaptación intestinal estimado en adultos es de 2 años, pero en niños puede durar hasta más de 3 años4,5.
El tratamiento de estos niños se basa en el suministro de una nutrición adecuada: nutrición parenteral total (NPT) más nutrición enteral (NE) cuando sea posible y así promover la adaptación intestinal. También se requiere prevenir y/o tratar las complicaciones derivadas de su enfermedad de base o secundarias al uso de NPT prolongada6.
La existencia de programas multidisciplinarios enfocados en el tratamiento integral de estos pacientes ha modificado en forma dramática la supervivencia de estos niños en las últimas décadas7-9. El cuidado de estos pacientes en nuestra institución está guiado por un grupo de profesionales bajo un protocolo con posibilidad de individualizarse según cada caso en particular y que ha ido evolucionando a la luz de la nueva evidencia.
El objetivo de este estudio fue describir las características clínicas, así como la evolución en términos de autonomía intestinal y supervivencia, de un grupo de pacientes pediátricos con falla intestinal tratados en un centro de referencia de tercer nivel.
Población y métodosSe realizó un estudio retrospectivo con 33 pacientes pediátricos hospitalizados entre diciembre del 2005 y diciembre del 2013 en el Hospital Pablo Tobón Uribe, una institución de alta especialidad, centro de rehabilitación y trasplante intestinal, ubicado en la ciudad de Medellín, Colombia.
Se incluyó a todos los pacientes menores de 18 años evaluados por el grupo de soporte nutricional pediátrico del hospital con falla intestinal y uso de NPT. No hubo lugar a exclusiones.
Se estimó la probabilidad de los pacientes de lograr autonomía intestinal, definida como la capacidad de desarrollar cambios estructurales y fisiológicos después de la resección intestinal, lo cual se refleja al suspender la nutrición parenteral, tolerar el 100% de requerimientos nutricionales vía enteral y mantener un crecimiento según lo esperado10.
Toda la información fue capturada de las historias clínicas de los pacientes, por lo que no fue necesario el consentimiento informado de las familias. Previo a la recolección, se aplicó una prueba piloto a una muestra aleatoria simple del 10% de la población inicial, con lo que se probó y ajustó el proceso y el instrumento de recolección de información.
Análisis estadísticoLas variables cualitativas se presentan con frecuencias simples y porcentajes. Todas las variables cuantitativas se presentan con la mediana y el rango intercuartílico (RIC), las cuales mostraron distribución no normal a través de la prueba Shapiro-Wilk.
Para estimar la probabilidad de lograr la autonomía intestinal en el tiempo de tratamiento, se usó el método Kaplan-Meier y para realizar comparaciones se utilizó el log-rank test. El evento fue lograr la autonomía intestinal y los casos censurados fueron los fallecimientos, trasplantes o pérdidas de seguimiento.
En todos los casos se tuvo en cuenta un nivel de significación estadística cuando el valor de p era < 0.05. Se utilizó el programa estadístico SPSS para Windows versión 19.0.
ResultadosSe incluyó a 33 niños, de los cuales el 54.5% fue de sexo masculino. Hubo predominio de niños menores de 2 años, quienes representaron el 75.8% de la población de estudio. El 18.2% llegó al hospital en el periodo neonatal y un 6% a una edad mayor de 2 años. La mediana de edad en el momento de ingresar al hospital fue 2 meses (RIC: 1-4 meses). La mediana de seguimiento hospitalario y ambulatorio de estos pacientes fue 281 días (RIC: 161-772 días).
La mayoría de los pacientes fueron sometidos a resección intestinal el primer mes de vida (84.8%), siendo las 5 primeras causas: atresia intestinal (30.3%), enterocolitis necrosante (ECN) (24.2%), atresia intestinal más gastrosquisis (12.1%), invaginación intestinal (12.1%) y vólvulos o malrotación (9.1%).
Debido a que algunos pacientes venían remitidos de otras instituciones, la clasificación del grado de resecciones estuvo disponible en 26 de los pacientes, de los cuales el 73.1% presentó resección intestinal grande (intestino residual entre 40 y 100cm), el 19.2% resección masiva (intestino residual menor de 40cm) y el 7.7% síndrome de intestino ultracorto (intestino residual menor de 15cm). Los 33 pacientes quedaron con presencia de colon después de la resección y 8 (24.2%) con válvula ileocecal (tabla 1).
Características iniciales de la población de estudio
| Población total | |
|---|---|
| n = 33 | |
| Edad en meses al llegar a la institución, mediana (RIC) | 2 (1-4) |
| Sexo, n (%) | |
| Femenino | 15 (45.5) |
| Masculino | 18 (54.5) |
| Edad de resección, n (%) | |
| Primer mes de vida | 28 (84.8) |
| Entre el mes y el primer año de vida | 3 (9.1) |
| Entre el primer año de vida y los 5 años | 1 (3.0) |
| Después de los 10 años de vida | 1 (3.0) |
| Grado de resección intestinal, n (%) | |
| Grande (intestino residual entre 40 y 100cm) | 19 (57.6) |
| Masiva (intestino residual menor de 40cm) | 5 (15.2) |
| Síndrome de intestino ultracorto (intestino residual menor de 15cm) | 2 (6.1) |
| Sin dato | 7 (21.2) |
| Causa de resección, n (%) | |
| Atresia intestinal | 10 (30.3) |
| Enterocolitis necrosante | 8 (24.2) |
| Invaginación intestinal | 4 (12.1) |
| Atresia intestinal y gastroquisis/enfermedad Hirschsprung | 4 (12.1) |
| Vólvulos y malrotación | 3 (9.1) |
| Trastorno de la motilidad | 2 (6.1) |
| Enfermedad Hirschsprung | 1 (3.0) |
| Gastrosquisis | 1 (3.0) |
| Intestino residual, cm, mediana (RIC) | 60 (35-95) |
| Presencia de válvula ileocecal | 8 (24.2) |
| Presencia de colon | 33 (100) |
El tipo de soporte predominante durante el tratamiento en el hospital fue el mixto (NPT y NE) en el 75.8% de los casos, seguido por NPT más vía oral (12.1%), NPT exclusiva (6.1%), NE exclusiva (3.0%) y vía oral exclusiva (3.0%). Se debe aclarar que los casos que recibieron NE o vía oral exclusiva venían remitidos de otra institución en la cual recibieron NPT de forma prolongada.
Nutrición enteral o vía oralTreinta y un pacientes recibieron en el hospital, alimentación a través del tracto gastrointestinal, sea por vía oral o enteral. El inicio de esta vía de alimentación fue en 61.3% de los pacientes a través de sonda e infusión continua y en el resto fue por vía oral. La fórmula utilizada para dar inicio en la institución fue sobre la base de aminoácidos libres en 67.7% de los pacientes, con fórmula extensamente hidrolizada (FEH) en el 19.3% y con fórmula polimérica en el 12.9%. El 48.4% de los pacientes presentaron intolerancia a la primera fórmula suministrada en la institución pero esto parece no relacionarse con el tipo de administración (intolerancia en infusión continua: 47.4%, vía oral: 50%).
Nutrición parenteralTreinta y uno de los 33 pacientes recibieron NPT durante su estancia en el hospital, los 2 restantes, aunque tuvieron NPT en algún momento de su enfermedad, esta fue suspendida antes de la remisión al hospital. La mediana de duración de la NPT en nuestra institución fue de 68 días (RIC: 21-138 días). El periodo de ciclado de la NPT fue de 2 a 12 h de acuerdo con las condiciones del paciente, lográndose realizar en 8 casos.
En 3 pacientes se dio manejo con nutrición parenteral ambulatoria.
Evolución de falla intestinalDurante la mediana de seguimiento de 281 días (RIC: 161-772 días), el 69.7% de los pacientes lograron autonomía intestinal, el 15.1% egresó del hospital sin aun haber logrado la autonomía y el 9.1% falleció durante el proceso a causa de shock séptico (2 casos) y obstrucción intestinal con deterioro de condición (un caso). En el transcurso del tratamiento, el equipo multidisciplinario también determinó que 2 pacientes (6.1%) fueran llevados a trasplante intestinal (véase tabla 2).
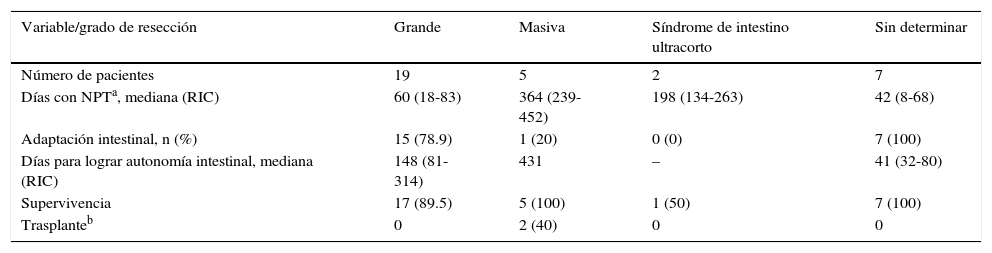
Evolución según grado de resección intestinal
| Variable/grado de resección | Grande | Masiva | Síndrome de intestino ultracorto | Sin determinar |
|---|---|---|---|---|
| Número de pacientes | 19 | 5 | 2 | 7 |
| Días con NPTa, mediana (RIC) | 60 (18-83) | 364 (239-452) | 198 (134-263) | 42 (8-68) |
| Adaptación intestinal, n (%) | 15 (78.9) | 1 (20) | 0 (0) | 7 (100) |
| Días para lograr autonomía intestinal, mediana (RIC) | 148 (81-314) | 431 | – | 41 (32-80) |
| Supervivencia | 17 (89.5) | 5 (100) | 1 (50) | 7 (100) |
| Trasplanteb | 0 | 2 (40) | 0 | 0 |
NPT: nutrición parenteral total; RIC: rango intercuartílico.
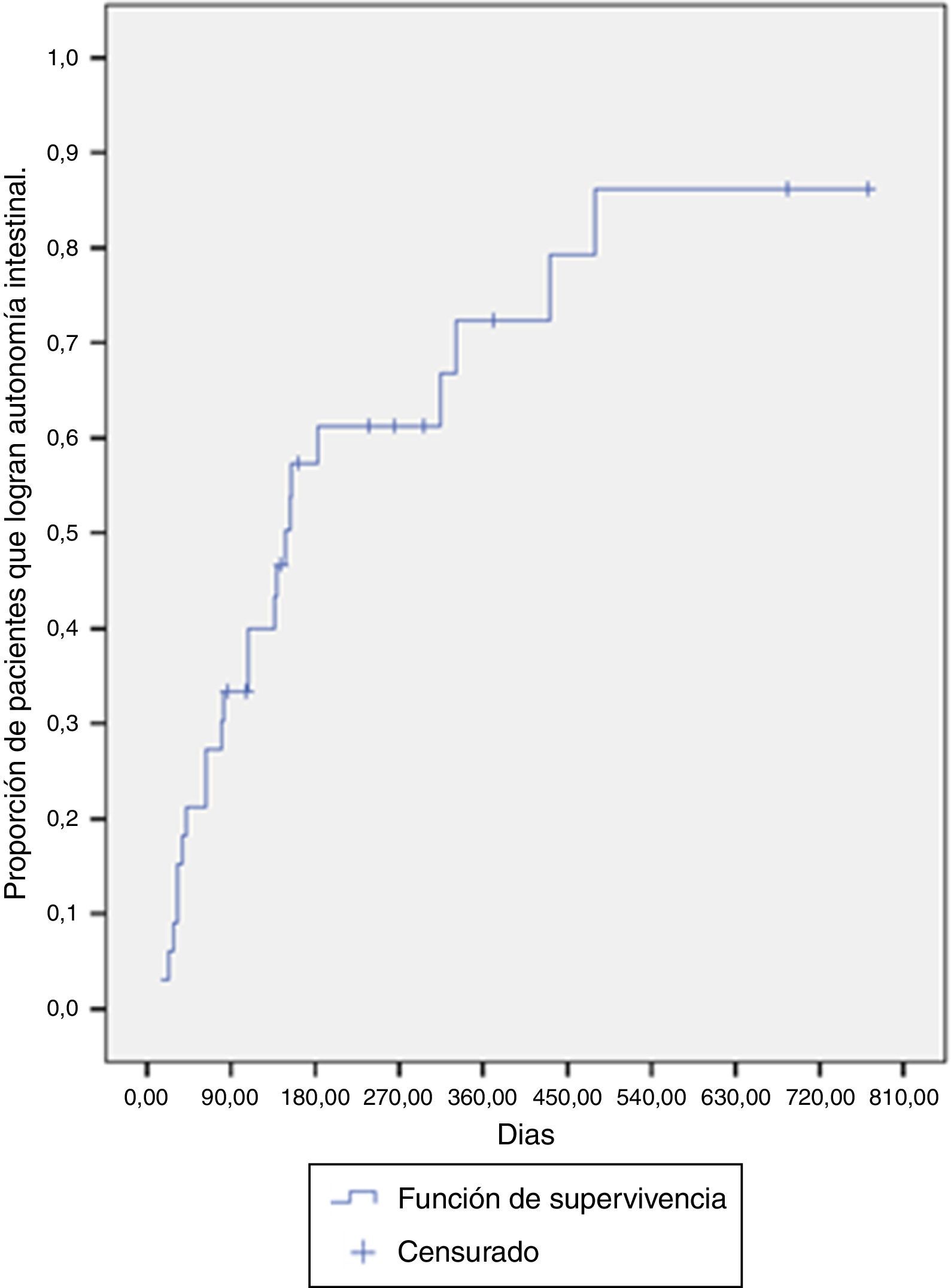
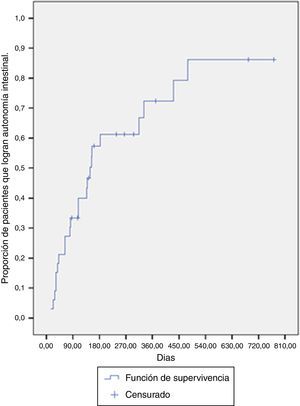
La mediana de tiempo para lograr la autonomía intestinal fue de 148 días (RIC: 63-431 días). A los 6 meses de tratamiento, la probabilidad de lograr autonomía fue del 61.2%, y para el año de tratamiento está era cercana al 72.3% (fig. 1).
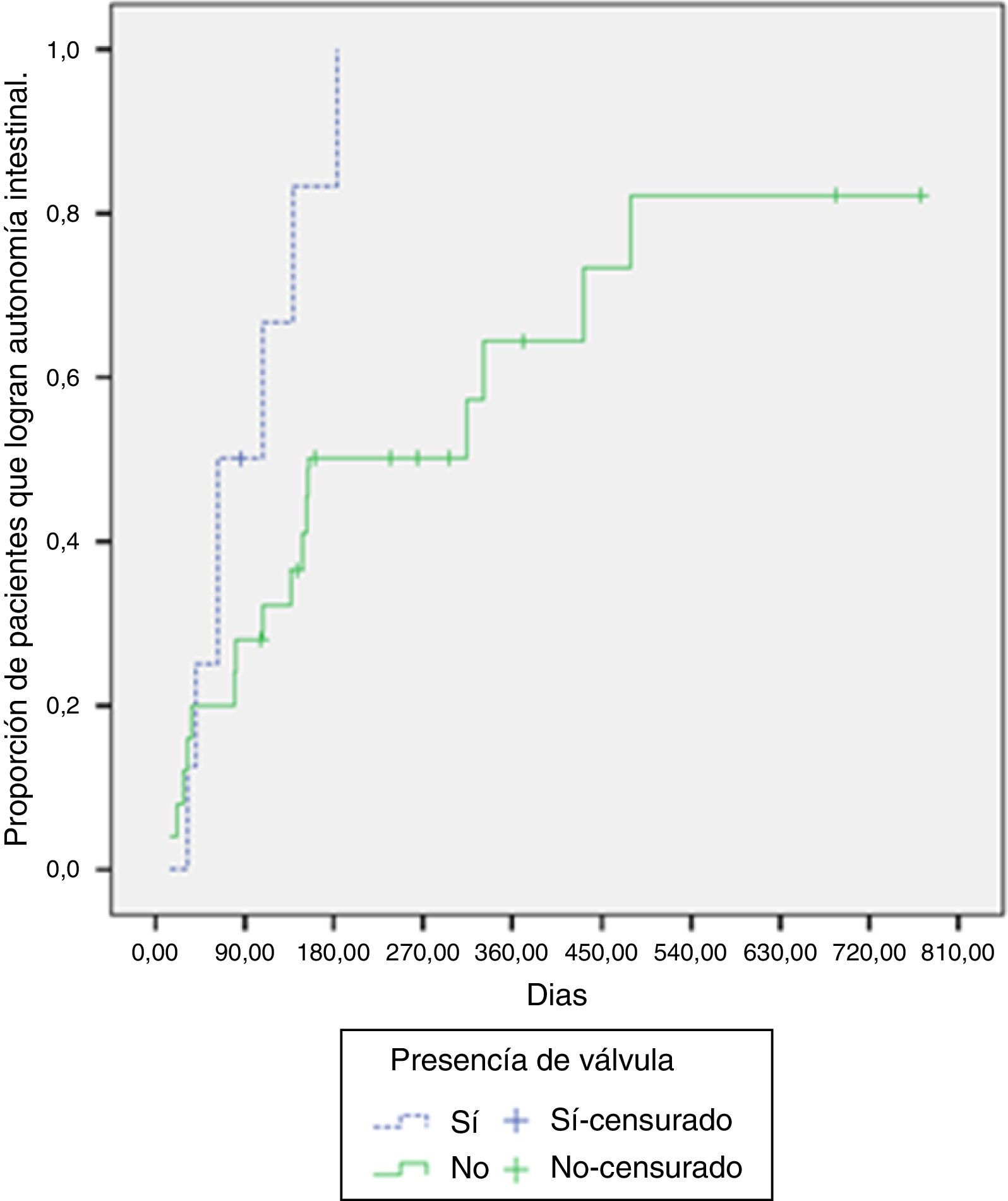
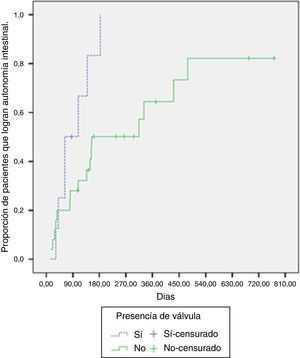
De los pacientes con presencia de válvula ileocecal, el 87.5% logró la adaptación intestinal, mientras que el 64% la logró en los pacientes sin válvula. La mediana de tiempo requerido para la adaptación en los pacientes con válvula fue de 63 días (RIC: 41-139 días), comparado con 154 días (RIC: 81-479 días) en los pacientes sin esta. Al contrastar la probabilidad de adaptación según la presencia o no de válvula ileocecal, se hallaron diferencias significativas (log-rank test, p=0.029) (fig. 2).
Se comparó la probabilidad de adaptación según el tipo de administración inicial de la NE(infusión continua vs. vía oral), sin encontrar diferencias significativas (log-rank test, p=0.68).
DiscusiónEl manejo de los pacientes con falla intestinal es complejo, necesita de personal de distintas especialidades, altamente calificado y que forme parte de un programa de rehabilitación intestinal, para así alcanzar el objetivo principal, que es lograr la autonomía enteral. Debido a los avances en los últimos años en el diagnóstico y el tratamiento de los casos con falla intestinal, se ha mejorado la supervivencia de estos niños. Sin embargo, el manejo óptimo de estos pacientes es conseguir no solo la rehabilitación intestinal, sino también una mayor calidad de vida11.
Si bien los resultados de este estudio muestran que las principales causas de falla intestinal en nuestra población están en concordancia con estudios en Europa y Estados Unidos12-14, llama la atención que las 2 primeras causas en un estudio francés fueron gastrosquisis y vólvulos13, y en Estados Unidos fueron ECN y gastrosquisis12,14, mientras que en nuestra población fueron la atresia intestinal y la ECN. Esto pudiera estar relacionado con diferencias regionales en cuanto a susceptibilidad genética, posibilidad de acceso temprano a centros hospitalarios con unidades de cuidados neonatales y diferencias en el sistema de salud en países sudamericanos comparados con los europeos y americanos.
El protocolo de trabajo del Hospital Pablo Tobón Uribe incluye estimular la adaptación por medio de NE, iniciando con infusión continua y progresando a bolos y vía oral. Uno de los tópicos que aún es debatido por los clínicos en el soporte nutricional de niños con falla intestinal es el modo de administración de la nutrición (continua o bolos) y la composición de la fórmula (polimérica, elemental o semielemental)11,15. Algunos autores han demostrado que la administración en infusión continua podría aumentar el porcentaje de absorción de lípidos, proteínas y energía comparada con la administración por bolos al maximizar la saturación de las proteínas transportadoras15,16. En nuestra experiencia, la NE por infusión continua se utilizó inicialmente en un poco más de la mitad de los pacientes (61.3%), en el otro 38.7% se inició alimentación por vía oral debido a que ingresaron con este esquema de alimentación y sin antecedente previo de intolerancia. Al comparar la probabilidad de autonomía intestinal según la forma inicial de administración no se encontraron diferencias.
Con respecto a la fórmula ideal para iniciar la alimentación enteral, se ha descrito, en modelos animales con SIC17 y en reportes de casos en humanos18, mejor tolerancia con el uso de fórmulas de aminoácidos libres. Sin embargo, otros estudios no evidencian diferencias en la absorción de proteínas, permeabilidad y adaptación intestinal al utilizar una FEH o una fórmula de proteína entera15,19. En nuestra serie de pacientes se utilizaron, en el 67.7% de los casos, fórmulas sobre la base de aminoácidos libres, ya fuera por indicación del gastroenterólogo o por antecedente de intolerancia a las FEH y/o leche materna.
En cuanto al uso de NPT, la mediana de duración en nuestra institución fue 68 días (RIC: 21-138 días), en tanto la literatura americana y europea reportan una mediana de duración de 229 días (RIC: 129-408 días) en un grupo de pacientes de Boston7 y de 292 días (RIC: 146-438 días) en un estudio finlandés20. Se debe aclarar que este estudio no logró cuantificar los días previos de NPT antes de su remisión a nuestro hospital, por lo que el tiempo de NPT de estos pacientes podría esperarse que sea realmente superior al reportado.
Teniendo en cuenta que la estancia hospitalaria prolongada puede afectar al desarrollo psicomotor y la calidad de vida, la NPT ambulatoria debe considerarse tan pronto como sea posible en niños con falla intestinal severa13. Del total de pacientes que recibieron NPT, el 9.7% se manejó de forma ambulatoria, cifra menor a la reportada por los franceses que utilizaron esta estrategia en el 40.7% de sus pacientes13; esto resalta la necesidad local de mejorar los programas de salud en casa y nutrición parenteral domiciliaria.
La autonomía enteral sigue siendo el objetivo fundamental de programas de rehabilitación intestinal. Según una revisión sistemática del 2013, el porcentaje de pacientes que logran autonomía oscila entre el 42 y el 84% a través de los distintos programas de rehabilitación, durante un seguimiento de 12 a 50 meses9. Este estudio muestra que el 69.7% de los pacientes lograron la autonomía intestinal, porcentaje que se encuentra en concordancia con lo reportado en la revisión sistemática y en estudios más recientes, como el de Demehri et al., en 2015, que reporta autonomía intestinal en el 64.3% de los pacientes14.
La mediana de tiempo para lograr la autonomía intestinal fue de 148 días, algunos estudios muestran una mediana de 7621 y 117 días22, indicando que es variable y depende de factores anatómicos, de la función del intestino remanente y de las complicaciones que se presenten en la evolución23. Por ejemplo, la presencia de válvula ileocecal mostró ser en nuestro estudio, un factor que contribuye a lograr la autonomía intestinal (log-rank test, p=0.029). Un estudio canadiense muestra cómo la presencia de válvula ileocecal fue un predictor significativo para el tiempo de adaptación en el análisis univariado y, aunque no fue incluido en el modelo multivariado final, esta variable ha demostrado ser un importante predictor del resultado de varios modelos de adaptación intestinal14,24,25.
La supervivencia fue del 91% entre 33 pacientes seguidos durante una mediana de 9 meses, lo cual se encuentra en concordancia con porcentajes reportados en otros estudios con tamaños de cohorte pequeños que señalan supervivencias del 89% (48/54)7 e incluso del 100% (31/31) cuando se aplican protocolos de atención estandarizados22. Otros estudios con seguimientos más prolongados reportan tasas de supervivencia del 85%14 y de hasta un 71% en una cohorte de 114 pacientes seguidos por una mediana de 7 años13. Una revisión sistemática publicada en 2013 señala que, entre los diversos programas multidisciplinarios, la mortalidad varía entre el 6.4 y el 37.5%, y la amplia gama de la mortalidad puede en parte explicarse por diferencias en las características basales de los pacientes. Por ejemplo, los programas que informan tasas altas de mortalidad tienden a ser centros de referencia terciarios para grandes áreas geográficas que plantean la posibilidad de un sesgo en los resultados9. La revisión sistemática también señala que la causa de la muerte ha sido uniforme en todos los programas9, siendo la primera causa la sepsis, situación que concuerda con el principal motivo de muerte de nuestros pacientes.
Aunque el seguimiento después del trasplante intestinal no fue objeto de este estudio, cabe mencionar que los 2 pacientes sometidos a trasplante fallecieron a los 42 y 240 días posteriores al trasplante, respectivamente. Las muertes fueron secundarias a paro cardiorrespiratorio durante una endoscopia de control y el otro paciente falleció por una sepsis por Klebsiella pneumoniae multirresistente.
Las limitaciones de este estudio son las propias de una investigación retrospectiva, que impidió tener el control deseado sobre la naturaleza y la calidad de mediciones. Información sobre días con NPT y manejo suministrado antes de la remisión a este hospital no se lograron recolectar de las fuentes secundarias.
En conclusión, el manejo de pacientes con insuficiencia intestinal es complejo y debe realizarse por un equipo multidisciplinario, como ha sido demostrado en la literatura, ya que mejora la supervivencia y la calidad de vida en estos pacientes7-9,22,23. En nuestro estudio, los pacientes con falla intestinal tratados por el grupo de soporte nutricional pediátrico obtuvieron una adaptación intestinal en el 69.7% de los casos y una supervivencia del 91%, cifras que son comparables con otros programas de rehabilitación intestinal. Representa un desafío para los diferentes especialistas involucrados, quienes deben orientar siempre su trabajo hacia el logro de la rehabilitación intestinal y la autonomía enteral. Según nuestros resultados, la remisión oportuna de dichos pacientes a un centro especializado está fuertemente recomendada e incide de manera positiva para que la mayoría de los pacientes logre una adecuada adaptación intestinal.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoNo se recibió patrocinio de ningún tipo para llevar a cabo este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.