¿ Introducción
El cáncer de páncreas es una entidad poco común, que se presenta frecuentemente como un cuadro de ictericia obstructiva indolora, pérdida de peso y en algunos casos como diabetes mellitus de reciente diagnóstico. El médico general, cirujano y gastroenterólogo deben de tener un alto índice de sospecha y estar familiarizados con la mejor forma de diagnosticar y tratar a las personas con esta enfermedad. Este artículo se enfocará en el adenocarcinoma ductal que representa la mayoría de los tumores malignos del páncreas y el término cáncer de páncreas (CP) será utilizado como sinónimo.
¿ Objetivo
Brindar un panorama completo y actual de esta enfermedad con un enfoque quirúrgico.
¿ Métodos
Se realizó una revisión crítica de la literatura médica, mediante la búsqueda en PubMed y Medline, bases de datos bibliográfica de ciencias e información biomédica compilada por la National Library of Medicine de los Estados Unidos de América, del año 2000 a la fecha, empleando las palabras clave "páncreas", "pancreatic, adenocarcinoma", "cáncer", "Whipple" y "pancreaticoduodenectomy" con franca preferencia por artículos publicados en el idioma inglés y de revistas con enfoque quirúrgico. El enfoque de la búsqueda incluyó información relevante y actual de revistas de alto impacto, aportada por autores reconocidos en algún rubro relacionado con el cáncer de páncreas. No fue el objetivo de esta revisión realizar una búsqueda sistematizada.
¿ Epidemiología
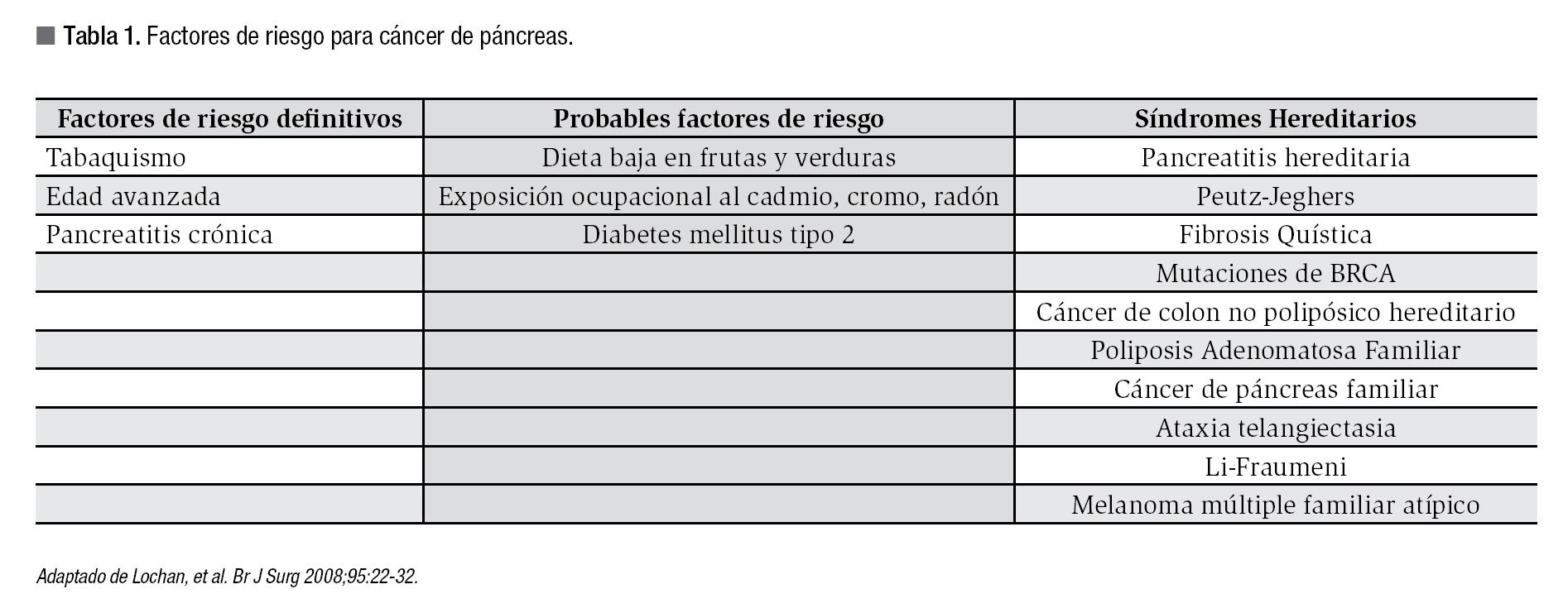
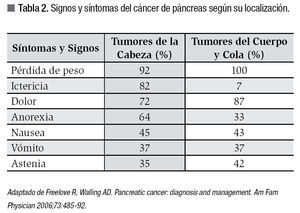
El adenocarcinoma ductal es la neoplasia maligna más común del páncreas, representando entre 80% a 90% de todos los tumores de la glándula. Aproximadamente 70% de los casos suceden en la cabeza del páncreas cuya afección provoca la sintomatología característica. En EE.UU el cáncer del páncreas representa la cuarta causa de muerte por cáncer. Alrededor de 35 mil casos se diagnostican cada año en ese país y 95% de estos muere en menos de cinco años a causa de esta enfermedad. Los factores de riesgo con clara asociación con el CP son la edad avanzada y el fumar tabaco, sin embargo estudios han mostrado asociación menos clara con pancreatitis crónica, la diabetes mellitus tipo 2 y exposición ocupacional a sustancias como el cadmio, radón o cromo. También existe un componente hereditario en alrededor de 10% de los casos de CP asociado a pancreatitis hereditaria, síndrome de Peutz-Jeghers, mutaciones del BRCA-1 y BRCA-2, cáncer colorrectal no polipósico y melanoma múltiple atípico familiar entre otros. Algunos estudios epidemiológicos sugieren cierta protección con la ingesta de dieta abundante en frutas y verduras, al parecer por su efecto antioxidante (Tabla 1).1,2
¿ Biología molecular
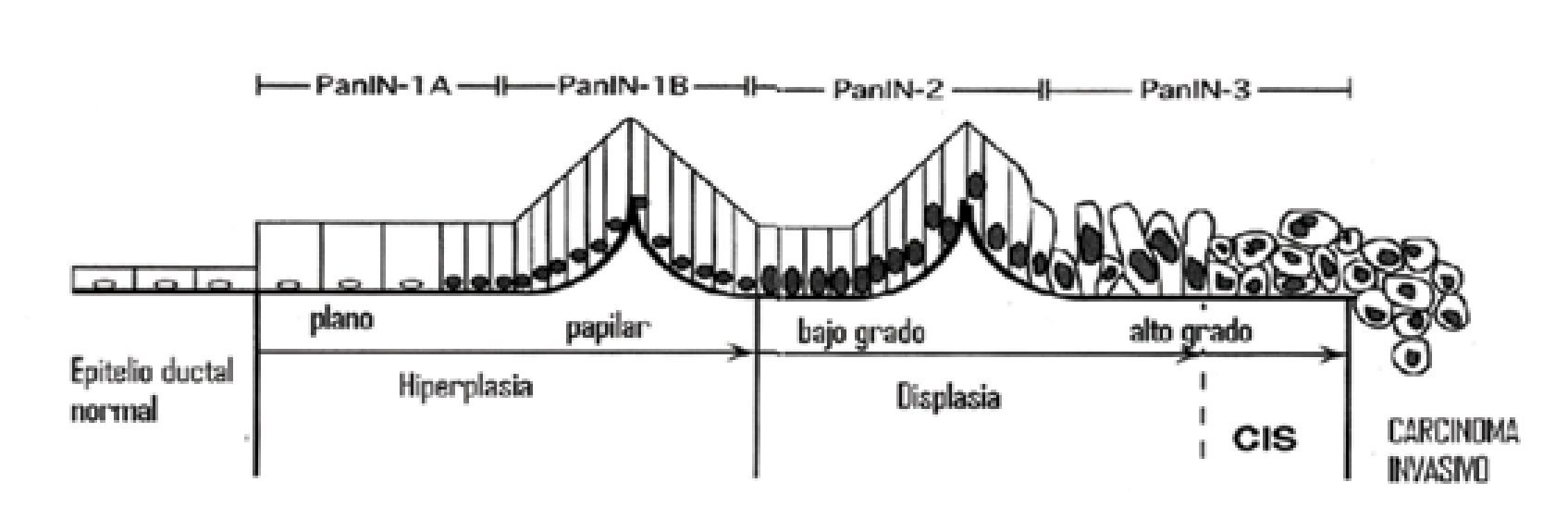
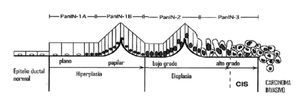
Como en otros tumores gastrointestinales, hay evidencia que en las células ductales del páncreas existe una serie de mutaciones que se presentan en sucesión para dar lugar al adenocarcinoma ductal. El modelo más aceptado y ampliamente difundido en los últimos años sugiere una secuencia gradual de mutaciones que provocan lesiones premalignas denominadas neoplasias pancreáticas intra-epiteliales (PanIN, por sus siglas en inglés) las cuales progresan desde células mínimamente displásicas (PanIN 1a y 1b), a lesiones con mayor displasia (PanIN 2 y 3) hasta convertirse en lesiones invasoras definitorias de cáncer.3 Algunos autores cuestionan el orden lineal de esta secuencia; sin embargo, no hay duda que varias de las mutaciones que se encuentran en el CP también se encuentran en lesiones PanIN (Figura 1).4
¿ Figura 1. Esquema de progresión a carcinoma de las neoplasias intraepiteliales pancreáticas (PanIN, por sus siglas en inglés).
Existen cuatro mutaciones relevantes en el desarrollo de esta neoplasia. Noventa por ciento de los pacientes presenta una mutación que ocasiona la sobre-activación del oncogén K-ras, el cual favorece la proliferación y la supervivencia celular. Esta mutación sucede de forma temprana. Noventa y cinco por ciento de los casos, presenta una pérdida de la función de la proteína p16, que regula la transición entre G1-S en el ciclo celular y por consiguiente favorece la proliferación celular al perderse su función. El segundo gen supresor de tumores que presenta pérdida de función de su proteína efectora en 75% de los casos es el TP53 ubicado en el cromosoma 17 hasta en 75% de los casos. La pérdida de la función de la proteína p53 debilita tanto la vigilancia del daño al ácido desoxirribonucléico (ADN) como una vía importante de apoptosis. La cuarta mutación más común que se presenta en alrededor de 55% de los casos involucra al gen supresor DPC4 (deleted in pancreatic cancer4, por sus siglas en inglés) y provoca señalización aberrante del receptor de superficie celular TGF-B.2,4-6 A pesar de que estas son las mutaciones más frecuentes, cada tumor tiene alrededor de 60 mutaciones potencialmente relevantes, lo cual hace muy difícil su estudio pero también es un campo fértil para posibles terapias moleculares en el futuro.2 Estudios recientes también sugieren que la relación entre las células epiteliales y las células estelares (miofibroblastos) juega un papel fundamental en la formación, progresión, invasión y propagación del CP.2,7
¿ Aspectos clínicos
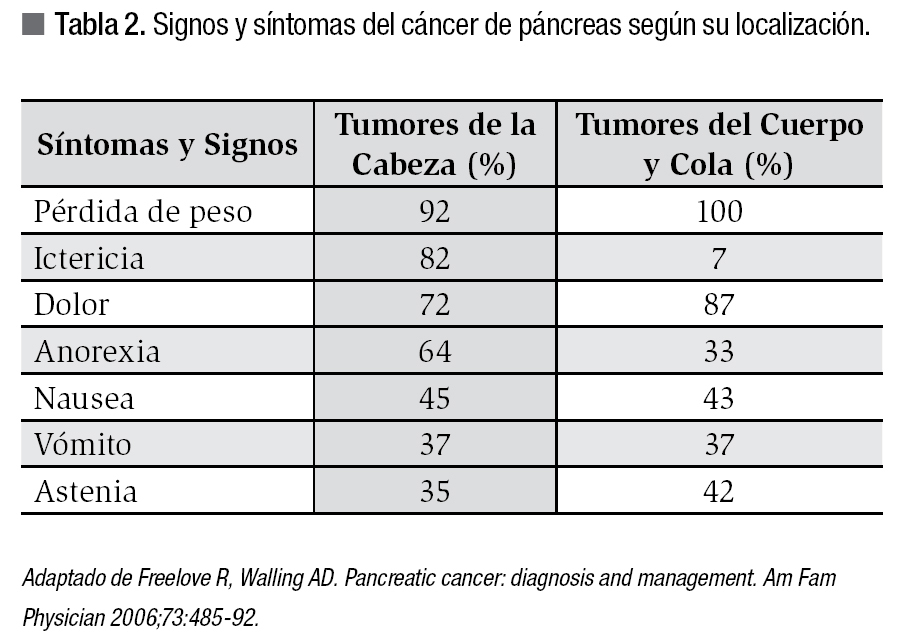
Al momento de solicitar atención médica, el cuadro clínico habitual del cáncer de cabeza de páncreas es de ictericia obstructiva y pérdida de peso; sin embargo, 20% a 30% de los tumores que se presentan en cuerpo y cola no obstruyen la vía biliar, por lo que al ser clínicamente silentes, presentan síntomas cuando la enfermedad es avanzada. La presencia del dolor que generalmente es sordo y localizado profundo en el epigastrio o espalda alta generalmente habla de enfermedad avanzada y está presente en hasta 70% de los pacientes. La ascitis es también indicador de enfermedad avanzada y suele ser secundaria a carcinomatosis peritoneal. El signo de Courvoisier (vesícula palpable no dolorosa) es muy específico de una obstrucción maligna distal entre ellas el CP pero con una sensibilidad menor a 55%. Otros síntomas menos comunes incluyen anorexia, vómito, nausea, tromboflebitis migratoria (síndrome de Trousseau), pancreatitis aguda, diabetes mellitus de diagnóstico reciente, esteatorrea y depresión (Tabla 2).2,8 Los exámenes de sangre son muy inespecíficos, pero con frecuencia existen alteraciones de las pruebas de funcionamiento hepático (hiperbilirrubinemia directa), anemia por enfermedad crónica o microcítica e hipocrómica, e hiperglicemia. El uso del antígeno CA 19-9 como marcador para el CP es el único que ha probado ser de utilidad clínica. Su especificidad y sensibilidad diagnóstica es de 80% y 70% respectivamente, por lo que no se utiliza con fines de diagnóstico. Alrededor de 10% de los pacientes con CP no elevan el antígeno debido a que carecen del antígeno de superficie de Lewis, de donde proviene el CA 19-9. Además, otras causas benignas de ictericia obstructiva también lo pueden elevar considerablemente.2,9 Su uso se limita entonces a pronóstico y seguimiento de pacientes posoperados o que reciben otro tipo de terapia (quimioterapia y radioterapia). Algunos estudios han demostrado que un valor preoperatorio elevado (más de 200 u/mL) en pacientes con enfermedad resecable, es un factor de mal pronóstico con sobrevida significativamente menor que aquellos resecados con valores más bajos.10,11 Por otro lado, en pacientes resecados con una disminución a parámetros normales del antígeno (<37 u/mL) en el posoperatorio tuvieron mayor sobrevida que en los que no se normalizó el antígeno, con relación directa al estadio de la enfermedad. Los pacientes en estadios más avanzados tenían menor posibilidad de normalización del CA19-9 después de la cirugía.9
¿ Diagnóstico multidisciplinario
La evaluación de pacientes con sospecha diagnóstica de CP debe enfocarse en el diagnóstico, estadiaje, valoración de resecabilidad y paliación de los síntomas. Para lograr esto de forma apropiada se requiere la interacción de cirujanos, gastroenterólogos, radiólogos y oncólogos entre otros. Se ha observado que el envío de los pacientes a centros especializados de alto volumen agiliza el diagnóstico y mejora la sobrevivencia, sobre todo en los casos que requieren cirugía.12
Estudios de imagen: Frecuentemente el ultrasonido es el estudio inicial en enfermedades hepato-pancreato-biliares. Es barato, seguro y está disponible en prácticamente todos los hospitales. Sin embargo, es operador-dependiente y tiene limitaciones para observar estructuras profundas por el aire intestinal. Es útil para ver dilatación intra y extra hepática de la vía biliar y para descartar enfermedad avanzada con lesiones hepáticas o ascitis. La tomografía computarizada (TC) es hoy en día, el estudio más solicitado para apoyar el diagnóstico, el estadio y la resecabilidad del CP; el cual es hipovascular, por lo que se puede observar como una masa hipodensa en comparación con el resto del parénquima pancreático en la fase arterial. En los pacientes en donde la tomografía trifásica con cortes finos del páncreas demuestra un tumor en la cabeza sin enfermedad extra-pancreática, sin involucro de la vena o de la arteria mesentérica o el tronco celiaco, es posible realizar la pancreáticoduodenectomía en 70% a 85% de los casos.13 La sensibilidad para detectar tumores pancreáticos es de hasta 100% en lesiones de más de 20 mm, pero desciende hasta 67% en lesiones menores a 15 mm, situación en la que el apoyo de otros estudios será muy valioso.14 La dilatación del conducto pancreático y del colédoco es un hallazgo común y está presente en 2/3 de los pacientes con tumores de la cabeza del páncreas. La especificidad y sensibilidad para detectar invasión vascular es de 94%. La dilatación de las venas peripancreaticas predicen enfermedad localmente avanzada en 100% de los casos.15 La tomografía no es un buen estudio para valorar metástasis hepáticas menores de 1 cm o ganglios.14 El ultrasonido transendoscópico (USTE) es muy buen complemento de la tomografía para buscar tumores menores a 2 cm, incluso puede detectar lesiones de 2 mm o 3 mm. Es el estudio más sensible para valorar involucro de los vasos y debe ser utilizado cuando queda duda de esto en la tomografía. Parece tener mejor sensibilidad que la tomografía para identificar metástasis ganglionares aunque es controversial. Es el estudio de elección para toma de biopsias pancreáticas, cuando estas se requieren, con una precisión de 95% para lesiones pancreáticas y 88% para ganglios.16 La resonancia magnética es útil en pacientes con insuficiencia renal que no toleran el contraste, para visualizar metástasis pequeñas en hígado y para valorar estructuras llenas de líquido como el conducto pancreático y los quistes. Sin embargo, es un estudio caro, tardado y que ofrece pocas ventajas en comparación con la tomografía, fuera de los casos mencionados. La colangio-pancreatografía retrograda endoscópica (CPRE) es útil cuando se requiere derivar la vía biliar o para realizar cepillado del conducto, sin embargo no debe ser utilizado como método puramente diagnóstico.2 En casos en los que se piensa realizar cirugía con intento curativo, derivar la vía biliar parece aumentar el riesgo de infecciones en el post-operatorio por lo que no se recomienda.17-19
Biopsia pancreática: Debido a que la biopsia negativa no descarta la presencia de tumor, no se recomienda de forma pre-operatoria en tumores que parecen resecables por imagen. Se debe de considerar la biopsia sólo cuando se necesite el diagnóstico histopatológico para tratamiento neoadyuvante o si hay un alta sospecha de una lesión diferente a adenocarcinoma ductal (ej. Linfoma o pancreatitis autoinmune) en cuyo caso la resección no es la primera línea de tratamiento. Cuando son necesarias las biopsias pre-operatorias se realizan por punción guiadas por TC, CPRE o USTE. La opción más empleada hoy en día es la biopsia por aspiración de aguja fina (BAAF), que supera en sensibilidad y especificidad a la biopsia directa, al tru-cut y al cepillado que se realiza por CPRE para el diagnóstico de malignidad. Incluso si al momento de la cirugía se encuentra enfermedad irresecable se debe de realizar BAAF, que resulta más sensible que la biopsia en cuña aunque se requiere de citopatólogos con experiencia.20 Sin embargo, para el diagnóstico de otras enfermedades en el diagnóstico diferencial como lo son el linfoma y la pancreatitis autoinmune las biopsias por tru-cut, si juegan un papel importante.21-25
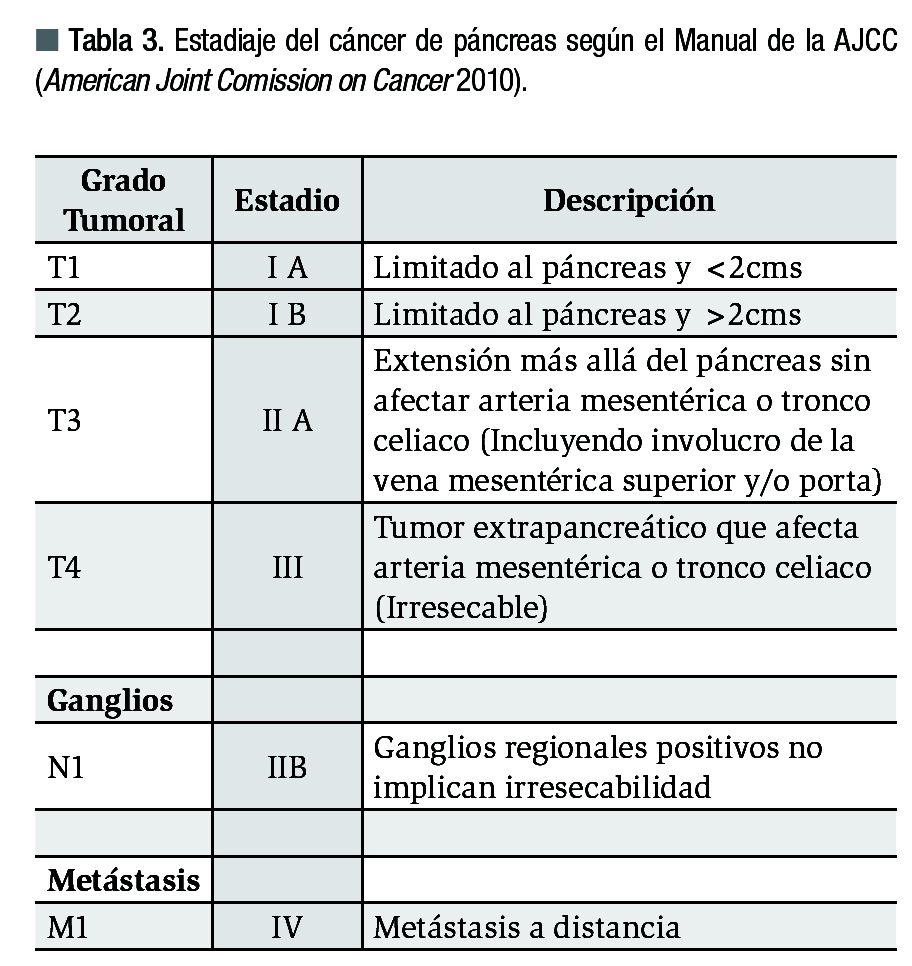
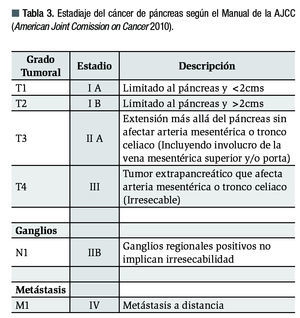
Estadiaje: Debe realizarse según el más reciente manual del American Joint Comitee on Cancer (AJCC) o clasificación tumor-nodes-metastasis (TNM). Los tumores localizados (hasta T3) son operables incluyendo los que involucran la vena mesentérica, mientras que los tumores T4 que se salen del páncreas o involucran arterias y los que tienen metástasis a distancia son inoperables. Cabe mencionar que los ganglios regionales positivos no implican irresecabilidad (Tabla 3).2
¿ Tratamiento
Ningún tratamiento aislado ofrece hoy en día una solución para el cáncer de páncreas. En un estudio poblacional muy grande la terapia multimodal que se utiliza en la mayoría de centros parece ofrecer ventaja sobre tratamientos únicos.26
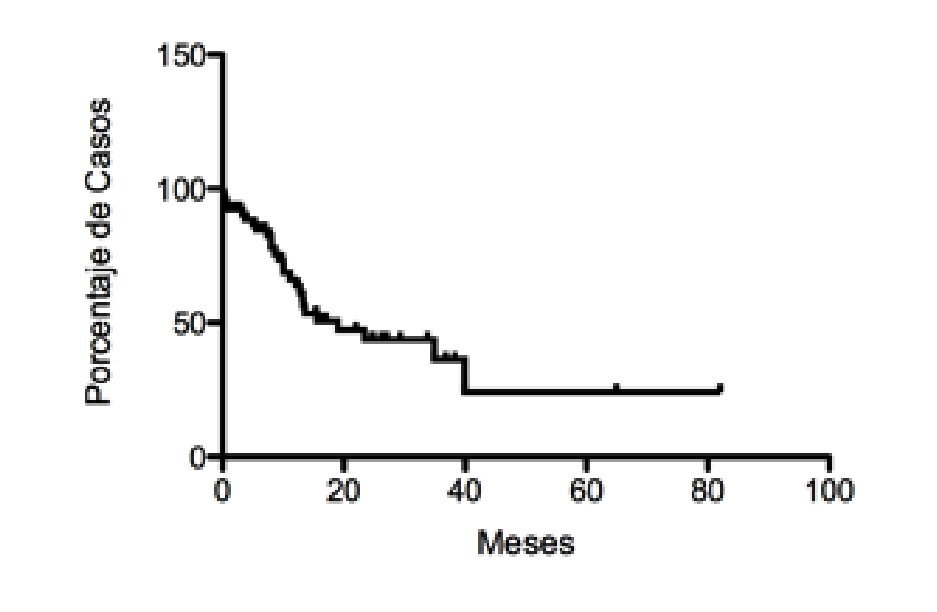
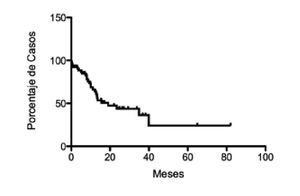
Tratamiento quirúrgico: Hoy en día, la cirugía es el único tratamiento que ofrece oportunidad de curación para el CP. Una vez descartada la presencia de metástasis y del involucro de la arteria mesentérica superior o del tronco celiaco por medio de tomografía u otros estudios preoperatorios, se piensa en cirugía con potencial curativo. Sólo 20% cumplen con dichos criterios y son los que claramente se benefician al ser referidos a un centro especializado.12,27,28 Incluso este 20% de pacientes con tumores resecables tiene una sobrevida muy pobre como demuestra la curva de Kaplan-Meyer de 67 pacientes con adenocarcinoma de páncreas resecados en el Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán (INCMNSZ) entre 2000 a 2010 (Figura 2).
¿ Figura 2. Supervivencia de pacientes con adenocarcinoma pancreático resecado en el INCMNSZ.
La laparoscopia diagnóstica se usa de forma rutinaria en algunos centros, ya se evidencian metástasis que no se ven ni en los tomógrafos más sensibles en 5% a 15% de los pacientes y de esa manera se evita una laparotomía innecesaria.29 La mayoría de expertos recomiendan su uso sólo en casos con alta sospecha de metástasis como en tumores mayores de 3 cm, tumores de cuerpo y cola, y en casos de CA19-9 mayor de 150 U/mL.30 El uso de ultrasonido laparoscópico puede hacer más útil este procedimiento aumentando la sensibilidad de la laparoscopia diagnóstica.31
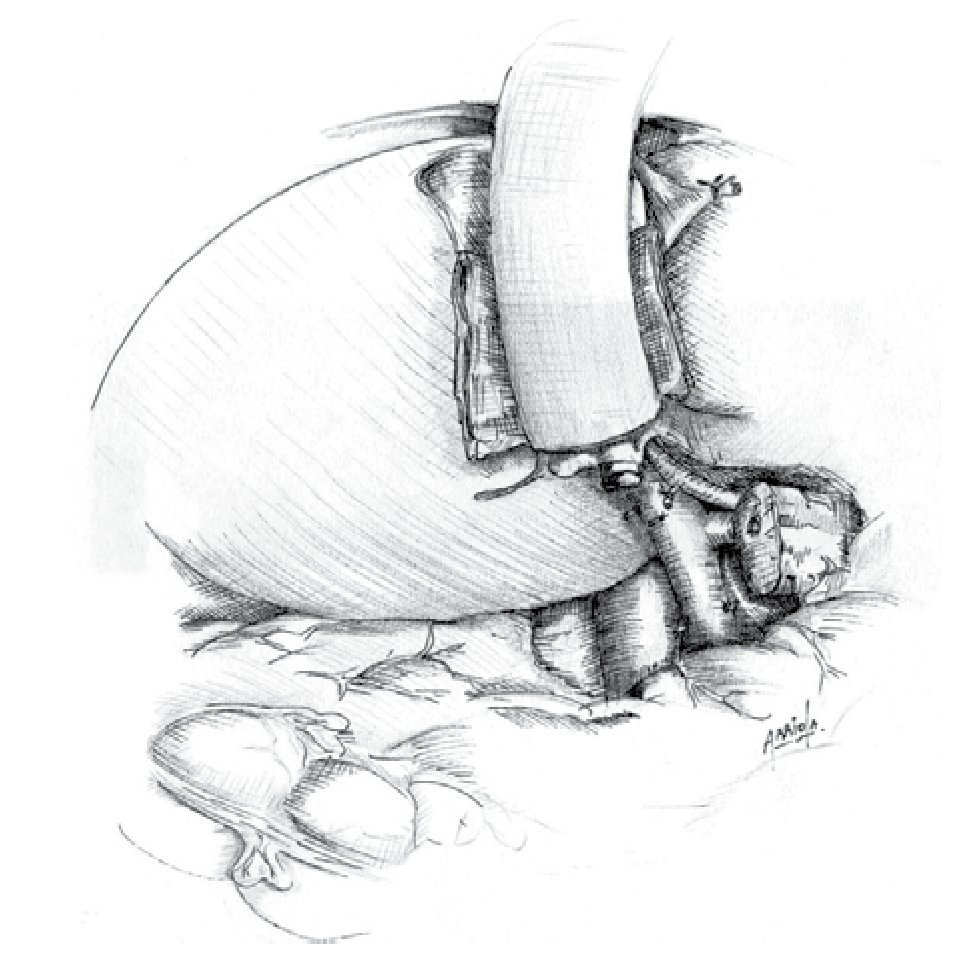
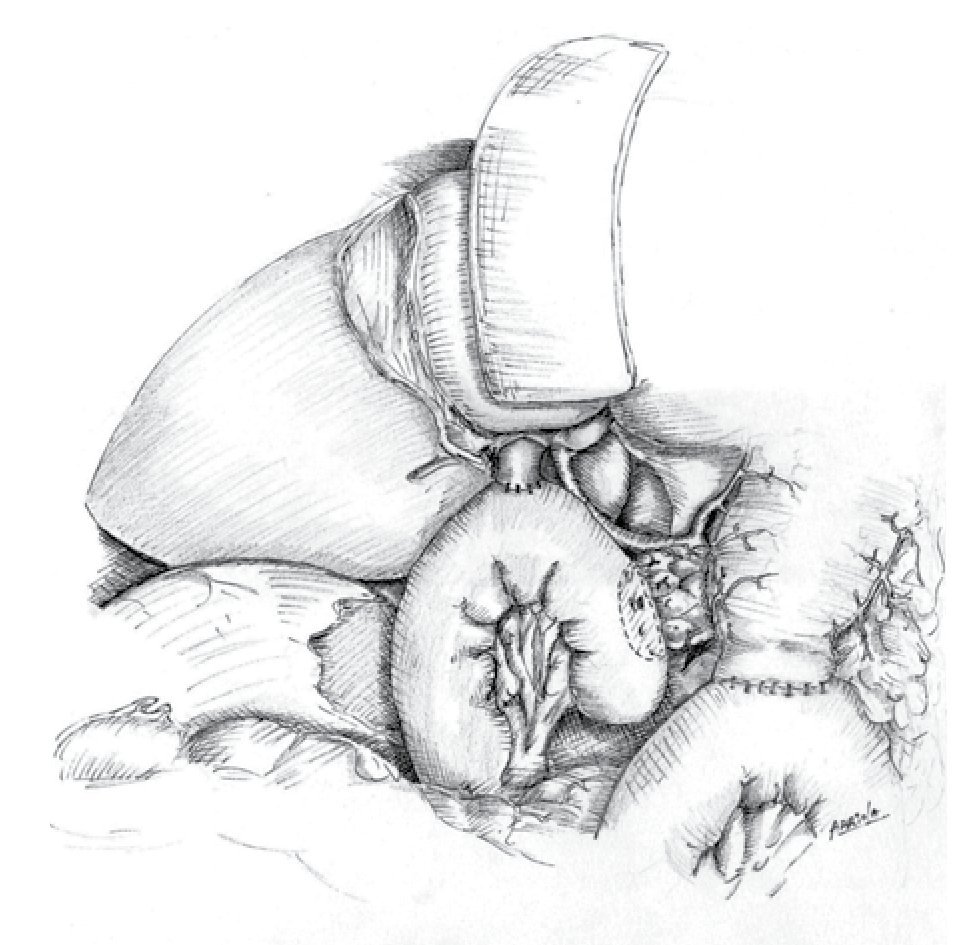
La cirugía con intento curativo requiere resección completa del tumor. Las opciones quirúrgicas dependen de la localización del tumor y varían desde pancreatectomías distales, pancreatectomías centrales (poco usuales) y pancreático-duodenectomías (PD) o procedimiento de Whipple. Esta última es la cirugía de elección en tumores de la cabeza del páncreas. Debido a la complejidad de la pancreático-duodenectomía y su alto índice de morbilidad, esta debe ser realizada por cirujanos familiarizados con la cirugía hepato-pancreatobiliar en centros de alto volumen que realicen más de 20 PD al año. Existen múltiples variantes a éste procedimiento, entre las más mencionadas en la bibliografía está la opción preservadora de píloro, la anastomosis pancreático-gástrica en vez de la pancreático-yeyunal y la linfadenectomía extendida.19,32,33 La técnica que se utiliza en el INCMNSZ está descrita en otras publicaciones (Figuras 3 y 4).34 La mortalidad aceptada es menor al 5% e incluso menor al 2% en los mejores centros del mundo, mientras que la morbilidad oscila alrededor de 40%. Entre las complicaciones más comunes se encuentran el retraso en el vaciamiento gástrico, la fístula pancreática, colecciones intra-abdominales y el sangrado. El estar familiarizado con las complicaciones y su manejo es parte fundamental para considerar un hospital un centro especializado. Como se vio en el estadiaje según la AJCC, el involucro de la vena mesentérica o vena porta no contraindica la cirugía. La resección parcial de vena o la colocación de un injerto autólogo o sintético es una opción que permite la resección completa del tumor sin alterar la supervivencia en manos expertas. Empero, alarga el tiempo quirúrgico y aumenta el sangrado transoperatorio asi como la posibilidad de transfusión en algunas series. Las resecciones de arteria mesentérica superior y tronco celiaco están reportadas en la literatura y se hacen en algunos centros de alto volumen en casos muy seleccionados, pero en términos generales no se recomiendan.35,36 Las resecciones laparoscópicas para CP son factibles según múltiples reportes de casos y series pequeñas con las ventajas conocidas de la laparoscopía. Pero no se ha comprobado la factibilidad oncológica en ensayos clínicos controlados o estudios con muchos pacientes. En muchos centros se realizan las pancreatectomías distales por cáncer de forma laparoscópica, otras resecciones se hacen abiertas en la mayoría de centros especializados.37 Existen muy pocos centros en donde se realizan de forma rutinaria PD laparoscópicas y a pesar de que sus beneficios aún no están claros es probable que se realicen con mayor frecuencua en el futuro cercano.38,39
¿ Figura 3. Técnica utilizada en el INCMNSZ en el tratamiento del cáncer de páncreas.
¿ Figura 4. Técnica utilizada en el INCMNSZ en el tratamiento del cáncer de páncreas.
La cirugía paliativa ha sido reemplazada por métodos menos invasivos de paliación con menor mortalidad, morbilidad y estancia hospitalaria. Sigue siendo indicada en aquellos casos en donde se encuentran metástasis o tumores irresecables durante una cirugía con intención curativa, realizar una derivación hepatoyeyunal y una gastroyeyuno anastomosis como paliación de la obstrucción biliar y como paliación de la obstrucción duodenal, respectivamente. La obstrucción duodenal sucede de forma postoperatoria en 20% de los pacientes a los que solo se les realiza la derivación biliodigestiva y por eso se realiza la doble derivación de forma rutinaria tenga o no obstrucción duodenal.41 En pacientes con una sobrevida esperada mayor a un año y adecuado estado funcional también puede estar indicada la paliación quirúrgica ya que ofrece mayor permeabilidad a largo plazo que las prótesis que se colocan endoscópicamente.41
En pacientes que no son candidatos a cirugía curativa se suelen emplear otros métodos de paliación. Se puede liberar la obstrucción biliar por medio de endoscopía y colocación de endoprótesis (stents) generalmente metálicas y que habitualmente se consideran definitivas. También existen endoprótesis duodenales para paliar la obstrucción intestinal pero son costosas. En pacientes en los que no es posible la CPRE (colangiopancreaticografía retrógrada endoscópica) la paliación percutánea se vuelve una alternativa viable. El tratamiento más común del dolor es con opiáceos, sin embargo es posible paliar el dolor refractario inyectando alcohol al plexo celiaco durante la cirugía paliativa, por endoscopia o por radio-intervención.41
Quimioterapia: La quimioterapia es parte integral del tratamiento del cáncer de páncreas. En ensayos clínicos controlados en los Estados Unidos de Norteamérica (EEUU) y en Europa se ha demostrado un aumento en sobrevida de tan sólo unos meses, sin embargo la mayoría de los pacientes aún muere por la enfermedad.2,42 Una descripción detallada de los ensayos clínicos controlados referentes a la quimioterapia en el CP va más allá de los objetivos de este artículo.
La quimioterapia adyuvante es, actualmente, la modalidad más común de tratamiento en el contexto de enfermedad resecable. A pesar de que no existe un consenso internacional de cuál es el tratamiento adyuvante estándar, el más común es la gemcitabina como agente único tras una resección quirúrgica. Muchos centros utilizan esquemas combinados, en el contexto de ensayos clínicos, sin evidencia clara de superioridad.43 El 5-fluorouracilo (5FU) también ha mostrado beneficio y puede utilizarse como quimioterapia adyuvante. El mayor beneficio se observa en casos con indicadores de mal pronóstico.44,45
Considerando que el tratamiento quirúrgico en ocasiones retrasa o anula la posibilidad del tratamiento sistémico, la quimioterapia neoadyuvante ofrece la oportunidad del control sistémico de la enfermedad antes del procedimiento. Otro beneficio potencial se presenta en pacientes con tumores limítrofes, en donde parece aumentar la posibilidad de resecabilidad y de márgenes negativos en la pieza quirúrgica. Por último esta modalidad de tratamiento podría ayudar a discernir a aquellos pacientes que progresan a pesar de tratamiento sistémico y que, probablemente no eran buenos candidatos a cirugía. Esto permite seleccionar a aquellos que se beneficien más de ser operados. Utilizando en su mayoría la gemcitabina o el 5FU como base para monoterapias o terapias combinadas, la neoadyuvancia ha demostrado beneficio similar al de la terapia adyuvante en estudios fase II no aleatorizados. Se necesitan ensayos clínicos con mayor número de pacientes para definir mejor el potencial beneficio.44,46,47
La quimioterapia paliativa se puede emplear en casos no resecables con beneficio marginal pero significativo en la supervivencia. La gemcitabina es la piedra angular de esta opción de tratamiento. Se han hecho múltiples ensayos clínicos para valorar el uso combinado de la gemcitabina con otros agentes sin encontrar beneficio significativo. Sólo el erlotinib (inhibidor del receptor del factor de crecimiento epidérmico) y en casos muy específicos el platino y la fluoropirimidina dan un beneficio cuando se dan en combinación con la gemcitabina. El Folfirinox, una triple combinación de 5-FU, leucovorin, irinotecan y oxaliplatin, recientemente ha demostrado resultados impresionantes en estudios fase III aunque con un índice muy alto de efectos adversos, sobretodo neutropenias grado 3 y 4.2,48,49
Nuevas terapias se encuentran en desarrollo. Múltiples publicaciones recientes estudian terapias moleculares incluyendo anticuerpos monoclonales contra ciertos receptores, inhibidores de tirosinacinasas o de metaloproteinasas que juegan un papel en el cáncer de páncreas. Dichos agentes se han estudiado en pequeños ensayos clínicos en pacientes con enfermedad irresecable en conjunto con el tratamiento estándar, la gemcitabina. Fuera del erlotinib, el resto no ha demostrado un beneficio sustancial aunque se siguen buscando blancos para la terapia molecular que eventualmente podría resultar en un cambio favorable.2,42 Recientemente se han publicado trabajos prometedores con terapias inmunológicas contra el cáncer de páncreas.43,50
Radioterapia: Se usa de forma rutinaria en combinación con quimioterapia como tratamiento adyuvante en la mayoría de los centros de EUA a pesar de que su beneficio es controversial. En Europa prácticamente no se utiliza la radioterapia en el tratamiento para el CP. Parece ofrecer beneficio en el tratamiento de la enfermedad localmente avanzada. Se necesitan más estudios para definir adecuadamente su papel en el cáncer de páncreas.43,44,51
¿ Conclusión
El cáncer de páncreas continúa siendo un gran reto, ya que a pesar de ser uno de los tumores más estudiados, su pronóstico es muy pobre. Todo médico debe estar familiarizado con los signos y síntomas, los métodos diagnósticos y los criterios de operabilidad para reconocer a los pacientes que se benefician de ser atendidos en centros especializados. La referencia a centros con la experiencia y el equipo necesario para el manejo de estos pacientes se traduce en mejores resultados. La cirugía continúa siendo la piedra angular del tratamiento y ofrece la única oportunidad de cura en aquellos pacientes en los que está indicada. La quimioterapia y radioterapia tienen un papel en el tratamiento pero el beneficio en sobrevivencia y en tiempo libre de enfermedad hasta este momento
es poco. El futuro en el manejo de estos tumores, sin embargo, se inclina más hacia la prevención, diagnóstico temprano y novedosos esquemas de quimioterapia al igual que la promesa de las terapias moleculares.
¿ Agradecimiento
Al Dr. Juan Carlos Arriola por sus excelentes ilustraciones.
Correspondencia: Dr. Carlos Chan Núñez.
Vasco de Quiroga #15, Colonia Sector XVI, Delegación Tlalpan. CP 14000, México D. F.
Teléfono: 5487 0900, ext. 2140, fax: 5573 9321.
Correo electrónico: carchan@prodigy.net.mx
Recibido el 30 de marzo de 2011;
aceptado el 5 de mayo de 2011.