Los IBP se han asociado con sobrepoblación bacteriana del intestino delgado, lo cual se incrementa con el tiempo de uso, y esta se ha asociado con síndrome de intestino irritable (SII).
ObjetivoInvestigar la prevalencia de síntomas intestinales en pacientes tratados con IBP en México.
MétodosGastroenterólogos de 36 ciudades encuestaron pacientes tratados con IBP utilizando un instrumento ad hoc para determinar la presencia de síntomas intestinales y SII.
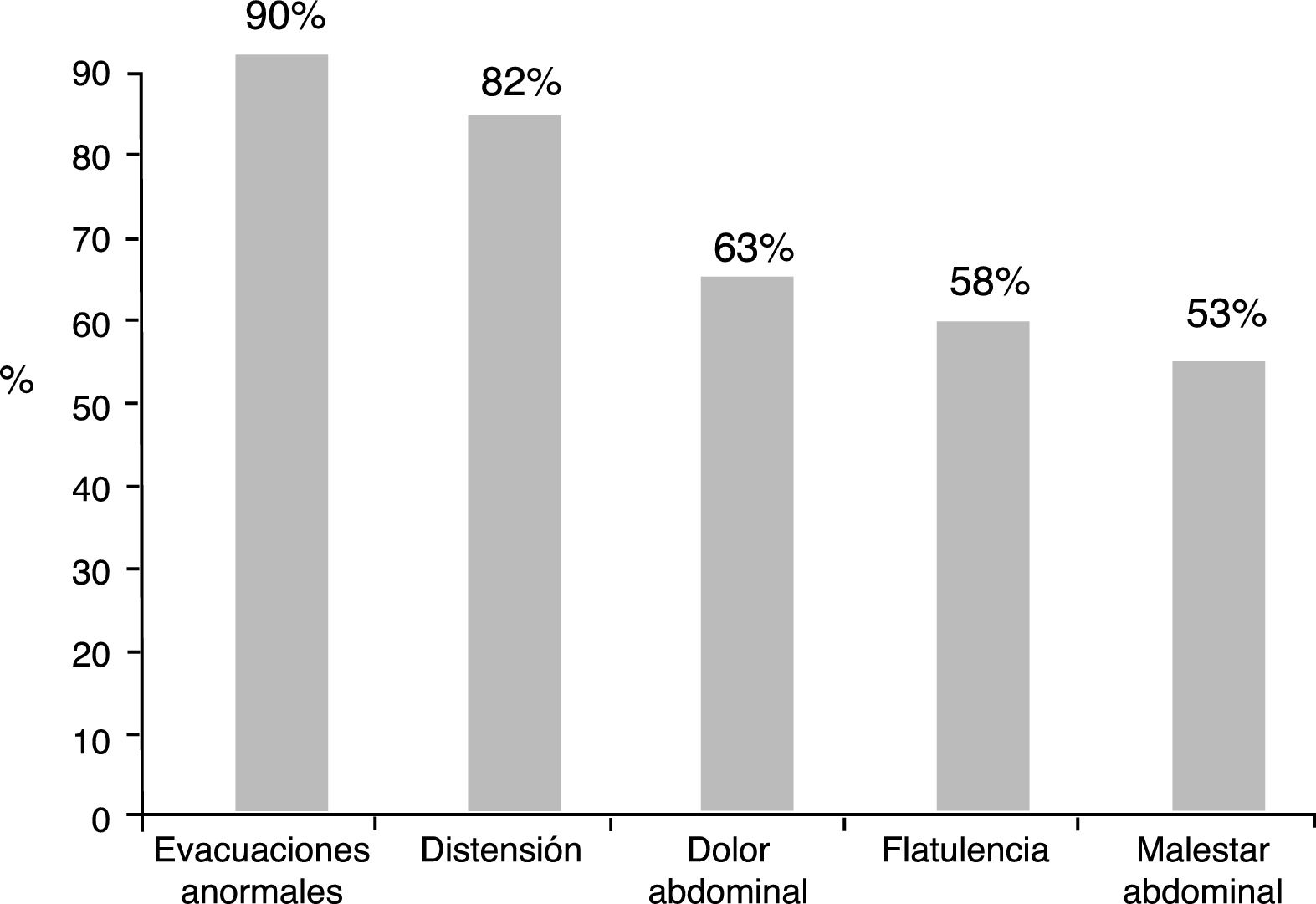
ResultadosDoscientos quince médicos incluyeron 1,851 pacientes. La indicación de IBP fue gastritis (48.8%), reflujo gastroesofágico (38.5%), úlcera péptica (6.2%) y otras (6.5%); el 77.5% recibió tratamiento por ≤6 meses y 11.9% por ≥1 año. El 92.3% reportó síntomas: evacuaciones anormales (90%), distensión subjetiva (82%), dolor abdominal (63%), flatulencia (58%), malestar abdominal (53%) y el 67.5% llenó criterios de Roma III para SII. En el 55.9% los síntomas se presentaron antes y en 44.1% después de IBP (p<0.005). En los primeros predominó el estreñimiento (63.8%), en los segundos diarrea (56.5%) (p<0.0001). Los tratamientos recetados para manejar estos síntomas fueron antiespasmódicos, antibióticos, procinéticos y antiflatulentos, sin embargo los pacientes consideraron la mayor satisfacción con antibióticos (rifaximina mayormente) (p<0.0001).
ConclusiónLa asociación de IBP con síntomas intestinales y SII es frecuente en México. Predominan la diarrea y la distensión subjetiva, y los antibióticos producen la mayor satisfacción al tratamiento. Lo anterior sugiere la sobrepoblación bacteriana del intestino delgado o disbiosis como causa de estos síntomas por IBP, lo cual debe ser confirmado.
Proton pump inhibitors (PPIs) have been associated with small intestinal bacterial overgrowth (SIBO), which increases with prolonged PPI use, and SIBO has been associated with irritable bowel syndrome (IBS).
ObjectiveThe aim of the present study was to study the prevalence of bowel symptoms in patients treated with PPIs in Mexico.
MethodsGastroenterologists in 36 cities surveyed patients treated with PPIs, utilizing an ad hoc questionnaire to determine the presence of bowel symptoms and IBS.
ResultsTwo hundred and fifteen physicians interviewed 1,851 patients. PPI indications were gastritis (48.8%), gastroesophageal reflux (38.5%), peptic ulcer (6.2%), and others (6.5%). A total of 77.5% of the patients received treatment for ≤6 months and 11.9% for ≥1 year. Symptoms were reported in 92.3% of the patients: abnormal bowel habits (90%), bloating (82%), abdominal pain (63%), flatulence (58%), and abdominal discomfort (53%). A total of 67.5% of the patients fit the Rome III criteria for IBS. Symptoms presented in 55.9% of the patients before PPI intake and in 44.1% of the patients after PPI use (P<.005). Constipation (63.8%) predominated in the former, and diarrhea (56.5%) in the latter (P<.0001). The treatments prescribed for managing those symptoms were antispasmodics, antibiotics, prokinetics, and antiflatulents, but patients stated greater satisfaction with antibiotics (mainly rifaximin) (P<.0001).
ConclusionThe association of PPIs with bowel symptoms and IBS is frequent in Mexico. Diarrhea and bloating predominate, and antibiotics produce the greatest treatment satisfaction, suggesting that SIBO or dysbiosis is the cause of the PPI-related bowel symptoms. However, that remains to be confirmed.
La reducción farmacológica de la secreción del ácido gástrico fue una revolución en el tratamiento de la enfermedad ácido péptica, primero con los antagonistas de los receptores H2 hace más de 35 años y con los inhibidores de la bomba de protones (IBP) 10 años después1. Por su eficacia y seguridad los IBP se han convertido en el pilar del tratamiento de los padecimientos relacionados con el ácido gástrico, tales como la enfermedad por reflujo gastroesofágico (ERGE)2. Los eventos adversos graves relacionados con el uso de IBP son extremadamente raros, y en general su uso se considera bastante seguro, aun a largo plazo3,4. Sin embargo, en los pacientes que reciben IBP se ha informado un incremento en la frecuencia de infecciones respiratorias, incluyendo neumonías5–8, y de infecciones gastrointestinales9–11, incluyendo mayor riesgo de infección por Clostridium difficile12–14.
La inhibición de la secreción del ácido gástrico va seguida de una mayor frecuencia de sobrepoblación bacteriana en el intestino delgado (SIBO)15–20. Un metaanálisis acerca de la relación de IBP y SIBO comprobó que había una relación significativa entre el tratamiento con IBP y SIBO cuando este se diagnosticó con cultivo de aspirado duodenal o yeyunal, aunque no fue significativa cuando el diagnóstico fue por medio de pruebas de aliento, debido probablemente a las diferentes metodologías utilizadas21. La importancia clínica de estos datos se informó incluso recientemente en un grupo de 200 pacientes que recibían IBP, el 50% de ellos tuvieron una prueba de aliento con glucosa-hidrógeno diagnóstica de SIBO en comparación con solo el 6% de un grupo de individuos sanos. En ellos la prevalencia de SIBO y la severidad de los síntomas relacionados con SIBO fueron significativamente mayores con la administración prolongada de los IBP por más de un año que con el tratamiento a corto plazo22.
Lo anterior sugiere que los pacientes en tratamiento con IBP pueden tener una alta prevalencia de síntomas digestivos, especialmente de origen intestinal, así como de síndrome de intestino irritable (SII), el cual ha sido asociado con SIBO y disbiosis22,23. Nuestra hipótesis fue que los pacientes en tratamiento con IBP presentarían una mayor frecuencia de síntomas intestinales y SII después de iniciar los IBP, y a mayor tiempo de uso de los mismos, y que esto sería independiente del IBP utilizado. Por lo anterior, nuestro objetivo fue investigar la prevalencia de síntomas intestinales y SII en pacientes que utilizaban IBP en México. Así mismo queríamos explorar el tratamiento utilizado por los médicos para el manejo de dichos síntomas y la satisfacción de los pacientes con los diferentes tratamientos.
MétodosEntre octubre de 2013 y marzo de 2014 se invitó a 2,044 médicos gastroenterólogos a lo largo de la República Mexicana a participar en un estudio que consistía en llenar un breve cuestionario junto con el paciente, durante la consulta médica. El criterio de inclusión era 10 pacientes consecutivos de la consulta que estuvieran en tratamiento con IBP, independiente de la indicación del mismo o del diagnóstico.
El cuestionario específicamente diseñado para el estudio incluyó preguntas sobre la presencia de dolor o malestar abdominal, distensión subjetiva, meteorismo, flatulencia, alteración en la frecuencia o consistencia de las evacuaciones, la presencia de SII según los criterios diagnósticos de Roma III; determinar si los síntomas comenzaron antes o después de iniciado el IBP y la relación de los síntomas con el tiempo de uso de IBP. Finalmente se interrogó sobre el tratamiento utilizado por los gastroenterólogos para tratar dichos síntomas intestinales y la satisfacción de los pacientes con los diferentes tratamientos.
El análisis estadístico fue realizado bajo dirección de los investigadores, por la Agencia de Ciencia, Innovación y Mercadotecnia. Las variables categóricas se describieron en porcentajes y las continuas en medias±DE y se utilizaron las pruebas Chi cuadrado y «t» de Student según el caso. Se consideró significativa una p<0.05 a 2 colas.
El protocolo fue aprobado por el Comité de Ética en Investigación (CEDOPEC). Todos los pacientes incluidos consintieron contestar la encuesta.
ResultadosMédicos y pacientesDe los gastroenterólogos invitados solo 215 de 36 ciudades de México aceptaron participar. Estos encuestaron a un total de 1,851 pacientes, incluyendo 1,092 (59%) mujeres y 759 (41%) hombres. La edad fue 47.5±19 y 47.1±19 respectivamente (p=0.585).
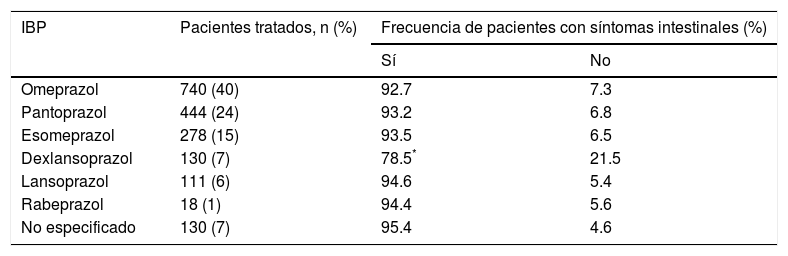
Inhibidores de la bomba de protonesLas indicaciones para utilizar IBP fue gastritis (48.8%), ERGE (38.5%), úlcera péptica (6.2%) y otras (6.5%). Los IBP utilizados en orden de frecuencia fueron omeprazol (40%), pantoprazol (24%), esomeprazol (15%), dexlansoprazol (7%), lansoprazol (6%), rabeprazol (1%), no especificado (7%) (tabla 1). La duración del tratamiento con IBP fue de uno a 3 meses en el 56.9%, de 4 a 6 meses en el 20.6%, de 7 a 9 meses en el 3.7%, de 10 a 12 meses en el 6.9% y de más de un año en el 11.9%. La indicación terapéutica fue similar en los diferentes lapsos de tratamiento, excepto una mayor proporción de casos con ERGE en aquellos con tratamiento mayor de un año; sin embargo, la diferencia no fue significativa. No se analizó la dosis de IBP.
Frecuencia de IBP utilizados y síntomas intestinales asociados con cada uno
| IBP | Pacientes tratados, n (%) | Frecuencia de pacientes con síntomas intestinales (%) | |
|---|---|---|---|
| Sí | No | ||
| Omeprazol | 740 (40) | 92.7 | 7.3 |
| Pantoprazol | 444 (24) | 93.2 | 6.8 |
| Esomeprazol | 278 (15) | 93.5 | 6.5 |
| Dexlansoprazol | 130 (7) | 78.5* | 21.5 |
| Lansoprazol | 111 (6) | 94.6 | 5.4 |
| Rabeprazol | 18 (1) | 94.4 | 5.6 |
| No especificado | 130 (7) | 95.4 | 4.6 |
El dexlansoprazol fue el IBP que se asoció con menor frecuencia a síntomas intestinales y abdominales.
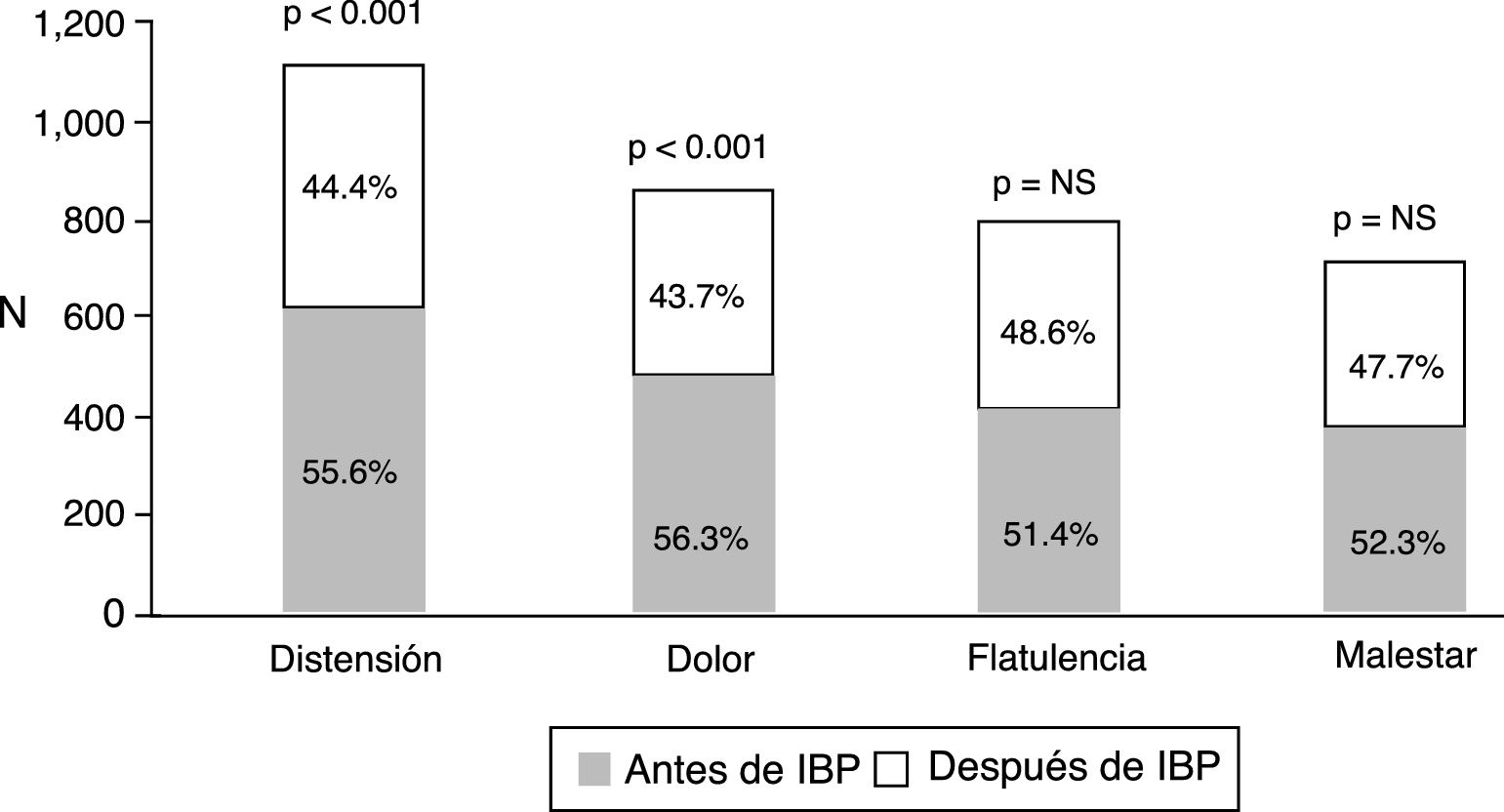
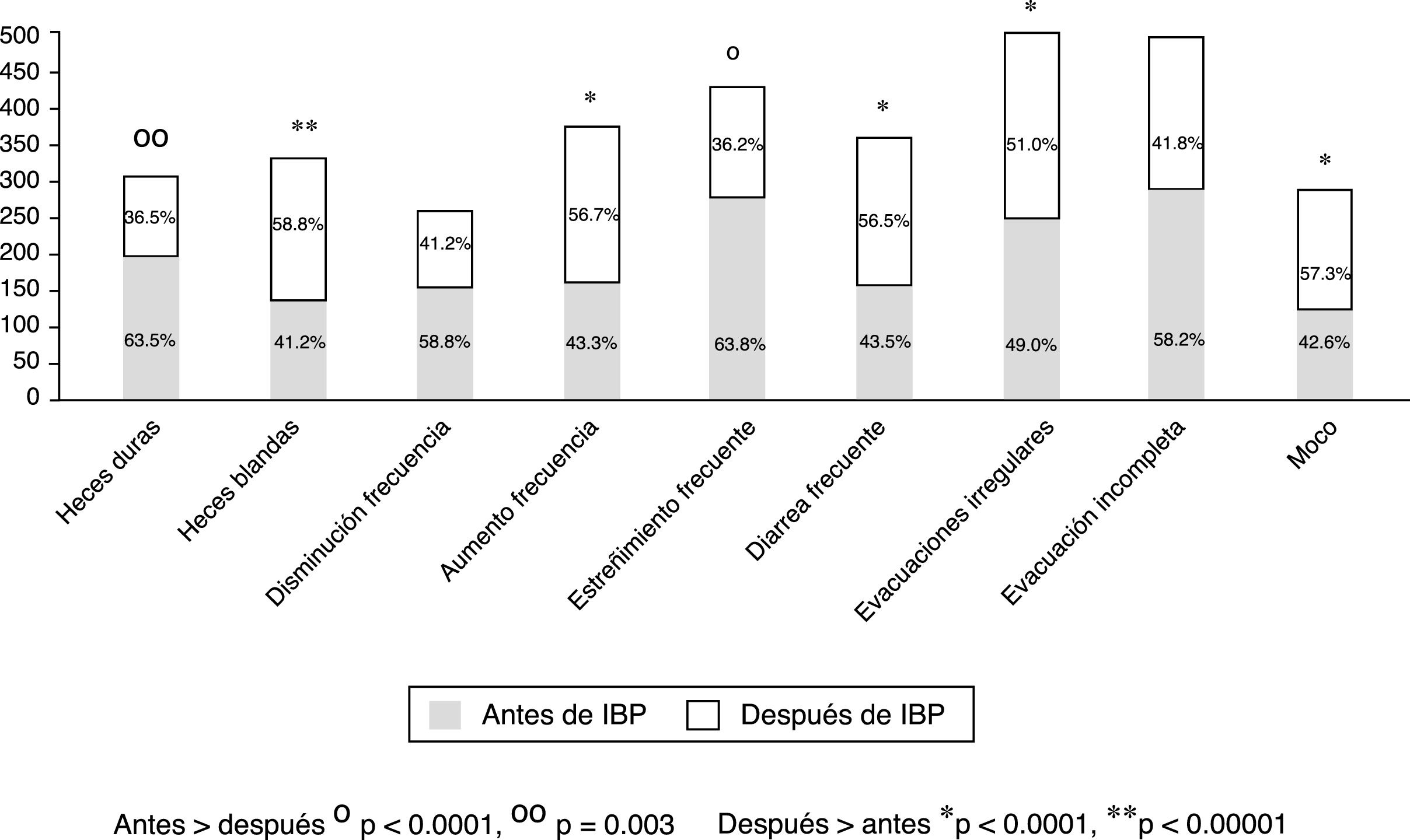
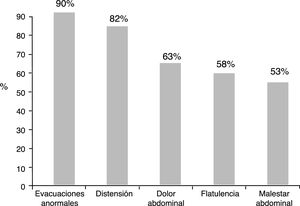
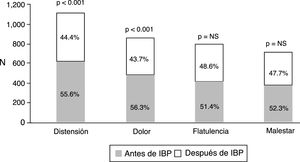
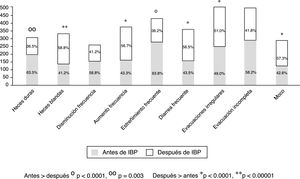
Del total de los pacientes tratados con IBP 1,708 (92.3%) reportaron algún síntoma intestinal. Los síntomas más comunes fueron evacuaciones anormales en frecuencia, consistencia o ambas, seguido de distensión abdominal subjetiva, dolor abdominal, flatulencia y malestar abdominal (fig. 1). Los síntomas abdominales como distensión subjetiva, dolor abdominal, malestar y flatulencia comenzaron antes del inicio del tratamiento con IBP en el 55.9% de los casos y después de iniciado el tratamiento en el 44.1% (fig. 2). En contraste, las evacuaciones irregulares comenzaron con mayor frecuencia después del uso de IBP (p<0.0001). Específicamente fue evidente que los síntomas relacionados con diarrea como heces blandas (p<0.00001), aumento de la frecuencia (p<0.0001) y el mismo reporte de diarrea frecuente (p<0.0001) aparecieron de forma más común después del inicio del tratamiento con IBP (p<0.0001). En cambio, los síntomas de estreñimiento como heces duras (p<0.0001) y estreñimiento habitual (p=0.003) estaban presentes más frecuentemente antes de iniciar el tratamiento con IBP. Es de reseñar que no hubo diferencia en cuanto a la disminución en la frecuencia de las evacuaciones (fig. 3). En los casos en los que los síntomas comenzaron después de iniciado el uso de IBP, en su mayoría (92%) aparecieron en los primeros 6 meses del tratamiento.
Frecuencia de síntomas intestinales según su aparición antes o después de iniciar el tratamiento con IBP. Todos los síntomas abdominales se encontraban presentes en mayor frecuencia antes de iniciar los IBP; sin embargo solo la distensión subjetiva y el dolor abdominal alcanzaron significación estadística.
Frecuencia de alteración en las evacuaciones según su aparición antes o después de iniciar el tratamiento con IBP. Fue evidente que la presencia de síntomas relacionados con el estreñimiento (heces duras y estreñimiento frecuente) fueron significativamente más frecuentes antes del tratamiento con IBP y los asociados con diarrea (heces blandas, aumento de la frecuencia, diarrea frecuente y moco) fueron más frecuentes posteriores al tratamiento.
De los 1,708 pacientes con síntomas abdominales/intestinales, 1,249 (67.5%) llenaron criterios de Roma III para SII. En cuanto a los subtipos de SII, en orden de frecuencia se distribuyeron en SII con diarrea (SII-D): 43%, SII-no clasificable: 33%, SII con estreñimiento: 21% y mixto (SII-M): 3%. En general el SII fue más frecuente en mujeres que en hombres (69.0% vs. 64.6%, p=0.038), pero específicamente el SII-D predominó en los pacientes de sexo masculino (47.8% vs 37.8%, p=0.033). En el 52.4% los síntomas de SII estaban presentes antes de iniciar el tratamiento y en el 47.6% aparecieron después de iniciar los IBP (p<0.005). No hubo diferencias en la frecuencia de los subtipos de SII si este apareció antes o después de iniciado el tratamiento con IBP.
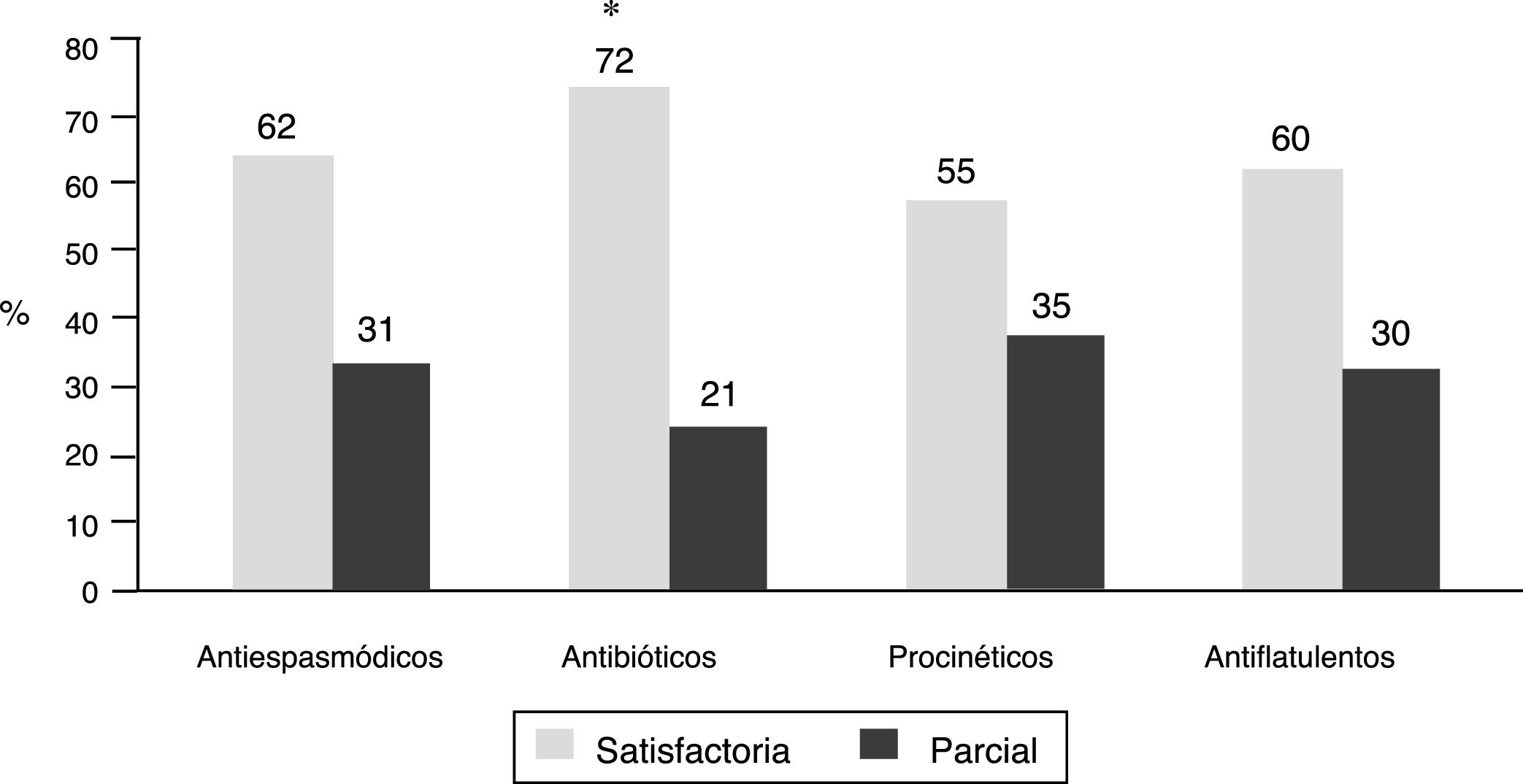
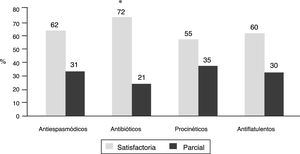
Síntomas intestinales de acuerdo con el inhibidor de la bomba de protones y conducta terapéuticaLa presencia o ausencia de síntomas intestinales no fue muy diferente según el IBP utilizado, excepto una menor frecuencia de síntomas con dexlansoprazol (78.5%) en comparación con los demás IBP (p<0.05) (tabla 1). En cuanto a la conducta utilizada por los médicos para manejar los síntomas intestinales en el 61% se continuó el uso de IBP, en el 22% se suspendieron y en 17% no se reportó la conducta. Por otra parte, el tratamiento utilizado por los médicos para manejar los síntomas incluyó antiespasmódicos (en 941 pacientes), antibióticos (en 524), procinéticos (en 439), antiflatulentos (en 381) y otros tratamientos (en 31). Hay que anotar que en el 35.6% de los pacientes los médicos indicaron más de un tratamiento simultáneamente, es decir, combinaciones. Los pacientes reportaron una respuesta satisfactoria a estos tratamientos en el 55% al 72%, y con una respuesta parcial en el 21% al 35%. Los pacientes que recibieron antibióticos (rifaximina en el 82.8% de los casos) reportaron con mayor frecuencia una respuesta satisfactoria (72%) y menor frecuencia de respuesta parcial (21%) en comparación con los demás tratamientos (p<0.0001) (fig. 4).
Discusión y conclusionesEl presente estudio es una encuesta de 1,851 pacientes en tratamiento con IBP consultados por gastroenterólogos a lo largo de la República Mexicana. El 92.3% reportó algún síntoma abdominal/intestinal y el 67.5% de ellos llenó criterios de Roma III para SII. En casi la mitad de los pacientes los síntomas comenzaron con posterioridad al inicio del tratamiento con IBP. De modo interesante los síntomas de diarrea y distensión abdominal subjetiva, así como el SII-D, fueron los más comúnmente asociados con el uso de IBP. Además, en 2/3 partes de los casos, los médicos continuaron el tratamiento con IBP, pero en todos indicaron tratamiento farmacológico para el manejo de estos síntomas, de los cuales los antiespasmódicos fueron los más frecuentemente utilizados, pero los antibióticos, en su mayoría rifaximina, fueron considerados por los pacientes como los más satisfactorios en la mejoría de dichos síntomas.
Nuestros resultados sugieren varios aspectos que deben ser considerados. Por una parte, el uso indiscriminado de IBP en la clínica, incluso por largos períodos de tiempo (en el 11% por más de un año), fuera de los lineamientos recomendados24,25. En segundo lugar, la alta frecuencia de síntomas de diarrea y distensión abdominal, así como SII-D que se presenta luego del uso de IBP, y la mayor satisfacción con el tratamiento, principalmente con el uso de rifaximina, sugiere que estos síntomas pueden ser producto de SIBO o disbiosis que han sido asociadas con el uso de IBP. Y en tercer lugar, el hecho de que en la mayoría de los casos los médicos no suspendieron los IBP con la aparición de los síntomas. Lo anterior hace pensar que desconocen la asociación del IBP con estos trastornos y que se requieren campañas educativas para el uso racional de los IBP.
Alta frecuencia en el uso de inhibidores de la bomba de protonesEn los últimos años ha habido una preocupación en el campo de la medicina por la alta frecuencia en el uso de IBP en la clínica y el alto costo de estos tratamientos. Los IBP están aceptados para el tratamiento de ERGE, enfermedad ulcerosa péptica, erradicación del H. pylori, esofagitis eosinofílica y síndrome de Zollinger Ellison. La ERGE es la indicación principal para el uso de IBP, pero en la mayoría de los casos la presencia de ERGE ni siquiera ha sido bien documentada26. Debido a que los IBP son una clase de medicamentos bien tolerados y se consideran entre aquellos con mejor perfil de seguridad, han sido utilizados de forma indiscriminada, sin control de tiempo de uso, o sin consideración de los efectos adversos potenciales con su uso a largo plazo. Por ejemplo, la interferencia con la absorción de micronutrientes (vitamina B12 y hierro) y magnesio, la relación con infecciones gastrointestinales debido a la hipoclorhidria y la presencia de una serie de síntomas gastrointestinales que resulta difícil de demostrar27. Sin embargo, esto último se sugiere en el presente estudio, donde más del 44% de los pacientes presentaron síntomas como diarrea y distensión abdominal con el uso de estos medicamentos. Además, los IBP se consideran hoy por hoy la primera causa de nefritis intersticial aguda relacionada con medicamentos, son un factor de riesgo para nefropatías crónicas y para la progresión hacia la fase terminal de estas28. Pero se ha asociado también con hiponatremia por una secreción excesiva de la hormona antidurética (ADH)29. Además, han sido relacionados con fracturas por osteoporosis, infecciones como neumonía y Clostridium difficile, rabdomiólisis, anemia y trombocitopenia30, además de un modesto incremento en el riesgo de un primer accidente cerebrovascular isquémico, independientemente del uso de antiagregantes plaquetarios31, hasta la asociación con demencia. Todo ello ha llevado a una reevaluación cuidadosa del uso general de IBP y de las indicaciones de la FDA para IBP32.
Alta frecuencia de síntomas abdominales/intestinales con inhibidores de la bomba de protonesPor una parte, en la población general en México los síntomas digestivos más frecuentemente reportados fueron dolor abdominal, diarrea, estreñimiento, pirosis y distensión abdominal. Así mismo los diagnósticos más frecuentes son la ERGE y el SII después de las gastroenteritis33. Sin embargo, los hallazgos de nuestro estudio mostraron una frecuencia de síntomas abdominales/intestinales sorprendentemente elevada en pacientes que utilizaron IBP. Esta no parece explicarse simplemente por la coexistencia de 2 trastornos gastrointestinales comunes, como son los trastornos acidopépticos o ERGE y SII, si bien es conocido que muchos pacientes con SII presentan síntomas de otros trastornos funcionales gastrointestinales o extra-gastrointestinales34. De hecho, una revisión sistemática de la literatura encontró una gran sobreposición entre ERGE y SII, que excede por mucho la prevalencia individual de estos trastornos por separado: más de un 30% de los pacientes con SII tienen ERGE, mientras que más de un 40% de los pacientes previamente diagnosticados con ERGE tienen SII35. En México, en un estudio prospectivo, se encontró que los individuos con SII tienen significativamente una mayor frecuencia que los controles de pirosis, dolor torácico, dolor epigástrico y náuseas36. La sobreposición de síntomas de SII, tanto con ERGE como con pirosis funcional, sugiere una relación fisiopatológica no bien dilucidada37.
La posibilidad de que el uso de medicamentos, en especial IBP, como es el caso de nuestro estudio, explique lo anterior, se apoya en los hallazgos de Choung et al. En una encuesta poblacional acerca de la relación entre la administración de medicamentos y síntomas digestivos observaron una relación significativa entre el uso de IBP y diversos trastornos gastrointestinales funcionales: ERGE, dispepsia, distensión y SII. La asociación con SII fue independiente de la presencia de comorbilidades como dispepsia y ERGE38. Se ha cuestionado el significado de la asociación IBP-SII, ya que podría ser simplemente la presencia de síntomas candidatos al tratamiento con IBP en pacientes con SII, o bien que los IBP al reducir la acidez facilitarían la aparición de SIBO que se asociaría al SII39. La demostración de la relación causa-efecto se encontró en un estudio prospectivo en el que se valoraron la aparición de síntomas intestinales y SIBO en 42 pacientes con ERGE no erosiva que recibieron esomeprazol durante 6 meses. En ese lapso de tiempo desarrollaron distensión el 52%, flatulencia el 33%, dolor abdominal el 24% y diarrea el 17%. Además llenaron criterios de Roma III para SII el 19%, y se encontró prueba de aliento con glucosa positiva para SIBO en el 26%40. También se ha observado que la administración de IBP a largo plazo puede alterar el tránsito intestinal y favorecer la aparición de SIBO por este mecanismo41. La relación causal entre el uso de IBP y la presencia de SIBO y de síntomas intestinales se apoya por la investigación de Lombardo et al.22, que encontraron que la prevalencia de SIBO era mayor en aquellos que habían recibido IBP por más de un año, al mismo tiempo que los síntomas intestinales eran más intensos. El mecanismo hipotético por el cual los IBP pueden desencadenar síntomas intestinales es que la inhibición de la secreción del ácido gástrico permitiría el paso de bacterias viables hacía el intestino, favoreciendo así la sobrepoblación bacteriana en los segmentos superiores del intestino delgado. En relación con esto llama la atención que en una unidad de cuidados intensivos el riesgo de tener una infección por C. difficile fue 3.7 veces mayor en quienes recibieron IBP que en los que recibieron antagonistas H2, que son antiácidos más débiles14. También se ha asociado el tratamiento con IBP y la aparición de enfermedad celíaca, tal vez al permitir el paso de antígenos a la submucosa42.
La mayoría de los pacientes analizados en el presente estudio recibieron IBP por 6 meses o menos, mientras que solo 11.9% llevaba más de un año con el tratamiento, de modo que una limitación es que no se pudo establecer una relación entre los síntomas y un tratamiento prolongado. Sin embargo, llamó la atención que antes de iniciar los IBP poco más de la mitad de los pacientes tenía síntomas intestinales principalmente relacionados con el estreñimiento, mientras que quienes iniciaron las manifestaciones intestinales después de iniciar el tratamiento con IBP tuvieron evacuaciones diarreicas o irregulares. Esto podría sugerir una relación fisiopatológica entre los síntomas intestinales y SIBO. En nuestra serie el 67.5% de los pacientes con síntomas intestinales llenaron criterios de Roma III para SII. Uno podría especular que los IBP producen síntomas de SII por SIBO y/o disbiosis. Aunque los resultados de los estudios son heterogéneos, en una revisión sistemática con metaanálisis se encontró que los pacientes con SII tienen una prueba de aliento positiva para SIBO: 3.45-4.7 veces más frecuentemente que los controles asintomáticos43. La microbiota está relacionada fisiopatológicamente con el SII no solo por SIBO y disbiosis, sino también por la aparición de este síndrome después de infecciones entéricas (SII-postinfección), probablemente a través de producir microinflamación44,45. Un estudio en heces de pacientes con uso prolongado —mayor de 5 años de IBP— encontró que estos pacientes presentaron una disminución de los filotipos Bacteroidetes y aumento de Firmicutes, y en lo referente a especies un aumento de Holdemania filiformis y disminución de Pseudoflavonifractor capillosus en comparación con controles sin historia de IBP46.
Además hay que anotar que todos los tratamientos para los síntomas intestinales que se utilizaron en los pacientes de nuestro estudio fueron seguidos de mejoría, pero los pacientes reportaron significativamente una respuesta más satisfactoria con antibióticos, principalmente con rifaximina. La mayor respuesta de los pacientes con el uso de este antibiótico luminal es otro factor que apoya la disbiosis o SIBO como causa de los síntomas intestinales con el uso de IBP. La rifaximina ha demostrado eficacia en la mejoría sintomática de los pacientes con SII sin estreñimiento, es decir, aquellos con SII-D o SII-M, y en la mejoría de la distensión abdominal, precisamente los síntomas más frecuentemente observados después de iniciar los IBP43–45.
Desconocimiento por los médicos de la asociación de inhibidores de la bomba de protones y síntomas gastrointestinalesLa explosión de la literatura revisada anteriormente es una evidencia clara de que se requiere un uso racional de los IBP en la clínica. Si bien en nuestro estudio solo el 11.9% de los pacientes utilizaron los IBP por más de un año, ya el uso superior a 6 meses se considera prolongado. La mayoría de las guías y consensos recomiendan un primer tratamiento con una dosis estándar de IBP por 8 semanas y, ante la falta de respuesta, un segundo ciclo de 8 semanas con dosis dobles. A pesar de que en nuestro estudio más del 44% de los pacientes presentaron síntomas posteriores al inicio de los IBP, en más del 60% de los casos el tratamiento no fue suspendido. Lo anterior sugiere que se deben realizar campañas de educación para el uso adecuado de los IBP en nuestro país. En este sentido, en Canadá se realizó un estudio en el cual se establecieron criterios para la prescripción de IBP en un asilo, se evaluó el uso de estos agentes 9 meses antes y 12 meses después. La publicación de los criterios se asoció con una disminución en la prescripción de los IBP durante los primeros 6 meses, si bien no alcanzó significación estadística, y una disminución en el costo mensual por residente. Sin embargo, la prescripción de IBP empezó a aumentar luego de 6 meses de la publicación, demostrando una dificultad en el mantenimiento de la conducta de prescripción47.
Nuestro estudio tiene ciertas limitaciones. Por una parte es un estudio retrospectivo realizado solo en pacientes que se encontraban en tratamiento con IBP, siendo lo ideal un estudio prospectivo en pacientes que inicien los IBP en comparación con una cohorte sin este tratamiento. Por otra parte, puede haber un sesgo de memoria en los síntomas, sin embargo resulta interesante el cambio de los mismos desde predominio de estreñimiento antes de los IBP hasta el predominio de diarrea y distensión luego de haber comenzado el tratamiento. En tercer lugar, no contamos con una medición objetiva para determinar la presencia de SIBO como pruebas de aliento o disbiosis como secuenciación de heces y de mucosa colónica para determinar la microbiota antes y durante el tratamiento con IBP48. Sin embargo, las fortalezas de este estudio son que es el primero en México al respecto, incluye un gran número de pacientes de diversas regiones del país y demuestra un alto desconocimiento del tiempo de tratamiento con IBP y de los efectos gastrointestinales asociados con su uso.
En conclusión, este estudio demuestra una alta asociación entre la presencia de síntomas intestinales y el tratamiento con IBP. Además, al menos 2/3 de los pacientes llenaron criterios de Roma III para SII. Los pacientes que iniciaron los síntomas intestinales antes de comenzar el tratamiento con IBP tenían síntomas predominantemente asociados con estreñimiento, mientras que en quienes presentaron los síntomas luego de iniciado el tratamiento presentaron predominantemente síntomas de diarrea y distensión abdominal. Sin embargo, en la mayoría de los casos no se suspendieron los IBP y el tratamiento con antibióticos fue considerado por los pacientes como el más satisfactorio para la mejoría de los síntomas asociados con IBP.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de los encuestados.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de los encuestados.
FinanciaciónInvestigación financiada por Alfa Wassermann, S.A. de C.V.
Conflicto de interesesMax Schmulson ha sido consultor para Alfa Wassermann, Commonwealth Diagnostics International Inc. y Takeda. Ha sido ponente para Alfa Wasserman, Commowealth Diagnostics Inc, Mayoly-Spindler y Takeda y ha recibido becas de investigación de Alfa Wassermann y Nycomed/Takeda. Alberto Frati es empleado de Alfa Wassermann S.A. de CV.