La obesidad es un transtorno grave en casi todo el mundo. Representa un importante factor de riesgo para una serie de condiciones que afectan y amenazan la salud. En la actualidad, la cirugía bariátrica es el tratamiento más eficaz de la obesidad mórbida y resulta además de la pérdida de peso en la redución de morbilidad en esta población. El número de pacientes obesos operados se ha incrementado significativamente. A pesar del éxito de la cirugía bariátrica, un grupo de pacientes presentará complicaciones mayores en el postoperatorio. Para que la endoscopia contribuya en el diagnóstico y tratamiento de las complicaciones de la cirugía de la obesidad, es necesario que el gastroenterólogo esté familiarizado con las particularidades de la cirugía bariátrica. En el presente artículo revisamos los aspectos anatómicos resultantes de las principales técnicas quirúrgicas empleadas, los síntomas más comunes en el postoperatorio, las ponteciales complicaciones y las posibilidades de diagnóstico y de tratamiento endoscópico. La endoscopia, en el tratamiento de las complicaciones de la cirugía bariátrica, es un área que está en crecimiento y en continua evolución. El objetivo de esta revisión es contribuir para la preparación de los gastroenterólogos para que ofrezcan diagnóstico y tratamiento endoscópico adecuado a esta población de alto riesgo.
Obesity is a serious disorder in almost the entire world. It is an important risk factor for a series of conditions that affect and threaten health. Currently, bariatric surgery is the most effective treatment for morbid obesity, and in addition to the resulting weight loss, it reduces morbidity in this population. There has been a significant increase in the number of obese patients operated on. Despite the success of bariatric surgery, an important group of patients still present with major postoperative complications. In order for endoscopy to effectively contribute to the diagnosis and treatment of complications deriving from obesity surgery, the gastroenterologist must be aware of the particularities involved in bariatric surgery. The present article is a review of the resulting anatomic aspects of the main surgical techniques employed, the most common postoperative symptoms, the potential complications, and the possibilities that endoscopic diagnosis and treatment offer. Endoscopy is a growing and continuously evolving method in the treatment of bariatric surgery complications. The aim of this review is to contribute to the preparation of gastroenterologists so they can offer adequate endoscopic diagnosis and treatment to this high-risk population.
La prevalencia de pacientes obesos ha aumentado en todo el mundo1. La obesidad se asocia con una serie de condiciones que amenazan la salud, por lo que representa un grave problema de salud pública2,3. El tratamiento clínico para una fración importante de los pacientes obesos no es satisfactorio a largo plazo4,5. El tratamiento quirúrgico es considerado eficaz en la pérdida de peso, en el mantenimiento de esta pérdida y mejora de las morbilidades a largo plazo6,7. El número de cirugías bariátricas ha aumentado sistemáticamente cada año8. La mortalidad en la cirugía bariátrica es inferior al 1% en centros de referéncia9 y se estima que el 5 a 10% de los pacientes tengan complicaciones agudas y el 9 a 25% complicaciones tardías10. El examén endoscópico en el postoperatorio de la obesidad tiene indicaciones bien definidas en la evaluación de síntomas, diagnóstico de complicaciones y eventualmente para procedimientos terapéuticos11,12. Para que el examén endoscópico contribuya en el diagnóstico y tratamiento de las complicaciones de la cirurgía de la obesidad, es necesario el adecuado conocimiento de los aspectos anatómicos resultantes de las técnicas quirúrgicas empleadas, sus potenciales complicaciones y el manejo13,14.
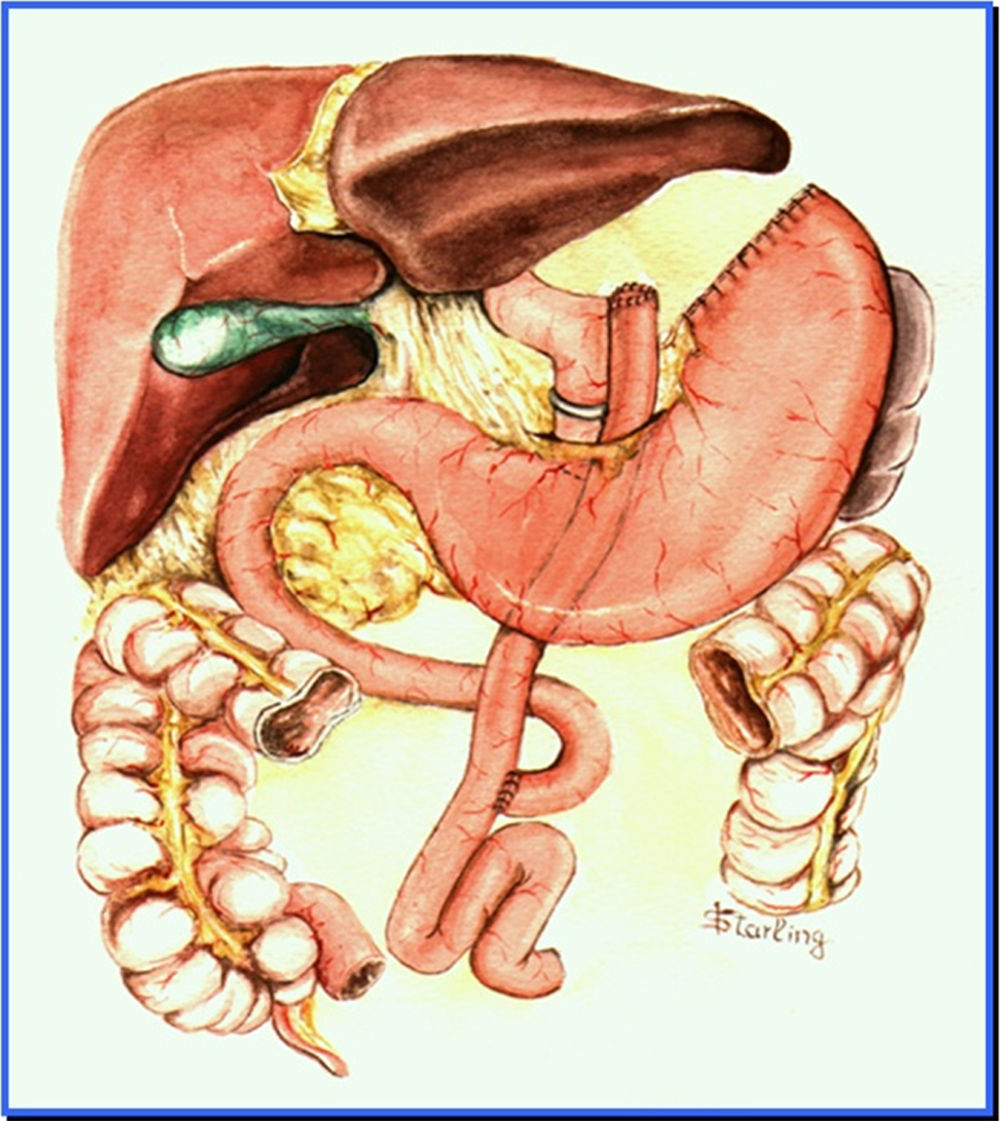
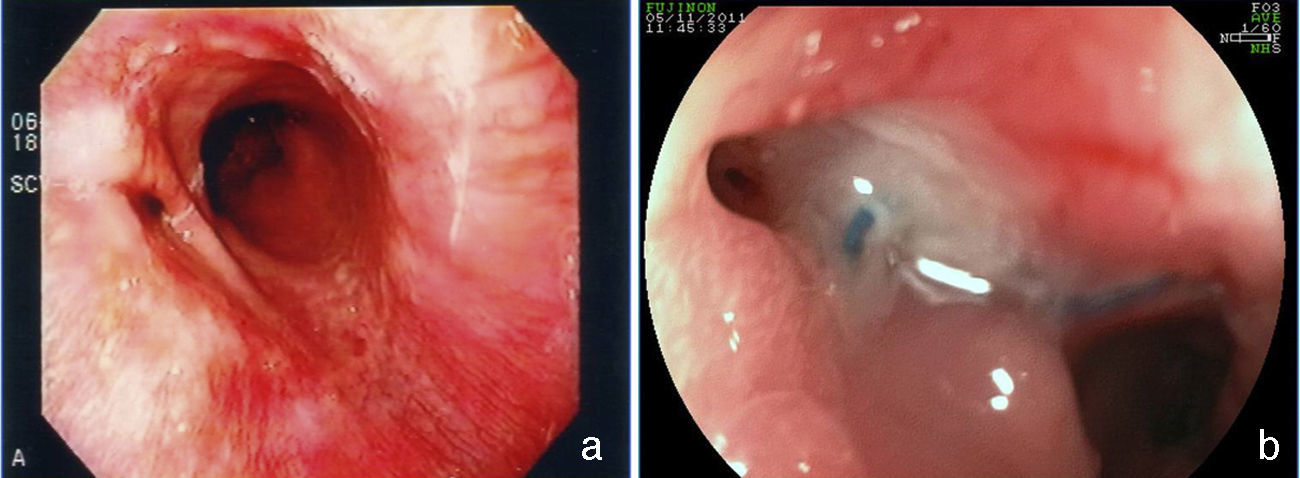
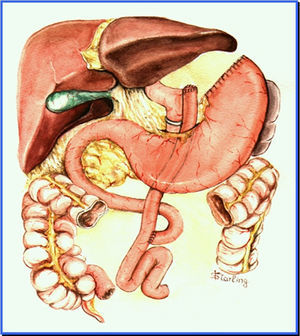
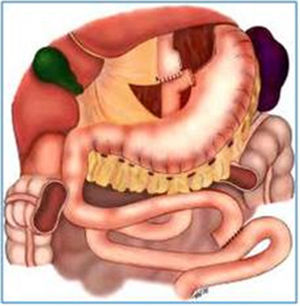
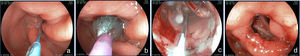
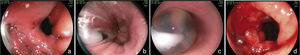
Aspectos endoscópicos de la derivación gástrica en Y de Roux con anillo (cirugía de Capella)Durante muchos años la técnica más utilizada fue la cirugía de Capella15, en la que el estómago es engrapado y seccionado formando un pequeño reservorio junto al cardias, llamado de bolsa gástrica. Todo el restante del estómago, del duodeno y parte del yeyuno proximal quedan excluidos del tránsito alimenticio. Este es reconstituido con una anastomosis término-lateral entre la bolsa gástrica y un asa yeyunal en Y de Roux (fig. 1). En la endoscopia, la bolsa gástrica comienza justo debajo de la transición esofagogástrica y mide entre 5 y 7cm de extensión. A veces se puede notar la línea de sutura de la sección gástrica. Un anillo de material sintético es colocado externamente a la bolsa, para limitar su vaciamiento y, en el examén endoscópico es visto como una impresión anular de 12mm en la porción más distal de la bolsa. Justo debajo del anillo se observa la anastomosis gastroyeyunal que tiene un diámetro aproximado de 12 a 14mm. El asa aferente es corta, termina en fondo ciego, tiene un ángulo agudo y está imbricada en la línea de sutura de la bolsa gástrica, modificación propuesta por Fobi16. El asa eferente es larga y queda dispuesta casi en el mismo eje de la bolsa. El endoscopista debe estar atento a la mucosa esofágica, al tamaño e integridad de la bolsa gástrica, especialmente en la línea de sutura, al posicionamiento y calibre del anillo, al aspecto de la anastomosis y a la mucosa yeyunal proximal17,18.
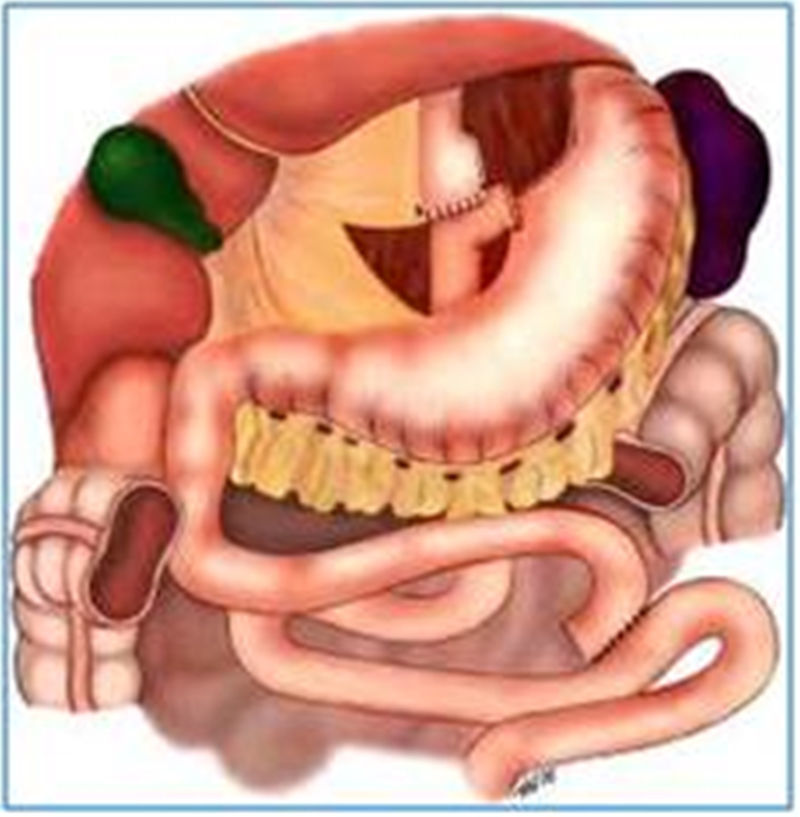
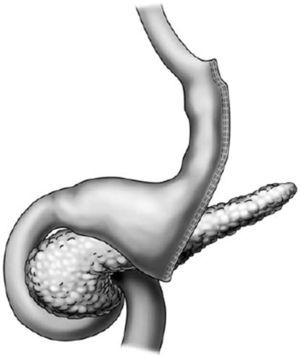
Aspectos endoscópicos de la derivación gástrica en Y de Roux (bypass gástrico)Actualmente es la cirugía para obesidad más realizada, preferiblemente hecha por vía laparoscópica. La técnica es prácticamente la misma de la cirugía de Capella, pero no tiene la colocación del anillo y se confecciona una bolsa menor, especialmente por el lado de la curvatura mayor, con elaboración de una anastomosis, que puede ser término-terminal o término-lateral, con reducción de su calibre, con el objeto de sustituir el efecto restrictivo del anillo11,18 (fig. 2). El aspecto endoscópico se asemeja a la cirugía de Capella (derivación gástrica con anillo), con tendencia a una bolsa menor y a una anastomosis de menor calibre, obviamente no se observa la impresión del anillo17–19 (fig. 3).
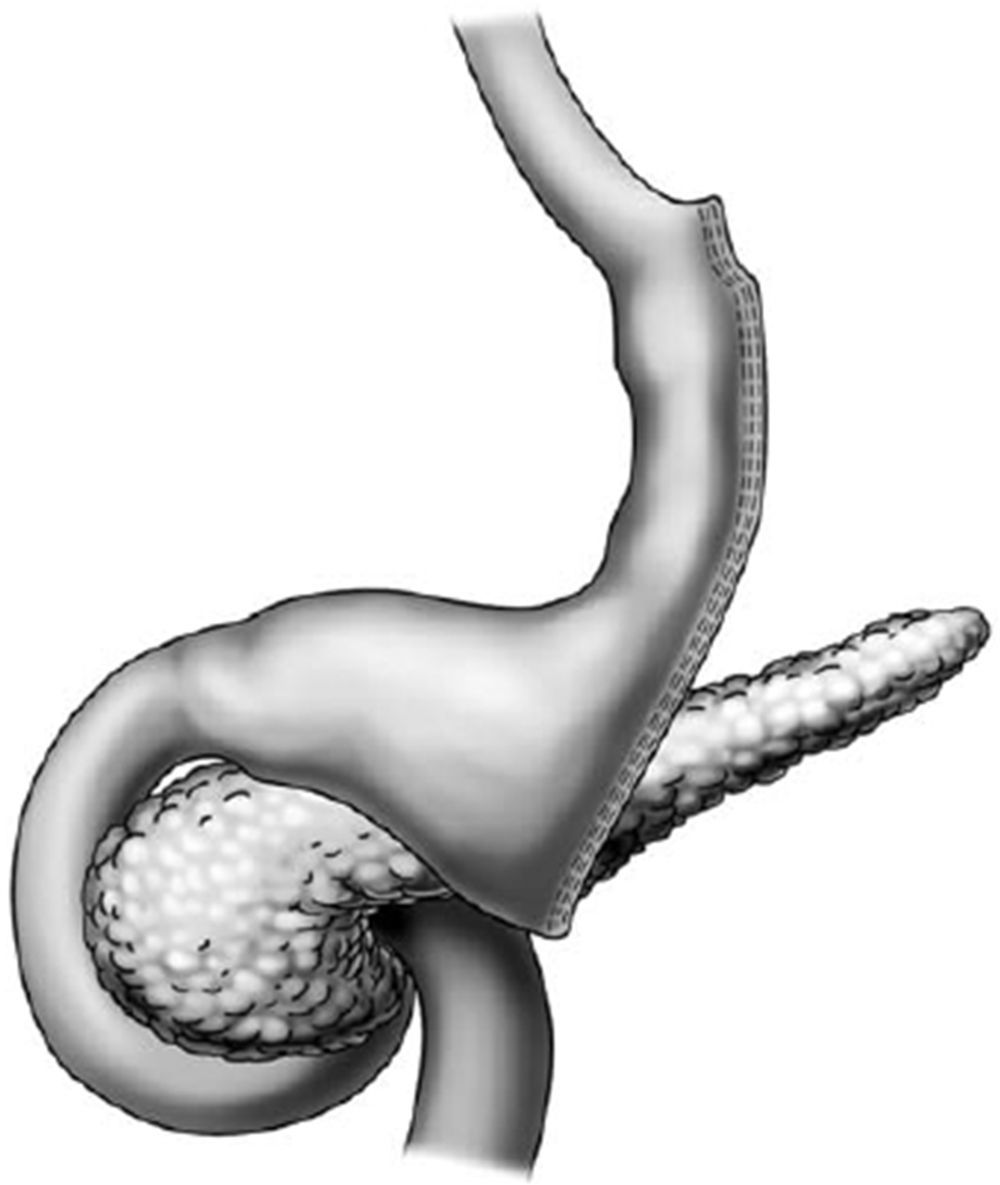
Aspectos endoscópicos de la gastrectomía vertical (Sleeve)La gastrectomía vertical es una técnica puramente restrictiva. Se confecciona un tubo vertical a través de la resección de la curvatura mayor y del fondo gástrico, restando un estómago con volumen reducido. La resección es hecha a partir de 7cm del píloro hasta el ángulo de His (fig. 4). A la endoscopia observamos la parte proximal del muñón gástrico tunelizada hasta la incisura angular, donde se nota una angulación construida intencionalmente para dificultar el vaciamiento gástrico. Después de la angulación se observa el antro y el duodeno preservados. El endoscopista debe observar la mucosa esofágica, la transición epitelial esofagogástrica, el eje de la porción tunelizada, la transición de la porción tunelizada para el antro, la mucosa antral y duodenal17–19.
Endoscopia en el postoperatorio inmediatoDeberá ser realizada con cuidado y mínima insuflación de aire, aunque raramente puede resultar en complicaciones20,21. En los primeros días del postoperatorio, la endoscopia se ve perjudicada por el edema y friabilidad en la región del anillo y de la anastomosis. Su realización podrá ser imperiosa en la presencia de hemorragia, manifestada como hematemesis o melena. La hemorragia ocurre en el postoperatorio inmediato en uno hasta 5% de los casos de derivación gástrica22,23. Un estudio demostró que la hemorragia se manifiesta durante las primeras 4 horas en el 70% de los casos24. La hemorragia es rara después de una gastrectomía vertical o de una banda laparoscópica25. La tasa de sangrado es mayor en la derivación gástrica laparoscópica (5.1%) que en el acceso por laparotomía (2.4%), siendo el resangrado también mayor en el grupo laparoscópico22. En una revisión de 933 pacientes operados de derivación gástrica la tasa de sangrado fue de 3.2%, de estos, 47% tuvieron un episodio, 43% dos episodios y 10% tres episodios23. Algunas veces el examen endoscópico no es necesario, pues la hemorragia puede ser leve y/o autolimitada. Si el sangrado es grave o si hay recidiva después del manejo conservador, la endoscopia deberá ser realizada25. El sangrado comúnmente se origina en la anastomosis gastrointestinal, con posibilidad de hemostasia endoscópica14,25. El uso de endoclips es una mejor opción en comparación a los métodos térmicos, ya que minimiza la lesión en la anastomosis y debe ser asociado al uso de una solución de adrenalina, ya que la terapia doble tiene mejor resultado13,26. En una revisión de 89 pacientes con sangrado inmediato posderivación, 77% fueron tratados de forma conservadora y la endoscopia diagnóstica y terapéutica se realizó en solamente 6 (6.7%) y 5 (5.6%) de estos pacientes, respectivamente27. En otro reporte la endoscopia fue realizada en 27 de 30 pacientes (90%), siendo la fuente del sangrado la anastomosis gastroyeyunal en todos los casos23. En el 85% de estos pacientes había hemorragia activa o estigmas de sangrado y la terapéutica endoscópica con inyección, coagulación térmica o con uso de endoclips fue utilizada. El control inicial ocurrió en todos los pacientes, pero 5 pacientes (17%) resangraron y fueron sometidos a nueva terapéutica endoscópica. Más raramente la hemorragia puede ocurrir en la línea de sección de la bolsa gástrica, en la anastomosis enteroentérica, en otro punto del intestino delgado o del colon o, mismo, en el estómago excluido11,13,28.
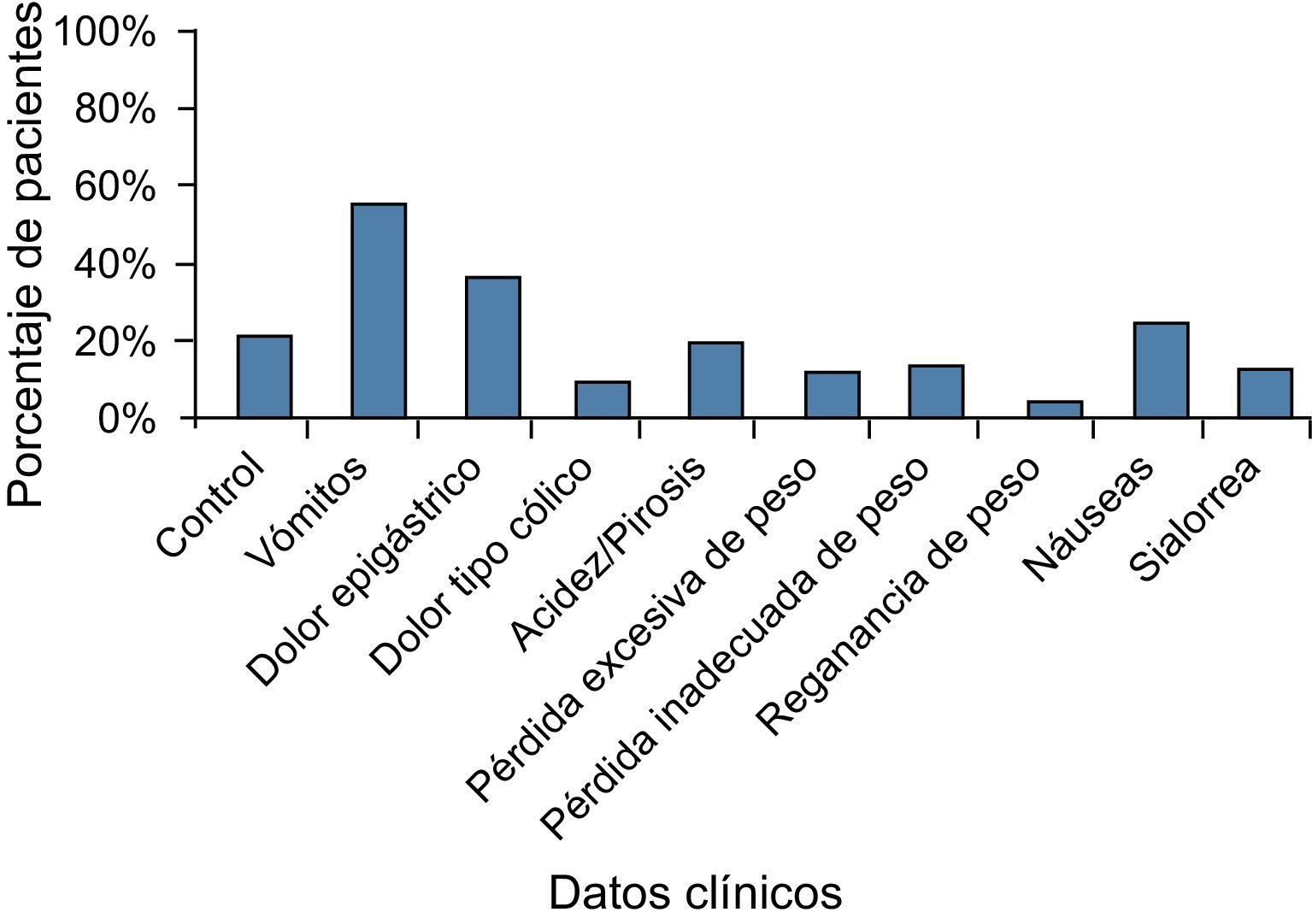
Endoscopia en el postoperatorio tardíoPuede ser realizada, en ausencia de sintomas, para certificación y evaluación de la técnica quirúrgica19. Esta indicación es cuestionada por algunos, teniendo en consideración el costo-beneficio29. La endoscopia será realizada en la presencia de síntomas que pueden ocurrir en el 20 hasta 30% de los pacientes19,30, e incluyen principalmente dolor abdominal, náuseas y vómitos, sintomas de reflujo, disfagia y problemas relacionados con el peso11,19,31,32. La tabla 1 muestra las indicaciones de endoscopia en 218 pacientes en el primer año de postoperatorio32. Entre los principales hallazgos endoscópicos se detectaron la esofagitis, úlcera marginal, estenosis de la anastomosis, erosión y deslizamiento del anillo, hemorragias y fístulas, con incidencia variable de acuerdo con las características de los pacientes investigados13,14,19,21.
Náuseas y vómitosNo son raros en los primeros días, normalmente duran alrededor de una semana y están relacionados con el uso de medicamentos, edema de la anastomosis, dismotilidad transitoria o más frecuentemente a una combinación de estos factores33. Cuando no desaparecen o no mejoran lo suficiente para permitir la ingestión de líquidos, la endoscopia será indicada31. Son quejas que también ocurren después de las primeras semanas de postoperatorio y no constituyen, por sí solo, indicación de examen endoscópico14. En general, existe una tendencia de mejora de los vómitos entre uno y 6 meses hasta que cerca del 75% de los pacientes no vomitarán más o lo harán esporádicamente34. Es importante la caracterización del vómito en relación al aspecto, si es claro tipo saliva o si es de residuos de alimentos, en relación a su frecuencia, si es constante o si es posprandial, en relación al número de episodios, su asociación con sialorrea, disfagia o dolor y su correlación con el tiempo de cirugía33,34. La endoscopia será indicada llevando en consideración estos factores, para que, por un lado se eviten exámenes innecesarios y por otro, se pueda hacer el diagnóstico de estenosis del anillo o de la anastomosis y hasta de impactación alimenticia11,12,19.
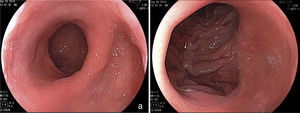
Pérdida de peso inadecuadaLa pérdida de peso es mayor en los primeros 6 meses y disminuye a partir de este período. Se espera que se produzca de forma leve y constante hasta 12 o 15 meses, alcanzando hasta el 45% del peso inicial6,7. Algunos pacientes pueden recuperar de 5 hasta 10% del peso perdido después de 2 a 4 años de la cirugía, lo que es aceptable35. Se estima que entre el 18 y el 30% de los pacientes pueden recuperar casi todo el peso perdido, caracterizando un fracaso del tratamiento quirúrgico35,36. Aunque los resultados inadecuados con relación a la pérdida de peso sean relacionados con problemas dietéticos, conductuales y hormonales37, alteraciones susceptibles al manejo endoscópico pueden estar involucradas. De esta forma en la pérdida de peso insuficiente o exagerada y cuando se pasa la recuperación del peso perdido, la endoscopia estará indicada38. En la pérdida insuficiente se puede hacer el diagnóstico de fístulas entre la bolsa gástrica y el asa anastomosada (gastroyeyunal) o entre la bolsa y el estómago excluido (gastrogástrica) y de erosión parcial o total del anillo. Bolsas de gran tamaño y anastomosis dilatadas también están correlacionadas con una insuficiente pérdida de peso13,19,39. Existen casos de intervenciones endoscópicas sobre la anastomosis dilatada para disminuir su calibre y inducir la pérdida de peso con inyección de esclerosantes40, fulguración con gas de argón41 (fig. 5) y aplicación de endoclips42. Utilizando estos métodos el 64% de los pacientes pueden perder hasta el 75% de la reganancia de peso43,44. Existen relatos de intervenciones endoscópicas experimentales con diferentes plataformas de sutura para disminuir el diámetro de la anastomosis o el tamaño de la bolsa. Estas técnicas incluyen las plicaturas con sistemas como el EndoCinth45, Apollo OverStitch46, StomaphyX47, Rose y BOB48. De la misma forma en las fístulas gastrogástricas y gastrointestinales existe la posibilidad de tratamiento endoscópico a través de suturas con estos mismos sistemas13,48,49. Estos distintos abordajes endoscópicos tienen éxito en inducir la pérdida de peso en 75% de los pacientes48,50,51. No obstante se desconoce el efecto de estos procedimientos sobre la anastomosis y el mantenimiento de estas plicaturas y suturas a largo plazo. De esta forma, el impacto de estos procedimientos todavía necesitan de más estudios, considerando también que la pérdida de peso es multifactorial13,48.
Úlcera marginalLa úlcera marginal o de boca anastomótica puede ocurrir después de la derivación gástrica para la obesidad, siendo descrita tanto en los primeros días como muchos años después de la cirugía52. La incidencia varía de 0.5 hasta 20%12,53 y depende de una serie de factores. Estos incluyen la frecuencia con que se realiza la exploración endoscópica, la época en que es realizada y la tasa de tratamiento empírico antes de la endoscopia12,53. La incidencia de úlcera marginal era mayor en los casos en que no se hacía la sección de las dos cámaras gástricas, ya que podría haber recanalización entre los muñones, permitiendo que el ácido del estómago excluido alcanzase directamente la mucosa yeyunal54. Con la transección de las dos cámaras gástricas y la interposición del asa entre ellas, la posibilidad de fístula es rara54, disminuyendo la incidencia de úlcera11,13. Otro aspecto técnico a ser considerado es la bolsa gástrica de gran tamaño, que tendría una mayor producción de ácido y una mayor probabilidad de úlcera54. La tendencia actual de la bolsa pequeña disminuyó esa incidencia52,55. De esta manera la úlcera marginal ocurre en la cirugía de derivación entre el 0 y 6%30,55. Algunos separan la úlcera marginal del estoma (de la línea de sutura, margen gástrica) de la úlcera marginal (de la mucosa yeyunal, adyacente a la anastomosis)12,19. En los casos de úlcera marginal, relacionada con los factores descritos, la lesión ocurre más tardíamente, puede ser única o múltiple y se localiza en la mucosa yeyunal, adyacente a la anastomosis13. La úlcera del estoma puede ocurrir también por los factores técnicos relacionados con la realización de la anastomosis y del asa en Y de Roux y no como resultado de una bolsa grande, de fístulas o de otro factor ulcerogénico. Generalmente estas úlceras son causadas por la presencia de un cuerpo extraño (hilo de sutura) en la línea de sutura52,55, disminución del aporte sanguíneo en la mucosa yeyunal, compresión y edema en la anastomosis o tensión debido al mesenterio corto55,56. Estas úlceras ocurren en el postoperatorio precoz y son observadas en la línea de sutura, a veces sobre un hilo quirúrgico y cicatrizan con 2 o 3 meses, principalmente si el agente causal es removido56,57. Otros factores relacionados con la etiología de la úlcera marginal incluyen el tabaquismo, el etilismo y el uso de ácido acetilsalicílico y de antiinflamatórios52,56. Algunos estudios han abordado el efecto del Helicobacter pylori (H. pylori) en el desarrollo de úlceras después de cirugías bariátricas11,13. La serología es el mejor método de detección del H. pylori en esta población, ya que las biopsias de la bolsa y el test respiratorio pueden resultar falsos negativos13,56. En la derivación gástrica la tasa de infección es baja y su papel en la génesis de la úlcera marginal todavía no fue bien definido12,52,56. Por lo tanto, la pesquisa de la bacteria en la bolsa y su tratamiento solo pueden ser hechos de manera empírica. Dolor abdominal es el síntoma más común en pacientes con úlcera11–13. Náuseas y vómitos pueden estar presentes, con o sin dolor y la hemorragia masiva es poco común52. El diagnóstico es inminentemente endoscópico. Las úlceras precoces, relacionadas con problemas en la línea de sutura, tienden a cicatrizarse espontáneamente52,56. La ulceración recurrente o persistente, asociada a la presencia de cuerpo extraño puede ser tratada con la extracción endoscópica del mismo57,58. El endoscopista puede retirar hilos de sutura cuando son visibles en la luz y si están asociados a una úlcera marginal. Esta conducta tiene el potencial de facilitar la cicatrización y así aliviar cuadros de dolor abdominal25. Las úlceras causadas por problemas en la confección de la bolsa, normalmente localizadas en la mucosa yeyunal, serán tratadas con inhibidores de la bomba de protones asociados con sucralfato y el tiempo de cicatrización puede variar de 8 semanas hasta 6 meses12,13,56. En casos de las fístulas gastrogástricas o de bolsas de gran tamaño e intratabilidad de la úlcera, será necesario la revisión del procedimiento quirúrgico12,13,53.
Impactación con bolo alimenticioLos pacientes sometidos a la cirugía de Capella tienen una bolsa gástrica de pequeño tamaño cuyo vaciamiento es limitado por el anillo de silicona. En la derivación gástrica en Y de Roux sin anillo, la anastomosis tiene menor calibre y también limita el vaciamiento de la bolsa. En algunas situaciones, por equívoco o por abuso alimenticio, dificultad de masticación o estenosis de la anastomosis o del anillo, estos pacientes podrán presentar alimentos o bolos alimenticios impactados en la bolsa. En estos casos el paciente se quejará de sialorrea, disfagia, odinofagia, náuseas y vómitos de inicio abrupto19,59. Algunos refieren mejora parcial y temporal con vómitos y son capaces de ingerir pequeños volúmenes de agua, lo que puede ser explicado por un probable mecanismo valvular. El examen endoscópico debe ser realizado con especial cuidado para evitar que se produzca aspiración bronquial59. El bolo alimenticio que normalmente estará libre en la bolsa gástrica puede ser constituido de carne, semillas de frutas o de otros alimentos menos comunes. El endoscopista debe evaluar el tamaño y la consistencia del material impactado y elegir el mejor accesorio y la técnica más adecuada, para retirarlo59,60. Se puede utilizar un asa de polipectomía, una cesta de Dormia, pinzas de biopsias o de cuerpo extraño y el bolo alimenticio podrá ser retirado por la cavidad oral, fragmentado y empujado más alla del anillo y de la anastomosis o aspirado utilizándose un cap de ligadura elástica59,60. Después o durante la remoción del bolo alimenticio el endoscopista hará el examen endoscópico completo en busca de alteraciones obstructivas que expliquen la impactación. La importancia de la identificación de la alteración radica en la conducta a ser adoptada: apenas una reorientación alimentaria o la resolución endoscópica o quirúrgica del factor obstructivo19,59.
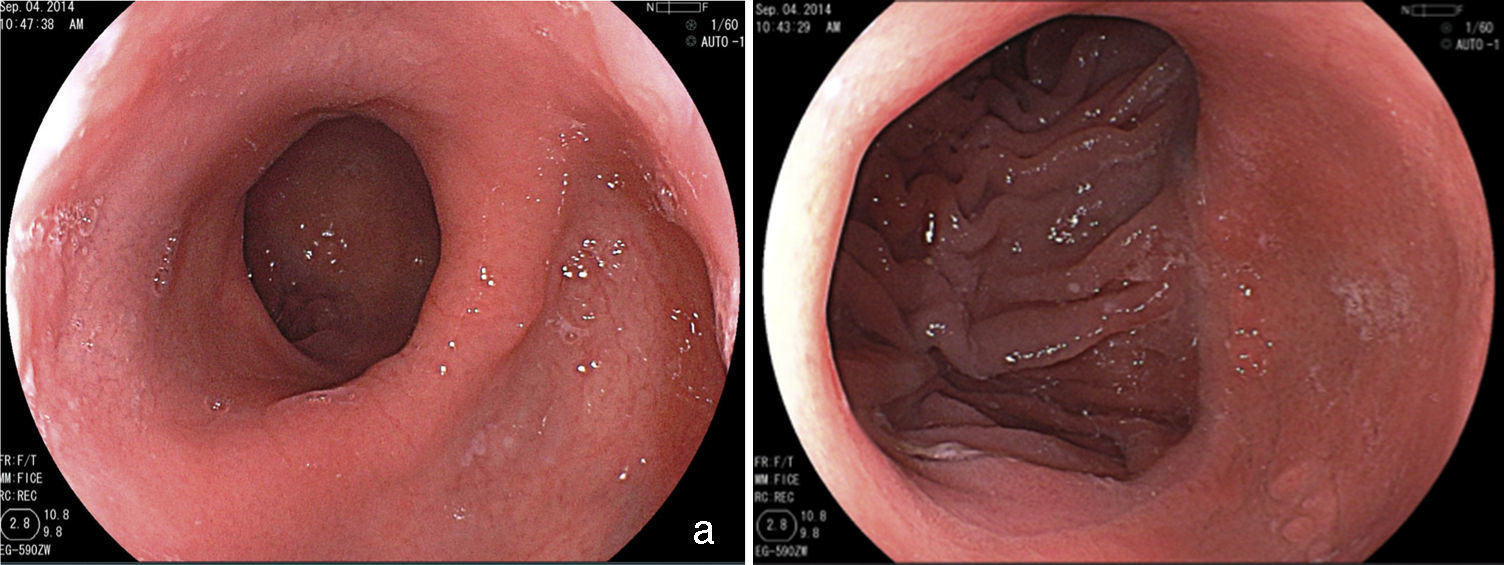
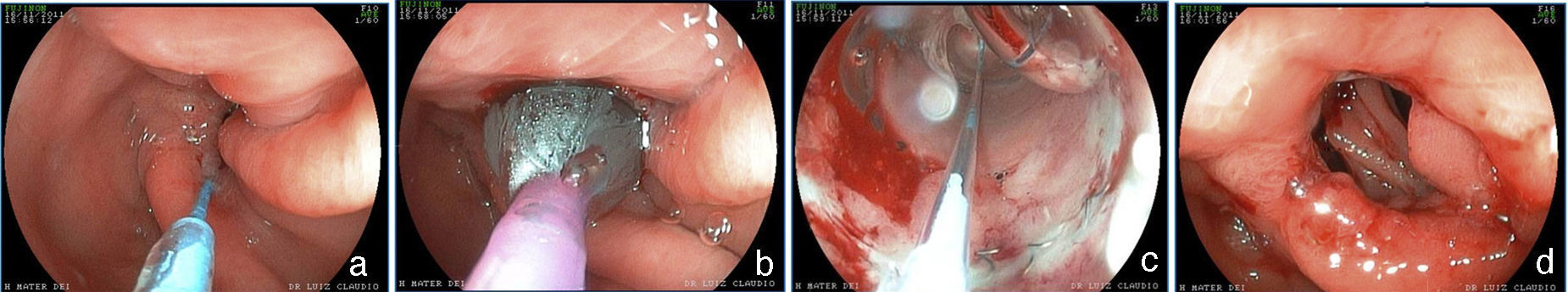
Estenosis de la anastomosis y del anilloLa estenosis de la anastomosis gastroyeyunal en la derivación gástrica en Y de Roux ocurre con frecuencia del 3 al 19%61–63. Esta variación se explica en parte por las diferencias en la técnica64. En la derivación gástrica sin anillo se intenta hacer una anastomosis con menor calibre, siendo la incidencia de estenosis ligeramente mayor65. En el acceso laparoscópico la incidencia es mayor (5 a 12%) que en la cirugía abierta (3 a 5%)62,66. Esto deriva generalmente de alguna complicación de la técnica quirúrgica, tales como: dehiscencia, hematoma o ulceración, procesos que producen fibrosis y retracción13,19,67. El paciente puede presentar dificultad para alimentarse, especialmente con alimentos sólidos, náuseas y vómitos, entre 4 y 10 semanas después de la cirugía60,65,67. El aspecto endoscópico es de una anastomosis con estenosis anular, fibrótica, de calibre puntiforme, impidiendo el paso del endoscopio13,67, a veces con una úlcera en la mucosa adyacente67. El tratamiento es endoscópico mediante dilataciones con balones hidrostáticos introducidos por el canal de trabajo del endoscopio y que permiten el paso de un hilo-guía67–69 (fig. 6). Se debe tener cautela al pasar el balón por la estenosis puntiforme, pues distalmente a la estenosis tenemos el asa aferente, que es ciega y la porción intestinal de la anastomosis13,67. De esta forma, para evitar complicaciones como perforación, que ocurre en un promedio de 2.2% de los casos67, el balón debe ser pasado cuidadosamente en dirección al asa eferente, lo que es facilitado por el paso previo de un guía, que puede ser monitorizado por fluoroscopia11. Normalmente la dilatación inicial, lo mismo que en las estenosis puntiformes, puede alcanzar hasta 15mm70. No obstante, la dilatación progresiva, hasta 12mm en la primera sesión y hasta 13.5 y 15mm en las sesiones subsecuentes, realizadas después de 7 o 15 días, parece ser más seguro y con menor índice de complicaciones11,12. En la derivación gástrica sin anillo, algunos autores recomiendan no exceder 12 a 13mm, considerando la posibilidad de que resulte en una anastomosis muy amplia, lo que podría tener impacto en la pérdida de peso a largo plazo71,72. Se ha reportado la dilatación con dilatadores de Savary-Gilliard y en una revisión que comparó a los dos métodos, el resultado fue semejante, con necesidad de 2 o 3 dilataciones y con tasa de complicaciones de 3%67. No obstante la dilatación progresiva con balón guiado, principalmente en las estenosis puntiformes, parece ser más segura y efectiva13,73. La mayoría de los casos se resuelven en dos o en un máximo de tres sesiones, con un índice de resolución de 95 hacia 100%67–69,74. El anillo con calibre disminuido llevando a una estenosis es menos común, ocurriendo en 1 a 2% de los pacientes21. El cuadro clínico es semejante al de la estenosis de anastomosis. En el examen endoscópico, la mucosa en la región de la anastomosis se presenta intensamente edematizada y no existe el aspecto fibrótico y de cicatrización, sugiriendo que se trata de una compresión extrínseca del anillo muy justo. A veces, al aproximar el endoscopio por el anillo es posible identificar distalmente a la línea de anastomosis con calibre normal32. La dilatación con balón de hasta 20mm no es efectiva y, eventualmente, puede empeorar el cuadro debido a la reacción inflamatoria y al edema ocasionado por la compresión de la mucosa contra el anillo75. Una opción es la dilatación con balón de acalasia (30mm), posicionado como una guía de Savary-Gilliard76. El objetivo es la rotura del hilo que sustenta internamente el anillo o solo el aumento definitivo del diámetro debido a la elasticidad del hilo (fig. 7). Es una técnica compleja, debe realizarse bajo fluoroscopia y tiene un potencial de complicación, principalmente el de perforación. Además de esta alternativa el tratamiento quirúrgico debe ser considerado.
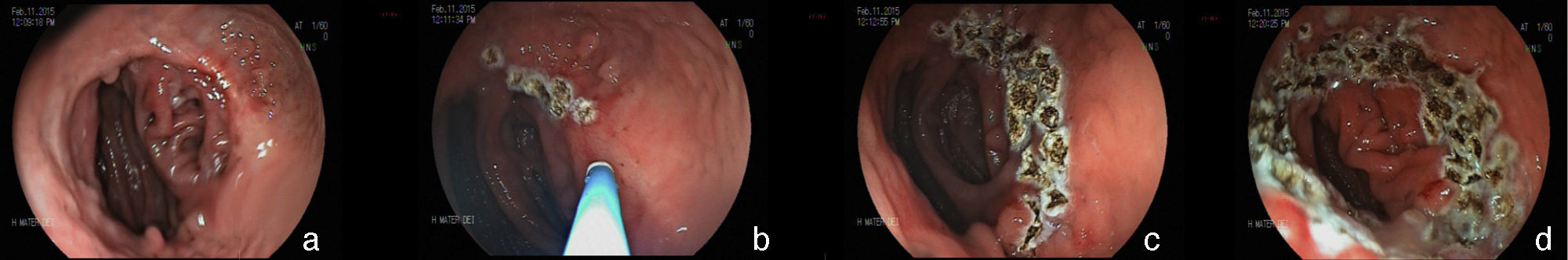
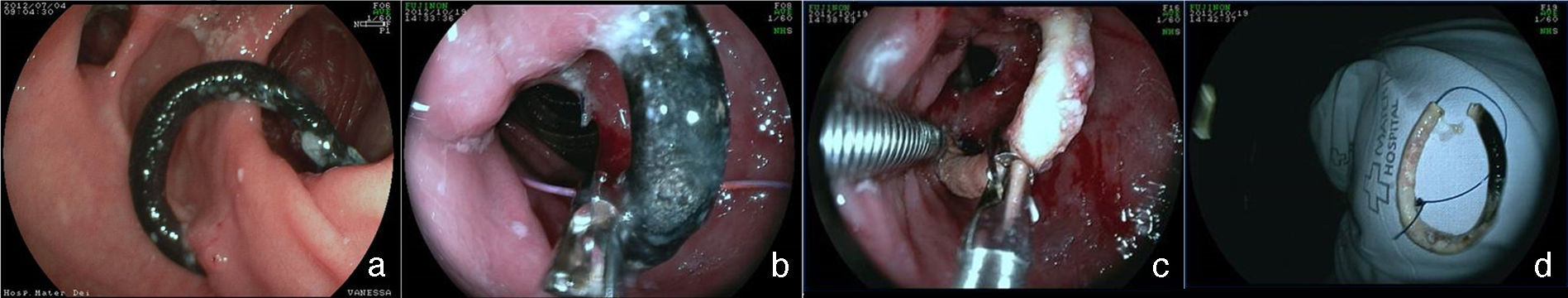
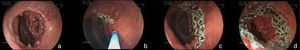
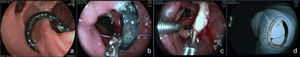
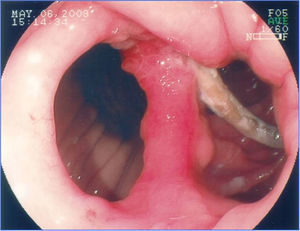
Una complicación del anillo es la ulceración de la mucosa por él comprimida y su migración parcial o total para la luz gástrica. La incidencia global de la migración del anillo para la luz en grandes series es alrededor de 1.6%21,59. Esta complicación ocurre en el 0.9% de las cirugías primarias, en el 5.5% de las reintervenciones y en el 28.5% de las cirugías con recolocación del anillo después de una migración previa del mismo77. La migración del anillo comienza con una reacción inflamatoria entre el anillo y la pared gástrica. La causa es la colocación del anillo de forma muy justa, la sutura del mismo al estómago o la presencia de infección local75. Esta complicación puede ser asintomática o, más comúnmente presentarse como un síndrome de obstrucción, provocando náuseas, vómitos y pérdida de peso. Otros síntomas posibles son el dolor epigástrico, la disfagia y más raramente anemia, hematemesis o melena32. La endoscopia permite el diagnóstico preciso, mostrando la erosión o ulceración con migración parcial del anillo. El tratamiento puede ser expectante, endoscópico o quirúrgico. La vigilancia puede estar indicada en aquellos pacientes asintomáticos, en que la pérdida de peso es satisfactoria y en quienes apenas una pequeña porción del anillo se encuentra migrada. La remoción es el tratamiento de elección78. Normalmente, es realizada la sección del anillo utilizando una tijera endoscópica o una guía acoplada a un sistema de litotripsia mecánica (fig. 8), de igual manera que la remoción de la banda gástrica migrada78,79. En ocasiones puede ser necesario el auxilio de un canal extra en el endoscopio26. Otra posibilidad de remoción del anillo migrado, erosionado o estenosado es el paso de una prótesis autoexpansidble que induce la migración completa del anillo y después de 6 a 8 semanas la prótesis y el anillo son removidos conjuntamente79,80. Se debe estar alerta a la posibilidad de la formación de una fístula, aunque esto sea raramente descrito, ciertamente por el intenso proceso de fibrosis que envuelve la región, mismo motivo por el cual el tratamiento quirúrgico es técnicamente difícil13,32. El efecto de la remoción del anillo sobre la pérdida de peso y el mantenimiento de esta pérdida aún no está definido. La reganancia de peso (de 61 a 75% del peso perdido) puede ocurrir en cerca del 14% de los pacientes cuando el anillo es removido en los primeros 6 meses, en comparación con el 6% cuando la remoción ocurre después de este período77. El deslizamiento del anillo es una complicación todavía más rara y ocurre en menos del 1% de los casos21,59. La fijación indadecuada del anillo puede llevar al desplazamiento, normalmente de su porción anterior, hasta la región de la anastomosis. El cuadro clínico es el de obstrucción, con vómitos y pérdida excesiva de peso60. El estudio radiológico muestra el anillo fuera de su posición habitual. El aspecto endoscópico es característico con la bolsa un poco dilatada, sin la compresión anular de su porción más distal y con la mucosa yeyunal parcialmente evertida, pudiéndose notar la compresión del anillo en algún lugar del asa, llevando a una estenosis puntiforme75. Por lo general, no es posible pasar el endoscopio, notándose residuos de alimentos en la bolsa o incluso en una de las asas. Aunque hayan sido relatadas las técnicas de la dilatación del anillo con balón de acalasia de 30mm76 o de la colocación de prótesis para tratar esta complicación78,80, el abordaje quirúrgico con remoción del anillo es realizado con más frecuencia.
Remoción del anillo migrado para la luz de la bolsa, poscirugía de derivación gástrica. a) Anillo migrado. b) Pasaje de la guía a través del anillo. c) Sección del anillo con sistema de litotripsia (izquierda) y pinza de cuerpo extraño (derecha) sujetando al anillo. d) Anillo después de su remoción.
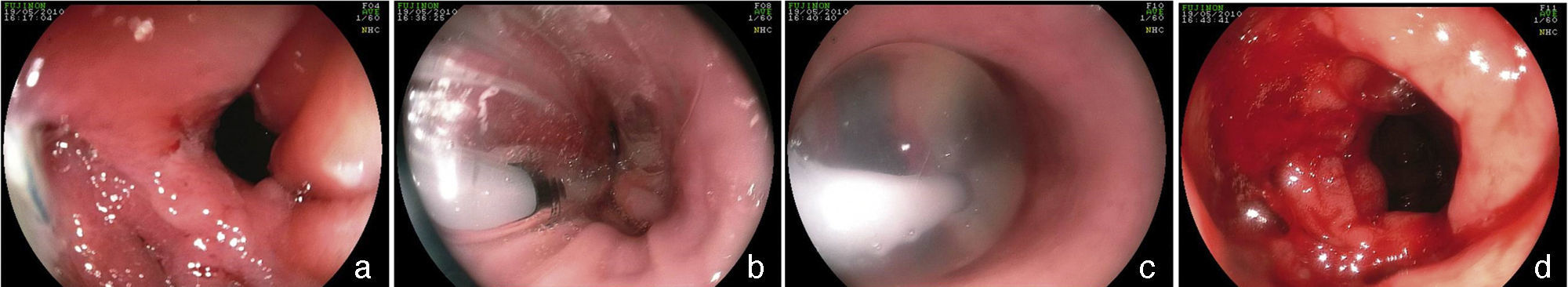
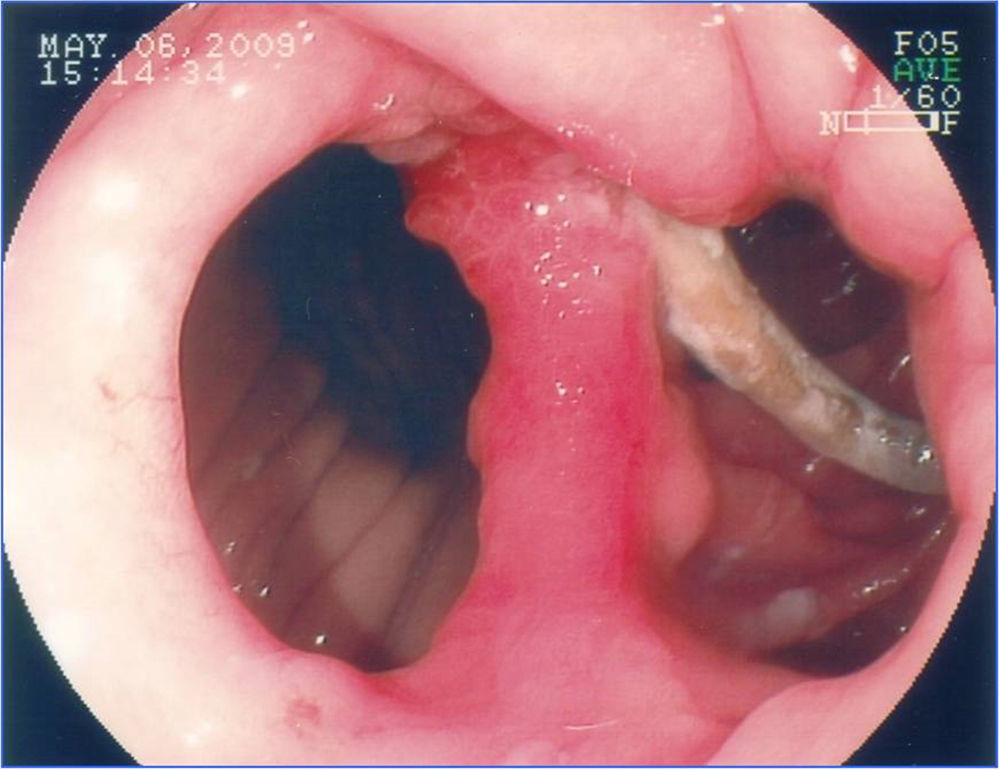
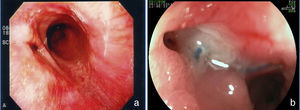
La incidencia de fístulas en la cirugía bariátrica varía con la técnica, con el número de pacientes y el período analizado y si se trata de series endoscópicas o quirúrgicas y estaba anteriormente estimada entre 0.4 hasta 26% de los casos21,49,81. Sin embargo, con la mejora de las cirugías hubo una disminuición significativa en esta tasa y se estima actualmente que las fístulas ocurran en 2.05 a 5.2% después de una derivación gástrica laparoscópica, en 1.68 a 2.60% después de una derivación abierta y en 0.6 a 7% después de una gastrectomía vertical82–85. Esta incidencia puede llegar hasta el 8% cuando la cirugía es realizada debido a una conversión de otra técnica59. Es una de las complicaciones más graves y es la segunda causa de muerte en la cirugía bariátrica, con una tasa de mortalidad de hasta 1.5%86,87. Las fístulas pueden ser gastrocutáneas, internas (gastrogástrica o gastroenteral) o pueden ser consideradas complejas, afectando la bolsa gástrica y algun órgano adyacente o distante87. La fístula gastrocutánea ocurre después de un cuadro precoz de sepsis abdominal, debido a peritonitis o absceso localizado, tratado con intervención quirúrgica y/o drenaje87. En la fístula gastrogástrica o gastrointestinal la manifestación clínica es tardía, con pérdida de peso inadecuada o con readquisición de peso, dolor epigástrico (debido a una úlcera marginal) y reflujo, pero puede ser subclínica, asintomática y con pérdida de peso satisfactoria13. La endoscopia define la presencia del orificio fistuloso y lo caracteriza en relación a su localización, tamaño del orifício interno y la presencia de cuerpo extraño (hilo de sutura) en la mucosa adyacente. La fístula gastrocutánea ocurre más comúnmente en la anastomosis gastroyeyunal y en la porción alta de la línea de sutura de la bolsa gástrica (derivación) o del muñon gástrico (gastrectomía), adyacente a la transición esofagogástrica (fig. 9), ciertamente por una deficiencia en la vascularización en este punto14,87. En la fístula interna observamos una amplia comunicación con el asa intestinal o con el estómago excluido (fig. 10). En las dos situaciones se puede diagnósticar una estenosis distal, relacionada con el anillo y a la anastomosis en la derivación gástrica o una angulación excesiva en la porción final de la zona tunelizada de la gastrectomía vertical. Estos factores son considerados predisponentes y mantenedores de las fístulas86. La endoscopia puede identificar otras alteraciones como la migración interna del anillo en la derivación, tortuosidad y dilatación de la porción tubular en la gastrectomía vertical y la presencia de septos de mucosa adyacentes al orificio fistuloso. El estudio contrastado de la fístula puede ser realizado para la demostración y delimitación del trayecto fistuloso, diagnóstico de comunicaciones con otros órganos, diagnóstico de fístulas complejas y, especialmente, para la evaluación de la dificultad del vaciamiento relacionada con estenosis distales a la fístula13,19. Las fístulas, después de las cirugías bariátricas, son tratadas con soporte nutricional, supresión de las secreciones gastrointestinales, tratamiento de la infección y excisión quirúrgica del orificio fistuloso14. La endoscopia puede ayudar en estas medidas generales con procedimientos como el pasaje de una sonda nasoentérica que permite la nutrición, excluyendo así el tránsito en la región de la fístula, remoción de cuerpos extraños en la región del orificio, colocación, tracción y reposicionamiento de los drenajes o sondas en las cavidades y colecciones y, sobre todo, tratando eventuales estenosis distales a la fístula84. Este tipo de tratamiento es de considerable valor y permite conllevar al cierre de hasta el 85% de las fístulas88. Sin embargo, algunas veces este abordaje puede ser demorado, de alto costo y no lograr el éxito esperado. En estos casos se sugiere el tratamiento endoscópico específico dirigido a la fístula gastrocutánea que puede llevar al cierre o contribuir para una resolución más rápida, disminuyendo el tiempo de internación y la morbilidad86. El cierre de la fístula puede requerir la oclusión no solo del orificio fistuloso, sino de todo su trayecto. Esto ha sido intentado con la inyección endoscópica de sustancias como pegamentos biológicos o sintéticos, colocación de matriz acelular en forma de tiras o conos en el trayecto o en el orificio fistuloso, aplicación de endoclips y en casos especiales con la colocación de prótesis autoexpandibles13,14,86. Más comúnmente, se utiliza una combinación de técnicas. Para indicar una técnica endoscópica de tratamiento de fístulas es necesario cerciorarse que el factor de mantenimiento de la misma haya sido resuelto, como infección, cuerpo extraño y obstrucción distal. Una de las opciones de tratamiento endoscópico de las fístulas poscirugía bariátrica es la colocación de prótesis autoexpanbibles, parcial o totalmente recubiertas86,89. En el caso de las fístulas poscirugía bariátrica es necesario utilizar prótesis especiales que pueden ser removidas90. Inicialmente fueron usadas las prótesis plásticas y después las metálicas89,90. La prótesis autoexpandible recubierta forma una barrera física entre la fístula y el contenido endoluminal, favoreciendo la cicatrización mientras permite la nutrición enteral91. Poli et al.92 revisaron 67 casos de fístulas después de derivaciones gástricas en Y de Roux, de gastrectomías verticales, de switch duodenal y de gastroplastias verticales con bandas tratados con la colocación de prótesis. Los resultados mostraron cierre de las fístulas en el 87.7% de los casos, con un rango entre 79 a 94% (intervalo de confianza de 95%). El intervalo de tiempo entre la colocación y la retirada de las prótesis, varió en la mayoría de los estudios entre uno y 2 meses. Seis de los 67 pacientes (9%) fueron sometidos a tratamiento quirúrgico tras el fracaso del cierre con la colocación de hasta dos prótesis. Hubo migración del stent en 16.9% de los casos, relacionada al diseño de las prótesis o tipo de cirugía, y no con la técnica endoscópica de la colocación. La remoción endoscópica de las prótesis fue posible en casi 92% de los casos, las causas de falla fueron hiperplasia del tejido y migración. Hay relatos de dificultad en la retirada de las prótesis, con complicaciones graves como hemorragia, remoción en pedazos e incluso mucosectomía. Existen casos de colocación de prótesis plástica dentro de la prótesis metálica para facilitar su remoción93. Considerando las dificultades y complicaciones de la retirada, de la tasa de migración y de los distintos detalles anatómicos de las técnicas quirúrgicas, será necesario el desarrollo de prótesis específicas para que sean utilizadas en las fístulas poscirugía bariátrica86,91. Aunque el tratamiento de las fístulas con prótesis parece promisor, todavía faltan datos controlados para recomendar su uso rutinário14,90. Estos accesorios deben tener tamaño y calibre diferenciados (adaptados a la anatomía quirúrgica), sistema antimigración y mecanismo de remoción seguro o que sean biodegradables13,86,90. Por fin, nos parece que la tendencia para el papel de la endoscopia en las fístulas será en dos situaciones: primero en la colocación de prótesis en los casos precoces93, segundo en la dilatación vigorosa de eventuales estenosis distales en los casos crónicos19. En los casos de fístulas gastrogástricas y gastrointestinales el tratamiento clásico es quirúrgico, que puede cursar con una morbimortalidad dos veces superior a la primera cirugía. Considerando los problemas de las reintervenciones quirúrgicas, inclusive el fracaso en el cierre de las fístulas, se sugiere el tratamiento endoscópico. En los últimos años, publicaciones con pequeñas series o relatos de casos muestran la posibilidad de la sutura endoscópica de estos defectos, utilizando accesorios como el Endo-Cinch94, clips especiales (Ovesco)95, StomaphyX96 y Apollo OverStitch97 o el intento de cierre del orificio utilizando prótesis, pegamento biológico y debridamiento por coagulación con argón plasma y algunas veces utlizando una combinación de dos o más métodos90. Todas las técnicas se muestran factibles, aunque la durabilidad de estas suturas endoscópicas todavía carece de evaluación y de seguimiento a largo plazo, especialmente en las grandes comunicaciones de la bolsa con el estómago y/o el intestino86,90.
La incidencia de litiasis biliar después de la cirugía bariátrica es alta, ciertamente debido a la rápida pérdida de peso98. Hasta el 36% de los pacientes desarrollan colecistolitiasis, por lo general en los primeros 6 meses de postoperatorio99. Aproximadamente el 30% de los cirujanos realizan la colecistectomía durante la cirugía bariátrica en pacientes con vesícula normal19,100. Otros consideran que esta conducta no es justificable101. Considerando la alta incidencia de litiasis biliar en los pacientes operados, en la presencia de síntomas, con exámenes de laboratorio y ultrasonográficos sugestivos de litiasis, se debe realizar de forma sistemática la colangiorresonancia magnética para el diagnóstico de coledocolitiasis que ocurre en el 4.7 a 7% de estos pacientes11. En la presencia de coledocolitiasis el tratamiento no quirúrgico estandarizado es a través de la colangiografía y la papilotomía endoscópica. Este abordaje en la derivación gástrica es limitado debido a la imposibilidad del acceso oral. Algunas técnicas fueron propuestas para realizar la colangiografía y la papilotomía endoscópicas después de la derivación gástrica. Este abordaje puede ser endoscópico o combinado con laparoscopia y endoscopia13,102. Las soluciones incluyen la enteroscopia por balones, gastrostomía percutánea en el estómago excluido o acceso endoscópico transgástrico asistido por laparoscopia103–107. La tasa de éxito utilizando enteroscopia alcanza el 84% de los pacientes19,106,107. Las desventajas de este método son la falta de accesorios con una longitud compatible con el enteroscopio, la falta del elevador y limitaciones del endoscopio de visión frontal para la terapéutica biliopancreática19. La gastrostomía percutánea, realizada por métodos radiológicos, o en el momento de la cirugía bariátrica, ofrece la posibilidad de múltiples accesos, pero requiere tiempo para madurar y como no puede ser rápidamente removida es un tanto molesta102. Entre las opciones, la colangiografía y papilotomía endoscópicas por acceso transgástrico asistido por laparoscopia, ha sido relatada como la mejor opción, con alta tasa de éxito y bajo riesgo, especialmente en pacientes colecistectomizados. Esta técnica es segura, reproducible, utiliza equipamientos y accesorios conocidos y disponibles y técnicas laparoscópicas y endoscópicas estandarizadas102,104,105. Si el paciente se presenta en el postoperatorio con colecistolitiasis y coledocolitiasis el cirujano realizará la colecistectomía y podrá tratar la coledocolitiasis por cirugía o por abordaje combinado, colecistectomía más la creación de un acceso transgástrico para la papilotomía endoscópica11,12. Existen variaciones técnicas en este método que incluyen la manera en que el cirujano realiza y prepara el accceso al estómago (utilizando puntos, trócar u otro tubo) y cómo el endoscopista pasa y posiciona el duodenoscopio (directamente o guiado por el cirujano)102.
El estómago excluido en la derivación gástricaEl estómago excluido en la cirugía de desvío gástrico no puede ser examinado por las técnicas endoscópicas o radiológicas habituales108. La duodenogastroscopia, utilizando un colonoscopio pediátrico, introducido de forma retrógrada por el asa yeyunal hasta el segmento excluido, fue realizada con éxito en un 68% de 77 intentos109. No obstante, nos parece que esta técnica solo es posible en casos selecionados cuando se utiliza una gastroyeyunostomía para la reconstrucción y en los casos de Y de Roux corto con anastomosis enteroentérica laterolateral amplia. El método de acceso a través de un asa larga actualmente resulta prácticamente imposible. Algunas publicaciones han demostrado éxito y seguridad en accesar el estómago excluido con el uso del enteroscopio de balón (simple o doble)110,111. Las indicaciones del uso de este método varían entre dolor epigástrico, anemia, pérdida excesiva de peso, sangramiento activo y sangramiento oculto. En el análisis de 12 pacientes con sangramiento oculto y con la anatomía alterada por Y de Roux, siendo 6 por derivación gástrica, los hallazgos principales fueron de úlcera de la anastomosis, neovascularización perianastomosis y lesiones de Dieulafoy112. En contraste, otra serie de enteroscopia en 35 pacientes con Y de Roux, pero con indicación de dolor epigástrico, los hallazgos predominantes fueron erosiones y úlceras en el estómago en un 35% de los casos y pocos diagnósticos de úlceras y neovascularización perianastomosis113. En un paciente con 10 años de derivación gástrica, presentando melena y anemia grave, el examen del estómago excluido en Y de Roux con enteroscopia de doble balón, mostró pangastritis erosiva hemorrágica grave, que fue adecuadamente tratada con altas dosis de inhibidores de bomba114. En algunas series en que fue posible el examen del estómago excluido, fue constatada gastritis crónica superficial en 87%, confirmada histológicamente en 42%, con 10% de metaplasia intestinal, hallazgos de significado oscuro110,111. La produción de ácido fue menor que en la población normal y el H. pylori fue negativo en un 70% de los casos, lo que sugiere que el estómago excluido sea menos ulcerogénico108. No obstante, la úlcera péptica puede ocurrir en el estómago excluido, inclusive en forma perforada o hemorrágica con incidencia inferior a 0.3%113,115. El tiempo promedio entre la cirugía y el episódio hemorrágico es en media de 9.5 años. En una revisión de la literatura hay relatos de cinco casos de cáncer gástrico en el estómago excluido de la derivación gástrica, siendo uno después de 13 años, tres después de 9 años y otro después de 5 años de cirugía116. La incidencia es extremamente baja, considerando el gran número de cirugías bariátricas realizadas. De esta forma, se estima en menos del 1% la necesidad real del examen endoscópico del estómago excluido108,109.
FinanciamientoLos autores declaran que no se recibió patrocinio de ningún tipo para llevar a cabo este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.