La infección por Helicobacter pylori (Hp) presenta alta prevalencia mundial, asociada a gastritis hasta cáncer gástrico. Informes sugieren que el alcohol tiene acción antibacteriana; su concentración y cantidad de ingesta, disminuyen el riesgo de infección por Hp; en contraste, diversos estudios relacionan el tabaco y el consumo de café como factores de riesgo para infección por Hp, siendo controvertido.
ObjetivosComparar la frecuencia del consumo de alcohol en pacientes con infección por Hp con aquellos sin infección y secundariamente comparar la asociación de tabaquismo y consumo de café con infección por Hp.
Material y métodosEstudio de casos y controles realizado en trabajadores del estado de Sinaloa, que fueron sometidos a endoscopia y prueba serológica de Hp. Se definió caso a pacientes con test sérico para Hp o biopsia con prueba rápida de ureasa positivos. El consumo de alcohol se categorizó como: no consumo, bajo riesgo y en riesgo. Muestra: 269 sujetos por grupo. Se estimaron la razón de momios y los intervalos de confianza del 95%.
ResultadosLa edad promedio ± desviación estándar de los sujetos fue de 45.7 ± 9 años en ambos grupos (p=0.99); el género se distribuyó en 139 mujeres (51.7%) y 130 hombres (48.3%); consumo de alcohol 108 (40.1%) y 85 (31.6%) en casos y controles, respectivamente (p=0.039), RM 1.45 (IC del 95%, 1.019-2.069). La cantidad en gramos de alcohol en sujetos con consumo en riesgo fue significativa; sin embargo, no hubo diferencias significativas en relación con el consumo de tabaco y café entre los grupos.
ConclusionesSe observó asociación entre el consumo de alcohol y la infección por Hp, sin asociación a tabaquismo y consumo de café.
There is a high prevalence worldwide of Helicobacter pylori (Hp) infection associated with gastritis and extending to gastric cancer. Reports have suggested that alcohol has antibacterial action and that its concentration and the amount consumed reduce the risk for Hp infection. In contrast, different studies suggest that tobacco and coffee consumption are risk factors for Hp infection, but their results are controversial.
AimsTo compare the frequency of alcohol consumption in patients infected by Hp with that of non-infected subjects and, as a secondary aim, to compare the association of smoking and coffee consumption with Hp infection.
Material and methodsA case-control study was conducted on Sinaloa State workers that underwent endoscopy and the Hp serology test. Cases were defined as patients with a positive Hp serology test or a positive biopsy with the rapid urease test. Alcohol consumption was categorized as: no consumption, low-risk, and at-risk. The sample included 269 subjects per group. Odds ratio (OR) and 95% confidence interval (CI) were calculated.
ResultsIn both groups, the mean age of the subjects was 45.7 (SD: 9) years (P=.99), 139 of the subjects were women (51.7%) and 130 were men (48.3%); alcohol consumption was present in 108 (40.1%) and 85 (31.6%) of the cases and controls, respectively (P=.039), OR 1.45 (95%CI 1.019-2.069). The quantity of grams of alcohol in subjects with at-risk consumption was significant; However, there were no significant differences in relation to smoking and coffee consumption between the groups.
ConclusionsAn association between alcohol consumption and HP infection was observed and no relation with HP infection was found with respect to smoking and coffee consumption.
El Helicobacter pylori (Hp) es una bacteria que infecta la mucosa del epitelio del estómago humano. Marshall y Warren, en 1981, aislaron este microorganismo y lo cultivaron de la mucosa gástrica, determinando que muchas de las úlceras gástricas y gastritis estaban causadas por la colonización del estómago por esta bacteria1. La infección por Hp es la más común en el mundo y está asociada a enfermedades del aparato gastrointestinal, incluyendo la gastritis crónica, la dispepsia funcional, la enfermedad ulcerosa péptica y el cáncer gástrico. La evidencia epidemiológica indica que la mayoría de las infecciones por Hp son adquiridas en la infancia2. La prevalencia está asociada a las condiciones socioeconómicas, siendo esta infección más común en países en vías de desarrollo que en países desarrollados como los Estados Unidos3. Se estima que la prevalencia de infección por Hp en los Estados Unidos es del 30-40%4. En México se han reportado prevalencias del 79% en población abierta5 y hasta del 87% en pacientes6; la encuesta nacional que utilizó serología como método de escrutinio mostró una prevalencia del 66% por infección de Hp7. El mecanismo de transmisión de la infección por Hp es oral-oral o fecal-oral, así como por contaminación del agua8. El potencial patogénico de las cepas circulantes de Hp ha sido considerado como un factor decisivo en la evolución de la infección y en el desarrollo de cáncer gástrico9, así como relacionado con factores condicionados a circunstancias geográficas y raciales10. Algunos autores en Reino Unido manifestaron que los factores del estilo de vida durante la adultez, como el tabaquismo y el alcohol, podrían influir en una erradicación espontánea del Hp11. Existen informes que indican que el alcohol tiene una acción antibacteriana, dependiendo de su concentración y cantidad de ingesta, disminuyendo el riesgo de infección mediante la inducción de adaptación citoprotección como resultado de su uso a largo plazo, mientras que otros informan de que no hay diferencia de prevalencia entre los alcohólicos y la población normal12. Estudios experimentales en ratas han mostrado que la administración intragástrica de etanol produce adaptación de la mucosa gástrica y se asocia a mayor proliferación celular y aumento de la expresión de la mucosa del factor de crecimiento transformante alfa y el factor de crecimiento epidérmico; sin embargo, dicho mecanismo continúa sin explicación13. Los datos de la Encuesta Nacional de Adicciones en 2008 en México reportan que 8 de cada 1,000 personas informaron consumir todos los días, en una proporción de 7.5 hombres por cada mujer. La cerveza es la bebida de preferencia de la población mexicana. Le siguen los destilados y, en una proporción significativamente menor, el vino de mesa y las bebidas preparadas. Existen casi 4 millones de consumidores consuetudinarios (5 copas o más para el hombre o 4 o más para las mujeres una vez a la semana), siendo más frecuente en una proporción de 5.8 hombres por cada mujer14; cualquier nivel de consumo de alcohol implica riesgos para la salud15. Se han diseñado estudios a nivel mundial haciendo referencia a la presencia de infección por Hp con el consumo del alcohol. Apoyados en los antecedentes de publicaciones de diversos investigadores, y pretendiendo la contribución que tienen los hábitos de vida en nuestro entorno, como son principalmente el consumo del alcohol y, secundariamente, el café y el tabaco, como probables factores de riesgo, los cuales podrían cambiar y/o evitar afecciones gástricas o en su caso beneficios aún no identificados, se decidió realizar este estudio. La hipótesis planteada fue que la frecuencia del consumo de alcohol es menor en pacientes con infección por Hp que en aquellos que no la tienen. El objetivo del estudio fue comparar la frecuencia del consumo de alcohol en pacientes con infección por Hp con aquellos sin la infección, y como objetivos secundarios, la asociación de tabaquismo y consumo de café con la infección por Hp en dichos pacientes.
Material y métodosSe realizó un diseño observacional, longitudinal, comparativo, tipo estudio de casos y controles. Fue presentado y aprobado por la Comisión de Investigación y Ética del Hospital Regional del Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado en Culiacán, Sinaloa. La población estudiada se constituyó por pacientes adultos que acudieron a los servicios de consulta externa en esa unidad hospitalaria ubicada al noroeste de México, del 1 de enero del 2010 al 15 de agosto del 2011, así como pacientes incidentes del 1 de septiembre del 2011 al 15 de febrero del 2012. Se formaron 2 grupos: casos (n=269) y controles (n=269). Se definió caso: pacientes adultos con test sérico de anticuerpos contra Hp o biopsia por endoscopia con prueba rápida de la urea-ureasa positivos. Se definió control: pacientes adultos con test sérico de anticuerpos contra Hp o biopsia por endoscopia con prueba rápida de la urea-ureasa negativos. Los criterios de selección fueron: pacientes adultos de 25 hasta 60 años de edad, de uno u otro género, trabajadores del estado, originarios del estado de Sinaloa y que habían firmado el consentimiento informado; los criterios de exclusión fueron: pacientes con antecedentes de cirugía gástrica, ingesta reciente de inhibidores de la bomba de protones (2 semanas antes), antibióticos y sales de bismuto (4 semanas antes), con tratamiento previo contra el Hp; criterios de eliminación: errores en los resultados del laboratorio por mala técnica para el test del Hp.
Los sujetos del estudio fueron sometidos a endoscopia por los siguientes motivos: dispepsia con síntomas de alarma (sangrado digestivo, bajada de peso no intencionada), enfermedad orgánica (control cicatrización de úlcera duodenal), enfermedad por reflujo gastroesofágico en determinadas situaciones, como esofagitis y control en esófago de Barrett, y por dispepsia en estudio.
La variable independiente fue infección por Hp y la variable dependiente fue consumo de alcohol.
Operacionalización de las variables. Infección por Hp. Sobre la base de la prueba de inmunoanálisis cromatográfico rápido, se realizó detección cualitativa de anticuerpos Hp IgG, IgA e IgM en suero humano y o biopsia por endoscopia con prueba rápida de la urea-ureasa, kit utilizado: Hp Fast (GI Supply, Chek-Med Systems, Inc. PA, Estados Unidos). El test sérico negativo (ausencia de infección por Hp), cuando solo aparezca una sola línea de control violeta en la parte superior de la ventana y positivo (presencia de infección por Hp), cuando aparezca una segunda línea violeta de prueba en la parte baja de la ventana. La biopsia por endoscopia con prueba rápida urea-ureasa negativa (ausencia de infección por Hp) si el test no cambia de color, positiva (presencia de infección por Hp) un cambio en el color indicador de pH, de amarillo a rosa mexicano, en el término de minutos a 1h como máximo.
Consumo de alcohol. Se definió, según el Instituto Nacional para el Abuso de Alcohol y Alcoholismo de los Estados Unidos (NIAAA)16 y las Guías Alimentarias para los Estadounidenses del Departamento de Agricultura y de Departamento de Salud y Servicios Humanos de los Estados Unidos de América17,18, como:
- –
Consumo de alcohol de bajo riesgo a aquellos sujetos que consumen hasta una bebida por día para las mujeres y hasta de 2 bebidas para los hombres, o no más de 7 bebidas por semana en las mujeres y no más de 14 bebidas en los hombres.
- –
Consumo de alcohol en riesgo a aquellos sujetos que consumen más de 3 bebidas en un día o más de 7 bebidas a la semana en las mujeres y el consumo de más de 4 bebidas en un día o más de 14 bebidas por semana en los hombres.
- –
No consumo de alcohol a aquellos sujetos mujeres y hombres que no consumen bebidas alcohólicas.
Una bebida alcohólica se definió como 12 onzas de cerveza regular (5% de alcohol), 5 onzas líquidas de vino (12% de alcohol) o 1.5 onzas líquidas de 80° (40% de alcohol) en bebidas destiladas. Una bebida contiene 0.6 onzas (16 g) de alcohol.
Consumo de café. Se consideró consumidores de café a aquellos sujetos que tomaban diariamente una o más tazas de café actualmente y por más de un año. Se categorizó en no consumo de café con 0 tazas diarias, 1-2 tazas diarias y ≥ 3 tazas diarias19.
Tabaquismo. Se consideró tabaquismo en los sujetos que fumaron al menos un cigarrillo durante el último mes (en cualquier cantidad). No fumador es quien no ha fumado nunca cigarrillos o menos de 100 cigarrillos en su vida20. El grado de tabaquismo: fumador leve en sujetos que fumen menos de 5 cigarrillos diarios, fumador moderado en sujetos que fumen un promedio de 6 a 15 cigarrillos diarios y fumador severo en sujetos que fuman más de 16 cigarrillos por día promedio21.
Tamaño de la muestra. Se calculó una n de 269 sujetos con una potencia del 80% para detectar una diferencia entre las proporciones de 0.10 (Delta). La proporción en el grupo uno (el grupo del tratamiento) se asume que es 0.27 bajo hipótesis nula y 0.37 bajo hipótesis alternativa. El estadístico usado fue la prueba unilateral (una sola cola) de Z. El nivel de significación fue 0.05.
El muestreo fue aleatorio, estratificado por género y edad. El tipo de instrumento de medición fue observacional (para la medición de la variable infección por Hp se utilizó el test sérico para anticuerpos Hp y prueba rápida de la urea-ureasa) y la recolección de datos sobre el consumo de alcohol, café y tabaquismo (2 mediciones: consumo actual y consumo hace más de un año) se realizó a través del expediente clínico y por entrevista telefónica a los casos prevalentes y entrevista en consultorio a los casos incidentes.
El análisis estadístico se realizó con el paquete SPSS v. 16 (SPSS, Inc., Chicago, Estados Unidos). En estadística descriptiva para variables cuantitativas, se utilizó la media ± desviación estándar, así como para variables categóricas se presentaron en frecuencias y porcentajes. La comparación de medias se realizó con estadístico t de Student y para la comparación de variables categóricas, la prueba de la ji al cuadrado de Pearson (univariado). Para analizar la relación entre la variable dependiente y las independientes se utilizó un análisis de regresión logística (multivariado) por el método de pasos hacia atrás. Se estimó la razón de momios (RM) con intervalos de confianza del 95% con una p≤0.05.
ResultadosLos casos y los controles fueron constituidos por 269 sujetos cada uno. Los grupos fueron estratificados por edad y género; la edad promedio ± desviación estándar de los sujetos fue 45.7 ± 9 años en ambos grupos (p=0.99), y el género se distribuyó en mujeres 139 (51.7%) y hombres 130 (48.3%) en ambos grupos (p>0.05).
El diagnóstico de infección por Hp en el grupo casos fue por test sérico Hp en 214 (79.6%) pacientes y por endoscopia con prueba rápida de la urea-ureasa en 55 (20.4%) pacientes. En el grupo control fue por test sérico Hp en 199 (73.97%) pacientes y por endoscopia con prueba rápida de la urea-ureasa en 70 (26.03%).
Las indicaciones de endoscopias para el grupo casos fueron dispepsia en estudio 22(44%), enfermedad por reflujo gastroesofágico 16 (32%), dispepsia con síntomas de alarma 7(14%), control de esófago de Barrett 3(6%) y control de cicatrización de úlcera duodenal 2(4%). Las indicaciones de endoscopia para el grupo control fueron dispepsia en estudio 38 (54.3%), enfermedad por reflujo gastroesofágico 31(44.3%) y control de esófago de Barrett 1 (1.4%).
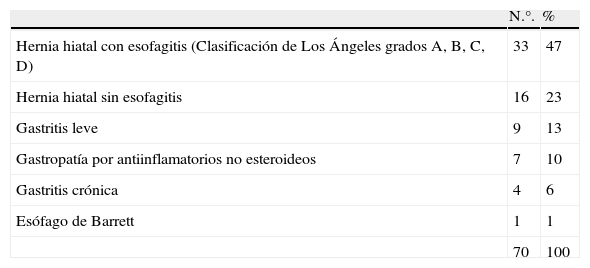
Para el grupo casos, los hallazgos endoscópicos más frecuentes fueron hernia hiatal con esofagitis (Clasificación de Los Ángeles grados A, B, C, D) en 20 (40%) y gastritis crónica 12 (24%) (tabla 1) y los hallazgos endoscópicos del grupo control más frecuentes fueron hernia hiatal con esofagitis (Clasificación de Los Ángeles grados A, B, C, D) con 33 (47%) y hernia hiatal sin esofagitis 16 (23%) (tabla 2).
Hallazgos de endoscopia en grupo casos
| N.°. | % | |
| Hernia hiatal con esofagitis (Clasificación de Los Ángeles grados A, B, C, D) | 20 | 40 |
| Gastritis crónica | 12 | 24 |
| Gastritis leve | 8 | 16 |
| Gastropatía por antiinflamatorios no esteroideos | 7 | 14 |
| Metaplasia intestinal | 1 | 2 |
| Esófago de Barrett | 1 | 2 |
| Cicatrización úlcera duodenal | 1 | 2 |
| 50 | 100 |
Hallazgos de endoscopia en grupo controles
| N.°. | % | |
| Hernia hiatal con esofagitis (Clasificación de Los Ángeles grados A, B, C, D) | 33 | 47 |
| Hernia hiatal sin esofagitis | 16 | 23 |
| Gastritis leve | 9 | 13 |
| Gastropatía por antiinflamatorios no esteroideos | 7 | 10 |
| Gastritis crónica | 4 | 6 |
| Esófago de Barrett | 1 | 1 |
| 70 | 100 |
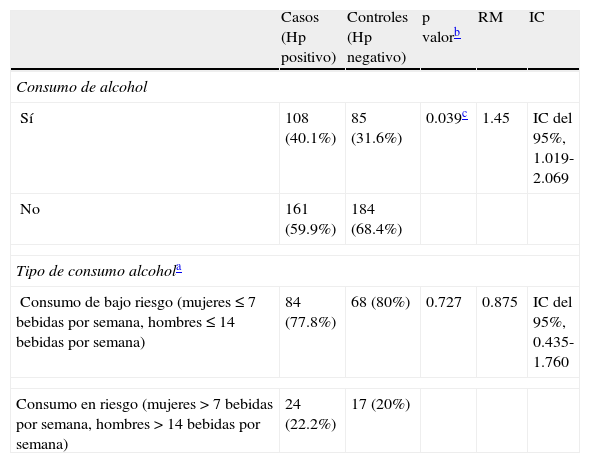
En relación con el consumo de alcohol, se presentó en 108 (40.1%) y 85 (31.6%) pacientes en casos y controles, respectivamente (p=0.039), con una RM 1.45 (IC del 95%, 1.019-2.069). Respecto al tipo de consumo de alcohol, no hubo diferencia significativa con el consumo de bajo riesgo y el consumo en riesgo en ambos grupos (p=0.727) (tabla 3).
Relación del consumo de alcohol con infección por Helicobacter pylori
| Casos (Hp positivo) | Controles (Hp negativo) | p valorb | RM | IC | |
| Consumo de alcohol | |||||
| Sí | 108 (40.1%) | 85 (31.6%) | 0.039c | 1.45 | IC del 95%, 1.019-2.069 |
| No | 161 (59.9%) | 184 (68.4%) | |||
| Tipo de consumo alcohola | |||||
| Consumo de bajo riesgo (mujeres ≤ 7 bebidas por semana, hombres ≤ 14 bebidas por semana) | 84 (77.8%) | 68 (80%) | 0.727 | 0.875 | IC del 95%, 0.435-1.760 |
| Consumo en riesgo (mujeres > 7 bebidas por semana, hombres > 14 bebidas por semana) | 24 (22.2%) | 17 (20%) | |||
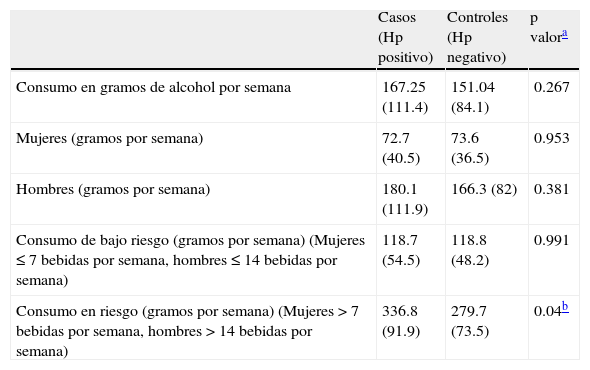
El promedio de gramos consumidos de alcohol en casos y controles fue 167.25 ± 111.4 y controles 151.04 ± 84.1, con una p=0.267; de acuerdo con el promedio de consumo en gramos de alcohol, en sujetos con consumo de bajo riesgo en casos y controles no fue significativo (p=0.991); sin embargo, en consumo de alcohol en riesgo en ambos grupos sí hubo diferencia significativa (p=0.04) (tabla 4).
Consumo en gramos de alcohol en casos y controles
| Casos (Hp positivo) | Controles (Hp negativo) | p valora | |
| Consumo en gramos de alcohol por semana | 167.25 (111.4) | 151.04 (84.1) | 0.267 |
| Mujeres (gramos por semana) | 72.7 (40.5) | 73.6 (36.5) | 0.953 |
| Hombres (gramos por semana) | 180.1 (111.9) | 166.3 (82) | 0.381 |
| Consumo de bajo riesgo (gramos por semana) (Mujeres ≤ 7 bebidas por semana, hombres ≤ 14 bebidas por semana) | 118.7 (54.5) | 118.8 (48.2) | 0.991 |
| Consumo en riesgo (gramos por semana) (Mujeres > 7 bebidas por semana, hombres > 14 bebidas por semana) | 336.8 (91.9) | 279.7 (73.5) | 0.04b |
Se reportan medias ± DE.
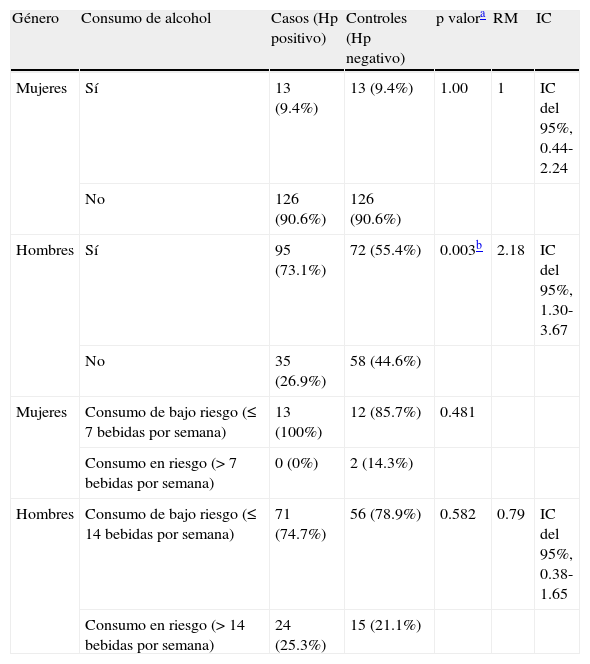
Se observó asociación de la infección por Hp y el consumo de alcohol en los hombres (p=0.003), con una RM 2.18 (IC del 95%, 1.30-3.67); en las mujeres no hubo diferencia significativa. Con respecto a la asociación de infección por Hp con el consumo de bajo riesgo y el consumo en riesgo con su relación con el género, no se observó diferencia significativa (tabla 5).
Relación del consumo de alcohol por género con infección por Helicobacter pylori
| Género | Consumo de alcohol | Casos (Hp positivo) | Controles (Hp negativo) | p valora | RM | IC |
| Mujeres | Sí | 13 (9.4%) | 13 (9.4%) | 1.00 | 1 | IC del 95%, 0.44-2.24 |
| No | 126 (90.6%) | 126 (90.6%) | ||||
| Hombres | Sí | 95 (73.1%) | 72 (55.4%) | 0.003b | 2.18 | IC del 95%, 1.30-3.67 |
| No | 35 (26.9%) | 58 (44.6%) | ||||
| Mujeres | Consumo de bajo riesgo (≤ 7 bebidas por semana) | 13 (100%) | 12 (85.7%) | 0.481 | ||
| Consumo en riesgo (> 7 bebidas por semana) | 0 (0%) | 2 (14.3%) | ||||
| Hombres | Consumo de bajo riesgo (≤ 14 bebidas por semana) | 71 (74.7%) | 56 (78.9%) | 0.582 | 0.79 | IC del 95%, 0.38-1.65 |
| Consumo en riesgo (> 14 bebidas por semana) | 24 (25.3%) | 15 (21.1%) |
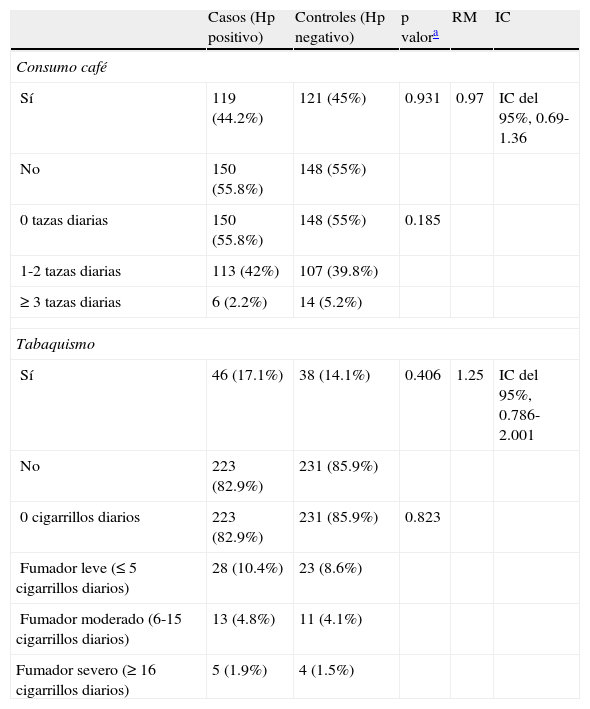
No hubo diferencia significativa entre la infección por Hp y el consumo de café, y la cantidad de ingesta de tazas diarias; tampoco se encontró significación estadística con tabaquismo ni con la cantidad de cigarrillos diarios entre ambos grupos (tabla 6).
Relación del consumo de café y tabaco con infección por Helicobacter pylori
| Casos (Hp positivo) | Controles (Hp negativo) | p valora | RM | IC | |
| Consumo café | |||||
| Sí | 119 (44.2%) | 121 (45%) | 0.931 | 0.97 | IC del 95%, 0.69-1.36 |
| No | 150 (55.8%) | 148 (55%) | |||
| 0 tazas diarias | 150 (55.8%) | 148 (55%) | 0.185 | ||
| 1-2 tazas diarias | 113 (42%) | 107 (39.8%) | |||
| ≥ 3 tazas diarias | 6 (2.2%) | 14 (5.2%) | |||
| Tabaquismo | |||||
| Sí | 46 (17.1%) | 38 (14.1%) | 0.406 | 1.25 | IC del 95%, 0.786-2.001 |
| No | 223 (82.9%) | 231 (85.9%) | |||
| 0 cigarrillos diarios | 223 (82.9%) | 231 (85.9%) | 0.823 | ||
| Fumador leve (≤ 5 cigarrillos diarios) | 28 (10.4%) | 23 (8.6%) | |||
| Fumador moderado (6-15 cigarrillos diarios) | 13 (4.8%) | 11 (4.1%) | |||
| Fumador severo (≥ 16 cigarrillos diarios) | 5 (1.9%) | 4 (1.5%) | |||
En el análisis de regresión logística por el método de pasos hacia atrás, el tabaquismo se eliminó en el primer paso (p=0.754), el consumo de café en el segundo paso (p=0.737) y en el tercer paso se encontró significación estadística (p=0.039) para el consumo de alcohol, con una RM 1.452 (IC del 95%, 1.019-2.069).
DiscusiónLos resultados de los estudios relacionados con la asociación entre infección por Hp y consumo de alcohol en riesgo siguen siendo controvertidos, ya que algunos autores no encontraron asociación entre los 2 factores22-24. Otros autores señalan un efecto protector del consumo de alcohol frente a la infección activa por Hp y un efecto contrario del consumo de café25,26. Algunos resultados concluyen que el tabaquismo y consumir alcohol son factores protectores para la infección por Hp27. Existen estudios en los cuales no se encontró asociación entre infección por Hp y consumo de alcohol y café; sin embargo, existe un factor de riesgo relacionado con el tabaquismo28. Algunos autores refieren que el consumo moderado de alcohol podría estar inversamente asociado a la seroconversión de Hp19,29. Sin embargo, se ha considerado, al estudiar la relación de factores como la dieta y el estado socioeconómico, que no existe asociación entre infección por Hp con consumo de alcohol, café y tabaquismo30.
En este estudio se observó relación entre el consumo de alcohol y la infección por Hp; el riesgo de presentar la infección es mayor en personas consumidoras de alcohol que en aquellas que no lo consumen, con una probabilidad de presentarlo hasta 1.45 veces más, con un intervalo de 1.01 a 2.06. Los hombres tienen 2 veces más riesgo, con un intervalo de 1.3 a 3.6 de infección por Hp que en mujeres; la cantidad de gramos por semana de consumo de alcohol en riesgo fue mayor en personas con la infección por Hp que en aquellos que no la tenían. El tabaquismo y el consumo de café no fueron factores de riesgo para la infección por Hp.
Estos resultados difieren de otros22,24,28 que no encontraron ninguna asociación entre consumo de alcohol y presencia de infección por Hp. Contrariamente, otros investigadores11,19,25-27 sugirieron un efecto protector del consumo de alcohol frente a la infección activa por Hp.
Brenner et al.25,26 encontraron que el consumo de café se asociaba a un incremento en el riesgo en infección por Hp, resultado no encontrado en este estudio. Sin embargo, Moayeddi et al.28 y Gikas et al.19 no encontraron asociación con consumo de café.
Referente al tabaquismo, Ogihara et al.27 concluyeron que el tabaquismo tiene efecto protector frente a la infección por Hp; así mismo Moayeddi et al.28 mencionaron que dicho hábito es un factor de riesgo, siendo dichos resultados diferentes de este estudio.
Otros estudios19,22,24 tuvieron resultados similares a este estudio al no encontrar asociación entre el tabaquismo y la infección por Hp.
La diversidad de los resultados podría estar en relación con diferentes condiciones entre los países (nivel socioeconómico, entorno ambiental, variabilidad biológica, etc.); también en los trabajos científicos suelen aparecer rangos de clasificación en todo caso arbitrarios, e inclusive dificultades en el adecuado control en la medición de las variables.
Los criterios del NIAAA16 señalan que el consumo de alcohol, dentro de las 2h, de 4 o más bebidas para las mujeres y 5 o más bebidas para los hombres denominado «binge drinking» (el cual puede traducir al español como «embriaguez» y considerarse como riesgoso no excesivo), al menos una vez a la semana, se asocia al desarrollo de dependencia al alcohol. Sin embargo, el «binge drinking» no se evaluó en este estudio, lo cual es una limitante. Este deberá tomarse en cuenta para futuros estudios epidemiológicos relacionados con el consumo de alcohol.
Este estudio, como todos los diseños de casos y controles, no involucra secuencia de tiempo, por lo tanto, no puede demostrar causalidad y es propenso a problemas de sesgos (calidad de la información, del recuerdo, selección de casos, entre otros), por lo que se consideraron las posibles fuentes de sesgos.
En conclusión, en el presente estudio se observó una asociación entre el consumo de alcohol y la infección por Hp. El riesgo de presentar infección por Hp es mayor en personas que consumen alcohol que en aquellas que no lo consumen; así mismo la cantidad de gramos por semana de consumo de alcohol en riesgo fue mayor en personas con la infección por Hp. No hubo asociación con el tabaquismo y el consumo de café.
FinanciaciónUniversidad Autónoma de Sinaloa en el Programa de Fortalecimiento y Apoyo a Proyectos de Investigación (PROFAPI-2011).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradeciendo el apoyo brindado por el personal de endoscopia y laboratorio del Hospital Regional del ISSSTE Culiacán, así como a la Universidad Autónoma de Sinaloa.