La disección endoscópica de la submucosa (DES) es un tratamiento bien establecido para las neoplasias superficiales del tracto gastrointestinal y permite la resección en bloque. La tracción adecuada del tejido es importante para una disección efectiva y segura. La DES guiada por anclaje magnético (DES-AM) con imán de neodimio (simplificada) tiene beneficios potenciales en comparación con otros métodos actuales de tracción. Evaluamos la factibilidad de la DES-AM simplificada en un modelo porcino ex vivo.
Materiales y métodosDiseño experimental, se empleó la técnica estándar de DES. Para el anclaje magnético (AM), utilizamos un imán externo y uno interno de neodimio. El imán interno de neodimio se fijó a una rama de un hemoclip con sutura seda 2-0. Después de la incisión, el clip con el imán interno se colocó al borde de la lesión y luego se maniobró un imán externo alrededor de la superficie para aplicar una tracción adecuada.
ResultadosEn total, se realizaron 15 DES (cinco sin AM y 10 con AM), de las cuales el 100% se completaron en bloque. En todos los casos, la tracción y la disección fueron factibles. Todos los procedimientos se completaron en menos de 90 minutos. El tamaño de las lesiones fue de 15 a 50 mm (promedio 30 mm). Dos casos presentaron perforación puntiforme en el grupo con AM (13.3%).
ConclusionesNuestro estudio mostró la factibilidad de la DES-AM simplificada en un modelo porcino ex vivo y resección en bloque.
Endoscopic submucosal dissection (ESD) is a well-established treatment for superficial gastrointestinal tumors and enables en bloc resection. Adequate tissue tension is important for safe and effective dissection. Simplified magnetic anchor-guided ESD (MAG-ESD) with a neodymium magnet has potential benefits, compared with other current traction methods. We evaluated the feasibility of simplified MAG-ESD in an ex vivo porcine model.
Materials and methodsAn experimental study was conducted, utilizing the standard ESD technique. An external magnet and an internal magnet, both neodymium magnets, were used for the magnetic anchoring. The internal magnet was attached to an arm of a hemoclip with a 2-0 silk suture. After the incision, the clip with the internal magnet was placed at the edge of the lesion. The external magnet was maneuvered around the surface to apply adequate tension.
ResultsA total of 15 en bloc ESDs (five with no magnetic anchoring and 10 with magnetic anchoring) were carried out. Traction and dissection were feasible in all cases and the procedures were completed in fewer than 90 min. Lesion size ranged from 15 to 50 mm (mean 30 mm). Two cases in the group with magnetic anchoring presented with punctate perforation (13.3%).
ConclusionsOur study demonstrated the feasibility of simplified MAG-ESD and en bloc resection in an ex vivo porcine model.
La disección endoscópica de la submucosa (DES) se ha desarrollado para el tratamiento de las lesiones tempranas del tracto gastrointestinal, el objetivo es realizar una resección en bloque para obtener un diagnóstico histopatológico seguro y para lograr la reducción en la recurrencia local1–3. Sin embargo, la DES es técnicamente difícil y la limitada visualización puede producir graves complicaciones como sangrado y perforación4,5. Para facilitar su realización, varios dispositivos y métodos de tracción han sido desarrollados6–16. La DES guiada por anclaje magnético (DES-AM), utilizando un imán externo de gran tamaño proporciona varios grados de tracción17,18. Se ha descrito un método simplificado de DES-AM, usando magnetos de neodimio de pequeño tamaño, útil para la práctica diaria, en estómagos de porcinos resecados y de perros vivos19,20. Recientemente, Matsuzaki et al. publicaron una serie prospectiva de 50 pacientes con lesiones de estómago, utilizando el método simplificado de DES-AM, logrando la resección exitosa en todos los casos21 y en 48 lesiones colorrectales con los mismos resultados22; esta técnica de anclaje magnético (AM), a nuestro conocimiento, no ha sido reportada en México. Por otro lado, el entrenamiento en modelos animales, en particular utilizando el estómago, para superar la curva de aprendizaje de la DES, se ha descrito y se ha incorporado en varios centros para el aprendizaje de la DES23. El objetivo de este estudio es evaluar la factibilidad de la DES-AM con el método simplificado en modelos porcinos ex vivo.
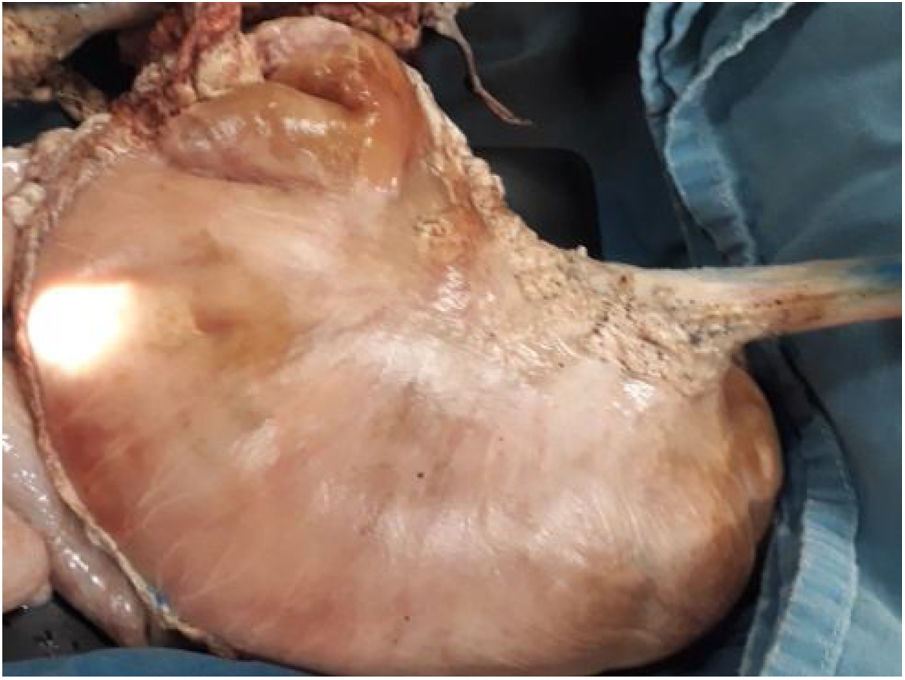
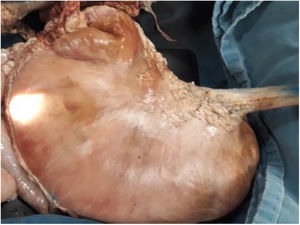
Material y métodosModelo porcino ex vivoSe utilizaron estómagos (fig. 1) y, en un caso, el colon de cerdos resecados y preparados, de acuerdo con las recomendaciones establecidas por Ramírez et al.24 Los procedimientos fueron realizados por un solo endoscopista (Miguel Ángel Ramírez-Ramírez) quien inició su curva de aprendizaje y adiestramiento en DES, especialista en otros procedimientos avanzados de endoscopia y con siete años de experiencia en el adiestramiento de procedimientos endoscópicos con modelos ex vivo.
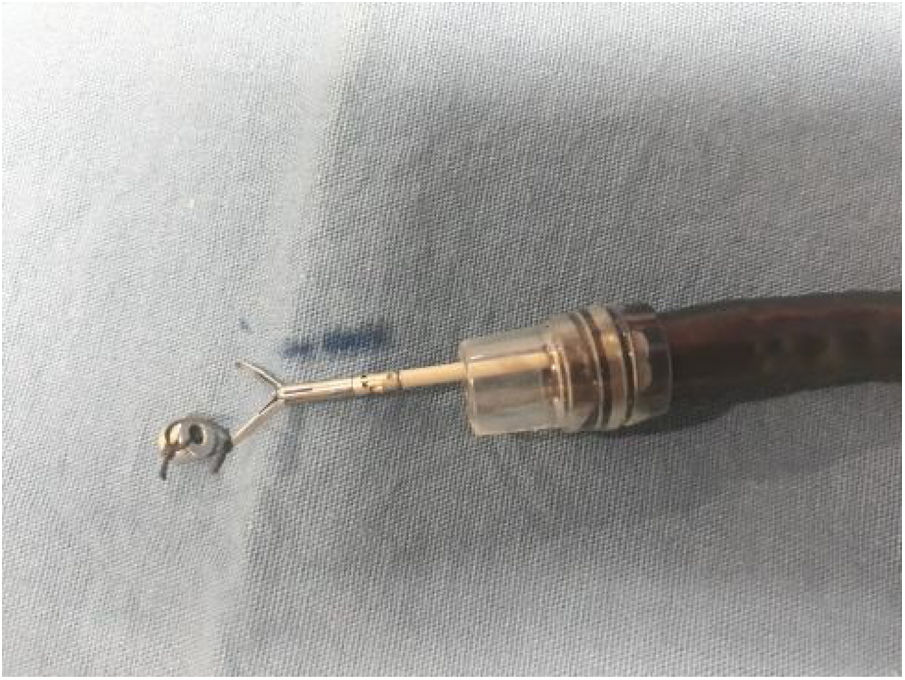
Magneto de neodimioSe utilizaron magnetos permanentes de neodimio (Nd2Fe12B) para uso experimental, internos y externos (Innova Endoscopy S.A. de C.V. CDMX). Los magnetos de neodimio son los imanes más fuertes disponibles y altamente resistentes a la desmagnetización debido a su estructura atómica. El magneto externo (fuerza de atracción 845.8 N; densidad de flujo magnético, 534 Mt) tiene forma de moneda (diámetro 3 cm; altura 8 mm) y el interno (5.3 N, 296 Mt) tiene forma de anillo (diámetro externo 5 mm, diámetro interno 1 mm, altura 3 mm).
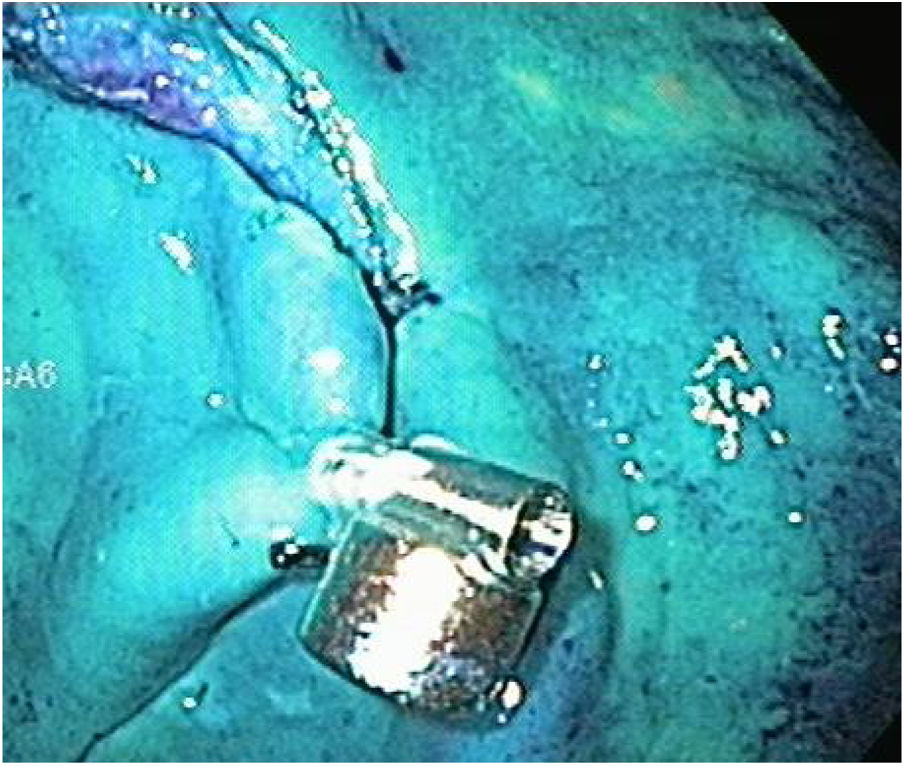
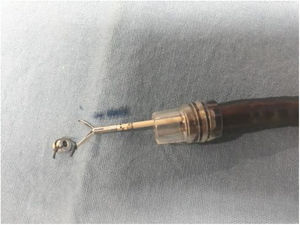
Anclaje magnéticoEl anclaje magnético consiste en fijar el imán interno de neodimio a una rama del hemoclip. Para la preparación del anclaje magnético, inicialmente un hemoclip fue insertado en el canal de trabajo del endoscopio, al cual se colocó un capuchón de plástico transparente (cap) en la punta. Una vez que se exteriorizó el hemoclip en la parte distal del endoscopio, el magneto fue atado a una rama con seda 2-0 (fig. 2). Subsecuentemente, se retiró unos centímetros hasta quedar cubierto por el capuchón plástico (fig. 3) listo para ser introducido sin lesionar la mucosa.
Como parte del entrenamiento, en una primera etapa, se realizaron cinco procedimientos de DES sin utilizar el AM. En una segunda fase se llevaron a cabo 10 DES, introduciendo el método de AM, para fines descriptivos, lo mencionaremos de aquí en adelante como el grupo con AM y el grupo sin AM. Se empleó una técnica endoscópica de DES mediante cuatro etapas: marcaje, inyección submucosa, incisión circunferencial y disección propiamente.
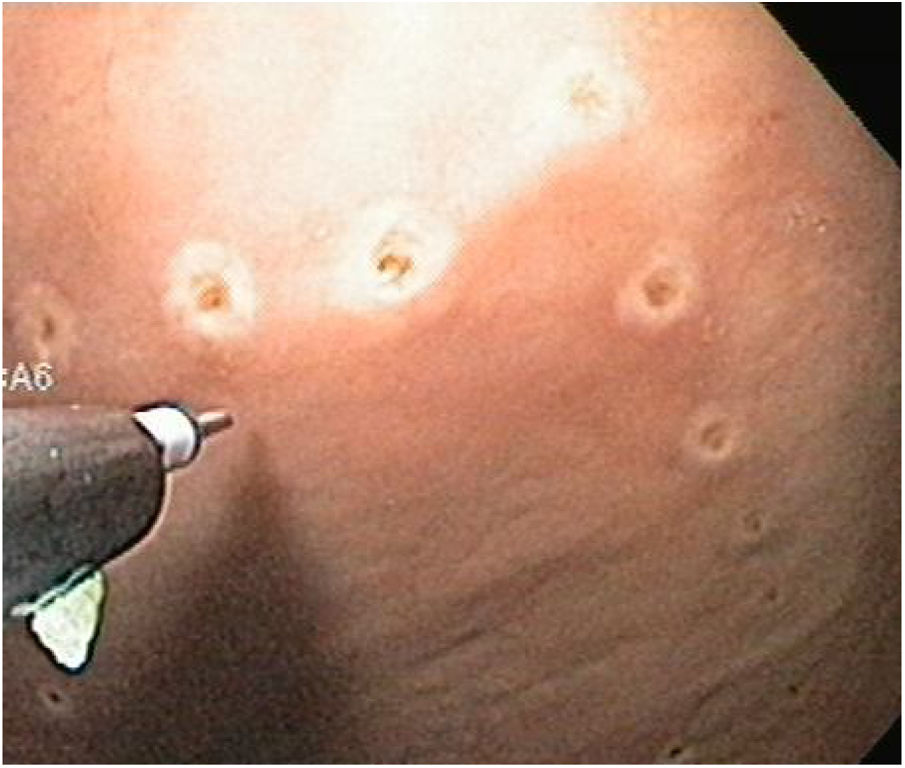
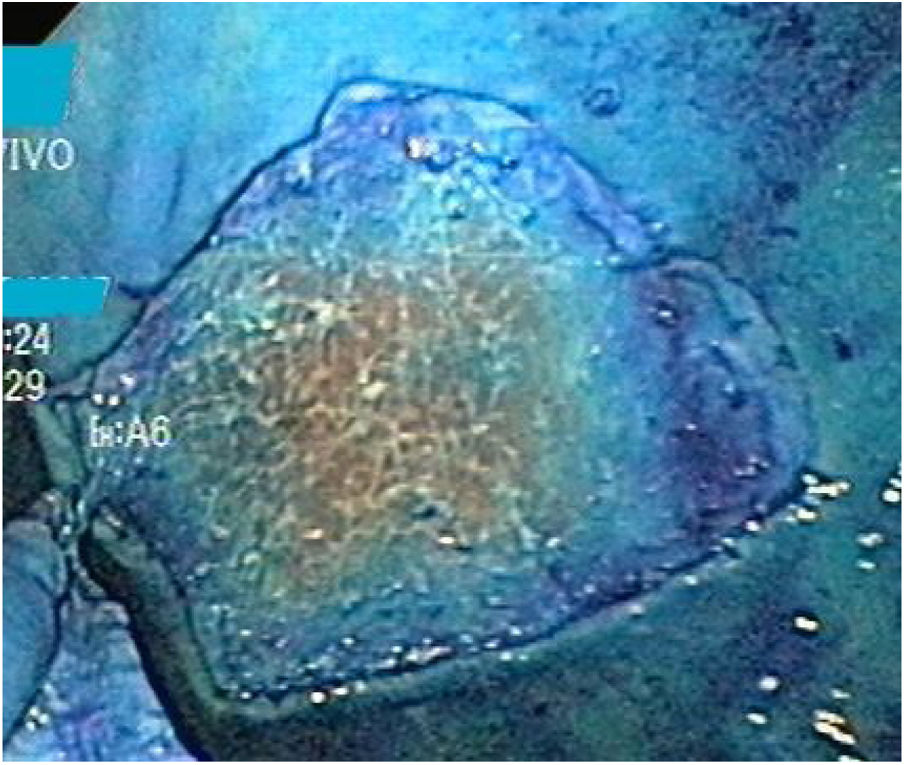
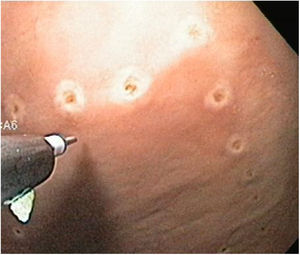
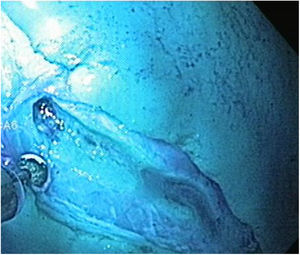
Técnica DES sin AMSe utilizó un endoscopio de un solo canal (GIF Q160; Olympus Medical System Corp, Tokyo, Japan) con un capuchón transparente de plástico en la punta, una unidad electroquirúrgica (ERBE ICC, T200 Tübingen, Germany) y los siguientes accesorios y cuchillos: cylindrical type rotatable, cylindrical type-square and ball type IT knife (Alton Medical Instruments CO., LTD, Shanghai, China). Como primer paso, se realizó un marcaje (fig. 4) de una lesión simulada mayor a 15 mm, subsecuentemente, se llevó a cabo la inyección submucosa con solución salina y azul de metileno, enseguida se procedió a realizar la incisión circunferencial (fig. 5) y finalmente, se efectuó la disección, utilizando el capuchón para la contratracción.
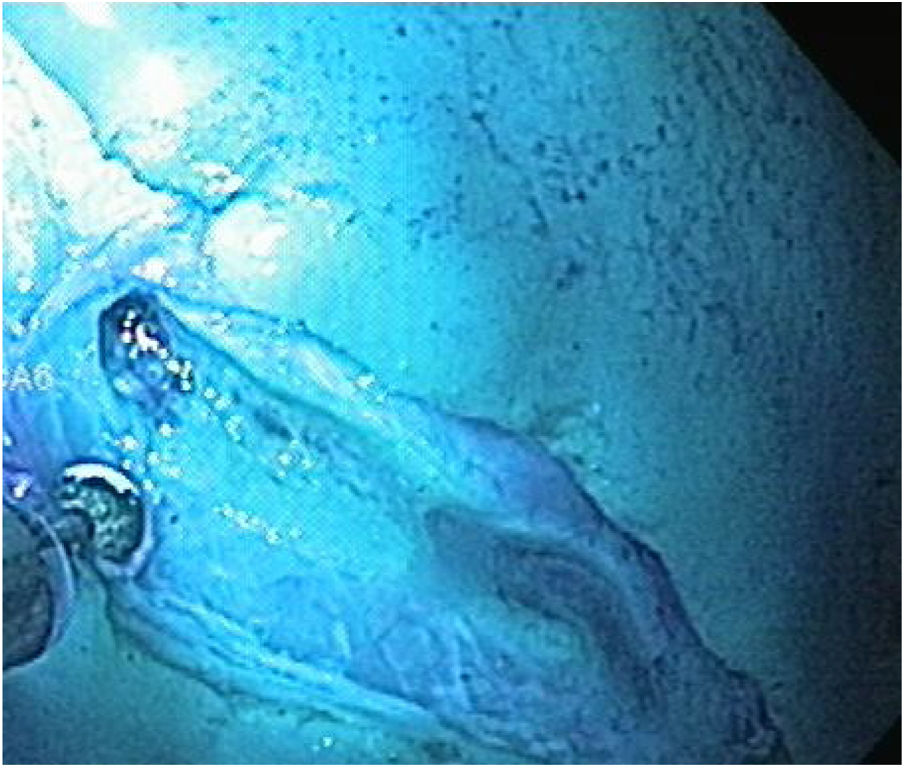
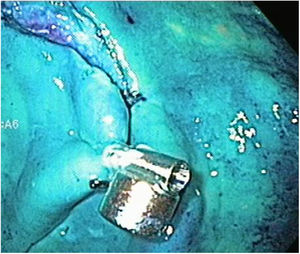
Las etapas de marcaje, inyección e incisión circunferencial se realizan de la misma manera, y antes de proceder a la etapa de disección, se extrajo el endoscopio para poder colocar el anclaje magnético con el clip, una vez preparado, se procedió a reintroducir el endoscopio y a liberar el clip en una esquina de la lesión (fig. 6). En el primer caso de este grupo, se continuó la disección con el capuchón en la punta del endoscopio y el AM, sin embargo, en el resto de los casos de este grupo (9/10) una vez liberado el clip con el imán interno, se extrajo el endoscopio y se retiró el capuchón, ya que nos percatamos que técnicamente no era necesario y mejoraba el campo de visión. Para la tracción, el magneto externo fue maniobrado alrededor de la superficie del modelo ex vivo hasta obtener una adecuada tracción del imán interno y exponer el plano correcto de disección (fig. 7). Después de terminada la disección propiamente dicha, tanto la pieza resecada como el anclaje magnético in situ fueron recuperados (fig. 8).
Análisis descriptivo con porcentaje de variables categóricas. Media y desviación estándar de variables cuantitativas.
Variables- 1.
Resección en bloque. Categórica
- 2.
Adecuada tracción: obtener la adecuada tracción y la contratracción del anclaje magnético en todos los ángulos. Categórica.
- 3.
Tiempo máximo de duración (90 min) del procedimiento de disección (evaluado desde el comienzo del corte circunferencial hasta el final de la disección). Cuantitativa continúa.
- 4.
Tamaño (mm) del tejido resecado. Cuantitativa discreta.
- 5.
Perforación: definida como la pérdida de continuidad de la pared gastrointestinal. Categórica.
Consideramos 90 minutos un tiempo límite máximo para lograr la DES, no medimos el tiempo de cada procedimiento ya que no era la intención comparar esta variable, más bien, fue la factibilidad de llevarlo a cabo.
Consideraciones éticasSe han cumplido las normas de buena práctica clínica y de experimentación animal, el estudio fue realizado en modelos ex vivo, no se utilizaron animales in vivo ni pacientes, los equipos y accesorios usados son de uso exclusivo «animal».
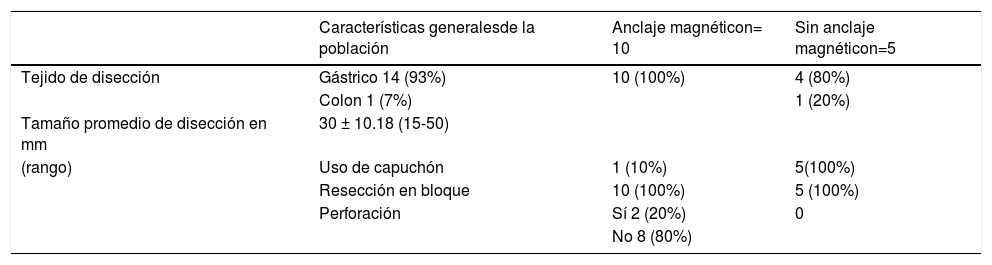
ResultadosEn total, se realizaron 15 DES (tabla 1). Los primeros cinco casos sin AM (cuatro en estómago y uno en colon) y 10 con AM (todas en estómago). En ambos grupos se logró la resección en bloque en el 100% de los casos. El AM permitió una adecuada tracción y contratracción en todos los ángulos y la disección correcta en todos los casos (100%). Todos los procedimientos fueron realizados en menos de 90 minutos (100%). El tamaño de las lesiones fue desde 15 mm a 50 mm (promedio 30 mm). Dos casos en el grupo de AM presentaron una perforación puntiforme (13.3%) las cuales se repararon y se logró terminar la disección en bloque.
Características generales de la población y variables de estudio
| Características generalesde la población | Anclaje magnéticon= 10 | Sin anclaje magnéticon=5 | |
|---|---|---|---|
| Tejido de disección | Gástrico 14 (93%) | 10 (100%) | 4 (80%) |
| Colon 1 (7%) | 1 (20%) | ||
| Tamaño promedio de disección en mm | 30 ± 10.18 (15-50) | ||
| (rango) | Uso de capuchón | 1 (10%) | 5(100%) |
| Resección en bloque | 10 (100%) | 5 (100%) | |
| Perforación | Sí 2 (20%) | 0 | |
| No 8 (80%) |
En este estudio determinamos que la DES-AM simplificada es factible en modelos ex vivo. La DES se ha desarrollado para el tratamiento de lesiones tempranas del tracto gastrointestinal; el objetivo es realizar la resección en bloque para obtener un diagnóstico histopatológico seguro y lograr la reducción en la recurrencia local1–3. El entrenamiento en modelos animales es el mejor camino para superar la curva de aprendizaje para la DES24. Un programa formal de adiestramiento secuencial que incluya modelos ex vivo, in vivo y humanos puede ser útil en países donde hay bajo volumen de casos. En nuestro estudio con modelos ex vivo, la DES-AM fue realizada de manera exitosa y en bloque en todos los casos, aun en el comienzo de la curva de aprendizaje del operador, como se ha reportado previamente25, es preciso reiterar que el endoscopista que efectuó los procedimientos es experto en otras técnicas avanzadas de endoscopia lo cual podría ser un factor que no refleje necesariamente los resultados esperables para médicos endoscopistas con menor o diferente grado de experiencia. El AM nos permite realizar tracción y contratracción en varios ángulos durante la DES, similar a un primer ayudante durante una cirugía, lo cual pudimos corroborar en este estudio. Esta técnica se puede implementar en el futuro en un programa secuencial y reproducir nuestros resultados en modelos in vivo.
Utilizar un capuchón transparente en la punta del endoscopio es útil e indispensable para la DES ya que sirve para realizar la disección mediante contratracción; sin embargo, puede representar una desventaja en la visión cuando el diámetro es pequeño26. Nosotros observamos, durante este estudio, que el AM hace innecesario dejar el «capuchón» en la punta del endoscopio durante la etapa de disección, lo cual permite un mejor campo de visión. En los cinco casos sin AM, utilizamos el capuchón y solo en un caso en el grupo de AM, en los siguientes nueve con AM este fue retirado, lo cual implica tener que extraer el endoscopio para remover el capuchón; sin embargo, esto es en favor de obtener un mejor campo de visión. En comparación, Matsuzaki et al.21,22 no especifican esta potencial ventaja; sin embargo, se requieren más estudios en el futuro para poder determinar si el retiro del capuchón ofrece o no beneficios. Es importante mencionar que el capuchón sí se utilizó en todos los casos cuando se introdujo el anclaje magnético para su colocación que sirvió como protección de la mucosa y del mismo anclaje.
La DES, técnicamente, conlleva importantes riesgos como la perforación; dos metaanálisis reportaron un promedio de perforación durante la DES gástrica de aproximadamente 4.5%27,28 y en la DES de colon de 4.8%. Asimismo, Minami et al.29 reportaron una gran serie de casos de perforación donde en el 98% se realizó un cierre exitoso con clip y no se requirió cirugía. En nuestro estudio, tuvimos dos casos (13%) de perforación puntiforme, que se identificaron durante el procedimiento, se suturaron y fue factible terminar la DES-AM en bloque en el 100% de los casos.
Por ser un modelo ex vivo no es posible evaluar el riesgo de sangrado y técnicamente no tenemos el inconveniente de la peristalsis, sin embargo, debe ser un aprendizaje secuencial migrado hacia modelos vivos y humanos, en el futuro podrían realizarse estudios en modelos porcinos in vivo y, subsecuentemente, en humanos (efectuado por expertos) para medir las variables como el sangrado y valorar el factor de la peristalsis y la barrera física del cuerpo a la atracción magnética, teniendo como base y antecedente este estudio.
Es necesario señalar algunas limitaciones desde el punto de vista metodológico, en primer lugar, tuvimos variabilidad en las lesiones ya que incluimos 14 gástricas y solo una de colon (DES sin AM), por lo cual, estrictamente hablando, la factibilidad de la DES-AM fue establecida solo para lesiones gástricas, sin embargo, consideramos que los resultados podrían extrapolarse a lesiones de colon pero no se investigó. En segundo lugar, aunque no fue la finalidad del estudio, no se midió el tiempo preciso de cada DES, por lo tanto, no podemos evaluar si la duración del procedimiento estuvo relacionada con el tamaño o con la localización de las lesiones.
ConclusiónNuestro estudio mostró la factibilidad de la DES-AM con el método simplificado en modelo porcino ex vivo y resección en bloque. Durante la DES-AM no es necesario utilizar capuchón en la punta del endoscopio lo cual aumenta el campo de visión.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interésLos autores declaran no tener ningún conflicto de intereses.