La enfermedad por hígado graso no alcohólico (EHGNA) es actualmente una de las principales causas de hepatopatía crónica en el mundo occidental. La prevalencia mundial reportada en población general es del 25%. La adiposidad visceral y la grasa hepática propician un estado de inflamación sistémica, predisponiendo a los individuos con EHGNA a enfermedades extrahepáticas como enfermedad cardiovascular (causa más común de muerte en EHGNA), diabetes mellitus, enfermedad renal crónica, hipotiroidismo, síndrome de ovario poliquístico, apnea obstructiva del sueño, así como aumento del riesgo de presentar neoplasias gastrointestinales y extraintestinales. Diversos mecanismos se han reportado entre la EHGNA y su asociación con enfermedades extrahepáticas, y la lipotoxicidad es la principal causa de activación de vías inflamatorias que ocasionan el daño tisular extrahepático.
Non-alcoholic fatty liver disease (NAFLD) is currently one of the main causes of chronic liver disease in Western countries, with a 25% prevalence reported in the general population worldwide. Visceral adiposity and liver fat promote a state of systemic inflammation, predisposing individuals with NAFLD to the extrahepatic pathologies of cardiovascular disease (the most common cause of death in patients with NAFLD), diabetes mellitus, chronic kidney disease, hypothyroidism, polycystic ovary syndrome, obstructive sleep apnea, and an increased risk for presenting with gastrointestinal and extraintestinal neoplasias. Different mechanisms between NAFLD and its association with extrahepatic diseases have been reported, and lipotoxicity is the main cause of inflammatory pathway activation that results in extrahepatic tissue damage.
La enfermedad por hígado graso no alcohólico (EHGNA) es una enfermedad clínica caracterizada por el hallazgo histológico de ≥5% de esteatosis macrovesicular de los hepatocitos en individuos sin consumo significativo de alcohol (≥30g/día para hombres y ≥20g/día para mujeres) u otra causa conocida de enfermedad hepática crónica1,2. Se ha convertido en una causa importante de enfermedad hepática crónica en ciudades occidentales y se convertirá en la primera causa subyacente de trasplante hepático dentro de los próximos 10años3-5.
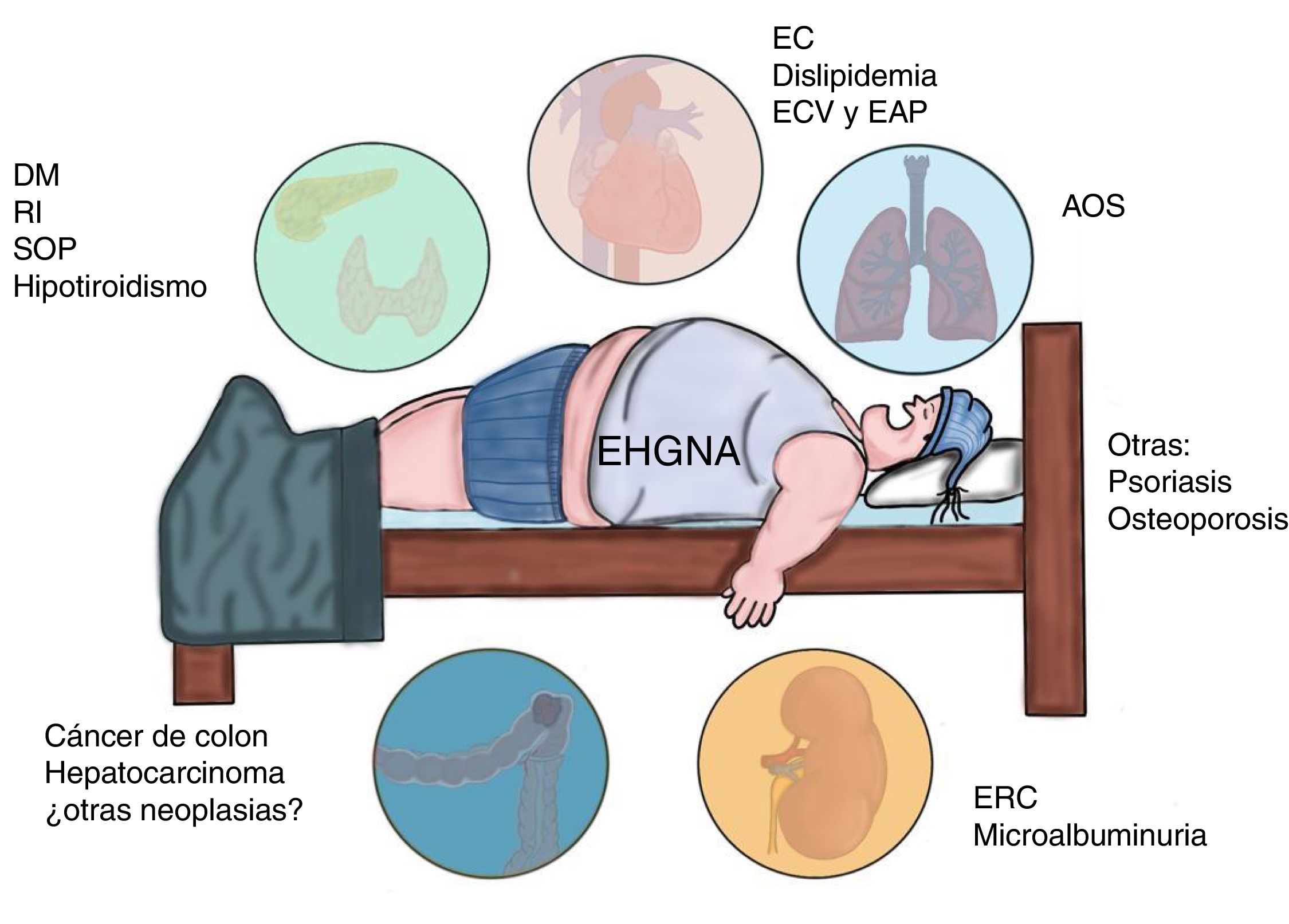
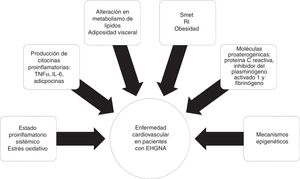
La EHGNA está asociada con comorbilidades metabólicas que incluyen diabetes mellitus (DM), resistencia a la insulina (RI), obesidad, hipertensión e hiperlipidemia, las cuales incrementan por sí mismas el riesgo de enfermedad cardiovascular (ECV)6. En los últimos 10años se ha identificado a la EHGNA como una enfermedad multisistémica que afecta una variedad de órganos, incluyendo DM, enfermedad renal crónica (ERC), ECV y malignidades, entre otras (fig. 1).
Enfermedades asociadas a la afectación multisistémica presente en la enfermedad por hígado graso no alcohólico (EHGNA).
AOS: apnea obstructiva del sueño; DM: diabetes mellitus; EAP: enfermedad arterial periférica; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; ERC; enfermedad renal crónica; RI: resistencia a la insulina; SOP: síndrome de ovario poliquístico.
En la encuesta de examen nacional de salud y nutrición 2015-2016 (NHANES) se incluyeron más de 11,000 individuos con EHGNA, los cuales fueron seguidos por una media de 14.5años, donde la causa principal de muerte fue ECV (9.3%) y malignidad (5%), mientras que las complicaciones relacionadas con la enfermedad hepática solo fueron reportadas como causa de muerte en el 0.4%. Hasta la fecha, la evidencia ha indicado que la enfermedad coronaria (EC) es la principal causa de morbimortalidad en pacientes con EHGNA, así como un vínculo con alteraciones funcionales y estructurales del miocardio, con o sin características coexistentes del síndrome metabólico (SMet)3. Gran parte de la evidencia clínica y epidemiológica ha reportado que la EHGNA no solo se asocia con morbimortalidad relacionada con el hígado, sino también con el incremento de enfermedad cardiaca coronaria, alteraciones de la función y estructura cardiaca (disfunción ventricular izquierda, hipertrofia y falla cardiaca), enfermedad valvular coronaria (esclerosis de la válvula aórtica) y arritmias (fibrilación auricular)3,7.
En un estudio de aproximadamente 3,000 pacientes no seleccionados con DM la prevalencia de EC, enfermedad cerebrovascular y enfermedad vascular periférica fue notablemente mayor entre los pacientes EHGNA que en aquellos sin esta enfermedad, independientemente de los factores de riesgo tales como la duración de la DM, el control de la glucemia, el uso de fármacos hipolipemiantes, hipoglucemiantes, antihipertensivos o antiplaquetarios y componentes del SMet. Los pacientes con EHGNA tuvieron una prevalencia notablemente más alta (p<0.001) ajustada por edad y sexo de EC (10.8% frente al 1.1%), cerebrovascular (37.3% frente al 5.5%) y enfermedad vascular periférica (24.5% frente al 2.5%) que sus contrapartes sin EHGNA7.
Los objetivos de esta revisión bibliográfica fueron reconocer las complicaciones extrahepáticas asociadas a la EHGNA dando relevancia al impacto cardiovascular de esta entidad, además de revisar los aspectos generales epidemiológicos y fisiopatológicos implicados en la EHGNA y sus complicaciones, con lo que se espera contribuir en la actualización de médicos generales y especialistas afines a la gastroenterología para dotar de conocimientos que proporcionen atención oportuna y de calidad a quienes padezcan esta enfermedad hepática.
Material y métodosSe realizó una revisión bibliográfica analizando las bases de datos de DynaMed, Google Scholar y PubMed en busca de revisiones sistemáticas, guías de práctica clínica, estudios controlados aleatorizados y estudios epidemiológicos en idioma español e inglés que mencionaran las palabras «esteatosis», «enfermedad por hígado graso no alcohólico», «esteatohepatitis», «síndrome metabólico», «mortalidad», «neoplasias», «cáncer», «psoriasis», «hipotiroidismo», «ovario poliquístico» y «riesgo cardiovascular» entre los años 2000 y el primer trimestre de 2019. Los resúmenes fueron buscados manualmente para su inclusión y las referencias seleccionadas se basaron en adecuación a los objetivos de la revisión.
EpidemiologíaLa EHGNA es la afección hepática más común en las ciudades occidentales, y de acuerdo con los diferentes métodos diagnósticos, edad, sexo y etnicidad, afecta al 17-46% de los adultos8,9. Las tasas más altas se han reportado en Sudamérica y el Oriente Medio, seguidos de Asia, Estados Unidos de América y Europa10. Se encuentra presente entre el 7 y el 9% de personas con peso normal según varios reportes, y se ha observado con mayor frecuencia en mujeres, a edad más temprana y con enzimas hepáticas normales, resaltando que individuos delgados con EHGNA tienen un perfil clínico diferente que pacientes obesos o con sobrepeso y EHGNA11-13.
Sin embargo, de manera global se ha reportado la cifra de prevalencia en adultos en población general que oscila entre el 3 y el 24%, con la mayoría de las estimaciones en el rango del 6 al 14%14.
El escrutinio para EHGNA ha sido cuestionado, dados los altos costos directos e indirectos de las pruebas, el bajo valor predictivo de las pruebas no invasivas, el riesgo de biopsia hepática y la falta de efectividad de los tratamientos. Sin embargo, las formas agresivas, como la esteatohepatitis no alcohólica (EHNA), particularmente cuando se asocia con fibrosis avanzada, deben ser identificadas en pacientes de riesgo (edad >50años, DM o SMet), debido a las implicaciones pronósticas2.
En general, no es fácil establecer la prevalencia de la EHGNA en la población general debido a la necesidad de evaluación histológica. En un estudio realizado en población general mundial la prevalencia de EHGNA se estimó utilizando ultrasonido y pruebas hepáticas alteradas en ausencia de otra causa de enfermedad hepática, reportando una prevalencia mundial del 25%8, aunque la base de datos de NHANESIII reporta que la prevalencia de EHGNA de acuerdo con la ultrasonografía es del 19%, y con enzimas hepáticas alteradas es de 24%9.
Aunque la mayoría de los pacientes tienen enfermedad estable, se ha mostrado que la progresión de la fibrosis ocurre tanto en pacientes con EHNA y EHGNA (incremento anual 0.14 y 0.07 de fibrosis, respectivamente). Sin embargo, un subgrupo de pacientes fue identificado con progresión rápida de fibrosis; los progresores rápidos que se identificaron se presentaron con alta frecuencia de inflamación lobular leve o balonización de hepatocitos, en comparación con los no progresores, y aunque fue insuficiente para el diagnóstico de EHNA, estas diferencias sutiles podrían explicar su progresión15.
El registro europeo de EHGNA ha reclutado, hasta abril del 2019, 6,708 pacientes, de los cuales el 21% tienen esteatosis simple, el 5% esteatosis y fibrosis, el 58% esteatohepatitis (con o sin fibrosis) y el 8% cirrosis hepática16.
Sabemos que México es un país cuya población reúne diversos factores de riesgo para EHGNA, y respecto a los datos epidemiológicos se ha reportado una prevalencia poblacional con variaciones que oscilan del 14.3 hasta el 50%17-19.
Complicaciones extrahepáticas de la EHGNALa adiposidad visceral y la grasa hepática propician un estado de inflamación sistémica, la cual parece predisponer a los individuos con EHGNA a enfermedades extrahepáticas2. La causalidad de estas afecciones extrahepáticas puede ser controversial; sin embargo, su trascendencia es incuestionable, ya que, hasta la fecha, la morbimortalidad en estos pacientes se debe principalmente a ECV, seguida de las neoplasias extrahepáticas20.
Enfermedad cardiovascularEl hígado juega un papel crucial en la homeostasis de los lípidos y la glucosa; por lo tanto, es el centro de la enfermedad cardiometabólica. Existe una interacción muy compleja entre el intestino, el tejido adiposo visceral y subcutáneo, el tejido muscular y los sistemas cardiovascular y hepático21.
Se han realizado numerosos estudios para identificar individuos que pueden desarrollar ECV, así como los mecanismos por los cuales la enfermedad hepática influencia este proceso. Debido a que la ECV es la causa más común de muerte en pacientes con EHGNA, la habilidad para identificar y modificar los riesgos cardiovasculares se ha convertido en un importante blanco para el manejo de pacientes con EHGNA.
Varios ensayos prospectivos han investigado la conexión entre ECV y EHGNA utilizando una variedad de técnicas diagnósticas, incluyendo ultrasonografía, biopsia hepática e incremento en los niveles séricos de alanino-aminotransferasa (ALT) y gamma-glutamil transpeptidasa (GGT). El incremento en los niveles de GGT se piensa que es un indicador de estrés oxidativo22. Haring et al.23 encontraron que los niveles alterados de GGT estaban asociados con incremento de más de 2 veces el riesgo de mortalidad cardiovascular, además de ser superior a la ecografía hepática en la predicción del riesgo de mortalidad.
Por otro lado, un estudio prospectivo incluyó pacientes diagnosticados con EHGNA mediante ultrasonografía, encontrando mayor incidencia de eventos cardiovasculares serios durante el seguimiento, independientemente de otros factores de riesgo conocidos, incluyendo tabaquismo, hipertensión, niveles de colesterol de lipoproteínas de baja densidad, SMet, edad y sexo24. Una revisión retrospectiva con datos de la NHANES mostró un incremento en el riesgo de ECV en pacientes con EHGNA diagnosticados por ultrasonografía independientemente de los niveles de enzimas hepáticas, pero sin incremento en la mortalidad25. Además de los factores de riesgo cardiovasculares tradicionales, se han observado algunos «no tradicionales», como hiperuricemia, hipoadiponectinemia e hipovitaminosisD, además de su relación con ERC, que a su vez aumenta el riesgo cardiovascular20.
Enfermedad cardiovascular subclínicaLa ECV subclínica se define como un desequilibrio entre sustancias vasoconstrictoras y vasodilatadoras, especialmente el óxido nítrico, llevando a disfunción endotelial, considerándose un estado de riesgo para ECV en individuos asintomáticos. Se han establecido diversos parámetros para detectar signos tempranos de ECV: a)el incremento del grosor de la pared arterial o presencia de placas carotídeas mediante ultrasonografía; b)la puntuación de calcificación de la arteria coronaria por TC; c)disfunción ventricular izquierda y arritmias cardiacas, mediante electrocardiograma y ecocardiograma, así como d)la enfermedad arterial periférica evaluada mediante el índice de presión tobillo-brazo26,27.
Evaluación del riesgo cardiovascular subclínicoSe han utilizado diversas pruebas no invasivas en pacientes con EHGNA para el diagnóstico de ECV subclínica. Estas pruebas incluyen medición de la íntima-media de la carótida, rigidez arterial, vasodilatación del flujo mediado, calcificación de la arteria coronaria (CAC) y grasa epicárdica.
Una revisión sistemática de 7 estudios incluyó 1,427 pacientes con EHGNA y 2,070 controles, mostrando una asociación significativa entre EHGNA e incremento del espesor de la íntima-media de la carótida, así como la presencia de placas carotídeas28. El incremento de los niveles séricos de ALT y GGT se correlaciona fuertemente con el grado de engrosamiento de la íntima-media carotídea, sugiriendo una relación entre la severidad de la enfermedad hepática y el riesgo de enfermedad aterosclerótica.
En un estudio, adultos jóvenes de 20-40años de edad con EHGNA fueron significativamente asociados con ateroesclerosis subclínica utilizando evaluación vascular, incluyendo engrosamiento de la íntima-media carotídea, vasodilatación mediada por flujo y rigidez arterial29. La CAC es otro marcador de ECV subclínica que ha sido ligada al incremento de riesgo de eventos cardiacos. El incremento sustancial de la prevalencia de CAC en pacientes con EHGNA parece ser igual que en pacientes con factores de riesgo cardiacos bien establecidos, así como en tabaquismo y DM30,31.
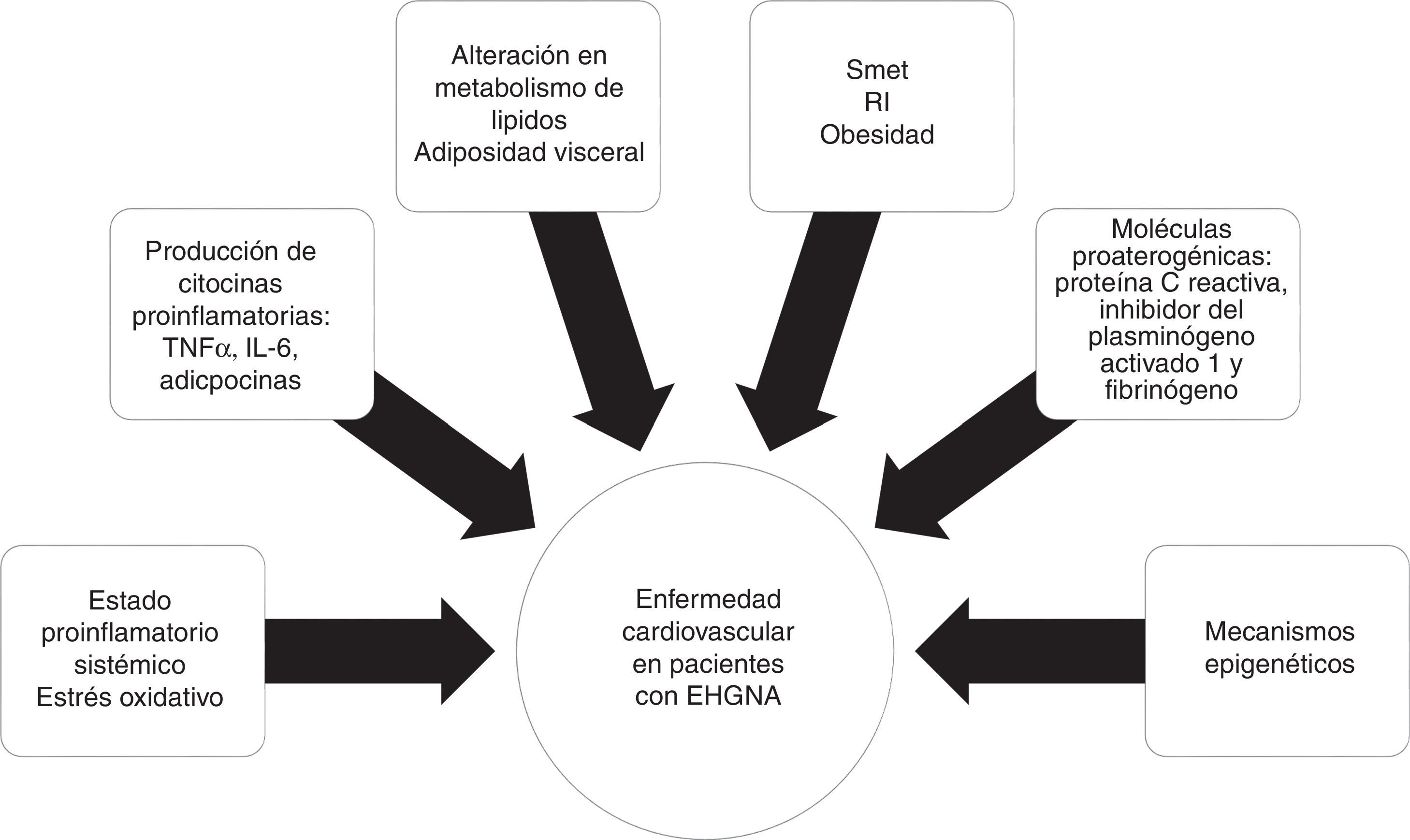
FisiopatologíaLa relación entre EHGNA y ECV no parece estar puramente relacionada con el traslape de los factores de riesgo, pero sí al efecto ateroesclerótico de la esteatosis hepática y esteatohepatitis. Los supuestos mecanismos para acelerar la enfermedad ateroesclerótica en pacientes con EHGNA incluyen un estado proinflamatorio a nivel sistémico y alteraciones en el metabolismo de los lípidos.
La RI es un componente clave en el SMet, fuertemente ligado al desarrollo y a la progresión de la EHGNA32. La obesidad, específicamente la adiposidad visceral, provoca un incremento de acumulación hepática de ácidos grasos libres, así como disminución de la oxidación de estos y alteración en el metabolismo de la glucosa, contribuyendo con la RI hepática.
La obesidad visceral se asocia con la producción de citocinas proinflamatorias, como el factor de necrosis tumoral alfa (TNF-α) y la interleucina6 (IL-6), adipocinas e infiltración de macrófagos, resultando en inflamación sistémica y, consecuentemente, en la producción hepática de moléculas proaterogénicas, como la proteínaC reactiva, el inhibidor del plasminógeno activado1 y el fibrinógeno, provocando finalmente disfunción endotelial y aterosclerosis33. El rol de mecanismos epigenéticos, como la metilación del ADN, podría explicar las interacciones gen-ambiente que influyen en la ECV20 (fig. 2)
Diabetes mellitusComo componente del SMet, la DM y la RI están fuertemente relacionadas con la prevalencia de la EHGNA y, por lo tanto, la EHGNA ha mostrado ser un factor de riesgo independiente para el desarrollo de DM. En el estudio de Framingham se comprobó que los individuos con EHGNA de base eran más susceptibles de desarrollar DM tipo2 subsecuente que quienes no contaban con EHGNA20. El sobrepeso y la obesidad en individuos con EHGNA que se someten a escrutinio para DM con prueba de tolerancia a la glucosa tuvieron mayor rango de intolerancia a los hidratos de carbono al compararlos con un grupo control de sobrepeso u obesidad sin EHGNA (75% vs 25%)34.
Tanto la grasa hepática como la DM están asociadas significativamente con la presencia de RI, sugiriendo que el incremento de grasa hepática juega un rol en el desarrollo de DM. Dado el riesgo significativo de desarrollar DM en pacientes con EHGNA, el escrutinio para DM con hemoglobina glucosilada anual o prueba de tolerancia oral a la glucosa son pruebas recomendadas35.
PatogénesisExiste una mutua asociación con la disfunción del tejido adiposo, la EHGNA y el desarrollo de la alteración en la tolerancia a la glucosa y la DM. La asociación de esteatohepatitis y fibrosis avanzada con DM parece ser independiente de la obesidad y estar ligada a la presencia de RI32. La lipotoxicidad resulta de la acumulación de metabolitos tóxicos y triglicéridos en el músculo, el hígado y las células beta pancreáticas con activación de vías inflamatorias resultando en RI. El exceso de ácidos grasos libres en la EHGNA lleva a RI en el músculo esquelético, siendo proporcional el grado de tejido adiposo con la RI. Como resultado de la disfunción del tejido adiposo, hay desarrollo de anormalidades metabólicas, incluyendo dislipidemia, RI muscular y hepática, esteatosis hepática y esteatohepatitis36,37.
Enfermedad renal crónicaLa ERC se define como una reducción estimada de la filtración glomerular (eGFR), o microalbuminuria o proteinuria. La ERC a menudo afecta a personas con factores de riesgo metabólicos ya conocidos, los cuales incluyen hipertensión y DM. Existen nuevos estudios donde se revela que la EHGNA está asociada independientemente con el incremento en la prevalencia de ERC, por lo que los pacientes con EHGNA parecen tener mayores rangos de ERC comparado con los pacientes sin EHGNA38.
Por otro lado, se reportó en 11,469 adultos estadounidenses que no existe mayor riesgo para ERC en pacientes diagnosticados con EHGNA mediante ultrasonido, después de la remisión del SMet39. Sin embargo, la evidencia reciente de un estudio de cohorte en adultos sin ERC confirmó que la EHGNA se asoció con un mayor riesgo de desarrollo de ERC. Además, se documentó que la EHGNA puede afectar negativamente la función renal, y es posible que los pacientes deban ser monitoreados cuidadosamente de la función renal por el riesgo incrementado de daño renal a largo plazo40. Debido a esto, se recomienda el escrutinio de ERC con evaluación anual de eGFR y microalbuminuria en pacientes con EHGNA.
PatogénesisActualmente se sugiere que la EHGNA es un marcador de ERC. La lipotoxicidad subyacente, el estrés oxidativo y la inflamación crónica en la EHGNA son considerados contribuyentes importantes de la patogénesis de la ERC mediante la activación de las vías de inflamación, promoción de la disfunción endotelial, niveles alterados de la fetuinaA y adiponectina, y la sobrerregulación de las moléculas de adhesión41, además de la aterogénesis incrementada. Desafortunadamente, en la mayoría de los estudios que muestran esta asociación no se utilizó biopsia renal, por lo que no se sabe si la EHGNA está asociada con un tipo histológico particular de ERC20.
La adiponectina y la fetuinaA son mediadores de RI y ligandos clave entre la obesidad, la enfermedad hepática y la enfermedad renal. La fetuinaA es un promotor de RI; secretada por el hígado, regula la producción de adiponectina por el tejido adiposo. Los niveles bajos de adiponectina se correlacionan con microalbuminuria y proteinuria. El mecanismo parece ser la disminución en la proteína quinasa activada por AMP5́ en los podocitos, que resulta en albuminuria42.
Neoplasias extrahepáticasLa obesidad incrementa el riesgo de mortalidad en todos los tipos de cáncer. Aunque la fibrosis hepática y la cirrosis están claramente relacionados con el desarrollo de carcinoma hepatocelular, los pacientes con EHGNA parecen tener mayor rango de neoplasias extrahepáticas. Particularmente, la neoplasia de colon presenta fuerte asociación con la EHGNA. Sin embargo, además de esta, la presencia de otros tumores malignos en pacientes con EHGNA es bien conocida a nivel tanto gastrointestinal (esófago, estómago, páncreas) como extraintestinal (riñón y próstata en hombres, y mama en mujeres), con lo que los diversos tipos de cáncer se han convertido en una de las tres causas principales de mortalidad en estos pacientes43.
Cáncer colorrectalEl cáncer colorrectal (CCR) es el tercero más común a nivel mundial y tiene factores de riesgo modificables, incluyendo obesidad, sedentarismo y dieta rica en grasa animal y baja en fibra. Wong et al. encontraron mayor prevalencia de adenomas colorrectales en individuos con esteatohepatitis por biopsia (51% vs 25.6%) y neoplasias (34.7% vs 14%) comparado con esteatosis hepática sin inflamación, siendo un hallazgo que persiste después de la corrección de otros factores de riesgo identificables44.
Prácticamente todos los estudios recientes realizados han mostrado una elevada prevalencia de lesiones colorrectales en pacientes con EHGNA comparado con los pacientes que no padecen esta última. Un estudio realizado por Hwang et al.45 en una población de 2,917 participantes a quienes se practicó colonoscopia, ultrasonido abdominal y pruebas de función hepática demostró que en aquellos en quienes se encontraron pólipos adenomatosos de colon la prevalencia de EHGNA fue del 41.5%, contra el 30.2% en el grupo sin pólipos; en el análisis multivariado la presencia de hígado graso se asoció con un incremento en el riesgo de desarrollar pólipos adenomatosos en colon hasta tres veces mayor. En un estudio posterior realizado en Corea, en una población de 5,517 mujeres, se encontró que aquellas con esteatosis hepática presentaron un riesgo dos veces mayor de desarrollar pólipos adenomatosos, y hasta tres veces mayor de sufrir CCR, comparadas con controles46.
Uno de los hallazgos más importantes sobre esta relación es el que muestra que, de entre los pacientes con EHGNA, aquellos con evidencia histológica de esteatohepatitis tienen el mayor riesgo de desarrollar cáncer de colon. Existen estudios que demuestran que el CCR se encuentra con mucha mayor frecuencia en pacientes con EHNA comparados con aquellos con EHGNA sin inflamación (51.0% vs 25.6%), donde la evidencia de esteatohepatitis permaneció fuertemente asociada con riesgo elevado tanto de adenomas (OR4.89) como de neoplasias avanzadas de colon (OR5.34) incluso tras ajustar factores de riesgo demográficos y metabólicos47.
Actualmente las guías para el escrutinio de CCR no recomiendan realizar ajustes para pacientes con EHGNA o esteatohepatitis; sin embargo, dada su clara asociación, la adhesión a estas guías debe ser fuertemente recomendable48.
Otras neoplasias digestivas y extradigestivasComo se mencionó previamente, se ha descrito la asociación —y el posible riesgo— entre EHGNA y otros tumores malignos. Un ejemplo es el cáncer de mama, donde un estudio reporta prevalencia de hasta el 63% de estas neoplasias en pacientes con hígado graso comparadas con el 48% de controles49. Otro ejemplo claro son las neoplasias malignas esofágicas, principalmente adenocarcinoma, en las que se ha demostrado que la obesidad incrementa el riesgo hasta cuatro veces sobre población control, y donde la presencia de grasa visceral (incluyendo hígado graso) presenta una asociación independiente de la presencia de reflujo para desarrollar este tipo de tumores50. Una asociación aún mayor entre grasa visceral y neoplasia se ha observado en el cáncer de páncreas, donde el riesgo relativo (RR) de desarrollar esta neoplasia puede aumentar 1.11 (IC95%: 1.05-1.18) por cada 10cm de incremento en el perímetro abdominal, y donde el SMet y la presencia simultánea de hígado y páncreas graso se han identificado como factores de riesgo neoplásicos, con un RR de 1.58 (p<0.0001) para desarrollar cáncer pancreático sobre todo en mujeres, posiblemente mediado por actividad física disminuida, consumo de alimentos con alta carga calórica, consumo elevado de grasas, baja ingesta de fibra y estrés oxidativo51.
Finalmente, dos neoplasias más en las que se ha encontrado cierta asociación con EHGNA son el cáncer renal y los tumores prostáticos. Un estudio europeo encontró un incremento lineal en el riesgo de desarrollar cáncer renal en los pacientes con componentes de SMet comparados con controles (43% en hombres y 40% en mujeres) aun tras ajustar para factores como tabaquismo, dieta y herencia52. En otro estudio realizado en 118 pacientes que recibieron manejo quirúrgico por presencia de carcinoma de células renales se midieron los niveles séricos de adiponectina y se encontró que estos presentaron una relación inversamente proporcional con la severidad de la neoplasia, hallando los niveles más bajos en pacientes que presentaban ya enfermedad metastásica53. En cuanto al cáncer prostático, la evidencia es menos sólida. En esta búsqueda solo encontramos un estudio que describe la asociación de diversas neoplasias en 1,600 pacientes con presencia de EHGNA demostrado por ultrasonido contra 1,600 controles portadores de hepatitisC (VHC)54. Los autores presentan que el cáncer de próstata se presentó en el 12.6% de los pacientes con hígado graso, comparado con el 3.5% de aquellos con VHC, y que la incidencia de este tipo de cáncer en pacientes con EHGNA fue mayor que la observada en población general.
EndocrinopatíasLa EHGNA se ha asociado con una variedad de endocrinopatías, incluyendo síndrome de ovario poliquístico, hipotiroidismo, deficiencia de hormona del crecimiento, hipogonadismo, hipopituitarismo e hipercortisolemia.
La deficiencia y el exceso de andrógenos juegan un rol en el desarrollo del hipogonadismo en hombres y del síndrome de ovario poliquístico en mujeres34.
Síndrome de ovario poliquísticoEl síndrome de ovario poliquístico (SOP) es una enfermedad reproductiva caracterizada por exceso de andrógenos y asociada con obesidad y RI. Múltiples estudios de cohorte han mostrado mayor prevalencia de EHGNA en mujeres con síndrome de ovario poliquístico55. Actualmente existe poca evidencia que sugiera un efecto directo del exceso de andrógenos en la patogénesis de la EHGNA, pero debido a los factores de riesgo que comparten, se debe pensar y descartar SOP en mujeres con infertilidad y alteraciones en la menstruación35.
Los datos de varios estudios revelan que la prevalencia de EHGNA en SOP oscila del 35 al 70%, comparado con el 20 al 30% en mujeres sin SOP con edad, IMC y circunferencia de cadera similares56. Macut et al.57 reportaron en 600 mujeres de raza blanca con diagnóstico de SOP que la EHGNA fue más prevalente en cohortes de SOP con incremento de circunferencia abdominal, producto de acumulación lipídica aumentado, incremento de la RI, además de niveles séricos elevados de colesterol total y triglicéridos. Finalmente, podemos mencionar que fisiopatológicamente lo que vincula el SOP y la EHGNA es la RI. Lo anterior se explica por una supresión fallida de la lipolisis en el tejido adiposo, llevando a un aumento en la entrada de ácidos grasos libres al hígado. La adiposidad visceral y la hipertrigliceridemia juegan un papel importante en la patogénesis de la EHGNA en mujeres con SOP, tal como ha sido demostrado por la reducción de esteatosis hepática posterior a la pérdida de peso y reducción de triglicéridos séricos con el uso de ácidos grasos omega-358.
HipotiroidismoLa disfunción tiroidea, relacionada previamente con la obesidad y el SMet, parece también tener una fuerte asociación con el desarrollo de la EHGNA59. El hipotiroidismo es una enfermedad metabólica caracterizada por un nivel bajo de hormona tiroidea (TH) y elevación sérica de hormona estimulante de tiroides (TSH), lo cual está fuertemente asociado a la EHGNA. La prevalencia de hipotiroidismo en pacientes con EHGNA se ha reportado del 15.2-36.3%, con prevalencia nacional del 3.7%60. En varios estudios se ha encontrado correlación del nivel de TSH a manera de dosis dependiente con el riesgo de EHGNA. Incluso se ha reportado asociación sólida entre hipotiroidismo subclínico y función tiroidea normal baja con riesgo de EHNA y fibrosis avanzada61. Respecto a los mecanismos fisiopatológicos implicados, existe evidencia donde se ha demostrado la relación entre la autoinmunidad de tiroides y el riesgo cardiovascular. En este estudio se encontró que la autoinmunidad tiroidea se asoció de manera positiva con HbA1c, HOMA-IR, obesidad, obesidad central, hiperlipidemia y SMet, especialmente en mujeres (SMet 25%)62.
Ferrandino et al.63 realizaron un estudio con ratones donde demostraron que la patogénesis de la EHGNA inducida por hipotiroidismo sucede por mecanismos intra y extrahepáticos. El hipotiroidismo induce EHGNA a través de un efecto pleiotrópico de las TH sobre la secreción de insulina y la estimulación adrenérgica de la lipólisis en el tejido adiposo. Por otro lado, la reducción de los niveles séricos de TH altera la secreción de insulina, conllevando la alteración de la supresión de la lisis y el aumento en el transporte de ácidos grasos al hígado, acumulados como triglicéridos, donde inducen EHGNA. La acumulación de lípidos en el hígado induce a RI, llevando a una deficiente supresión en la producción de glucosa endógena posprandial. Es por ello que, basándose en estos datos, se ha mencionado que el escrutinio en pacientes con EHGNA con TSH anual debe ser considerado64,65.
Apnea obstructiva del sueñoLa apnea obstructiva del sueño (AOS) es una condición médica que afecta aproximadamente al 4% de la población general, con una prevalencia mayor en personas con obesidad (incidencia del 25-35%), y está fuertemente asociada con la EHGNA66, además de ser un factor de riesgo importante para esteatohepatitis y fibrosis avanzada. La hipoxia crónica e intermitente que ocurre en la AOS lleva a un incremento en la producción de citocinas proinflamatorias, estrés oxidativo y RI, afectando directamente la fibrogénesis a través de factores que inducen hipoxia. Actualmente no existen datos prospectivos en cuanto a la incidencia de AOS en pacientes con EHGNA o que indiquen que el manejo apropiado de la AOS pueda afectar la progresión de la EHGNA67,68.
PsoriasisLa psoriasis no es una patología aislada de la piel, sino una condición sistémica que involucra a múltiples órganos y sistemas. Debido a la alta frecuencia de SMet en la psoriasis, la alta incidencia de EHGNA en este grupo de estudio no es una sorpresa. El primer estudio, obra de Roberts et al.69, para comprobar el riesgo incrementado de EHGNA en pacientes con psoriasis demostró una prevalencia general de EHGNA del 47%. La prevalencia de EHNA comprobada por biopsia fue del 22%, de los cuales más de un tercio tenían fibrosis avanzada. La presencia de EHGNA se ha relacionado con mayor severidad de psoriasis y en el riesgo incrementado de daño articular. A su vez, individuos con EHGNA y psoriasis concomitantemente son más propensos a desarrollar fibrosis hepática en comparación con controles nopsoriásicos70. El vínculo etiopatogénico entre ambas es el estado de inflamación crónica y la RI. Algunas citocinas proinflamatorias sintetizadas por linfocitos y queratinocitos en piel psoriásica, incluyendo IL-6, IL-7 y TNF-α, pueden contribuir a la RI, una característica común con EHGNA. Una de las principales comorbilidades que vincula la EHGNA con la psoriasis es la obesidad. La relación epidemiológica entre la obesidad y la psoriasis, en particular en las formas graves, actúa de manera bidireccional, de modo que la obesidad favorece la psoriasis y su gravedad, y viceversa71.
ConclusionesA la luz de los conocimientos actuales, la EHGNA se debe considerar como una enfermedad multisistémica que identifica a un subgrupo de la población que tiene un riesgo incrementado de desarrollar complicaciones crónicas serias; el impacto clínico de la EHGNA va más allá de la mortalidad coligada a enfermedad hepática: está asociada a morbimortalidad cardiovascular, ERC, AOS, osteoporosis, psoriasis, CCR, sobrecarga de hierro y varias endocrinopatías. Han adquirido énfasis especial la ECV y la mortalidad asociada, ya que en el tratamiento de toda enfermedad se deben plantear objetivos, y uno de los prioritarios en EHGNA debe estar relacionado con evitar la morbimortalidad cardiovascular y, de forma simultánea, prevenir la inflamación, la fibrosis y las neoplasias. De momento no se cuenta con metas claras en estas últimas; ante la ausencia de tratamientos vigentes enfocados en evitar la progresión de la enfermedad hepática, el modelo de prevención de complicaciones cardiovasculares, detección y tratamiento de complicaciones extrahepáticas de la EHGNA debe ser la primera línea de tratamiento.
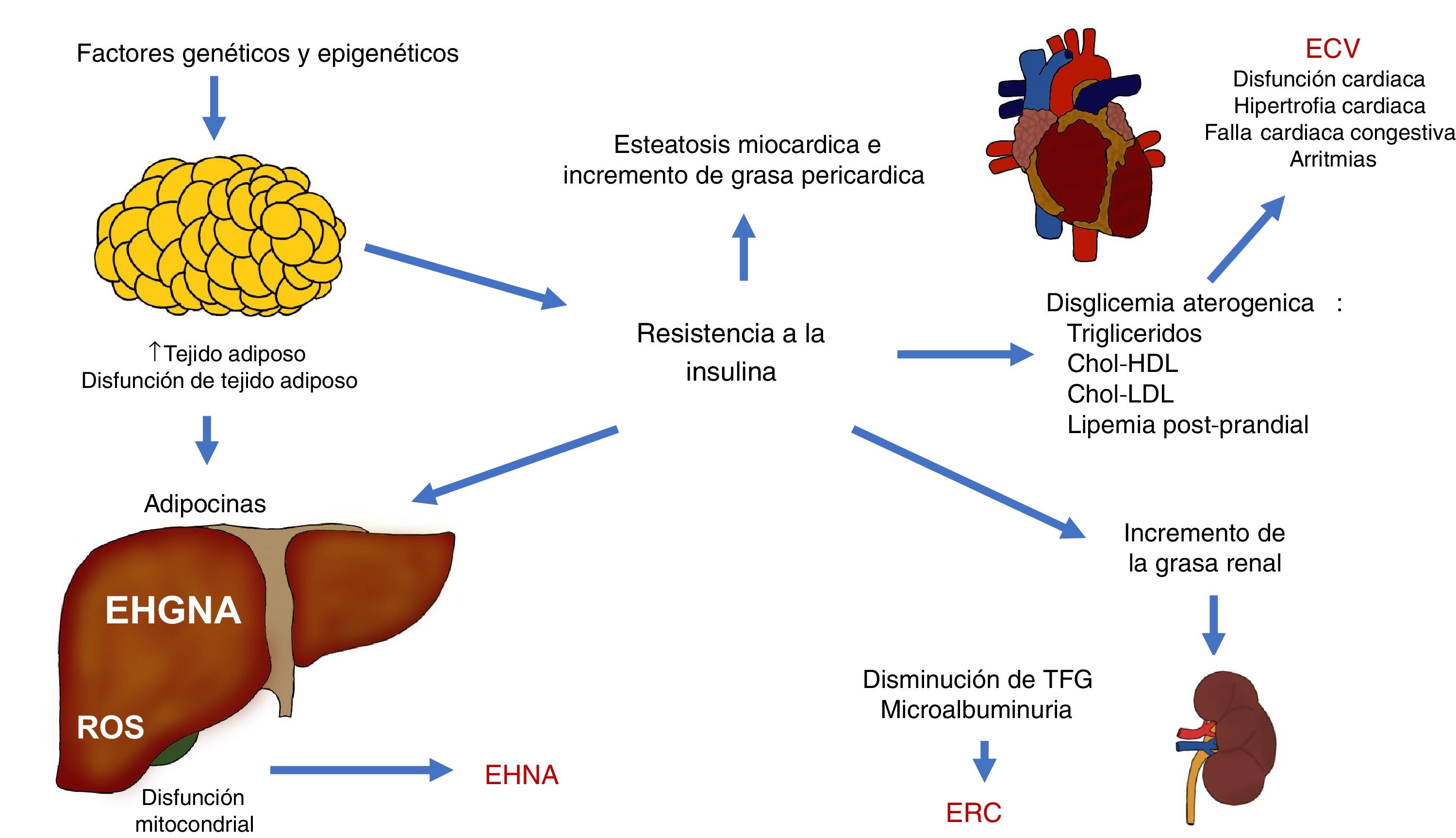
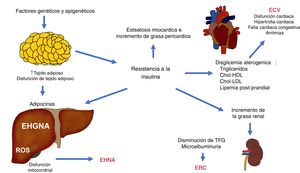
Los diferentes mecanismos fisiopatológicos que contribuyen en la EHGNA interactúan entre sí y hacen que un individuo pueda presentar diferentes situaciones clínicas complejas que se pueden explicar puntualmente. La expansión del tejido adiposo junto la RI son mecanismos fundamentales que conectan a la ECV, la ERC y otras complicaciones (fig. 3).
Interacciones fisiopatológicas que vinculan la enfermedad cardiovascular (ECV), la enfermedad renal crónica (ERC) y otras complicaciones observadas en la enfermedad por hígado graso no alcohólico (EHGNA).
Chol-HDL: colesterol ligado a lipoproteínas de alta densidad; Chol-LDL: colesterol ligado a lipoproteínas de baja densidad; EHNA: esteatohepatitis no alcohólica; ROS: especies reactivas de oxígeno; TFG: tasa de filtración glomerular.
La evidencia médica actual recomienda el escrutinio para condiciones altamente prevalentes como DM, ECV, enfermedad renal, hipotiroidismo, síndrome de ovario poliquístico y apnea obstructiva del sueño, lo cual llevaría al clínico a hacer énfasis en los cambios en los estilos de vida respecto al ejercicio, pérdida de peso y dejar de fumar, así como tratamientos farmacológicos capaces de modificar las complicaciones extrahepáticas asociadas a EHGNA. Finalmente, la evidencia clínica actual que asocia la EHGNA y varias complicaciones extrahepáticas se basa principalmente en estudios observacionales con periodos de seguimiento cortos, por lo que se requieren estudios longitudinales que puedan determinar el perfil de riesgo cardiometabólico basal y en el seguimiento para evaluar más detalladamente el impacto real de la EHGNA en el daño micro y macrovascular de estas enfermedades sistémicas.
Responsabilidades éticasEste trabajo de investigación no requirió consentimiento informado de pacientes, ya que es un artículo de revisión.
Este trabajo no requirió la autorización de comités de ética debido a que es una revisión bibliográfica.
Los autores declaran que este artículo no contiene información personal que permita identificar a pacientes.
FinanciaciónLos autores declaran que no se recibió ningún tipo de financiamiento para este estudio.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.